Introducción
Ochenta y cinco por ciento de las plantas terrestres presentan asociaciones mutualistas con hongos en sus raíces conocidas como micorrizas. Estos hongos ayudan a las plantas a establecerse y al llegar a la etapa adulta, ya que les proporcionan fósforo y nitrógeno y previenen el estrés por sequía y el ataque de patógenos (Brundrett y Tedersoo, 2018). Dependiendo de su morfología y de la familia de las plantas hospederas, Smith y Read (2008) clasificaron las micorrizas en siete tipos: arbuscular, ectomicorriza, ectendomicorriza, arbutoide, monotropoide, orquideoide y ericoide. Además, existen otro tipo de relaciones rizosféricas con hongos, tales como los patógenos de raíz, saprótrofos y los endófitos (Newsham, 2011). Estos últimos son comunes en las raíces, pero se desconoce mucho acerca de la interacción que mantienen con la planta.
Los hongos ectomicorrizógenos pertenecen a los Phyla Ascomycota, Basidiomycota y Mucoromycota y se estima que forman ectomicorrizas con 3% de las plantas terrestres (Brundrett y Tedersoo, 2018). Si bien este tipo de micorrizas se presenta en una baja diversidad vegetal, sus hospederos representan 60% de la cobertura arbórea mundial (Steidinger et al., 2019). Las familias vegetales en las que se conoce esta interacción son Achatocarpaceae, Asteropeiaceae, Betulaceae, Cistaceae, Dipterocarpaceae, Fabaceae, Fagaceae, Gnetaceae, Goodeniaceae, Junglandaceae, Myrtaceae, Nothofagaceae, Nyctaginaceae, Phyllanthaceae, Pinaceae, Polygonaceae, Salicaceae y Sarcolaenaceae (Corrales et al., 2018). Los hongos ectomicorrizógenos tienen alta especificidad hacia su hospedero; su diversidad es mayor en los bosques templados y boreales, comparada con los bosques tropicales (Tedersoo et al., 2014). A pesar de la importancia de los ecosistemas tropicales, los conceptos morfológicos de las ectomicorrizas provienen casi exclusivamente de observaciones de bosques boreales y templados (Agerer y Rambold, 2004-2021).
En contraste, los hongos micorrízicos arbusculares pertenecen al Subphylum Glomeromycotina del Phylum Mucoromycota (sensuSpatafora et al., 2016); se presentan aproximadamente en 70% de las plantas terrestres, abarcando gimnospermas y angiospermas (Brundrett y Tedersoo, 2018). Estos hongos tienen poca especificidad hacia su hospedero y su abundancia es mayor en los bosques tropicales que en los bosques de latitudes mayores de 30° (Steidinger et al., 2019). Además, se conoce que estos hongos ayudan a disminuir el estrés hídrico de las plantas en condiciones de sequía (p. ej. Al-Karaki et al., 2004; Symanczik et al., 2015).
Por otro lado, a nivel mundial el estatus micorrízico solo se ha evaluado en 1% de las especies vegetales (Albornoz et al., 2021), por lo que el tipo de micorrizas en la mayoría de las plantas solo ha sido inferido. Especialmente en las latitudes tropicales donde la diversidad vegetal y fúngica es más alta (Tedersoo et al., 2014), hay mayor desconocimiento de las asociaciones micorrízicas. En el bosque tropical caducifolio, uno de los ecosistemas estacionales con mayor diversidad beta y endemismos vegetales (Trejo y Dirzo, 2002; Miles et al., 2006; Linares-Palomino et al., 2010; DRYFLOR et al., 2016), se ha reportado la presencia de hongos ectomicorrizógenos y micorrízico arbusculares (Gavito et al., 2008; Ramírez-López et al., 2012; Álvarez-Manjarrez et al., 2018; Carrillo-Saucedo et al., 2018). Sin embargo, se conoce poco sobre sus hospederos, la anatomía, función y estacionalidad de esta simbiosis en las temporadas de secas y lluvias.
Entre más evaluaciones sobre el estatus micorrízico de plantas se han realizado, más nuevas interacciones con anatomías previamente desconocidas se han descubierto. Entender el estatus micorrízico nos ayuda a tener mejores estimaciones de la distribución e importancia de la simbiosis micorrízica a nivel ecosistémico (Steidinger et al., 2019); además de conocer la morfología detrás de cada asociación. Un ejemplo de esto es la micorriza “cavendishioide”, que se forma entre Cavendishia nobilis Lindl. y algunos Sebacinales; su morfología es similar a la ectendomicorriza con variaciones morfológicas únicas (Setaro et al., 2006). Por lo tanto, conforme se sigan explorando las raíces de las plantas tropicales, se espera encontrar nuevas variantes en las simbiosis micorrízicas aún no descritas. Con esto en mente, nuestro principal objetivo fue documentar el estatus micorrízico y la morfología de las interacciones fúngicas en las raíces de especies arbustivas y arbóreas que habitan en el bosque tropical caducifolio en el Pacífico mexicano.
Materiales y Métodos
En México, el bosque tropical caducifolio se encuentra distribuido en el Pacífico, desde Sonora hasta Chiapas, en la Península de Yucatán y zonas del Golfo de México; en el continente americano tiene una distribución fragmentada desde México hasta Argentina y Bolivia (DRYFLOR et al., 2016). Este tipo de bosque en México tiene una riqueza vegetal que varía de 29 a 123 especies con 2.5 cm de diámetro a la altura del pecho en un área de 0.1 ha (Trejo y Dirzo, 2002); siendo las familias Fabaceae y Euphorbiaceae las de mayor riqueza (Lott y Atkinson, 2002).
Los muestreos de raíces se realizaron en la costa del Pacífico mexicano, específicamente en Chamela, Jalisco, y desde Puerto Escondido hasta Salina Cruz, Oaxaca. Se emplearon dos metodologías de muestreo: núcleos de suelo y rastreo de raíces. El muestreo con núcleos de suelo se hizo en la Estación de Biología Chamela de la Universidad Nacional Autónoma de México (UNAM), en Jalisco, durante la época de lluvias de julio a octubre de 2012 a 2014. Los núcleos fueron tubos de PVC de 2.5 cm de diámetro × 30 cm de largo; en cada sitio de muestreo se tomaron cuatro núcleos para realizar una muestra compuesta. Se siguieron las veredas preestablecidas de la estación y se tomaron núcleos de suelo al encontrarse de manera oportunista alguna especie vegetal potencialmente ectomicorrízica (como aquellas de la familia Fabaceae). En cada sitio se trató de muestrear al menos tres individuos de cada hospedero en etapa reproductiva. También se recolectó suelo debajo de esporomas de hongos ectomicorrizógenos o alrededor de hospederos ectomicorrízicos. El suelo se tamizó recolectando y separando todas las raíces secundarias encontradas en la muestra. Cada raíz secundaria se revisó bajo un microscopio estereoscópico (Olympus SZ60, Tokio, Japón) separando y preservando en FAA (Formaldehído, Etanol, Ácido acético 10%:50%:5% + 35% agua) durante 24 h todas las raíces terciarias con manto, posteriormente se lavaron con agua corriente y se transfirieron a etanol al 100%. Los morfotipos más abundantes se cortaron con un microtomo (American Optical 820, Texas, EUA) y se tiñeron con la metodología reportada por Álvarez-Manjarrez et al. (2018). Los morfotipos únicos no se tiñeron y se cortaron a mano.
Para estudiar más a detalle la morfología de las ectomicorrizas, se realizó un muestreo por rastreo de raíces con los hospederos ectomicorrízicos identificados con el muestreo de núcleos en Chamela y en 12 puntos de la costa oaxaqueña, desde Puerto Escondido hasta Salina Cruz (Cuadro 1). Los hospederos ectomicorrízicos que se muestrearon fueron Achatocarpus gracilis H. Walter, Achatocarpus spp., Coccoloba barbadensis Jacq., C. liebmannii Lindau, Cordia elaeagnoides DC., Guapira petenensis (Lundell) Lundell, Lonchocarpus sp., Nyctaginaceae spp., Ruprechtia fusca Fernald y R. aff. pallida Standl. El rastreo de sus raíces se realizó con un rastrillo y pala manual desde las raíces primarias hasta las raíces secundarias. Por individuo se tomaron tres raíces secundarias de aproximadamente 10 cm de largo y se almacenaron en FAA. La revisión de estas raíces se hizo con el protocolo previamente descrito en el muestreo de núcleos de suelo. El muestreo en la costa oaxaqueña se llevó a cabo durante enero y febrero de 2016, que corresponde a la época de secas. Adicionalmente se tomaron muestras botánicas de hojas con flor y/o fruto de los hospederos ectomicorrízicos que fueron depositados en el Herbario MEXU (1428392-1428420) (Cuadro 2).
Cuadro 1: Sitios de muestreo de raíces de hospederos ectomicorrízicos en la costa de Oaxaca, México.
| Sitio de muestreo | Municipio | Coordenadas |
|---|---|---|
| Playa La Boquilla | San Pedro Pochutla | 15°41'30''N, 96°28'31''O |
| El Zapotal | Santa María Tonameca | 15°43'02''N, 96°34'17''O |
| Ranchería de don Laurencio | Santa María Tonameca | 15°43'07''N, 96°32'20''O |
| Carretera Santa Martha - Santa María Colotepec | Santa María Colotepec | 15°52'44''N, 96°57'27''O |
| Camino hacia Coyula | Santa María Huatulco | 15°43'52''N, 96°19'11''O |
| Playa Bajos del Arenal | Santa María Huatulco | 15°41'11''N, 96°14'40''O |
| Playa San Andrés | Santa María Huatulco | 15°41'36''N, 96°14'08''O |
| Puente Xúchitl 1 | Santa María Huatulco | 15°46'58''N, 96°12'33''O |
| Puente Xúchitl 2 | Santa María Huatulco | 15°46'58''N, 96°12'33''O |
| Laguna en Barra de Copalita | San Miguel del Puerto | 15°48'13''N, 96°01'18''O |
| Puente de Chacalapa | San Pedro Huamelula | 15°51'35''N, 95°57'50''O |
| Playa Chipehua | Santo Domingo Tehuantepec | 16°02'07''N, 95°22'39''O |
Cuadro 2: Lista de ejemplares de hospederos ectomicorrízicos de los que se recolectaron raíces en la costa de Oaxaca, México, depositados en el Herbario Nacional (MEXU).
| Especie | Localidad | MEXU |
|---|---|---|
| Achatocarpus gracilis H. Walter | Parque Nacional Huatulco, Playa San Andrés de Bajos del Arenal, Santa María Huatulco | 1428392, 1428412 |
| Achatocarpus aff. gracilis H. Walter | Hotel La Luna, Llano Grande, Playa Chipehua, Puente Chacalapa, Santa María Huatulco, Santa María Tonameca, Santiago Astata, Santo Domingo Tehuantepec | 1428401, 1428403, 1428404, 1428407, 1428408 |
| Achatocarpus sp. | Bajos del Arenal, Barra de Copalita, Camino hacia Bajos de Coyula, Llano Grande, Playa Chipehua, San Miguel del Puerto, Santa Mara Huatulco, Santa María Huatulco, Santa María Tonameca, Santo Domingo Tehuantepec | 1428393, 1428395, 1428396, 1428397, 1428399, 1428415 |
| ¿Achatocarpus sp.? | Parque Nacional Huatulco, Playa Chipehua, Santa María Huatulco, Santo Domingo Tehuantepec | 1428398, 1428420 |
| Coccoloba barbadensis Jacq. | Carretera en construcción, km 197 hacia Santa María Colotepec | 1428417 |
| Coccoloba liebmannii Lindau | Bajos del Arenal, Camino hacia Bajos de Coyula, El Zapotal a 5 minutos de Mazunte, Parque Nacional Huatulco, Santa María Huatulco | 1428394, 1428411, 1428413, 1428418 |
| Lonchocarpus aff. lanceolatus Benth. | Playa San Andrés de Bajos del Arenal, Santa María Huatulco | 1428409 |
| Ruprechtia fusca Fernald | Hotel La Luna, Llano Grande, Parque Nacional Huatulco, Santa María Huatulco, Santa María Tonameca | 1428405, 1428406, 1428410, 1428419 |
| Ruprechtia aff. pallida Standl. | Bajos del Arenal, Santa María Huatulco | 1428416 |
Todos los morfotipos de ectomicorrizas que se encontraron fueron caracterizados bajo el microscopio estereoscópico (Olympus SZ60, Tokio, Japón), utilizando la guía morfológica-anatómica de Agerer y Rambold (2004-2021). Además, se realizaron fotografías de las puntas micorrizadas con el mismo microscopio estereoscópico. Con un microscopio óptico con contraste Nomarski (Olympus BX51, Tokio, Japón) se tomaron fotos de los cortes longitudinales y transversales, realizados manualmente. En las micorrizas donde la red de Hartig no era evidente, los cortes se tiñeron con rojo Congo al 2% y se observaron en un microscopio invertido (Zeiss Axio Imager Z2, Berlín, Alemania) en el laboratorio de Morfo-Anatomía y Citogenética del Instituto de Biología de la UNAM.
Las raíces que no presentaron manto se aclararon con KOH al 10% en un horno de secado (Ecocell® EC.55ECO, München, Alemania) a 60 °C (tiempo variable dependiendo de la cantidad de lignina y suberina de cada especie vegetal) en el Laboratorio de Microcosmos Bioedáfico en el Instituto de Geología de la UNAM. Posteriormente el KOH se neutralizó con HCl al 10% y la muestra se lavó con agua corriente. En seguida las raíces se tiñeron con azul de Tripán al 0.05% en glicerol y se montaron en alcohol polivinílico en un portaobjetos. Se calculó el porcentaje de colonización de acuerdo con Hernández-Cuevas et al. (2008).
Resultados
Se encontraron raíces micorrizadas tanto en época de secas como de lluvias. Por el método de núcleos de suelo se recolectaron 209 raíces terciarias con manto, de las cuales se describen 64 morfotipos ectomicorrízicos (Apéndice). En algunas de las ectomicorrizas tomadas con núcleos no fue posible identificar al hospedero vegetal. Durante la época de secas, con el rastreo de raíces, se recolectaron 151 muestras de raíces de los géneros Achatocarpus Triana (Achatocarpaceae), Coccoloba P. Browne (Polygonaceae), Cordia L. (Boraginaceae) y Ruprechtia C.A. Mey. (Polygonaceae), de las cuales 104 presentaron manto. Estos generalmente tuvieron manto, nula ramificación y escaso micelio externo vegetativo.
En las ectomicorrizas descritas, el manto generalmente se encontró cubriendo totalmente la raíz terciaria; pero en varias especies de Coccoloba el manto se formó incompleto con zonaciones en las raíces terciarias (Fig. 1A). En las ectomicorrizas de Achatocarpus el manto fue muy incipiente (Fig. 1B). En Lonchocarpus sp. (Fig.1C), Guapira petenensis y otras nictagináceas (Fig. 1D, E), se presentaron mantos densos recubriendo completamente la punta de la raíz. Los mantos en general tenían exploración de contacto, con algunos morfotipos de exploración media presentando rizomorfos y/o cordones miceliares (Apéndice: Figs. S56, S57, S59, S62).
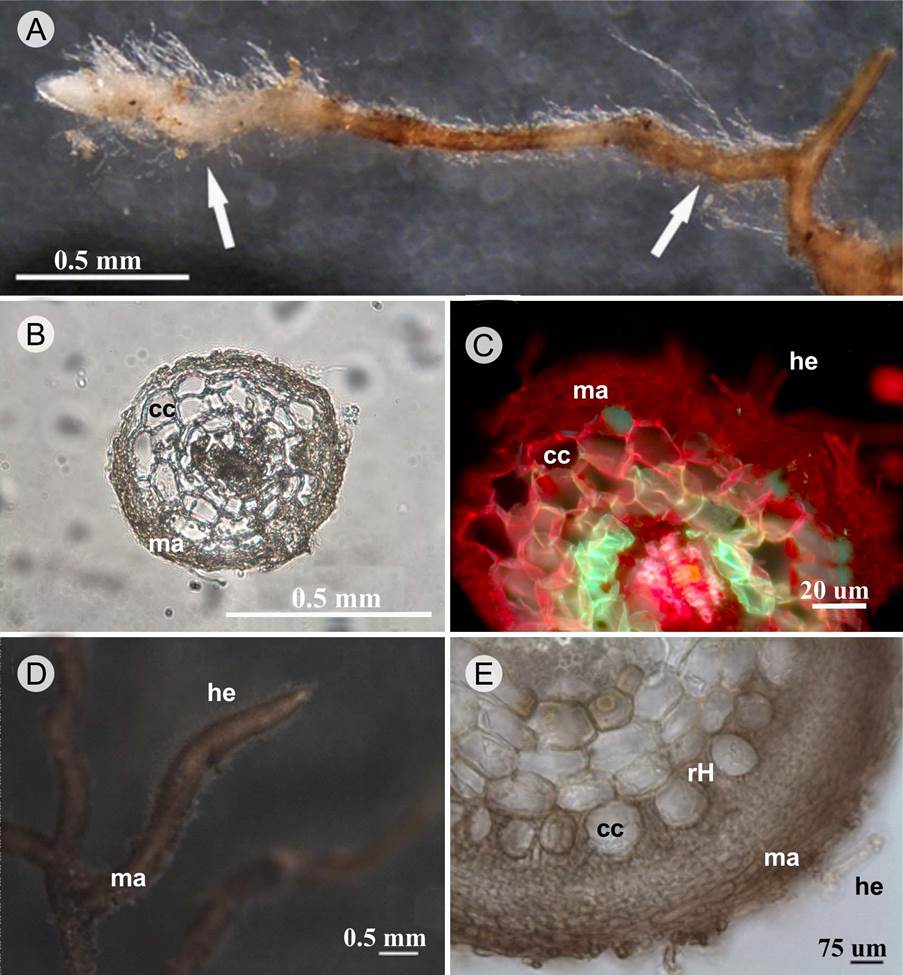
Figura 1: Morfotipos de las ectomicorrizas de diferentes especies vegetales del bosque tropical caducifolio de Jalisco y Oaxaca, México. A. ectomicorriza de Coccoloba liebmannii Lindau donde se muestran con flechas las zonaciones del manto; B. corte transversal de ectomicorriza de Achatocarpus gracilis H. Walter, se aprecia el manto incipiente, células corticales de la raíz y ausencia de red de Hartig; C. corte transversal de ectomicorriza de Lonchocarpus sp. en microscopía de fluorescencia, se aprecia el manto conformado por varias capas de hifas, hifas emanentes y ausencia de red de Hartig; D. vista general de ectomicorriza de Guapira sp. donde se observa un manto evidente y opaco, así como hifas emanentes cortas; E. corte transversal de ectomicorriza de Guapira sp., se observa un manto grueso, hifas emanentes y red de Hartig paraepidermal muy evidente. manto=ma, células corticales=cc, hifas emanentes=he, red de Hartig=rH.
En aquellos morfotipos ectomicorrízicos que presentaron red de Hartig, esta siempre fue de tipo paraepidermal. Las ectomicorrizas de la familia Nyctaginaceae (Apéndice: Figs. S13-S21) presentaron red de Hartig; además de hifas que colonizan dentro de las células del córtex que aparentan emerger del manto. En ninguno de los morfotipos de Achatocarpus (Apéndice: Figs. S1-S9) y Lonchocarpus Kunth, se encontró red de Hartig. En las familias Araliaceae y Sapotaceae se observó una sola ectomicorriza (Apéndice: Figs. S11, S56). También se describen algunos morfotipos de plantas que no fue posible identificar (Apéndice: Figs. S57-S64).
Achatocarpus fue el único género donde se observaron ectomicorrizas y micorrizas arbusculares, siendo una planta con micorrización dual (Fig. 2). El porcentaje de micorrización arbuscular en Achatocarpus aff. gracilis fue 29% y el de A. oaxacanus H. Walter y A. nigricans Triana, 23%, con estructuras como hifas, arbúsculos, ovillos y vesículas (Fig. 2). Todas las raíces de Cordia elaeagnoides, Ruprechtia fusca y R. aff. pallida presentaron colonización por hongos micorrízico-arbusculares, con un porcentaje de colonización de 16, 15 y 13%, respectivamente. En las tres especies la colonización fue del tipo Paris con vesículas, hifas y ovillos sin evidencia de arbúsculos (Apéndice).

Figura 2: Micorrización dual de Achatocarpus spp. A. vista general de ectomicorriza donde se observa el manto evidente e hifas emanentes; B. corte transversal donde se observa el manto, hifas emanentes, células corticales de la raíz y ausencia de red de Hartig; C. corte longitudinal de la raíz terciaria, se observan hifas intraradicales (puntas de flecha) y arbúsculos (flechas); D. corte longitudinal de la raíz terciaria, se observan esporas intraradicales (flechas) e hifas (punta de flecha); E. corte longitudinal de la raíz terciaria en el que se observan ovillos (flechas) e hifas que les dan origen (punta de flecha); F. corte longitudinal de la raíz terciaria donde se observan vesículas intraradicales y extraradicales (flechas) e hifas que les dan origen (puntas de flecha). manto=ma, células corticales=cc, hifas emanentes=he.
Otras interacciones rizosféricas que se encontraron dentro de las raíces fueron microesclerocios e hifas pertenecientes a los endófitos oscuros septados en Achatocarpus spp., Cordia elaeagnoides y Ruprechtia fusca. Estos hongos no fueron comunes en las muestras (Fig. 3).

Figura 3: Estructuras de hongos endófitos septados obscuros en plantas de selva baja. A. microesclerocios (flechas negras) e hifas de endófitos septados oscuros septados (flechas blancas) en Achatocarpus sp.; B. microesclerocios (flechas negras), hifas de endófitos septados oscuros septados (cabeza de flecha negra) y esporas de hongos micorrízicos arbusculares (flecha roja) en Cordia L.; C. microesclerocios (flechas negras) de endófitos septados oscuros septados en Ruprechtia sp.
Discusión
Este estudio encontró que todas las especies vegetales evaluadas presentan asociaciones fúngicas en la época de secas y de lluvias en el bosque tropical caducifolio. Estas asociaciones formaron ectomicorrizas, micorrizas arbusculares, micorrización dual y endófitos oscuros septados. Se describieron en Coccoloba (Polygonaceae), Achatocarpus (Achatocarpaceae) y algunas especies de nictagináceas 64 morfotipos de ectomicorrizas. Estos morfotipos nos ayudan a ampliar el concepto de las ectomicorrizas de los bosques tropicales, que se discute más adelante.
Coccoloba liebmannii y C. barbadensis son dos árboles que crecen frecuentemente en el bosque tropical caducifolio (Santos-Moreno y Ruiz-Velásquez, 2011). Así como se ha reportado para Coccoloba uvifera (L.) L. en dunas costeras de América y la Amazonía (Tedersoo et al., 2010; Sené et al., 2015), corroboramos que ambas especies son hospederos ectomicorrízicos. Los morfotipos encontrados en estas especies presentaron mantos que no recubren toda la raíz terciaria, sino que tienen zonaciones sobre las raíces secundarias y terciarias, característica no reportada previamente para Coccoloba, pero sí para géneros de Nyctaginaceae como Guapira Aubl., Neea Ruiz & Pav. y Pisonia L. (Ahsford y Allaway, 1985; Haug et al., 2005, 2014). Además, se registraron ectomicorrizas turgentes principalmente en la época de secas, lo cual se puede asociar con su fisiología adaptativa a este ecosistema, ya que estas plantas son heliofilas; es decir, permanecen con hojas en época de secas, mientras que en lluvias las escinden (Fanjul y Barradas, 1985; Barradas y Glez-Medellín, 1999; Durán et al., 2002). Esta inversión de la planta a mantener una simbiosis activa en temporadas o condiciones desfavorables puede ayudar a reducir el estrés hídrico de la temporada de secas en estas especies. Así como se conoce que las ectomicorrizas reducen el estrés salino en C. uvifera impuesto por su hábitat de dunas (Bandou et al., 2006), también se sabe que las ectomicorrizas ayudan a tener mejor manejo del recurso hídrico aumentando el Ca disponible en el suelo (Li et al., 2021), o incluso propiciando modificaciones estructurales en sus hospederos (Osonubi et al., 1991; Wang et al., 2021).
Algunas especies de la familia Nyctaginaceae forman ectomicorrizas con mantos gruesos (Haug et al., 2005). Nuestras observaciones en Nyctaginaceae nos llevaron a clasificarlos en nueve morfotipos con mantos de tonalidades claras a oscuras y texturas generalmente lisas o con cistidios, prediciendo que hay diversos hongos ectomicorrízicos asociados a las nictagináceas (Vanegas-León et al., 2019). En esta interacción se observaron hifas intracelulares, que podrían ser hongos endófitos o una nueva variación en la morfología de la ectomicorriza. Esta situación ha sido previamente observada en otras nictagináceas (Vanegas-León et al., 2019) asociadas a hongos de los órdenes Russulales y Thelephorales (Haug et al., 2005).
Los conceptos morfológicos de las ectomicorrizas provienen de los bosques templados donde se describen tres características: 1) el manto externo recubre completamente la raíz terciaria, 2) la red de Hartig, es decir las hifas que intercambian nutrientes con la planta y rodean a las células del cortex de la raíz, en angiospermas solo abarca la primera capa de células corticales, 3) micelio externo vegetativo que crece extraradicalmente (Agerer y Rambold, 2004-2021; Peterson et al., 2004). Al comparar las observaciones de este trabajo realizadas en diferentes géneros con la información previamente publicada (Ashford y Allaway, 1985; Dell et al., 1994; Haug et al., 2005; 2014; Vanegas-León et al., 2019), queda claro que las variaciones morfológicas encontradas en ectomicorrizas tropicales se comparten en diferentes zonas del mundo. Por ejemplo, formación de manto pero ausencia de red de Hartig, mantos con zonaciones y formación de pelos radiculares donde no hay manto, y red de Hartig paraepidermal con elementos intracelulares. Por ello, proponemos el concepto de ectomicorriza “incipiente”: manto incipiente o grueso que se puede encontrar cubriendo total o parcialmente raíces secundarias y terciarias; red de Hartig paraepidermal con o sin hifas intracelulares, o ausente; ramificación de las ectomicorrizas y micelio externo vegetativo poco frecuente (Fig. 1).
Varias especies del género Achatocarpus presentaron micorrización dual de ectomicorrizas y micorriza arbuscular. En este género se encontró formación de manto tanto en época de lluvias como en secas. Este manto se forma de manera incipiente sin evidencia de la formación de red de Hartig. Es el único género evaluado donde se encontró micorrización dual. Se observaron estructuras típicas de los hongos micorrízico-arbusculares: arbúsculos, ovillos y vesículas (Fig. 2), que son modificaciones hifales ensanchadas para almacenar lípidos y glucógeno, y son estructuras que también pueden funcionar como inóculo de propagación (Bermann y Linderman, 1983; Jabahi-Hare et al., 1984). Esto demuestra que es una colonización funcional y bien establecida. Achatocarpus fue el único género con formación de arbúsculos como estructuras hiper ramificadas, en las que se intercambian los nutrientes entre la planta y el hongo y se forman en una colonización activa y funcional (Roth et al., 2019). Sin embargo, con mayor frecuencia se observaron ovillos que también son estructuras postuladas como los sitios de intercambio de nutrimentos (Peterson y Massicotte, 2004; Dreyer et al., 2008).
La micorrización dual, de muy reciente estudio, ha sido descrita en angiospermas como Acacia Mill., Alnus Mill., Eucalyptus L'Hér., Fraxinus L., Populus L., Salix L., Shorea Roxb. ex C.F. Gaertn. y Uapaca Baill. (Teste et al., 2019). También llega a presentarse en plantas que, en etapas tempranas después de la germinación, desarrollan micorrizas arbusculares y son remplazadas en su totalidad por ectomicorrizas cuando llegan a brinzales (Brundrett y Tedersoo, 2018). Se ha propuesto que esta doble colonización es una transición de una aptitud evolutiva de formar a priori asociaciones con micorrizas arbusculares, pues es la micorriza más antigua (edad máxima aproximada de 727 millones de años; Lutzoni et al., 2018), y que algunos de dichos géneros están en la transición de adquirir la asociación ectomicorrízica (Brundrett y Tedersoo, 2018). En la evolución de las plantas hubo grupos vegetales que perdieron totalmente su capacidad de asociarse con hongos arbusculares (Brundrett y Tedersoo, 2018), y otros formaron asociaciones ectomicorrízicas cuya transición ha sido completamente establecida desde el Devónico en la diversificación de las coníferas en el Jurásico (aproximadamente 460 millones de años; Kohler et al., 2015; Lutzoni et al., 2018). En este trabajo se describe la posible transición micorrízica de Achatocarpus, lo cual explicaría el manto incipiente y la ausencia de red de Hartig como estructura de intercambio de nutrimentos ya establecida; como sucede en otros géneros que no desarrollan red de Hartig (p. ej. Casuarina L. o Eucalyptus; Dell et al., 1994; Harrington y Mitchell, 2002; Teste et al., 2019).
En el caso de Cordia elaeagnoides (Boraginaceae), Ruprechtia fusca y R. aff. pallida (Polygonaceae), tuvieron asociación con hongos micorrízico-arbusculares con colonización del tipo Paris y endófitos septados oscuros. La colonización del tipo Paris generalmente forma más ovillos que arbúsculos y es un tipo de colonización común en plantas (Cavagnaro et al., 2003). Aun cuando tienen menor actividad enzimática que los arbúsculos (Van Aarle et al., 2005), son un indicador de que las plantas que evaluamos se encontraban metabólicamente activas en época de secas como lo encontrado para las ectomicorrizas.
La presencia de hongos endófitos oscuros septados durante la época de secas fue infrecuente en las muestras observadas, pero se encontraron en raíces que a su vez tenían micorrizas arbusculares. Algunos hongos endófitos oscuros pueden contribuir al crecimiento vegetal al solubilizar fósforo que se vuelve disponible para otros organismos (Della Monica et al., 2015) y reducen el estrés ambiental, especialmente cuando los suelos tienen baja disponibilidad de nutrientes (Jumpponen y Trappe, 1998; Jumpponen, 2001). El estudio de la coexistencia de estos endófitos con los hongos micorrízicos ha sido propuesta como antagonista, pues compiten por los mismos recursos (Weishampel y Bedford, 2006). Sin embargo, en ambientes estresantes tiene una correlación positiva (Gooden et al., 2020) e incluso en un bosque templado mixto se encontró que la asociación entre hongos micorrízico arbusculares, ectomicorrízicos y endófitos septados oscuros sugiere una sinergia en esta co-existencia en las dinámicas de las comunidades vegetales (Toju y Sato, 2018).
El bosque tropical caducifolio es un ecosistema con alto estrés hídrico. Las plantas de este ecosistema tienen xilema resistente a las embolias, conductancia estomática como estrategia de uso del agua, formación de biomasa, etc. (Pineda-García et al., 2013; Werden et al., 2017; González-M. et al., 2021). Además, tienen simbiosis activas con sus simbiontes fúngicos bajo estrés hídrico (Gavito et al., 2008). En este trabajo encontramos micorrizas vivas en la época de secas, tanto arbuscular con la formación de arbúsculos y ovillos, como ectomicorrizas con mantos turgentes. Las variaciones en el estatus y tipo micorrízico reflejan aspectos de la dinámica ecofisiológica que se da en este tipo de bosques estacionales. Tener varios simbiontes puede permitirles a las plantas obtener más recursos del hábitat; la incipiente colonización de las ectomicorrizas en el estrato arbóreo puede ser parte de esta estrategia. Por ejemplo, los hongos ectomicorrízicos obtienen y transfieren N disponible a sus fotobiontes (Tunlid et al., 2016). Conforme se evalúen más estatus micorrízicos de plantas tropicales se podrán hacer mejores inferencias sobre la distribución de los tipos de micorrizas y con ello entender su contribución en la fijación de carbono y los ciclos de nitrógeno y fósforo, entre otros (p. ej. Craine et al., 2009; Swaty et al., 2016; Steidinger et al., 2019; Soudzilovskaia et al., 2019).
Conclusiones
Todas las plantas evaluadas pertenecientes a las familias Achatocarpaceae, Boraginaceae, Fabaceae, Nyctaginaceae y Polygonaceae presentaron asociación ectomicorrízica y/o micorrízica arbuscular activa durante secas y lluvias y algunas presentaron hongos endófitos oscuros septados asociados a micorrizas arbusculares. El estudio de estas familias de angiospermas distribuidas en el bosque tropical caducifolio permitió documentar variaciones en la morfología de las ectomicorrizas, lo que hace posible proponer el nuevo concepto de la ectomicorriza ‘incipiente’. La familia Polygonaceae desarrolla un manto discontinuo con zonaciones, en Nyctaginaceae existen hifas intra radiculares en la red de Hartig, en Achatocarpaceae (Achatocarpus spp.) el manto es incipiente y no presenta red de Hartig, que tampoco se observó en las ectomicorrizas de Lonchocarpus sp. (Fabaceae). Se describe por vez primera la micorrización dual de Achatocarpus spp., así como la formación de micorriza arbuscular en Cordia elaeagnoides, Ruprechtia fusca y R. aff. pallida.











 nueva página del texto (beta)
nueva página del texto (beta)



