Introducción
El uso de términos precisos para estudiar las formas de vida de las plantas en los distintos grupos taxonómicos es de gran importancia para no generar confusiones conceptuales, aunque debido a la variación biológica implícita dentro de los organismos, su aplicación en ocasiones no es exacta. Evidentemente, de manera práctica, ninguna definición de las distintas formas de vida es capaz de reflejar el crecimiento de los individuos de un mismo taxón o grupo. Por ejemplo, tanto Annona glabra L. como Sequoia sempervirens Endl. son comúnmente consideradas árboles; sin embargo, a veces A. glabra está categorizada como arbusto porque tiene múltiples troncos, lo que demuestra cierta ambigüedad en este tipo de clasificación. Esta misma situación se observa en las plantas estructuralmente dependientes, que se caracterizan por no mantenerse enhiestas, sino que necesitan apoyarse en otras plantas, generalmente árboles, o en algún soporte fijo para su desarrollo (Zotz, 2016). Desde las obras clásicas de Schimper (1888, 1903) y Went (1895, 1940), ha habido una serie de cambios en las definiciones de las categorías de este grupo peculiar.
Sin considerar a los muérdagos o parásitas, porque son ecológicamente distintos y aislados evolutivamente (Zotz, 2016), se han usado hasta hace algunos años cuatro categorías para las demás plantas estructuralmente dependientes (Zotz et al., 2020; Fig. 1): 1) trepadoras o enredaderas, germinan en el suelo y trepan sobre un huésped manteniendo contacto con la tierra durante todo su ciclo de vida, pueden ser lianas leñosas o trepadoras herbáceas; 2) epífitas verdaderas (= holoepífitas), germinan y enraízan de manera no parásita sobre otras plantas (generalmente árboles) durante todo su ciclo de vida; 3) hemiepífitas primarias (HP), germinan y pasan su estado juvenil como epífitas y posteriormente, mediante raíces adventicias, establecen contacto con el suelo; 4) hemiepífitas secundarias (HS), germinan de manera terrestre, al igual que otras trepadoras, pero se supone que su tallo principal muere después de adherirse al tronco de un árbol, perdiendo así “todas las conexiones con el suelo” pasando a un estado epifítico (Schimper, 1888, 1903; Kress, 1986).

Figura 1: Representación conceptual de los cambios ontogénicos por el contacto de raíces y tallos con el suelo de las diferentes formas de vida estructuralmente dependientes. La terminología sigue a Zotz (2016) (Figura tomada y editada por Zotz et al., 2020).
Mientras que las tres primeras categorías son comúnmente aceptadas, el uso de hemiepífitas secundarias es controvertido. El término HS es introducido por Hosokawa (1943), pero ignorado hasta 1965 cuando Ellenberg y Mueller-Dombois lo mencionan nuevamente, y establecido hasta la mitad de los años ochenta por Kress (1986) y Putz y Holbrook (1986). Posteriormente se aceptó que HP y HS son formas de vida diferentes; ejemplo de ello son los múltiples trabajos de revisión sobre (hemi)epífitas (Gentry y Dodson, 1987; Williams-Linera y Lawton, 1995; Nadkarni et al., 2001). A pesar de la “aceptación” de ambos términos, especialmente HS ha sido cuestionado durante los últimos 20 años, ya que de acuerdo con Moffett (2000) y Zotz (2013, 2016) es inadecuado para la mayoría de las especies que están catalogadas así. Lo anterior se debe a que no hay evidencia de que estas plantas realmente pierdan todas las conexiones con el suelo para pasar a un estado epifítico, tal como lo plantea la definición original de Kress (1986). Además, el doble uso de “hemiepífita” para formas de vida que se consideran diferentes da pie a confusiones, más aún cuando se utiliza sin un calificativo (primaria/secundaria) y se deja abierta la libre interpretación (ej. Fernández-Alonso y Hernández-Schmidt, 2007; Sierra-Giraldo et al., 2019).
Ante la falta de evidencia sobre la ontogenia de HS, Moffett (2000) sugiere el abandono de este término a favor de “nomadic vine” (NV) para todas las plantas trepadoras que germinan en el suelo, o al menos cerca de este, y que generalmente pierden las partes más viejas de su tallo en el proceso de ascenso (en contraste con las lianas). El uso de este nuevo término alude implícitamente a una similitud con otras plantas trepadoras, dejando de lado cualquier relación con las HP, la cual en realidad no existe al tratarse de estrategias ecológicas distintas (Fig. 1). De esta manera, si HS fuese reemplazada por NV, ya no sería necesario usar el calificativo “primaria” en HP; por lo tanto, esta estrategia ecológica debería ser referida únicamente como “hemiepífita”, tal como lo plantea la definición original de Schimper (1903). También evitaría hacer suposiciones no probadas y asociadas con la definición tradicional de que las HS “pierden todas las conexiones”; por lo que se descontinuaría la práctica, bastante frecuente, de hacer conclusiones al respecto, sin evidencia. En relación con la traducción de NV, Moffett (2000) sugiere “bejuco nómada” y Benavides y Hernández-G. (2015) usan “liana nómada”, pero ambos términos son imprecisos, ya que bejuco y liana aluden a una planta trepadora leñosa (Moreno, 1984); mientras que, NV se refiere generalmente a plantas herbáceas con muy pocas excepciones. Por lo tanto, se sugiere el uso del término “enredadera nómada” (EN), propuesto por Cascante-Marín (2020).
En el caso particular de la familia Araceae, el uso del término controvertido HS es todavía común (Zotz, 2013; Zotz et al., 2020). Desde las revisiones taxonómicas efectuadas en el siglo XIX se indica que hay aráceas trepadoras (“scandens”; Schott, 1858), pero también se reconocen especies epífitas en Anthurium Schott y arbustos trepadores en Monstera Adans. (“kletternde Sträucher”; Engler, 1889). Aparte de las plantas denominadas “hemiepífitas”, Schimper (1903) observó también la existencia de otro grupo que germina en el suelo y puede perder las partes más viejas de su tallo en el proceso del ascenso, al cual nombró “pseudoepífitas”. Asimismo, este último grupo es mencionado por Simmonds (1950) en su trabajo sobre la biología de Araceae de Trinidad; sin embargo, el autor no le atribuye ningún término, ya que solo distingue plantas epífitas y trepadoras. Madison (1977a) denominó a las aráceas trepadoras “hemiepífitas” bajo la misma explicación de Schimper (1903) dada para “pseudoepífitas”. Posteriormente, con los trabajos de Kress (1986) y Putz y Holbrook (1986), se refuerza la idea de la existencia de formas de vida diferentes, denominando HP a las “hemiepífitas” y HS a las “pseudoepífitas” de Schimper (1903).
Los múltiples intentos por dar un nombre y describir la existencia de dos formas de vida diferentes deja entrever un problema mayor, y es que todas las definiciones mencionadas en párrafos anteriores han sido meramente inferencias a partir de historias anecdóticas no probadas (Zotz, 2013). Lo anterior da pie a cuestionar ¿hasta qué punto podemos confiar en la terminología utilizada en la literatura? y ¿hasta dónde las muestras botánicas aportan información útil, si se pretende realizar estudios más específicos sobre la biología y ecología de las especies? Por ejemplo, nuestra pregunta ¿realmente existen plantas que pierden todas las conexiones? no podría tener respuesta en los ejemplares de herbario porque estos son solo una imagen puntual del estado de desarrollo u ontogenia de la planta. Los especímenes generalmente no cuentan con información referente al tipo de conexión que tenían los organismos vegetales cuando fueron colectados, solo del sustrato sobre el que se encontraban. Por lo tanto, para informar correctamente sobre su forma de vida, es necesario observar y describir su estado de ontogenia en el momento de la colecta, dato usualmente ausente en las etiquetas.
Las observaciones someras en el campo, así como la escasa evidencia y falta de información, son las principales razones del porqué hasta la fecha no se puede comprobar la existencia de dos formas de vida supuestamente diferentes, tanto en el campo como en el herbario, dando paso a publicaciones confusas. Por ejemplo, llama la atención que en trabajos procedentes de un mismo laboratorio citan de manera diferente a las mismas especies estudiadas apareciendo en algunas ocasiones como bejuco y en otras, como hemiepífita (Muñoz et al., 2003; Salinas et al., 2010), lo cual también indica una cierta confusión conceptual. Por otro lado, en la mayor parte de la literatura sobre aráceas se les describe indistintamente como “hemiepífitas”, resultando inútil si lo que se pretende es obtener información sobre su estrategia ecológica (Ter Steege y Cornelissen, 1989; Hietz-Seifert et al., 1996; Nieder et al., 2000; Wolf y Flamenco, 2003; Küper et al., 2004; Kreft et al., 2004; Benavides et al., 2005; Krömer et al., 2005, 2013; Cardelús et al., 2006; Martínez-Meléndez et al., 2009; Croat y Ortiz, 2016; Freitas et al., 2016; Croat et al., 2018; Guzmán-Jacob et al., 2020).
Pocos estudios como el de Zotz et al. (1999) distinguen las HP de las HS, y escasos trabajos mencionan las especies de aráceas que podrían ser HP (Croat, 1978, 1997; Kelly, 1985; Mayo, 1991; Mantovani, 1999; Meyer y Zotz, 2004; Lozano-Orihuela y Waechter, 2010; Zotz et al., 2020, en revisión). Dentro de estos, se ha reportado que una especie del género Anthurium (A. clavigerum Poepp. & Endl.) y 13 de Philodendron Schott (P. alternans Schott, P. bipinnatifidum Schott ex Kunth, P. corcovadense Kunth, P. fragrantissimum (Hook.) G. Don, P. goeldii G.M. Barroso, P. maximum K. Krause, P. megalophyllum Schott, P. solimoesense A.C. Sm., P. speciosum Schott ex Endl., P. radiatum Schott, P. schottii K. Koch, P. tripartitum (Jacq.) Schott, P. williamsii Hook. f.) son HP. Se esperan más especies de HP en Philodendron subg. Pteromischum (Schott) Mayo, debido a que Grayum (1996) menciona que estas tienen muchas semillas pequeñas y pegajosas, probablemente con germinación epífita. Por otro lado, se ha reportado germinación terrestre para especies trepadoras de los géneros Heteropsis K.S. Kunth, Monstera y Syngonium Schott (Madison, 1977b; Croat, 1981; Soares et al., 2013), lo cual sugiere que podrían ser HS si posteriormente pierden el contacto con el suelo. Sin embargo, estas afirmaciones siguen siendo débiles, debido al número reducido de especies consideradas en dichos estudios.
Recientemente se ha emprendido la labor de comprobar mediante datos cuantitativos la estrategia ecológica de las aráceas, la cual consiste en incluir la mayor cantidad posible de especies. Derivado de esto, los primeros resultados reportados por Zotz et al. (2020) indican que es difícil distinguir categorías, debido a que las especies presentan una amplia variación natural en las formas de vida. Lo anterior refleja que hay una falta de conocimiento sobre este aspecto dentro de las especies trepadoras de Araceae, así como de definiciones que contemplen la variación implícita dentro de los individuos, ya que el desconocimiento sobre la ontogenia nos puede llevar a la confusión o malinterpretación de términos, dando como resultado conclusiones erróneas sobre la biología de las especies. Nuestro objetivo fue demostrar la confusión conceptual actual derivada de la literatura y ejemplares de herbario vs. observaciones y datos de campo, con la meta de identificar los problemas del uso de la terminología en las aráceas trepadoras.
Materiales y Métodos
Se revisaron y compilaron las categorías de formas de vida utilizadas en diferentes floras y tratamientos taxonómicos (Matuda, 1954; Madison, 1977b; Grayum, 1996; Ibarra-Manríquez y Sinaca-Colín, 1996; Croat, 1997; Croat y Stiebel, 2001; Croat y Vannini, 2006; Croat y Acebey, 2015; Cornejo-Tenorio et al., 2019), para 30 especies que ocurren en el estado de Veracruz, México (Krömer et al., 2020). Además, se revisó y compiló la información documentada, sobre las formas de vida, en las etiquetas de ejemplares depositados en varios herbarios regionales de Veracruz: a) Herbario CIB, del Instituto de Investigaciones Biológicas, b) Herbario CITRO, del Centro de Investigaciones Tropicales, ambos de la Universidad Veracruzana, en Xalapa, Veracruz, c) Herbario de la Estación de Biología Tropical “Los Tuxtlas”, de la Universidad Nacional Autónoma de México y d) Herbario XAL, del Instituto de Ecología, A.C., en Xalapa, Veracruz, así como en la base de datos en línea del Herbario Nacional (MEXU) del Instituto de Biología de la Universidad Nacional Autónoma de México (IBUNAM, 2020) y la de Tropicos (TROPICOS, 2020) del Missouri Botanical Garden, St. Louis, EUA.
Además del análisis bibliográfico y de gabinete se realizó un censo con las especies de Araceae más comunes en el bosque tropical perennifolio de la Estación de Biología Tropical “Los Tuxtlas”, ubicado en el sureste del estado de Veracruz (Acebey y Krömer, 2008). Se establecieron siete parcelas de 20 × 20 m, en las que se registró un total de 936 individuos pertenecientes a seis especies (Anthurium flexile Schott, Monstera acuminata K. Koch, Monstera tuberculata Lundell, Philodendron seguine Schott, Rhodospatha wendlandii Schott, Syngonium podophyllum Schott). Para cada individuo se buscaron cuidadosamente las conexiones de sus raíces adventicias y tallos con el suelo y se anotó su identidad taxonómica, altura, longitud total de la planta y longitud de la hoja más alta y baja con respecto al suelo.
Con las medidas de las hojas y la longitud total de cada individuo se crearon tres clases ontogénicas (Zotz et al., 2020): clase 1, individuos más pequeños; clase 2, individuos de longitud intermedia; clase 3, individuos más grandes (Fig. 2). Para reconocer los tamaños aproximados en individuos juveniles y adultos y poderlos incluir en alguna categoría, de las tres mencionadas, se consultaron las descripciones taxonómicas de cada especie (Croat y Acebey, 2015) y se utilizaron sus cambios heteroblásticos como guía. Para especies metamórficas, como Syngonium podophyllum y Monstera acuminata, se consideró la forma y el tamaño de las hojas, mientras que para las alomórficas, como Anthurium flexile y Rhodospatha wendlandii, se utilizó únicamente el tamaño de las hojas en relación con el tamaño total de cada individuo (Fig. 2). Si bien las clases ontogénicas se basan en el tamaño de hojas y planta, esto no indica que para la clase 3 los individuos examinados sean adultos.

Figura 2: Ejemplos de tamaños considerados para crear las tres clases ontogénicas en la Estación de Biología Tropical “Los Tuxtlas”, Veracruz, México. A. Anthurium flexile subsp. flexile (J.F. Macbr.) Croat & R.A. Baker; B. Rhodospatha wendlandii Schott; C. Syngonium podophyllum Schott. Los números 1, 2, 3, se refieren a las clases ontogénicas utilizadas. Fotografías: A. P. Bautista-Bello.
Las figuras sobre los tipos de conexión y cambios ontogénicos fueron creadas en R v. 4.02 (R Core Team, 2020), usando el paquete "tidyverse" (Wickham et al., 2019).
Resultados
Publicaciones y etiquetas de herbario
En el Cuadro 1 se presentan las descripciones de formas de vida de las 30 especies de Araceae trepadoras de Veracruz que aparecen en las nueve publicaciones mencionadas en el apartado de Materiales y Métodos. La mayoría de las especies tiene una marcada inconsistencia en la descripción de sus formas de vida, misma que se refleja en diferentes trabajos de un mismo autor. Por ejemplo, Anthurium flexile (Fig. 3A) se denomina “epífita trepadora” (Matuda, 1954), “epífita escandente” (Croat y Stiebel, 2001; Cornejo-Tenorio et al., 2019) o “hemiepífita trepadora” (Croat y Acebey, 2015), y Monstera acuminata (Fig. 3B) como “scandent epiphyte” (Madison, 1977b), “trepadora hemiepífita” (Croat y Stiebel, 2001), “epífita trepadora” (Croat y Acebey, 2015) o “trepadora hemiepífita o epífita” (Cornejo-Tenorio et al., 2019). Por otro lado, Philodendron seguine es referida como “epífita trepadora” (Matuda, 1954), “subligneous vine or liana” (Grayum, 1996), “trepadora hemiepífita” (Ibarra-Manríquez y Sinaca-Colín, 1996), “bejuco o liana trepadora” (Croat y Acebey, 2015) o “trepadora hemiepífita o epífita” (Cornejo-Tenorio et al., 2019), mientras que P. radiatum se describe como “trepadora hemiepífita o epífita” (Croat y Stiebel, 2001; Cornejo-Tenorio et al., 2019) o “epífita o hemiepífita, raramente terrestre” (Croat, 1997; Croat y Acebey, 2015).
Cuadro 1: Descripción de la forma de vida de 30 especies de Araceae trepadoras presentes en el estado de Veracruz, México, mencionadas en nueve publicaciones diferentes. Según Croat y Acebey (2015), Monstera lechleriana Schott debe ser llamada M. egregia Schott en México y América Central, ya que la anterior es una especie de Sudamérica. § indica las seis especies de Araceae más abundantes de la Estación de Biología Tropical “Los Tuxtlas”, Veracruz, México.
| Especie | Matuda (1954); | Madison (1977b) *Grayum (1996); #Croat(1997) | Ibarra-Manríquez y Sinaca-Colín (1996) | Croat y Stiebel (2001) | Croat y Vannini (2006) | Croat y Acebey (2015) | Cornejo-Tenorio et al. (2019) |
|---|---|---|---|---|---|---|---|
| Anthurium flexile Schott § | epífita trepadora | epífita | epífita escandente | epiphytic, hemiepiphytic | hemiepífita trepadora | epífita escandente | |
| Anthurium pentaphyllum G. Don | epífita trepadora | epífita | trepadora epífita | lithophytic, epiphytic | hemiepífita adpreso- trepadora | epífita o terrestre | |
| Monstera acuminata K. Koch § | scandent epiphyte | trepadora | trepadora hemiepífita | hemiepiphytic | epífita trepadora | trepadora hemiepífita o epífita | |
| Monstera deliciosa Liebm. | epífita trepadora | rupestral or epiphyte | trepadora hemiepífita | hemiepiphytic | hemiepífita o rupícola | ||
| Monstera florescanoana Croat, T. Krömer & Acebey | hemiepífita adpreso- trepadora | ||||||
| Monstera lechleriana Schott (M. egregia Schott) | epiphyte | hemiepiphytic | hemiepífita adpreso- trepadora | ||||
| Monstera punctulata Schott ex Engl. | trepadora | robust climber | epífita trepadora | ||||
| Monstera siltepecana Matuda | epífita trepadora | juvenile terrestrial creeper, adult climbing shoots | trepadora hemiepífita | hemiepiphytic | hemiepífita adpreso- trepadora | ||
| Monstera tuberculata Lundell § | trepadora | climbing and hanging epiphyte | trepadora | trepadora epífita | hemiepiphytic | trepadora epífita | trepadora epífita |
| Philodendron advena Schott | trepadora | #terrestrial, epilithic or hemiepiphytic | terrestrial, lithophytic, hemiepiphytic | terrestre, rupícola o hemiepífita | |||
| Philodendron anisotomum Schott | #hemiepiphytic vine | trepadora hemiepífita | lithophytic, hemiepiphytic | trepadora hemiepífita o rupícola | |||
| Philodendron hederaceum Kunth | #hemiepiphyte | trepadora | trepadora | hemiepiphytic | hemiepífita trepadora | trepadora hemiepífita | |
| Philodendron inaequilaterum Liebm. | *scandent vine, rarely terrestrial or epilithic | trepadora hemiepífita | trepadora hemiepífita | unknown | trepadora o rupícola | ||
| Philodendron jacquinii Schott | #hemiepiphytic vine | trepadora epífita | hemiepiphytic | hemiepífita | |||
| Philodendron mexicanum Engl. | #hemiepiphytic, sometimes terrestrial or epilithic | terrestrial, lithophytic, hemiepiphytic | hemiepífita, raramente terrestre o rupícola | ||||
| Philodendron radiatum Schott | trepadora | #epiphytic or hemiepiphytic, rarely terrestrial | trepadora hemiepífita | trepadora hemiepífita o epífita | terrestrial, lithophytic, hemiepiphytic, epiphytic | epífita o hemiepífita, raramente terrestre | trepadora hemiepífita o epífita |
| Philodendron sagittifolium Liebm. | trepadora | #hemiepiphytic, rarely terrestrial or epilithic | trepadora | trepadora epífita o hemiepífita | terrestrial, lithophytic, hemiepiphytic | hemiepífita | trepadora epífita o hemiepífita |
| Philodendron schottii K. Koch | *coarse vine or scandent vine or liana | trepadora hemiepífita escandente | unknown | trepadora escandente | |||
| Philodendron seguine Schott § | epífita trepadora | *coarse subligneous vine or liana | trepadora hemiepífita | unknown | bejuco o liana trepadora | trepadora hemiepífita o epífita | |
| Philodendron smithii Engl. | #hemiepiphytic, sometimes terrestrial or epilithic | trepadora hemiepífita | terrestrial, lithophytic, hemiepiphytic | hemiepífita terrestre o rupícola | |||
| Philodendron standleyi Grayum | *appresssed-climbing epiphyte | trepadora hemiepífita | unknown | epífita, trepadora adpresa | |||
| Philodendron subincisum Schott | #hemiepiphytic | hemiepífita | |||||
| Philodendron tripartitum Schott | epífita trepadora | #hemiepiphytic appressed-climbing | trepadora | trepadora hemiepífita | hemiepiphytic | hemiepífita, trepadora adpresa | |
| Philodendron tuerckheimii Grayum | *scandent vine | trepadora escandente | unknown | hemiepífita escandente | |||
| Rhodospatha wendlandii Schott § | epífita trepadora | trepadora epífita | trepadora hemiepífita | lithophytic, epiphytic | hemiepífita adpreso- trepadora | trepadora epífita o hemiepífita | |
| Syngonium angustatum Schott | trepadora hemiepífita | hemiepiphytic | hemiepífita trepadora | ||||
| Syngonium chiapense Matuda | epífita trepadora | trepadora hemiepífita | hemiepiphytic | hemiepífita, trepadora | trepadora hemiepífita | ||
| Syngonium neglectum Schott (Engl.) | hemiepífita, trepadora | ||||||
| Syngonium podophyllum Schott § | trepadora | trepadora hemiepífita | trepadora hemiepífita | hemiepiphytic | hemiepífita, trepadora | trepadora hemiepífita | |
| Syngonium sagittatum G.S. Bunting | hemiepífita, adpreso- trepadora |

Figura 3: Vistas de algunas especies de aráceas trepadoras de Veracruz, México. A. Anthurium flexile subsp. flexile (J.F. Macbr.) Croat & R.A. Baker; B. Monstera acuminata K. Koch; C. Monstera lechleriana Schott (= M. egregia Schott); D. Philodendron advena Schott; E. Philodendron hederaceum Kunth; F. Philodendron sagittifolium Liebm.; G. Rhodospatha wendlandii Schott; H. Syngonium chiapense Matuda; I. Syngonium podophyllum Schott. Fotografías: T. Krömer.
El análisis de los datos sobre las formas de vida, documentados en las etiquetas de ejemplares de herbario, reveló para 17 especies de aráceas trepadoras con un mínimo de cinco ejemplares revisados, que todas fueron asignadas con al menos tres de ocho diferentes categorías de hábito: 1) trepador (“climber/vine”); 2) bejuco (“liana”); 3) hemiepífita; 4) hemiepífita trepadora (“climbing hemiepiphyte”); 5) epífita; 6) epífita trepadora (“epiphytic climber/creeper/vine”); 7) terrestre y 8) rupícola (sobre rocas), aunque la mayoría pertenece a cinco o hasta siete categorías (Fig. 4). De un total de 213 ejemplares considerados, excluyendo colectas sin información específica sobre la forma de vida (ej. “hierba”), la mayoría fueron asignados como epífita (56), hemiepífita (45) y trepadora (42), siendo Anthurium flexile (25), Syngonium podophyllum (19; Fig. 3I), Monstera acuminata y Philodendron radiatum (17 cada una) las especies con más ejemplares.

Figura 4: Asignación de formas de vida de las etiquetas de ejemplares de herbario de 17 especies de Araceae de Veracruz, México, dada como porcentajes para cada especie. Las ocho categorías de forma de vida se detallan arriba en la figura. Entre paréntesis se indica el número de ejemplares considerados por especie.
Observaciones de campo vs. literatura y etiquetas de herbario
Monstera tuberculata está categorizada en la mayoría de las publicaciones y etiquetas de herbario como “hemiepífita”, “hemiepífita trepadora”, “trepadora” y “epífita trepadora” (Cuadro 1, Fig. 4). Nuestros datos de las seis especies de Araceae más abundantes de la Estación de Biología Tropical “Los Tuxtlas” indican para esta especie que, de los 59 individuos observados en campo, más de 70% de los más pequeños presentan conexión con el suelo por medio del tallo, situación que se incrementa en los más grandes. Alrededor de 30% de los individuos de la clase 1 presentó conexión por medio de raíces adventicias, disminuyendo a 15% para la clase 3 (Fig. 5A). Estos resultados indican que esta especie no es epífita ni hemiepífita como lo mencionan las publicaciones y los ejemplares de herbario y, aunque un alto porcentaje del total de los individuos tiene conexión por medio de tallos, tampoco se puede decir que es una enredadera, ya que también hay individuos con otro tipo de conexión en todas las clases ontogénicas.
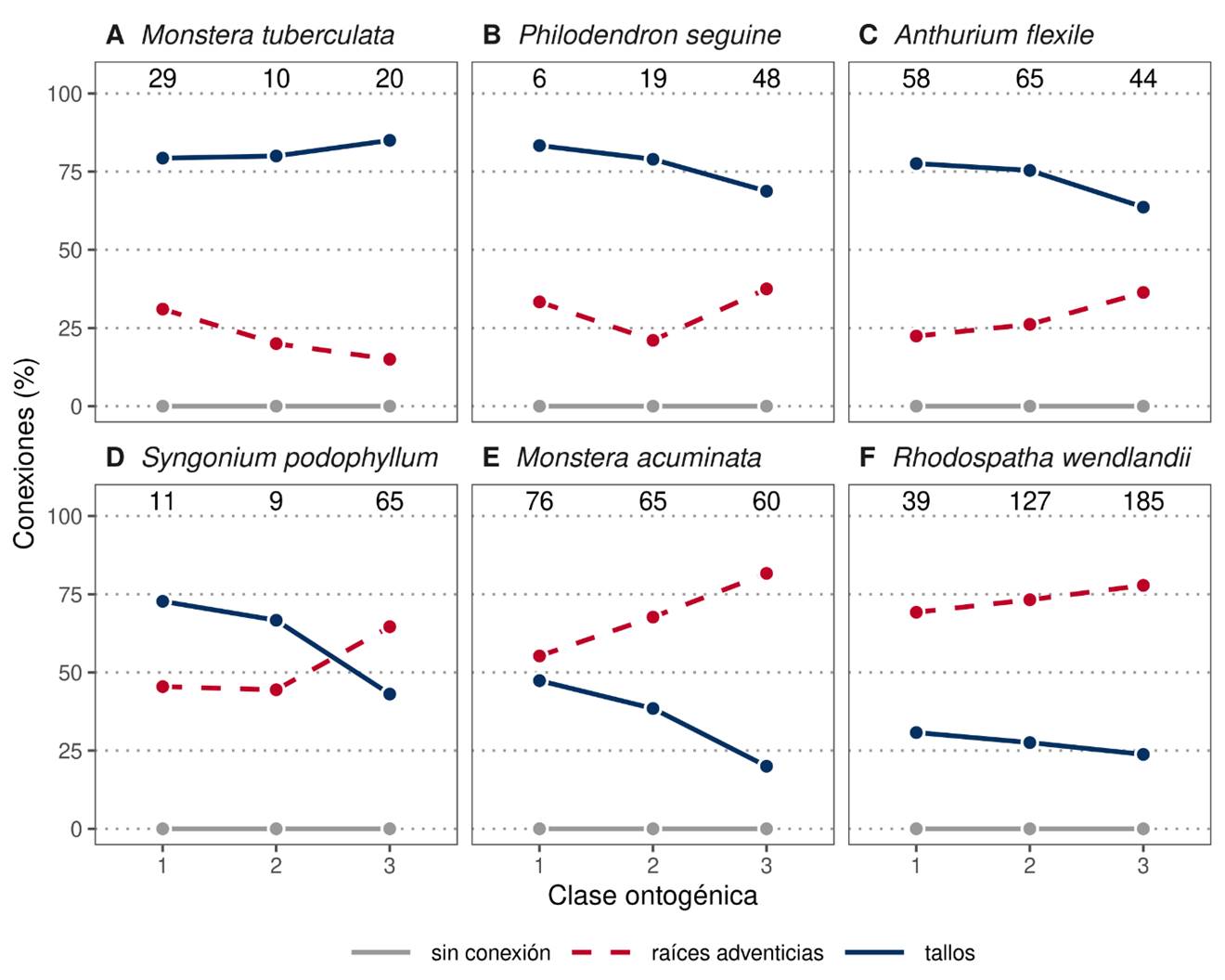
Figura 5: Cambios ontogénicos en el porcentaje de plantas con conexión por tallo, conexión por raíces o sin conexión (= ocurrencia de epífitas) con el suelo en seis especies de Araceae, presentes en la Estación de Biología Tropical “Los Tuxtlas”, Veracruz, México. La suma de los porcentajes de conexiones por raíces y tallos puede exceder 100%, ya que algunos individuos presentaron ambas conexiones.
Philodendron seguine y Anthurium flexile están etiquetadas principalmente como “epífita trepadora”, “trepadora epífita/hemiepífita”, o “bejuco o liana” (Cuadro 1). Ambas especies presentan una trayectoria ontogénica similar; es decir, más de 75% de los individuos de la clase 1 tiene conexión con el suelo por medio de tallos, mientras que solo 60% de la clase 3. Ambas especies tienen pocos individuos pequeños con conexión por medio de raíces adventicias, pero 30% en los grandes (Figs. 5B, C). Los patrones encontrados para estas dos especies no coinciden con las clases otorgadas en la literatura y etiquetas revisadas, ya que se registraron individuos conectados con el suelo, tanto con la raíz como con el tallo, en todas las clases ontogénicas.
Syngonium podophyllum está categorizada como “trepadora hemiepífita”. De los individuos pequeños, 74% tienen conexión con el suelo a través del tallo, y en los grandes hasta 40%. Mientras que durante la trayectoria ontogénica hay pocos individuos de la clase 1 conectados por medio de raíces adventicias, este fenómeno se incrementa hasta 60% en los de la clase 3 (Fig. 5D). Por tanto, esta especie no puede ser catalogada como una trepadora epífita debido a la amplia variación ontogénica presentada entre los individuos clasificados en las tres clases.
En Monstera acuminata y Rhodospatha wendlandii (Fig. 3G), la trayectoria ontogénica indica que más de 50% de los individuos de la clase 1 presentan conexiones por medio de raíces adventicias, y hasta 75% y 80% respectivamente, en los de la clase 3; menos de 50% de los de la clase 1 tiene conexión con tallo, y hasta 25% y 15% para los de la clase 3 (Figs. 5E, F). A pesar de que estas dos especies muestran una ligera tendencia a incrementar la conexión con el suelo por medio de raíces adventicias en la clase 3; esto no concuerda con las categorías epífita/hemiepífita-trepadora asignadas en la literatura, ya que también presentan conexión terrestre por medio de sus tallos en plantas más grandes.
Discusión
Los resultados de este trabajo muestran que todavía existe una profunda confusión cuando se trata de describir la forma de vida de las aráceas trepadoras. Las inconsistencias en el uso de la terminología entre los investigadores que trabajan en Araceae son problemáticas (Zotz et al., 2020), debido a que actualmente es imposible distinguir entre una confusión terminológica y una posible variación biológica. Además, se vislumbra un problema mucho más serio, ya que la comparación de los datos de campo con las etiquetas de ejemplares de herbario, floras y otra literatura relevante, sugiere que ninguna de las seis especies examinadas en campo en esta investigación encaja dentro del concepto de “hemiepífita secundaria” (sensuKress, 1986) y estas en realidad podrían ser muy escasas o no existir.
Si bien solo se presentan datos de observaciones de campo para las seis especies de Araceae más abundantes en la Estación de Biología Tropical “Los Tuxtlas”, estos coinciden con los resultados reportados por Zotz et al. (2020), donde ni una sola planta de las cuatro especies observadas en Barro Colorado Island (BCI), Panamá, presentó desconexión con el suelo. Además, es notable que los individuos de las especies observadas en ambos estudios tienden a tener un desarrollo ontogénico gradual y variado. Por ejemplo, independientemente de la clase ontogénica, se presentan distintos porcentajes de individuos juveniles y más grandes conectados por raíces adventicias o tallo. Es decir, en ninguna clase de la trayectoria ontogénica, las especies presentaron 100% de sus individuos con una conexión exclusiva, ya sea por raíz, por tallo o sin conexión, lo cual descarta la posibilidad de poder diferenciar con claridad a qué categoría pertenecen. La excepción es Anthurium clavigerum de BCI, donde ni un solo individuo tuvo contacto por tallo con el suelo, pero sí por raíces adventicias, aumentando de 30% en plantas juveniles a 100% en las adultas. Además, la longitud de los tallos cambió relativamente poco en esta especie y la posición de sus ápices fue mucho más alta en comparación con su longitud, coincidiendo así con la definición de una hemiepífita sin el calificativo “primaria” (sensu Zotz, 2013).
El presente estudio sirve para exhortar a no hacer asignaciones precipitadas basadas en observaciones de campo sin tener datos cuantitativos sobre el contacto de las plantas con el suelo durante la ontogenia. Por ejemplo, en observaciones previas al censo realizado se pudo notar un gran número de plántulas de Anthurium flexile y Monstera acuminata sobre el suelo y bases de los árboles, mientras que las plantas más grandes predominaban trepando los troncos y ramas. Partiendo de estas observaciones se podría deducir que ambas especies son NV, ya que en los resultados obtenidos podemos ver que un gran porcentaje de individuos de las tres clases ontogénicas de A. flexile presenta conexión por tallo al suelo, mientras que en M. acuminata el mayor porcentaje la presenta por raíces adventicias. Sin embargo, en ambas especies se presenta un porcentaje menor de otro tipo de conexión, ya sea por raíz o tallo respectivamente.
Lo anterior sugiere que hay una gran variación natural en el sitio de germinación de las especies, lo que también fue observado en la Guayana Francesa por Cockle (2001), quien registra el sitio de establecimiento de 1572 plántulas de varias especies del género Philodendron. Menos de 10% se encontraron en el suelo; un número similar en troncos y tallos de árboles más pequeños, pero la mayoría creció en contrafuertes muertos, escombros leñosos u hojarasca. Las conclusiones de ese estudio son limitadas, ya que las plántulas no se identificaron a nivel de especie, pero las observaciones ciertamente sugieren una plasticidad intraespecífica sustancial. Así concluimos que la ontogenia de estas y otras especies trepadoras de Araceae es mucho más compleja y variable y no se pueden hacer conclusiones basadas en observaciones someras o en la literatura, en la cual sus autores han errado en cuanto a las categorías implementadas.
Es necesario analizar y aclarar la ontogenia de las aráceas trepadoras. Esto puede contribuir a estructurar adecuadamente nuestros conceptos y evitar ambigüedades en la terminología. De esta manera también se podría evitar que se agrupen especies de Araceae indistintamente en estudios sobre epífitas, lo cual lleva a sobreestimar la riqueza y diversidad reportada (ej. Benavides et al., 2005; Martínez-Meléndez et al., 2009; Freitas et al., 2016; Guzmán-Jacob et al., 2020; Krömer et al., 2020). Descartar el uso de HS resuelve el problema de una posible confusión con hemiepífitas “primarias” cuando este es usado sin un calificativo y, aunque el uso de “nomadic vine” o “enredadera nómada” se hace cada vez más presente en publicaciones botánicas (Woods et al., 2018; Hay y Boyce, 2019; Wong y Boyce, 2019) el problema principal persiste.
Se propone la realización de estudios cuantitativos sobre la germinación y el establecimiento temprano, así como los relacionados con aspectos funcionales entre epífitas verdaderas, hemiepífitas “primarias” y enredaderas leñosas y herbáceas para descifrar si las enredaderas nómadas podrían representar un posible camino evolutivo hacia el epifitismo, idea que probablemente está implícita con el término “hemiepífita”. Así mismo se sugiere prestar atención a lo que se ve en campo e incluir información en las etiquetas sobre el tipo de conexión cuando se realizan colectas. Por ahora es necesario tener claros los términos básicos: epífita y hemiepífita sensuSchimper (1903), ya que por el momento la veracidad de los términos NV y HS no puede ser probada; por lo tanto, no tiene sentido tratar de hacer categorías si lo que se observa es más bien una variación continua.











 nueva página del texto (beta)
nueva página del texto (beta)



