Introducción
Los manglares son ecosistemas de distribución tropical y subtropical con una alta productividad primaria (Qasim y Wafar, 1990), la cual está asociada a la constante descomposición de materia orgánica, llevada a cabo principalmente por hongos, arqueas y bacterias (Odum y Heald, 1975). En México se encuentra alrededor de 5% de la superficie total de manglares del mundo (Rodríguez-Zuñiga et al., 2013). Dentro de las especies que se distribuyen en el país se encuentra Rhizophora mangle L., comúnmente conocida como mangle rojo o colorado. Esta es una especie arbórea o arbustiva, perennifolia y halófita, que forma ecosistemas con dominancia absoluta en la parte de mayor influencia salina y en la que el nivel de inundación es mayor. Es característica de los litorales, en donde forma poblaciones en las zonas intermareales de lagunas costeras y esteros con influencia de agua salada (Lacerda et al., 2002). Rhizophora mangle se distribuye en las costas americanas del Océano Pacífico de forma continua desde el sur de Sonora y Baja California hasta Ecuador, incluyendo el Archipiélago de Galápagos y en 1902 fue introducida a Hawái. En el Océano Atlántico se presenta en forma discontinua desde las costas de Florida hasta Brasil. Se le encuentra también en Bermuda, Bahamas, Antillas Mayores y Menores (DeYoe et al., 2020). En el continente africano está presente desde Angola a Mauritania (Ellison, 1991).
La micobiota es clave en la composición y funcionamiento de los ecosistemas de manglar, ya que dentro de esta se pueden encontrar especies saprobias que degradan el material vegetal y facilitan el reciclaje de nutrientes en el ecosistema, además de mutualistas como líquenes y micorrizas, e incluso fitopatógenos capaces de provocar daños en la vegetación (Hyde y Lee, 1995; Hyde et al., 1998; Wier et al., 2000). En México el conocimiento de la diversidad fúngica en estos ecosistemas es aún incipiente; las primeras publicaciones datan de 1968 en manglares de las costas de Chiapas, Oaxaca y Veracruz (Kohlmeyer, 1968).
El objetivo del presente estudio es aportar información sobre la composición taxonómica, descripción morfológica y distribución de hongos asociados a restos vegetales y estructuras vivas de Rhizophora mangle en comunidades naturales de manglares de la Reserva de la Biosfera Isla de Cozumel en el Caribe Mexicano.
Materiales y Métodos
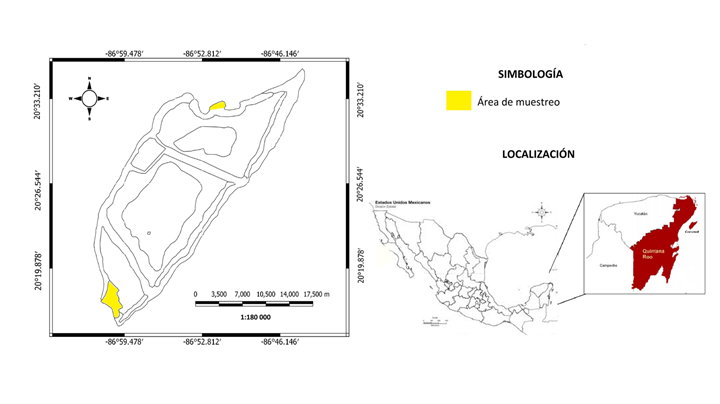
Área de estudio
La Isla de Cozumel se encuentra ubicada entre las coordenadas 20°35'20'' y 20°17'16'' de latitud norte (N) y 86°43'55'' y 87°00'07'' de longitud oeste (O) (Fig. 1). Está constituida por sedimentos calcáreos de origen marino del periodo Terciario y Reciente (CNA, 2002). El clima, de acuerdo con el sistema de Köppen, modificado por García (1981), es de tipo AmW(I), cálido húmedo con abundantes lluvias en verano. La temperatura media anual es de 25.5 °C, las máximas (39 °C) se presentan en agosto y las mínimas (20 °C) en enero. La precipitación promedio anual es de 1570 mm con un máximo en septiembre-octubre (250 mm mensuales) y un mínimo en marzo-abril (40 mm mensuales) (INEGI, 2013). La vegetación de manglar ocupa aproximadamente 12.41% de la superficie total de la Isla (CONANP, 2007), está representada por Rhizophora mangle, Laguncularia racemosa (L.) C.F. Gaertn., Conocarpus erectus L. y Avicennia germinans L.
Muestreo y tratamiento de muestras
Se realizaron recolecciones en dos temporadas, en el mes de mayo (temporada de estiaje) y en octubre (temporada de lluvias) del año 2019. Primeramente se localizaron las poblaciones de R. mangle en el sitio de estudio con base en los criterios de Agraz-Hernández et al. (2006). En cada sitio se realizaron recorridos en busca de restos vegetales con cuerpos fructíferos (troncos, ramas, hojas en descomposición, etc.) y plantas vivas con signos de colonización fúngica (manchas foliares, presencia de carpóforos en ramas, tallos, cortezas y raíces).
Los especímenes se caracterizaron en fresco, describiendo los caracteres macroscópicos de acuerdo con el tamaño, forma, consistencia y color. Posteriormente se deshidrataron y se trasladaron al Laboratorio de Micologia de la Escuela Nacional de Ciencias Biológicas (ENCB) del Instituto Politécnico Nacional (IPN). Todo el material se examinó según las técnicas tradicionales micológicas propuestas por Cifuentes et al. (1986).
Para la microscopía se realizaron cortes a mano de los cuerpos fructíferos, de los cuales se elaboraron preparaciones montadas en alcohol al 70%, KOH al 10%, y en el caso de los ascomicetos se tiñeron con reactivo Melzer para la detección de la amiloidia en las ascas. La observación y caracterización microscópica se efectuó utilizando los microscopios ópticos K-7 (Zeiss, Jena, Alemania) y Nikon Eclipse 8i con una camara adaptada Nikon DS-Fi1 (Nikon, Tokio, Japón). La terminología empleada se basó en el diccionario ilustrado de micología (Ulloa y Hanlin, 2006). Las referencias de los colores se indican de acuerdo con la tabla de color de Kornerup y Whasher (1974).
En el caso de los líquenes, los especímenes se analizaron en el Laboratorio de Calidad Ambiental de la Facultad de Biología de la Universidad Veracruzana y el Laboratorio de Micromicetos del Instituto de Ecología, A.C. (INECOL), de acuerdo con la metodología expuesta por Brodo et al. (2001), tomando las medidas de las estructuras sexuales en agua.
Para la determinación taxonómica se emplearon las claves de Kolhmeyer y Kohlmeyer (1979), Sutton (1980), Rogers y Ju (1998), San Martín et al. (1999), Whalley et al. (2000), Nash et al. (2007), Seifert et al. (2011), Wijayawardene et al. (2014), Han y Cui (2015), Brodo (2016) y Reyes et al. (2020).
Los ejemplares se depositaron en la colección de hongos del Herbario de la Escuela Nacional de Ciencias Biológicas del Instituto Politécnico Nacional (ENCB) y en el caso de algunas especies liquenizadas se depositaron duplicados en el Herbario de la Universidad Veracruzana (XALU). Los nuevos registros para México se describen macro y microscopicamente, mientras que en el resto de las especies solo se incluyen notas taxonómicas.
Resultados
Se registraron 36 especimenes y se determinaron 20 especies pertenecientes a 18 géneros, 14 familias, ocho órdenes, siete clases; la mayoría pertenece al Phylum Ascomycota (16 especies) y la minoría a Basidiomycota. Todas las especies son nuevos registros para Cozumel, a excepción de Pycnoporus sanguineus (L.) Murrill; diez para el estado de Quintana Roo: Arthonia antillarum (Fée) Nyl., Naevia pinastri (Anzi) Thiyagaraja., Lüking & K.D. Hyde, Alyxoria varia (Pers.) Ertz & Tehler, Dimidiographa graphidiza (Nyl.) Ertz & Theler, Bactrospora denticulata (Vain.) Egea y Torrente, Patellaria atrata (Hedw.) Fr., Pyrenula cerina Eschw., Annulohypoxylon nitens (Ces.) Y.M. Ju, J.D. Rogers & H.M. Hsieh, Rhodofomitopsis feei (Fr.) B.K. Cui, M.L. Han y Y.C. Dai y Megasporoporia setulosa (Henn.) Rajchenb y cinco para México: Arthonia conferta (Fée). Nyl., Halorosellinia oceanica (S. Schatz) Whalley, E.B.G. Jones, K.D. Hyde & Læssøe, Chaetosphaerella fusca (Fuckel) E. Müll & C. Booth, Phyllosticta capitalensis Henn. y Pseudocamarosporium propinquum (Sacc.) Wijayaw., Camporesi & K.D. Hyde. En este trabajo se siguió la clasificación de Kirk et al. (2008).
Taxonomía
Arthoniaceae
Arthonia antillarum (Fée) Nyl., Flora Regensburg 50: 7. 1867.
TIPO: ANTILLAS. Localidad no mencionada, colector no mencionado (holotipo: G-00290176).
= Coniocarpon antillarum Fée, Essai Crypt. Exot., Suppl. Révis. (Paris): 94. 1837.
Hábito y hábitat: liquenizado, sobre ramas vivas de R. mangle.
Distribución: es una especie de amplia distribución, ha sido citada de manglar, como epífita de Sonneratia sp. (Lythraceae) en Sri Lanka (Maduranga et al., 2018). Los últimos registros a nivel mundial se encuentran en Puerto Rico (Mercado-Díaz y Sur, 2009), Florida (Lucking et al., 2011), noroeste de la India (Das et al., 2013), Bermuda (Berger y LaGreca, 2014), noroeste de Brasil (Leite et al., 2015), norte de Estados Unidos de América (Esslinger, 2016) y Antillas Holandesas (Aptroot y Stech, 2018). En México se ha registrado en Jalisco (Herrera-Campos et al., 2017). El registro presentado en este estudio constituye el primero para el estado de Quintana Roo.
Material estudiado: MÉXICO. Quintana Roo, municipio Cozumel, Punta sur, 20°16'48''N, 86°58'44''O, 19.V.2019, Y. A. García y M. A. Bravo 31c (ENCB).
Notas taxonómicas: esta especie se caracteriza por los apotecios de 0.2-0.3 mm de diámetro, redondeados a irregulares, pardos y maculiformes; ascas de 15-20 × 10-15 µm, globosas a oblongas, bitunicadas, octosporadas; ascosporas de 13-15(18) × 4-5 µm, macrocéfalas, hialinas, con tres septos; talo I+ azul, K-, C-, UV+ amarillo; himenio I+ rojo y KI+ azul oscuro. Fácilmente distinguible de otras especies de Arthonia Ach. debido a su característica reacción del talo UV + amarillo.
Arthonia conferta (Fée). Nyl., Mém. Soc. Imp. Sci. Nat. Cherbourg 5: 132. 1857. Fig. 2.
TIPO: ANTILLAS. Localidad no mencionada, colector no mencionado (holotipo: G-00290202).
= Coniocarpon confertum Fée, Essai Crypt. Exot., Suppl. Révis. (Paris): 95. 1837.

Figura 2: Arthonia conferta (Fée) Nyl. A. ascoma; B. corte longitudinal del ascoma en sustrato; C. asca con ascosporas; D. ascosporas.
Talo costroso, blanquecino, ligeramente aereolado; fotobionte Trentepohliaceae; apotecios 200-250 × 20-50 µm, maculados, color marrón a negro, emarginados, con una capa fina de pruina, solitarios, dispersos, errumpentes a superficiales, excípulo discreto, epitecio 10-15 µm de alto; himenio 180-200 × 20-50 µm, hialino; parafisas 1 µm de diámetro, hialinas, anastamosadas; subhimenio 10-15 µm de grosor, hialino; ascas 30-35 × 20-35 µm, globosas, hialinas, osctosporadas; ascosporas 18-20 × 5-6 µm, clavadas, macrocéfalas, hialinas a verde claro, con 5 septos; excípulo KI-, himenio I+ azul y KI+ azul oscuro, subhimenio KI+ azul oscuro.
Hábito y hábitat: liquenizado, sobre ramas vivas de R. mangle.
Distribución: se ha citado para Cuba (Minter et al., 2001), Venezuela (Neuwirth, 2008), Puerto Rico (Mercado-Díaz y Sur, 2009), norte de Estados Unidos de América (Esslinger, 2016), el archipiélago Seychelles (Neuwirth y Stocker-Wörgötter, 2017) y las Antillas Holandesas (Aptroot y Stech, 2018). Se cita por primera vez para México.
Material estudiado: MÉXICO. Quintana Roo, municipio Cozumel, Punta sur, 20°18'00''N, 87°00'03''O, 20.V.2019, Y. A. García y M. A. Bravo 58a (ENCB), 58ab (XALU).
Notas taxonómicas: esta especie se caracteriza por apotecios maculados; ascosporas de 1820 × 56 µm, macrocéfalas, hialinas a verde claro con cinco septos.
Coniocarpon cinnabarinum DC. en Lamarck & de Candolle, Fl. franç. 2: 323. 1805.
TIPO: Material tipo no localizado.
= Sphaeria gregaria Wigel, Observ. Bot.: 43. 1772.
= Arthonia tumidula (Ach.) Ach., Neues J. Bot. 1(3): 11. 1806.
= Spiloma tumidulum var. rubrum Ach., Lichen. Univers: 137. 1810. TIPO. DINAMARCA. Sin localidad, Ach. s.n. (holotipo: C).
= Conioloma coccineum Flörke, Deutsche Lich. 2(21): 3. 1815.
= Lecanactis cinnabarina (DC.) Fr., Lich. Eur. Reform.: 379. 1831.
= Arthonia cinnabarina (DC.) Wallr., Fl. Crypt. Germ. (Norimbergae) 1: 320. 1831.
= Spiloma gregarium (Weigel) Taylor, en Mackay, Fl. Hibern. 2: 77. 1836.
= Spiloma gregarium var. cinnabarinum (DC.) Turner, Spec. Lich. Brit.: 42. 1839.
= Arthonia coccinea (Flörke) D. Dietr., Deutschl. Kryptog. Gewächse 4: 79. 1846.
= Lepra kermesina Schaer., Eum. Critic. Lich. Europ. (Bern): 240. 1850.
= Coniocarpon gregarium var. coccineum (Flörke) A. Massal., Memor. Lich.: 116. 1853.
= Coniocarpon cinnabarinum var. concolor (Turner) Leight., Ann. Mag. Nat. Hist., Ser. 2(13): 445. 1854.
= Coniocarpon cinnabarinum var. marginatum (Turner) Leight, Ann. Mag. Nat. Hist., Ser. 2(13): 444. 1854.
= Arthonia gregaria (Weigel) Körb., Syst. Lich. Germ. (Breslau): 291. 1855.
= Arthonia cinnabarina var. marginata (Turner) Mudd, Man. Brit. Lich: 249. 1861.
= Arthonia gregaria var. dubia (Turner & Borrer) Mudd, Man. Brit. Lich.: 249. 1861.
= Arthonia cinnabarina var. astroidea (Leight.) Leight., Lich.-Fl. Great Brit. 3: 423. 1871.
= Arthonia cinnabarina f. concolor (Turner) Leight., Lich.-Fl. Great Brit. 3: 422. 1879.
= Melaspilea coccinea (Flörke) Stein, Ostafr. Gletscherfahrten: 320. 1890.
= Arthonia gregaria var. kermesina (Schaer.) Willey, Syn. Gen. Arthonia: 7. 1890.
= Arthonia gregaria var. anerythrea (Nyl.) Willey, Syn. Gen. Arthonia: 7. 1890.
=Arthonia gregaria var. tumidula (Ach.) Vain., en Hiern, Cat. Welwitsch. Afric. Pl. 2(2): 448. 1901.
= Arthonia gregaria f. pruinata (Delise ex Nyl.) Hue, Bull. Soc. Bot. Fr. 54: 18. 1908.
= Arthonia cinnabarina var. coccinea (Flörke) Zahlbr., Cat. Lich. Univers. 2: 24. 1922.
= Arthonia cinnabarina var. nudata (Müll Arg.) Zahlbr., Cat. Lich. Univers. 2: 26. 1922.
= Arthonia cinnabarina var. purpurea (Eschw.) Zahlbr., Cat. Lich. Univers. 2: 29. 1922.
= Arthonia gregaria var. cuspidans A.L. Sm., Monogr. Brit. Lich., End 2(2): 30. 1926.
= Trachylia gregaria var. tumidula (Ach.) Vain., Bolm. Soc. Broteriana, Coimbra, Sér. 2(6): 171. 1930.
= Arthonia tumidula var. coccinea (Flörke) J. Nowak, Flora Polska 1(1): 85. 1983.
Material estudiado: MÉXICO. Quintana Roo, municipio Cozumel, Punta sur, 20°16'48''N, 86°58'44''O, 19.V.2019, Y. A. García y M. A. Bravo 31d (ENCB).
Hábito y hábitat: liquenizado, sobre ramas vivas de R. mangle.
Distribución: ampliamente distribuido en el mundo (Grube, 2007), posiblemente una especie cosmopólita; se citó previamente de Quintana Roo por Guzmán-Guillermo et al. (2019).
Notas taxonómicas: se distingue de otras especies del grupo cinnabarinum por apotecios con el margen pruinoso rojo K+ púrpura, esporas con tamaños mayores a 20 µm y el aparato apical del asca KI-.
Naevia pinastri (Anzi) Thiyagaraja., Lücking & K. D. Hyde, Fungal Diversity 102: 216. 2020.
TIPO: ITALIA. Passo del Carnaio - Bagno di Romagna, Providencia de Forli - Cesena, sobre troncos de pinos, 25.IX.2017, M. Anzi s.n. (holotipo: H-NYL 4772; lectotipo: MFLU 17-1696, designado por Thiyagaraja et al., 2020).
= Arthonia pinastri Anzi, Comm. Socc, Crittog. Ital. 1(3): 159. 1862.
Hábito y hábitat: saprobio, sobre ramas muertas de R. mangle.
Distribución: es una especie de amplia distribución mundial (Thiyagaraja et al., 2020). En México ha sido reportado en Sonora, Baja California Norte, Baja California Sur y Sinaloa (Nash et al., 2007). El registro presentado en este estudio constituye el primero para el estado de Quintana Roo.
Material estudiado: MÉXICO. Quintana Roo, municipio Cozumel, Punta sur, 20°18'00''N, 87°00'14''O, 19.V.2019, Y. A. García y M. A. Bravo 62 (ENCB); loc. cit., 20°18'00''N, 87°00'14''O, 16.X.2019, T. Raymundo 8321 (ENCB).
Notas taxonómicas: esta especie se caracteriza por apotecios de 0.2-0.3 mm de diámetro, redondeados a irregulares, negros, gregarios, errumpentes; parafisas 0.5 a 1 µm de diámetro, hialinas; ascas 25-25 × 15-20 µm, globosas a oblongas, bitunicadas, octosporadas; ascosporas 11-15 × 4-6 µm, macrocefalas, hialinas, con tres septos; excípulo KI+ azul oscuro, himenio K+ verde y KI+ azul oscuro; subhimenio KI+ azul oscuro. La microscopía difiere de lo reportado por Torrente y Egea (1987) y Lee y Hur (2016), ya que no reportan ascosporas macrocefalas; sin embargo, este carácter coincide con lo reportado por Grube (2007), Lücking et al. (2011) y Thiyagaraja et al. (2020).
Lecanographaceae
Alyxoria varia (Pers.) Ertz & Tehler, Fungal Diversity 49(1): 53. 2011.
TIPO: Material tipo no localizado.
= Opegrapha varia Pers. Ann. Bot. 7: 30. 1794.
= Lichen diaphorus Ach., Lich. Suec. Prodr.: 20. 1798.
= Alyxoria diaphora Gray., Nat. Arr. Brit. Pl 1: 504. 1821.
= Graphis varia (Pers.) Branth & Rostr., Bot. Tidsskr. 3: 243. 1869.
= Graphis varia var. varia. (Pers.) Branth & Rostr., Bot. Tidsskr. 3: 243. 1869.
Hábito y hábitat: liquenizado, sobre ramas vivas de R. mangle.
Distribución: es una especie de amplia distribución. En México se ha citado para Jalisco (Herrera-Campos et al., 2017). El registro presentado en este estudio constituye el primero para el estado de Quintana Roo.
Material estudiado: MÉXICO. Quintana Roo, municipio Cozumel, Punta sur, 20°16'48''N, 86°58'44''O, 19.V.2019, Y. A. García y M. A. Bravo 31b (ENCB).
Notas taxonómicas: esta especie se caracteriza por ascomas lireliformes de 1-3 mm longitud, ramificados, superficiales; excípulo completamente carbonizado; himenio 120 × 100 µm; epitecio 25 µm de alto; ascas bitunicadas de 45-50 × 15-18 µm, globosas a oblongas, bitunicadas, octosporadas; ascosporas 20-25 × 4-5 µm, hialinas, con tres a cinco septos; himenio I+ rojo, KI+ azul oscuro. Esta especie se distingue de otras similares por un excípulo completamente carbonizado y todas las reacciones I, Cl, K y UV negativas sobre el talo.
Roccellographaceae
Dimidiographa graphidiza (Nyl.) Ertz & Tehler, Fungal Diversity 49(1): 53. 2011.
TIPO: ANGOLA. Luanda, sobre Euphorbia candelabrium (Euphorbiaceae), F. Welwitsch s.n. (holotipo: H-NYL 6559).
= Opegrapha graphidiza Nyl., Bull. Soc. Linn. 2: 517. 1868.
Hábito y hábitat: liquenizado, sobre ramas vivas de R. mangle.
Distribución: presenta una distribución amplia en el planeta, citado de África, Asia y Australia (Ertz, 2009). Previamente se citó para México de Baja California Sur como Opegrapha subgraphidiza Zahlbr. (Ertz y Egea, 2007). El registro presentado en este estudio constituye el primero para el estado de Quintana Roo.
Material estudiado: MÉXICO. Quintana Roo, municipio Cozumel, Punta sur, 20°18'00''N, 87°00'03''O, 19.V.2019, Y. A García y M. A. Bravo 58b (ENCB); loc. cit., 20.V.2019, Y. A. García y M. A. Bravo 44 (XALU).
Notas taxonómicas: esta especie se caracteriza por formar ascomas lireliformes de 2-5 mm de diámetro, no ramificados, negros, errumpentes a superficiales, completamente carbonizados; excípulo ectal lateralmente carbonizado de 35-40 µm de grosor; himenio de 90-100 × 8-9 µm; ascas 50 × 20-5 µm, ascosporas 30-35 × 4-5 µm, con siete a ocho septos; himenio e hipotecio I+ rojo y KI+ azul oscuro.
Incertae sedis
Bactrospora denticulata (Vain.) Egea & Torrente, Lichenologist 25(3): 229. 1993.
TIPO: ESTADOS UNIDOS DE AMÉRICA. Isla St. Thomas, sobre la corteza de árbol, 1896, F. Bergesen (lectotipo: TUR 26458, designado por Egea y Torrente, 1993).
= Lecanactis denticulata Vain., Ann. Acad. Sci. fenn., Ser 6(7): 141. 1915. TIPO: ESTADOS UNIDOS DE AMÉRICA. Isla San Croix, sobre corteza de árbol, 14.II.1906, Raunkiaer (paratipo: TUR 26457).
Hábito y hábitat: liquenizado, sobre ramas vivas de R. mangle.
Distribución: se ha encontrado en las islas del Caribe, en Florida (Estados Unidos de América) (Egea y Torrente, 1993), Archipiélago Galápagos (Aptroot y Sparrius, 2008) y Antillas Holandesas (Aptroot y Stech, 2018). En México se ha citado para Jalisco (Herrera-Campos et al., 2017). El registro presentado en este estudio constituye el primero para el estado de Quintana Roo.
Material estudiado: MÉXICO. Quintana Roo, municipio Cozumel, Punta sur, 20°16'48''N, 86°58'44''O, 19.V.2019, Y. A. García y M. A. Bravo 31c (ENCB).
Notas taxonómicas: esta especie se caracteriza por apotecios de 300-800 × 20-50 µm, negros, con un margen grueso formado por 3 a 4 lóbulos, acuminados, solitarios, dispersos, errumpentes a sésiles; excípulo 100-130 × 30-40 µm, negro, completamente carbonizado, abierto o cerrado bajo el subhimenio; epitecio 25-30 µm; himenio 140-160 µm, hialino; parafisas de 1 µm de diámetro, hialinas, subhimenio 60-100 µm de diámetro, hialino; ascas 100-140 × 10-12 µm, clavadas, con cámara ocular KI+ azul, octosporadas; ascosporas 80-90 × 2-3 µm, alargadas, hialinas, con ocho a nueve septos; talo I-, KI+ azul, excípulo I- y KI-, himenio I+ rojo y KI+ azul oscuro, subhimenio I- y KI+ azul oscuro.
Botryosphaericeae
Pseudocamarosporium propinquum (Sacc.) Wijayaw., Camporesi & K.D. Hyde, Cryptog. Mycol. 35(2): 191. 2014. Fig. 3.

Figura 3: Pseudocamarosporium propinquum (Sacc.) Wijayaw., Camporesi & K.D. Hyde: A. picnidios sobre corteza de rama de R. mangle; B. picnidio; C. pared del picnidio; D. conidio.
TIPO: FRANCIA. Rouen, sobre ramas de Salix vitellina L. (Salicaceae), Letendre s.n. (holotipo: PAD); ITALIA. Provincia Firenze, sobre rama muerta de Salix sp. (Salicaceae), 12.V.2013, E. Camporesi NNW IT 1253 (epitipo: MFLU 14-0092, designado por Wijayawardene et al., 2014).
= Camarosporium propinquum Sacc., Syll. Fung. 3: 464. 1884.
= Hendersonia propinqua Sacc., Michelia. 1(5): 516. 1897.
Micelio inmerso en el sustrato; hifas ramificadas, septadas, oscuras; picnidios 300-400 µm de diámetro × 200-300 µm de alto, semiglobosos, negros, solitarios, subepidermales a superficiales, uniloculares con pared de 50-54 µm de grosor, formada por dos capas de células negras de textura angular; ostiolo circular central; conidióforos ausentes; células conidiógenas holoblasticas discretas, hialinas, formadas en la pared de picnidio; conidios 12-15 × 5 µm, variables en forma, marrones, muriformes con septos transversales, longitudinales y oblicuos, base truncada.
Hábito y hábitat: saprobio lignícola sobre rama caída de R. mangle.
Distribución: India (Sridhar, 2009), Francia (Wijayawardene et al., 2014) e Italia (Wijayawardene et al., 2016). Se cita por primera vez para México.
Material estudiado: MÉXICO. Quintana Roo, municipio Cozumel, Punta sur, 20°16'48''N, 86°58'44''O, 16.X.2019, Y. A. García 120 (ENCB).
Notas taxonómicas: esta especie se caracteriza por picnidios subepidermales y conidios elipsoidales a ovales con dos a tres septos transversales de 12-15 × 5-7 µm.
Phyllostictaceae
Phyllosticta capitalensis Henn., Hedwigia 48: 13. 1908.Fig. 4.

Figura 4: Phyllosticta capialensis Henn: A. picnidios sobre sustrato; B. vista lateral de picnidio; C. corte longitudinal de picnidio liberando conidios; D. conidios.
TIPO: BRASIL. São Paulo, sobre hojas de Stanhopea, Putteman 736 (no se menciona en que herbario fue depositado el tipo).
= Phyllosticta pyriformis E.K. Cash & A.M.J. Watson, Micologia 47(5): 737. 1955. TIPO: ESTADOS UNIDOS DE AMÉRICA. Sanford, sobre Schomburgkia (Orchidaceae) en las Islas Caiman, V.1945 (no se menciona en que herbario fue depositado el tipo).
= Guignardia mangiferae A.J.Roy, Indian Phytopath. 20(4): 348. 1967. TIPO: INDIA. Uttar Pradesh, sobre hojas secas de Mangifera indica, A. J. Roy s.n. (no se menciona en que herbario fue depositado el tipo).
= Guignardia endophyllicola Okane, Nakagiri & Tad. Ito Can. J. Bot. 79(1): 103. 2001. TIPO: JAPÓN. Kyoto, sobre hojas de Rhododendron pulchrum Sweet (Ericaceae), 30.V.1995, sin colector s.n. (holotipo: IFO H-12230).
Picnidios 140-144 µm de diámetro, globosos, negros con una marca blanca apical cuando maduros, inmersos a parcialmente errumpentes, acervados, pared del conidioma delgada, de textura prismática y angular, compuesta de una a dos capas de células ovoides, oscuras, 8-10 µm en su parte más ancha, uniloculares; ostiolo circular central, oscuro de pared gruesa; conidióforos reducidos a células conidiógenas que revisten toda la cavidad del picnidio, integradas en una mucosidad; células conidiógenas discretas, basales, cortas, delgadas, hialinas; conidios 9-12 × 4-6 µm, subglobosos, con terminación redondeada, hialinos, unicelulares, holablasticos, vacuolados, pared delgada con un apéndice basal 1-5 µm de largo, hialino.
Hábito y hábitat: saprobio, sobre hojarasca de R. mangle.
Distribución: Sudáfrica (Schutte, 1995), Brasil, Uruguay, Venezuela (Baayen et al., 2002), Tailandia (Wikee et al., 2013) y China (Xu et al., 2019). Se cita por primera vez para México.
Material estudiado: MÉXICO. Quintana Roo, municipio Cozumel, Punta norte, 20°32'36''N, 86°52'40''O, 19.V.2019, Y. A. García 45 (ENCB); loc. cit., Punta sur, 20°16'48''N, 86°59'44''O, 16.X.2019, Y. A. García 121 (ENCB), 122 (ENCB), 123 (ENCB), 124 (ENCB), 125 (ENCB).
Notas taxonómicas: esta especie se caracteriza por conidios de 9-12 × 4-6 µm, redondeado subglobosos, hialinos, vacuolados, con un ápice basal. En México de este género solo se había reportado a P. ampelicida (Engelm.) Aa. y P. citricarpa (McAlpine) Aa. (Moreno-Velazqúez, et al., 2019). Estas especies son muy parecidas morfológicamente; sin embargo, difieren en que los conidios de P. capilatenesis son mas pequeños, así como la presencia de un apéndice, además de que las dos primeras especies son patógenas de cítricos.
Patellariaceae
Patellaria atrata (Hedw.) Fr., Syst. Mycol. (Lundae) 2(1): 158. 1822.
TIPO: Material tipo no localizado.
= Lichen atratus Hedw., Descr. Micr. Anal. Musc. Frond (Lipsiae) 2: 61. 1789.
≡ Lecanidion atratum (Hedw.) Endl., Flora Pason 1: 46. 1830.
Hábito y hábitat: saprobio lignícola, sobre ramas caídas de R. mangle.
Distribución: es una especie amplimante citada en regiones tropicales y templadas del mundo. En México se ha citado para Sonora (Méndez-Mayboca et al., 2010), Chiapas y Veracruz (Tapia, 2016). Este corresponde al primer registro de la especie para el estado de Quintana Roo.
Material estudiado: MÉXICO. Quintana Roo, municipio Cozumel, Punta sur, 20°18'01''N, 87°00'0''O, 15.X.2019, T. Raymundo 8326 (ENCB).
Notas taxonómicas: esta especie se caracteriza por ascomas discoides de 0.5-1 mm diámetro, negros, solitarios, superficiales, carbonáceos; ascas 50-80 × 15-20 µm, cilíndricas a claviformes, bitunicadas, con estípite corto, octosporadas, biseriadas; ascosporas 20-30 × 5-8 µm, claviformes, hialinas, con cuatro a cinco septos transversales.
Pyrenulaceae
Pyrenula cerina Eschw., Syst. Lich.: 25. 1824.
TIPO: BRASIL. Brasilia, K. F. P. Martilus s.n. (isotipo: H-NYL-1252, lectotipo: M-0024077).
Hábito y hábitat: liquenizado, sobre ramas y troncos vivos de R. mangle.
Distribución: presenta una distribución neotropical (Aptroot, 2012), asociada principalmente a las costas. Para México se conocía previamente de Jalisco (Herrera-Campos et al., 2017). El material estudiado representa el primer registro de la especie para el estado de Quintana Roo.
Material estudiado: MÉXICO. Quintana Roo, municipio Cozumel, Punta sur, 20°16'48''N, 86°58'44''O, 24.IV.2019, Y. A. García y M. A. Bravo 31e (ENCB), 58d (ENCB), 147 (ENCB), 162 (ENCB), 163 (ENCB).
Notas taxonómicas: esta especie se caracteriza por un talo amarillo UV+ naranja, peritecios embebidos en un pseudoestroma que se encuentra bajo el talo, con un ostiolo apical sin cuello de 30-40 um de diámetro, ascosporas 20-25 × 10-11 µm, fusiformes, hialinas, con tres septos y cuatro lóculos pardos, siendo los dos distales mas cortos que los centrales.
Chaetosphaerellaceae
Chaetosphaerella fusca (Fuckel) E. Müll. & C. Booth, Trans. Br. Mycol. Soc. 58 (1): 77. 1972. Fig. 5.

Figura 5: Chaetosphaerella fusca (Fuckel) E. Müll & C. Booth: A. micelio y esporas sobre raíz de R. mangle; B. hifas y conidios inmersos en el sustrato; C. conidióforo; D. conidios.
TIPO: REPÚBLICA CHECA. Localidad no especificada, sobre madera, Sambun s.n. (holotipo: PR).
= Botrytis didyma S. Schmidt, Mykologische Hefte (Leipzig) 1: 81. 1817.
= Diplosporium nigrescens Link, Linn. Spec. Plant. IV 6(1): 64. 1824.
= Oedemium atrum Link, Linn. Spec. Plant. IV 6(1): 42. 1824.
= Dimera didyma (J.C. Schmidt) Fr., Syst. Orb. Veg. (Lundae) 1: 183. 1825.
= Trichothecium fuligineum Spreng., Linn. Syst. Veg. XVI 4(11): 552. 1827.
= Cladotrichum polysporum Corda, Sturm. Deutschl. Fl., 3 Abt. (Pilze Deutschl.) 3(12): 39. 1831.
= Gongylocladium atrum (Link) Wallr., Handb. Erk. Gew. 2: 160. 1833.
= Cladotrichum scyphophorum Corda, Pracht-Fl. Eur. Schimmelbild. 47. 1839.
= Cladotrichum uniseptatum Cooke, Grevillea 3(28): 182. 1875.
= Sphaeria phaeostromoides Peck, Ann. Rep. N.Y. St. Mus. nat. Hist. 28: 77. 1876.
= Chaetosphaeria phaeostromoides (Peck) Sacc., Syll. Fung. (Abellini) 2: 93. 1883.
= Cladotrichum nigrescens (Link) Sacc., Syll. fung. (Abellini) 4: 373. 1886.
= Cladotrichum didymum (J.C. Schmidt) Sacc., Syll. Fung. (Abellini) 4: 373. 1886.
= Cladotrichum cookei Sacc., Syll. Fung. 4: 370. 1886.
= Diplosporium scyphophorum (Corda) Kuntze, Rev. Gen. Plant. 1: 280. 1891.
= Diplosporium polysporum (Corda) Kuntze, Rev. Gen. Plant. 1: 208. 1891.
= Thaxteria fusca (Fuckel) C. Booth, Naturalist, London 866: 88. 1958.
= Oedemium didymum (J.C. Schmidt) S. Hughes, Can. J. Bot. 36: 790. 1958. TIPO: CANADÁ. Tipo no localizado.
Micelio sobre sustrato superficial e inmerso, filamentoso, marrón oscuro; hifas septadas ramificadas, marrones 4 µm de diámetro; conidióforos 4-5 µm de diámetro, marrón pálido a marrón oscuro, macronematosos, solitarios, erectos, septados, ramificados, nodosos; células conidiógenas esféricas, subesféricas, marrón pálido, integradas, terminales; conidios 10-12 × 3-5 µm, elipsoidales a ovoides, doliformes, marrones, formados en cadenas acrópetas, con 0 a 1 septo, constreñidos en el medio.
Hábito y hábitat: saprobio, desarrollándose en raíces zancudas de R. mangle.
Distribución: Canadá (Hughes y Hennebert, 1963), Alemania, Tailandia y Estados Unidos de América (Kodsueb et al., 2007). Se cita por primera vez para México.
Material estudiado: MÉXICO, Quintana Roo, municipio Cozumel, Punta sur, 20°16'48''N, 86°58'44''O, 24.IV.2019, Y. A. García 67 (ENCB).
Notas taxonómicas: esta especie se caracteriza por conidios en cadenas acrópetas, ovoides, constreñidos en el centro con 0 a 1 septo, marrones, 10-12 × 3-5 µm; cicatrices basales planas, discretas, en ocasiones sobresalen. Las cadenas de conidios se fragmentan fácilmente formando así un polvo negro en el sustrato.
Valsaceae
Cytospora rhizophorae Kohlm. & E. Kohlm., Mycologia 63(4): 847. 1971.
TIPO: GUATEMALA. Iztápa, boca del Río Maria Linda, sobre raíces muertas de R. mangle, 18.III. 1970, J. K. Nos 2693 (holotipo: NY).
Hábito y hábitat: lingícola, sobre ramas vivas de R. mangle.
Distribución: México, Liberia, Hawái, Estados Unidos de América, Guatemala (Kohlmeyer y Kolhmeyer, 1977) y Puerto Rico (Wier et al., 2000). En todas las citas de distribución se reporta asociada al genero Rhizophora L.
Material estudiado: MÉXICO. Quintana Roo, municipio Cozumel, Punta sur, 20°16'48''N, 86°58'44''O, 24.IV.2019, Y. A. García y M. A. Bravo 63c (ENCB); loc. cit., 15.X.2019, Y. A. García y M. A. Bravo 93 (ENCB).
Notas taxonómicas: esta especie se caracteriza por picnidios de 1 mm de diámetro, amarillos a naranjas, gregarios, superficiales, ampuliformes, multiloculares, con lóculos de largo 350-500 µm; ostiolo central; conidióforo cilíndrico, filiforme, hialino; conidios alantoides en ocasiones ligeramente curveados, verde a amarillos, 5-7 × 2-3 µm.
Hypoxylaceae
Hypoxylon subgilvum Berk. & Broome, J. Linn. Soc, Bot. 14(74): 120. 1873.
TIPO: SRI LANKA. Central Province, sobre corteza, XII.1868, G. H. K. Thwaite 1087 (holotipo: K).
= Hypoxylon caaguazu Speg., Anal. Soc. cient. argent. 18(6): 275. 1884. TIPO: PARAGUAY. Sobre madera muerta, I.1882, B. Balansa 3359-60 (isotipo: BPI).
= Hypoxylon hypomiltum var. microsporum Y. Abe, Trans. Mycol. Soc. Japan 27: 55. 1986. TIPO: JAPÓN. Kitakata, Hgashiusuki-gun, Miyazaki Pref., en corteza de Quercus acutissima, 29.IX.1976, K. Aoshima y M. Tsunoda TFM-F-12665 (holotipo: TFM).
Hábitat y hábito: saprobio lignícola, sobre ramas caídas de R. mangle.
Distribución: Estados Unidos de América (Vasilyeva et al., 2007), Tailandia (Vasilyeva et al., 2012), Brasil (Cruz y Cortez, 2015), Argentina (Sir et al., 2016), para México se ha registrado en Jalisco, Oaxaca, San Luis Potosí, Tamaulipas, Quintana Roo y Yucatán (Reyes et al., 2020).
Material estudiado: MÉXICO. Quintana Roo, municipio Cozumel, Punta sur, 20°16'48''N, 86°58'44''O, 25.IV.2019, Y. A. García y M. A. Bravo 54 (ENCB).
Notas taxonómicas: esta especie se caracteriza por un estroma efuso pulvinado, marrón con pigmentos anaranjados al contacto con KOH al 10%; ascas 90-150 × 4-7 µm, cilíndricas con poro apical amiloide; ascosporas 9-14 × 4-6 µm, elipsoides con extremos redondeados, marrón obscuro, inequilaterales, con línea germinal recta a lo largo de la misma, perisporio dehiscente en KOH al 10%, episporio liso.
Annulohypoxylon nitens (Ces.) Y.M. Ju, J. D. Rogers & H.M. Hsieh, Mycologia 97(4): 861. 2005.
= Rosellinia nitens Ces., Atti Accad. Sci. fis. mat. Napoli 5(21): 13. 1872.
= Hypoxylon chalybaeum Berk. & Broome, J. Linn. Soc., Bot. 14(74): 121. 1873.
= Hypoxylon chalybaeum var. congestum Ces., Atti Accad. Sci. fis. mat. Napoli 8(3): 17. 1879.
= Hypoxylon nitens (Ces.) Y.M. Ju & J.D. Rogers, Mycol. Mem. 20: 220. 1996. TIPO: Material tipo no localizado.
Hábito y hábitat: saprobio lignícola, sobre ramas caídas de R. mangle.
Distribución: ampliamente distribuido en los trópicos y subtrópicos de América, en México, Puerto Rico y Argentina (Hladki y Romero, 2009). El registro presentado en este estudio constituye el primero para el estado de Quintana Roo.
Material estudiado: MÉXICO. Quintana Roo, municipio Cozumel, Punta sur, 20°16'48''N, 86°58'44''O, 16.X.2019 Y. A. García y M. A. Bravo 71b (ENCB).
Notas taxonómicas: esta especies se caracteriza por un estroma glomerulado a efuso-pulvinado con pigmentos verdes oliváceo al contacto con KOH al 10%, ascas 80-120 × 4-6 µm, con poro apical amiloide, ascosporas 6-8 × 3-5 µm, elipsoides, marrón claro, inequilaterales, con extremos redondeados, línea germinal recta a lo largo de la misma, perisporio dehiscente en KOH al 10%, episporio globoso.
Xylariaceae
Halorosellinia oceanica (S. Schatz) Whalley, E.B.G. Jones, K.D. Hyde & Læssøe, Mycol. Res. 104(3): 370. 2000. Fig. 6.

Figura 6: Halorosellinia oceanica (S. Schatz) Whalley, E.B.G. Jones, K.D. Hyde y Læssøe: A. y B. estromas sobre rama de R. mangle; C. poro apical del asca con reaccion amiloide al reactivo de Melzer (azul); D. ascas; E. y F. ascosporas.
TIPO: ESTADOS UNIDOS DE AMÉRICA. Florida, J. B. Lloyd State Park, sobre Rhizophora mangle, 25.IV.1986, FLA-16 (tipo no localizado). BERMUDAS. Shelly Bay Beach, sobre ramas muesrtas de Tamarix gallica L. (Tamaricaceae), 13.V.1976, J. Kohlmeyer 3724 (paratipo: IMS).
= Hypoxylon oceanicum S. Schatz, Mycotaxon 33: 413. 1988.
Pseudoestroma 1 mm de diámetro, 2 mm de alto, pulvinado, negro, incrustado en la base, individual, en grupos de 20 a 30; ascoma 1-1.5 mm de diámetro, peritecioide, subgloboso, negro, inmerso en el pseudoestroma, con ostiolo papilado; peridio 25-30 µm de diámetro; parafisis 2 µm de diámetro, acerosas, abundantes, septadas; ascas 135-140 × 4-7 µm, cilíndricas, unitunicadas, con poro apical amiloide, octosporadas; ascosporas 18-20 × 8-12 µm, elipsoides, marrón obscuro, con extremos redondeados, inequilaterales, gutuladas, uniseriada a parcialmente biseriada en el asca, con perisporo dehiscente.
Hábito y hábitat: saprobio lignícola, sobre ramas caídas de R. mangle.
Distribución: ampliamente citado de manglares de Asia (Hyde, 1990b) y Australia (Hyde 1990a; Whalley et al., 2000). Se cita por primera vez para México.
Material estudiado: MÉXICO. Quintana Roo, municipio Cozumel, Punta sur, 20°16'00''N, 87°00'03''O, 24.IV.2019, Y. A. Garcia y M. A. Bravo 50 (ENCB).
Notas taxonómicas: esta especie se caracteriza por pseudoestromas pequeños carbonáceos de 1-2 mm, papilados, ascas de 135-140 × 4-7 µm, ascosporas de 18-20 × 8-12 µm, marrón obscuro, elipsoides.
Fomitopsidaceae
Rhodofomitopsis feei (Fr.) B.K. Cui, M.L. Han & Y.C. Dai, en Han, Chen, Shen, Song, Vlasák, Dai & Cui, Fungal Diversity 80: 366. 2016.
TIPO: AUSTRALIA. Darwin, Parque Bicentenario, sobre tocón de angiosperma, 6.VI.1999, P. Uotila 42928 (holotipo: H).
= Polyporus feei Fr., Linnaea 5: 518. 1830.
= Trametes marchionica Mont., en Dumont d’Urville, Voy. Pole Sud, Bot.1: 204. 1845.
= Polystictus feei (Fr.) Fr., Nova Acta R. Soc. Scient. upsal., Ser. 31(1): 83. 1851.
= Polyporus eucalypti Kalchbr., Grevillea 4(30): 73. 1875.
= Polyporus foedatus Berk., J. Linn. Soc., Bot. 16(89): 41. 1878.
= Polyporus eucalypticola F. Muell., Fragm. phytogr. Austr. 11: 84. 1881.
= Polystictus eucalypti (Kalchbr.) Cooke, Grevillea 14(71): 82. 1886.
= Trametes sagrana (Mont.) Sacc., Syll. fung. (Abellini) 6: 336. 1888.
= Microporus feei (Fr.) Kuntze, Revis. gen. pl. (Leipzig) 3(3): 496. 1898.
= Microporus eucalypti (Kalchbr.) Kuntze, Revis. gen. pl. (Leipzig) 3(3): 496. 1898.
= Trametes feei (Fr.) Pat., Essai Tax. Hyménomyc. (Lons-le-Saunier): 92. 1900.
= Fomes sagranus (Mont.) Murrill, N. Amer. Fl. (New York) 9(2): 96. 1908.
= Trametes eucalypti (Kalchbr.) Lloyd, Mycol. Writ. 6(59): 226. 1915.
= Trametes lilacinogilva var. eucalypti (Kalchbr.) Cleland & Cheel, J. Proc. R. Soc. N.S.W. 51: 506. 1917.
= Polystictus feei var. substipitatus Speg., Boln Soc. Cienc. Córdoba 28: 380. 1926.
= Trametes foedata (Berk.) G. Cunn., Proc. Linn. Soc. N.S.W. 75(3-4): 226. 1950.
= Fomes feei (Fr.) J. Lowe, Mycologia 47(2): 217. 1955.
= Fomitopsis feei (Fr.) Kreisel, Ciencias Biológicas, Cuba 16: 83. 1971.
= Trametes feei var. irpicoidea Corner, Beih. Nova Hedwigia 97: 101. 1989. TIPO: MALASIA. Malasia insular, sobre madera caída, C. Corner FN 28272 (no se menciona en que herbario fue depositado el tipo).
Hábito y hábitat: saprobio lignícola, sobre troncos caídos de R. mangle.
Distribución: es una especie considerada de amplia distribución en los trópicos de América y Asia (Han y Cui, 2015). En México se ha encontrado en el Área Natural Protegida Ajos-Bavispe en Sonora (Montaño et al., 2006), así como en la Huasteca Potosina (Álvarez, et al., 2016). Este corresponde al primer registro de la especie para el estado de Quintana Roo.
Material estudiado: MÉXICO. Quintana Roo, municipio Cozumel, Punta sur, 20°18'00''N, 87°00'14''O, 24.X.2019, T. Raymundo 8331 (ENCB).
Notas taxonómicas: esta especie se caracteriza por un basidioma efuso, marrón con margen negro, píleo plano a irregular, contexto marrón, sistema hifal trímitico y basidiosporas de 4-5 × 2-3 µm, elipsoides, hialinas, pared delgada y lisa.
Polyporaceae
Megasporoporia setulosa (Henn.) Rajchenb., Mycotaxon 16(1): 180. 1982.
≡ Poria setulosa Henn., Bot. Jb. 28(3): 321. 1900. TIPO: TANZANIA. Muapa, sobre Leguminosa, 6.XII.1895, J. Buchwald 22 (no se menciona en que herbario fue depositado el tipo).
= Elmerina setulosa (Henn.) Bres., Hedwigia 53(1-2): 71. 1912.
= Trametes subserpens Murrill, Mycologia 12(2): 108. 1920.
= Poria subserpens (Murrill) Weir, A pathological survey of the para rubber tree (Hevea brasiliensis) in the Amazon Valley: 91. 1926.
= Antrodia setulosa (Henn.) Ryvarden Norw. J. Bot. 19: 230. 1972.
= Grammothele setulosa (Henn.) Ryvarden, en Ryvarden & Johansen, Prelim. Polyp. Fl. E. Afr. (Oslo): 45. 1980.
= Dichomitus setulosus (Henn.) Masuka & Ryvarden, Mycol. Res. 103(9): 1130. 1999.
Hábito y hábitat: saprobio lignícola, sobre rama caída de R. mangle.
Distribución: esta especie ha sido citada sobre madera de angiospermas en Tailandia (Choeyklin et al., 2011), Indonesia, Este de África, Sudáfrica y Sudamérica (Ryvarden y Johansen, 1980; Ryvarden et al., 1982; Suhirman, 1998). En México ha sido reportada en bosques templados para los estados de Veracruz (Welden y Guzmán, 1978) y Tamaulipas (Valenzuela y Chacón-Jiménez, 1991), en bosque tropical en Guerrero (Salinas-Salgado et al., 2012) y bosque de Quercus (Álvarez et al., 2016). Este corresponde al primer registro de la especie para el estado de Quintana Roo.
Material estudiado: MÉXICO. Quintana Roo, municipio Cozumel, Punta sur, 20°18'00''N, 87°00'14''O, 24.V.2019, T. Raymundo 8330 (ENCB).
Notas taxonómicas: esta especie se caracteriza por un basidioma anual, resupinado, color crema cuando fresco, himenóforo formado por numerosos poros angulares a daedaliformes, sistema hifal trímitico y basidiosporas cilíndricas hialinas de pared delgada y lisa.
Pycnoporus sanguineus (L.) Murrill, Bull. Torrey Bot. Club 31(8): 421. 1904. TIPO: SURINAM. Localidad no mencionada, D. Rolander s.n. (holotipo: UPS).
≡ Boletus sanguineus L. Sp. pl., Edn 2 2(2): 1646. 1763.
= Polystictus sanguineus (L.) G. Mey.,Nova Acta R. Soc. Scient. upsal., Ser. 1: 75. 1818.
= Polyporus sanguineus (L.) Fr., Syst. mycol. (Lundae) 1: 371. 1821.
= Microporus sanguineus (L.) Pat., Essai Tax. Hyménomyc. (Lons-le-Saunier): 83. 1900.
= Trametes sanguinea (L.) Lloyd, Mycol. Writ. 7: 1291. 1924.
=Trametes cinnabarina var. sanguinea (L.) Pilát, Atlas Champ. Europe, III, Polyporaceae (Praha) 1: 319. 1939.
= Trametes sanguinea var. intermedia Corner, Beih. Nova Hedwigia 97: 154. 1989.
Hábito y hábitat: saprobio lignícola, sobre tronco caído de R. mangle.
Distribución: se distribuye en casi todos los ambientes naturales hasta en zonas urbanas (Papinutti, 2013). Ha sido reportada en ecosistemas de manglar en Bangladesh (Das y Aminuzzaman, 2017), así como en Brasil (Trierveiler-Pereira et al., 2009) y ha sido registrada para la isla de Cozumel por la CONABIO (2008).
Material estudiado: MÉXICO. Quintana Roo, municipio Cozumel, Punta sur, 20°18'00''N, 87°00'14''O, 24.V.2019, Y. A. García y M. A. Bravo 27 (ENCB).
Notas taxonómicas: esta especie se caracteriza por un basidioma en forma de abanico, sésil, color rojo-naranja brillante cuando fresco y anaranjado rojizo cuando seco, himenóforo poroide rojizo.
Dacrymycetaceae
Dacryopinax spathularia (Schwein.) G.W. Martin, Lloydia 11: 116. 1948.
TIPO: AUSTRALIA. Islas Adam, J. B. Cleland 841 (holotipo: BPI).
= Merulius spathularia Schwein., Schr. naturf. Ges. Leipzig 1: 92. 1822.
= Guepinia spathularia (Schwein.) Fr., Elench. fung. (Greifswald)2: 32. 1828.
= Masseeola spathulata (Schwein.) Kuntze, Revis. Gen. Pl. (Leipzig) 2: 859. 1891.
= Guepiniopsis spathularia (Schwein.) Pat., Essai Tax. Hyménomyc. (Lons-le-Saunier): 30. 1900.
= Guepinia agariciformis Lloyd, Ann. Univ. Stellenbosch, Reeks A 1(1): 4. 1923.
= Guepinia spathularia f. alba G.W. Martin, Proc. Iowa Acad. Sci. 50: 165. 1944.
Hábito y hábitat: saprobio lignícola, sobre tronco caído de R. mangle.
Distribución: es una especie con amplia distribución mundial (McNabb, 1965). En México ha sido reportada en Veracruz (Welden y Lemke, 1961), Ciudad de México (Lowy, 1965), Oaxaca (Guzmán, 1983), Sonora (Esqueda-Valle et al., 1995), Querétaro (Sierra, 2000), Tamaulipas (García-Jiménez y Valenzuela, 2005), Quintana Roo (Pompa-González et al., 2011), Guerrero (Salinas-Salgado et al., 2012), Campeche (Sierra et al., 2012) y Nayarit (Sierra et al., 2013).
Material estudiado: MÉXICO. Quintana Roo, municipio Cozumel, Punta sur, 20°18'00''N, 87°00'00''O, 24.X.2019, T. Raymundo 8329 (ENCB).
Notas taxonómicas: esta especie se caracteriza por un basidioma solitario o gregario, espatulado, naranja, con consistencia gelatinosa, naranja cuando fresco, píleo espatulado, himenio liso o plegado longitudinalmente, basidiosporas 8-10 × 3-5 µm, cilíndricas, ligeramente curvadas, septadas al madurar.
Discusión
Los hongos identificados en materiales vegetales de Rhizophora mangle, de la Reserva de la Biosfera Isla de Cozumel, se ubicaron principalmente dentro del Phylum Ascomycota, con 80% de las especies, lo que concuerda con todos los estudios realizados sobre la micobiota de los manglares en diferentes partes del mundo (Arfi et al., 2011). El número de especies de basidiomicetos encontrados es más bajo que en otros estudios llevados a cabo en poblaciones de R. mangle en Brasil (Nogueira-Melo et al., 2017), pero más alta que los desarrollados en Panamá (Gilbert y Sousa, 2002).
La alta riqueza encontrada coincide con otros estudios efectuados en manglares tropicales. Este fenómeno ha sido explicado por varios autores desde diferentes perspectivas. Hyde y Lee (1995) mencionan que la alta diversidad fúngica en los manglares tropicales está correlacionada positivamente con la alta riqueza vegetal que se desarrolla en los trópicos. Por otro lado, Jones y Alias (1997) lo atribuyen a la cantidad de sustrato disponible para ser colonizado. De acuerdo con Lacerda et al. (2002), R. mangle colonizó el continente americano, incluida la Isla de Cozumel, desde el Eoceno y no se han registrado perdidas totales de esta población en la zona de estudio, por lo que sus poblaciones se han mantenido desde esta época geológica,
Es de interés el estudio de hongos en poblaciones de R. mangle, debido a que estas se encuentran en zonas inundables y de mayor influencia salina, convirtiéndolas en una zona de transición (Lacerda et al., 2002), por lo que se podría observar el desarrollo de especies fúngicas marinas y terrestres. Sin embargo, en este estudio, la mayoría de las especies resultaron terrestres. De las muestras estudiadas en el presente trabajo, las únicas especies reportadas como marinas son: Halorosellinia oceanica (Alias y Jones, 2000) y Cytospora rhizophorae (Kolhmeyer y Kolhmeyer, 1977; Wier et al., 2000), y como marina falcultativa: Pseudocamarosporium propinquum (Wijayawardene et al., 2014). El resto de las especies son típicamente terrestres, las cuales probablemente han adquirido adaptaciones para soportar las condiciones ambientales características de los ecosistemas de manglar, como alta concentración de sales, anegamiento, condiciones anaeróbicas del suelo, cambios de mareas, cambios en el nivel de mar y alta exposición solar y a vientos (Rai y Chowdhery, 1978). Cabe señalar que dentro de estas adaptaciones se han reportado la producción de proteínas de resistencia al choque térmico, síntesis de macromoléculas, mecanismos de tolerancia a la salinidad y la alta melanización de sus esporocarpos (Sosa-Rodríguez et al., 2009).
Las especies anteriormente reportadas sobre R. mangle y encontradas en este estudio son: Arthonia antillarum (Mercado-Díaz et al., 2015), Cytospora rhizophorae (Wier et al., 2000), Halorosellinia oceanica (Schatz, 1988; Whalleyet al., 2000), Pycnoporus sanguineus (Trierveiler-Pereira et al., 2009) y Pyrenula cerina (Marcelli, 1987; Mercado-Díaz et al., 2015). El resto de las especies son nuevos registros en asociación con R. mangle.
Del material estudiado, las especies mas abundantes fueron Phyllosticta capitalensis y Pyrenula cerina con seis y cuatro registros, respectivamente, mientras que las demás (Cuadro 1) especies presentaron entre uno y dos registros. Los sustratos que se hallaron colonizados por hongos fueron ramas vivas y muertas, raíces, troncos caídos y hojarasca. Todas las especies se localizaron solo en un tipo de sustrato, por lo que entre sustratos no comparten las especies (Cuadro 1). Los sustratos mejor colonizados fueron las ramas, vivas, muertas y caídas, seguido de hojarasca, troncos caídos y por último raíces. Sarma y Vittal (2000) obtuvieron resultados similares, ya que encontraron mayor riqueza de especies sobre madera caída que en sedimentos y raíces de R. apiculata y Sridhar (2009) en R. mucronata en India.
Cuadro 1: Número de registros de hongos en diferentes sustratos de Rhizophora mangle L. en la Reserva de la Biosfera Isla de Cozumel, Quintana Roo, México.
| Especie | Rama viva | Rama muerta | Rama caída | Tronco caído | Raíz | Hojarasca |
| Alyxoria varia (Pers.) Ertz & Tehler | 1 | |||||
| Annulohypoxylon nitens (Ces.) Y.M. Ju, J.D. Rogers & H.M. Hsieh | 1 | |||||
| Arthonia antillarum (Fée) Nyl. | 1 | |||||
| Arthonia conferta (Fée). Nyl. | 1 | |||||
| Naevia pinastri (Anzi) Thiyagaraja., Lücking & K.D. Hyde | 2 | |||||
| Bactrospora denticulata (Vain.) Egea & Torrente | 1 | |||||
| Pseudocamarosporium propinquum (Sacc.) Wijayaw., Camporesi & K.D. Hyde | 1 | |||||
| Coniocarpon cinnabarinum DC. | 1 | |||||
| Cytospora rhizophorae Kohlm. & E. Kohlm | 1 | |||||
| Dacryopinax spathularia (Schwein.) G.W. Martin | 1 | |||||
| Dimidiographa graphidiza (Nyl.) Ertz & Tehler | 2 | |||||
| Halorosellinia oceanica (S. Schatz) Whalley, E.B.G. Jones, K.D. Hyde & Læssøe | 1 | |||||
| Hypoxylon subgilvum Berk. & Broome | 1 | |||||
| Megasporoporia setulosa (Henn.) Rajchenb | 1 | |||||
| Chaetosphaerella fusca (Fuckel) E. Müll & C. Booth | 1 | |||||
| Patellaria atrata Hedw.) Fr. | 1 | |||||
| Phyllosticta capitalensis Henn. | 5 | |||||
| Pycnoporus sanguineus (L.) Murrill | 1 | |||||
| Pyrenula cerina Eschw. | 4 | |||||
| Rhodofomitopsis feei (Fr.) B.K. Cui, M.L. Han &Y.C. Dai | 1 | |||||
| TOTAL | 12 | 2 | 6 | 3 | 1 | 5 |
La menor colonización en las raíces puede deberse a que no son un sustrato muy favorable de colonizar, ya que están expuestas a constantes cambios de mareas, además a la alta salinidad, ya que las raíces son el órgano donde se acumula y excreta la sal en el género Rhizophora (Gilbert et al., 2002). Por su parte, en la hojarasca solo se encontró la especie Phyllosticta capitalensis, lo cual se podría explicar debido a que las especies desarrolladas en este sustrato suelen ser microscópicas (Sridhar, 2009). Por lo tanto, no fueron detectadas mediante la metodología empleada, ya que en diferentes estudios se ha demostrado que en este sustrato se desarrolla gran diversidad de especies microscópicas (Jia-Long et al., 2016). Debido a que ninguna de las especies se encontró en dos o más tipos de sustratos, es factible suponer que existe una preferencia por el tipo de sustrato que colonizan los hongos estudiados, situación que ha sido señalada por Sarma y Vittal (2000), en estudios sobre hongos en manglares. Por otro lado, los hongos liquenizados se desarrollaron en cortezas de ramas vivas, siendo los de forma de vida crustácea los mejor representados coincidiendo con lo reportado por otros trabajos para R. mangle (Marcelli, 1987).
Los hábitos encontrados fueron: cortícolas liquenizados (35%), saprobios lignícolas (55%), folícolas (5%) y parásitos (5%). La mayoría de las especies presentaron un hábito saprobio lignícola; esto puede deberse al abundante material vegetal en descomposición que se genera en estos ecosistemas. Además, al ser en su mayoría especies terrestres, no suelen tolerar la alta salinidad, protegiendo así el micelio en el duramen, solo formando las estructuras de reproducción al exterior (Hyde y Lee, 1995). El segundo lugar de riqueza y abundancia lo presentaron los líquenes epífitos; este grupo no ha sido muy estudiado en manglares, a pesar de que se ha demostrado que presentan una alta riqueza en estos ecosistemas (Marcelli, 1987; Nayaka et al., 2013; Reynolds et al., 2017). La única especie parásita encontrada corresponde a Cytospora rhizophorae, la cual se ha reportado como causante de mortalidad en comunidades de R. mangle en Puerto Rico (Tattar et al., 1994; Wier et al., 2000). En este estudio se registró una abundancia muy baja de dicha especie.
Conclusiones
La comunidad de hongos asociados a R. mangle en la Reserva de la Biosfera de la Isla de Cozumel encontrada en este estudio está dominada por ascomicetos; las clases mejor representadas fueron Arthoniomycetes y Sordariomycetes. El nicho principal de los hongos encontrados en las poblaciones de R. mangle fue saprobio, en particular lignícola. Los hongos presentraron especificidad hacia los sustratos colonizados. Con el presente estudio se eleva el número de especies fúngicas asociadas al mangle rojo en México de 13 a 33, por lo que aún deben realizarse más estudios con diferentes metodologías, para poder abarcar una mejor panorámica de la riqueza específica asociada a diferentes nichos por las comunidades de R. mangle en la Reserva de la Biosfera de la Isla de Cozumel.











 nueva página del texto (beta)
nueva página del texto (beta)