Introducción
Diversos estudios micobióticos se han realizado en los últimos 30 años en Jalisco, México. Sobresalen los de Nieves (1985), Téllez et al. (1988), Vázquez-González y Guzmán-Dávalos (1988), Rodríguez et al. (1994, 2010b, 2018), Fierros et al. (2000), Oliva-León (2000), Arroyo (2001), Herrera-Fonseca et al. (2002), Arceo-Orozco (2011), Gándara-Zamorano et al. (2014), Padilla-Velarde et al. (2016) y Terríquez-Villanueva et al. (2017). Particularmente en el Complejo Volcánico de Colima (CVC), zona que forma parte del Eje Volcánico Transversal Mexicano, reconocida por su alta riqueza, endemismos bióticos y porque constituye un área importante de especiación de organismos, sobresalen los trabajos de Fa y Morales (1993), Flores-Villela (1993), Ceballos et al. (1998), Espinosa et al. (2000) y Segura-Trujillo y Navarro-Pérez (2010).
Por su ubicación geográfica, el CVC se encuentra situado en un extremo de la zona de transición entre dos regiones biogeográficas como son la Neártica y la Neotropical, en donde es posible observar desde selvas tropicales a bosques templados y zonas semiáridas, así como la presencia de comunidades bióticas únicas como el bosque mesófilo de montaña (Rzedowski, 1978; Cox, 2001). Respecto a estudios previos sobre diversidad fúngica en el área del CVC, solo se contaba con la cita de 140 taxones registrados de los municipios que lo comprenden, recopilados la mayor parte por Sánchez-Jácome y Guzmán-Dávalos (2011) y de otros trabajos consultados como los de Bautista-Hernández et al. (2011), Landeros y Guzmán-Dávalos (2013) y Rodríguez et al. (2009, 2010a, 2013).
Con base en lo anterior, y por ser reconocido el Complejo Volcán Nevado de Colima como una zona de alta diversidad biológica, se considera relevante este estudio porque permite conocer la micobiota de esta región, la distribución geográfica de sus especies, sus aspectos ecológicos e importancia.
Materiales y Métodos
Área de estudio
El Complejo Volcánico de Colima (CVC) forma parte del Eje Volcánico Transversal Mexicano (Fig. 1), se localiza entre los estados de Jalisco y Colima, en las coordenadas geográficas 19°40'45"N, 103°49'16"O y 19°22'48"N, 103°25'32"O, con una superficie total de 843.13 km2 (Magaña-Martínez y Palacios-Vargas, 2010; Segura-Trujillo y Navarro-Pérez, 2010). Dicho complejo está constituido por tres cumbres volcánicas: el Nevado de Colima (4270 m s.n.m.), el Volcán de Fuego (3860 m s.n.m.) y el Volcán del Cántaro (2900 m s.n.m.) (SEMARNAT-CONANP, 2007). El CVC comprende seis municipios del estado de Jalisco: San Gabriel (Venustiano Carranza), Tonila, Tuxpan, Zapotiltic, Zapotitlán de Vadillo y Zapotlán el Grande (Ciudad Guzmán) y dos del estado de Colima: Comala y Cuauhtémoc (SEMARNAT-CONANP, 2007).
El complejo se localiza en un extremo de la zona de transición biogeográfica en la que es posible observar bosque tropical caducifolio y subcaducifolio, bosque mesófilo de montaña (principalmente en cañadas), bosque de Pinus-Quercus, bosque de Pinus hartwegii y bosque de Abies (Rzedowski, 1978; Jardel et al., 2014). La flora presenta cinturones de vegetación que cambian a través de un gradiente de altitud que va desde 1200 m hasta poco más de 4000 m. El clima puede variar desde cálido y subhúmedo en las partes bajas, hasta frío subhúmedo en alta montaña, variación que está dada en función de su gradiente altitudinal y orientación geográfica (Segura-Trujillo y Navarro-Pérez, 2010). Los datos de precipitación media anual que se tienen dentro de los municipios que conforman el Complejo Volcánico de Colima, oscilan entre 700 y 800 mm3 con régimen de lluvias de junio a octubre (INIFAP, 2019).
Recolección y determinación de material fúngico
Se efectuaron diversas exploraciones a campo, al menos una por semana, durante el periodo de lluvias en los meses de junio a octubre entre 2011 y 2018; época de esporulación de la mayoría de los macromicetos considerados en este estudio.
Todo el material colectado fue herborizado y depositado en la Colección Micológica del Herbario IBUG de la Universidad de Guadalajara. Los ejemplares se determinaron a través del estudio de sus características macro y microscópicas basadas en el concepto de morfoespecie. Para el estudio micromorfológico se realizaron cortes del esporoma siguiendo las técnicas empleadas en micología propuestas por Largent et al. (1977) y Vellinga (1998). Los especímenes fueron estudiados con un microscopio óptico (Zeiss K-7, Jena, Alemania). Dentro de algunas de las estructuras microscópicas con valor diagnóstico, están el tamaño y forma de las esporas, la cual, a partir de su medición, se obtiene el coeficiente Q=largo/ancho cuyo intérvalo indica la forma básica de las esporas. Para la toma de las fotografías de los caracteres microscópicos se utilizó un microscopio óptico (Zeiss Axioskop 40, Jena, Alemania), cámara (AxioCam MRc, Zeiss, Jena, Alemania) y software Axio Vision 4 (Carl Zeiss Microscopy, 2020).
Aunado a lo anterior, se efectuó el estudio microscópico de ejemplares que estaban identificados como afínes, con el propósito de incrementar el número de registros y/o especies.
La determinación de las especies se realizó con base en la revisión de diversas obras y claves dicotómicas (Guzmán, 1977; Pegler, 1977, 1983, 1986; Breitenbach y Kränzlin, 1984, 1986, 1991, 1995, 2000; Pegler et al., 1995; Calonge, 1998; Kränzlin, 2005) y literatura especializada para cada grupo (Smith y Thiers, 1964; García-Jiménez y Castillo, 1981; Santiago et al., 1984; Gilberson y Ryvarden, 1986, 1987; Phillips, 1991, 2006; Vázquez-González y Guzmán-Dávalos, 1991; Valenzuela et al., 1994; García-Jiménez, 1999; Nuñez y Ryvarden, 2001; Rodríguez y Guzmán-Dávalos, 2001; Gándara-Zamorano y Ramírez-Cruz, 2005; Sánchez-Jácome y Guzmán-Dávalos, 2005; Groposo et al., 2007; Esqueda-Valle et al., 2009, 2011; Camacho-Sánchez, 2010; Raymundo et al., 2013a, b; Rodríguez, 2013; Montañez et al., 2016).
Revisión de herbario y bibliografía
Se revisó la colección micológica IBUG con el objetivo de incluir material no citado previamente en la literatura y confirmar la validación de los registros históricos con el fin de evitar sinonimias. Con base en el trabajo de Sánchez-Jácome y Guzmán-Dávalos (2011) y revisión bibliográfica, se logró obtener la referencia completa de algunas especies citadas para dicha zona, la cual se menciona en el Apéndice 1.
Listado de especies
El listado actualizado de hongos se realizó con base en los ejemplares de las colecciones antes mencionadas, la revisión del material de herbario, la corroboración de algunas especies erróneamente identificadas de acuerdo con la base de datos pública digital de la Comisión Nacional para el Conocimiento y Uso de la Biodiversidad (CONABIO) (Guzmán-Dávalos, 2003), y de los taxa que previamente se tenían citados en la bibliografía del área de estudio.
El orden taxonómico de las especies se siguió de acuerdo con Wijayawardene et al. (2018), He et al. (2019), Index Fungorum (2019) y MycoBank (2019); consultándose estos últimos también para la validación de los taxones determinados, los nombres de autores y sinonimias. En la lista de especies (Apéndice 1) se incluye el nombre abreviado del colector, su número de colección, tipo de vegetación, localidad, hábitat e importancia.
En dicho listado, además de las especies estudiadas y corroboradas en este trabajo, se incluyen los taxones citados en la bibliografía y en el que la mayoría de los casos no se cuentan con el ejemplar y/o datos completos (o precisos) del material. La información sobre el uso de los hongos se obtuvo de la consulta bibliográfica de diversas obras (Guzmán, 1994, 2004, 2008; Hall et al., 2003; Pérez-Moreno et al., 2008; Shepard et al., 2008; Bautista-González y Moreno-Fuentes, 2014; Garibay-Orijel y Ruan-Soto, 2014). Se aporta la lista de colectores con su respectiva abreviatura (Apéndice 2) con un total de 136 registrados. Se incluye un listado de localidades de los municipios de ambos estados, Jalisco y Colima, que comprenden el CVC (Cuadro 1).
Cuadro 1: Lista de localidades en la que fueron colectados los ejemplares estudiados. BMM=bosque mesófilo de montaña; BP=bosque de Pinus; BPA=bosque de Pinus con Abies; BPE=bosque de Pinus-Quercus; BTC=bosque tropical caducifolio; BTSC=bosque tropical subcaducifolio; CM=cultivo de maíz; R.M.O.=Repetidora de Microondas; SD=sin datos.
| Estado | Municipio | Localidad | Vegetación |
|---|---|---|---|
| Jalisco | Zapotlán el Grande | 1) 100m-3 km del crucero, El Floripondio camino a Las Víboras, Las Antenas, R.M.O. | BPE |
| 2) km 4-5 del crucero, El Floripondio camino a Las Víboras, Las Antenas, R.M.O. | BPE | ||
| 3) km 6-7 del crucero, El Floripondio camino a Las Víboras, Las Antenas, R.M.O. | BPE | ||
| 4) km 8-9 del crucero, El Floripondio camino a Las Víboras, Las Antenas, R.M.O. | BP | ||
| 5) km 5.5-6.5 camino hacia el Refugio La Joya, Parque Nacional Volcán Nevado de Colima. | BPE | ||
| 6) km 28 Refugio la Joya, Volcán Nevado de Colima. | BPA | ||
| 7) Entre El Leoncito y Los Depósitos, Volcán Nevado de Colima. | BP | ||
| 8) km 11.5 brecha El Fresnito, Antenas del Canal 13, Volcán Nevado de Colima. | BPE | ||
| 9) km 14 brecha El Fresnito, Antenas del Canal 13, Volcán Nevado de Colima. | BPE | ||
| 10) Parque los Ocotillos, Ciudad Guzmán. | BTC | ||
| 11) Camino de Ciudad Guzmán a San Andrés Ixtlán. | BPE | ||
| 12) Sin localidad precisa. | SD | ||
| Zapotitlán de Vadillo | 13) Predio Los Corralitos. | BMM | |
| 14) Predio El Borbollón. | BMM | ||
| 15) Camino al Volcán Nevado de Colima, ladera N. | BMM | ||
| 16) km 4.7 de la brecha El Milanés, Volcán Nevado de Colima. | BPE | ||
| 17) Poblado San José del Carmen. | BMM | ||
| 18) km 4 después del poblado de Telcruz, Predio La Colmena. | BPE | ||
| 19) km 7-11 después del poblado de Telcruz, Predio La Colmena. | BPE | ||
| 20) Sin localidad precisa. | SD | ||
| Zapotiltic | 21) Poblado El Rincón, km 1 camino al cerro El Calaque. | BTC | |
| Tuxpan | 22) Cerro de Los Puercos. | BPE | |
| 23) km 2 al S del poblado de Tuxpan. | BPE | ||
| 24) Borde del Río Tuxpan. | BTSC | ||
| 25) La Higuera. | CM | ||
| Tonila | 26) Volcán de Fuego ladera E, camino al poblado de Atenquique. | BPE | |
| 27) Sin localidad precisa. | SD | ||
| San Gabriel | 28) 200 m-2 km sobre la brecha, Cerro Las Víboras, Puerto El Floripondio. | BPE | |
| 29) km 15 después de La Media Luna, Volcán Nevado de Colima. | BPE | ||
| 30) Poblado El Apango, km 20 de la carretera Sayula-San Gabriel. | BPE | ||
| 31) km 3 sobre la brecha que cruza el poblado de Apango. | BPE | ||
| 32) Alrededores del poblado de San Gabriel. | BPE | ||
| 33) Poblado La Mesa, 11 km al S de San Gabriel. | BPE | ||
| 34) km 3 antes del poblado La Cañada, carretera Sayula-San Gabriel. | BP | ||
| 35) km 8 del crucero de La Yerbabuena-San Gabriel, carretera Tapalpa-San Gabriel. | BPE | ||
| 36) Sin localidad precisa. | SD | ||
| Colima | Comala | 37) 500 m-1 km antes del poblado La Yerbabuena, camino a la Laguna María. | BMM |
| 38) Alrededores de la Laguna María. | BMM | ||
| 39) km 1 camino La Becerra-La Yerbabuena, alrededores de la Laguna María. | BTC | ||
| 40) km 9.5 después del poblado Campo Cuatro, camino hacia Lagunillas. | BPE | ||
| 41) Cultivo de café, cercano a la carretera Comala-Colima. | BTSC | ||
| 42) Laguna La María, ex hacienda de San Antonio. | BTC |
Para conocer el estado de riesgo de las especies o su estado de conservación se consultaron los documentos sobre normas y criterios nacionales e internacionales como la Unión Internacional para la Conservación de la Naturaleza (UICN, 2020) y la Norma Oficial Mexicana NOM-059-SEMARNAT-2020 (SEMARNAT, 2020). Toda la información obtenida fue agrupada y depurada en bases de datos diseñadas para éste y otros proyectos posteriores en formato Microsoft Excel® 2016.
Resultados
Con base en el material colectado durante los años 2011-2018 que suman 1542, así como los 400 especímenes del herbario revisados y 140 de la bibliografía consultada, se tiene un total de 2082 ejemplares que fueron determinados hasta especie, lo que corresponde a 408 taxones. De estos, 48 se incluyen en la división Ascomycota y 360 en Basidiomycota; se encuentran incluidos en 204 géneros distribuidos en 84 familias. En cuanto al número de órdenes registrados, en Basidiomycota se adscriben 17 y cinco para Ascomycota. Los órdenes con mayor riqueza en especies de Basidiomycota fueron los Agaricales con 164 taxones, seguido por Polyporales (60), Boletales (43), Russulales (29) e Hymenochaetales (16). Las familias mejor representadas de Ascomycota y Basidiomycota, por el número de taxones y los géneros más ricos en especies, se incluyen en el Cuadro 2.
Cuadro 2: Riqueza de grupos taxonómicos registrados para el Complejo Volcánico de Colima, México.
| División | Órdenes | Familias | Géneros | Taxa |
|---|---|---|---|---|
| Ascomycota | Helotiales | 2 | 2 | 2 |
| Hypocreales | 3 | 4 | 7 | |
| Leotiales | 2 | 2 | 2 | |
| Pezizales | 7 | 16 | 29 | |
| Basidiomycota | Xylariales | 2 | 3 | 8 |
| Agaricales | 22 | 68 | 164 | |
| Auriculariales | 2 | 3 | 5 | |
| Boletales | 9 | 22 | 43 | |
| Cantharellales | 3 | 5 | 8 | |
| Dacrymycetales | 1 | 3 | 5 | |
| Geastrales | 1 | 1 | 6 | |
| Gloeophyllales | 1 | 1 | 3 | |
| Gomphales | 2 | 3 | 6 | |
| Hymenochaetales | 2 | 7 | 16 | |
| Phallales | 1 | 1 | 1 | |
| Polyporales | 10 | 39 | 60 | |
| Pucciniales | 2 | 3 | 3 | |
| Russulales | 7 | 13 | 29 | |
| Sebacinales | 1 | 2 | 3 | |
| Thelephorales | 2 | 4 | 5 | |
| Tremellales | 1 | 1 | 2 | |
| Ustilaginales | 1 | 1 | 1 | |
| Total | 22 | 84 | 204 | 408 |
Se encontraron dos registros nuevos para México, Ductifera exidioidea Lowy y Psathyrella longistriata (Murrill) A.H. Sm., 11 para la micobiota del estado de Jalisco, Bulgaria inquinans (Pers.) Fr., Crepidotus applanatus (Pers.) P. Kumm., Gymnopilus sapineus (Fr.) Murrill, Hohenbuehelia spathulata (Pers.) Singer, Hygrocybe spadicea (Scop.) P. Karst., Inocybe obsoleta (Quadr. & Lunghini) Valade, Lepiota cristata (Bolton) P. Kumm., Pholiota lubrica (Pers.) Singer, Rhizina undulata Fr., Scleroderma aff. pseudostipitatum Petch y Trichoderma alutaceum Jacklitsch y 20 especies como nuevos registros para Colima, de los cuales no se incluye su descripción dado que son muy conocidas, pero que hasta ahora no habían sido mencionadas.
La mayoría de los ejemplares incluidos en este estudio fueron colectados de Comala, Colima. Sin embargo, del municipio Cuauhtémoc, Colima, que también forma parte del CVC, nada se tiene reportado en la bibliografía consultada. Poco se conoce de la micobiota de Colima, hasta ahora 77 especies se tienen citadas, aunque sin dar localidades precisas (López-Ramírez y Medel, 2016), por lo que resultan importantes los nuevos registros aquí aportados, ya que se incrementará el conocimiento de la diversidad fúngica para esta entidad.
Cabe mencionar que del total de los 408 taxa determinados, 183 son exclusivamente registros nuevos para la zona, 140 habían sido previamente citados y 85 se citan por primera vez para algunos municipios, los cuales son señalados en el Apéndice 1. Los 183 taxones antes mencionados se encuentran distribuidos dentro de los municipios que conforman el CVC, siendo Zapotlán el Grande (114) y San Gabriel (27) los que reportan un mayor número de especies para Jalisco, y cinco registros del estado de Colima del municipio Comala. Los taxa que se encontraron con mayor frecuencia y que fueron recolectados en más de cinco localidades fueron Auricularia nigricans (Sw.) Birkebak, Looney & Sánchez-García, Lentinus tricholoma (Mont.) Zmitr., Schizophyllum commune Fr., Stereum ostrea (Blume & T. Nees) Fr. y Trametes villosa (Sw.) Kreisel.
De acuerdo con los resultados, la diversidad fúngica registrada en la zona presentó una amplia distribución en los diferentes tipos de vegetación, siendo el bosque de Pinus-Quercus (BPE) el mejor representado con 363 taxones, seguido del bosque mesófilo de montaña (BMM) con 65, bosque de Pinus con elementos de Abies (BPA) con 50 y el bosque de Pinus (BP) con 45; mientras que en el bosque tropical caducifolio (BTC) y subcaducifolio (BTSC) se registraron 17 y cinco respectivamente, siendo estas dos últimas comunidades vegetales poco exploradas en el CVC.
Los resultados anteriores muestran que la mayor riqueza de especies fúngicas encontradas en el BPE se ha debido precisamente al sesgo en la recolección, situación algo similar a lo señalado en otros estudios (ej. Cifuentes et al., 1990; Fierros y Guzmán-Dávalos, 1995; Herrera-Fonseca et al., 2002; Gándara-Zamorano et al., 2014), por citar algunos. Lo anterior quizás se deba a la afinidad de las especies por determinado tipo de vegetación; esto tiene similitud con lo mencionado por Fierros et al. (2000), quienes señalan que cada comunidad vegetal puede presentar una micobiota característica, sumado al esfuerzo o intensidad de muestreo realizado.
De acuerdo con el Apéndice 1, se presenta el número de especies exclusivas de los principales tipos de sustrato, la mayoría de ellas son terrícolas (182 spp., 44.60%), lignícolas (161, 39.46%), humícolas (26, 6.37%), fimícolas (11, 2.68%) y fungícolas (7, 1.71%). De las 182 especies terrícolas el mayor número registrado se adscribe al BPE con 112 y el de menor cantidad al BMM con tres. Respecto a las especies lignícolas, en general estas fueron recolectadas en BPE, con un número de 74, mientras que en BMM y BPA se reportan siete y cuatro taxones, respectivamente; en tanto que en el BP y BTC se encontraron solo tres en cada uno de ellos.
Dentro de las especies humícolas, 18 son registradas del BPE, en tanto que en BMM y BP se presentan cinco. Los taxones mejor representados son Gymnopus dryophilus (Bull.) Murrill, G. polyphyllus (Peck) Halling y Lepista nuda (Bull.) Cooke. Respecto a los hongos fímícolas, se registran siete taxones de BPE, y solo uno en BPA.
En cuanto a la importancia y uso de los hongos macroscópicos enlistados en el Apéndice 1, cabe destacar que 122 taxones son micorrizógenos, lo que representa 29.90% del total de especies registradas. Es importante mencionar que este tipo de asociación simbiótica micorrícica es más común en bosques templados que en tropicales en donde también puede presentarse, aunque de forma más escasa, quizás debido a las condiciones o factores medio ambientales (humedad y temperatura principalmente) y las especies de árboles presentes que sean susceptibles de micorrizarse (Guzmán-Dávalos y Guzmán, 1979; Janos, 1983).
Se registra un total de 127 hongos comestibles silvestres, entre ellos, Helvella crispa (Scop.) Fr., Hygrophoropsis aurantiaca (Wulfen) Maire, Hydnum repandum L., Laccaria laccata (Scop.) Cooke, Gymnopus dryophilus y Schizophyllum commune; estos dos últimos encontrados de forma frecuente en el área de estudio. La mayor riqueza de hongos comestibles se reporta para BPE con 118 especies (28.92%), seguido del BMM con 23 (5.63%) y 15 (3.67%) en BP y BPA.
Asimismo, se citan 40 especies consideradas como venenosas, desde aquellas que causan ciertos problemas gastrointestinales hasta las venenosas mortales (Ramírez-Terrazo et al., 2014). Algunos de los taxones registrados para el CVC son Amanita gemmata (Fr.) Bertill, A. magnivelaris Peck, A. muscaria (L.) Lam., Chlorophyllum molybdites (G. Mey.) Massee, Hypholoma fasciculare (Huds.) P. Kumm., Inocybe geophylla (Bull.) P. Kumm., Lactarius torminosus (Schaeff.) Gray, Russula foetens Pers., Scleroderma areolatum Ehrenb. y S. texense Berk. Todos estos son micorrizógenos, a excepción de C. molybdites e H. fasciculare que son especies terrícola y lignícola, respectivamente. Dentro del grupo de los hongos medicinales se citan 82 taxones, entre los que se encuentran Ganoderma lobatum (Cooke) G.F. Atk., Phlebia tremellosa (Schrad.) Nakasone & Burds., Schizophyllum commune, Trametes versicolor (L.) Lloyd y Tremella mesenterica Retz., todos ellos lignícolas. Referente a las especies parásitas, un total de 12 se registran, de las cuales cabe destacar a Heterobasidion annosum (Fr.) Bref. y Fomitopsis pinicola (Sw.) P. Karst. como hongos xilófagos causantes de enfermedades forestales (Ruiz Rodríguez y Pinzón-Picaseño, 1994; Cibrián-Tovar et al., 2007; Romero-Bautista et al., 2010).
A continuación, se presenta la descripción de los nuevos registros para Jalisco y México señalados con ** y • respectivamente, cuya simbología fue representada en el Apéndice 1. Por último, se incluyen láminas de imágenes, una de ellas con algunas de las especies colectadas (Fig. 2) y otra, con fotografías de basidiomas y estructuras microscópicas de los taxones Ductifera exidioidea y Psathyrella longistriata, citados por primera vez para el país (Fig. 3).

Figura 2: Cuerpos fructíferos de algunas especies de Ascomycota y Basidiomycota registradas dentro del Complejo Volcánico de Colima, México. A. Cordyceps militaris (L.) Fr.; B. Amanita muscaria (L.) Lam.; C. Montagnea arenaria (DC.) Zeller; D. Xeromphalina campanella (Batsch) Kühner & Maire; E. Omphalotus mexicanus Guzmán & V. Mora; F. Humaria hemisphaerica (F.H. Wigg.) Fuckel. Fotos: C. Torres-Preciado, D. Figueroa-García y D. Ulloa-Olmos.
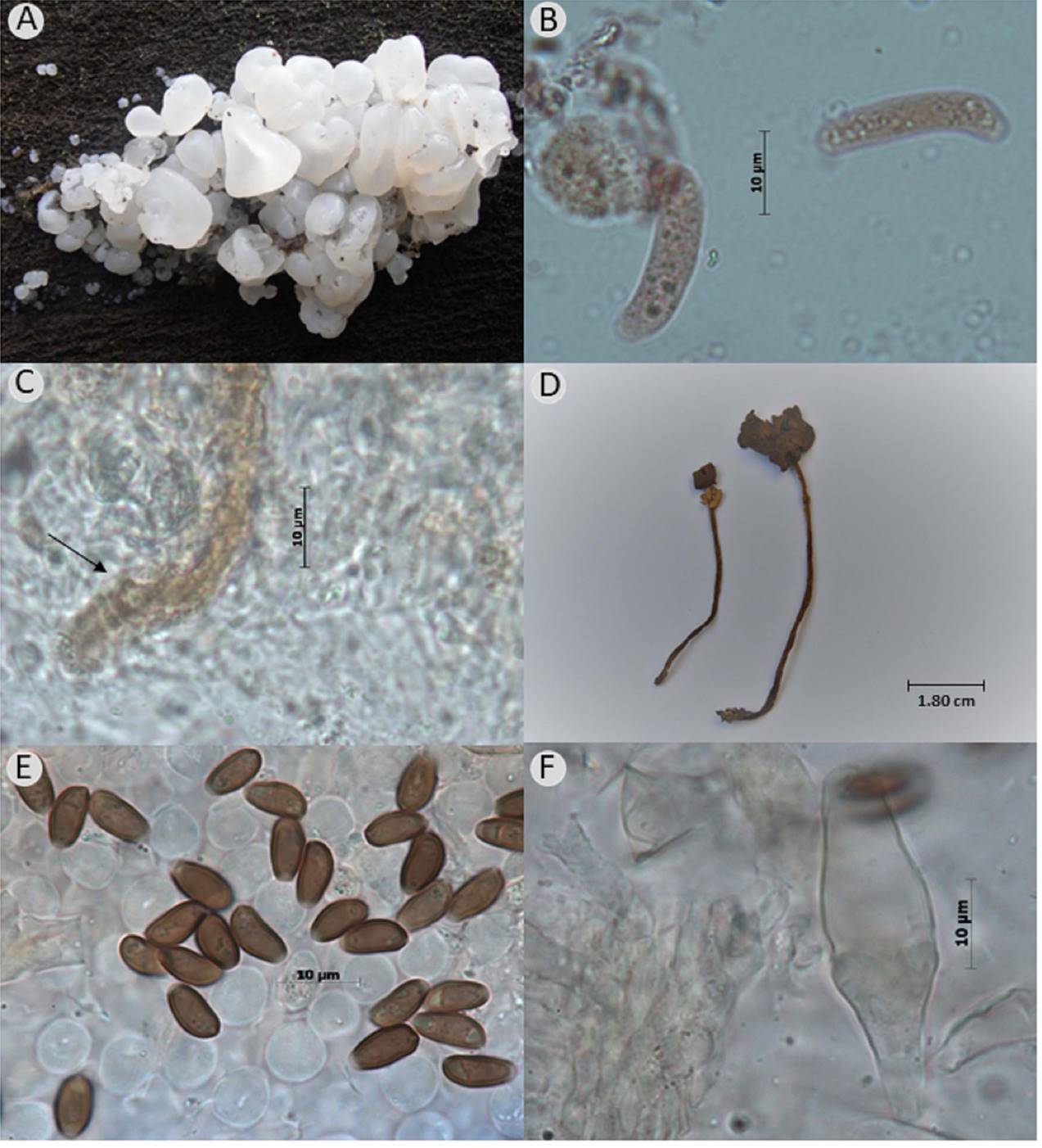
Figura 3: A. Ductifera exidioidea Lowy (C. Torres-Preciado 471, IBUG); B. esporas alantoides con ápice truncado; C. gleocistidio claviforme con ápice obtuso; D. basidiomas secos de Psathyrella longistriata (Murrill) A.H. Sm. (G. Nieves 276, IBUG); E. esporas elongadas con poro germinal hialino; F. pleurocistidios subutriforme. Fotos: C. Torres-Preciado, M. Herrera-Fonseca y D. Figueroa-García.
Ascomycota
Leotiomycetes
Leotiales
Bulgariaceae
** Bulgaria inquinans (Pers.) Fr., Syst. mycol. 2(1): 167. 1822. TIPO: encontrado sobre madera muerta de Quercus y Fagus (Espécimen tipo no designado, ni se menciona en cual herbario se depositó).
= Peziza polymorpha Oeder, Fl. dan.: t. 464. 1769.
≡ Peziza inquinans Pers., Neues Magazin für die Botanik 1: 113. 1794.
≡ Ascobolus inquinans (Pers.) Nees, System der Pilze und Schwämme: 268, t. 39: 296. 1817.
≡ Phaeobulgaria inquinans (Pers.) Nannf., Nova Acta Regiae Societatis Scientiarum Upsaliensis 8(2): 311. 1932.
Apotecio en forma de copa, sésil, 10 mm de diámetro, consistencia gelatinosa, himenio liso, color negruzco; esporas (12.4-)13.2-15.2 × 6.4-7.2 µm, Q=1.7-2.2, elongadas a cilíndricas, en forma de rebanada de sandía, con una estría longitudinal hialina, en algunas con presencia de un cayo en ambos extremos, color verde-olivo.
Material examinado: MÉXICO. Jalisco, municipio Zapotlán el Grande, El Floripondio, camino a las antenas R.M.O., Las Víboras, faldas del Nevado de Colima, 12.VII. 1998, L. Arvizu Franklin 5 (IBUG).
Hábitat: lignícola, sobre madera podrida, gregario en bosque mesófilo de montaña; 2300 m s.n.m.
Distribución: en México ha sido registrada de Morelos (Bautista et al, 1986; Medel et al., 1999), Michoacán (Díaz-Barriga et al., 1988), Oaxaca (Raymundo et al., 2013b) e Hidalgo (Raymundo et al., 2019).
Notas taxonómicas: Bulgaria inquinans se distingue por su himenio liso, que se mancha de negro al tacto y por las esporas color café oscuro. El material estudiado concuerda con lo señalado por Dennis (1981), Phillips (2006) y Beug et al. (2014). Por su parte Breitenbach y Kränzlin (1984) y Raymundo et al. (2019) describen esporas lisas, ampliamente elípticas en forma de limón o reniformes, 9-17 × 6-7.6 µm, mientras que Dennis (1981) y Phillips (2006) las citan de 11-14 × 6-7 µm, medidas que concuerdan con lo observado en el ejemplar revisado.
Pezizomycetes
Pezizales
Rhizinaceae
** Rhizina undulata Fr., Observationes mycologicae 1: 162. 1815. TIPO: en suelo arenoso (Espécimen tipo no designado, ni se menciona en cual herbario se depositó).
= Helvella inflata Schaeff., Fungorum qui in Bavaria et Palatinatu circa Ratisbonam nascuntur Icones 4: 102, t. 153. 1774.
≡ Racodium nigrum Schumach., Enumeratio Plantarum, in Partibus Sællandiae Septentrionalis et Orientalis Crescentium 2: 447. 1803.
≡ Racodium vulgare Pers., Mycologia Europaea 1: 67. 1822.
Apotecio 3-5 cm de diámetro, sésil, margen irregular, con numerosos rizomorfos, color café-anaranjado a café-rojizo negruzco, margen más claro blanquecino-amarillento; esporas (25-)26-31(-37) × 8.5-10 µm, Q=(2.5-)2.8-3.4(-4), cilíndricas a baseliformes, finamente rugosas, bigutuladas, color café-verdoso, con dos apéndices polares, 9-5 × 1-2 µm, dextrinoides en melzer; ascas 400 × 15-20 µm; paráfisis con ápice obtuso a subcapitado, contenido granuloso, muy abundante, color amarillento.
Material examinado: MÉXICO. Jalisco, municipio Zapotitlán de Vadillo, km 4.7 brecha El Milanés, Volcán de Colima, 11.XI.2007, A. Hermosillo 27 (IBUG).
Hábitat: humícola, gregario; bosque de Pinus-Quercus; 2337 m s.n.m.
Distribución: esta especie ha sido reportada para la micobiota mexicana de los estados de Morelos y Puebla (Chacón y Guzmán, 1983), del Estado de México (Frutis et al., 1985; Zarco, 1986), de Michoacán (Gómez Reyes et al., 2014). Se amplía su distribución al registrarse por primera vez de Jalisco.
Notas taxonómicas: el material estudiado concuerda con lo descrito por Dennis (1981), Breitenbach y Kränzlin (1984), Hansen y Knudsen (2000) y Yei-Zeng (2001). Solo difieren en el nombre de la forma que presentan las esporas. Dennis (1981) los llama apículos hialinos en cada extremo, Breitenbach y Kränzlin (1984) apéndices apuntados en ambos extremos, Hansen y Knudsen (2000) como apéndices polares puntiagudos, mientras que Yei-Zeng (2001) solo las describe con apículo grande. La morfología de las esporas es un carácter de importancia para la especie debido al tipo de éstas que presenta.
Sordariomycetes
Hypocreales
Hypocreaceae
** Trichoderma alutaceum Jaklitsch, Fungal Diversity. 48: 69. 2011. HOLOTIPO: Aislado de WU 29177 y depositado con el espécimen teleomorfo como cultivo seco WU 29177a.
≡ Sphaeria alutacea Pers., Commentatio de Fungis Clavaeformibus: 12. 1797.
≡ Cordylia alutacea (Pers) Fr., Observ. Mycol. 2: 317. 1818.
≡ Xylaria alutacea (Pers.) Gray, A natural arrangement of British plants 1: 511. 1821.
≡ Hypocrea alutacea (Pers.) Ces. & De Not., Commentario della Società Crittogamologica Italiana 1(4): 370. 1863.
≡ Cordyceps alutacea (Pers.) Quél., Mémoires de la Société d'Émulation de Montbéliard sér. 2, 5: 487. 1875.
≡ Podocrea alutacea (Pers.) Lindau, Nat. Pflanzenfamilien: 364. 1897.
≡ Podostroma alutaceum (Pers.) G.F. Atk. Bot. Gaz. 40: 416. 1905.
Estroma erecto, claviforme, formado por un pie color anaranjado a café amarillento en seco, de 3-7 × 1-2 cm, superficie irregular, aspecto pruinoso debido a los ostíolos, que se encuentran embebidos en todo el estroma; esporas 3-4 × 2-3 µm, Q=1.1-2, elipsoides, equinuladas, innamiloides, hialinas; ascas (35.1-)40-61.8(-66.5) × (2.8-)2.8-3.4 (-3.6) µm, con 16 esporas, cilíndricas, inamiloides, hialinas.
Material estudiado: MÉXICO. Jalisco, municipio Zapotitlán de Vadillo, Predio La Colmena, km 7-11 después del poblado de Telcruz, ejido Zapotitlán, faldas del Nevado de Colima, 7.IX.2011, C. Torres-Preciado 336 (IBUG); municipio Zapotlán el Grande, km 8-9 del crucero, El Floripondio camino a Las Víboras, Las Antenas, R.M.O., 14.IX.2011, C. Torres-Preciado 376 (IBUG).
Hábitat: lignícola, solitario; bosque de Pinus-Quercus; 1999 m s.n.m.
Distribución: se amplía la distribución de Trichoderma alutaceum al registrarse de Jalisco, especie hasta ahora citada de Chiapas y Durango (Medel, 2002; Raymundo et al., 2012).
Notas taxonómicas: el ejemplar estudiado concuerda con lo descrito por Medel (2002), excepto que menciona esporas con un rango de 3.2-4(-4.8) × 3.2(-4) µm, a diferencia del material revisado que son de menor tamaño, al registrarla de una selva alta perennifolia (Medel, 2002) y al no asociada a bosques de coníferas como lo citado por Dennis (1981). Así mismo se ajusta a las descripciones de Seaver (1910), Dennis (1981), Breitenbach y Kränzlin (1984) y Raymundo et al. (2012), solo que estos autores mencionan el estroma con tonalidades blanquecinas, amarillentas o marrón, a diferencia del material revisado que es de color anaranjado.
Basidiomycota
Agaricomycetes
Agaricales
Agaricaceae
** Lepiota cristata (Bolton) P. Kumm., Der Führer in die Pilzkunde: 137. 1871. TIPO: creciendo en en jardín de J. Cook, 15.IX.1787 (Espécimen tipo no designado, ni se menciona en cual herbario se depositó)
≡ Agaricus cristatus Bolton, An History of Fungusses, Growing about Halifax 1: 7. 1788.
≡ Agaricus colubrinus var. cristatus (Bolton) Pers., Synopsis methodica fungorum 2: 259. 1801.
≡ Lepiota colubrina var. cristata (Bolton) Gray, A natural arrangement of British plants 1: 602. 1821.
≡ Lepiotula cristata (Bolton) E. Horak, Beiträge zur Kryptogamenflora der Schweiz 13: 338. 1968.
= Lepiota cristata var. pallidior Bon, Documents Mycologiques 11(43): 34. 1981.
≡ Lepiota cristata var. macrospora (Zhu L. Yang) J.F. Liang & Zhu L. Yang, Mycotaxon 116: 391. 2011.
Píleo 2-3 cm de diámetro, cónico, escamas aplanadas en toda la superficie, color café chocolate, umbo central del mismo color que las escamas; láminas libres, juntas, angostas, borde liso, color blanco-amarillento; estípite 4-5 × 1-2 cm de largo, central, uniforme, superficie estriado-fibriloso, frágil, sólido, anillo supero, membranoso, colgante, concoloro al estípite y píleo; esporas (6.9-)7-9(-9.5) × 3-4 µm, Q=1.75-3(-3.6), cilíndricas a baseliformes, apice truncado, pared gruesa (≥0.5 µm), gutuladas, contenido granuloso, hialinas; basidios (18-)19-22 × 6-7 µm, claviforme a ventricosos, tetraspóricos, contenido refringente, fíbula basal, hialinos; pleurocistidios no observados; queilocistidios (21-)23-33 × 10-13 µm, claviformes, pared gruesa (1 µm), abundantes, hialinos; pileipellis de tipo himeniforme (20.9-)23.6-63(-77) × 10-15.5(-17.7) µm, claviformes, fíbula basal, hialinos.
Material estudiado: MÉXICO. Jalisco, municipio Zapotlán el Grande, km 5.7 del camino que va hacia las Joyas, Parque Nacional Nevado de Colima, 17.VIII.2011, C. Torres-Preciado 207 (IBUG).
Hábitat: terrícola, gregario; bosque de Pinus-Quercus; 2320 m s.n.m.
Distribución: especie de amplia distribución, pero no común, registrada hasta ahora del hemisferio norte, en Europa, Estados Unidos de América, Japón y México. Para la micobiota mexicana se había reportado de Colima y Veracruz (Murrill, 1911), del Estado de México, Hidalgo, Michoacán, Nuevo León (Valenzuela et al., 1981) y de Oaxaca (Villarruel-Ordaz et al., 2015).
Notas taxonómicas: Lepiota cristata se distingue por presentar una pileipellis himeniforme y esporas espolonadas, y macroscópicamente por el píleo umbonado con tonos café-rojizo de sus escamas concéntricas sobre fondo blanco. El ejemplar examinado concuerda con lo señalado por Murrill (1911), Valenzuela et al. (1981), Breitenbach y Kränzlin (1995) y Vellinga (2001). Se diferencia nuestro material de lo observado por Valenzuela et al. (1981), quienes describen queilocistidios más grandes (24-45 × 7.5-13.5 µm) y de pared delgada. Vellinga (2001), por su parte, describe esporas espolonadas, de tamaño más pequeño, (5-)5.5-8.5(-10) × 2.5-3.5 µm, y una pileipellis de tipo himeniforme. En tanto Breitenbach y Kränzlin (1995) describen esporas truncadas en forma de bala, 5.9-9.3 × 2.7-3.7 µm y una pileipellis himeniforme con elementos claviformes a cilíndricos.
Hygrophoraceae
** Hygrocybe spadicea (Scop.) P. Karst. (como ‘Hydrocybe’), Bidr. Känn. Finl. Nat. Folk 32: 237. 1879. TIPO: Espécimen tipo no designado, ni se menciona en cual herbario se depositó.
≡ Agaricus spadiceus Scop., Flora carniolica 2: 443. 1772.
≡ Hygrophorus spadiceus (Scop.) Fr., Epicrisis Systematis Mycologici: 332. 1838.
≡ Hydrocybe spadicea P. Karst., Bidrag till Kännedom av Finlands Natur och Folk 32: 237. 1879.
≡ Godfrinia spadicea (Scop.) Herink, Sborník Severoceského Musea 1: 66. 1958.
Píleo 41-43 mm de diámetro, cónico, cúspide, muy conspicuo, subviscoso, margen ondulado, color café oscuro en el centro, el resto irregularmente con zonas más claras; láminas subadheridas, subjuntas, borde erodado, color amarillas con tonos mamey; estípite 60-90 × 1-3 mm, central, flexuoso hacia la base, superficie fibrilosa, subviscosa, hueco, color amarillo-verdoso a café muy claro; olor muy desagradable; esporas 10.4-12.4 × 6-7.6 µm, Q=1.5-1.8, elipsoides a elongadas, ápice obtuso y apículo evidente, pared delgada, hialinas; pileipellis un ixocutis, hifas 2.4-3.2 µm de diámetro, pared delgada, septadas, fíbulas y pigmento intracelular, color pardo-amarillento.
Material examinado: MÉXICO. Jalisco, municipio Venustiano Carranza, 3 km antes de La Cañada, carretera Sayula - Venustiano Carranza, 23.VII.1991, M. R. Sánchez-Jácome 107 (IBUG).
Hábitat: humícola, gregario; bosque de Pinus; 2000 m s.n.m.
Distribución: con distribución en Europa y Estados Unidos de América (Arnolds, 1990). Se amplía su distribución en México al citarse para Jalisco, ya que solo se conocía del Estado de México (Santillán y Valenzuela, 1986).
Notas taxonómicas: Hygrocybe spadicea se caracteriza por el color del píleo y el tamaño de sus esporas. El material examinado concuerda con lo mencionado por Santillán y Valenzuela (1986) y Arnolds (1990). Este último describe esporas más grandes, 8-12(-13.5) × 5-9 µm, que lo observado en el ejemplar estudiado, 10.4-12.4 × 6-7.6 µm. Por su parte, Santillán y Valenzuela (1986) mencionan esporas ligeramente más pequeñas, 8-11(-12) × (4.8-)5.6-7.2 µm. Estos últimos autores señalan además a Hygrocybe immutabilis (Peck) Murrill como una especie afín; sin embargo, su píleo es de color café amarillento a café verdoso.
Hymenogastraceae
** Gymnopilus sapineus (Fr.) Murrill, Mycología 4(5): 254. 1912. TIPO: Espécimen tipo no designado, ni se menciona en cual herbario se depositó.
≡ Agaricus hybridus Sowerby, Col. fig. Engl. Fung. Mushr. 2(18): tab. 221. 1799.
≡ Agaricus penetrans Fr., Observationes mycologicae 1: 23. 1815.
≡ Agaricus sapineus Fr., Systema Mycologicum 1: 239. 1821.
≡ Agaricus liquiritiae subsp. sapineus (Fr.) Pers., Mycologia Europaea 3: 184. 1828.
≡ Flammula sapinea (Fr.) P. Kumm., Der Führer in die Pilzkunde: 82. 1871.
≡ Gymnopilus penetrans (Fr.) Murrill, Mycologia 4(5): 254. 1912.
≡ Gymnopilus sapineus (Fr.) Maire, Fungi Catalaunici: Contributions à l'étude de la Flore Mycologique de la Catalogne: 96. 1933.
Píleo 3-5 cm de diámetro, plano-convexo, margen entero, superficie seca, escamoso, escamas aplanadas, color café; láminas adheridas, juntas, anchas, borde serrado a crenado, color amarillo ferruginoso; estípite 1-2 × 0.7-1.2 cm, central, uniforme, fibriloso, firme, sólido, micelio algodonoso basal, color blanco-amarillento; restos de velo presente; contexto suave, color amarillo, olor fúngico; KOH mancha el píleo de color café-rojizo obscuro a negruzco en seco; esporas 8-8.8 × 5.2-6 µm, Q=1.4-1.6, elipsoides, verrugosas, verrugas medianas, ápice subagudo a agudo, sin placa, dextrinoides, color anaranjado-amarillento; pleurocistidios no observados; queilocistidios 27.2-42.4 × 6.8-8.8 µm, langeniforme-subutriformes, ápice subcapitado-capitado, fíbula basal, hialinos o contenido amarillento; trama himenófora subparalela, hifas septadas, con fibulas, hialinas a amarillentas; hifas laticíferas presentes, tortuosas, color anaranjado-amarillentas; trama del píleo radial, compacta, hifas de pared delgada-subgruesa, color amarillentas; pileipellis un cutis, hifas con bandas conspicuas, septadas, fíbulas presentes, pigmento incrustado; caulocistidios 48-59.2 × 3.6-4.8 µm, cilíndricos, ápice capitado, con o sin contenido amarillento.
Material examinado: MÉXICO. Jalisco, municipio de Zapotlán el Grande, 100 m a 3.5 km después del crucero El Floripondio camino a Las Víboras, Las antenas R.M.O. faldas del Nevado de Colima, 13.XI.2012, C. Torres-Preciado 570 (IBUG).
Hábitat: lignícola, gregario; bosque de Pinus-Quercus con presencia de Abies Mill. 2200-2450 m s.n.m.
Distribución: Gymnopilus sapineus es una especie de amplia distribución de acuerdo con lo citado en la bibliografía, se conoce de Estados Unidos de América, Sudamérica, Europa, África, Asia y Australia; para México solo se conocía del estado de Oaxaca (Guzmán-Dávalos, 1996).
Notas taxonómicas: la especie aquí descrita se caracteriza por el color y ornamentación del píleo, y la trama radial de éste. El ejemplar se determinó según lo descrito por Hesler (1969) y Guzmán-Dávalos (1996), quienes la citan con presencia de caulocistidios capitados, velo presente, con píleo finamente escamoso e hifas de la pileipellis con pigmento en bandas, caracteres observados en el material revisado.
Inocybaceae
** Crepidotus applanatus (Pers.) P. Kumm., Der Führer in die Pilzkunde: 74. 1871. NEOTIPO: Loch Lomond, en tocón de madera, 27.VIII.1963, E. Kits van Waveren (L 986.062-019).
≡ Agaricus applanatus Pers., Observationes mycologicae 1: 8. 1796.
≡ Agaricus planus Pers., Synopsis methodica fungorum: 480. 1801.
≡ Crepidotus globiger (Berk.) Sacc., Syll. Fung. 5: 879. 1887.
≡ Crepidotus putrigenus (Berk. & M.A. Curtis) Sacc., Syll. Fung. 5: 883. 1887.
≡ Crepidotus applanatus var. subglobiger Singer, Beih. Nova Hedwigia 44: 478. 1973.
Píleo 1-4.5 cm de diámetro, conchado o petaloide, liso, margen estriado cuando joven, color blanco a marrón pálido; láminas en forma radiada, poco separadas, onduladas, color blanquecino a ocre; esporas 4.5-7.8(-9) × 4-7(-7.2) µm, Q=1-1.27(-1.28), en su mayoría globosas a subglobosas, algunas ampliamente elipsoides, equinuladas, gutuladas, apículo prominente, pared gruesa (0.79 µm), hialinas; pleurocistidios no observados; queilocistidios 14-29(-30.8) × 6-8(-10) µm, claviformes a cilíndricos, pocos lecitiformes, en su mayoría con ápice subcapitado a obtuso, hialinos, contenido refringente y fíbula basal.
Material examinado: MÉXICO. Jalisco, municipio Zapotlán el Grande, km 6.4 del camino que va hacia las Joyas, Parque Nacional Nevado de Colima, 17.VIII.2011, C. Torres-Preciado 218 (IBUG).
Hábitat: lignícola, solitario a gregario; bosque de Pinus-Quercus; 2334 m s.n.m.
Distribución: Crepidotus applanatus se tiene registrada de Europa, Estados Unidos de América y Asia (Breitenbach y Kränzlin, 2000). Se amplía su distribución al citarse de Jalisco, ya que solo se conocía de los estados de Chiapas y Oaxaca (Bandala y Montoya, 2008).
Notas taxonómicas: de acuerdo con lo mencionado por Bandala y Montoya (2008), una especie afín es Crepidotus cuneiformis Pat., de la cual se distingue por el tamaño más pequeño y forma de sus esporas, 5.5-7 × 5.5-6.5(-7) µm, Q=1.03, globosas a subglobosas equinuladas, pero se puede diferenciar por la ausencia de pleurocistidios y la presencia de queilocistidios lageniformes y capitados. Por otra parte, Breitenbach y Kränzlin (2000) mencionan que la especie es casi imposible de determinar macroscópicamente, debido a la diferente coloración que presenta durante su desarrollo. Se puede confundir macroscópicamente con Crepidotus mollis (Schaeff.) Staude, pero se diferencia de ésta por el tamaño y forma de las esporas, 6.5-9.2 × 4.8-6.4 µm y queilocistidios vs. 30-60 × 5-9 µm cilíndricos a legeniformes.
** Inocybe obsoleta (Quadr. & Lunghini) Valade, Index fungorum 165: 1. 2014. HOLOTIPO: FRANCIA. Dept. Seine-et-Oise: Yerves, Chateau de la Grange, 18.VIII.1942, Romagnesi 42.59, herb. Romagnesi (PC).
≡ Inocybe obsoleta Romagn., Flora Analytique des Champignons Supérieurs: 218. 1953.
= Inocybe rimosa var. obsoleta Quadr. & Lunghini, Quaderni dell'Accademia Nazionale dei Lincei 264: 109. 1990.
Píleo 4 cm de diámetro, cónico, umbo central, margen estriado-plicado, color café-crema; láminas subadheridas, juntas, angostas, borde entero, concoloro al píleo; estípite 7 × 1-2 cm central, uniforme, superficie estriado-flocoso, frágil, sólido, concolor al píleo; esporas 10.1-10.9 × 6-6.8 µm, Q=1.5-1.8, ampliamente elipsoides a elongadas, lisas, pared gruesa (≥0.4 µm), gutuladas, contenido refringente, coloración café-amarillento; basidios 35-40 × 10-11.8 µm, claviformes, tetraspóricos, hialinos, fíbula basal; pleurocistidios ausentes; queilocistidios 21-54(-55) × 8-19 µm, claviformes, cilíndricos a lageniformes, fíbula basal, hialinos.
Material estudiado: MÉXICO. Jalisco, municipio Zapotlán el Grande, 100 m después del crucero, El Floripondio, camino a las antenas R.M.O., Las Víboras, faldas del Nevado de Colima, 24.VIII.2011, C. Torres-Preciado 262 (IBUG).
Hábitat: terrícola, solitario a gregario; bosque de Pinus-Quercus; 2362 m s.n.m.
Distribución: es una especie registrada de Europa y Estados Unidos de América (Kuyper, 1986; Larsson et al., 2009; Fernández-Sasia, 2013). De México se tiene citada del Estado de México (Zarco, 1986; Pérez-Silva et al., 2011) y de Sonora (Pérez-Silva et al., 2006).
Notas taxonómicas: Inocybe obsoleta se caracteriza macroscópicamente por la presencia de un velo blanco o blanquecino en basidiomas jóvenes y la ausencia de olor, y microscópicamente por el tamaño pequeño de las esporas. Es afín a Inocybe rimosa (Bull.) P. Kumm.; sin embargo, se diferencia por los tonos amarillo oliváceo de sus láminas, el olor espermático y la presencia de esporas más grandes, 9.6-14 × 5.4-7.5 µm (Breitenbach y Kranzlin, 2000). La especie aquí descrita ha sido considerada coespecifica o como simple forma o variedad de Inocybe rimosa. No obstante, de acuerdo con estudios moleculares realizado por Larsson et al. (2009), son dos especies distintas. El material estudiado concuerda con lo descrito por Kuyper (1986) y Fernández-Sasia (2013).
Pleurotaceae
** Hohenbuehelia spathulata (Pers.) Singer, Fieldiana Botany 21: 42. 1989. TIPO: Espécimen tipo no designado, ni se menciona en cual herbario se depositó.
≡ Agaricus spathulatus Pers., Synopsis methodica fungorum 2: 479. 1801.
≡ Agaricus petaloides var. spathulatus (Pers.) Fr., Systema Mycologicum 1: 183. 1821.
≡ Pleurotus petaloides var. spathulatus (Pers.) P. Karst., Meddn Soc. Fauna Flora fenn. 14: 85. 1887.
≡ Pleurotus spathulatus (Pers.) Peck, Annual Report on the New York State Museum of Natural History 39: 63. 1887.
= Agaricus petaloides Bull., Herbier de la France 5: tab. 226. 1785.
= Hohenbuehelia petalodes (Bull.) Schulzer, Verhandlungen der Zoologisch-Botanischen Gesellschaft Wien 16: 45. 1866.
Píleo 5-20 mm de diámetro, forma conchada o petaloide, superficie ligeramente tomentosa, margen estriado, arqueado, color café; láminas decurrentes juntas, angostas, borde entero, color café más claro hacia el borde; estípite 1-3 × 0.7 cm, lateral, superficie estriada longitudinalmente, consistencia flexible, color café; olor y sabor fúngico; esporas (4.1-)4.3-6.2(-6.5) × 3.5-3.7(-5.1) µm, Q=1.07-1.31(-1.38), globosas a subglobosas hasta ampliamente elipsoides, apículo prominente, contenido refringente, hialinas, inamiloides; basidios 23-26(-30) × 5-7 µm, tetraspóricos, claviformes, hialinos; cistidios 44-53(-56) × 9-16 µm, metuloides con presencia de cristales en el ápice, setiformes a fusiformes, pared gruesa (≥0.5 µm), ápice rostrado, abundantes, coloración verdosa.
Material examinado: MÉXICO. Jalisco, municipio Zapotlán el Grande, 4 km después del crucero, camino que va hacia los cultivos de aguacate, secundario al camino hacia las antenas, El Floripondio, faldas del Nevado de Colima, 11.VII. 2012, C. Torres-Preciado 511 (IBUG).
Hábitat: lignícola, solitario a gregario; bosque de Pinus-Quercus; 2500 m s.n.m.
Distribución: se amplía su distribución al citarse para Jalisco, ya que solo se conocía para el estado de Veracruz (Gándara-Zamorano y Ramírez-Cruz, 2005).
Notas taxonómicas: una especie similar es Hohenbuehelia petaloides (Bull.) Schulzer, pero se diferencia principalmente por presentar un píleo tomentoso, de color café-amarillento (Gándara-Zamorano y Ramírez-Cruz, 2005). Microscópicamente se observan esporas elipsoides a ampliamente elipsoides (5-)5.5-7.5(-8) × (3-)3.5-4.5(-5) µm, Q=1.2-1.66. Ambas especies presentan metuloides con cristales en el ápice.
Psathyrellaceae
• Psathyrella longistriata (Murrill) A.H. Sm., Mushrooms in their natural habitats: 552. 1949. TIPO: ESTADOS UNIDOS DE AMÉRICA. Washington: Seattle, sobre tierra y restos de madera, 20.X.1911, W. A. Murrill 233 (WTU). Fig. 3 (D, E y F).
≡ Stropharia longistriata Murrill, Mycologia 4(6): 301. 1912.
Píleo 20-40 mm de diámetro, convexo-aplanado, superficie glabra, margen estriado, color café a café-grisáceo; láminas adheridas, muy juntas, subanchas, borde entero, color café oscuro o café chocolate; estípite 60-90 × 1-3 mm, central, más o menos uniforme, superficie fibrilosa, hueco, blanquecino, con anillo apical, membranoso, estriado, color blanco con borde más oscuro; esporas 8-10.4 × 4-4.4 µm, Q=1.7-2, elongadas, lisas, poro germinal hialino, pared gruesa (≥0.5 µm), color verde-olivo, café-verdoso; pleurocistidios 37.6-50.4 × 9.6-14.4 µm, subutriformes a claviformes, algunos constricción central, ápice subcapitado a obtuso, fíbula basal, hialinos; pileipellis un epitelio, 20.8-36.8 × 16.8-32 µm, de células claviformes, subglobosas, color anaranjado-amarillento.
Material estudiado: MÉXICO. Jalisco, municipio Zapotlán el Grande, Puerto El Floripondio, 20 minutos al suroeste de Ciudad Guzmán, 7.VII.1984, G. Nieves 276 (IBUG).
Hábitat: lignícola, sobre madera en descomposición, gregario; bosque de Pinus-Quercus; sin datos de altitud. La especie en estudio ha sido citada de hábitat humícola o creciendo sobre restos de madera (Desjardin et al., 2015).
Distribución: se conoce su distribución en Estados Unidos de América y Australia (Smith, 1972, 1975; Desjardin et al., 2015). Esta especie se registra por primera vez para México.
Notas taxonómicas: Psathyrella longistriata se distingue por el píleo glabro con escasas fibrillas y margen estriado, con estípite de color blanquecino y la presencia de un anillo bien definido, estriado en la superficie. El material examinado concuerda con lo descrito por Smith (1972, 1975) y Desjardin et al. (2015). Una especie afín a Psathyrella longistriata es P. ellenae A.H. Sm.; sin embargo, esta última no presenta un anillo estriado. Otra especie parecida es P. barrowsii A.H. Sm. pero se diferencia al carecer de fibrillas en el píleo, estrías en el margen y en el anillo (Desjardin et al., 2015).
Strophariaceae
** Pholiota lubrica (Pers.) Singer, Lilloa 22: 516. 1951. TIPO: Espécimen tipo no designado, ni se menciona en cual herbario se depositó.
≡ Agaricus lubricus Pers., Synopsis methodica fungorum 2: 307. 1801.
≡ Flammula lubrica (Pers.) P. Kumm., Der Führer in die Pilzkunde: 81. 1871.
≡ Inocybe lubrica (Pers.) Roze, Bulletin de la Société Botanique de France 23: 113. 1876.
≡ Dryophila lubrica (Pers.) Quél., Enchiridion Fungorum in Europa media et praesertim in Gallia Vigentium: 70. 1886.
≡ Flammopsis lubrica (Pers.) Fayod, Annales des Sciences Naturelles Botanique ser. 7, 9: 356. 1889.
≡ Gymnopilus lubricus (Pers.) S. Imai, Journal of the Faculty of Agriculture of the Hokkaido Imperial University 43: 231. 1938.
≡ Pholiotina lubrica (Pers.) Singer, Lilloa 22: 516. 1951.
= Agaricus decussatus Fr., Epicrisis Systematis Mycologici: 185. 1874.
= Agaricus decussatus subsp. illustris Kalchbr., Icones selectae Hymenomycetum Hungariae 2: 26, t. 25: 1. 1874.
= Pholiota lenta var. medullata Wichanský, Mykologicky Sbornik: 144. 1967.
Píleo 1.5 cm de diámetro, convexo, recto, superficie viscosa-pruinosa, margen entero, color anaranjado amarillento con tonos anaranjado-rojizo más obscuro hacia el centro; láminas adheridas, subdistantes, angostas, borde crenado, color amarillo; estípite 5 × 1-2 cm, central, uniforme, rígido, color blanco con tonos café-amarillentos; esporas 6-8(-8.5) × 3.5-4.4(4.5) µm, Q=(1.5-)1.55-2(-2.12), elipsoides, en su mayoría elongadas a cilíndricas, apículo muy conspicuo, ápice truncado con poro germinal, pared gruesa (≥0.5 µm), contenido granuloso refringente, inamiloides, gutuladas, color café-amarillento; basidios (21-)21.8-25.01(-25.1) × (5.7-)6-7(-7.4) µm, claviformes, tetraspóricos, abundantes, contenido refringente, hialinos; pleurocistidios (50-)58-71(-74) × (11-)12-19(-20) µm, ventricosos, ápice capitado, pared gruesa (≥0.5 µm), fíbula basal, abundantes, hialinos; queilocistidios 50-65(-68) × 11-17 µm, ventricosos, ápice capitado, similares a los pleurocistidios, pared gruesa (≥1 µm), fíbula basal, abundantes, hialinos; pileipellis un ixocutis, hifas 5.1-12.5 µm, pigmento incrustado conspicuo, pared gruesa (≥0.5 µm), color café-amarillento.
Material estudiado: MÉXICO. Jalisco, municipio de Zapotlán el Grande, 8 km después del crucero, El Floripondio, camino a Las Víboras, antenas R.M.O., El Pajarito, faldas del Nevado de Colima, 26.IX.2011, C. Torres-Preciado 405 (IBUG).
Hábitat: terrícola, gregario; bosque de Pinus-Quercus con elementos de Abies; 2739 m s.n.m.
Distribución: Pholliota lubrica es citada de Europa y Estados Unidos de América (Breitenbach y Kränzlin, 1995; Noordeloos, 1999). Su distribución en México hasta ahora fue registrada del Estado de México (Guzmán, 1970; Valenzuela et al., 2004).
Notas taxonómicas: de acuerdo con Holec (2001), una característica de importancia taxonómica dentro del género Pholiota es la presencia de cistidios para dividirlo en subgéneros. Pholiota lubrica se caracteriza por la ausencia de crisocistidios según lo señalado por Breitenbach y Kranzlin (1995), quienes mencionan la presencia de hifas pigmentadas con incrustaciones muy conspicuas, así como los cistidios con ornamentaciones en su ápice, características que coinciden con lo observado en el material estudiado. Conforme con Noordeloos (1999), Pholliota lenta (Pers.: Fr.) Singer es parecida microscópicamente por la forma de esporas; sin embargo, la coloración de su basidioma es de tonos grisáceo-ocre a oscuros.
Auriculariales
Exidiaceae
• Ductifera exidioidea Lowy, J. Elisha Mitchell Scient. Soc. 80: 65. 1964. TIPO: GUATEMALA. Finca San Mayor, km 33 al oeste de la ciudad de Guatemala, sobre ramas caídas de Quercus sp., 25.VI.1963, G195 (LSUM). (Fig. 3 A, B, C ).
Hongo gelatinoso de forma foliosa-petaloide, superficie pegajosa provista con numerosos gránulos negros, color blanquecino a marrón; esporas 18.7-21.7(-22.6) × 4.4-5.7 µm, Q=3.8-4.58(-4.6), alantoides, ápice truncado, gutuladas, contenido refringente, hialinas; basidios 15.1-20.5(-21) × 8.8-11.8 µm, tetraspóricos, con fragmobasidios de tipo ovoide, hialinos; gleocistidios 39.6-84 × 4-9.1 µm, claviformes, ápice obtuso, muy abundantes, hialinos a café amarillento.
Material examinado: MÉXICO. Jalisco, municipio Zapotlán el Grande, 1 km después del crucero, 2 km después del camino que va hacia las antenas, El Floripondio, faldas del Nevado de Colima, 27.VI.2011, C. Torres-Preciado 471 (IBUG).
Hábitat: lignícola, gregario sobre una rama de Quercus L. en bosque de Pinus-Quercus; 2400 m s.n.m.
Distribución: la especie solo se ha citado de Guatemala (Lowy, 1964; Flores-Arzú et al., 2012) e India (Mahamulkar et al., 2002).
Notas taxonómicas: Ductifera exidioidea se caracteriza por sus esporas alantoides y gleocistidios hialinos, con muy escaso o sin contenido granular. El material estudiado concuerda con lo descrito por Lowy (1964), excepto por el tamaño de las esporas las cuales son más pequeñas, 15-18 × 4.5-5.5 µm con respecto a nuestro ejemplar. Una especie afín es Ductifera sucina (Möller) K. Wells; sin embargo, esta se diferencia por la textura suave, cerosa-gelatinosa y color del basidioma café pálido, tamaño de esporas (9.6.-12.8 × 4-6.4 µm) y forma de basidios oblongo-claviformes (Lowy, 1964).
Boletales
Sclerodermataceae
** Scleroderma aff. pseudostipitatum Petch, Ann. R. bot. Gdns Peradeniya 7(1): 76. 1919. TIPO: SRI LANKA Hakgalla, IX.1908, T. Petch, sobre suelo (K).
≡ Veligaster pseudostipitatus (Petch) Guzmán & Tapia, Documents Mycologiques 25(98-100): 191. 1995.
Basidioma 150-250 × 120-220 mm, globoso, estipitado 10-30 x 5-10(-20) mm, bien formado y con cordones miceliares blanquecinos; peridio delgado, 1 mm de grosor, rubescente, escamas planas con apariencia de verrugas, color café a café-rojizo obscuro; gleba color café-grisáceo cuando maduro; esporas (8-)10.4-12.8 µm, no incluye ornamentación, Q=1, globosas, equinuladas, espinas cónicas 1.6-2.4 µm de altura, algunas curveadas, color verde-olivo, amarillentas.
Material estudiado: MÉXICO. Jalisco, municipio de Zapotlán el Grande, El Floripondio, Nevado de Colima, 9.IX.1998, G. Guzmán 32654 (IBUG, XAL).
Hábitat: terrícola, gregario; bosque de Pinus-Quercus; sin datos de altitud.
Distribución: la especie hasta ahora fue registrada de Sri Lanka y México, de este último citada del estado de Veracruz (Guzmán et al., 2013).
Notas taxonómicas: el material estudiado concuerda con lo observado por Guzmán et al. (2013), quien describe a Scleroderma spseudostipitatum con un basidioma estipitado con esporas (8.3-)10-14(-15) µm, equinuladas con espinas 1-2(-2.5) µm, tamaño más grande que lo observado en el ejemplar aquí registrado. Una especie afín es S. verrucosum (Bull.) Pers. con esporas de (8-)9-12(-14) µm, pero con estípite poco desarrollado y S. nitidum Berk. de (6-)7-11(-13) µm, ambas especies con espinas más pequeñas a lo observado. Por su parte, Rifai (2017) diferencia a S. spseudostipitatum de S. nitidum por el diámetro más pequeño de sus esporas (6.6-9 µm), espinas cónicas de hasta 1.8 µm y el peridio con escamas café-rojizas. De acuerdo con la literatura consultada, no es clara la delimitación de S. pseudostipitatum y sus especies similares, por lo que el material aquí revisado se identifica como afín a esta especie, en espera que futuros estudios moleculares puedan elucidar los complejos de especies de este género.
Discusión
El número de taxones determinados, como resultado del presente trabajo, se incrementó de 140 a 408, de las cuales 30% se consideran potencialmente de importancia económica y ecológica por su valor comestible y/o micorrizógeno.
Se detectó que algunas especies típicas de cierto tipo de bosque están también presentes en otro, como es el caso de Laccaria laccata registrada del BP y encontrándose al igual en el BPE y BMM; situación similar con lo observado por Fierros et al. (2000) y en el área de estudio. Esto puede deberse, según lo mencionado por Fierros et al. (2000), a que los lugares muestreados tienen características peculiares donde la comunidad florística es muy variable y en la que puede asociarse al BPE, donde algunos elementos de ambos llegan a traslaparse, ocasionando la existencia de especies compartidas, situación observada en este estudio. Lo anterior descrito, se observa en especies micorrizógenas como Amanita caesarea (Scop.) Pers., la cual puede asociarse a especies de pino o encino. Asimismo, especies como Lentinus crinitus y Stereum ostrea, por citar algunos ejemplos, se tienen reportadas tanto de bosques templados como de tropicales (Frutis-Molina y Pinzón-Picaño, 1997; Esqueda-Valle et al., 1999; Chanona-Gómez et al., 2007; Villarruel-Ordaz et al., 2015).
La cita de 183 registros nuevos para el CVC es el resultado del estudio, en su mayoría, de las colecciones obtenidas en los últimos diez años, así como de la revisión o corroboración del material depositado en la colección micológica, lo que nos muestra a su vez lo mucho que falta por trabajar.
El listado de los 408 taxones registrados puede considerarse representativo, dado que supera en mucho lo encontrado en catálogos previos, no solo para la zona del CVC, sino también de otras contribuciones micobióticas realizadas en Colima y Jalisco (López-Ramírez y Medel, 2016; Padilla-Velarde et al., 2016; Terríquez Villanueva et al., 2017; Rodríguez et al., 2018, 2019). Es importante mencionar que se observaron localidades o municipios poco o nada explorados como es el caso de Zapotiltic, del que no se contaba con ningún registro, y que ahora aporta 10 este trabajo. Sin embargo, se considera necesario continuar con las exploraciones micológicas que enriquezcan el catálogo de hongos del área de estudio.
Asimismo, un mayor conocimiento de la micobiota del Complejo Volcán Nevado de Colima podría permitir evaluar su diversidad fúngica, distribución actual, y establecer estrategias de un posible aprovechamiento, manejo y conservación en esta zona reconocida por su alto endemismo en flora y fauna (Segura-Trujillo y Navarro Pérez, 2010).
Con base en los resultados obtenidos de las especies fúngicas determinadas, se muestra la importancia de este recurso para su posible aprovechamiento como fuente alimenticia local, y su manejo forestal en esta región que comprende el CVC, ya que desafortunadamente no son consumidos o aprovechados por los lugareños de estas localidades. Por lo anterior, se considera necesario conocer sobre su micobiota, más aún en este tipo de zonas en la que convergen tanto bosques templados como tropicales, siendo estos últimos tan escasamente explorados.
Otro aspecto importante para mencionar es sobre endemismo en hongos, de la que pocos estudios se tienen, que nos permitan conocer con exactitud la distribución tan amplia que muchas de las especies presentan. De acuerdo con la Norma Oficial Mexicana NOM-059-SEMARNAT-2020, se enlistan 46 especies de hongos bajo alguna categoría de riesgo, de las cuales nueve se presentan dentro del CVC, en donde ocho especies están bajo la categoría de amenazada (A) y una citada como sujeta a protección (Pr) (Cuadro 3). Asimismo, dentro de las categorías y criterios de la lista roja de la UICN (International Union for Conservation of Nature), de la que incluye 280 especies de hongos, solo una de ellas se tiene registrada del Complejo Volcánico Colima, Boletinellus merulioides (Schwein.) Murrill, catalogada bajo el estatus de vulnerable (VU) (UICN, 2020).
Cuadro 3: Especies de hongos incluidas en la NOM-059-SEMARNAT-2020 (SEMARNAT, 2020) presentes en el Complejo Volcánico de Colima, México. A=Amenazada; Pr=Sujeta a protección especial.
| Especies | Categoría |
|---|---|
| Amanita muscaria (L.) Lam. | A |
| Cantharellus cibarius var. cibarius=C. cibarius Fr. | Pr |
| Gomphidius rutilus (Schaeff.) S. Lundell | A |
| Hygrophorus russula (Schaeff. ex Fr.) Kauffman | A |
| Morchella angusticeps Peck | A |
| Morchella conica=M. esculenta (L.) Pers. | A |
| Morchella costata Pers. | A |
| Morchella esculenta var. umbrina=M. esculenta (L.) Pers. | A |
| Psilocybe mexicana R. Heim | A |
| Psilocybe zapotecorum R. Heim | A |











 text new page (beta)
text new page (beta)




