Introducción
Las briofitas (antoceros, hepáticas y musgos) son plantas no vasculares cuyo ciclo de vida incluye el gametofito y el esporofito. El primero se reproduce sexualmente y da lugar al esporofito y las esporas, pero también puede formar estructuras asexuales como fragmentos o yemas (Delgadillo y Cárdenas, 1990). Las esporas y las diásporas asexuales son las unidades de reproducción y de dispersión que en estas plantas son importantes para su supervivencia y distribución. Su producción es muy variable entre especies pues es controlada por factores fisiológicos, ambientales o genéticos. La abundancia, ausencia o rareza de esporofitos depende de la distancia de fecundación, de la proporción diferencial de plantas femeninas vs. masculinas y de la distribución y arreglo de los órganos sexuales (condición sexual). Este último tiene especial relevancia en el éxito reproductivo de plantas dioicas (unisexuales) o monoicas (bisexuales) (Bisang y Hedenäs, 2005; Crawford et al., 2008). La reproducción sexual es menos frecuente en especies dioicas que en monoicas; las primeras producen más diásporas vegetativas especializadas y menos esporas (Longton y Schuster, 1983; Hedderson y Longton, 1995; During, 2007; Vanderpoorten y Goffinet, 2009; Laenen et al., 2016; Cavalcanti Pôrto et al., 2017).
Maciel-Silva et al. (2012a) indican que las diferencias en la reproducción de briofitas pueden ser influenciadas por los sistemas de reproducción (monoicos y dioicos), pero hacen notar que el hábitat también es importante. En otros casos, Gemmell (1950), mediante una evaluación de la proporción de las especies dioicas y monoicas por región, determina que los musgos dioicos están más ampliamente distribuidos que los monoicos y que las especies estériles. Ignatov et al. (2009) mencionan que el patrón de diversidad de especies usualmente se correlaciona con la diversidad fisiográfica y que las especies dioicas son relativamente más numerosas entre las de amplia distribución. En el caso de las hepáticas, parece existir una relación entre la producción de propágulos con el tamaño del área de distribución, pero no se ha detectado correlación entre el dioicismo y la producción de propágulos (Laenen et al., 2016).
En este estudio se revisó la relación entre la condición sexual y la distribución de especies de la familia Pottiaceae. Ésta es una de las familias de musgos más diversas del mundo, con alrededor de 76 géneros y más de 1400 especies (Zander, 1993). Las Pottiaceae habitan en ambientes distintos, tanto en lugares húmedos como secos, en zonas bajas o altas y en ambientes extremos (Zander, 1993; Delgadillo, 2014). En México están representadas por 53 géneros y 158 especies; es la familia más diversa y con una amplia distribución en el país (Delgadillo, 2014) y su condición sexual es bien conocida; entre ellas podemos encontrar especies dioicas, monoicas y polioicas (Peña-Retes y Delgadillo-Moya, 2018). Sin embargo, no se ha establecido la relación entre la condición sexual y la distribución con base en datos de campo. Por ello, se desea determinar si a) la distribución de las especies monoicas en el país es función de la producción frecuente de esporofitos y la mayor disponibilidad de esporas, b) las especies dioicas, al menos las que no producen esporofitos, muestran una distribución discontinua o restringida y c) las especies que solo producen yemas tienen áreas de distribución muy reducidas.
Materiales y Métodos
Los datos de las Pottiaceae en México provienen de Sharp et al. (1994), información actualizada de LATMOSS (Delgadillo, 2010) y registros de 7000 ejemplares de la Colección de Briofitas del Herbario Nacional de México (MEXU).
Para cada especie se obtuvieron datos de localidad, coordenadas geográficas, condición sexual y presencia o ausencia de esporofitos y diásporas asexuales. En algunos casos las coordenadas se obtuvieron empleando Google Earth y el gacetero de Localidades Geoestadísticas y Nombres geográficos de INEGI (2019).
Con los datos de localidad se prepararon mapas de las especies en ArcMap 10.1 software (ESRI, 2012), localizando cada registro en el territorio mexicano. Las especies dioicas se separaron de las monoicas para identificar posibles patrones de distribución. En el caso de las especies que únicamente producen yemas y que carecen de esporofitos se prepararon otros mapas con los mismos programas y se hizo una búsqueda adicional en herbarios extranjeros a través de bases de datos (CNABH, 2020; GBIF, 2020), agregando registros ausentes en MEXU. Se excluyeron las especies polioicas.
En un mapa inicial de todos los registros de Pottiaceae, no se observaron patrones definidos entre dioicos y monoicos ya que los registros de ambos grupos se entremezclaban. Posteriormente, con el objetivo de tener más elementos para separar la distribución de las especies, se agregaron capas de factores ambientales como temperatura, precipitación y altitud tomados de la página de WorldClim 2 (Fick y Hijmans, 2017) a una resolución de 30 segundos. Con esos datos, se elaboraron diagramas de caja en Excel para visualizar posibles agrupaciones de especies dioicas y monoicas. Se eligieron las que tuvieran entre 100 y 200 registros cada una para comparar su distribución.
Resultados
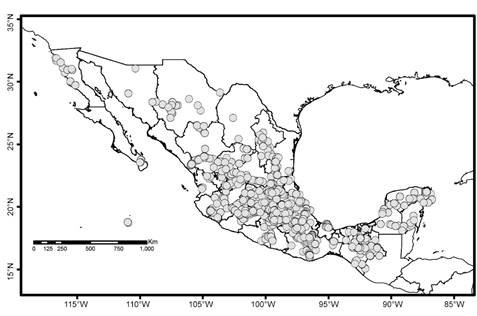
De las 158 especies de Pottiaceae que se registran en México, solo se consideraron 142, pues Leptobarbula berica (De Not.) Schimp. no cuenta con descripción de condición sexual y 15 no tienen registros en MEXU. De las 142 especies, 13 son polioicas (condición sexual, monoica y dioica; ver Peña-Retes y Delgadillo-Moya, 2018); 94 son dioicas y 35 monoicas (Apéndice). La mayoría de las especies dioicas producen esporofitos; nueve de ellas únicamente yemas y siete no producen esporofitos ni yemas (Fig. 1) en el territorio nacional.

Figura 1: A. Weissia controversa Hedw. mostrando el gametofito (color verde) y esporofitos (color amarillo); B. Syntrichia amphidiacea (Müll. Hal.) R.H. Zander. mostrando yemas en la parte ventral y dorsal de sus hojas.
Los miembros de la familia Pottiaceae están ampliamente distribuidos en México. Sin embargo, las especies dioicas y monoicas difieren en la amplitud de las áreas ocupadas, pues las primeras se registran en más estados que las segundas. Así, por ejemplo, la primera barra de la Figura 2, con la frecuencia de distribución por número de estados, indica que hay 12 especies dioicas que se distribuyen en un estado; en tanto que hay 14 especies monoicas que siguen este patrón. La segunda barra muestra 10 especies dioicas y cuatro monoicas que se encuentran en dos estados; en esta y las barras siguientes las dioicas superan a las monoicas.
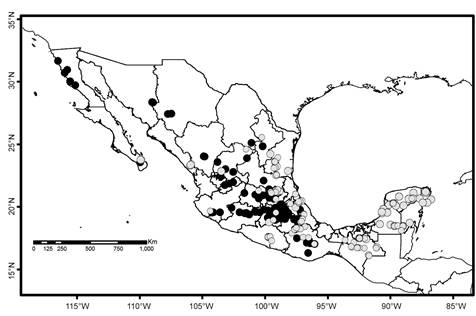
La Figura 3 muestra la distribución de las Pottiaceae dioicas en los estados del país. De acuerdo con los datos de herbario el esfuerzo de colecta no ha sido uniforme, pues existen zonas con muchas especies registradas; por ejemplo, el estado de México, Puebla y Veracruz tienen más de 50 especies dioicas registradas; en contraste, Baja California Sur registra solo dos de ellas.
A nivel nacional las especies dioicas que solo se reproducen por yemas incluyen Barbula bolleana (Müll. Hal.) Broth., Chenia leptophylla (Müll. Hal.) R.H. Zander, Didymodon umbrosus (Müll. Hal.) R.H. Zander, Leptodontium proliferum Herz., Mironia crassicuspis (H. Rob.) R.H. Zander, Streptopogon calymperes Müll. Hal. ex Geh., Streptopogon cavifolius Mitt., Syntrichia pagorum (Milde) Amann y Syntrichia papillosa (Wilson) Jur., pero su distribución no muestra tendencias o patrones definidos (Fig. 4). La distribución parece más reducida en Chenia leptophylla, Leptodontium proliferum, Streptopogon calymperes y Streptopogon cavifolius, porque existen pocos registros disponibles. La situación es similar para siete especies que no presentan esporofitos ni yemas: Anoectangium stracheyanum Mitt., Bellibarbula recurva (Griff.) R.H. Zander, Chionoloma schlimii (Müll. Hal.) Alonso, Cano & Jiménez, Hennediella standfordensis (Steere) Blockheel, Hyophila nymaniana (M. Fleisch.) Menzel, Saitobryum lorentzii (Müll. Hal.) Ochyra y Syntrichia percarnosa (Müll. Hal.) Ochyra (Fig. 5). La búsqueda en otros herbarios no aumentó el número de registros, ni hay patrones de distribución definidos.
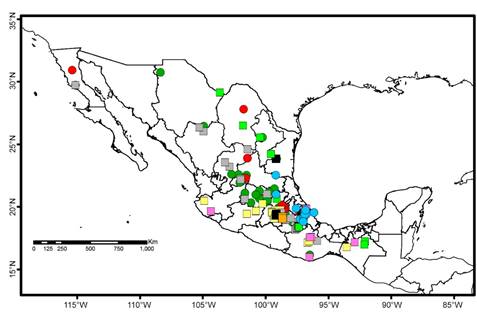
Figura 4: Distribución de especies de Pottiaceae en México que solo producen yemas. Barbula bolleana (Müll. Hal.) Broth. (cuadros verdes); Chenia leptophylla (Müll. Hal.) R.H. Zander (cuadros negros); Didymodon umbrosus (Müll. Hal.) R.H. Zander (cuadros grises); Leptodontium proliferum Herz. (cuadros naranjas); Mironia crassicuspis (H. Rob.) R.H. Zander (cuadros amarillos); Streptopogon calymperes Müll. Hal. ex Geh. (cuadros rosas); Streptopogon cavifolius Mitt. (círculos azules); Syntrichia pagorum (Milde) Amann (círculos verdes) y Syntrichia papillosa (Wilson) Jur. (círculos rojos).
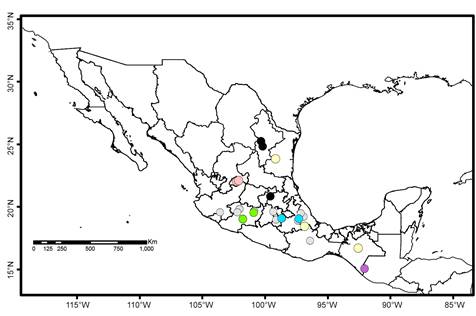
Figura 5: Especies de Pottiaceae en México sin yemas ni esporofitos. Anoectangium stracheyanum Mitt. (morado); Bellibarbula recurva (Griff.) R.H. Zander (gris); Chionoloma schlimii (Müll. Hal.) Alonso, Cano & Jiménez (amarillo); Hennediella standfordensis (Steere) Blockheel (rosa), Hyophila nymaniana (M. Fleisch.) Menzel (verde), Saitobryum lorentzii (Müll. Hal.) Ochyra (azul) y Syntrichia percarnosa (Müll. Hal.) R. H. Zander (negro).
Con relación a los musgos monoicos, solo dos de las 35 especies carecen de registros de esporofitos. Su distribución (barras azules, Fig. 2) incluye un número menor de estados, y excepto por esto, el patrón de su distribución es similar al de especies dioicas (Fig. 6). Tampoco se observan diferencias en la distribución de especies dioicas y monoicas al incorporar las capas de datos ambientales. Sin embargo, en un análisis mediante diagramas de caja, se distinguen los siguientes dos tipos de distribución: el representado por taxa dioicos como Plaubelia sprengelii (Schwägr.) R.H. Zander var. sprengelii y Weissia jamaicensis (Mitt.) Grout y el representado por especies monoicas como Syntrichia obtusissima (Müll. Hal.) R.H. Zander y Timmiella anomala (Bruch & Schimp.) Limpr. Los valores de temperatura y precipitación se sobreponen, lo que significa que hay un punto en el que pueden crecer dioicas y monoicas por igual. Sin embargo, el rango de precipitación en el que se presentan los dioicos es más amplio. La altitud de las especies monoicas es mayor y su tolerancia es menor que en el caso de los dioicos; los valores extremos indican la tolerancia de las especies para ocupar otros sitios (Figs. 7, 8 y 9). Los resultados muestran que las especies monoicas se distribuyen preferentemente en el Eje Neovolcánico y hacia el noroeste (Fig. 10, círculos negros). La distribución de especies dioicas se localiza hacia el este y sureste del país (Fig. 10, círculos grises). Las diferencias en distribución más claras se muestran entre Weissia jamaicensis y Syntrichia obtusissima. La primera especie crece sobre suelo, areniscas o rocas calcáreas, en sitios con una temperatura promedio de 23 °C, precipitación anual de 1300 mm, a 800 m s.n.m. Syntrichia obtusissima crece sobre suelo calcáreo y roca, en sitios secos y húmedos, con una temperatura promedio de 15 °C, una precipitación de 600 mm y a 2200+ m s.n.m. (Figs. 7, 8 y 9).
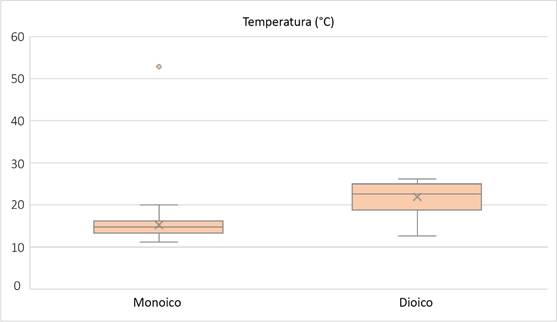
Figura 7: Diagrama de caja de especies dioicas y monoicas de Pottiaceae en México, con base en la temperatura. Los extremos indican el valor mínimo y máximo, la longitud de los bigotes muestra 25% de los datos en la parte inferior y superior, la extensión de los cuartiles se relaciona con los valores de los datos incluidos en los rangos del mínimo-máximo.
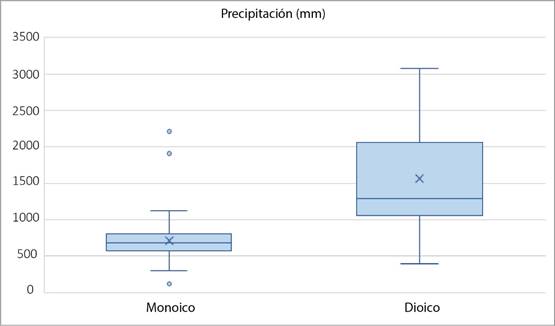
Figura 8: Diagrama de caja de especies dioicas y monoicas de Pottiaceae en México, con base en la precipitación. Los extremos indican el valor mínimo y máximo, la longitud de los bigotes muestra 25% de los datos en la parte inferior y superior, la extensión de los cuartiles se relaciona con los valores de los datos incluidos en los rangos del mínimo-máximo.
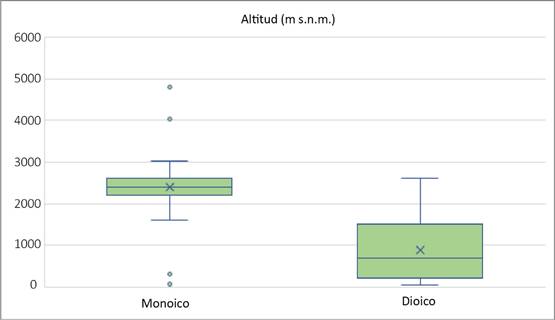
Figura 9: Diagrama de caja de especies dioicas y monoicas de Pottiaceae en México, con base en la altitud. Los extremos indican el valor mínimo y máximo, la longitud de los bigotes muestra 25% de los datos en la parte inferior y superior, la extensión de los cuartiles se relaciona con los valores de los datos incluidos en los rangos del mínimo-máximo.
Discusión
Aunque se ha propuesto que existe relación entre la distribución de las especies y su condición sexual (Gemmell, 1950; Laenen et al., 2016), en el caso de las Pottiaceae mexicanas, las dioicas superan en cantidad a las monoicas y ambos grupos tienen una distribución similar en el territorio nacional. Sin embargo, los datos de la figura 2 apoyan la idea de que el rango de distribución es mayor en especies dioicas que en monoicas. Es pertinente señalar que los muestreos de musgos todavía son deficientes en partes importantes del país y que la mejor exploración puede modificar ideas sobre la distribución de algunos taxa; por ejemplo, si se encontrara un número significativo de especies monoicas en los estados poco colectados. Actualmente, más de 60% de las especies de Pottiaceae de México son dioicas y 26% son monoicas. La condición dioica también sobrepasa a la monoica en otras familias importantes de nuestra flora de musgos, pero su riqueza de especies es menor, p. ej. Bryaceae y Dicranaceae. En contraste, en la familia Fissidentaceae el balance entre dioicas y monoicas se invierte (Peña-Retes y Delgadillo-Moya, 2018).
La evaluación del efecto de la condición sexual en la distribución de los musgos también debe considerar otras características biológicas y la heterogeneidad ambiental, la era de diferenciación de las especies y de los sustratos, entre otros factores. La presencia de Pottiaceae dioicas en cualquier lugar del país, ya sea en microambientes naturales o en sitios perturbados por la actividad humana, hace difícil determinar el efecto de la condición sexual.
Se ha mencionado que la producción de esporofitos podría ser más eficiente en las especies monoicas que en las dioicas por la disponibilidad de células sexuales masculinas y femeninas en una misma planta o población (Longton y Schuster, 1983). La mayor producción de esporofitos puede incrementar el potencial de dispersión de esporas y el rango geográfico de las especies monoicas con respecto a las dioicas (Cavalcanti Pôrto et al., 2017). En la presente investigación, contrario a lo esperado, las especies dioicas y monoicas de Pottiaceae en México tienen áreas de distribución similares (Figs. 2, 5). Esta aparente incongruencia podría deberse al menor número de taxa monoicos incluidos en el estudio (Fig. 1). Es probable que la mejor recolección de muestras por estado también modifique los resultados preliminares, así como la obtención de datos para conocer el tiempo de ocupación de áreas y origen de las especies.
Existen otras características biológicas que pueden relacionarse con la condición sexual, por ejemplo, las estrategias de vida (During, 2007). Las especies monoicas viven poco tiempo en un sitio e invierten recursos importantes en la producción de esporas; así también se explica el alto número de esporas de especies monoicas recuperadas en un banco de diásporas de un bosque lluvioso en Brasil (Maciel-Silva et al., 2012b). En contraste, la mayoría de las especies dioicas de amplia distribución son consideradas como perennes; es decir, tienen una vida más larga, gametofitos más grandes e invierten más recursos en la reproducción asexual como estrategia de vida. De acuerdo con la longevidad y estacionalidad de reproducción se determina la probabilidad y frecuencia de los eventos reproductivos, los cuales disminuyen al aumentar la esperanza de vida (Hedderson y Longton, 1995; Longton, 1998; During, 2007; Crawford et al., 2008; Ignatov et al., 2009; Maciel-Silva et al., 2012a).
Los fósiles de briofitas podrían utilizarse para estimar el tamaño del área de distribución o el número de especies dioicas en una flora. Sin embargo, a falta de registros fósiles de musgos para México no se pueden ofrecer estimaciones. En otras partes del mundo los fósiles más antiguos pertenecen al Carbonífero (Anderson, 1974) y Pérmico (Ignatov y Shcherbakov, 2009) y aunque se sabe poco acerca de la edad de diversificación, se puede decir que algunas familias ya eran diversas en el Cretácico superior (Konopka et al., 1997). Los musgos pleurocárpicos se originaron hace 194-161 millones de años (Newton et al., 2007), y es probable que los acrocárpicos (y las Pottiaceae) sean más antiguos. Para cuando el territorio mexicano alcanzó su configuración actual (cf. López Ramos, 1983), seguramente las Pottiaceae ya eran parte de su flora, por lo cual se les puede considerar como un componente antiguo que ha tenido suficiente tiempo para alcanzar su distribución actual, a pesar de la ausencia de la reproducción sexual en algunos casos.
De acuerdo con las hipótesis planteadas, las siete especies de Pottiaceae que no producen esporofitos localmente (o para las que no se conocen), deberían tener una distribución muy restringida. Anoectangium stracheyanum, Bellibarbula recurva, Chionoloma schlimii, Hennediella standfordensis, Hyophila nymaniana, Saitobryum lorentzii y Syntrichia percarnosa están en ese caso en México. Sin embargo, su área de distribución puede ser muy amplia en otros países; se desconoce la participación de fragmentos en la formación de nuevos gametofitos, especialmente en las especies de distribución discontinua o sin registros en los estados del norte. Todos los musgos son capaces de alguna reproducción asexual, involucrando alguna parte fragmentada del gametofito, la cual dará lugar a un nuevo gametofito bajo condiciones favorables (Crawford et al., 2008). Por su parte, las especies que únicamente producen yemas podrían alcanzar una distribución similar a la de especies que producen esporofitos a través del tiempo. Algunas podrían producir esporofitos ocasionalmente, aunque en ausencia de algún órgano sexual se establecen patrones de distribución alopátrica (Anderson, 1943). Syntrichia pagorum, por ejemplo, es una especie frecuente en Norteamérica, pero las colonias masculinas se han observado únicamente en Europa (Anderson, 1943). No obstante, en muchos casos la producción de propágulos vegetativos es suficiente para asegurar la persistencia de las especies (Glime y Bisang, 2017). Barbula bolleana, Dydimodon umbrosus, Mironia crassicuspis y Syntrichia pagorum muestran una distribución continua en varios estados del país y la aparente ausencia de esporofitos no es obstáculo para que dichas especies puedan habitar en varios sitios (Fig. 3). Bisang y Hedenäs (2005) y Maciel et al. (2012b)mencionan que las especies compensan las bajas tasas de fertilización y la frecuencia de plantas femeninas con una alta producción de yemas en las fases iniciales de su ciclo de vida y que cualquier especie, sea dioica o monoica, puede producir yemas en sus primeras etapas. Se sabe que los musgos dioicos invierten más en reproducción asexual y los monoicos en reproducción sexual (Hedderson y Longton, 1995). En la familia Pottiaceae, las especies monoicas están representadas en número menor, mientras que las especies más numerosas y que producen yemas son dioicas.
Las especies dioicas (Plaubelia sprengelii var. sprengelii, Weissia jamaicensis) y monoicas (Syntrichia obtusissima y Timmiella anomala) se localizan en microhábitats distintos, es decir, en diferentes condiciones ambientales y tipos de suelo. Estos microhábitats deben determinar las zonas de ocupación de cada especie y no su condición sexual. Por ello se pueden encontrar otras especies en los dos tipos de microhábitats de las especies anteriores, pero no se puede predecir si son dioicas o monoicas. Los patrones en la diversidad de especies usualmente se correlacionan con la diversidad fisiográfica (Gemmell, 1950; Ignatov et al., 2009) y, de acuerdo con Ignatov et al. (2009); la proporción de especies dioicas puede estar relacionada con características ambientales y no con su condición sexual.
Un caso excepcional es el de Streptopogon cavifolius que solo se distribuye en la vertiente del Golfo de México; la búsqueda de datos en otros herbarios no produjo nuevos registros. La mejor exploración podría aportar otros datos sobre su distribución actual o ayudar a identificar los factores que controlan su presencia en esta región.
En síntesis, podría suponerse que la distribución actual de las Pottiaceae en México es independiente de su condición dioica o monoica. Aunque se ha sugerido que la frecuencia de la reproducción sexual es menor en las especies dioicas, entre las Pottiaceae mexicanas son pocas para las que se desconocen los esporofitos y las que se reproducen únicamente por yemas no tienen una distribución restringida, como se esperaba. Por otra parte, las especies que aparentemente no producen ni esporofitos ni yemas muestran una distribución más limitada, pero no hay evidencia clara de que carecen de diásporas. Antes de descartar la condición sexual como responsable directa de la distribución de las Pottiaceae en México, se pueden considerar factores como la edad y origen de cada especie, apoyadas por estudios de sus relaciones filogenéticas. También se deben explorar aspectos de su biología como la relación entre las formas de vida y la condición sexual.











 nueva página del texto (beta)
nueva página del texto (beta)