Introducción
Las macroalgas bentónicas se desarrollan adheridas a un sustrato con el cual no mantienen ningún tipo de relación trófica (Báez y Flores-Moya, 2003) y se denominan epizoicas a las que para desarrollarse usan como basibionte a algún animal (Wahl, 2009). A nivel mundial existen pocos estudios que analizan la epibiosis de algas en animales; la mayoría se refieren a tortugas y peces basibiontes y en menor medida a invertebrados como moluscos, corales y esponjas sobre los que se han encontrado las siguientes especies de algas: Aglaothamnion boergesenii (Aponte & D.L. Ballantine) L’ Hardy-Halos & Rueness, Blidingia marginata (J. Agardh) P.J.L. Dangeard ex Bliding, Centroceras clavulatum (C. Agardh) Montagne, Chaetomorpha antennina (Bory) Kützing, C. linum (O.F. Müller) Kützing, Champia parvula (C. Agardh) Harvey, Cladophora albida (Nees) Kützing, C. vagabunda (L.) Hoek, Ectocarpus siliculosus (Dillwyn) Lyngbye, Sphacelaria tribuloides Meneghini, Scytonematopsis crustacea (Thuret ex Bornet & Flahault) Koválik & Komárek (Frazier et al., 1985; Bretos y Chihuailaf, 1990; Ballantine et al., 2001; Báez et al., 2001, 2002; Báez y Flores-Moya, 2003; Connelly y Turner, 2009; Levenets et al., 2010; Serio et al., 2011; Martins et al., 2014).
Aunque el conocimiento ficológico para la región del Pacífico mexicano es amplio, la mayoría de los estudios han estado orientados a conocer la flora local que se encuentra adherida a sustratos rocosos. Es menor el número de trabajos desarrollados para conocer las macroalgas que crecen sobre organismos vivos, ya sea como epífitos o como epizoicos (González-González et al., 1996; Mateo-Cid y Mendoza-González, 1991, 1992, 2012; Mendoza-González y Mateo-Cid, 1985, 1986, 1998; Pedroche y Sentíes, 2003a; Dreckmann et al., 2006; Vázquez-Delfín, 2008; Vega et al., 2008; Mendoza-González et al., 2011).
Solo tres estudios se han desarrollado específicamente sobre algas epizoicas marinas, uno para el Caribe mexicano acerca de especies que crecen sobre tortugas marinas (Sentíes et al., 1999), en el que se registraron 37 taxa de algas epizoicas, destacando los órdenes Ceramiales y Cladophorales; otro para Jalisco con epibiontes de tortugas golfinas que incluyó especies del género Polysiphonia Greville (Hernández-Vázquez y Valadez-González, 1998) y recientemente, Álvarez-Cerrillo et al. (2017) reportaron los epibiontes de Chiton articulatus G.B. Sowerby I 1832, capturados en las costas de Guerrero, a partir de la presencia de dos grupos morfofuncionales, filamento y costra, pero no determinaron categorías taxonómicas.
El objetivo de este trabajo es hacer un aporte al conocimiento de la ficoflora epizoica registrada para el Pacífico tropical mexicano. Por un lado, el estudio se basó en las algas epizoicas en la cucaracha de mar Chiton articulatus (Mollusca, Polyplacophora) en la costa del estado de Guerrero, México, y por otro lado, en la revisión de la literatura publicada entre 1944 y 2019 sobre este tema.
Materiales y Métodos
Captura de organismos
En esta contribución se da información de las especies de macroalgas que crecen sobre las conchas del molusco Chiton articulatus y que fueron capturados por los autores en la región de Ixtapa-Zihuatanejo, la cual se localiza en la porción suroeste de México, en las costas del estado de Guerrero. En enero, mayo, julio y noviembre de 2014, los animales se capturaron de forma manual con ayuda de una espátula en dos localidades: 37 individuos en el intermareal rocoso medio y alto de playa El Palmar (17°39'0.4"N, 101°36'2.79"O), en el extremo norte de Ixtapa y 25 en el intermareal rocoso del muelle municipal (17°38'13.88"N, 101°33'31.87"O), en la bahía de Zihuatanejo (Fig. 1).
Los organismos se colocaron en bolsas con agua de mar para ser transportados al laboratorio de la Unidad Multidisciplinaria de Docencia e Investigación Zihuatanejo (UMDI-Z) de la Universidad Nacional Autónoma de México (UNAM), se preservaron en frío a 4°C para su relajación y a continuación fueron colocados en formol para su posterior identificación.
Los organismos se identificaron con base en sus caracteres conquiliológicos (caracteres morfológicos de la concha) y con apoyo de la literatura malacológica especializada para el Océano Pacífico (Keen, 1971; Kaas et al., 2006). Los ejemplares fueron depositados en la colección, en proceso de registro ante SEMARNAT, “Invertebrados Asociados a Macroalgas” del laboratorio de Ficología marina (Biodiversidad Marina), UNAM.
De 62 individuos capturados de Chiton articulatus, se revisaron 26 (16 para playa El Palmar y 10 para el muelle municipal) para la identificación de las algas, ya que sólo en esos se encontraron creciendo dichos organismos.
Identificación de algas
A partir de la observación de las características morfológicas de las algas con apoyo de microscopía estereoscópica (Nikon CLEDS, Tokio, Japón) y de preparaciones semipermanentes en gelatina glicerinada de los talos y de los cortes transversales observadas con microscopía óptica (OLYMPUS-CX23, Tokio, Japón), se realizó la determinación taxonómica de las algas empleando la siguiente literatura ficológica especializada: Taylor (1945, 1960), Dawson (1953a, b, 1954, 1960, 1961a, b, 1962, 1963a, b), Abbott y Hollenberg (1976) y Anagnostidis y Komárek (1988).
Revisión bibliográfica
Se revisaron 80 trabajos realizados entre 1944-2019, dados a conocer en artículos científicos, capítulos de libro y tesis de licenciatura y posgrado, que incluían información de ocho estados (Sinaloa, Nayarit, Jalisco, Colima, Michoacán, Guerrero, Oaxaca y Chiapas) a lo largo de la costa del Pacífico tropical mexicano (PTM). Dichos documentos se obtuvieron de repositorios en línea, de bases de datos y de la biblioteca del laboratorio de Ficología (Biodiversidad Marina) de la Facultad de Ciencias, UNAM. Se seleccionaron aquellos trabajos florísticos y ecológicos realizados en localidades del PTM desde el trabajo más antiguo realizado en estas costas hasta los estudios más recientes, se revisaron los resultados, las listas de especies y las descripciones de dichas investigaciones en búsqueda de los sustratos; en el caso de tratarse de un animal, se realizó su registro junto con la especie de alga epizoica. En el presente estudio se incluyen y se citan todos los documentos que presentan información al respecto.
Con los datos provenientes de la revisión de las algas que crecen en las conchas de Chiton articulatus capturados en la región de Ixtapa-Zihuatanejo y de los registros de la literatura, se elaboró una lista de especies, arreglada sistemáticamente y actualizada con AlgaeBase (Guiry y Guiry, 2020). Para los nuevos registros se llevó a cabo una descripción morfológica. Se registraron los grupos morfofuncionales a los que cada especie pertenece (microscópicas, filamento, folioso, foliosas corticadas, filamento corticado, coriáceas, calcáreas articuladas, costras), de acuerdo con la clasificación de Steneck y Dethier (1994). Cada especie de algas se asoció a un tipo de estructura de fijación al sustrato.
Resultados
Inventario de algas epizoicas en Chiton articulatus
En total se capturaron 62 ejemplares de quitones en la zona de Ixtapa-Zihuatanejo, Guerrero, México. De éstos, 26 presentaron algas epibiontes (42%). Se registraron 35 especies de algas pertenecientes a cuatro divisiones, 16 especies de Chlorophyta, 15 de Rhodophyta, dos de Ochrophyta-Phaeophyceae y dos de Cyanobacteria. De éstas, 12 son nuevos registros para la flora de macroalgas del estado de Guerrero, de las cuáles seis son exclusivamente para Guerrero. Del resto, tres especies representan nuevos registros para el Pacífico tropical mexicano y tres lo son para el Pacífico de México. De la revisión bibliográfica solo se encontraron registros de algas epizoicas en 18 estudios que incluyen información de ocho estados a lo largo de la costa del Pacífico tropical mexicano (Apéndice).
En total se registraron 124 especies de algas al integrar los reportes de las que crecen sobre las conchas de Chiton articulatus y de la revisión bibliográfica (Apéndice), las cuales están distribuidas en 81 géneros, 51 familias, 27 órdenes y cuatro divisiones, incluyendo 79 especies de Rhodophyta, 27 de Chlorophyta, 13 de Ochrophyta-Phaeophyceae y cinco de Cyanobacteria. Adicionalmente, 12 ejemplares solo pudieron ser identificados hasta nivel de género, debido al estado de preservación de los talos o a la cantidad de estos, que imposibilitó la observación de caracteres diagnósticos a nivel de especie; estos no se incluyeron en los conteos del presente trabajo. Los órdenes mejor representados fueron Ceramiales con 23 especies y Corallinales con 20. Las familias con mayor riqueza de especies fueron Rhodomelaceae (13), Cladophoraceae (11) y Lithophyllaceae (10), mientras que los géneros mejor representados fueron Amphiroa y Cladophora, con siete especies cada uno.
Riqueza por estado
Guerrero es el estado con el mayor número de algas registradas como epizoicas (58 especies), seguido de Nayarit (21) y Sinaloa (11), mientras que en Chiapas únicamente se ha registrado una. Quince especies se compartieron entre los distintos estados, las del género Gelidium J.V. Lamouroux se reportan para siete estados y en particular G. pusillum (Stackhouse) Le Jolis ha sido registrada en cinco estados, así como Ulva intestinalis L. en cuatro (Apéndice).
Grupos morfofuncionales
El grupo predominante fue el de los filamentos con 57 especies, seguido de los filamentos corticados (27) y de las algas costrosas (20) (Apéndice).
Tipos de basibiontes
De acuerdo con los resultados de las recolecciones realizadas en este estudio de algas epizoicas de Chiton articulatus y con los reportes de la información bibliográfica revisada, se identificaron cuatro basibiontes animales: balanos, coral vivo, esponjas y moluscos. Estos últimos presentaron el mayor número de epibiontes (66 especies), seguidos de los corales vivos (23), esponjas (seis) y balanos (una). Por su parte, 13 especies de algas se encontraron creciendo en más de un basibionte (Amphiroa beauvoisii J. V. Lamouroux, A. misakiensis Yendo, Caulerpa cupressoides (Vahl) C. Agardh, C. racemosa (Forsskål) J. Agardh, C. sertularioides (S.G.Gmelin) M. Howe, Cladophora microcladioides Collins, Crusticorallina muricata (Foslie) P.W. Gabrielson, Martone, K.R. Hind & C.P. Jensen, Derbesia marina (Lyngbye) Solier, Gelidium mcnabbianum (E.Y. Dawson) B. Santelices, G. microdentatum E.Y. Dawson, G. pusillum (Stackhouse) Le Jolis, Hildenbrandia rubra (Sommerfelt) Meneghini, Hypnea johnstonii Setchell & N.L. Gardner). Gelidium pusillum (Stackhouse) Le Jolis fue el alga que se encontró en mayor número de basibiontes (moluscos, corales, esponjas y balanos). Para 14 especies de algas, aunque se menciona su condición de epizoicas, no se registra el basibionte donde se encontraron (Apéndice).
Estructuras de fijación
Los resultados de este trabajo muestran que la biodiversidad de algas presente en los sustratos animales es alta. Además, contribuye notablemente a la riqueza específica registrada para Guerrero y para el Pacífico de México. Se hace patente la importancia de desarrollar más estudios que se enfoquen al conocimiento de la epibiosis algal, además de la perspectiva florística, desde el punto de vista de las interacciones ecológicas.
El tipo predominante de forma de adhesión al basibionte fue el de los rizoides que presentaron 76 especies, seguido de los discos basales con 24 (Apéndice). Cabe destacar que 15 especies no presentan ningún tipo de estructura especializada; sin embargo, se sabe que estas algas segregan sustancias cementantes para la fijación al sustrato (algas costrosas). Por último, cinco especies presentaron mucílago (Cyanobacteria) y cuatro utilizan una célula basal como estructura de adhesión al sustrato.
Descripción de nuevos registros
A continuación, se presentan las descripciones de los 12 nuevos registros para Guerrero, de los cuales seis fueron exclusivos para dicho estado (indicados con *); además, tres representan nuevos registros para el Pacífico tropical mexicano (**), mientras que tres especies representan nuevos registros para el Pacífico de México (***). Los talos de algunos de los especímenes descritos se observan en la Figura 2.
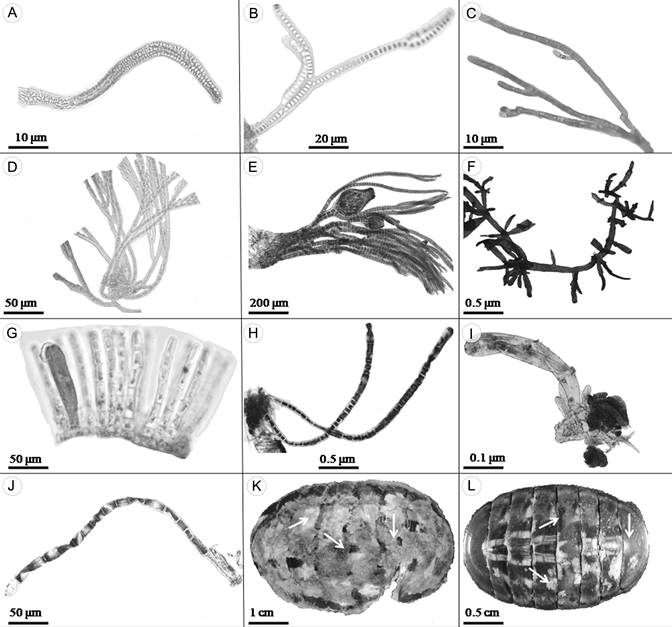
Figura 2: A. Porphyrostromium pulvinatum West & Zuccarello; B. Chroodactylon ornatum (C. Agardh) Basson, filamentos ramificados; C. Colaconema coccineum (K.M. Drew) P.W. Gabrielson; D. Grania pectinata (Kylin) Athanasiadis; E. Polysiphonia pacifica Hollenberg, filamentos con cistocarpos; F. Gelidium pusillum (Stackhouse) Le Jolis; G. Myrionema strangulans Greville; H. Chaetomorpha linum (O.F. Müller) Kützing; I. Siphonocladus sp.; J. Ulothrix flacca (Dillwyn) Thuret; K, L. Chiton articulatus G.B. Sowerby, con algas epibiontes.
CHLOROPHYTA
Cladophorales
Cladophoraceae
*Cladophora laetevirens (Dillwyn) Kützing. Phycologia generalis order Anatomie, Physiologie und Systemkunde der Tange 2: 263. 1843. TIPO: INGLATERRA. Gales, Swansea, Glamorgan, sin colector s.n (holotipo: no localizado).
Talo 1 mm de largo; células apicales 25-3 µm de diámetro, 130-225 µm de longitud, células en las porciones medias 30-50 µm de diámetro, 4-7 diámetros de longitud, hacia la base células 25-40 µm de diámetro, 6-10 diámetros de longitud; ápices redondeados y ligeramente curvados hacia la derecha; ramificación dicotómica hacia la base, se torna unilateral desde la zona media hacia el ápice, de primer o segundo orden de ramificación.
Distribución: Península de Baja California (León Tejera et al., 1993; Serviere-Zaragoza et al., 1993, 1998); Jalisco y Nayarit (León Tejera et al., 1993; Serviere-Zaragoza et al., 1993, 1998).
Hábitat: creciendo en valvas de Chiton articulatus.
Ejemplar examinado: MÉXICO. Guerrero, municipio Zihuatanejo de Azueta, playa El Palmar, 24.VII.2014, L. Aguilar et al. INV-835 (Invertebrados Asociados a Macroalgas, UNAM).
**Cladophora graminea Collins, Rhodora 11: 19. Fig. 6. 1909. TIPO: ESTADOS UNIDOS DE AMÉRICA. California, Monterey Península, Mr. A.E. Bush s.n. (holotipo: no localizado).
Talo en mechones hemisféricos,0.5-1 cm de largo; células apicales 100-500 µm de diámetro; células basales 300-500 µm de diámetro, 20-30 veces más largas; ramas rígidas, en su mayoría largas e ininterrumpidas por ramificaciones a cierta distancia; ramificación dicotómica o tricotómica hacia la base, alterna arriba; ramitas con 1-3 células, estrechándose desde la base hasta el ápice.
Distribución: Baja California, Sonora (Dawson, 1944,1945, 1949, 1951,1953b, 1961b, 1966; Dawson, 1960; Norris, 1975; Huerta, 1978; Littler y Littler, 1981; Aguilar y Bertsh, 1983; Aguilar y Pacheco, 1986; Aguilar et al., 1990).
Hábitat: creciendo en valvas de Chiton articulatus.
Ejemplar examinado: MÉXICO. Guerrero, municipio Zihuatanejo de Azueta, muelle municipal, 26.VII.2014, L. Aguilar et al. INV-825 (Invertebrados asociados a macroalgas, UNAM).
*Chaetomorpha californica Collins, Phycotheca boreali-americana. A collection of dried specimens of the algae of North America: 664. 1900. TIPO: ESTADOS UNIDOS DE AMÉRICA. La Jolla, California, sin colector s.n. (holotipo: NY).
Talos filamentosos, anclados en el extremo proximal por medio de ramas rizoides no separadas que forman un disco; células apicales de diámetro uniforme, 20-25 µm de diámetro, 1-5 veces más largas que anchas; célula basal alargada 100-150 µm de largo; paredes laterales claramente engrosadas en capas.
Distribución: Michoacán, Oaxaca (Dreckmann et al., 1990; León-Tejera et al., 1993).
Hábitat: creciendo en valvas de Chiton articulatus.
Ejemplar examinado: MÉXICO. Guerrero, municipio Zihuatanejo de Azueta, muelle municipal, 01.V.2014, L. Aguilar et al. INV-803 (Invertebrados asociados a macroalgas, UNAM).
*Chaetomorpha linum (O.F. Müller) Kützing, Phycologia germanica: 204. 1845. TIPO: DINAMARCA. Nakskov Fjord, Lolland, sin colector s.n. (holotipo: no localizado). Fig. 2H.
Talos filamentosos, erectos, uniseriados; anclados por medio de ramas rizoidales; células apicales de diámetro uniforme,150-300 µm de diámetro, 1-2 veces más largas que anchas; células cercanas a la base 1-2.5 veces más largas que anchas; célula basal 750-1200 µm de largo.
Distribución: Colima, Jalisco, Nayarit, Oaxaca, Sinaloa y Sonora (Mendoza-González y Mateo-Cid, 1986; Ortega et al., 1987; Mateo-Cid y Mendoza-González, 1992; León-Tejera y González-González, 1993; Serviere-Zaragoza et al., 1993, 1998; Mendoza-González et al., 1994; Dreckmann y Gamboa-Contreras, 1998; Aguilar-Rosas et al., 2002).
Hábitat: creciendo en valvas de Chiton articulatus.
Ejemplares examinados: MÉXICO. Guerrero, municipio Zihuatanejo de Azueta, playa el Palmar, muelle Municipal. 01.V.2014; 02.V.2014, L. Aguilar et al. INV-803, INV-805, INV-816 (Invertebrados asociados a macroalgas, UNAM).
***Chaetomorpha nodosa Kützing, Species algarum: 376. 1849. TIPO: GUYANA FRANCESA. Cayenne, Le Prieur s.n. (holotipo: NY).
Talos filamentosos, aislados o formando grupos de dos a tres individuos, anclados al sustrato por una célula basal recta con base discoide; células apicales redondeadas; célula basal cónica, más larga que ancha, 20-25 μm de diámetro, 2.5-6 diámetros de longitud; el resto de las células con paredes lameladas y leves constricciones, 31-41 μm de diámetro, 0.6-1 diámetros de longitud.
Distribución: Atlántico mexicano (Quiroz et al., 2017). Nuevo registro para el Pacífico mexicano.
Hábitat: creciendo en valvas de Chiton articulatus.
Ejemplar examinado: MÉXICO. Guerrero, municipio Zihuatanejo de Azueta, playa el Palmar 02.V.2014, L. Aguilar et al. INV-816 (Invertebrados asociados a macroalgas, UNAM).
Ulotrichales
Ulotrichaceae
*Ulothrix flacca (Dillwyn) Thuret, Mémoires de la Société Impériale des Sciences Naturelles de Cherbourg 10: 156. 1863. TIPO: INGLATERRA. Gales, Swansea, Glamorgan, sin colector s.n. (lectotipo: BM, K) Fig. 2J.
Talo filamentoso, filamentos uniseriados sin ramificaciones con múltiples septos, 23-39 μm de diámetro; células 10-37 μm de diámetro con paredes anchas, 6-7 μm de ancho, 28-45 μm de largo; cloroplastos en forma de anillo y con disposición parietal en las células; pirenoides 1-2.
Distribución: Michoacán (Stout y Dreckmann, 1993).
Hábitat: creciendo en valvas de Chiton articulatus.
Ejemplar examinado: MÉXICO. Guerrero, municipio Zihuatanejo de Azueta, playa el Palmar 02.V.2014, L. Aguilar et al. INV-816 (Invertebrados asociados a macroalgas, UNAM).
***Urospora penicilliformis (Roth) Areschoug, Nova Acta Regiae Societatis Scientiarum Upsaliensis, Ser. 3 6(2): 16. 1866. TIPO: ALEMANIA. Niedersachsen, Eckwarden, sin colector s.n. (holotipo: no localizado).
Filamentos unidos por rizoides retenidos dentro de las paredes laterales de las células; células multinucleadas, cuadradas a cilíndricas, 38-45 µm de diámetro, de diámetro uniforme; células, 0.5- 1.5 veces más largas que anchas; con cloroplastos reticulados.
Distribución: desde Alaska al sur de California (Abbott y Hollenberg,1976).
Hábitat: creciendo en valvas de Chiton articulatus.
Ejemplar examinado: MÉXICO. Guerrero, municipio Zihuatanejo de Azueta, playa El Palmar 02.V.2014, L. Aguilar et al. INV-816 (Invertebrados asociados a macroalgas, UNAM).
***Urospora penicilliformis (Roth) Areschoug, Nova Acta Regiae Societatis Scientiarum Upsaliensis, Ser. 3 6(2): 16. 1866. TIPO: ALEMANIA. Niedersachsen, Eckwarden, sin colector s.n. (holotipo: no localizado).
Filamentos unidos por rizoides retenidos dentro de las paredes laterales de las células; células multinucleadas, cuadradas a cilíndricas, 38-45 µm de diámetro, de diámetro uniforme; células, 0.5- 1.5 veces más largas que anchas; con cloroplastos reticulados.
Distribución: desde Alaska al sur de California (Abbott y Hollenberg, 1976).
Hábitat: creciendo en valvas de Chiton articulatus.
Ejemplar examinado: MÉXICO. Guerrero, municipio Zihuatanejo de Azueta, playa El Palmar 02.V.2014, L. Aguilar et al. INV-816 (Invertebrados Asociados a Macroalgas, UNAM).
Rhodophyta
Erythropeltales
Erythrotrichiaceae
* Erythrotrichia tetraseriata N.L. Gardner, Botany 13: 240. 1927. TIPO: ESTADOS UNIDOS DE AMÉRICA. California, San Pedro, H. D. Johnston s.n. (holotipo: UC 1110600)
Filamento unido al sustrato por un disco basal; parte inferior del talo uniseriada, conforme se aproximan al ápice se observan cuatro tiras de células cuadradas a irregulares, 8.5-12.5 µm de diámetro, 10-12.5 µm de largo; talo 38-44 µm de diámetro; cloroplastos en forma de banda.
Distribución: Baja California, Jalisco (Dawson, 1951, 1953a, b, 1961b; Norris, 1975; Abbott y Hollenberg, 1976; Pedroche y González-González, 1981; Pacheco y Aguilar, 1984; Aguilar y Pacheco, 1985; Huerta y Mendoza-González, 1985).
Hábitat: creciendo en sutura de la concha de Chiton articulatus.
Ejemplar examinado: MÉXICO. Guerrero, municipio Zihuatanejo de Azueta, muelle municipal, 01.V.2014, L. Aguilar et al. INV-801 (Invertebrados asociados a macroalgas, UNAM).
** Porphyrostromium pulvinatum West & Zuccarello, Journal of Phycology 47(3):633. 2011. TIPO: ESTADOS UNIDOS DE AMÉRICA. Monterey County, Carmel, Pebble Beach Bay, N. L. Gardner 2896 (holotipo: UC1110598). Fig. 2A
Talo pequeño de hasta 1 mm de largo, con una pequeña extensión rizoidal en la base, hacia la base uniseriado, expansión monostromática local conforme se acerca al ápice; filas de 3 células de grosor, células cuadradas 7.5-10 µm de diámetro y 9-12.5 µm de largo.
Distribución: Baja California (Dawson, 1949, 1951, 1953a, 1953b; 1961b; Abbott y Hollenberg, 1976).
Hábitat: creciendo en sutura de Chiton articulatus.
Ejemplar examinado: MÉXICO. Guerrero, municipio Zihuatanejo de Azueta, playa El Palmar, 02.V.2014, L. Aguilar et al. INV-817 (Invertebrados asociados a macroalgas, UNAM).
Acrochaetiales
Acrochaetiaceae
***Colaconema coccineum (K.M. Drew) P.W. Gabrielson, Phycological Contribution 6: 95. 2004.TIPO: ESTADOS UNIDOS DE AMÉRICA. California, San Francisco, Fort Point, 10.IX.1916, N. L. Gardner 3488 (holotipo: UC274015). Fig. 2C
Talo 0.5 mm de largo, con ramificación irregular, con 1-2 órdenes de ramificación; células 6.25-10 µm de diámetro, 1.5-2.5 diámetros de longitud, disminuye conforme se acerca al ápice; un cloroplasto parietal; monosporangios en las ramillas laterales, pedicelados, 5-7.5 µm de diámetro y 8.5-12.5µm de largo.
Distribución: solo costa oeste de Estados Unidos de América y British Columbia, Canadá (Abbott y Hollenberg, 1976).
Hábitat: creciendo en valvas de Chiton articulatus.
Ejemplar examinado: MÉXICO. Guerrero, municipio Zihuatanejo de Azueta, playa El Palmar, 08.I.2014, L. Aguilar et al. INV-796 (Invertebrados asociados a macroalgas, UNAM).
Ceramiales
Rhodomelaceae
*Polysiphonia pacificaHollenberg. American Journal of Botany 29: 777. 1942. TIPO: ESTADOS UNIDOS DE AMÉRICA. California, Santa Cruz, colector: C. L. Anderson s.n (holotipo: NY ). Fig. 2E
Talo rojo oscuro, unido al sustrato por rizoides, ramificación primaria alterna; ejes 55-180 µm de diámetro, que se atenúan conforme se acerca al ápice; presencia de cuatro células pericentrales, 100-220 µm de diámetro, 4-8 diámetros de longitud; tetrasporangios en series en ramas terminales de 60-70 µm de diámetro.
Distribución: Baja California, Michoacán (Hollenberg, 1942; Dawson 1953b, 1961b; Abbott y Hollenberg, 1976; Huerta, 1978; Aguilar, 1981, 1982; Martinell-Benito, 1983, 1986; Aguilar et al., 1985, Huerta y Mendoza-González,1985; Mendoza-González y Mateo-Cid,1985,1986; Treviño-Murphy, 1986; Rodríguez,1989; Sánchez et al., 1989).
Hábitat: creciendo en valvas y suturas de Chiton articulatus.
Ejemplares examinados: MÉXICO. Guerrero, municipio Zihuatanejo de Azueta, playa el Palmar, 20.XI.2014, L. Aguilar et al. INV-852 (Invertebrados Asociados a Macroalgas, UNAM).
Discusión
La riqueza de especies epizoicas del presente trabajo (124) alcanzó alrededor de 12% del registro del número de especies del Pacífico mexicano, de 1100 especies (Pedroche y Sentíes, 2003a). Esto sugiere que esta proporción de algas epizoicas podría incrementarse con un mayor énfasis en la recolección, así como con un esfuerzo dirigido a valorar algunos rasgos funcionales, como los hábitos de vida (epizoismo, epifitismo y epilitismo) en las comunidades de macroalgas (Jänes et al., 2017).
De las especies registradas como epizoicas en el Pacífico tropical mexicano, las algas rojas fueron las más diversas, seguidas de las verdes y en menor número las pardas, así como las cianobacterias. Esta relación proporcional entre los diferentes grupos algales coincidió con lo registrado por otros autores para los inventarios florísticos en localidades de distintos estados del Pacífico tropical mexicano (Mateo-Cid y Mendoza-González, 1991, 1992, 2002, 2012; Mendoza-González y Mateo-Cid, 1992, 1996, 1998; Pedroche y Sentíes, 2003a, b; Vega et al., 2008; Dreckmann et al., 2006; Mendoza-González et al., 1994, 2011), e inclusive en las costas del Pacífico donde un estudio a largo plazo demostró que Rhodophyta fue la división más diversa, la cual alcanzó 66.6% (Lin et al., 2018). Las algas rojas presentan un marcado cambio en su riqueza desde el ecuador hasta mares más fríos, siendo mayor en las zonas tropicales (Lee, 2008), de la misma manera que se presenta en la ficoflora del Pacífico tropical mexicano.
Las familias de algas mejor representadas fueron Corallinaceae, Rhodomelaceae y Cladophoraceae, lo cual coincidió con estudios previos en México (Mateo-Cid y Mendoza-González, 1991, 1992, 2002, 2012; Mendoza-González y Mateo-Cid, 1992, 1996, 1998; Pedroche y Sentíes, 2003a, b; Mendoza-González et al., 1994, 2011; Vega et al., 2008).
De las 124 especies de algas reportadas en este estudio, 12 representan nuevos registros para el estado de Guerrero, tres de ellos también lo son para las costas del Pacífico tropical mexicano, así como tres para las costas del Pacífico mexicano. Cabe mencionar que es la primera vez que se registra el género Siphonocladus F. Schmitz para el estado, por lo que se considera importante profundizar en la manifestación de sus caracteres morfológicos, a fin de permitir una adecuada determinación específica, dado que el género ha sufrido importantes cambios nomenclaturales (Guiry y Guiry, 2020).
En cuanto a los nuevos registros para Guerrero, Erythrotrichia tetraseriata estaba registrada para Baja California y Jalisco (Dawson 1951, 1953a, b, 1961b; Norris, 1975; Abbott y Hollenberg, 1976; Pedroche y González-González, 1981; Pacheco y Aguilar, 1984; Aguilar y Pacheco, 1985; Huerta y Mendoza-González, 1985), Polysiphonia pacifica para Baja California y Michoacán (Hollenberg, 1942; Dawson, 1953b, 1961b; Abbott y Hollenberg, 1976; Huerta, 1978; Aguilar, 1981, 1982; Martinell-Benito, 1983, 1986; Aguilar y Pacheco, 1985; Huerta y Mendoza-González, 1985; Mendoza-González y Mateo-Cid, 1985, 1986; Treviño-Murphy, 1986; Rodríguez, 1989; Sánchez et al., 1989), Cladophora laetevirens para el norte del Pacífico tropical mexicano así como en la Península de Baja California (León Tejera et al., 1993; Serviere-Zaragoza et al., 1993, 1998), y Chaetomorpha linum y C. californica se registraron previamente en Colima, Michoacán, Nayarit, Oaxaca , Sinaloa y Sonora (Mendoza-González y Mateo-Cid, 1986; Ortega et al., 1987; Dreckmann et al., 1990; Mateo-Cid y Mendoza-González, 1992; León-Tejera y González-González, 1993; León-Tejera et al., 1993; Serviere-Zaragoza et al., 1993, 1998; Mendoza-González et al., 1994; Dreckmann y Gamboa Contreras, 1998; Aguilar et al., 2002). Finalmente, Ulothrix flacca se había registrado para Michoacán (Stout y Dreckmann, 1993). La ampliación del área de distribución hacia el estado de Guerrero de todas estas especies puede relacionarse con la falta de muestreos en el área de estudio, o a que son individuos de tallas pequeñas como es el caso de las anteriormente mencionadas, lo que confirma la importancia del estudio de otros sustratos como los animales en el conocimiento de la biodiversidad algal.
Como nuevo registro para el Pacífico tropical mexicano se presentan a Cladophora graminea, Urospora wormskioldii y Porphyrostronium pulvinatum, especies previamente registradas para Baja California Norte, Baja California Sur y parte de Sonora (Dawson, 1944, 1945, 1949, 1951, 1953a, b, 1960, 1961b, 1966; Norris, 1975; Abbott y Hollenberg, 1976; Huerta, 1978; Littler y Littler, 1981; Aguilar y Bertsh, 1983; Aguilar y Pacheco, 1986; Aguilar et al., 1990; Pedroche et al., 2005). En relación con los nuevos registros para el Pacífico mexicano, las especies Colaconema coccineum y Urospora penicilliformis han sido reportadas anteriormente solo en localidades templadas del norte y sur del Pacífico americano (Abbott y Hollenberg, 1976). En el caso de Chaetomorpha nodosa, es una especie recientemente señalada como parte de la flora del Atlántico mexicano por Quiroz-González et al. (2017). La presencia de estas especies en las localidades del estado de Guerrero, además de relacionarse con una falta de muestreo previo en este estado, podría vincularse con la capacidad de dispersión y colonización de estos talos sobre diferentes sitios. Esto ocurre con Urospora penicilliformis, una especie típica de aguas templadas y frías, con un rango de crecimiento óptimo de 5-15 °C, pero que puede tolerar temperaturas de 24-26 °C (Rico et al., 2003). Su llegada a las costas del Pacífico tropical mexicano podría explicarse por su capacidad para tolerar diversos rangos de radiación UV y de temperatura superiores al óptimo (Roleda et al., 2009). En Guerrero, estado donde se hace el registro de esta especie, los rangos de temperatura del agua oscilan entre 25-28 °C en la temporada de secas, pudiendo alcanzar hasta 30 °C en lluvias, momento del año en el que se registró dicha especie, lo que indicó que ésta ha alcanzado rangos de tolerancia superiores a los registrados previamente por Rico et al. (2003). Además, cabe mencionar que no es la primera vez que se registra en aguas tropicales de México, ya que García-López et al. (2017) la ubicaron en las costas de Veracruz. Esto también ocurre con Chaetomorpha nodosa, especie previamente registrada en el Golfo de México por Quiroz et al. (2017). La ampliación de la distribución de especies previamente registradas en ambientes templados podría vincularse al transporte accidental de organismos como parte de la flora y fauna incrustantes en los cascos de embarcaciones que se trasladan constantemente entre continentes y regiones (Aguilar et al., 2014).
Es importante destacar que Chaetomorpha linum es la especie más comúnmente registrada como epizoica, tanto en vertebrados como en invertebrados en distintos trabajos (Sentíes et al., 1999; Báez, 2002; Levenets, 2010; Martins et al., 2014), en regiones templadas y tropicales, cuya presencia puede deberse a su condición como especie oportunista (Sorce et al., 2018), misma que además puede ser indicadora de ambientes eutrofizados. En este trabajo, C. linum se registró en el muelle municipal que, de acuerdo con otros autores (Aguilar-Estrada et al., 2017; López et al., 2017), es un área contaminada y con altas tasas de sedimentación, por lo que la presencia de esta especie de alga verde podría ser un indicador de procesos de eutrofización.
Las diferencias entre las especies de algas registradas en Chiton articulatus y las reportadas en la literatura como epizoicas se deben a que estas últimas fueron registradas en mayor número de sustratos y localidades, sin restringirse a una sola especie de basibionte como es la cucaracha de mar.
Principalmente las especies Cladophora laetevirens, Chaetomorpha linum, Urospora penicilliformis y Ulothrix flacca, mencionadas como nuevos registros, han sido objeto de controversias taxonómicas, por lo que es importante considerar futuros tratamientos moleculares y morfológicos para tener certidumbre de la identidad de esos taxones.
Guerrero presentó el mayor número de registros de algas epizoicas, lo que representa 36% del inventario florístico para el estado de acuerdo con otros autores (Pedroche y Sentíes, 2003a; Mateo-Cid y Mendoza-González, 2012). A pesar de que Pedroche y Sentíes (2003b) mencionaron que los estados con la mayor riqueza de algas son Oaxaca (222) y Nayarit (213), estos no presentaron tantos registros de algas epizoicas. Esto fue probablemente causado por los diferentes objetivos de los estudios y en consecuencia por los diferentes tipos de muestreos seguidos, enfocados principalmente a la recolección de algas en el intermareal rocoso para la elaboración de ficofloras que dejan de lado a otros sustratos como los animales.
De las especies registradas en este trabajo, algunas han sido señaladas como epizoicas en otras regiones del mundo, donde la interacción se ha documentado mayormente entre las algas y organismos vertebrados como tortugas y peces (Ballantine et al., 2001; Báez et al. 2002; Báez y Flores-Moya, 2003).
Por ejemplo, se comparten seis especies del presente trabajo con el estudio llevado a cabo por Ballantine et al. (2001) de algas epizoicas en peces escorpión en Puerto Rico (Scytonematopsis crustacea (Thuret ex Bornet & Flahault) Koválik & Komárek, Centroceras clavulatum, Champia parvula, Chroodactylon ornatum (C. Agardh) Bason, Erythrotrichia carnea (Dillwyn) C. Agardh y Sahlingia subintegra (Rosenvinge) Kornmann), mientras que al comparar con los trabajos realizados por Báez et al. (2002) y Báez y Flores-Moya (2003) de la flora que crece en peces espada y tortugas del Mediterráneo, sólo hubo tres especies coincidentes (Chaetomorpha linum, Ectocarpus siliculosus y Sphacelaria tribuloides).
Además, se han llevado a cabo varios trabajos que han evaluado la interacción entre algas y moluscos, sustrato que de acuerdo con Wahl (2008) es uno de los más recurrentes para las algas.Levenets et al. (2010) observaron sobre moluscos pectínidos de Japón, 51 especies de algas epibiontes, de las cuales Chaetomorpha linum, Derbesia marina (Lyngbye) Soliery y Erythrotrichia carnea coinciden con el presente estudio. Así mismo, sobre Ceratozona squalida C.B. Adams 1845 de Florida (Connelly y Turner, 2009), se registraron 27 especies de algas epizoicas de las cuales Chaetomorpha antennina y Ulva flexuosa Wulfen también se presentan en este trabajo. Chaetomorpha linum y Cladophora laetevirens, especies consideradas cosmopolitas, fueron igualmente registradas en Argentina como epibiontes de la lapa Patella aspera Röding 1798 por Martins et al. (2014).
Respecto a los tres estudios realizados en México, Sentíes et al. (1999) reportaron a Chaetomorpha linum, Sphacelaria tribuloides, Centroceras clavulatum, Erytrotrichia carnea y Champia parvula sobre tortugas marinas en el Caribe. Estas algas también fueron registradas en el presente estudio. Hernández-Vázquez y Valadez-González (1998), y recientemente Álvarez-Cerillo et al. (2017), registraron a las algas a nivel de grupo morfofuncional sin ahondar en la identidad de los taxones, destacando la presencia de filamentos y costras en tortugas marinas y quitones, respectivamente. Por otro lado, es importante mencionar que en algunos estudios no se especifica el tipo de sustrato sobre el que se encuentran las algas y es aún más frecuente que se proporcionen datos acerca de especies que son epífitas que aquellas que son epizoicas.
En este estudio solo 17 especies epizoicas aparecieron sin descripción del basibionte y fueron los moluscos los que presentaron la mayor cantidad de especies algales epizoicas, sin especificación de los taxa incluidos, a excepción de Chiton articulatus estudiado aquí.
Con relación a los grupos morfofuncionales que presentaron las algas epizoicas aquí registradas (124 especies), la gran mayoría se encuentra entre los filamentos (43.6%), los filamentos corticados (20.6%) y las costras (15.8%), sumando 80% del total. La presencia mayoritaria de los filamentos indica ensambles algales soportados por especies anuales y oportunistas de rápido crecimiento, complementados por especies perennes, sucesionales tardías y de crecimiento lento como son los filamentos corticados y las costras (Steneck y Dethier, 1994).
Debido a que la mayor parte de las algas bentónicas se adhieren al sustrato por medio de distintas estructuras como rizoides, discos y hápteros, o a partir de sustancias cementantes (algas pardas costrosas), su presencia en la mayoría de los casos está asociada a distintas rocas y guijarros, donde diferentes características, como la estructura física del sustrato, la dureza y el grado de compactación, juegan un papel muy importante en la distribución de las algas marinas (Santelices, 1977). Esto puede explicar la predominancia de los moluscos como sustratos para las algas, ya que las conchas de estos organismos presentan un alto grado de dureza debido a su conformación con carbonato de calcio y proteínas (Hickman, 2013; Heller, 2015).
Por otra parte, se han reportado especies de algas creciendo sobre coral vivo (Vázquez-Texocotitla, 2013); estos parecen representar un sustrato óptimo para el establecimiento de algas (Díaz-Pulido y McCook, 2004). Se registraron seis especies de algas creciendo sobre esponjas, las cuales tienen una superficie bastante heterogénea en términos de relieve, por lo que puede proporcionar a las algas un sitio adecuado para el desarrollo de los propágulos y germinación de las esporas, así como un espacio para la protección y fijación de los talos, reduciendo el desprendimiento de estos por el efecto de las olas y las corrientes (Arias et al., 2006; Passarelli et al., 2014; Gastaldi et al., 2015).
Generalmente, los epibiontes presentan tallas pequeñas lo que los convierte en organismos poco conspicuos al momento de realizar un inventario florístico (Mendoza-González et al., 2011), por lo que muy probablemente su abundancia y diversidad han sido subestimadaa. Esto coincide con que gran parte de las especies registradas como epizoicas en el presente trabajo son pequeñas, incluyendo entre ellas a la mayoría de las especies de la familia Rhodomelaceae, que es la mejor representada en cuanto a número de especies.
Conclusiones
La epibiosis constituye un componente importante en el estudio de la estructura de las comunidades marinas bentónicas; sin embargo, son escasos los estudios realizados, siendo predominantes los reportes de epifitismo y en muy pocos casos de los organismos epizoicos. Por ello es importante desarrollar más estudios que se enfoquen al conocimiento de este tipo de epibiosis algal.
Los resultados de este trabajo muestran que la biodiversidad de algas presente en los sustratos animales es alta; además contribuye notablemente a la riqueza específica registrada para Guerrero y para el Pacífico de México. Se hace patente la importancia de desarrollar más estudios que se enfoquen al conocimiento de la epibiosis algal, además de la perspectiva florística, desde el punto de vista de las interacciones ecológicas.











 nueva página del texto (beta)
nueva página del texto (beta)




