Introducción
El consumo del café en los últimos años se ha incrementado en el mundo (Quintero-Rizzuto y Rosales, 2014). No obstante, México ha perdido su posición mercantil. En 1990, las exportaciones mexicanas fueron del orden de 220,980 toneladas año-1, las cuales en 2016 fueron superadas por Brasil con 1,016,160 toneladas año-1, Colombia con 836,640 toneladas año-1, Indonesia con 414,180 toneladas año-1 y Costa de Marfil con 256,980 toneladas año-1 (ICO, 2018). Asimismo, otros países como los Estados Unidos de América, China e Italia están también incursionando en la producción de café como resultado de nuevos cultivares y la visión futurista de algunos emprendedores (Ayala, 2017; Heinze, 2018; Laiacona, 2018).
En México, la producción del grano de café se concentra mayormente en los estados de Chiapas, Veracruz y Puebla (Flores, 2015). En Chiapas el cultivo del cafeto es fundamental para la economía de la población indígena y campesina (Anta Fonseca, 2006; Mariscal, 2011) y éste estado ha sido pionero en cafeticultura orgánica (Barrera y Parra, 2000). En particular, en la región del Soconusco, Chiapas, el cultivo del cafeto es uno de los más importantes. Sin embargo, enfrenta plagas como la roya (Hemileia vastatrix Berk. & Broome) y la broca (Hypothenemus hampei Ferrari) (DGSV-CNRF, 2015), además de que muchas veces crece en suelos con elevada acidez y baja disponibilidad de fósforo que también limitan su producción (FAO, 2015).
El costo de la producción de café de altura también se ha incrementado, debido a que los problemas fitopatológicos en el cafeto son cada vez más frecuentes y obligan a los productores a cambiar sus plantaciones de la especie arábica (Coffea arabica L.) por la especie robusta (Coffea canephora L.) (Bertolini et al., 2018), que es menos susceptible y más productiva. No obstante, el cultivo del café arábica bajo un manejo orgánico podría reducir la pérdida de la producción por problemas fitopatológicos, sobre todo si este manejo agronómico se combina con el uso de inóculos microbianos nativos que coadyuven al desarrollo de los cafetos, como es el caso de los hongos micorrizógenos arbusculares (HMA) (Dobo et al., 2018; Herrera et al., 2019; Prates et al., 2019). Estos hongos pertenecen al phylum Glomeromycota y se asocian con más de 80% de las plantas formando la micorriza arbuscular en las raíces (Smith y Read, 2008). En esta asociación, los hongos reciben de la planta hospedera hidratos de carbono y un hábitat para completar su ciclo de vida, al mismo tiempo que contribuyen a mejorar el estado nutrimental y la hidratación de su hospedero, además de protegerlo de fitopatógenos (Smith y Read, 2008; Cuenca, 2015). Posada et al. (2016) indican que los cafetales, con policultivo o árboles de sombra, albergan más diversidad de HMA que los bosques nativos, reportando hasta 79 especies de estos hongos en plantaciones de C. arabica en Veracruz, México. Asimismo, hay evidencia de que los HMA favorecen el desarrollo y rendimiento del cultivo del cafeto en términos de un mayor crecimiento y mejor estado nutrimental de las plantas (Vaast et al., 1997; de Almeida et al., 2003; Adriano Anaya et al., 2011; Trejo et al., 2011; Perea-Rojas et al., 2019). No obstante, su efectividad depende de la composición del inóculo micorrícico y de su compatibilidad con el hospedero (Van der Heijden y Sanders, 2002; Trejo et al., 2011). Además, el tipo de manejo agronómico puede modificar la riqueza y composición de HMA (Arias et al., 2012; Dobo et al., 2018) en conjunto con las características edáficas propias de cada sitio donde se localiza la plantación (de Beenhouwer et al., 2015; Posada et al., 2016; Prates et al., 2019). De esta manera, se esperaría que distintas plantaciones de café podrían albergar una comunidad de HMA diferente en su rizosfera, dependiendo de la especie de café cultivada y también de la fertilidad del suelo donde se desarrollan.
En la región cafetalera del Soconusco, Chiapas, México, se conoce muy poco acerca de los simbiontes del cafeto. Recientemente, Bertolini et al. (2018) realizaron un estudio sobre las comunidades de HMA en plantaciones de café robusta (Coffea canephora), documentando 20 morfoespecies incluyendo cinco nuevos registros de HMA asociados a su rizósfera, y cuya composición específica está ligada a la acidez y disponibilidad de fósforo en el suelo. No obstante, es también critico documentar la interacción de la especie arábica con los HMA como un primer paso exploratorio para detectar cuales especies pudieran ser aisladas y a futuro empleadas como biofertilizantes, y que permitan a las plantaciones arábicas subsistir en la cafeticultura del Soconusco, debido a su alto valor económico y cultural. Además, el conocimiento y empleo de HMA nativos resultarían cruciales para la conservación de la biodiversidad del suelo y podrían garantizar con mayor probabilidad la efectividad de los HMA en el desarrollo de los cafetos (Adriano-Anaya et al., 2011). Por lo tanto, los objetivos de este trabajo fueron: 1) Estimar la diversidad de morfoespecies de HMA en el suelo rizosférico de C. arabica, y 2) Examinar su relación con las características edáficas en plantaciones ubicadas en las faldas del volcán Tacaná en el Soconusco, Chiapas, México.
Materiales y Métodos
Las plantaciones cafetaleras elegidas para este estudio están en las proximidades del volcán Tacaná, en la región del Soconusco, al sur de Chiapas, México. El volcán Tacaná se ubica entre los límites de México y Guatemala entre los 15°07ꞌ48ꞌꞌ N y 92°06ꞌ45ꞌꞌ O, y en el territorio mexicano está al noroeste de Tapachula, Chiapas (Fig. 1). En las faldas del Volcán, donde se ubica el área de este estudio, los tipos de vegetación originales son el bosque mesófilo de montaña y la selva alta perennifolia; ambos han sido transformados para el cultivo del cafeto y en menor grado para agricultura y potreros (Martínez-Camilo y Martínez-Meléndez, 2010). El suelo es de origen volcánico con elevada concentración de hierro y aluminio, así como alta fijación de fosfatos; se clasifica como Andosol úmbrico (WRB, 2014). El clima es templado húmedo con abundantes lluvias en verano y hasta 3640 mm de precipitación anual y una temperatura media anual de 20.7 °C (SMN, 2019).

Figura 1: Ubicación geográfica de los sitios de recolecta del suelo en los municipios Cacahoatán y Tapachula, Chiapas, México, en donde se localizan las cinco plantaciones de café (Coffea arabica L.) cultivadas en los alrededores del volcán Tacaná. Plantaciones examinadas: P=Peloponeso (15°8ꞌ44.4ꞌꞌ N, 92°14ꞌ50.7ꞌꞌ, altitud 1648 m s.n.m.); M=Montecristo (15°5ꞌ37.2ꞌꞌ N, 92°7ꞌ28.2ꞌꞌ, altitud 1752 m s.n.m.); Ch=Chiquihuites (15°5ꞌ35.4ꞌꞌ N, 92°5ꞌ47.3ꞌꞌ, altitud 2004 m s.n.m.); FPP=Finca Perú-París (15°8ꞌ3.6ꞌꞌ N, 92°16ꞌ0.9ꞌꞌ, altitud 1059 m s.n.m.); BN=Barrio Nuevo (15°4ꞌ33.8ꞌꞌ N, 92°6ꞌ27ꞌꞌ, altitud 1434 m s.n.m.).
Entre los meses de octubre y noviembre de 2017, se recolectaron muestras de suelo rizosférico asociado a plantas de cafeto de altura (Coffea arabica), en cinco diferentes plantaciones cafetaleras en los municipios Cacahoatán y Tapachula: Peloponeso, Montecristo, Chiquihuites, Finca Perú-París y Barrio Nuevo; todas localizadas en las faldas del volcán Tacaná en altitudes de entre 1000 y 1800 m s.n.m. (Fig. 1). En cada plantación se recolectaron tres muestras simples de suelo de aproximadamente 300 g cada una, obtenidas al pie de tres diferentes cafetos a una profundidad de 20 cm y a una distancia aproximada de 400 m entre sí. Con el propósito de registrar abundante esporulación, el muestreo se llevó a cabo durante el periodo de más escasa precipitación, que corresponde al trimestre de octubre-diciembre, previo a la etapa productiva del cafeto (SMN, 2019). El manejo de los cafetales de donde se recolectaron las muestras es de bajo recurso tecnológico, con régimen de sombra parcial realizada a través de podas a los árboles de sombra (Inga spp.), sin fertilización, sin deshierbes, sin aplicación de agroquímicos y en donde, de acuerdo con Moguel y Toledo (1999), se producen en promedio 1000 kg de café por año. Estas características fueron cruciales para que el suelo fuese lo más conservado posible, garantizando en condiciones de campo la presencia de HMA nativos.
Las esporas de HMA se extrajeron con la técnica de tamizado húmedo y decantación (Gerdemann y Nicolson, 1963) modificada por Brundrett et al. (1996), usando 100 g de suelo por cada muestra. Las esporas fueron separadas del material mineral y orgánico del suelo por medio de agitación mecánica seguida de centrifugación (Uco, Mod. 8724E, New Jersey, EUA) a 2500 r.p.m. (revoluciones por minuto) en agua, una segunda centrifugación a 1200 r.p.m. en una solución de sacarosa al 60% y decantación en un tamiz con malla de 44 µm. Cada extracción se puso en una caja de Petri dividida en cuadrantes (0.5 × 0.5 cm) para aislar las esporas de HMA, considerando sólo aquellas con contenido y coloración homogénea. Las esporas se observaron en un estereomicroscopio (AmScope, SM-1BN-64S, California, EUA) y fueron agrupadas por color, forma y tamaño. La abundancia de las esporas de HMA se determinó mediante conteo directo. Las esporas se colocaron en preparaciones permanentes, usando alcohol polivinílico lactoglicerol (PVLG) y PVLG más reactivo de Melzer (1:1, v/v (volumen/volumen)) como líquidos de montaje, según lo recomendado por la International Culture Collection of (Vesicular) Arbuscular Mycorrhizal Fungi (INVAM, 2018).
Las preparaciones permanentes de las esporas de HMA se observaron en un microscopio óptico (Olympus BX51, Tokyo, Japón) equipado con luz polarizada e iluminación Nomarski, para examinar y contrastar las capas que componen su pared y así determinar tamaño, consistencia, arreglo, reacción al reactivo de Melzer, presencia de ornamentaciones, escudos de germinación y tipo de hifa. Estas características morfológicas fueron la base para la determinación taxonómica de los HMA, considerando las descripciones especializadas de las especies reportadas a nivel mundial en el sitio web http://www.amf-phylogeny.com/ (Schüβler, 2018) y en la International Culture Collection of (Vesicular) Arbuscular Mycorrhizal Fungi (INVAM, 2018). Para la nomenclatura taxonómica se siguió la propuesta de Schüßler y Walker (2010). Las preparaciones están resguardadas en el Laboratorio de Biosistemática de Leguminosas, Departamento de Biología, Universidad Autónoma Metropolitana-Iztapalapa.
La abundancia se determinó contando el total de esporas de HMA en 100 g de suelo y la riqueza de especies como el número de especies de HMA observadas, esto para cada plantación. La diversidad se estimó con dos índices: 1) El de Shannon-Wiener (H’) mediante la fórmula: H’=-Σρi × ln ρi; en donde Σ es la sumatoria de ρi, que corresponde a la abundancia relativa de cada especie (ρi=número de esporas de la especie i entre la abundancia total de esporas) y ln es el logaritmo natural y 2) El de Simpson (λ) que se calculó como: λ=Σρi2; en donde ρi es la abundancia proporcional de cada especie. La comparación de la composición de morfoespecies de HMA entre plantaciones se hizo con el índice de similitud de Bray-Curtis, que indica el reemplazo de especies entre comunidades y considera la abundancia relativa de las especies (Moreno, 2001).
El ambiente edáfico se caracterizó mediante el análisis físico y químico de las muestras de suelo provenientes de las cinco plantaciones cafetaleras en estudio. Los análisis se llevaron a cabo en el Laboratorio Institucional Acreditado, de Análisis de Suelos y Plantas de ECOSUR (El Colegio de la Frontera Sur), San Cristóbal, Chiapas siguiendo la NOM-012- SEMARNAT-2000 (SEMARNAT, 2002). El pH activo del suelo se determinó con un potenciómetro equipado con un electrodo Orion StarA111 (Texas, EUA), en una suspensión de suelo: agua destilada en proporción 1:2 (p/v). La conductividad eléctrica (CE) se determinó por extracto de saturación y filtración al vacío de una pasta de suelo saturada con agua destilada y se midió con un conductímetro Orion StarA212 (Texas, EUA). La materia orgánica del suelo (MOS) se cuantificó por el procedimiento de Walkley y Black (1934) y a partir de ésta se estimó el carbono orgánico del suelo (COS). El nitrógeno total (Nt) se determinó con una digestión ácida semi-micro de Kjeldahl (Bremmer y Mulvaney, 1982), seguida de un análisis colorimétrico en un auto-analizador Braun+Luiebbe III, (Frankfurt, Alemania; Technicon, 1977). Se obtuvo el cociente carbono-nitrogeno (C:N) dividiendo la concentración de COS entre la del Nt. El fósforo disponible (PO4 -3) del suelo se extrajo con NaHCO3 (pH=8.5) y se determinó de acuerdo con Olsen et al. (1954). La textura del suelo se determinó con el hidrómetro de Bouyoucos Gilson, SA-2 (Ohio, EUA; Bouyoucos, 1962) y la capacidad de intercambio catiónico (CIC) por el método del acetato de amonio (Rhoades, 1982). Todos los datos fueron expresados en peso seco de suelo.
Un análisis de varianza (ANOVA) seguido de una prueba de medias Tukey se utilizó para detectar diferencias en abundancia de esporas, riqueza y diversidad de morfoespecies y propiedades del suelo entre las plantaciones. Previo al ANOVA se verificó que los datos cumplieran los supuestos de la distribución normal y, en su caso, estos se ajustaron mediante transformaciones logarítmicas (Sokal y Rohlf, 1995). La significancia del dendograma de similitud se determinó mediante un ANOSIM (análisis de similitud) para comparar la composición de especies de HMA entre las plantaciones. La relación entre los HMA y las propiedades del suelo fue explorada con un análisis de correspondencia canónica (ACC). Los análisis se realizaron con el programa PAST v. 3.25 (Hammer et al., 2001) y XLSTAT v. 2018.7 (Addinsoft, 2018) y en todos los casos una p≤0.05 fue considerada como significativa.
Resultados
Las plantaciones de café Barrio Nuevo y Peloponeso registraron la mayor abundancia de HMA en 100 g de suelo seco, con valores promedio de 198 y 126 esporas, respectivamente; mientras que Chiquihuites y Finca Perú-París tuvieron valores intermedios de 104 y 76 esporas, respectivamente. La plantación Montecristo registró la menor abundancia con 55 esporas (Fig. 2A).

Figura 2: Abundancia, riqueza y diversidad de hongos micorrizógenos arbusculares (HMA) en cinco diferentes plantaciones de café (Coffea arabica L.) cultivadas en los alrededores del volcán Tacaná, Chiapas, México. Las barras son promedios (± error estándar) seguidos de letras distintas son estadísticamente diferentes entre plantaciones (Tukey=p≤0.05). Nivel de significancia: *p≤0.01, **p≤0.001, ***p≤0.0001.
Las plantaciones con la mayor riqueza de morfoespecies, tanto promedio como observada, fueron Barrio Nuevo y Chiquihuites seguidas por Finca Perú-París; mientras que Peloponeso y Montecristo presentaron los valores más bajos (Cuadro 1; Fig. 2B). Las plantaciones con los índices de Shannon-Wiener más altos fueron Chiquihuites, seguida de Barrio Nuevo y la Finca Perú-París; mientras que Peloponeso y Montecristo registraron los menores índices de diversidad (Fig. 2C). En contraste, el índice de diversidad de Simpson mostró un patrón opuesto al de Shannon-Wiener, en donde las plantaciones Peloponeso y Montecristo tuvieron los mayores valores y la plantación Chiquihuites registró el menor valor del índice de Simpson (Fig. 2D).
Cuadro 1: Presencia-ausencia de morfoespecies de hongos micorrizógenos arbusculares (HMA) en cinco diferentes plantaciones de café (Coffea arabica L.) cultivadas en los alrededores del volcán Tacaná, y en plantaciones de café robusta, en la región del Soconusco, Chiapas, México. *Datos obtenidos de Bertolini et al. (2018). A Nuevo registro para Chiapas y México.
| Especies de HMA | Plantaciones de café arábica (C. arabica L.) | Plantaciones de café robusta* C. canephora L. | ||||
|---|---|---|---|---|---|---|
| Pelopo-neso | Monte-cristo | Chiqui-huites | Finca Perú-París | Barrio Nuevo | ||
| Acaulospora denticulata Sieverd. & S. Toro | x | x | ||||
| Acaulospora excavata Ingleby & C. Walker | x | x | x | |||
| Acaulospora foveata Trappe & Janos, | x | x | x | |||
| Acaulospora mellea Spain & N.C. Schenck | x | x | x | x | x | x |
| Acaulospora rehmii (Sieverd. & S. Toro | x | x | ||||
| Acaulospora scrobiculata Trappe | x | x | ||||
| Acaulospora spinosa C. Walker & Trappe | x | x | x | |||
| Acaulospora sp. 1 | x | x | x | x | ||
| Acaulospora sp. 2 (tipo entrophosporoide) | x | x | x | |||
| Acaulospora sp. 3 “laberintos” | x | x | ||||
| Ambispora appendicula C. Walker | x | |||||
| Ambispora reticulata A Oehl & Sieverd | x | x | x | |||
| Claroideoglomus claroideum C. Walker & Schuessler | x | x | x | x | ||
| Entrophospora infrequens R.N. Ames & R.W. Schneid | x | |||||
| Funneliformis geosporum C. Walker & Schuessler | x | x | ||||
| Funneliformis mosseae C. Walker & Schuessler | x | |||||
| Gigaspora gigantea Gerd. & Trappe, | x | x | ||||
| Glomus macrocarpum Tul. & C. Tul. | x | x | x | |||
| Glomus trufemii B.T. Goto, G.A. Silva & Oehl | x | x | x | x | ||
| Glomus sp. 1 “tinción rojiza” | x | x | ||||
| Glomus sp. 2 “ornamentado con espinas” (Glomeral) | x | |||||
| Sclerocystis sinuosa Gerd. & B.K. Bakshi | x | x | x | |||
| Sclerocystis taiwanensis C.G. Wu & Z.C. Chen | x | x | ||||
| Sclerocystis sp. | x | |||||
| Scutellospora calospora C. Walker & F.E. Sanders | x | |||||
| Scutellospora sp. “capa interna rosa” en Melzer | x | x | ||||
| Paraglomus sp. | x | x | ||||
| Riqueza de morfoespecies por sitio | 7 | 7 | 15 | 11 | 16 | |
| Riqueza total de morfoespecies | 27 | 20 | ||||
| Morfoespecies compartidas (arábica vs. robusta) | 9 | |||||
El análisis morfológico convencional de las esporas de HMA reveló la presencia de 27 morfoespecies de HMA pertenecientes a 10 géneros. Del total de morfoespecies detectadas, 19 se identificaron a nivel de especie y ocho a nivel de género (Cuadro 1; Fig. 3). El género con mayor número de morfoespecies fue Acaulospora Trappe & Gerd. (10), seguido de Glomus Tul. & C. Tul. (4), mientras que en los demás géneros se registraron entre una y tres morfoespecies. Las morfoespecies exclusivas de alguna de las plantaciones fueron: Acaulospora scrobiculata Trappe, Funneliformis mosseae C. Walker & Schuessler, Sclerocystis sp., S. taiwanensis C. G. Wu & Z. C. Chen, Scutellospora calospora C. Walker & F. E. Sanders y un Glomeral (Glomus sp.1) no identificado (Cuadro 1). Cabe resaltar que Ambispora reticulata Oehl & Sieverd corresponde a un nuevo registro para México y para el estado de Chiapas (Fig. 3I). La composición de morfoespecies de HMA (diversidad β) mostró que los suelos de las plantaciones forman tres grupos en función de su similitud en composición de morfoespecies, el primero corresponde a las plantaciones de Barrio Nuevo y Peloponeso con 74% de similitud, el segundo a Montecristo y Finca Perú-París con 56% y el tercero a Chiquihuites, la cual difirió en 94 y 96% en su composición de HMA de los otros dos grupos, respectivamente (Fig. 4).
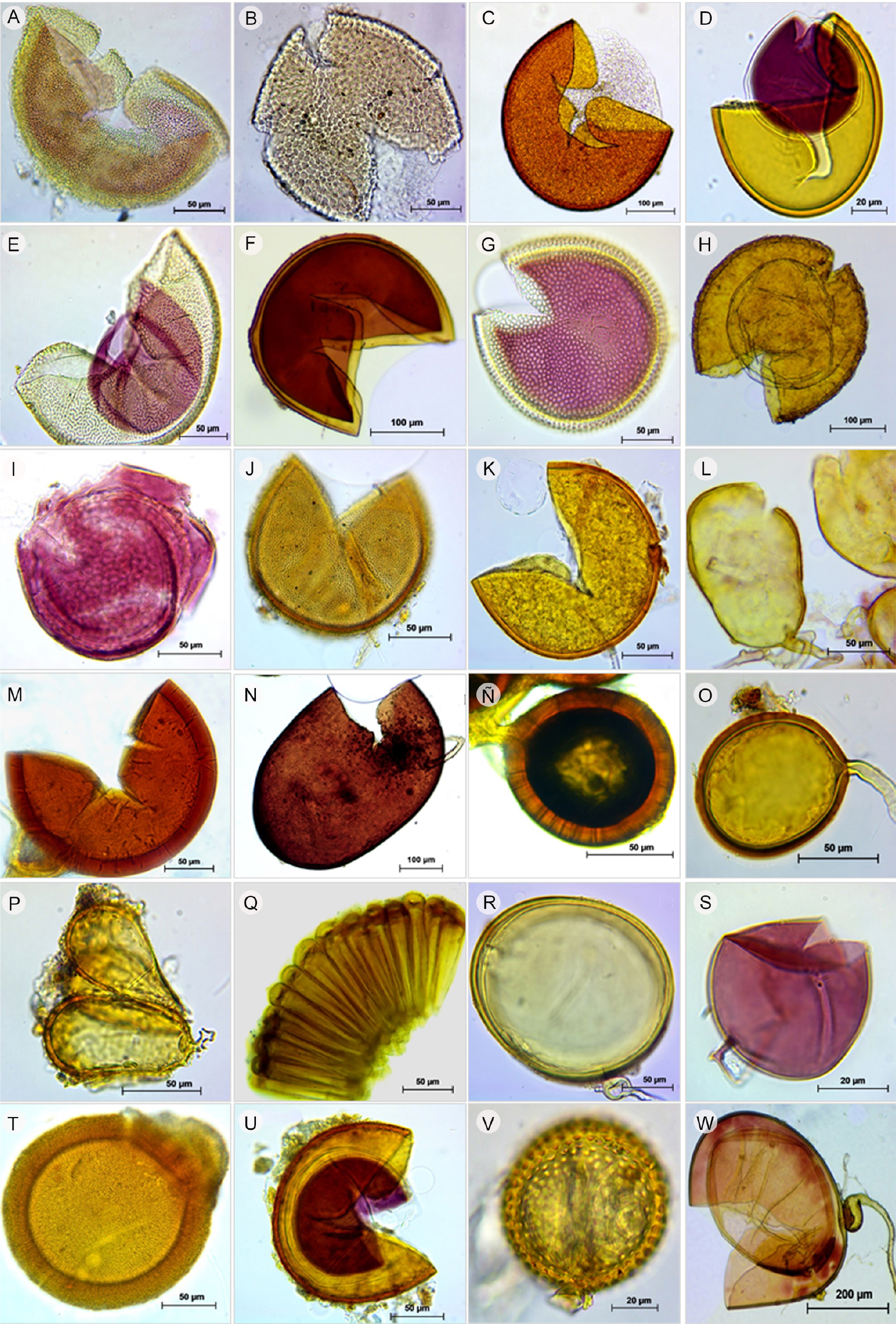
Figura 3: Composición de morfoespecies de hongos micorrizógenos arbusculares en cinco diferentes plantaciones de café (Coffea arabica L.) cultivadas en los alrededores del volcán Tacaná, Chiapas, México: A. Acaulospora denticulata Sieverd. & S. Toro; B. A. excavata Ingleby & C. Walker; C. A. foveata Trappe & Janos; D. A. mellea Spain & N.C. Schenck; E. A. rehmii Sieverd. & S. Toro; F. A. spinosa C. Walker & Trappe; G. A. scrobiculata Trappe; H. Ambispora appendicula C. Walker; I. A. reticulata Oehl & Sieverd; J. Entrophospora infrequens R.N. Ames & R. W. Schneid; K. Claroideoglomus claroideum C. Walker & Schuessler; L. Funneliformis mosseae C. Walker & Schuessler; M. F. geosporum C. Walker & Schuessler; N. Gigaspora gigantea Gerd. & Trappe; Ñ. Glomus macrocarpum Tul. & C. Tul.; O. G. trufemii B. T. Goto, G. A. Silva & Oehl; P. Sclerocystis sinuosa Gerd. & B. K. Bakshi, detalle de las esporas con peridio; Q. S. taiwanensis C. G. Wu & Z. C. Chen, detalle de las esporas agrupadas en forma radial; R. Scutellospora calospora C. Walker & F.E. Sanders; S. Glomus sp. 1; T. Glomus sp. 2 (Glomeral); U. Acaulospora sp. 2; V. Acaulospora sp.1; W. Scutellospora sp.
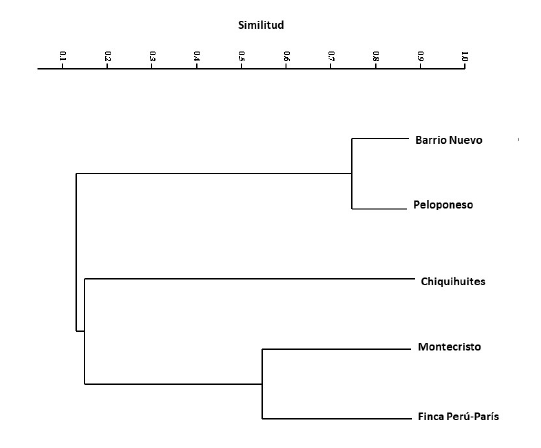
Figura 4: Similitud (índice Bray-Curtis) en la composición de especies (diversidad beta) de hongos micorrizógenos arbusculares entre cinco diferentes plantaciones de café (Coffea arabica L.) cultivadas en los alrededores del volcán Tacaná, Chiapas, México.
El suelo de los cafetales estudiados tiene un pH ácido, varió entre plantaciones de 5.3 a 6.6. Montecristo fue la plantación con el pH más ácido y Barrio Nuevo la que registró el pH menos ácido, mientras que el suelo en las otras tres plantaciones tuvo un pH similar y con valores intermedios con respecto a Montecristo y Barrio Nuevo. La conductividad eléctrica del suelo fue muy baja y no difirió entre las plantaciones (Cuadro 2). Las plantaciones Peloponeso y Barrio Nuevo registraron los valores más altos de MOS, COS, Nt, relación C:N y CIC; mientras que Montecristo, Chiquihuites y Finca Perú-París registraron los valores más bajos sin diferencias significativas entre estas plantaciones (Cuadro 2). En contraste, la concentración de PO4 -3 en el suelo de las plantaciones Peloponeso y Finca Perú-París, seguidas de la plantación Barrio Nuevo, fue mayor que la registrada en el suelo de las plantaciones Montecristo y Chiquihuites (Cuadro 2). El suelo en todas las plantaciones tiene textura franca arenosa con un componente arenoso importante, con la particularidad de que el suelo en la Finca Perú-París y en dos sitios de Montecristo registró mayor cantidad de arena y arcilla en relación con el limo y con el suelo de las otras plantaciones (Cuadro 2).
Cuadro 2: Propiedades edáficas de cinco diferentes plantaciones de café (Coffea arabica L.) cultivadas en los alrededores del volcán Tacaná, Chiapas, México. C.E.=Conductividad eléctrica, MOS=materia orgánica del suelo, COS=carbono orgánico del suelo, Nt=nitrógeno total, CIC=capacidad de intercambio catiónico, PO4 -3=fósforo disponible (Olsen). Promedios (± error estándar) seguidos de letras distintas son estadísticamente diferentes entre plantaciones (Tukey=p≤0.05). Nivel de significancia: ns=no significativo, *p≤0.01, **p≤0.001, ***p≤0.0001.
| Plantaciones de café arábica | ||||||
|---|---|---|---|---|---|---|
| Peloponeso | Montecristo | Chiquihuites | Finca Perú-París | Barrio Nuevo | ||
| Propiedades | ANOVA F | |||||
| pH (H20) | 5.7(0.2)b | 5.3(0.04)c | 6.1(0.2)b | 5.8(0.2)b | 6.6(0.3)a | 1.3* |
| C.E. (dS m-2) | 0.1(0.001)a | 0.1(0.003)a | 0.03(0.01)a | 0.02(0.001)a | 0.1(0.02)a | 0.07ns |
| MOS (%) | 16.4(2.1)a | 5.0(1.5)b | 5.8(2.4)b | 4.0(1.3)b | 16.2(0.3)a | 2.7** |
| COS (%) | 8.8(1.1)a | 2.7(0.8)b | 3.1(1.3)b | 2.2(0.7)b | 8.8(0.1)a | 3.4** |
| Nt (%) | 0.8(0.1)a | 0.3(0.05)b | 0.4(0.1)b | 0.3(0.01)b | 0.8(0.01)a | 2.9** |
| C:N | 10.9(0.2)a | 8.5(1.3)b | 7.7 (2.1)b | 7.5(1.6)b | 10.9(0.4)a | 3.6*** |
| PO4 -3 (mg kg-1) | 18.1(9.7)a | 5.3(0.5)c | 6.2(0.4)c | 18.4(4.1)a | 10.2(0.01)b | 4.3*** |
| CIC (Cmol kg-1) | 39.8(3.9)a | 17.4(2.6)b | 18.5(2.9)b | 16.7(2.4)b | 41.3(0.1)a | 4.5** |
| Arena (%) | 57.6(7.3)b | 62.6(1.2)b | 61.6(0.8)b | 68.6(1.2)a | 58.6(2.1)b | 7.2** |
| Arcilla (%) | 7.5(1.1)ab | 6.7(0.7)b | 6.4(0.8)b | 9.4(1.2)a | 8.7(0.7)a | 6.1* |
| Limo (%) | 35(7.3)a | 30.7(0.7)a | 32(0.02)a | 22(1.2)b | 32.7(1.3)a | 5.3* |
| Clase textural | Franco Arenoso | |||||
El ACC, cuyos ejes principales explicaron 71.5% de la varianza total (Fig. 5), ordenó la riqueza observada y el índice de Shannon-Wiener de diversidad de morfoespecies en la plantación Chiquihuites con base en el PO4 -3, en donde ambas correlacionaron negativamente con este nutriente, al mismo tiempo que el PO4 -3 tuvo correspondencia positiva con el índice de Simpson. Por su parte, la abundancia de esporas se relacionó positivamente con la CIC, Nt y COS en las plantaciones Barrio Nuevo y Peloponeso y en uno de los sitios de la plantación Montecristo. En contraste, la abundancia de esporas de HMA en la plantación Finca Perú-París correlacionó negativamente con el PO4 -3 y los porcentajes de arena y arcilla del suelo (Fig. 5). Asimismo, con respecto a la composición de HMA, el ACC indicó que algunos HMA ocurren en plantaciones con suelo arenoso, otros en plantaciones con suelo ácido y con baja disponibilidad de fósforo, y otros producen abundantes esporas en suelo con más COS, Nt y CIC (Fig. 5).
Figura 5: Análisis de correspondencia canónica (ACC) que muestra la relación entre las comunidades de hongos micorrizógenos arbusculares (HMA) y las propiedades edáficas de cinco diferentes plantaciones de café (Coffea arabica L.) cultivadas en los alrededores del volcán Tacaná, Chiapas, México. Abundancia de esporas (Abund Espo), Riqueza de especies (Riq Obs spp), índices de diversidad Shannon-Wiener (Diver Sh-Wie) y Simpson (Div Simpson).
Discusión
La riqueza de 27 morfoespecies de HMA, reportada de manera global en este estudio para las cinco plantaciones de café examinadas, fue mayor que la registrada en otras plantaciones de café como las ubicadas en Maasai Mara (15 spp.) en Kenya (Muchane et al., 2012), y menor que en otros sistemas cafetaleros como el de C. arabica (79 spp.) en Veracruz, México (Posada et al., 2016) y Araponga (42 spp.), Minas Gerais, Brasil (Prates et al., 2019). No obstante, la riqueza de morfoespecies está cercana al promedio reportado en plantaciones de café de la región de Sidama (28 spp.) al sureste de Etiopia (Dobo et al., 2018) y en algunas localizadas en Chiapas, México, con hasta 20 spp. registradas en café robusta (Bertolini et al., 2018). Esta amplia variación en la riqueza de especies de HMA en sistemas cafetaleros revela una compleja interacción entre las comunidades de HMA, los cafetos y las plantas nativas creciendo en las plantaciones como hospederos potenciales y, probablemente, entre las características climáticas y edáficas de cada región.
Como se ha reportado en otros estudios, los géneros Acaulospora y Glomus y algunas de sus especies son los que más frecuentemente han sido observados en las plantaciones de café (Mathimaran et al., 2007; Arias et al. 2012; Posada et al., 2016; Bertolini et al., 2018, Dobo et al., 2018; Herrera et al., 2019). Especies del género Acaulospora y en segundo o tercer lugar de Glomus, podrían esporular más en suelos ácidos a neutros con pHs entre 5.4 y 7.0 (Aguilera et al., 2015), lo cual coincide con los intervalos de pH detectados en los suelos de las cinco plantaciones aquí estudiadas y con lo señalado previamente en suelos con plantaciones de robusta (C. canephora) en la región del Soconusco, Chiapas, México (Bertolini et al., 2018). La abundancia de especies de Acaulospora en todas las plantaciones estudiadas confirma la importancia de este género en suelos ácidos, por lo que las especies registradas de dicho género podrían ser un componente esencial en la elaboración de biofertilizantes para plantaciones de C. arabica creciendo en estos suelos.
Ambispora C. Walker, Vestberg & Schuessler fue uno de los géneros de HMA que menos especies aportó a la riqueza global registrada para las cinco plantaciones; sin embargo, Ambispora reticulata representó un nuevo registro para el estado de Chiapas y para México. Esta especie fue reportada por primera vez de los Alpes suizos y los Andes chilenos, frecuentemente entre los 1000 y 2100 m s.n.m., se caracteriza por formar esporas acauloambisporoides, de 87-131 μm × 125-150 μm de diámetro, las cuales están constituidas por tres paredes: i) la externa de color amarillo-marrón a marrón con tres capas, ii) la intermedia con dos capas hialinas y iii) la interna con dos o tres capas hialinas. En Ambispora reticulata la primera capa de la pared intermedia de las esporas tiene una superficie ornamentada reticulada, que consiste de depresiones irregulares de forma triagonal a octagonal (generalmente tetragonal a hexagonal), de 3-7.5(-10) μm de amplitud y 0.5-2.5 μm de profundidad (Oehl et al., 2012). Estos elementos morfológicos sugieren que A. reticulata es un registro nuevo que se suma a los cinco previamente reportados en plantaciones cafetaleras del Soconusco (Bertolini et al., 2018) y que contribuye a incrementar de 149 a 150 las especies de Glomeromycota conocidas en México (Chimal-Sánchez et al., 2019; Varela et al., 2019), representando 47.7% de las especies reportadas en el mundo.
La comunidad de HMA difirió entre las cinco plantaciones de C. arabica examinadas. La plantación Chiquihuites destacó por presentar mayor riqueza y diversidad de morfoespecies de HMA y por favorecer una abundancia de esporas intermedia y la equitatividad en términos de las morfoespecies. Asimismo, esta plantación difirió completamente de las demás en su composición de HMA. Esto pudo deberse a que el suelo de esta plantación presentó bajos niveles de MOS, COS, CIC, C:N y PO4 -3, lo cual pudo favorecer a los HMA. Varios estudios muestran que las plantas en general (Smith et al., 2011), incluyendo las de café (Trejo et al., 2011; Perea-Rojas et al., 2019) requieren establecer una simbiosis funcional con los HMA cuando la disponibilidad de fósforo es reducida, ya que la micorriza arbuscular facilita el acceso de las raíces de la planta hospedera a nutrientes con poca movilidad en el suelo (Smith y Read, 2008; Cuenca, 2015), o bien cuando ocurre una baja tasa de mineralización de P debida a una reducida cantidad o calidad de MOS que aporte este nutriente (Bünemann et al., 2011). Esto contrasta con lo detectado en las plantaciones Montecristo y Finca Perú-París, las cuales comparten una composición de HMA similar, pero registraron los valores más bajos de riqueza y diversidad de morfoespecies, a pesar de tener también suelos con bajos niveles de MOS, COS, C:N, CIC y PO4 -3, que al parecer sólo favorecen la esporulación de algunas morfoespecies de HMA. No obstante, los suelos de las plantaciones Montecristo y Finca Perú-París también tienen un pH más ácido que el suelo de Chiquihuites, lo cual sugiere que el nivel de acidez podría ser un factor importante que, al controlar la disponibilidad de P, a su vez determina en conjunto con este nutriente, la dinámica de la comunidad de los HMA, como se había sugerido previamente para la región cafetalera del Soconusco (Bertolini et al., 2018).
Asimismo, otra evidencia que apoya la hipótesis de una posible interacción entre la acidez y la disponibilidad de P en el suelo como regulador de las comunidades de HMA, es que la plantación Barrio Nuevo tuvo altos niveles de MOS, COS, C:N, CIC y PO4 -3, pero sólo la abundancia de esporas y la riqueza de morfoespecies de HMA respondieron a la variación en estos recursos del suelo, y no así la diversidad de HMA. Esta respuesta en las comunidades micorrízicas ocurrió con los valores de pH menos ácidos con respecto a las otras plantaciones, lo que sugiere que hay más P disponible, debido a que, en condiciones de menor acidez, la fijación química del PO4 -3 al aluminio y hierro es menor y, por lo tanto, su disponibilidad se ve favorecida y en consecuencia esto reduce la diversidad de HMA (Bünemann et al., 2011; Aguilera et al., 2015).
La composición de HMA fue otro aspecto muy distinto entre las plantaciones examinadas; Chiquihuites fue la que tuvo menor similitud con las otras cuatro plantaciones, mientras que Montecristo con Finca Perú-París y Peloponeso con Barrio Nuevo fueron muy similares en su composición de morfoespecies (Figs. 4 y 5). Vaast et al. (1997) indican que algunas especies de HMA tienen una mejor respuesta a determinados niveles de P disponible que otras, debido a su diferente habilidad para capturar este nutriente del suelo. Así, la relación positiva entre algunas especies de HMA, particularmente del género Acaulospora, con el pH del suelo, a la vez que el PO4 -3 y el pH correlacionaron negativamente, y la relación positiva entre otras morfoespecies de HMA con la CIC, el Nt y el COS, sugieren que estas propiedades edáficas, particularmente la disponibilidad del fósforo y la acidez del suelo, podrían promover el recambio de las especies de HMA en las plantaciones de cafeto en la región del Soconusco. Así, una manera en que los HMA responden a estos mecanismos biogeoquímicos de limitación de fósforo en el suelo y aseguran una simbiosis funcional con los cafetos para lograr suplir las necesidades nutricionales de estas plantas hospederas (Perea-Rojas et al., 2019), podría ser a través de modificar su composición de especies. Estos efectos promotores de la diversidad beta con valores de hasta 73% entre las comunidades de HMA en función de la disponibilidad de P han sido documentados en diferentes comunidades de plantas y contextos ambientales (Posada et al., 2016; Dobo et al., 2018). Sin embargo, este estudio es el primero en registrarlo en plantaciones de C. arabica y el segundo en sugerirlo, después de Bertolini et al. (2018), como un efecto combinado de la disponibilidad de fósforo y la acidez del suelo en los cafetales del Soconusco.
En comparación con otro estudio realizado en la región del Soconusco (Bertolini et al., 2018), la composición de morfoespecies de HMA en las cinco plantaciones cercanas al volcán Tacaná, en esta misma región, indica que C. arabica alberga una mayor riqueza de HMA que C. canephora (27 vs. 20 spp.) y que estas especies de cafeto presentan una distinta composición de morfoespecies de HMA (véase Cuadro 1). Así, C. arabica contiene géneros y morfoespecies de HMA que no fueron registrados en las plantaciones de C. canephora. Entre estos géneros están Ambispora, Claroideoglomus C. Walker & Schuessler, Entrophospora R.N. Ames & R.W. Schneid., Funneliformis C. Walker & Schuessler y Paraglomus J.B. Morton & D. Redecker. Asimismo, especies como Acaulospora denticulata y Glomus macrocarpum también corresponden a especies hasta ahora únicamente registradas en C. arabica en esta región (véase Cuadro 1). Varios de estos taxa han sido reportados en otras plantaciones de C. arabica establecidas en México (Veracruz) y en Colombia, entre ellos Ambispora, cuya presencia también se atribuye a la acidez de suelo (Posada et al., 2016; Herrera et al., 2019). Además, los reportes en plantaciones de C. arabica establecidas en otras regiones del mundo indican una mayor riqueza de especies que la registrada en la presente investigación (más de 33 spp. y hasta 81 spp.) y una composición que incluye géneros no detectados en la región del Soconusco (Arias et al., 2012; Posada et al., 2016; Prates et al., 2019). Este estudio, en conjunto con otros realizados en plantaciones de C. arabica, sugiere que esta especie de cafeto promueve la riqueza de especies de HMA con una composición de especies distinta a la registrada en C. canephora, por lo que la sustitución de C. arabica por C. canephora podría estar modificando la diversidad de los HMA en la región del Soconusco. No obstante, se requiere incrementar esfuerzo de muestreo y el uso de metodologías más sensibles para la detección de todas las especies de HMA, ya que no se descarta la posibilidad de que las morfoespecies identificadas de HMA puedan estar subestimadas por la dificultad de caracterizar aquellas no esporulantes, en latencia o dependientes de la fenología del cafeto o de las características edáficas de la localidad donde se ubica cada plantación. El uso de herramientas moleculares es una necesidad a futuro, ya que se ha observado que la diversidad de HMA varía en función de si es evaluada por métodos moleculares o morfológicos (Prates et al., 2019).
En conclusión, este estudio reporta 27 morfoespecies de HMA en plantaciones de C. arabica en los alrededores del volcán Tacaná y sugiere que esta especie de cafeto favorece la diversidad de HMA en comparación con las plantaciones de robusta (C. canephora) establecidas también en la región del Soconusco. Asimismo, la disponibilidad del fósforo, ligada a la acidez del suelo, podría estar regulando las comunidades de HMA en el suelo de las plantaciones de C. arabica, lo que coincide con lo reportado en otras plantaciones de café. Bajo estas condiciones podría haber nuevos registros de especies, como en el caso de Ambispora reticulata aquí reportada, así como HMA específicos para los niveles de PO4 -3 y acidez de estos suelos. Los HMA podrían pertenecer al género Acaulospora que son frecuentes en estos suelos o a géneros probablemente exclusivos de plantaciones de C. arabica, los cuales deberían ser examinados en cuanto a su compatibilidad funcional con esta especie de cafeto, con la finalidad de asegurar sus beneficios como biofertilizantes en la cafeticultura orgánica al promover el desarrollo y rendimiento de los cafetos en las faldas del volcán Tacaná en la región del Soconusco, Chiapas, México. Esto recientemente se reportó experimentalmente en C. arabica L. cultivar garnica (Instituto Mexicano del Café) en Veracruz, donde un consorcio de tres especies de Acaulospora y dos de hongos solubilizadores de fosfatos favorece el crecimiento y nutrición de esta variedad de café (Perea-Rojas et al., 2019).











 nueva página del texto (beta)
nueva página del texto (beta)




