Introducción
A partir de la incorporación, a finales de los años 80, de la sistemática molecular a los estudios sobre diversidad, se ha ido haciendo cada vez más evidente que la riqueza de especies ha sido subestimada; esto debido al descubrimiento de especies crípticas (especies genéticamente independientes, pero morfológicamente similares). Esta situación ha podido ser resuelta eficazmente mediante análisis de morfometría (Kraan et al., 2001; Maderbacher et al., 2008; Abdel-Rahman et al., 2009; Grenat et al., 2012; Hidalgo et al., 2012; Borda y Ramírez, 2014), ya que complementan los análisis cualitativos cuantificando y evaluando estadísticamente la variación morfológica entre taxones (Umphrey, 1996; Calle et al., 2008; Toro et al., 2010; Navia et al., 2015). Para el grupo de las macroalgas los análisis morfométricos son escasos (Verbruggen et al., 2005; Hidalgo et al., 2012; Núñez-Resendiz et al., 2015; Vilchis et al., 2019). De acuerdo con Verbruggen et al. (2005), se debe a que a simple vista estos organismos son poco adecuados para la investigación morfométrica, ya que sus estructuras y patrones de ramificación se caracterizan por una gran variación estocástica y plasticidad fenotípica. Sin embargo, debido a que los problemas de identificación morfológica son cada vez más frecuentes en este grupo, la morfometría ha comenzado a tener auge dentro de la ficología (Verbruggen et al., 2005; Hidalgo et al., 2012; Núñez-Resendiz et al., 2015).
El complejo Crassiphycus corneus-C. usneoides, integrado por C. corneus (J. Agardh) Gurgel, J.N. Norris et Fredericq y C. usneoides (C. Agardh) Gurgel, J.N. Norris et Fredericq, fue propuesto por Núñez-Resendiz et al. (2015) como consecuencia de la coincidencia morfológica entre ambas especies, atribuida a su baja plasticidad fenotípica. Dicho complejo está incorporado a la última revisión sistemática de la familia Gracilariaceae (Gurgel et al., 2018). De acuerdo con Dreckmann (2012), siguiendo las descripciones originales de Agardh (1852), el grosor del talo, la textura y el número de ramas podrían ser caracteres discriminantes entre C. corneus y C. usneoides. Autores como Taylor (1960), Fredericq y Hommersand (1989), Schneider y Searles (1991) y Ardito et al. (2014) mencionan que los principales caracteres de delimitación específica entre las especies son el patrón de ramificación y el número y tamaño de las células corticales y medulares. Sin embargo, Núñez-Resendiz et al. (2015) indican que, al menos para las poblaciones mexicanas, estos caracteres se sobreponen, lo cual deriva en la evidente dificultad para la interpretación de los caracteres de delimitación específica. Dicha diferencia únicamente ha podido ser sustentada mediante caracteres moleculares (Núñez-Resendiz et al., 2015; 2016). El problema adquiere mayor relevancia, si se toma en cuenta que estas especies se encuentran distribuidas simpátricamente desde el norte del Golfo de México hasta el norte de Brasil (Dreckmann, 2012; Ardito et al., 2014; Núñez-Resendiz et al., 2015; Lyra et al., 2015).
Dado lo anterior, el objetivo del presente trabajo fue evaluar morfométricamente algunos caracteres anatómicos que permitan la discriminación de las especies del complejo Crassiphycus corneus-C. usneoides.
Materiales y Métodos
Preparación de las muestras
Los ejemplares analizados en el presente trabajo están depositados en la Colección de Macroalgas Marinas del Herbario Metropolitano de la Universidad Autónoma Metropolitana Unidad Iztapalapa (UAMIZ, Cuadro 1), y fueron identificados molecularmente en los trabajos previos de Núñez-Resendiz et al. (2015; 2016).
Cuadro 1: Referencias de los ejemplares de herbario de Crassiphycus corneus (J. Agardh) Gurgel, J.N. Norris et Fredericq y Crassiphycus usneoides (C. Agardh) Gurgel, J.N. Norris et Fredericq analizados en este estudio, incluyendo números de herbario y localidad en la que fueron recolectados. Cada número de herbario contiene varios duplicados.
| Especie | Número de herbario | Localidad |
|
Crassiphycus corneus (J. Agardh) Gurgel, J.N. Norris et
Fredericq |
||
| UAMIZ-612 | Puerto Morelos, Quintana Roo | |
| UAMIZ-1282 | Sisal, Yucatán | |
| UAMIZ-456 | Puerto Morelos, Quintana Roo | |
| UAMIZ-1285 | Puerto Progreso, Yucatán | |
| UAMIZ-1346 | Isla Aguada, Campeche | |
| UAMIZ-1281 | Puerto Progreso, Yucatán | |
| UAMIZ-457 | Puerto Morelos, Quintana Roo | |
| UAMIZ-458 | Puerto Morelos, Quintana Roo | |
| UAMIZ-957 | Isla del Carmen, Campeche | |
|
Crassiphycus
usneoides (C. Agardh) Gurgel, J.N. Norris et
Fredericq |
||
| UAMIZ-1284 | Puerto Telchac, Yucatán | |
| UAMIZ-1339 | Puerto Morelos, Quintana Roo | |
| UAMIZ-1340 | Sabancuy, Campeche | |
| UAMIZ-563 | Playa del Carmen, Quintana Roo | |
| UAMIZ-458 | Puerto Morelos, Quintana Roo | |
| UAMIZ-456 | Puerto Morelos, Quintana Roo | |
| UAMIZ-970 | Playa Bonita, Campeche | |
| UAMIZ-988 | Playa Bonita, Campeche | |
| UAMIZ-1283 | Puerto Morelos, Quintana Roo |
Se extrajeron tres fragmentos de aproximadamente 4 mm de longitud de 20 ejemplares de C. corneus y 20 de C. usneoides, uno de la porción apical, otro de la porción media y el ultimo de la porción basal (Fig. 1A). Estos fueron hidratados con agua corriente durante 30 minutos y fijados en FAA (formaldehído-alcohol-acético-agua) por tres días, con la finalidad de que el tejido se endureciera lo suficiente y no sufriera deformaciones en las siguientes manipulaciones. Posteriormente, en un micrótomo de ultracongelación Leica CM 1510-3 (Leica Microsystems, Wetzlar, Alemania), se realizaron sobre cada fragmento cortes transversales de 10 µm de ancho, que fueron colocados en un portaobjetos y sometidos al siguiente tren de tinción y montaje: 1) hidratación con etanol al 95, 80, 75 y 50% durante cinco minutos por cada porcentaje, 2) tinción con verde rápido concentrado durante 2 horas, 3) deshidratación con etanol al 30%, 50%, 75% y 100% durante cinco minutos por porcentaje y un minuto en alcohol terbutílico al 100%, 4) por último las muestras fueron montadas en Entellan (López-Curto et al., 2005).
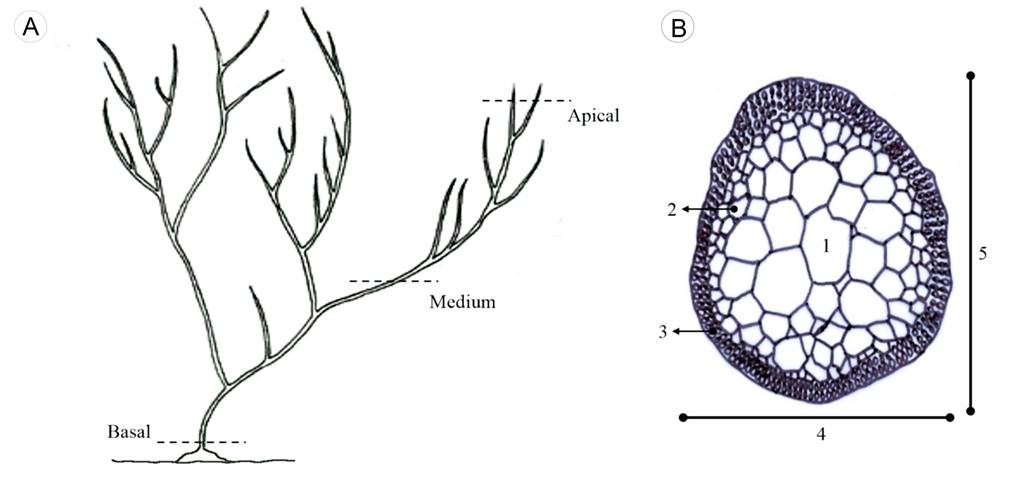
Figura 1: A. representación esquemática de los sitios en que fueron extraídos los fragmentos a analizar a lo largo del talo (modificada de Dreckmann, 2012); B. corte transversal donde se pueden distinguir los tipos de células a las que se hace referencia en este estudio: 1. células medulares, 2. células subcorticales, 3. células corticales, 4. diámetro menor del talo, 5. diámetro mayor del talo.
Análisis morfométrico
En un microscopio Leica DM LB (Leica Microsystems, Wetzlar, Alemania) equipado con un ocular micrométrico, se realizaron las siguientes mediciones en cada uno de los cortes: diámetro mayor y menor del talo en las porciones apical (Fig. 1B), media y basal, y largo y ancho promedio (medición promedio de 5 células) de las células corticales, subcorticales y medulares en cada porción. El tipo de células se ilustra en la Figura 1B. Los 24 caracteres cuantitativos fueron estandarizados y sometidos a un análisis de componentes principales (ACP) usando el programa PAST versión 2.17 (Hammer et al., 2001), con la intención de reducir las dimensiones del conjunto de datos. En el mismo programa y con los componentes principales (CP) resultantes, se realizó un NP-MANOVA con distancia euclidiana, esta última utilizada como medida que evalúa la diferencia entre las especies. La significancia de la separación de los grupos se evaluó mediante la permutación de la pertenencia a un grupo con 9999 repeticiones. Se utilizó la corrección de Bonferroni para comparaciones múltiples (Sokal y Rohlf, 1995) para el cálculo de los valores resultantes de p. Es importante mencionar que el análisis multivariante de la varianza (MANOVA) fue descartado para el análisis, ya que no se cumplieron los supuestos, como, por ejemplo, la normalidad multivariante. Adicionalmente, se graficó la media aritmética e intervalos de confianza al 95%, para los caracteres que mostraron mayor peso para la discriminación de las especies del complejo.
Finalmente, la matriz original con los 24 caracteres cuantitativos se sometió a un análisis de agrupamiento en el programa PAST versión 2.17 (Hammer et al., 2001), bajo el índice de disimilitud de distancia euclidiana y el algoritmo por ligamiento promedio no ponderado (UPGMA, por sus siglas en ingles); el análisis resumió los resultados en un dendograma.
Resultados
El ACP arrojó 24 componentes, los primeros tres explicaron 88.6% de la varianza. En el Cuadro 2 se muestran los eigenvalores para cada medida. El primer CP acumuló 59.12% de la varianza total, y la variable que mejor la explicó fue el diámetro mayor del talo en la porción media (Fig. 2), que de acuerdo con la figura 3A, fue considerablemente mayor en Crassiphycus usneoides que en C. corneus, midiendo en promedio 286.5 y 182.2 µm, respectivamente. El segundo CP explicó 19.18% de la varianza total y la variable que mejor la explicó fue el diámetro menor del talo en la porción apical (Fig. 2), el cual, en promedio, fue mayor en C. usneoides (122.4 µm) que en C. corneus (55.2 µm), de acuerdo con la figura 3B. El tercer componente acumuló 10.3% de la varianza total; la variable que mejor la explicó fue el diámetro mayor del talo en la porción apical; este carácter fue en promedio más grande en C. usneoides (134.3 µm) que en C. corneus (96.6 µm, Fig. 3C).
Cuadro 2: Eigenvalores obtenidos del análisis de componentes principales (CP) a partir de 24 medidas lineales de las especies Crassiphycus corneus (J. Agardh) Gurgel, J.N. Norris et Fredericq y C. usneoides (C. Agardh) Gurgel, J.N. Norris et Fredericq.
| Medidas | Porción | CP1 | CP2 | CP3 |
| Diámetro mayor del talo | Apical | 0.335 | 0.407 | 0.545 |
| Diámetro menor del talo | Apical | 0.337 | -0.723 | 0.340 |
| Diámetro mayor del talo | Media | 0.615 | 0.090 | -0.349 |
| Diámetro menor del talo | Media | 0.370 | 0.004 | -0.355 |
| Diámetro mayor del talo | Basal | 0.256 | 0.422 | 0.342 |
| Diámetro menor del talo | Basal | 0.436 | -0.350 | 0.194 |
| Largo células corticales | Apical | 0.006 | 0.012 | 0.004 |
| Ancho células corticales | Apical | 0.006 | 0.011 | 0.005 |
| Largo células subcorticales | Apical | 0.009 | 0.016 | 0.009 |
| Ancho células subcorticales | Apical | 0.008 | 0.013 | 0.018 |
| Largo células medulares | Apical | -0.001 | -0.013 | 0.040 |
| Ancho células medulares | Apical | 0.001 | 0.003 | 0.025 |
| Largo células corticales | Media | 0.005 | 0.010 | 0.005 |
| Ancho células corticales | Media | 0.005 | 0.010 | 0.004 |
| Largo células subcorticales | Media | 0.023 | 0.018 | 0.011 |
| Ancho células subcorticales | Media | 0.017 | 0.023 | 0.014 |
| Largo células medulares | Media | 0.005 | 0.003 | -0.038 |
| Ancho células medulares | Media | 0.002 | 0.006 | -0.015 |
| Largo células corticales | Basal | 0.018 | 0.027 | 0.012 |
| Ancho células corticales | Basal | 0.013 | 0.021 | 0.012 |
| Largo células subcorticales | Basal | 0.011 | -0.008 | -0.005 |
| Ancho células subcorticales | Basal | 0.007 | 0.000 | 0.000 |
| Largo células medulares | Basal | 0.013 | 0.006 | -0.025 |
| Ancho células medulares | Basal | 0.023 | 0.009 | -0.001 |
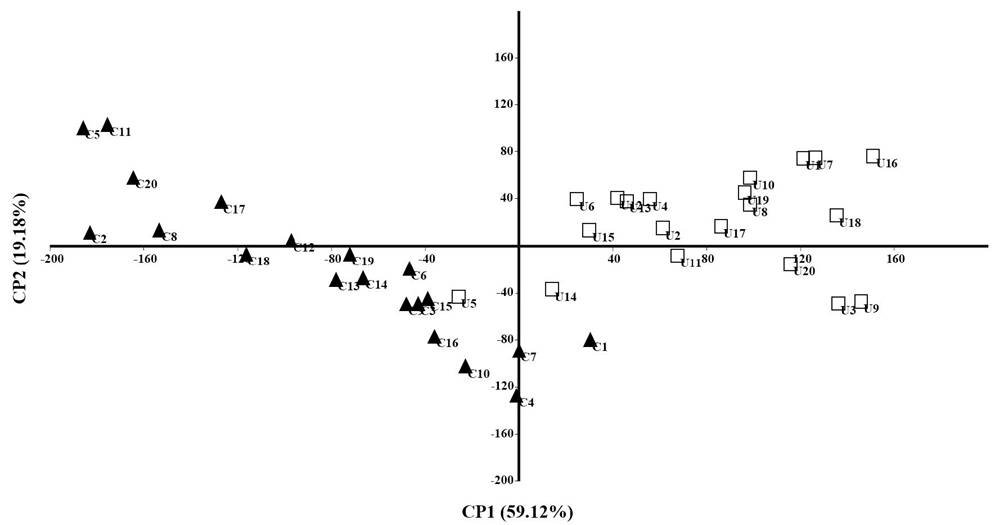
Figura 2: Diagrama de los dos primeros componentes principales, obtenidos a partir de 24 variables morfométricas para la discriminación de las especies Crassiphycus corneus (J. Agardh) Gurgel, J.N. Norris et Fredericq (□) y C. usneoides (C. Agardh) Gurgel, J.N. Norris et Fredericq (▲).
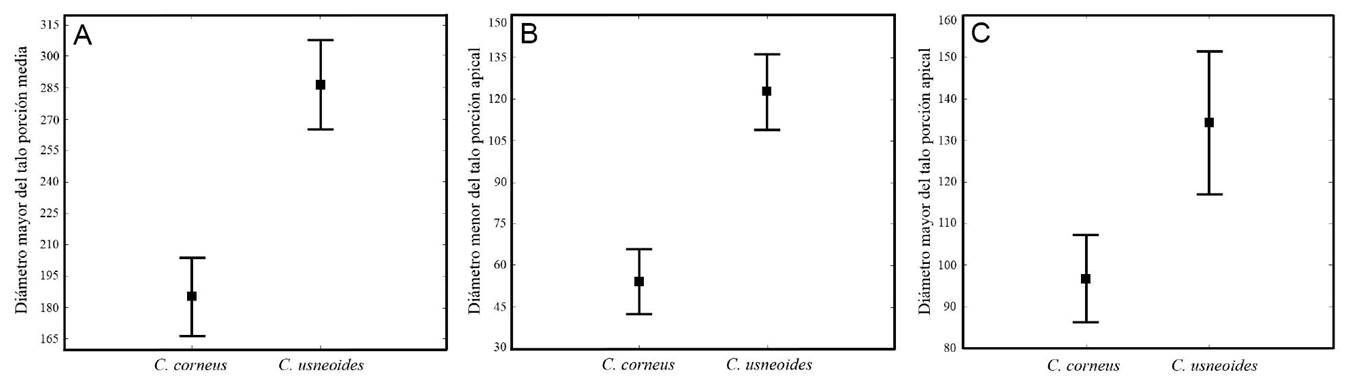
Figura 3: Diagrama comparativo de la media aritmética e intervalos de confianza al 95%, de los caracteres que resultaron con mayor peso para la discriminación de las especies del complejo C. corneus/C. usneoides. A. diámetro mayor del talo porción media; B. diámetro menor del talo porción apical; C. diámetro mayor del talo en la porción apical. Los cuadros negros representan la media aritmética y los bigotes los intervalos de confianza.
El NP-MANOVA evidenció que las medidas de los caracteres mencionados anteriormente mostraron diferencias significativas entre las especies comparadas mostrando un valor de p<0.005 y un valor de F de 5.18.
El dendograma basado en la matriz original de caracteres mostró dos grupos (Fig. 4). El primero involucró a todos los ejemplares de Crassiphycus corneus y el segundo los de C. usneoides, robusteciendo, de este modo, los resultados del ACP descrito anteriormente.
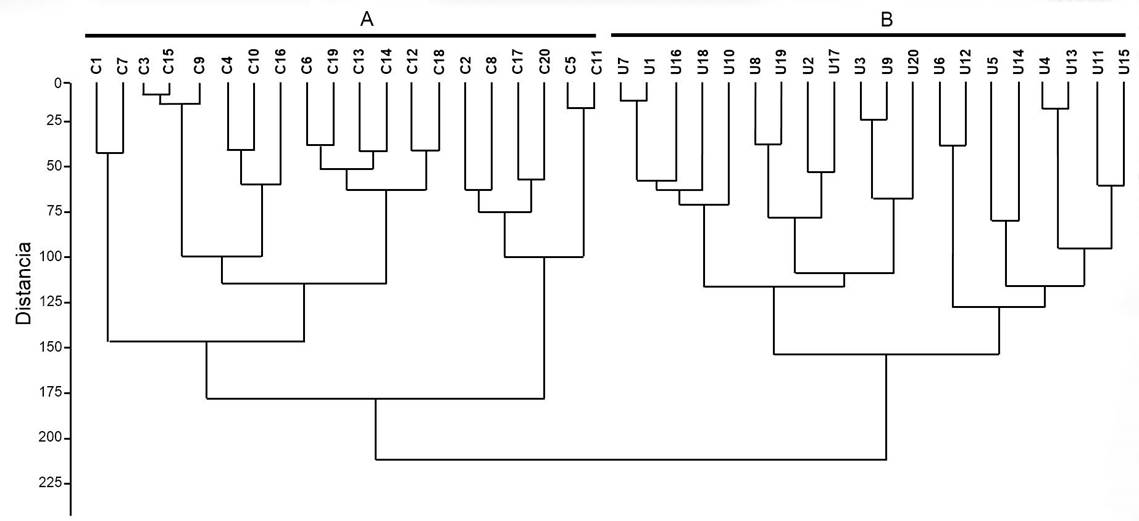
Figura 4: Dendograma resultado del análisis de agrupamiento bajo el índice de disimilitud de distancia euclidiana y el algoritmo UPGMA, basado en 24 caracteres cuantitativos tomados de 40 ejemplares de: A. Crassiphycus corneus (J. Agardh) Gurgel, J.N. Norris et Fredericq; B. C. usneoides (C. Agardh) Gurgel, J.N. Norris et Fredericq.
Discusión
Los análisis realizados indican que los caracteres morfométricos más importantes para la discriminación de Crassiphycus corneus y C. usneoides se encuentran localizados en la porción apical y media del talo. Estos fueron el diámetro mayor del talo en la porción media y el diámetro menor y mayor en la porción apical. Las medidas registradas en la porción basal no aportaron suficiente información discriminatoria entre las especies, esto se debe a que, las estructuras en esta porción tienden a deformarse dada su proximidad al pie de fijación, el cual soporta los fuertes movimientos del agua, además de que son las estructuras de mayor edad a lo largo del talo, recordando que estos organismos presentan un crecimiento uniaxial (Coomans y Hommersand, 1990; Dreckmann, 2012).
Núñez-Resendiz et al. (2015), como se mencionó anteriormente, integraron dentro de un complejo de especies a Crassiphycus corneus y C. usneoides, debido a su gran parecido morfológico (Fig. 5). Además, evidenciaron mediante un análisis morfométrico que el grosor del talo no es un carácter discriminante entre ambas especies como lo menciona Dreckmann (2012), ya que es posible encontrar ejemplares de C. corneus y C. usneoides con talos gruesos y delgados. Sin embargo, en el presente estudio, estos caracteres resultaron los más importantes para la discriminación. La diferencia entre ambos resultados probablemente esté en el manejo de los datos, ya que Núñez-Resendiz et al. (2015) consideraron estas medidas como el diámetro (mayor y menor) promedio de tres cortes transversales realizados en porciones diferentes del talo (apical, medio y basal), mientras que en este trabajo dichas medidas fueron consideradas separadamente, una por cada porción. Lo anterior evidencia que, para la discriminación de C. corneus y C. usneoides, es de suma importancia considerar la porción a lo largo del talo en la que se deben tomar las medidas.
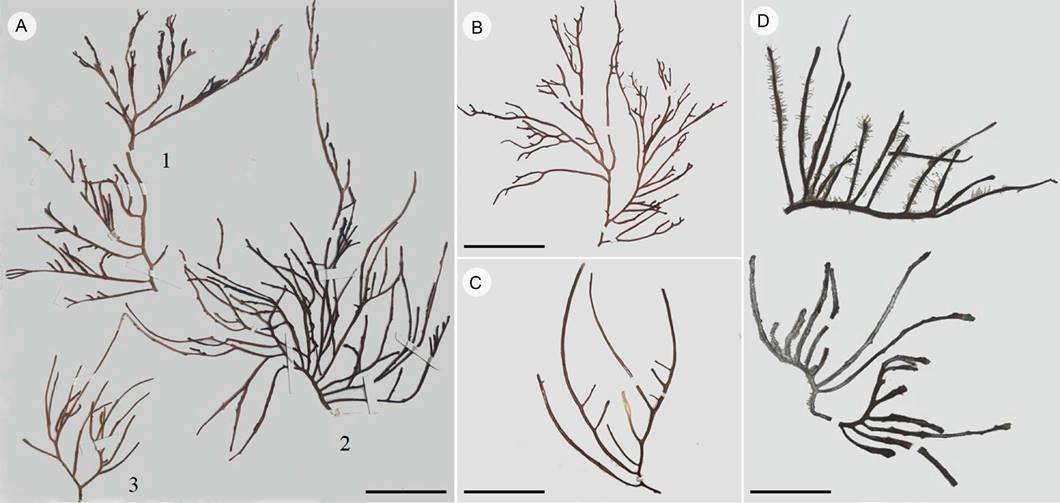
Figura 5: Ejemplares de Crassiphycus corneus (J. Agardh) Gurgel, J.N. Norris et Fredericq y C. usneoides (C. Agardh) Gurgel, J.N. Norris et Fredericq. A1. C. usneoides de Puerto Morelos, Quintana Roo; A2. C. corneus de Puerto Morelos, Quintana Roo; A3. C. usneoides de Puerto Morelos, Quintana Roo; B. C. corneus de Puerto Morelos, Quintana Roo; C. C. usneoides de Puerto Progreso, Yucatán; D. C. corneus de Puerto Progreso, Yucatán, México. Escala: 4 cm.
El análisis morfométrico realizado demostró ser eficiente para la segregación de las especies del complejo Crassiphycus corneus-C. usneoides, lo cual resulta trascendental si se toma en cuenta que, hasta el momento, los caracteres morfológicos no brindan información suficientemente robusta para su diferenciación taxonómica, problema que es atribuido a la baja plasticidad fenotípica entre ambas especies, resultado de su distribución simpátrica, al ser especies sujetas a las mismas presiones de selección. Estos resultados, además, son relevantes debido a que C. corneus es considerada una fuente importante de agar, polisacárido usado ampliamente en la industria alimentaria, farmacéutica, biotecnológica y médica (Dreckmann 2012; Núñez-Resendiz et al., 2015).
En este sentido, resultaría necesario continuar con estudios morfométricos, incorporando la perspectiva geométrica, la cual complementaria los resultados obtenidos, con la geometría o forma de las estructuras, permitiendo hallar nuevos caracteres que diferencien a ambas especies. Dichos estudios podrán servir como punto de referencia para la delimitación taxonómica de otras especies con la misma problemática, no solo dentro de la familia Gracilariaceae, si no de muchos géneros y familias de algas rojas.











 nova página do texto(beta)
nova página do texto(beta)



