Introducción
Flaveria Juss. (Asteraceae, Subfamilia Asteroideae, Tribu Tageteae) es un género que incluye 23 especies americanas, distribuidas en el Caribe, desde el centro y sur de Estados Unidos de América hasta el norte de Centroamérica y desde Venezuela extendiéndose hasta las regiones del Noroeste, Noreste, Centro y la Patagonia de Argentina (Powell, 1978; Novara y Petenatti, 2012). El género está representado en Argentina por dos especies: Flaveria bidentis (L.) Kuntze y F. haumanii Dimitri & Orfila (Bártoli et al., 2008). Estos taxones son hierbas nativas, anuales, F. bidentis ocurre de 0 a 3000 m s.n.m. y F. haumanii entre 0-1500 m s.n.m. (Petenatti y Ariza Espinar, 1997; Zuloaga y Morrone, 1999; Bártoli et al., 2008; Novara y Petenatii, 2012). A su vez, F. bidentis se ha citado como especie invasora en países de otros continentes, entre ellos Egipto (África), Francia e Inglaterra (Europa), Japón y China (Asia), y Australia (Oceanía) (Chai et al., 2012).
Morfológicamente, Flaveria se caracteriza por la reducción de piezas florales; en muchas especies, las diferencias se basan en la distribución que presentan, hábitat, follaje, capitulescencias las que pueden estar formadas por cabezas fuertemente agrupadas o laxas, en panículas corimbosas generalmente planas, o inflorescencias similares a glomérulos axilares sésiles; cabezuelas radiadas o discoides (Powell, 1978).
Una característica de las plantas anuales, como Flaveria bidentis y F. haumanii, es que tienen sólo una oportunidad durante su ciclo de vida para reproducirse y dejar descendencia; debido a ello, la supervivencia de estas especies depende de las condiciones ambientales prevalecientes, motivo por el cual la autofertilización puede considerarse un modo de reproducción sexual muy ventajoso (Proctor y Yeo, 1979). En las plantas donde las visitas de los polinizadores son limitadas y tienen estrategia monocárpica; la autogamia es un mecanismo que asegura la descendencia (Hagerup, 1951; Baker, 1955; Stebbins, 1957; Richards, 1986). El número y tamaño de los cromosomas tiene incidencia directa en los valores del índice de recombinación/ número de entrecruzamientos que tienen lugar durante la meiosis I (Darlington, 1939), los cuales están estrechamente relacionados con el modo de fertilización de las plantas; las especies con autofecundación se caracterizan por presentar complementos cromosómicos dotados de pocos y pequeños cromosomas, es decir, factores que generan la reducción potencial de quiasmas. Esta característica condiciona los sistemas genéticos con directa incidencia sobre el valor de recombinación total, afectando la variabilidad natural (Stebbins, 1971; Gabriele et al., 2009).
Citológicamente, en Asteraceae, solo una pequeña parte de las especies han sido analizadas y los recuentos de sus cromosomas han determinado una gran variedad en los números cromosómicos, desde n=2, por ejemplo, en Xanthisma gracile (Nutt.) D.R. Morgan & R.L. Hartm. y Brachyscome lineariloba (DC.) Druce, hasta formas poliploides con n=432 aproximadamente, en Olearia albida Hook f. (Beuzenberg y Hair, 1984).
Powell (1978) mencionó como número cromosómi co más representativo para Flaveria n=18, esto se ve reflejado en 18 de las 21 especies que cuentan con recuentos cromosómicos (Keil y Stuessy, 1977; Powell, 1978; Powell y Powell, 1978). Existen conteos cromosómicos gametofíticos de n=18 para F. bidentis provenientes de material de la flora Argentina y un recuento esporofítico de 2n=36 perteneciente a ejemplares de la flora de China (Powell y Powell, 1978; Robinson et al., 1981; Hunziker et al., 1990; Shi Li et al., 2006). Por el contrario, hasta el momento F. haumanii no cuenta con recuentos. El objetivo de este trabajo fue caracterizar citogenéticamente a F. bidentis y F. haumanii a través del análisis de la mitosis, el comportamiento meiótico y la estimación de la viabilidad del polen.
Materiales y Métodos
Material estudiado
El material fue recolectado en la provincia de Santiago del Estero (Argentina) y depositado en el Herbario Fanerogámico de la Fundación Miguel Lillo (LIL).
Material examinado de Flaveria bidentis: ARGENTINA. Provincia Santiago del Estero, Departamento San Pedro, Zanjón, 178 m s.n.m., 27º51'05.89''S, 64º14'34.19''O, 09.V.2014, V. de los A. Páez s.n. (LIL 613.740 A, B).
Material examinado de Flaveria haumanii: ARGENTINA. Provincia Santiago del Estero, Departamento Ojo de Agua, Isla Verde, 125 m s.n.m., 28°38'27.87''S, 64º05'12.35''O, 09.V.2014, V. de los A. Páez s.n. (LIL 613.733 A, B, C).
Metodología
Mitosis
Para el estudio se obtuvieron radículas de semillas germinadas que se pretrataron con 8-hidroxiquinoleina 0.002 M durante ocho horas a temperatura ambiente, posterior mente se fijaron en Farmer (alcohol etílico-ácido acético, 3:1) por 24 horas, y fueron conservadas a 4 °C en alcohol etílico 70%. Las raíces se hidrolizaron en HCl 1N durante 15 minutos a 60 °C (Estufa Dalvo MCM2, Industria, Argentina), con posterior lavado en agua destilada, después se colorearon y montaron con una gota de hematoxilina propiónica al 2%.
Los parámetros cariotípicos se obtuvieron a partir de siete placas metafásicas y las mediciones se realizaron con el programa Micromeasure 3.3 (Reeves, 2001). Se analizó, para cada par cromosómico, la longitud total de los cromosomas (c); longitud del brazo largo (l) y corto (s), longitud total del complemento cromosómico haploide (TCL) y, para el conjunto cromosómico de cada célula, la longitud cro mosómica media (C), longitud cromosómica máxima y mínima (C máxima, C mínima) e índice centromérico (Ic). Los cromosomas se clasificaron de acuerdo con la metodología propuesta por Levan et al. (1964) y las asimetrías cromosómicas se calcularon de acuerdo con la metodología propuesta por Romero-Zarco (1986).
Análisis estadístico
Para estudiar la relación entre las variables (c, l, s, Ic) de las especies, se llevó a cabo un experimento factorial 2 (especies) × 18 (pares de cromosomas) en un diseño completamente aleatorizado. Para el análisis se emplearon modelos lineales generales y mixtos, considerando a la especie, al par de cromosomas y a su interacción como factores fijos y se modeló la variancia con diferentes funciones. Con el propósito de determinar diferencias significativas entre las medias de las variables de las especies, se utilizó la prueba Di Rienzo, Guzmán y Casnoves o DGC (Di Rienzo et al., 2012). Con la finalidad de modelar la varianza se utilizaron los criterios de Akaike AIC (Akaike, 1973) y Bayesiano de Schwarz BIC (Schwarz, 1978), seleccionándose el modelo que tuvo el menor valor de AIC y BIC. Los datos se analizaron mediante el empleo del programa InfoStat (Di Rienzo et al., 2012).
Meiosis
Se recolectaron botones florales que se fijaron, colorearon y conservaron con el mismo protocolo empleado para el tratamiento de los meristemas radiculares. Se examinaron 50 células por cada estadio de la meiosis para este análisis. En diacinesis se estimó el número de bivalentes, la frecuencia de quiasmas e índice de recombinación de cada especie analizada. Se calculó el índice de recombinación (RI) de ambos taxones, el cual es una medida de la recombinación meiótica total intra e intercromosómica, que se obtuvo mediante la suma del número haploide de cromosomas (n) y el promedio de quiasmas por célula (Q/II) (Darlington, 1939).
Viabilidad de polen
La estimación de la viabilidad de los granos de polen se llevó a cabo con dos técnicas: a) la solución de Mützing (glicerina-carmín 1:1) para material fijado (Sharma y Sharma, 1965) y b) el fluorocromo diacetato de fluoresceína (DAF), en flores inmediatamente después de la antesis (Heslop- Harrison y Heslop-Harrison, 1970). En ambos casos se to maron diez flores al azar, y como valor mínimo 1000 granos de polen.
Las microfotografías se obtuvieron con una cámara Qcolor-5 (Ontario, Canadá) montada a un microscopio Olympus BX43 (Tokio, Japón). Los idiogramas se realizaron con el software CorelDrawX3.
Resultados
Mitosis
El estudio mitótico evidenció que ambas especies poseen un número cromosómico esporofítico 2n=36 (Figs. 1A-B). La fórmula cariotípica registrada para F. bidentis y F. haumanii fue de 36 m. En el Cuadro 1 se registran los parámetros morfométricos del complemento cromosómico para cada especie analizada.
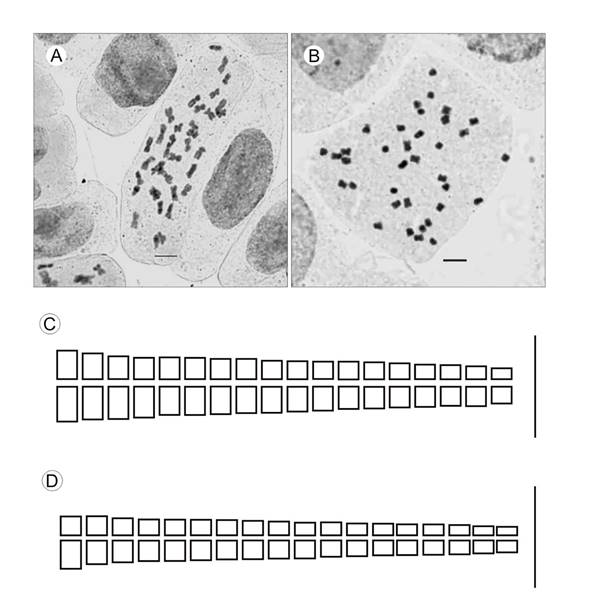
Figura 1: Cariotipo e idiograma de Flaveria bidentis (L.) Kuntze y F. haumanii Dimitri & Orfila. A, C. Flaveria bidentis. B, D. Flaveria haumanii. Escala=5 μm.
Cuadro 1: Parámetros morfométricos de los cromosomas de Flaveria bidentis (L.) Kuntze y F. haumanii Dimitri & Orfila. Longitud cromosómica total (c), longitud del brazo largo (l), longitud del brazo corto (s), índice centromérico medio (Ic), metacéntrico (m), error estándar (ES).
| Par cromosómico | c(µm) ± ES | l(µm) ± ES | s(µm) ± ES | Ic | Tipo cromosómico |
| F. bidentis (L.) Kuntze | |||||
| 1 | 3.08 ± 0.30 | 1.70 ± 0.17 | 1.38 ± 0.13 | 44.80 | m |
| 2 | 2.86 ± 0.28 | 1.60 ± 0.17 | 1.26 ± 0.13 | 4.05 | m |
| 3 | 2.69 ± 0.26 | 1.58 ± 0.16 | 1.11 ± 0.11 | 41. 26 | m |
| 4 | 2.55 ± 0.25 | 1.50 ± 0.16 | 1.05 ± 0.11 | 41.17 | m |
| 5 | 2.45 ± 0.23 | 1.38 ± 0.13 | 1.07 ± 0.11 | 43.67 | m |
| 6 | 2.42 ± 0.23 | 1.38 ± 0.11 | 1.04 ± 0.14 | 42.97 | m |
| 7 | 2.34 ± 0.23 | 1.35 ± 0.15 | 0.99 ± 0.10 | 42.30 | m |
| 8 | 2.28 ± 0.22 | 1.29 ± 0.12 | 0.99 ± 0.10 | 43.42 | m |
| 9 | 2.17 ± 0.20 | 1.27 ± 0.10 | 0.90 ± 0.11 | 41.47 | m |
| 10 | 2.09 ± 0.18 | 1.21 ± 0.11 | 0.88 ± 0.08 | 42.10 | m |
| 11 | 2.02 ± 0.18 | 1.17 ± 0.12 | 0.85 ± 0.09 | 42.07 | m |
| 12 | 1.96 ± 0.16 | 1.09 ± 0.12 | 0.87 ± 0.08 | 44.38 | m |
| 13 | 1.89 ± 0.16 | 1.06 ± 0.11 | 0.83 ± 0.06 | 43.91 | m |
| 14 | 1.79 ± 0.16 | 1.01 ± 0.09 | 0.78 ± 0.08 | 43.57 | m |
| 15 | 1.70 ± 0.15 | 0.99 ± 0.09 | 0.71 ± 0.07 | 41.76 | m |
| 16 | 1.62 ± 0.15 | 0.93 ± 0.08 | 0.69 ± 0.08 | 42.59 | m |
| 17 | 1.58 ± 0.14 | 0.95 ± 0.06 | 0.63 ± 0.09 | 39.87 | m |
| 18 | 1.35 ± 0.13 | 0.82 ± 0.10 | 0.53 ± 0.06 | 39.25 | m |
| F. haumanii Dimitri & Orfila | |||||
| 1 | 2.32 ±0.13 | 1.39 ±0.11 | 0.93 ±0.05 | 40.08 | m |
| 2 | 2.10 ±0.09 | 1.16 ±0.06 | 0.94 ±0.04 | 44.76 | m |
| 3 | 1.91 ±0.04 | 1.07 ±0.04 | 0.84 ±0.03 | 43.97 | m |
| 4 | 1.83 ±0.04 | 1.04 ±0.04 | 0.79 ±0.03 | 43.16 | m |
| 5 | 1.76 ±0.04 | 1.03 ±0.04 | 0.73 ±0.06 | 41.47 | m |
| 6 | 1.73 ±0.03 | 0.97 ±0.04 | 0.76 ±0.05 | 43.93 | m |
| 7 | 1.68 ±0.02 | 0.93 ±0.02 | 0.75 ±0.03 | 44.64 | m |
| 8 | 1.63 ±0.3 | 0.92 ±0.02 | 0.71 ±0.03 | 43.56 | m |
| 9 | 1.56±0.04 | 0.89 ±0.04 | 0.67 ±0.03 | 42.95 | m |
| 10 | 1.51 ±0.04 | 0.88 ±0.04 | 0.63 ±0.03 | 41.72 | m |
| 11 | 1.44 ±0.04 | 0.80 ±0.03 | 0.64 ±0.04 | 44.44 | m |
| 12 | 1.35 ±0.04 | 0.77 ±0.04 | 0.58 ±0.03 | 42.96 | m |
| 13 | 1.30 ±0.05 | 0.73 ±0.05 | 0.57 ±0.02 | 43.84 | m |
| 14 | 1.26 ±0.05 | 0.72 ±0.02 | 0.54 ±0.03 | 42.86 | m |
| 15 | 1.24 ±0.04 | 0.70 ±0.04 | 0.54 ±0.03 | 43.55 | m |
| 16 | 1.19 ±0.05 | 0.68 ±0.04 | 0.51 ±0.02 | 42.86 | m |
| 17 | 1.09 ±0.04 | 0.64 ±0.03 | 0.45 ±0.03 | 41.28 | m |
| 18 | 1.00 ±0.05 | 0.58 ±0.02 | 0.42 ±0.03 | 42.00 | m |
En Flaveria bidentis la longitud total del complemento cromosómico y la longitud cromosómica media registrada fueron de 68.98 y 1.91 μm respectivamente (Cuadro 2); la variación de sus longitudes cromosómicas medias osciló entre 3.08-1.35 μm (Cuadro 1). El índice centromérico medio tuvo un valor de 42.15 colocando a sus cromosomas en la categoría de metacéntricos (Fig. 1C). El cariotipo es unimodal por la semejanza en el tamaño cromosómico, justificado por el valor del índice de asimetría intercromosómica A2=0.20. El índice de asimetría intracromosómica indica un cariotipo simétrico con A1=0.30 (Cuadro 2).
Cuadro 2: Parámetros cariotípicos de Flaveria bidentis (L.) Kuntze y F. haumanii Dimitri & Orfila. Referencias: Longitud total del complemento cromosómico haploide (TCL). Longitud cromosómica media (C). Longitud cromosómica máxima y mínima (C máxima, C mínima). Índice centromérico medio (Ic). Índice de asimetría intracromósomica (A1). Índice de asimetría intercromosómica (A2). Metacéntrico (m).
| Parámetros | F. bidentis (L.) Kuntze | F. haumanii Dimitri & Orfila |
| 2n | 36 | 36 |
| Formula cariotípica | 36 m | 36 m |
| TCL (µm) | 68.98 | 54.65 |
| C (µm) | 1.91 | 1.51 |
| C máxima (µm) | 3.08 | 2.48 |
| C mínima (µm) | 1.35 | 0.98 |
| Ic | 42.15 | 43.07 |
| A1 | 0.30 | 0.32 |
| A2 | 0.20 | 0.22 |
En Flaveria haumanii, el complemento cromosómico total y la longitud cromosómica media calculados fueron de 54.65 y 1.51 μm respectivamente (Cuadro 2), mientras que las longitudes cromosómicas medias variaron entre 2.48- 0.98 μm (Cuadro 1). El valor del índice centromérico medio de 43.07 refleja cromosomas con categoría de metacéntrico (Fig. 1D). El cariotipo es unimodal y simétrico con valores de A2=0.22 y A1=0.32 respectivamente (Cuadro 2).
Análisis estadístico
El análisis estadístico mostró que los factores (especies y par cromosómico) resultaron significativos, no así la interacción (p=0.99), por lo que los factores especie y par de cromosómico actúan en forma independiente. Para las variables analizadas al comparar las medias con la prueba DGC, mostró menores valores en F. haumanii (1.55) con respecto a F. bidentis (2.16). El análisis del índice centromérico no resultó significativo para las variables especie, par de cromosomas e interacción.
El análisis estadístico de la variable c para ambas especies mostró diferencias significativas formándose tres grupos: el primero comprende los pares cromosómicos 1-8, el segundo con los pares 9-13 y el tercero incluye los pares 14-18. Para la variable l, el análisis determinó tres grupos que no se corresponden con los anteriores, un grupo comprende los pares 1-3, otro abarca los pares 4-10, y el tercero, del par 11-18. Finalmente, la variable s arrojó cuatro grupos: el primero abarca los pares 1-2, el segundo los pares 3-9, el tercero los pares 10-16 y el último incluye los pares 17-18 (Cuadro 3).
Cuadro 3: Medias ajustadas para la variable pares cromosómicos por análisis DGC. Medias con una letra común no son significativamente diferentes (p˃0.05). Referencias: Longitud cromosómica total (c). Longitud del brazo largo (l). Longitud del brazo corto (s).
| Par cromosómico | c | l | s | c | l | s |
| 1 | 2.7 | 1.55 | 1.16 | A | D | G |
| 2 | 2.48 | 1.38 | 1.10 | A | D | G |
| 3 | 2.31 | 1.33 | 0.97 | A | D | H |
| 4 | 2.19 | 1.27 | 0.92 | A | E | H |
| 5 | 2.11 | 1.21 | 0.90 | A | E | H |
| 6 | 2.08 | 1.18 | 0.90 | A | E | H |
| 7 | 2.01 | 1.14 | 0.87 | A | E | H |
| 8 | 1.96 | 1.11 | 0.84 | A | E | H |
| 9 | 1.87 | 1.07 | 0.79 | B | E | H |
| 10 | 1.80 | 1.05 | 0.75 | B | E | I |
| 11 | 1.73 | 0.99 | 0.74 | B | F | I |
| 12 | 1.66 | 0.93 | 0.73 | B | F | I |
| 13 | 1.60 | 0.90 | 0.70 | B | F | I |
| 14 | 1.52 | 0.87 | 0.66 | C | F | I |
| 15 | 1.47 | 0.84 | 0.63 | C | F | I |
| 16 | 1.41 | 0.81 | 0.6 | C | F | I |
| 17 | 1.30 | 0.75 | 0.54 | C | F | J |
| 18 | 1.23 | 0.75 | 0.48 | C | F | J |
Meiosis
En el análisis de la meiosis de las dos especies estudiadas, se observó cómo número gametofítico n=18 (Figs. 2A-B). En F. bidentis las células madre del polen (CMP) durante diacinesis presentaron la mayoría de sus bivalentes cerrados (54.61%) con quiasmas distales (70.66%), el promedio de quiasmas por bivalente (Q/II) fue de 1.54 y el índice de recombinación IR=45.82; mientras que en F. haumanii los bivalentes son cerrados (38.88%) con quiasmas distales (56.65%), el promedio de quiasmas por bivalente es de 1.37 y el IR=42.71 (Cuadro 4).
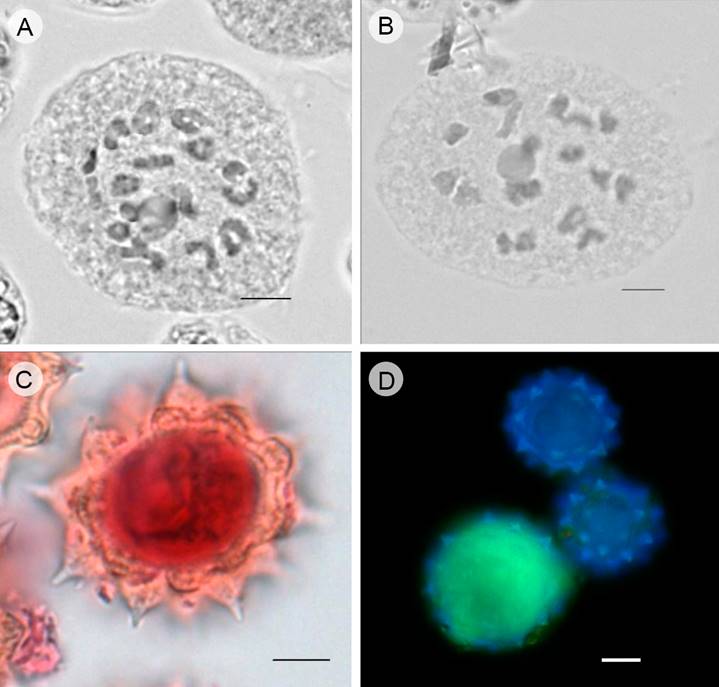
Figura 2: Diacinesis y viabilidad polínica de Flaveria bidentis (L.) Kuntze y F. haumanii Dimitri & Orfila. A. Flaveria bidentis, diacinesis n=18; B. Flaveria haumanii, diacinesis n=18; C. Flaveria haumanii, grano de polen viable teñido con Mützing; D. Flaveria bidentis, grano de polen viable (fluorescente) y granos inviables teñidos con DAF. Escala=5 µm.
Cuadro 4: Síntesis de parámetros meióticos de Flaveria bidentis (L.) Kuntze y F. haumanii Dimitri & Orfila. Diacetato de fluoresceína (DAF), error estándar (ES).
| Especie |
F.
bidentis
(L.) Kuntze |
F.
haumanii
Dimitri & Orfila |
| n | 18 | 18 |
| Bivalentes por célula ± ES | ||
| Cerrados | 9.83 ± 4.88 | 7.00 ± 2.52 |
| Abiertos | 8.17 ± 4.88 | 10.71 ± 2.50 |
| Totales | 18 | 18 |
| Quiasma por célula ± ES | 93 | 98 |
| Distales | 19.67 ± 9.75 | 14 ± 5.03 |
| Intersticiales | 8.17 ± 4.88 | 10.71 ± 2.5 |
| Totales | 27.83 ± 4.88 | 24.71 ± 2.63 |
| Quiasmas por bivalente ± ES | 1.54 ± 0.27 | 1.37 ± 0.15 |
| Índice de Recombinación (IR) | 45.82 | 42.71 |
| Viabilidad de polen | ||
| Mützing | 95.20% | 90% |
| DAF | 90% | 74% |
En la primera etapa de la división meiótica se observaron en F. bidentis metafase I (MI) con 8% de sus cromosomas fuera de placa ecuatorial; desde la anafase (AI) hasta la telofase (TI) las células exhibieron un comportamiento meiótico regular. En la segunda división meiótica se presentaron células regulares en los diferentes estadios; asimismo, durante el desarrollo de las tétradas no se observaron irregularidades.
En F. haumanii, en ambas etapas de la división, se observaron células con irregularidades meióticas con baja frecuencia, sólo 2% de las CMP con cromosomas fuera de la placa ecuatorial. El comportamiento de los cromosomas durante la división meiótica fue normal y la formación de tétradas regular.
Viabilidad de Polen
La estimación de la viabilidad de los granos de polen determinada con la solución de Mützing fue de 95.20% en F. bidentis y 90% en F. haumanii (Fig. 2C), mientras que con DAF en F. bidentis arrojó valores de 90% (Fig. 2D) y en F. haumanii de 74%. En el Cuadro 4 se resumen los parámetros meióticos analizados en diacinesis, MI y la viabilidad de polen de F. bidentis y F. haumanii.
Discusión
Lewis (1980) propuso el número básico x=9 para la familia Asteraceae, y sugirió que según la tribu analizada pueden presentarse otros dos números básicos diferentes al establecido para la familia: x=10 o 17. Por otro lado, Powell (1978) sostiene que Flaveria presenta un número básico x=18, siendo la mayoría de sus especies diploides. No obstante, hay indicios que sugieren un número básico menor a éste. Anderson (1972) observó n=9 para F. campestris J.R. Johnst. como ejemplo de polihaploide (planta haploide que deriva de un individuo poliploide). La poliploidía no es común en el género, por lo que Powell (1978) reportó n=36 para F. pringlei Gand., como única especie poliploide encontrada hasta el momento. Los antecedentes citogenéticos revelaron para Flaveria el número básico x=18, por lo tanto, los resultados del presente estudio se corresponden con la información mencionada (Turner, 1971, 1975; Powell, 1978), e indican que los taxones analizados son diploides y de comportamiento meiótico regular.
El análisis estadístico en F. bidentis y F. haumanii corrobora las diferencias entre ellas y esto puede ser observado en los pares cromosómicos antes mencionados para c, l y s. Shi Li et al. (2006) realizaron estudios citogenéticos en una población de F. bidentis proveniente de China y registraron la fórmula cariotípica de 24m+8sm+4st, la longitud total cromosómica de 81.16 µm y el rango de variación en los cromosomas de 1.12-3.36 µm. Aunque la fórmula cariotípica es disímil a la encontrada en este estudio (36 m), así como también la longitud total cromosómica, el rango de variación se asemeja a lo reportado por estos autores, la causa de esta diferencia podría deberse a alteraciones cromosómicas estructurales o bien al tiempo de exposición de las raíces al pretratamiento que difiere en ambos estudios.
Powell (1978) cita que las especies anuales, entre ellas F. bidentis, son autocompatibles y ocasionalmente la autofertilización puede ser estimulada por la fricción de los glomérulos; también mencionó que la fecundación cruzada que exhiben estas especies se debe a insectos polinizadores que se ven atraídos por las flores liguladas. La autofertilización reduce la variabilidad genética dentro de las poblaciones, no obstante, siempre existe cierta cantidad de entrecruzamiento durante las divisiones meióticas que evita o anula por completo la depresión por endogamia (Richards, 1986; Charlesworth y Charlesworth, 1987).
Koella (1993) realizó un análisis de las correlaciones ecológicas entre la frecuencia de quiasmas y el índice de recombinación de diferentes especies de plantas. En la mayoría de las especies con semillas pequeñas y amplia capacidad de dispersión estudiadas por este autor, los valores de IR oscilaron entre 19.4 y 27.1. Estos datos no son acordes a los resultados del presente estudio, debido a que tanto F. bidentis como F. haumanii son especies con semillas pequeñas; sin embargo, los valores de IR son considerablemente mayores a los descritos por Koella (1993).
Kulshreshtha y Gupta (1979) citan datos referentes a índice de recombinación y frecuencia de quiasma para el género Helianthus L., de un total de 28 taxones analizados, diez son especies anuales diploides con n=17; el índice de recombinación de estas especies varía de 22.60-28.83 y la frecuencia de quiasma entre 1.32-1.57, valores distintos a los encontrados en las especies estudiadas en el presente trabajo. Asimismo, Gabriele et al. (2009) realizaron sus propias investigaciones en Commelina benghalensis L.; otra maleza ampliamente distribuida en todos los continentes, los resultados que obtuvieron son disimiles a los de nuestro aporte (IR=37.3 y Q/II=1.9). Las diferencias pueden deberse a que el IR está directamente influenciado por el tamaño de los cromosomas y el nivel de ploidía de cada especie, presentando valores más grandes cuanto mayor sea el número y tamaño de los cromosomas (Kulshreshtha y Gupta, 1979; Gabriele et al., 2009).
La viabilidad del polen representa una medida confiable de estimación del potencial reproductivo masculino de las plantas (Alexander, 1980); ésta proporciona información necesaria para conocer la capacidad reproductiva de una especie y, con certeza científica, saber las posibilidades de perpetuidad del genoma analizado; además, su importancia en la agricultura se estima como un parámetro válido durante el período de planificación de un cultivo y/o su mejoramiento (Alexander, 1980). Tanto F. bidentis como F. haumanii mostraron alta viabilidad de los granos de polen con las técnicas empleadas, como consecuencia directa del comportamiento meiótico regular, hecho que concuerda con la amplia capacidad reproductiva de ambas especies.
Conclusiones
Por primera vez se dan a conocer los números cromosómicos gametofítico y esporofítico, para F. haumanii, como así el comportamiento meiótico (incluyendo su capacidad de recombinación) y la viabilidad de los granos de polen para F. bidentis y F. haumanii. Los datos recabados aquí podrían tener relevancia durante la planificación de estrategias de control, debido a la capacidad invasora de estas plantas.











 nova página do texto(beta)
nova página do texto(beta)



