Introducción
Los bosques ribereños son de los ecosistemas más vulnerables al cambio de uso del suelo generado por actividades humanas como la agricultura, ganadería, transporte, comunicación y urbanización (Apan et al., 2002; Burton et al., 2005, 2009; Vásquez et al., 2015). Estas actividades han provocado pérdidas y cambios en la diversidad, estructura y dinámica en los ecosistemas ribereños (Yoshida y Oka, 2004; Richardson y Rejmánek, 2011), afectando sustancialmente los servicios ecosistémicos de las riberas (Naiman et al., 2000; Meli et al., 2017). En comunidades tropicales la diversidad y estructura de la vegetación varían a través del gradiente altitudinal (Acosta et al., 2008; García y Wollmann, 2012) y por el efecto de las actividades antropogénicas (Apan et al., 2002, Burton et al., 2005; Sunil et al., 2010; Dummel y Pinazo, 2013), lo cual genera cambios en la comunidad de especies vegetales (Ramírez y Gutiérrez-Fonseca, 2016).
Los bosques ribereños tienen múltiples funciones, entre las más importantes se pueden mencionar: la reducción de sedimentos y contaminantes hacia los sistemas acuáticos, la mitigación de inundaciones, mantenimiento y distribución de nutrientes de suelo a lo largo del río (Granados-Sánchez et al., 2006; Nilsson y Renöfält, 2008; Arthington et al., 2010). Además, los bosques ribereños proveen recursos para la sobrevivencia de las poblaciones aledañas (Millennium Ecosystem Assessment, 2005; Garrido et al., 2010; Meli et al., 2017). Dada la importancia y la información aún escasa sobre los ecosistemas ribereños y su influencia con las actividades antropogénicas en áreas adyacentes en el estado de Tabasco y el sureste de México, surge la necesidad de evaluar a escala local, la diversidad y estructura de la vegetación ribereña y su relación con algunas métricas del paisaje. Los sitios de estudio forman parte de los hábitats críticos para la conservación de la especie arbórea Recchia simplicifolia Wendt & Lott (Wendt y Lott, 1985; Moreno-Jiménez et al., 2017). The World Conservation Monitoring Centre (1998)cataloga a esta especie como en Peligro de extinción (EN), por lo que los sitios pueden ser considerados como refugio para la especie; así como otros grupos taxonómicos asociados al corredor ribereño (aves, mamíferos, anfibios y reptiles). De acuerdo con Wendt y Lott (1985), estas áreas presentan fuertes afinidades florísticas y pudieron haber servido como refugio de flora tropical durante los climas adversos del Pleistoceno. Además, los sitios forman parte del Parque Estatal La Sierra de Tabasco y del Corredor Biológico Mesoamericano, lo cual realza la importancia de evaluar las condiciones actuales de la vegetación ribereña que servirá como base científica para la generación de estrategias de restauración y conservación de los sistemas ribereños en ríos tropicales. El presente estudio planteó las siguientes preguntas de investigación: ¿Existen diferencias en los atributos de la vegetación ribereña en los cinco sitios situados a lo largo del gradiente ribereño? y ¿existe alguna relación con las métricas del paisaje en áreas adyacentes del río Tacotalpa? En ese sentido, de acuerdo a los datos registrados de presiones antropogénicas en la región, se esperaba encontrar diferencias en la diversidad y la estructura de la vegetación ribereña, así como algunas correlaciones entre las métricas del paisaje.
El objetivo de este estudio fue comparar la diversidad y estructura de la vegetación ribereña en cinco sitios del río Tacotalpa, Tabasco, México y relacionar las variables de la vegetación ribereña con las métricas del paisaje.
Materiales y Métodos
Área de estudio
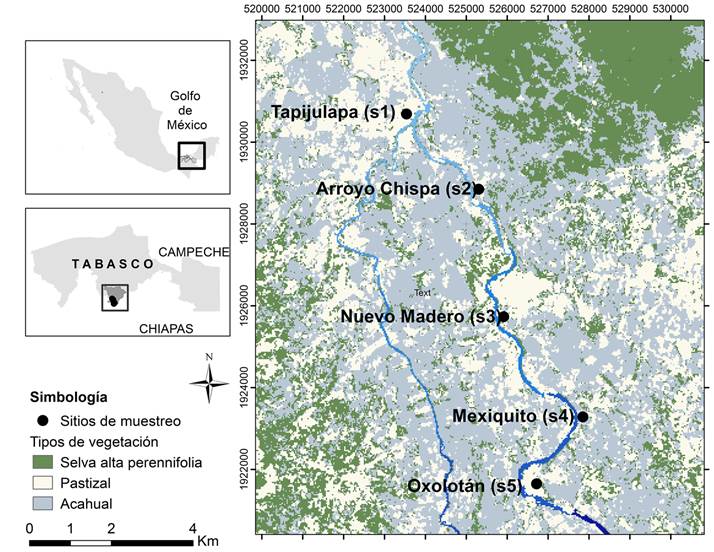
El área de estudio se encuentra ubicada en la subcuenca del río Tacotalpa del municipio Tacotalpa, Tabasco y pertenece a la cuenca río Grijalva-Villahermosa en su porción media y a las corrientes de agua con el nombre Tacotalpa-Sierra de clave RH30Dj (INEGI, 2000). El área colinda al norte con los municipios de Jalapa y Macuspana, Tabasco, rodeada al sur, oeste y este por el estado de Chiapas (Fig. 1). Fisiográficamente pertenece a la Sierra Norte de Chiapas (Ortiz-Pérez et al., 2005). El clima es cálido húmedo con lluvias todo el año Af(m), con una temperatura media anual de 25.6 °C, siendo la máxima media mensual de 29.2 °C en mayo y la mínima de 22 °C en diciembre. La precipitación anual es de 3458 mm (García, 2004). La subcuenca se encuentra entre 40 y 620 m s.n.m., en relieves de colinas, laderas inclinadas, escarpadas, sobre rocas calizas y rocas lutitas, en algunas áreas sobre lutitas areniscas y sedimentos aluviales en las partes bajas (SGM, 2005; Zavala-Cruz et al., 2011). La vegetación original que se encuentra en las partes altas de la subcuenca pertenece a la selva alta perennifolia, compuesta con especies como Ramón (Brosimum alicastrum Sw.), guapaque (Dialium guianense (Aubl.) Sandwith), laurelillo (Nectandra sp.) y bojón (Cordia alliodora (Ruiz & Pav.) Oken) (Maldonado-Sánchez y Maldonado-Mares, 2010). En el bosque ribereño se han reportado especies comunes como: chelele (Inga vera Willd.), coshigue (Trichilia havanensis Jacq.), gusano (Lonchocarpus hondurensis Benth.), uvero (Coccoloba barbadensis Jacq.), macuilís (Tabebuia rosea (Bertol.) Bertero ex A. DC), ciruela (Spondias mombin L.) y Piper spp. (Pérez et al., 2005; Moreno-Jiménez et al., 2017).
Sitios de muestreo
A lo largo del río Tacotalpa se ubicaron cinco sitios entre los 211 y 236 m de altitud (Cuadro 1): Tapijulapa (s1), Arroyo Chispa (s2), Nuevo Madero (s3), Mexiquito (s4) y Oxolotán (s5). Los criterios utilizados para la selección de los sitios analizados, fueron la altitud y las posibilidades de acceso. Estos se ubican en la cuenca media, donde el efecto de los meandros no es tan fuerte como sucede en la parte baja (planicie tabasqueña), donde se observa una mayor acumulación de sedimentos (García, 2011). Los s1 y s2 se localizan sobre rocas de lutitas-areniscas del Terciario Paleógeno, relieves de terraza aluvial y colinas con pendientes que van de 11 a 25%, con suelo Acrisol de media a baja fertilidad. Los s3, s4 y s5 se encuentran en rocas limonitas-areniscas del Terciario Paleógeno, relieves de laderas inclinadas y escarpadas con pendientes de 40 a 100%, suelos Alisoles, arcillosos y con buen contenido nutrimental (SGM, 2005; Zavala-Cruz et al., 2011, 2016).
Cuadro 1: Datos de los cinco sitios de muestreo del río Tacotalpa, Tabasco, México. s1=Tapijulapa, s2=Arroyo Chispa, s3=Nuevo Madero, s4=Mexiquito, s5=Oxolotán.
| Sitios | Número de habitantes | Altitud (m) | Coordenadas geográficas | |
| Latitud N | Longitud W | |||
| s1 | 2846 | 211 | 17°27'43.54'' | -92°46'41.95'' |
| s2 | 175 | 217 | 17°26' 43.59'' | -92°45'42.25'' |
| s3 | 164 | 226 | 17°25'02.20'' | -92°45'21.60'' |
| s4 | 262 | 234 | 17°23'42.36'' | -92°44'16.13'' |
| s5 | 1763 | 236 | 17°22'49.18'' | -92°44'54.56'' |
Método de muestreo de la vegetación ribereña
En cada sitio, se establecieron diez transectos de 100 × 10 m paralelos a la orilla del río con una distancia de 100 m entre cada uno. Posteriormente, se subdividieron en 10 unidades de muestreo de 10 × 10 m (Mostacedo y Fredericksen, 2000) y dentro de ellas se seleccionaron dos unidades de muestreo (UM) con menor alteración. En total se muestrearon 20 UM de 10 × 10 m (2000 m2) en cada sitio. En cada UM se censaron todos los árboles y arbustos con DAP (diámetro a la altura del pecho) a 1.3 m sobre el nivel de suelo ≥1 cm. Se tomaron datos de altura, DAP y número de individuos. La identificación de las especies se realizó con base en la consulta de bibliografía especializada (Gutiérrez, 2004; Pennington y Sarukhán, 2005; Pérez et al., 2005; Lira-Noriega et al., 2007; Espinoza-Jiménez et al., 2014; Gómez-Domínguez et al., 2015; Moreno-Jiménez et al., 2017) y The Plant List (TPL, 2013) para confirmar el nombre correcto de las especies.
Análisis de diversidad y estructura
La diversidad se calculó mediante el número de especies efectivas con la ecuación q D=(∑pi q ) 1/(1-q) ; donde: q D=diversidad verdadera, pi=densidad relativa de la iésima especie, q=orden de la diversidad y define la sensibilidad del índice a las densidades relativas de las especies (Jost, 2006; Moreno et al., 2011; Jost y González-Oreja, 2012). En este análisis se consideraron dos medidas de diversidad verdadera: orden cero ( 0 D), cuyo valor equivale a la riqueza de especies (S), donde la diversidad verdadera es insensible a la densidad relativa de las especies, y el orden 1 ( 1 D), donde todas las especies son consideradas en el valor de diversidad, ponderadas proporcionalmente según su densidad en la comunidad (Jost, 2006; Moreno et al., 2011). El cálculo directo 1 D se puede obtener con el exponencial de entropía de Shannon: 1 D=Exp (-∑pi × ln(pi)) (Jost, 2006), donde: pi=ni/N, que es el número de individuos de la iésima especie entre el número de individuos de todas las especies. La equitatividad se determinó con la ecuación E=H’/ln(S) (Magurran y McGill, 2011).
Para evaluar si el esfuerzo de muestreo fue suficiente se construyó una curva de acumulación de especies considerando las 20 subunidades de muestreo de cada sitio usando Estimates 9.1 (Colwell, 2013). La curva se ajustó con la ecuación de Clench, que es el modelo más usado debido al buen ajuste en la mayoría de los grupos taxonómicos (Moreno y Halffter, 2001; Willott, 2001; Jiménez-Valverde y Hortal, 2003). La similitud florística se determinó mediante un análisis de Cluster Bray-Curtis, tomando en cuenta las densidades absolutas de cada especie (Bray y Curtis, 1957; Ramírez et al., 2012).
La estructura vertical se determinó mediante histogramas de frecuencia en tres categorías de altura (1-10 m, 10-20 m y >20 m), mientras que la horizontal fue por frecuencias agrupadas considerando las clases diamétricas de los arboles ribereños (Zarco-Espinosa et al., 2010 y Zamora-Crescencio et al., 2011).
Métricas del paisaje
Este análisis se apoyó con el método de Dummel y Pinazo (2013) que consiste en utilizar tres escalas de análisis del paisaje (500, 1000 y 2000 m de radio como buffer, partiendo desde cada punto de muestreo). Según éstos autores, la máxima distancia busca evitar la auto-correlación de los datos, debido a la superposición de las áreas definidas en el radio de 2000 m, y en función a la distancia de dispersión de diferentes agentes (tales como el viento y aves) y la influencia del paisaje. En cada sitio se identificó y se determinó la cercanía de infraestructuras asociadas a cambios antropogénicos: la casa más cercana al punto de muestreo, el borde de las zonas urbanas más cercanas, cultivos más cercanos, pastizales más cercanos, remanente de bosque maduro más cercano, complementando con otras variables como las carreteras pavimentadas y terracerías más cercanas hacia el punto de muestreo (Pennington et al., 2010). En total se extrajeron 100 datos de distancias desde el punto de muestreo hacia el borde de cada variable mencionada anteriormente. El análisis se realizó con la ayuda de software ArcGIS 10.0 (ESRI, 2018).
Análisis estadísticos
Para determinar si existen diferencias estadísticamente significativas entre los sitios muestreados para las variables de diversidad verdadera de orden 0 D y 1 D, densidad, DAP y altura de especies leñosas, se empleó un análisis de varianza de un factor (p<0.05) seguido por pruebas post hoc de Tukey. Para determinar posibles interacciones entre las variables de vegetación (diversidad 0 D, 1 D, número de especies arbustivas y arbóreas, densidad y altura de las especies leñosas ribereñas) y las métricas del paisaje como: distancia de la casa más cercana (Dcas), distancia del borde de la zona urbana más cercana (Dzur), distancia del borde de cultivo más cercano (Dcul), distancia del borde de pastizal más cercano (Dpas), distancia del borde del bosque maduro más cercano (Dbosm), distancia de la carretera pavimentada más cercana (Dcarr) y distancia de la terracería más cercana (Dterr) se realizó un análisis de correlación de Pearson. Este último se complementó con un análisis de componentes principales (ACP), utilizándose el paquete estadístico PAST (Hammer, 2012) y SPSS (Castañeda et al., 2010). Todas la pruebas estadísticas se realizaron con un nivel de α=0.05.
Resultados
Composición florística
En el presente trabajo se registraron 2589 individuos distribuidos en 38 familias, 92 géneros y 119 especies. Nueve familias concentran el mayor número de especies: Fabaceae (19), Moraceae (10), Euphorbiaceae (7), Malvaceae (7), Myrtaceae (7), Rubiaceae (7), Lauraceae (5), Meliaceae (5) y Piperaceae (5), resaltando la diversidad representada por las primeras dos familias conteniendo 19 y 10 especies (Fig. 2). Los géneros más diversos fueron Piper L. (5), Ficus L. (4) Nectandra Rottb., Acalypha L. y Lonchocarpus Kunth (3) (Apéndice). Los valores más altos de riqueza de especies se presentaron en s4 y s5 (70 y 69 especies), mientras que s2 presentó el más bajo (52) (Cuadro 2).
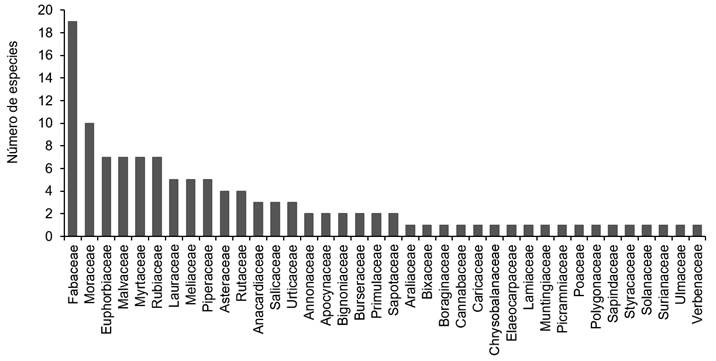
Figura 2: Frecuencia de especies por familia botánica registrada en los cinco sitios de muestreo en los márgenes del río Tacotalpa, Tabasco, México.
Cuadro 2: Composición, diversidad y equitatividad de la vegetación ribereña en cinco sitios del río Tacotalpa, Tabasco. 1 D=Diversidad verdadera de orden 1; s1=Tapijulapa, s2=Arroyo Chispa, s3=Nuevo Madero, s4=Mexiquito y s5=Oxolotán; a=no existe diferencias estadísticas entre los cinco sitios.
| Sitios | Individuos | Familias | Géneros | Especies | 1 D | Equitatividad |
| s1 | 774 | 25 | 45 | 54 | 8.15ª | 82 |
| s2 | 359 | 22 | 43 | 52 | 5.64ª | 80 |
| s3 | 512 | 27 | 54 | 65 | 8.38ª | 82 |
| s4 | 575 | 23 | 55 | 70 | 7.77ª | 82 |
| s5 | 369 | 28 | 55 | 69 | 8.00ª | 87 |
| Total | 2589 |
Las curvas de acumulación de especies señalan que el s4 acumuló especies más rápidamente y con mayor riqueza (70), seguido del s5, s3, s1 y s2 (69, 65, 54 y 52 respectivamente) (Fig. 3). En este orden, el modelo de Clench estimó 86, 90, 80, 67 y 62 especies, indicando que el inventario de árboles ribereños fue representativo en los cinco sitios (>75%). De acuerdo al modelo de Clench, el valor de R2 =0.99 mostró buen ajuste en las curvas de acumulación de especies en los cinco sitios. La pendiente de la curva tuvo valores menores de 0.1, indicando que se logró un inventario altamente fiable (Jiménez-Valverde y Hortal, 2003). La similitud florística entre los sitios osciló entre 0.41 a 0.58 (Cophen. Corr.=0.79). Los sitios con mayor similitud fueron s3 y s4 (0.58), mientras que s1 y s2 mostraron la menor similitud florística (0.41) (Fig. 4).

Figura 3: Curvas de acumulación de especies en los cinco sitios muestreados en los márgenes del río Tacotalpa, Tabasco, México. Las líneas punteadas representan el modelo ajustado a la ecuación de Clench para cada sitio.
Análisis estructural
Los datos de estructura vertical indican que en los sitios s1 y s3 estuvieron conformados por solo dos estratos de altura de árboles ribereños, bajo (0-10 m) y medio (10-20 m), mientras que en s2, s4 y s5 presentaron individuos en los tres estratos. El 90.46% de árboles ribereños (2342) estuvo concentrado en el estrato inferior y 9.54% en los estratos medio y alto (236 y 11) (Fig. 5). La estructura horizontal estuvo representada por una mayor densidad de árboles en diámetros pequeños de hasta 10 cm (2321 individuos), representando el 89.65% del total de los individuos y 10.35% en las categorías restantes mayores de 10 cm (238). La mayoría de los sitios registraron individuos en todas las categorías, excepto en s1 que no registró ningún individuo en la última categoría diamétrica (>30 cm) (Fig. 6).
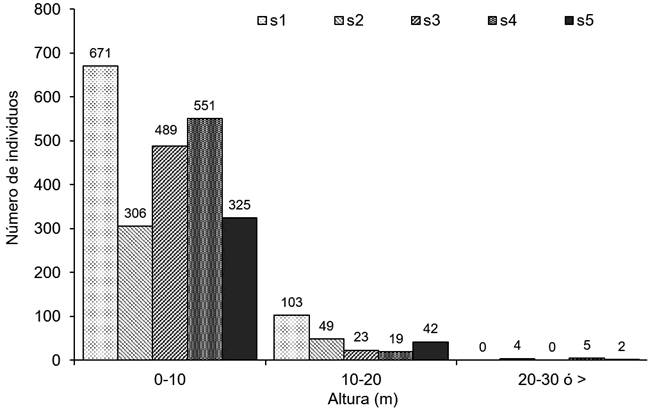
Figura 5: Diagrama de la estructura vertical basado en la frecuencia de individuos de especies leñosas en los diferentes estratos de altura obtenidos para los sitios de muestreo en los márgenes del río Tacotalpa, Tabasco, México. Los números sobre las barras representan el número de individuos por sitio.
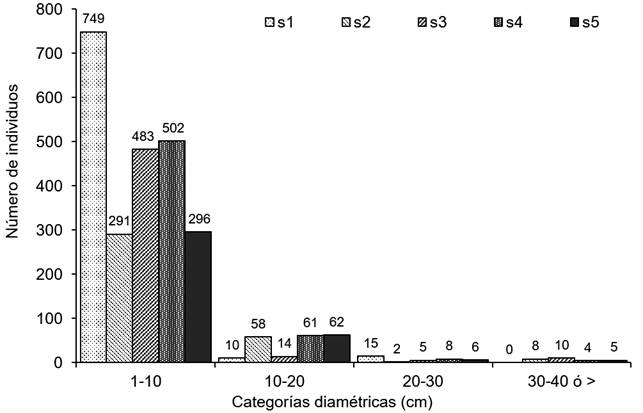
Figura 6: Diagrama de la estructura horizontal basado en la frecuencia de individuos de especies leñosas en las diferentes clases diamétricas obtenidas para los sitios de muestreo en los márgenes del río Tacotalpa, Tabasco, México. Los números sobre las barras representan el número de individuos por sitio.
Atributos ecológicos
Los resultados del ANOVA indican que existen diferencias estadísticamente significativas entre los sitios estudiados (p<0.05) para la diversidad 0 D. El sitio s2 presentó los valores más bajos de 0 D, siendo estadísticamente menor que los valores obtenidos en s1 y s3 (Tukey; p<0.05). La 0 D para s4 y s5 presentó valores intermedios no siendo diferentes entre sí (Fig. 7A). Los valores de diversidad 1 D no mostraron diferencias estadísticamente significativas entre sitios (p>0.05).

Figura 7: Valores promedio de diversidad del orden 0 D (A), densidad (B), diámetro a la altura del pecho (C) y altura de individuos (D) en los cinco sitios de muestreo en los márgenes del río Tacotalpa, Tabasco, México. Letras diferentes indican diferencias estadísticamente significativas (p<0.05).
Con respecto a los datos de densidad de árboles, el ANOVA indica diferencias estadísticamente significativas entre los sitios muestreados (p<0.05). El sitio s1 presentó el valor más alto, no siendo estadísticamente diferente del s4 (Tukey; p>0.05); sin embargo, los sitios s2, s3 y s5 tuvieron valores significativamente más bajos (Tukey; p<0.05. Fig. 7B).
Los valores promedios de DAP y altura mostraron patrones muy similares, existiendo diferencias estadísticas entre los sitos (ANOVA; p<0.05). Los contrastes a posteriori indican que el s2 presenta los valores más altos de estas dos variables, mientras que para s1 fueron significativamente más bajos (Tukey; p<0.05. Fig. 7C, D).
El análisis de correlación de Pearson, muestra que la diversidad de especies de orden 0 D, la riqueza de especies arbustivas y la densidad de árboles ribereños se asociaron positivamente con la distancia de las casas, la distancia a zonas urbanas y la distancia a las carreteras pavimentadas (p<0.05). Asimismo, la diversidad de especies de orden 1 D y la riqueza de especies arbóreas registradas en los puntos de muestreo se correlacionaron de manera positiva con la distancia a la carretera pavimentada (p<0.05); mientras que la altura de los árboles ribereños se asoció positivamente con la distancia a la terracería (p<0.05) y negativamente con la distancia a las casas y la distancia a la carretera pavimentada (Cuadro 3).
Cuadro 3: Coeficiente de correlación de Pearson entre las variables de vegetación ribereña con las métricas del paisaje del río Tacotalpa, Tabasco. Dcas=Distancia de la casa más cercana, Dzur=Distancia del borde de la zona urbana más cercana, Dcul=Distancia del borde de cultivo más cercano, Dpas=Distancia del borde de pastizal más cercano, Dbosm=Distancia del borde del remanente del bosque maduro más cercano, Dcarr=Distancia de la carretera pavimentada más cercano y Dterr=Distancia de la terracería más cercana. * es significativa en el nivel 0.05; ** es significativa en el nivel 0.01.
| Variables | Dcas | Dzur | Dcul | Dpas | Dbosm | Dcarr | Dterr |
|---|---|---|---|---|---|---|---|
| Diversidad 0 D | 0.24* | 0.25* | -0.10 | 0.14 | -0.07 | 0.35** | 0.10 |
| 0.02 | 0.01 | 0.32 | 0.16 | 0.51 | 0.00 | 0.32 | |
| Diversidad 1 D | 0.15 | 0.17 | -0.11 | 0.15 | -0.10 | 0.29** | 0.06 |
| 0.14 | 0.09 | 0.30 | 0.15 | 0.30 | 0.00 | 0.57 | |
| Riqueza de especies arbustivas | 0.22* | 0.20* | 0.03 | 0.15 | 0.14 | 0.31** | -0.04 |
| 0.03 | 0.04 | 0.75 | 0.13 | 0.18 | 0.00 | 0.73 | |
| Riqueza de especies arbóreas | 0.17 | 0.19 | -0.14 | 0.09 | -0.15 | 0.26* | 0.14 |
| 0.10 | 0.06 | 0.18 | 0.38 | 0.14 | 0.01 | 0.17 | |
| Densidad | 0.30** | 0.21* | 0.01 | 0.14 | -0.05 | 0.33** | 0.05 |
| 0.00 | 0.04 | 0.89 | 0.16 | 0.63 | 0.00 | 0.63 | |
| Altura | -0.27** | -0.16 | -0.16 | -0.16 | 0.03 | -0.41** | 0.24* |
| 0.01 | 0.12 | 0.12 | 0.12 | 0.75 | 0.00 | 0.01 |
En la figura 8 se muestra la disposición espacial de las unidades de muestreo sobre el plano definido de dos componentes principales, que en conjunto representan el 50% de la varianza total de los datos. La mayoría de las variables de vegetación y métricas del paisaje se correlacionaron positivamente con el primer componente, mientras que la altura de los arboles ribereños de manera negativa. En el componente 2, las variables de altura de los árboles ribereños, especies arbóreas, especies arbustivas, diversidad 0 D, diversidad 1 D, densidad y la distancia de la terracería (Dterr) se correlacionaron positivamente, mientras que el resto de las métricas del paisaje se correlacionaron negativamente (Dbos, Dcul, Dpas, Dzur, Dcas y Dcarr).

Figura 8: Análisis de componentes principales de las variables de vegetación y métricas del paisaje en los cinco sitios de muestreo en los márgenes del río Tacotalpa, Tabasco, México. ∎=unidades muestrales del sitio 1, ∗=unidades muestrales del sitio 2, ♦=unidades muestrales del sitio 3, ∆=unidades muestrales del sitio 4 y ⦁=unidades muestrales del sitio 5.
Discusión
El valor de 0 D (riqueza especifica) del río Tacotalpa fue relativamente baja (119 especies en 1 ha) en comparación con el registro de Moreno-Jiménez et al. (2017) en un afluente ribereño de Tacotalpa (131 especies en 0.6 ha). Esto muestra que a escala local, la subcuenca del río Tacotalpa ha perdido parte de su riqueza de especies provocado por las diferentes actividades humanas en áreas adyacentes de la ribera (Yang et al., 2011; Sunil et al., 2016). Esto concuerda con Meli et al. (2013) que también reportó una disminución de especies ribereñas en áreas perturbadas de la selva Lacandona, Chiapas. Las familias Fabaceae y Rubiaceae son consideradas dentro de las más representativas en bosques tropicales, coincidiendo con otros registros de la sierra tabasqueña (Maldonado-Sánchez y Maldonado-Mares, 2010; Zarco-Espinosa et al., 2010; Zamora-Crescencio et al., 2011; Moreno-Jiménez et al., 2017).
La similitud florística entre s3 y s4 se debió a la cercanía a un fragmento de vegetación original, lo que fortalece la conectividad de estos sitios, compartiendo un total de 46 especies. Esto coincide con lo que afirman otros estudios en relación a que dos sitios influenciados por el mismo remanente original puede mostrar mayor número de especies compartidas (Araujo et al., 2013; Moreno-Jiménez et al., 2017). La mayor disimilitud de especies fue entre s1 y s2 con 33 especies comunes. Esto puede atribuirse a la diferencia en la densidad absoluta de las especies (774 y 359), a las condiciones particulares del sitio y al número de especies introducidas (5 y 2) (Apéndice). Becerra (2006), Sirombra y Meza (2009) y Richardson y Rejmánek (2011) mencionan que la invasión de algunas especies exóticas pueden originar cambios en la composición de comunidades vegetales, generando a su vez competencia y desplazamiento a las especies nativas. El registro de algunas especies introducidas (Ricinus communis L., Tectona grandis L. f. y Guadua longifolia (E. Fourn.) R. W. Pohl L. f.) en s1 y s5 es señal del efecto negativo que tiene las perturbaciones sobre la composición de las especies vegetales. Sin embargo, Mander et al. (2005) mencionan que la densidad de estas especies podrían cumplir un papel importante en un ecosistema ribereño fragmentado, es decir a mayor densidad de árboles ribereños ya sea nativas o introducidas pueden retener los sedimentos hacia los sistemas acuáticos, protegiendo el hábitat de los organismos acuáticos.
La mayor concentración de individuos en el estrato bajo y diámetros menores coincide con los registros de Vásquez-Negrín et al. (2011) y Moreno-Jiménez et al. (2017) como indicadores de perturbación. En s1 se demostró este comportamiento, al no registrar individuos en las últimas categorías de altura y diámetro (Fig. 5, 6). Las especies que aportaron mayor densidad en el estrato bajo fueron Pleuranthodendron lindenii (Turcz.), Lonchocarpus hondurensis, Hampea nutricia Fryxell, Bursera simaruba (L.) Sarg., Acacia cornigera (L.) Willd., Myrcia sp., Lonchocarpus sp.2, Salix humboldtiana Willd. y Vatairea lundellii (Standl.) Record. La densidad de estas especies indica que están adaptadas a ambientes abiertos generados por disturbios humanos (Thompson et al., 2002; Zamora y Crescencio et al., 2011), son especies que aprovechan los claros y la entrada de luz generados por las perturbaciones humanas para establecerse (Martínez y Orth, 2007; Richardson y Rejmánek, 2011) y se adaptan mejor en las condiciones del sitio (Acosta et al., 2008). Steinbauer et al. (2017) mencionan que la densidad de los árboles ribereños de bajo porte y de menor diámetro también son señales de las perturbaciones. Por otro lado, las especies con alturas mayores de 25 metros fueron Ceiba pentandra (L.) Gaerth., Pterocarpus rohrii Vahl, Licania platypus (Hemsl.) Fritsch. Es probable que sean especies de vegetación original que permanecieron después de un proceso de fragmentación (Guevara et al., 2005).
Las especies que dominaron por su mayor diámetro fueron Ficus yoponensis Desv., Cordia alliodora, Ceiba pentandra, Pterocarpus rohrii, Pouteria sapota (Jacq.) H.E. Moore & Stearn, Licania platypus y Cedrela odorata L. Meli et al. (2014) y Moreno-Jiménez et al. (2017) coinciden que Pterocarpus rohrii está dentro de las especies con mayor diámetro. Estas especies indican que los sitios de estudio aún guardan remanentes de vegetación original de selva alta perennifolia (Pennington y Sarukhán, 2005) y que pueden tener un papel importante en la recuperación de ecosistemas ribereños (Sánchez et al., 2005) y en el mantenimiento de la biodiversidad local. Esto coincide con Melo et al. (2013), que mencionan que los parches de bosques secundarios podrían no solo ser habitados eventualmente por especies dependientes de los bosques, sino también conservar gran parte de la diversidad vegetal a escala local. Por tal motivo, se puede considerar que estas especies arbóreas al ser combinadas con algunas especies arbustivas (como Mircya sp.) fortalecería la conectividad y recuperación de los ecosistemas ribereños en sitios con mayor nivel de perturbación (s2).
Las diferencias significativas de diversidad de orden 0 D pueden deberse a los diferentes grados de perturbación que presentaron los cinco sitios. Esto sugiere, que la vegetación ribereña del río Tacotalpa se encuentran en diferentes grados de perturbación y de sucesión ecológica (Zarco-Espinosa et al., 2010). Además, la presión por el aprovechamiento de leña, agricultura y ganadería en el corredor ribereño puede modificar la estructura y composición de las especies (Sánchez et al., 2005), detener o desviar la sucesión de los bosques (Sodhi et al., 2011). El sitio 2 ejemplifica este patrón al considerarse como el más perturbado en términos de composición y diversidad (22 familias, 43 géneros y 52 especies), mientras que los sitios 4 y 5 como los más conservados (Cuadro 2). La similitud de diversidad de orden 1 D se debe a que los sitios obtuvieron una equitatividad mayor de 80%, donde la densidad de algunas especies tiende a equilibrar el índice de diversidad (Jost 2006; Moreno et al., 2011). Esto coincide con el estudio de Moreno-Jiménez et al. (2017) que señala que con un porcentaje mayor a 80 %, la población de las especies tiende a ser más equilibrada.
El análisis de correlación de Pearson demostró que la diversidad 0 D, las especies del estrato arbustivo y la densidad de los árboles tiende a aumentar positivamente con el incremento de las distancias de las casas, carreteras pavimentadas y el borde de las zonas urbanas (p<0.05), es decir, conforme aumenta la distancia de estas métricas del paisaje, la diversidad y la densidad de los árboles ribereños es mayor. La otra relación positiva importante fue entre la altura de los árboles ribereños y la distancia de la terracería, es decir, la altura aumenta al incrementar la distancia de las terracerías, lo cual es una señal de que estas vías de comunicación pueden ser factor para la extracción de árboles altos para leña y construcción de casas, incluyendo el acceso fácil para el establecimiento de cultivos temporales en áreas ribereñas. Esto coincide con otros estudios donde se ha demostrado que las actividades agropecuarias y la urbanización influyen en la estructura y diversidad de árboles ribereños (Apan et al., 2002; Burton et al., 2005, 2009; Pennington et al., 2010; Dummel y Pinazo, 2013). El ACP confirma la interacción que tienen las métricas del paisaje sobre la diversidad y estructura de la vegetación ribereña en el sureste de México; siendo el s2 como el más perturbado, mientras que los sitios 3, 4 y 5 tienden a mejorar su riqueza y diversidad, ya que se encuentran más alejados de las infraestructuras (Fig. 8). Este primer análisis puede servir de base para monitorear la recuperación y fragmentación de los ecosistemas ribereños del sureste de México.
Conclusión
Las diferencias significativas de la diversidad verdadera 0 D, la densidad, el DAP y la altura de árboles ribereños entre algunos sitios indican que el río Tacotalpa está sujeto a diferentes niveles de perturbación, provocando variación en sus atributos ecológicos. La construcción de infraestructuras cercanas en los corredores ribereños (casas, carreteras pavimentadas y terracerías) están influyendo en la diversidad y estructura de la vegetación ribereña, lo cual puede repercutir en el fututo de estos ecosistemas y puede aumentar la vulnerabilidad de las poblaciones humanas que están cerca de las áreas ribereñas. Por lo tanto, se recomienda evitar la construcción de asentamientos humanos en los primeros 10 m en las márgenes del río (según la Ley de Aguas Nacionales como zona federal). En sitios con mayor nivel de perturbación se sugiere que las especies como: Pleuranthodendron lindenii, Lonchocarpus hondurensis, Hampea nutricia, Bursera simaruba, Acacia cornigera, Myrcia sp., Lonchocarpus sp.2, Salix humboldtiana y Vatairea lundellii puedan ser consideradas dentro de los programas de restauración, debido a que demostraron buen nivel de reclutamiento en las primeras etapas de sucesión de los bosques ribereños. Asimismo, se recomienda la combinación de algunas especies arbustivas con especies arbóreas de vegetación original en forma de nucleación (pequeñas islas de especies combinadas a lo largo del corredor ribereño).











 nueva página del texto (beta)
nueva página del texto (beta)