Introducción
Las cactáceas son algunas de las plantas más representativas de ambientes áridos y semiáridos en América. Se distribuyen desde el sur de Canadá hasta el sureste de la Patagonia en Argentina. Aunque sus centros de diversidad y distribución se encuentran en las regiones áridas del norte y sur de América, especialmente en México y el suroeste de los Estados Unidos de América, los Andes y el este de Brasil (Taylor y Zappi, 2004; Ortega-Baes et al., 2015), crecen en una gran variedad de ecosistemas que incluyen ambientes húmedos, desérticos, zonas costeras, bosques secos y tropicales, así como entornos de montaña, con alturas desde el nivel del mar a 5100 m s.n.m. (Jiménez-Sierra, 2011).
En Cactaceae, al igual que en otras familias de plantas, el estudio de los caracteres morfológicos de estructuras vegetativas es de gran relevancia para entender los mecanismos de adaptación de sus especies a un ambiente particular. De igual manera, el análisis de caracteres morfométricos de estructuras involucradas en la reproducción (flores, frutos y semillas) es importante por su papel ecológico, ya que ayudan a predecir o identificar la presencia de potenciales polinizadores y dispersores e investigar sobre la dinámica poblacional de las especies (Santos-Fonseca et al., 2008; Schlumpberger et al., 2009; Queiroz et al., 2015; Grosse-Veldmann et al., 2016; Teixeira et al., 2018). Aunque la mayoría de las cactáceas son polinizadas y dispersadas por agentes bióticos (Taylor y Zappi, 2004), la morfología floral (forma, tamaño, color, presencia de aroma, periodo de antesis, producción de néctar), así como el tamaño, color, tipo de dehiscencia y número de semillas en los frutos, son parámetros importantes que influyen en las interacciones entre flores y polinizadores y entre frutos y dispersores (Lenzi y Orth, 2004). La polinización y dispersión de semillas son dos procesos clave en la ecología de la mayoría de las plantas y las cactáceas no son la excepción, de tal manera que en la mayoría de los casos son altamente dependientes de diferentes grupos de animales para llevarlos a cabo.
Melocactus Link & Otto es uno de los géneros de la familia Cactaceae del cual se reconocen 35 especies y 15 subespecies que se distribuyen desde México hasta Sudamérica y el Caribe (García-González et al., 2016); su centro de diversidad es el estado de Bahía, Brasil (Assis et al., 2003). Son cactáceas que tienen como característica distintiva el desarrollo de un cefalio (región reproductiva apical donde producen flores y frutos) (Gorelick, 2016). Dentro de este grupo destaca Melocactus violaceus Pfeiff. subsp. margaritaceus N.P. Taylor, conocido con el nombre popular cabeça de frade (cabeza de fraile), el cual tiene una amplia distribución sobre dunas del ecosistema restinga del litoral brasileño, desde el estado de Ceará a Río Grande do Norte hasta Río de Janeiro. Esta subespecie tiene también poblaciones discontinuamente establecidas en toda la costa este de Brasil en campos rupestres de los estados de Minas Gerais, Bahía y Sergipe (Taylor, 1991). En el estado de Sergipe (Fig. 1), Melocactus violaceus subsp. margaritaceus se diferencia de las demás subespecies porque su fruto es blanquecino, raramente rosado (M. violaceus subsp. violaceus y M. violaceus subsp. ritteri N.P. Taylor poseen frutos color lila a rosa-claro). Es una subespecie caracterizada por su forma globosa y porte relativamente pequeño, con espinas comprimidas uniformes, rectas y delgadas (Taylor y Zappi, 2004; Menezes et al., 2011, 2012, 2013). Al igual que otras especies de Melocactus ha sido estudiada en relación a su distribución y morfología; sin embargo, son ausentes las investigaciones sobre la influencia del microhábitat en sus poblaciones.

Figura 1: Poblaciones de Melocactus violaceus Peiff. subsp. margaritaceus N.P. Taylor (Cactaceae), estado de Sergipe, noreste de Brasil mostrando las dos zonas de estudio caatinga: Mata Atlântica en el Parque Nacional Sierra de Itabaiana; restinga: en la Playa de Pirambu.
Entre las cactáceas, un alto porcentaje de especies (6.7%) están clasificadas como críticamente amenazadas, 177 (12%) en peligro de extinción y 140 (9.4%) como vulnerables (Goettsch et al., 2015). Melocactus violaceus está clasificado como especie vulnerable por la Lista Roja de la IUCN debido a la pérdida de hábitat (Braun et al., 2017), ya que las llanuras arenosas brasileñas se encuentran bajo una enorme presión antrópica debido a actividades inmobiliarias y turísticas (Hughes, 2017). Es poca la información sobre esta especie, existe un documento sobre dispersión de semillas por lagartos (Figueira et al., 1994), otro trabajo sobre su ecología en el sudeste brasileño (Figueiredo, 2016), una mención como especie endémica en la cuenca hidrográfica del São Francisco (Meiado et al., 2015b) y un estudio ecológico sólo en un ecosistema de llanura arenosa (restinga) (Hughes, 2017). Cabe destacar que Melocactus violaceus se menciona como especie endémica en la cuenca hidrográfica del río São Francisco, la cual abarca varios estados brasileños, incluyendo Sergipe. En el caso particular de Melocactus violaceus subesp. margaritaceus a la fecha es catalogada como subes-pecie vulnerable, ya que existen evidencias de sus atributos ecológicos, distribución y su estado de conservación en dicha región (Meiado et al., 2015b).
Por lo anterior, la presente investigación se centra en realizar un estudio comparativo de las poblaciones de Melocactus violaceus subsp. margaritaceus en dos ecosistemas endémicos brasileños: Mata Atlântica en el Parque Nacional Sierra de Itabaiana en el Parque Nacional Sierra de Itabaiana, la cual es uno de los “hotspots” de biodiversidad más ricos y amenazados del planeta de acuerdo con Leitman et al. (2015) y restinga de la Playa de Pirambu, ambos ecosistemas del estado de Sergipe. Se analizaron patrones de distribución, densidad y morfometría de estructuras vegetativas y reproductivas para determinar si existen diferencias significativas y establecer la posible influencia del microhábitat en dichos caracteres de la subespecie.
Materiales y Métodos
Sitios de estudio
Sergipe es uno de los estados más pequeños de Brasil (21,910.3 km2), situado en la región noreste. Está localizado entre las coordenadas 9°30' y 11°30'S y 36°20' y 38°00'O, limitado al norte por el estado de Alagoas, en el este por el Océano Atlántico y al suroeste por el estado de Bahía (IBGE, 2008; 2010). Dos zonas de estudio en este estado fueron elegidas para llevar a cabo la presente investigación: Zona 1, caatinga y Zona 2, restinga.
Zona 1: caatinga de la Mata Atlântica en el Parque Nacional Sierra de Itabaiana (Fig. 1). Este parque se ubica en los municipios Areia Branca, Itabaiana, Laranjeiras, Itaporanga d’Ajuda y Campo do Brito. Se encuentra a una distancia de 45 km del municipio Aracaju (Dantas y de Souza Ribeiro, 2010; Dantas et al., 2010). El Parque Nacional Sierra de Itabaiana es el primer y único parque nacional (PARNA) del estado de Sergipe (Cunha-Costa y Gomes, 2014), está situado en un área de ecotono en la Mata Atlântica, en una zona de transición denominada de agreste, en la cual coexisten especies de flora y fauna de ambos ecosistemas. La posición geográfica del Parque (10°40'52"S; 37°25'15"O) le garantiza características especiales que favorecen la existencia de diversos grupos de vegetación, en los cuales destacan representantes de Fabaceae, Rubiaceae, Asteraceae, Poaceae, Apocynaceae y Cyperaceae (Dantas et al., 2010).
Zona 2: restinga en la municipalidad de Pirambu (Fig. 1). Es una zona situada en la costa noreste de Sergipe (10°40'42"S; 36°52'25"O), básicamente limitada por la presencia de formaciones de bancos de arena (Cuaternario) en llanuras arenosas costeras y llanuras costeras que se encuentran sobre mesetas bajas (UFS/SEPLAN, 1979). Las restingas de Sergipe, incluyendo la Playa de Pirambu, están localizadas en la planicie litoral, distribuidas en 168 km en la línea costera (SEPLANTEC, 2011; Oliveira y Landim, 2016). Esta zona, al igual que otras restingas brasileñas, posee una riqueza florística estimada de 131 familias y 1590 especies (Maestre et al., 2009; Restinga net, 2014; Meiado et al., 2015b). No obstante, estos ecosistemas se encuentran entre los más amenazados ya que están sujetos a impactos antrópicos (Oliveira y Landim, 2016).
Las particularidades de cada una de las zonas, tales como extensión, altitud, tipo de clima y suelo, temperatura, precipitación (Dantas et al., 2010; Landim et al., 2015; Oliveira y Landim, 2016), pueden observarse en el Cuadro 1.
Cuadro 1: Localización geográfica y características ambientales de las dos zonas de estudio, donde se distribuye Melocactus violaceus Pfeiff. subsp. margaritaceus N.P. Taylor. Zona 1: caatinga del Parque Nacional Sierra de Itabaiana; Zona 2: restinga en Playa de Pirambu, Sergipe, Brasil. Fuentes: Dantas et al. (2010); Silva et al. (2013); Oliveira y Landim (2016).
| Zona | Extensión (ha) | Altitud máxima (m) | Tipo de clima | Temperatura media anual (°C) | Precipitación pluvial (mm) | Suelo |
|---|---|---|---|---|---|---|
| 1 | 7966 | 660 | Tropical humedo | 17-23 | 1200-1300 | Distrófico (arenas blancas de cuarzo) |
| 2 | 20,588 | 56 | Tropical con influencia marítima | 24-26 | 1000-1200 | Dunas arenosas |
Subespecie de estudio
Melocactus violaceus subsp. margaritaceus es una planta con tallo globoso, 5- 15 cm de altura, 7-13 cm de diámetro; epidermis color verde a verde claro que presenta 8-15 costillas, 20 a 40 mm de ancho; aréolas 0.7-1 mm de diámetro, separadas entre sí 1-1.8 cm, 5-10 espinas uniformes rectas; cuando el individuo alcanza la etapa reproductiva, desarrolla una estructura diferenciada en la parte apical o terminal que constituye el cefalio, estructura no fotosintética totalmente cubierta de espinas y tricomas; el cefalio mide 5 cm de longitud × 3.7- 6.5 cm de diámetro, tiene cerdas rígidas color rosado en la región marginal, blanquecinas en el centro; flores color rosa intenso, estigmas 4-5 lobadas, blanquecinas, insertas; frutos 12.5-19 mm de longitud × 5.5-7 mm de diámetro, con coloración uniforme; semillas globosas, 1.2 mm de longitud, 1.12 mm de diámetro, brillantes, paredes de las células periclinales de la testa levemente convexas (Meiado et al., 2012; 2015a).
Densidad y patrones de distribución
Se establecieron de forma aleatoria 30 cuadrantes de 750 m2 en total (5 × 5 m cada uno) en las dos áreas de estudio, en zonas con presencia de la subespecie, durante los meses de junio y julio de 2014. La identificación taxonómica y descripción morfológica de la subespecie Melocactus violaceus subsp. margaritaceus se hizo de acuerdo a lo establecido por Meiado et al. (2012; 2015a). Se registraron para cada área de estudio los siguientes parámetros: densidad, patrones de distribución de individuos (cercanía o bajo la sombra de otras especies o crecimiento en espacios abiertos), número de individuos vivos y muertos, porcentaje de individuos con presencia de cefalio. Fue depositado un ejemplar con un duplicado de M. violaceus subsp. margaritaceus recolectado de cada una de las zonas estudiadas (ASE 39348- Melocactus violaceus subsp. margaritaceus de Itabaiana y ASE 30224- Melocactus violaceus subsp. margaritaceus de Playa de Pirambu), en el herbario ASE (Universidad Federal de Sergipe).
Morfometría de estructuras vegetativas y reproductivas
El registro de las variables morfométricas vegetativas de las plantas (altura y diámetro del tallo) se realizó con la ayuda de cinta métrica. Con la finalidad de observar la posible variabilidad morfológica de las estructuras reproductivas e inferir sobre la influencia del microhábitat en dicha variabilidad, así como su influencia en la densidad de Melocactus violaceus subsp. margaritaceus en las dos zonas de estudio, se llevó a cabo el análisis de los caracteres morfométricos de flores, frutos y semillas de individuos en ambas poblaciones. Para ello, se realizó la recolecta de flores y frutos de los individuos de cada una de las zonas (Mata Atlântica y restinga), los cuales fueron llevados al Departamento de Biología de la Universidad Federal de Sergipe para registrar los atributos longitud y diámetro de las flores, frutos y semillas con ayuda de un vernier digital (Modelo 500-144B, Mitutoyo South America, Ltda., Suzano, Brasil).
Análisis estadísticos
Todos los datos cuantitativos registrados fueron sometidos a un análisis estadístico para obtener los parámetros de la estadística descriptiva mediante el procedimiento proc univariate de SAS versión 9.4 (SAS, 2002). Posteriormente, se aplicó un análisis de varianza ANDEVA con el procedimiento proc glm y pruebas de comparaciones múltiples de medias de Tukey (p<0.05), para establecer la existencia de diferencias estadísticas significativas entre los caracteres morfológicos vegetativos y reproductivos entre las dos zonas de estudio. Con la finalidad de conocer la existencia de asociación entre las variables analizadas, se aplicó una prueba de Correlación de Pearson (rp). Todos los análisis se realizaron con el paquete estadístico SAS versión 9.4 (SAS, 2002).
Resultados
Densidad y patrones de distribución
Zona 1: Mata Atlântica. Se registraron 419 individuos de los cuales 72 (17%) estaban muertos. De los 347 ejemplares vivos, 65% (227 individuos) se distribuyen en espacios abiertos, mientras que el 35% restante (120 individuos) crecen asociados o cerca de otra especie de planta. Para los valores de densidad se obtuvo una media de 0.52±0.02 individuos/m2 y un coeficiente de variación de 3.1%.
Zona 2: restinga. Se contabilizaron 340 individuos, 11 muertos (3%); de los 329 ejemplares vivos, 66% (218 individuos) se distribuyen sin la protección de algún arbusto o árbol, mientras que 34% (111) crecen cerca o bajo la sombra de otra especie de planta.
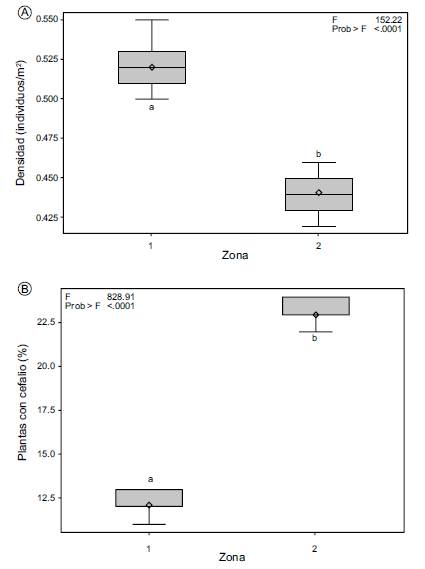
Se obtuvo una densidad media de 0.44±0.01 individuos/m2. En esta zona el coeficiente de variación para esta variable fue menor (2.7%) comparado con la Zona 1. La prueba de comparaciones múltiples de Tukey demostró la existencia de diferencias estadísticas significativas (p<0.05) para la variable densidad entre ambas zonas (Fig. 2A).
Presencia de cefalio
Se observó que del total (676) de los individuos vivos registrados en ambas zonas, un porcentaje relativamente bajo desarrollan cefalio en la etapa reproductiva. El valor de la media más alto para la variable presencia de cefalio fue de 23.0±0.9% en ejemplares de la Zona 2 (Fig. 2B), aunque la Zona 1 se caracterizó por un coeficiente de variación más alto (6.1%) para esta variable. Se observaron diferencias estadísticas significativas (p<0.05) al comparar los dos sitios de estudio (Fig. 2B). La posición del cefalio es apical y posee flores y frutos (Fig. 3).
Morfometría de estructuras vegetativas y reproductivas
Zona 1: Mata Atlântica. La altura y diámetro del tallo tuvieron una media de 6.1±0.1 y 8.9±0.02 cm, respectivamente. Las estructuras reproductivas, como son el diámetro de la flor, longitud y diámetro del fruto, se caracterizaron por tener los valores más altos comparados con los de restinga (Cuadro 2). El fruto se aproxima a una forma esférica como lo indica el valor obtenido de índice de forma (0.86). En el caso de la semilla el índice de forma tuvo una media de 0.84, proporcionando un indicativo de la morfología casi redonda de ésta (Cuadro 2). El ANDEVA demostró el coeficiente de variación más alto (94%) para la variable altura del tallo, mientras que para las estructuras reproductoras el valor más alto se obtuvo para longitud de la flor (61.9%) (Cuadro 3).
Cuadro 2: Caracteres morfológicos de tallos, flores, frutos y semillas de Melocactus violaceus Pfeiff. subsp. margaritaceus N.P. Taylor en dos ecosistemas contrastantes brasileños. Zona 1: Mata Atlântica del Parque Nacional Sierra de Itabaiana; Zona 2: restinga en Playa de Pirambu. Los datos representan la media ± desviación estándar (n=20 repeticiones de cada zona). Letras superíndices diferentes indican diferencias estadísticas significativas entre zonas (Tukey, p<0.05).
| Variable | Zona 1 | Zona 2 |
|---|---|---|
| Altura (cm) | 6.1±0.1a | 5.4±0.05b |
| Diámetro (cm) | 8.9±0.02a | 8.5±0.2b |
| Longitud flor (mm) | 18.9±0.1a | 19.1±0.4b |
| Diámetro flor (mm) | 16.1±0.1a | 9.7±0.1b |
| Longitud fruto (mm) | 8.1±0.2a | 7.6±0.2b |
| Diámetro fruto (mm) | 7.0±0.2a | 6.0±0.2b |
| Longitud semilla (mm) | 1.4±0.1a | 1.8±0.1b |
| Diámetro semilla (mm) | 1.2±0.1a | 1.3±0.1b |
| Índice de forma semilla | 0.84±0.02a | 0.75±0.03b |
| Índice de forma fruto | 0.86±0.003a | 0.78±0.004b |
Cuadro 3: Análisis de varianza de los caracteres morfológicos de tallos, flores, frutos y semillas de Melocactus violaceus Pfeiff. subsp. margaritaceus N.P. Taylor en dos ecosistemas contrastantes brasileños. Zona 1: caatinga del Parque Nacional Sierra de Itabaiana; Zona 2: restinga en Playa de Pirambu. Var: Varianza; Cv: Coeficiente de variación (%); CM: Cuadrado de la media; F: Estadístico F calculado de la variación entre zonas; Pr: Probabilidad.
| Variable | Var | Cv | CM | Valor de F | Pr>F | ||
|---|---|---|---|---|---|---|---|
| Zona 1 | Zona 2 | Zona 1 | Zona 2 | ||||
| Altura tallo | 0.0032 | 0.0025 | 94 | 93.5 | 2.191 | 759.16 | <0.0001 |
| Diám. tallo | 0.0004 | 0.0564 | 23.8 | 2.8 | 1.1854 | 41.65 | <0.0001 |
| Long. flor | 0.0001 | 0.0015 | 61.9 | 20.3 | 0.1711 | 206.31 | <0.0001 |
| Diám. flor | 0.0035 | 0.0003 | 36.9 | 18.9 | 211.12 | 1080.82 | <0.0001 |
| Long. fruto | 0.0006 | 0.0007 | 31.8 | 35.7 | 0.7411 | 1044.66 | <0.0001 |
| Diám. fruto | 0.0006 | 0.0006 | 35.5 | 41.2 | 4.8216 | 7776.81 | <0.0001 |
| Long.semilla | 0.0003 | 0.0001 | 36.3 | 73.2 | 0.6578 | 2310.65 | <0.0001 |
| Diám.semilla | 0.0002 | 0.0001 | 1.2 | 0.9 | 0.0878 | 440.07 | <0.0001 |
Zona 2: restinga. Para la altura y diámetro del tallo en las plantas de esta zona, se obtuvo una media de 5.4±0.05 y 8.5±0.2 cm, respectivamente (Cuadro 2). Las flores presentaron una longitud media mayor que en la zona de Mata Atlântica (19.1±0.4 mm), aunque su diámetro es menor (9.7±0.1 mm). Lo mismo ocurre con el tamaño de los frutos, cuya longitud y diámetro son menores que en la Zona 1. El índice de forma para frutos y semillas de esta zona también tuvo valores de la media menores que en Mata Atlântica (Cuadro 2). El coeficiente de variación mayor en la Zona 2 fue para la variable altura del tallo (93.5%), mientras que el menor porcentaje de variación (0.9 %) se registró para diámetro de semilla (Cuadro 3).
Mata Atlântica vs. Restinga
Los resultados del ANDEVA para todas las variables analizadas mostraron diferencias altamente significativas (<0.0001) al comparar las dos zonas de estudio, tanto para densidad (F=152.22) como presencia de cefalio (F=828.91) (Fig. 2). La comparación de medias de todos los caracteres morfométricos, tanto vegetativos (altura y diámetro del tallo) como de estructuras reproductivas de las plantas de M. violaceus subsp. margaritaceus de las dos zonas de estudio, mostró también diferencias estadísticas altamente significativas (Tukey, p<0.05). Los valores registrados para cada una de las variables morfométricas analizadas se muestran en los Cuadros 2 y 3. Las variables altura del tallo, diámetro de la flor y longitud de semilla de la Zona 1 presentan valores de varianza mayor (p<0.0001); mientras que diámetro del tallo, longitud de la flor y longitud del fruto mostraron la varianza más alta en la Zona 2. El valor más alto de F calculada (7776.81) al comparar las dos zonas, se obtuvo para diámetro de fruto (Cuadro 3). El análisis de correlación de Pearson demostró que existe una fuerte asociación entre algunas variables de ambas zonas, ya que coeficientes de correlación altamente significativos se obtuvieron entre las variables diámetro de fruto vs. longitud de fruto (rp=0.9909); longitud de fruto vs. diámetro de flor (rp=0.9907); longitud semilla vs. longitud de fruto (rp=0.9621) (Cuadro 4).
Cuadro 4: Matriz de coeficientes de correlación de Pearson (rp) de las variables morfológicas de Melocactus violaceus Pfeiff. subsp. margaritaceus N.P. Taylor, en dos ecosistemas contrastantes brasileños. ALTALLO: altura tallo; DTALLO: diámetro tallo; LFLOR: longitud flor; LFRUTO: longitud fruto; LSEMILLA: longitud semilla; DSEMILLA: diámetro semilla, (n=20 repeticiones de cada variable por zona de estudio) *altamente significativa, Prob>(r) suponiendo H0: Rho=0.
| ALTALLO | DTALLO | LFLOR | DFLOR | LFRUTO | DFRUTO | LSEMILLA | DSEMILLA | |
|---|---|---|---|---|---|---|---|---|
| ALTALLO | 1.0000 | |||||||
| DTALLO | 0.6559 | 1.0000 | ||||||
| LFLOR | -0.8476 | -0.7542 | 1.0000 | |||||
| DFLOR | 0.8915 | 0.8327 | -0.9650 | 1.0000 | ||||
| LFRUTO | 0.7045 | 0.8221 | -0.9647 | 0.9907* | 1.0000 | |||
| DFRUTO | 0.7089 | 0.8417 | -0.9213 | 0.9149 | 0.9909* | 1.0000 | ||
| LSEMILLA | -0.5567 | -0.5834 | 0.6518 | -0.6903 | 0.9621* | -0.6871 | 1.0000 | |
| DSEMILLA | -0.8888 | -0.8556 | 0.9521 | -0.9811 | 0.9390 | -0.9818 | 0.6594 | 1.0000 |
Discusión
Densidad y patrones de distribución
La densidad de individuos de Melocactus violaceus subsp. margaritaceus observada en ambas zonas es menor a la que se ha registrado en un estudio similar de la especie en suelos arenosos. Figueiredo (2016), por ejemplo, menciona una densidad promedio de 7.33 individuos/m2, en un ecosistema de restinga en Rio de Janeiro, Brasil, mientras que en la presente investigación los valores obtenidos varían de 0.44 en la Zona 2 de restinga en Playa de Pirambu a 0.52 individuos/m2 en la Zona 1 de Mata Atlântica del Parque Nacional Sierra de Itabaiana. Para otras especies de Melocactus, como M. ernestii Vaupel, se han registrado valores de densidad también mayores (0.67 individuos/m2) (Hughes, et al., 2011). Figuereido (2016) menciona que en la mayoría de los casos, los valores de densidad más altos se presentan en hábitats rocosos; enfatiza que a pesar de que existe una gran variedad de especies de Melocactus, M. violaceus suele ser una especie frágil, por lo que ha sido catalogada como vulnerable por la Lista Roja de la IUCN (IUCN, 2014), como vulnerable en los estados de Espírito Santo (Espírito Santo, 2005) y Pernambuco, así como amenazada en restingas de Rio de Janeiro (PCRJ, 2000). La Zona 1 (Mata Atlântica) presentó un valor de densidad más alto que la Zona 2 (restinga); esto probablemente puede atribuirse a que este último ecosistema está sometido a condiciones ambientales extremas, como las altas temperaturas, elevada salinidad, vientos constantes y bajos niveles de nutrientes (Melo-Junior y Torres-Boeger, 2016). Estos factores, además de la temperatura del suelo y la disponibilidad de agua, son elementos importantes que regulan la reproducción, reclutamiento y crecimiento de plantas (Martínez, 2003; Lane et al., 2008). Además, como mencionan Carboni et al. (2011) y Castanho et al. (2012), la restinga es considerado un ecosistema de dunas costeras tropicales que constituyen ambientes estresantes para las comunidades vegetales. Otro aspecto que se debe considerar es la preferencia diferencial por algún hábitat particular que poseen las especies de Melocactus y que influye en sus valores de densidad. Estudios realizados sobre la densidad de especies de este género en diversos tipos de hábitats (desde Mata Atlântica rupestre o rocoso, afloramientos rocosos, laderas de valles rocosos hasta parches xéricos) demuestran la preferencia de hábitats. Por ejemplo, M. andinus R. Gruber ex N.P. Taylor, tiene valores de densidad bajos (0.02 a 0.03 individuos/m2) y el crecimiento de éstos ocurre en laderas o pendientes de valles rocosos (Nassar y Ramírez, 2004; Nassar et al., 2007). En contraste, Colaço et al. (2006) registraron para M. glaucescens Buining & Brederoo y M. paucispinus Heimen & R.J. Paul densidades de 0.05 a 0.08 individuos/m2. Por otro lado, densidades elevadas (0.129 a 0.67 individuos/ m2) se establecen para las especies Melocactus ernestii y M. curvispinus Pfeiff. (Nassar y Ramírez, 2004; Nassar et al., 2007). Cabe destacar que, a pesar de que la vegetación de restinga posee un papel fundamental en la formación de dunas costeras (que son amenazadas por erosión eólica) y de constituir un refugio para la fauna (Scherer et al., 2005), son ecosistemas que se encuentran entre los más amenazados por la ocupación humana y extracción de ejemplares (Sacramento et al., 2007). De tal manera que en toda la franja del litoral brasileño, las restingas están sujetas a un sinnúmero de impactos antrópicos y constituyen los ambientes más degradados a causa de la actividad turística (Santos-Filho, 2009). Por lo anterior, la menor densidad de Melocactus violaceus subsp. margaritaceus registrada en la Zona 2 (restinga) podría atribuirse tanto a factores ambientales naturales como al impacto antrópico.
En lo que se refiere a los patrones de distribución, se observó que 65-66% de las plantas en ambas zonas estudiadas crecen a plena luz y en espacios abiertos, similar a lo que mencionan Freitas (1990) y Figueira et al. (1994). De acuerdo con Zamith et al. (2013), M. violaceus no sobrevive en áreas sombreadas; sin embargo, según Figueiredo (2016), la mayoría de los individuos de la especie se establecen bajo luz directa, aunque a una distancia consi derable de la vegetación, obteniendo de esta manera cierta cantidad de sombra por lo menos en alguna parte del día. Por otro lado, según Hughes et al. (2011), las especies de cactus globosos establecidas en suelo arenoso no dependen de una planta nodriza para su supervivencia, pero el efecto de sombra es benéfico para la germinación de semillas. En otros estudios realizados sobre cactáceas globosas, se ha observado que el mayor porcentaje de éstas sí se distribuye bajo el dosel de alguna planta nodriza. Por ejemplo, el estudio realizado sobre las especies Echinopsis chiloensis (Colla) Friedrich & G.D. Rowley y Eulychnia acida Phil. en la Reserva Nacional “Las Chichillas” en Chile (Cares et al., 2013); así como el realizado por Larios-Ulloa et al. (2015) en especies de Mammillaria Haw.
Diversos patrones de distribución espacial se han mencionado para otras formas de crecimiento de cactáceas, el establecimiento y reclutamiento de una gran cantidad de especies puede tener lugar en áreas cubiertas de arbustos (Mandujano et al., 2002). Sin embargo, en la presente investigación se podría mencionar que el establecimiento es facultativo. Dichos patrones de establecimiento podrían ser influidos por el tipo de vegetación, ya que los sitios en que se encuentran son hábitats densos y cerrados donde la luz solar no alcanza a penetrar hasta el suelo, de ahí que dichas especies se distribuyan exitosamente en parches libres de arbustos o árboles que les permitan llevar a cabo su crecimiento. Además de la vegetación, también influye la variabilidad de factores abióticos, ya que no sólo disminuye la supervivencia, el crecimiento y la reproducción de cactáceas, también puede limitar su distribución y patrones de abundancia (Hugues et al., 2011). Por ejemplo, para la cactácea columnar Harrisia portoricensis Britton, Rojas-Sandoval y Meléndez-Ackerman (2013) han mencionado que la variabilidad espacial es el resultado de una combinación de factores (temperatura, topografía, propiedades del suelo, precipitación y disponibilidad de plantas nodriza), los cuales determinan los patrones de distribución y abundancia local. En otro estudio realizado por Hughes et al. (2016) sobre estructura y distribución de poblaciones de especies de Melocactus, se observó que el establecimiento de cohortes está positivamente relacionado con la precipitación pluvial (>60%) y que los eventos de reclutamiento fueron microhábitats dependientes mostrando altos porcentajes de mortalidad (>70). Por tanto, podría decirse que el comportamiento demográfico de las poblaciones de Melocactus depende en gran medida de la supervivencia de los adultos para contrarrestar la alta mortalidad en las primeras etapas del ciclo de vida (Hughes et al., 2018). En el caso particular del presente estudio, no se analizaron características específicas del microhábitat; sin embargo, el promedio de precipitación pluvial en la Zona 1 Mata Atlântica es mayor (1200 a 1300 mm anuales) (Cuadro 1). Ese factor podría ser importante para explicar las diferencias de densidad y patrones de distribución; no obstante, podría considerarse en estudios futuros analizar las variaciones microclimáticas y edáficas (textura del suelo, disponibilidad de nutrientes, capacidad de retención del agua, entre otros), que influyen en el reclutamiento, establecimiento, patrones de distribución y densidad de Melocactus violaceus. Este hecho es de gran relevancia al considerar la restinga, ya que ésta se caracteriza por hierbas, arbustos y árboles (plantas xerofíticas y halófitas) que están organizadas en parches de plantas anuales y plantas perennes (pastos y arbustos). Estos parches de vegetación tienen, por tanto, niveles más altos de nutrientes y, además, los promedios de radiación y temperatura son generalmente más bajos que en el suelo desnudo (o entre parches), creando islas de fertilidad que mejoran el rendimiento de las plantas (Callaway et al., 1991; Tewksbury y Lloyd, 2001; Munguía-Rosas y Sosa, 2008). En el caso del Parque Nacional Sierra de Itabaiana los suelos son distróficos, formados por arenas de cuarzo excesivamente drenados, moderada o extremadamente ácidos y de baja fertilidad natural (EMBRAPA, 1975), presentando, además, áreas escasas de vegetación primaria continua. Quizá por estas razones, los porcentajes de patrones de establecimiento de Melocactus violaceus subsp. margaritaceus son similares en ambas zonas (65-66%) y corresponden a distribución en espacios abiertos, no bajo nodriza, pero en la cercanía de la vegetación circundante.
Presencia de cefalio
Las plantas de Melocactus violaceus subsp. margaritaceus en etapa inmadura en ambas zonas varían de 77 a 88%. Estos datos son similares a los presentados por Figueiredo (2016), quien menciona 70% de individuos inmaduros durante el periodo de verano (mes de agosto) para la mis ma especie. En contraste, para M. peruvianus Vaupel, se ha mencionado que presenta dos fases fenológicas, floración y fructificación, con ocho estadios fenológicos; la producción máxima de flores se presenta en marzo y octubre, mientras que el estadio de fruto maduro ocurre entre agosto y diciembre (Ramírez-Bullón et al., 2014). En Melocactus violaceus subsp. margaritaceus la presencia del cefalio es un indicio de que la planta ha alcanzado la madurez reproductiva y es de gran importancia para asegurar el éxito reproductivo de esta especie zoocora. Más aún si ésta se caracteriza por poseer tallos reducidos en tamaño, flores pequeñas y se distribuye en espacios abiertos, la formación de cefalio (mayormente presente en épocas de mayor precipitación pluvial) aseguraría la interacción flor-polinizador. Incluso podría asegurar la dispersión, ya que tanto las flores como los frutos se desarrollan sobre el cefalio, y en el caso de los frutos, aunque tienen desarrollo criptocárpico, son expuestos verticalmente sobre el cefalio solamente cuando han madurado para atraer al dispersor (Figueira et al., 1994; Gomes et al., 2014).
Morfometría de caracteres vegetativos y reproductivos
Las variables de altura y diámetro de tallo de ambas zonas mostraron diferencias estadísticas significativas, aunque los valores de la media se encuentran dentro de los promedios característicos para la misma especie en zonas con características ambientales similares dentro del nordeste brasileño (Figueira et al., 1994; Figueiredo, 2016). No obstante, son más bajos comparados con los valores promedio establecidos para otras especies de Melocactus. Por ejemplo, en M. macracanthos (Salm-Dyck) Link & Otto, los valores de altura oscilan desde 17.5 a 20 cm y para diámetro de 8.5 a 29.5 cm (Thomson, 2005). Para Melocactus peruvianus, M. ernestii, M. oreas Miq. y M. zehntneri (Britton & Rose) Luetzelb., se mencionan promedios de altura desde 7 hasta 48 cm (Castro-Cepero y Ceroni-Stuva, 2010; Dantas et al., 2016; Figueiredo, 2016). El tamaño de las flores, frutos y semillas de M. violaceus en ambas zonas de estudio está dentro del promedio establecido para otras especies de Melocactus en la región nordeste de Brasil tal como lo establecen Taylor et al. (2014) y Meiado (2015) para M. sergipensis N.P. Taylor & Meiado; así como para M. glaucescens (Colaço et al., 2006). Los frutos de M. macracanthos, M. peruvianus M. ernestii, M. oreas y M. zehntneri se caracterizan por una longitud promedio que varía de 5 a 28 mm (Thomson, 2005; Castro-Cepero y Ceroni-Stuva, 2010; Figueiredo, 2016). En la presente investigación la longitud de frutos fue de 7.6 a 8.1 mm. En el caso de las semillas, sin embargo, se observó que las del presente estudio mostraron valores de la media de 1.4 a 1.8 mm de longitud y de 1.2 a 1.3 mm de diámetro, los cuales son superiores a lo señalado para semillas de M. peruvianus (1.15 mm de longitud × 0.88 mm de diámetro) (Castro-Cepero y Ceroni-Stuva, 2010).
La mayoría de las variables vegetativas (longitud y diámetro del tallo) y reproductivas (tamaño de flores, frutos y semillas) tuvieron promedios más altos en la Zona 1 y mostraron diferencias estadísticas significativas al compararlos con la Zona 2. Estas diferencias morfológicas podrían estar relacionadas con los diferentes atributos ecológicos en los sitios de estudio, como ha sido registrado para otras especies de Cactaceae (Simão et al., 2007). Como se ha mencionado anteriormente, la Zona 2 restinga de la presente investigación está limitada por escasez de recursos, exceso de salinidad, entre otros factores (Melo-Junior y Torres-Boeger, 2016), que podrían influir de alguna manera en el desarrollo y atributos de las plantas. El caso contrario ocurre para la Zona 1 Mata Atlântica en El Parque Nacional Sierra de Itabaiana, que se caracteriza por un clima tropical con veranos secos y excedentes hídricos en invierno, lo que permitiría un mejor establecimiento, no sólo de cactáceas sino de varias especies endémicas de dicho ecosistema. Cabe destacar, además, que 26 especies vegetales son endémicas en esta región (Dantas et al., 2010).
En el caso de la longitud de la flor y longitud y diámetro de semilla de Melocactus violaceus subsp. margaritaceus presentes en la Zona 2, sus valores promedio fueron significativamente mayores. Sin embargo, son necesarios estudios sobre la biología reproductiva de esta subespecie en estos y otros ecosistemas contrastantes para concluir al respecto de la variabilidad ecológica sobre el desarrollo de caracteres vegetativos y reproductivos. En el caso de plantas con mayor diámetro en una de las zonas puede atribuirse a factores tales como edad de la planta y/o mayor disponibilidad de recursos que favorecen el crecimiento. Por lo contrario, en el caso de flores de mayor longitud, no se pue de saber si representa una estrategia de la planta para garantizar su reproducción bajo condiciones ambientales estresantes o simplemente porque hay mayor disponibilidad de recursos destinados a la formación de estas estructuras. En M. curvispinus se ha sugerido que los caracteres morfológicos de las flores corresponden a la clásica polinización por colibríes. Sin embargo, la polinización también es compartida con abejas, de tal manera que la planta implementa estrategias de mayor producción y secreción de néctar así como su horario y permanencia de antesis, el cual ocurre entre el medio día y el atardecer, asegurando de este modo su reproducción (Nassar y Ramírez, 2004). Es un hecho, sin embargo, que variaciones en la forma, tamaño, orientación de la flor, duración de la antesis y deposición del polen son factores que podrían influir en la polinización de Melocactus, como se ha observado en otras especies (Queiroz et al., 2015). Además, en ecosistemas semiáridos donde es común observar variaciones estacionales de precipitación pluvial y que estas sean menos abundantes durante periodos de sequía, las poblaciones de polinizadores pueden experimentar cambios drásticos en número y composición (Prado, 2003); son necesarios estudios detallados que corroboren este supuesto.
En el caso de los mecanismos de dispersión, los frutos de Melocactus, al ser consumidos por algunos animales, sus semillas tienen la posibilidad de ser dispersadas, principalmente por hormigas y lagartijas (Santos-Fonseca et al., 2012). Algunas investigaciones mencionan que las lagartijas Tropidurus hygomi Reinhardt & Lutken y Tropidurus torquatus Wied-Neuwied tienen una amplia actividad diurna que comienza temprano en la mañana y finaliza hasta el atardecer (Vargens et al., 2008). De ambas especies se ha observado que son consumidores de los frutos de M. violaceus subsp. margaritaceus (Figueira et al., 1994; Xavier y dos Reis Dias, 2015) en la vegetación costera de suelo arenoso en Espírito Santo y un fragmento de hábitat de restinga en Playa de Pirambu. Los frutos suculentos de esta especie de Cactaceae son altamente energéticos y tienen alto contenido de agua (Figueira et al., 1994), lo cual puede proporcionar importantes recursos a las lagartijas que viven en ecosistemas secos de restinga. Además, la morfología de éste y su patrón diurno de liberación representan adaptaciones para la dispersión por Tropidurus hygomi y T. torquatus (Figueira et al., 1994). Estas especies de lagartijas son consideradas dispersores de semillas de M. violaceus subsp. margaritaceus (Figueira et al., 1994; Xavier y dos Reis Dias, 2015), como ocurre para otras especies de Melocactus (Santos-Fonseca et al., 2012). Aunque se ha observado un síndrome de saurocoria para la dispersión del fruto, con una correlación entre emergencia del fruto y número de dispersores (lagartijas) activos, se requieren estudios más detallados para analizar esta interacción ecológica planta-dispersor y corroborar si la forma del fruto (forma cónica) facilita su extracción. Además, si el color (vistoso, brillante) y su exposición en la madurez en el cefalio de una planta de tamaño pequeño, entre otros caracteres, facilitaría su observación y consumo por este tipo de dispersor particular; en la presente investigación, aunque se registró una menor altura para plantas en la Zona 2 de restinga, los frutos son de menor longitud y su valor de índice de forma es también menor (0.78).
En el caso del tamaño de la semilla, es una variable que posiblemente está relacionada con el tamaño de los frutos. Sin embargo, de acuerdo con Bustamante et al. (2010), las causas de variación en el éxito reproductivo de las plantas (medido como número de frutos y/o semillas), se atribuye a factores tanto intrínsecos y extrínsecos. El factor intrínseco más común está relacionado con la disponibilidad de recursos para la reproducción. Cuando los recursos son limitados, se presenta una reducción en la fecundidad, incluso cuando se lleva a cabo una adecuada polinización. La producción de semillas puede también estar influenciada por la actividad de herbívoros, fragmentación del hábitat, baja densidad de poblaciones y factores genéticos (Bustamante et al., 2010). Algo similar podría ocurrir en la Zona 2 de restinga estudiada, porque aunque las semillas tuvieron un mayor tamaño (lo cual podría asegurar su germinación por poseer mayor cantidad de nutrientes almacenados), no se vio reflejado en los valores de densidad registrados. Probablemente como mencionan Zamith et al. (2013), Hughes et al. (2016) y Hughes (2017), factores, tales como las condiciones ambientales, disponibilidad de recursos, disturbios naturales o antrópicos, influyen en la germinación de semillas y patrones de distribución espacial y dinámica de poblaciones. Se conoce que la reproducción de especies de Melocactus en su hábitat natural ocurre ex clusivamente por semillas (Taylor, 1991). No obstante, de acuerdo con Hughes et al. (2011), los micrositios inicialmente efectivos para permitir con éxito la germinación de semillas pueden no ser los óptimos en el establecimiento de plántulas y su desarrollo en plantas adultas.
Conclusiones
Melocactus violaceus subsp. margaritaceus tiene un valor de densidad mayor en la Zona 1 Mata Atlântica. La Zona 2 restinga se caracterizó por la presencia en mayor cantidad de individuos con cefalio. En relación a los caracteres morfológicos vegetativos, las variables altura y diámetro del tallo tuvieron valores más altos en los individuos de la Zona 1. Al considerar las estructuras reproductivas, destacan los frutos de M. violaceus subsp. margaritaceus de la Zona 1 por un mayor tamaño. Las diferencias observadas en densidad, patrones de distribución y caracteres vegetativos y reproductivos podrían atribuirse a las diferencias del microhábitat de los individuos de esta subespecie de Melocactus.











 text new page (beta)
text new page (beta)