Introducción
Moringa oleifera Lam. es nativa de las zonas sub-Himalaya de la India, Bangladesh, Afganistán y Pakistán (Shahzad et al., 2013). Es la especie más utilizada de la familia Moringaceae (Steinitz et al., 2009). Es fuente de fitoquímicos con aplicación potencial en medicamentos, preparaciones funcionales de alimentos (Agramonte et al., 2014), purificación de agua y producción de biodiesel (Villarreal Gómez y Ortega Angulo, 2014). El uso medicinal de sus hojas, sobre todo, es reconocido mundialmente; se les atribuye la presencia de compuestos bioactivos funcionales (Saini et al., 2016; Fernández Sobrados et al., 2018).
Entre sus múltiples propiedades biológicas destacan su actividad anticancerígena, hepatoprotector, antiinflamatorio, antiarterosclerótico, protector oxidativo de los daños en el ADN, cardioprotector (Olson y Fahey, 2011; Canett Romero et al., 2016), así como nutracéutico en especial por su aporte de calcio, hierro, vitamina C y carotenoides (Bolarinwa, 2017). Debido a esta potencialidad en su uso, su cultivo se ha incrementado en los últimos años (Martín et al., 2013; Matos Ruiz et al., 2016). A pesar de todas sus bondades, es una especie subutilizada aún en su lugar de origen y, por consiguiente, el germoplasma es escaso (Shahzad et al., 2014).
Moringa oleifera tradicionalmente se propaga por semillas (Salem, 2016), pero su germinación es muy baja; varios autores han descrito su micropropagación además de semillas, a partir de segmentos nodales (Steinitz et al., 2009; Agramonte et al., 2014; Matos Ruiz et al., 2016). La alternativa más viable es la propagación vegetativa a través de estacas que, en última instancia, pueden causar la muerte de las plantas madre (Shahzad et al., 2014). En este sentido, con el objetivo de asegurar el mantenimiento de germoplasma y propagación rápida, se han desarrollado técnicas de cultivo in vitro para Moringa oleifera. Sin embargo, aún es escasa la información en relación a la importancia que representa la especie para su uso a nivel agrícola y médico.
Para la propagación in vitro de muchas especies se han utilizado con éxito los biorreactores de inmersión temporal (BIT®) (Watt, 2012). Con estos sistemas se han logrado obtener mejoras significativas en los indicadores morfofisiológicos de los brotes que garantizan mayor supervivencia y crecimiento, de los mismos, en condiciones ex vitro (Aragón et al., 2011).
Para el análisis de las semillas de moringa, aún no está estandarizado un test de germinación; solo existen escasos estudios relacionados con las condiciones óptimas de luz, temperatura y sustrato para su germinación (Navarro et al., 2015). El presente trabajo tuvo como objetivo estandarizar un protocolo para la germinación in vitro de Moringa oleifera mediante el uso de biorreactores de inmersión temporal, para acelerar el proceso y obtener plántulas que podrán ser utilizadas para experimentos de regeneración indirecta y/o directa para un escalado masivo de germoplasma.
Materiales y Métodos
Material vegetal y esterilización de las semillas
Se utilizaron semillas de diversos árboles de moringa, sanas y uniformes, cosechadas en febrero de 2017 en el departamento Capital de la Provincia de Corrientes, Argentina (27°28'09.8"S y 58°50'27.1"W) y almacenadas durante tres meses a 4 °C en bolsas de papel hasta el momento del ensayo.
Las semillas extraídas de los frutos fueron esterilizadas en superficie dentro del equipo de flujo laminar horizontal (CASIBA HL2A®, Buenos Aires, Argentina) por inmersión en una solución de etanol (70%) durante 1 min, transferidas luego a una solución de hipoclorito de sodio (NaOCl) en una concentración de 2.5% cloro activo y Triton® (0.1%) durante 30 min en agitación constante (90 r.p.m.). Una vez finalizado el tratamiento de desinfección, las semillas fueron enjuagadas tres veces con agua destilada estéril.
Germinación de semillas
La germinación de las semillas se evaluó en simientes con y sin testa. La remoción del tegumento seminal se realizó sobre las semillas desinfectadas de forma manual, utilizando guantes de examinación (Nitrilo sin polvo) para mantener la asepsia.
Se evaluaron seis diferentes medios basales líquidos, compuestos de agua (como control) y sales de Murashige y Skoog en su concentración original, al 50 y 25%, complementados además con 0, 15 y 30 g l-1 sacarosa según el caso (Cuadro 1). El pH de los medios de cultivo se ajustó a 5.8 con KOH o HCl y luego se les esterilizó por calor húmedo (121 °C) mediante autoclave (Pasteur SRL, modelo Alfax 40×60, capacidad 75 l, Buenos Aires, Argentina) a 1.46 kg cm-2 durante 20 minutos.
Cuadro 1: Medios de cultivo evaluados durante la germinación in vitro de semillas de Moringa oleifera Lam. MS: Murashige y Skoog (1962).
| Medios de cultivos (M) | Composición |
| M1 | agua |
| M2 | agua + 15 g l-1 de sacarosa |
| M3 | agua + 30 g l-1 de sacarosa |
| M4 | Sales de MS: concentración completa + 30 g l-1 de sacarosa |
| M5 | Sales de MS: 50% de la concentración + 30 g l-1 de sacarosa |
| M6 | Sales de MS: 25% de la concentración + 30 g l-1 de sacarosa |
Se cultivaron diez semillas por tratamiento en biorreactores de inmersión temporal (BIT) desarrollados artesanalmente (Fig. 1), que constan de dos recipientes interconectados por un tubo (constituyendo una unidad). Uno de ellos contiene el medio de cultivo, mientras que el otro alberga los explantes. Al aplicarse presión, el medio de cultivo asciende y cruza a través del tubo conector al otro recipiente. Cada biorreactor contó con 100 ml de volumen de medio basal. Se utilizó una frecuencia de cuatro horas y un tiempo de inmersión de un minuto. Los cultivos fueron incubados durante 21 días en condiciones de luz (116 μmol·m-2s-1 PAR, fotoperíodo 14 h) y temperatura (27±2 °C) controladas. Los cultivos de semillas con testa fueron mantenidos en incubación hasta observarse su germinación, que se alcanzó aproximadamente a los 45 días.
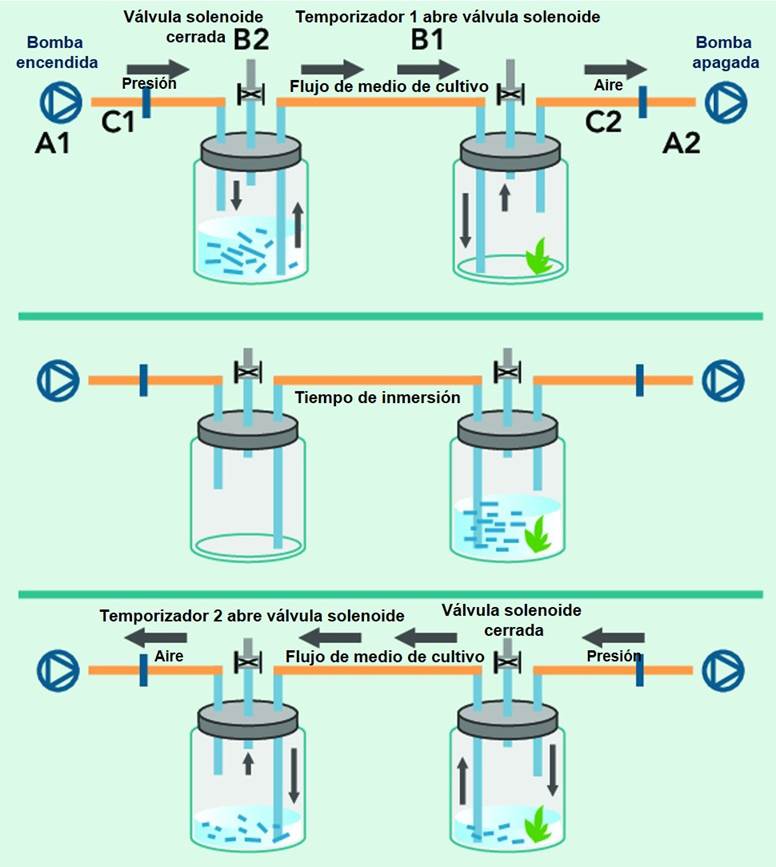
Figura 1: Biorreactor de inmersión temporal BIT. Adaptado de Monroy Álvarez y Filgueira Duarte, 2010.
Por el antecedente de Steinitz et al. (2009), de contaminación bacteriana endógena en el cultivo in vitro de semillas de M. oleifera, a los medios de cultivo de los biorreactores de inmersión temporal, se les adicionó un biocida (0.75 ml l−1 de Delcide™ TG: 5-chloro-2-methyl-4-isothiazolin-3-one+2-methyl-4-isothiazolin-3-one, 1.05 y 0.45%) para obtener un cultivo aséptico durante la ejecución del experimento (Luna et al., 2013).
Se registró el número de semillas germinadas cada tres días durante 21 días. Al finalizar el ensayo se evaluó el porcentaje de germinación (PG%), cuyos resultados se expresaron en porcentaje y número de semillas germinadas acumuladas o germinación acumulada. Para conocer con mayor detalle diferentes características del proceso de germinación se evaluaron algunos indicadores:
Índice de velocidad de germinación (IVG), se determinó a partir del empleo de la siguiente fórmula:
Donde Ci representa el número de semillas germinadas por día y Ti el número de días transcurridos desde el inicio del ensayo en que germinan Ci semillas.
El tiempo medio de germinación (TMG) se calculó a partir del IVG mediante la ecuación:
La capacidad de germinación (CG%) y el porcentaje de plántulas normales se han evaluado a los 12 días de incubación (Bekendam, 1980). Llámese plántulas normales a las que poseen las estructuras esenciales que son indicativas de su habilidad para producir una planta normal bajo condiciones favorables. Estas plántulas poseen un brote normal y sano (hipocótilo, cotiledones o epicótilo) y una raíz (primaria y secundaria) (FAO, 2011). El coeficiente de uniformidad (Cu) es definido por la ecuación:
Donde Ni es el número de semillas germinadas el día Di; Di es el número de días transcurridos desde su cultivo. Para fines prácticos, se consideró una semilla germinada a aquella que exteriorizaba el par de cotiledones y/o una raíz de no menos de 5 mm de longitud.
Para el análisis de crecimiento de plantas se evaluó lo siguiente:
La tasa de crecimiento absoluto (AGR (Absolute Growth Rate)), g día-1 de una planta u órgano para cualquier instante de tiempo (t); AGR se define como el incremento de masa seca de material vegetal (dW) por unidad de tiempo:
La relación raíz:parte aérea (R:S (root:shoot ratio)) se calcula a partir de los pesos de raíces, tallos, pecíolos y hojas.
La relación parte aérea: raíz (S:R) es la inversa de la anterior; es empleada en ciertas ocasiones.
La proporción de raíz (RMF (Root Mass Fraction)) representa la relación entre la biomasa del sistema radical y la biomasa total de la planta; se expresa en g (raíz) g-1 (planta).
La proporción de parte aérea (LMF (Leaf Mass Fraction)) cuantifica la relación entre la biomasa de la parte aérea y la biomasa total de la planta; se expresa en g (parte aérea) g-1 (planta) (Di Benedetto y Tognetti, 2016).
Los índices anteriormente descritos se calcularon a partir del registro de 1) biomasa fresca de tallo o peso fresco parte aérea (PFA), raíz (PFR) y total (PFT); para ello se realizó la extracción de las plántulas del medio con una pinza y se pesaron en una balanza analítica (WANT, modelo FA2004H, Jiangsu, China); 2) biomasa seca de tallo (PSA), raíz (PSR), total (PST) y su relación biomasa seca tallo y raíz (RBSA/BSR), para lo cual la biomasa fresca se colocó en una estufa (BIOELEC, modelo 2, Buenos Aires, Argentina) a 62° C durante 72 h, y 3) cálculo de parámetros biométricos para evaluar crecimiento como longitud de tallo (LA) y raíz (LR), número de hojas y masa seca por plántula (MS) en g.
Pruebas de viabilidad
A modo de complementariedad de los resultados del ensayo de semillas con testa, se realizó la prueba topográfica por tetrazolio, para evaluar viabilidad de las simientes cultivadas en los biorreactores y que no germinaron durante el ensayo. El mismo se basa en un cambio de coloración de los tejidos vivos en presencia de una solución de la sal de cloruro de 2,3,5-trifenil tetrazolio. Se acondicionaron las semillas realizando sumersión en la solución de tetrazolio para su tinción utilizando frascos de vidrio de 100 ml con tapa hermética. Se incubaron en estufa (DALVO, modelo TDE/70, Buenos Aires, Argentina) a 28 °C y en oscuridad durante 24 h. Una vez cumplida la tinción, las semillas se enjuagaron con abundante agua corriente y se realizaron observaciones individuales sobre cada semilla disectada. Se utilizó el patrón de clasificación de viabilidad adaptado de Fogaça et al. (2006). Las variables se expresaron en porcentajes.
Diseño experimental y análisis estadístico
Se evaluó la prueba topográfica por tetrazolio sobre la muestra de semillas, con testa o tegumento, visualmente identificada como sana, pero sin germinar en cada uno de los medios de cultivo ensayados. Todos los parámetros fueron evaluados estadísticamente con un diseño completamente aleatorizado donde se cultivaron diez semillas por tratamiento (medio de cultivo) y por biorreactor. Cada biorreactor representa una unidad experimental, se efectuaron tres repeticiones del experimento. Se realizó análisis de la varianza sobre los datos y las medias fueron comparadas entre sí por la prueba de comparaciones múltiples de Tukey (p<0.05) para determinar el grado de significancia entre los distintos tratamientos, por medio del software InfoStat (Di Rienzo et al., 2011).
Resultados
Las semillas con testa cultivadas en los biorreactores de inmersión temporal fueron monitoreadas hasta observar el inicio de germinación que se produjo a los 45 días de incubación. Al momento el M2 (agua+15 g l-1 sacarosa) fue el único tratamiento que desencadenó el proceso en 23.33±5.77%. Por ello no se ha logrado evaluar los parámetros de vigor propuestos. Al realizar la prueba de viabilidad de tetrazolio sobre las semillas no germinadas durante el experimento se registró que luego del tiempo de incubación solo 34.16±18.73% de las semillas aún se encontraba viable (Cuadro 2).
Cuadro 2: Patrón de clasificación de viabilidad de semillas de Moringa oleifera Lam.: descripción de las clases para la prueba de tetrazolio y porcentajes para cada una de ellas (Adaptado de Fogaça et al., 2006, atendiendo la licencia Creative Commons CC By-NC 4.0).
La germinación de las semillas sin testa o tegumento cultivadas en los biorreactores de inmersión temporal inició en menor tiempo (tercer día) en aquellos tratamientos cuyo medio basal fue el agua con o sin el agregado de sacarosa. Para el M1 (agua) y M2 (agua+15 g l-1 sacarosa) con 23.33 y 15% respectivamente (Fig. 2), alcanzó su máximo valor (66.66±5.77%) en M1 (agua) a los nueve días de incubación. El M5 (MS: 50%+30 g l-1 sacarosa) fue el tratamiento con mayor registro de germinación (80±10%) y se inició a los seis días.
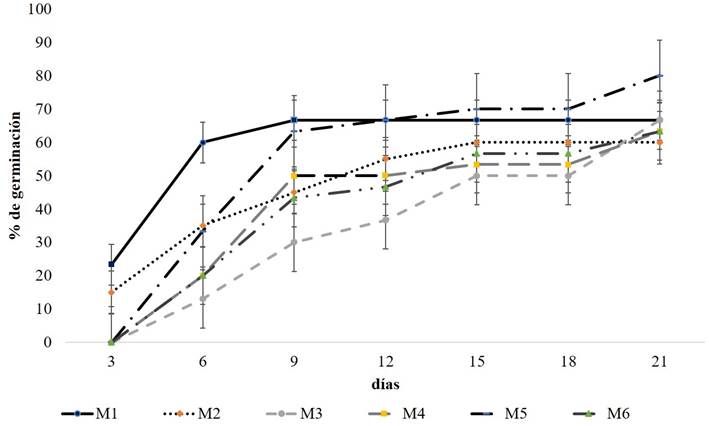
Figura 2: Germinación acumulada de semillas de Moringa oleifera Lam. La barra indica el error estándar de la media de tres repeticiones independientes. M1, M2, M3, etc. corresponden al número de tratamiento.
El porcentaje de germinación (PG) registrado (Cuadro 3), si bien no presenta diferencias significativas entre los distintos medios de cultivo ensayados, manifiesta que la remoción del tegumento muestra efectos significativos en el proceso. Se registraron valores que variaron entre 60±10 y 80±10%. El índice de velocidad de germinación (IVG) varió de 1.78±0.3 a 3.92±0.34 semillas germinadas por día, obteniéndose este último valor con el tratamiento M1 (agua) (Cuadro 3). Para la variable tiempo medio de germinación (TMG) se observó que el medio basal utilizado incide directamente en el tiempo necesario para que germinen las semillas, siendo diferentes significativamente los medios de cultivo compuestos por agua de los compuestos por MS (Cuadro 3). Por su parte el M1 (agua) fue el tratamiento que registró el menor tiempo requerido para el proceso en cuestión (13.02±0.39 días).
Cuadro 3: Indicadores de vigor en la germinación de semillas de Moringa oleifera Lam. en condiciones in vitro. PG: poder germinativo; IVG: índice de velocidad de germinación; TMG: tiempo medio de germinación; CG: capacidad de germinación en %; CU: coeficiente de germinación. En una misma fila se comparan diferentes medios de cultivo. Letras distintas indican diferencias significativas entre tratamientos (medios de cultivo) (p≤0.05, Test de comparaciones múltiples de Tukey).
| M1 | M2 | M3 | M4 | M5 | M6 | |
| PG% | 66.66±5.8a | 60±10a | 66.66±25. 2a | 66.66±9. 8a | 80±10a | 70±7.4a |
| IVG | 3.92±0.3a | 3.05±0.4ab | 1.78±0.3b | 2.25±0.3b | 2.93±0.3ab | 2.19±0.3b |
| TMG (días) | 13.02±0.3b | 14.30±0.4ab | 15.53±0.3 a | 14.56±0.4ab | 14.53±0.4ab | 14.88±0.4ab |
| CG% | 66.67±5.3a | 55.00±6.5 ab | 36.67±5.3 b | 50±5.3 ab | 66.67±5.3 a | 46.67±5.3ab |
| CU | 0.26±0.43a | 0.80±0.14a | 0.86±0.33a | 0.75±0.28a | 0.91±0.07a | 0.77±0.12a |
La capacidad germinativa (CG) fue similar para los tratamientos M1 (agua) y M5 (MS: 50%+30 g l-1 sacarosa) (66.67±5.3%), independientemente de la composición del medio basal. Si bien no se han encontrado diferencias significativas en el coeficiente de uniformidad de la germinación (CU) entre los diferentes medios de cultivo, se destaca el M5 (MS: 50%+30 g l-1 sacarosa) con el mayor valor (0.91±0.07) (Cuadro 3; Fig. 3A).

Figura 3: Detalle de la germinación in vitro de Moringa oleifera Lam. A. semillas germinadas sin testa; B, C. plántulas de 21 días en los biorreactores.
En cuanto al análisis del crecimiento de las plántulas, el número de hojas de las plantas obtenidas durante los 21 días varió entre 0.67±0.36 (M3: agua+30 g l-1 sacarosa) y 3.73±0.74 (M4: MS concentración completa+30 g l-1 de sacarosa), observándose diferencias significativas entre los tratamientos, lo cual permitió determinar como el mejor tratamiento para el desarrollo foliar a este último (M4) (Figs. 3B, C).
Para los parámetros longitud del tallo y raíz no se encontraron diferencias significativas entre los tratamientos evaluados (Cuadro 4). En estudios realizados por Medina et al. (2007), a partir de los 20 días de sembradas en macetas, los tratamientos de remojo en agua por 24 horas registraron una longitud del tallo de 10.7-11.2 cm y de la raíz de 3.4-3.9 cm; no difiriendo mucho con los resultados obtenidos en este estudio con el M1 (agua), donde se registró 7.09±1.7 cm para tallo y con el M5 (MS: 50%+30 g l-1 de sacarosa) 3±1.17 cm para raíz en condiciones in vitro.
Cuadro 4: Análisis del crecimiento de plántulas de Moringa oleifera Lam. en condiciones in vitro en los diferentes medios de cultivo ensayados. PFA: peso fresco parte aérea en g; PFR: peso fresco radical en g; PFT: peso fresco total en g; PSA: peso seco parte aérea en g; PSR: peso seco radical en g; PST: peso seco total en g; RBSA/BSR: relación biomasa seca aérea y radical; LA: longitud aérea en cm; LR: longitud radical en cm; AGR: tasa de crecimiento absoluto (mg día -1); R:S: relación raíz: parte aérea a partir de los pesos de raíces, tallos, pecíolos y hojas; S:R: relación parte aérea: raíz; RMF: proporción de raíz, representa la relación entre la biomasa del sistema radical y la biomasa total de la planta g (raíz) g-1 (planta) y LMF: proporción de parte aérea cuantifica la relación entre la biomasa de la parte aérea y la biomasa total de la planta; g (parte aérea) g-1 (planta). En una misma fila se comparan diferentes medios de cultivo. La comparación de las medias es en una misma fila. Letras distintas indican diferencias significativas entre tratamientos (p≤0.05, Test de comparaciones múltiples de Tukey).
| M1 | M2 | M3 | M4 | M5 | M6 | |
| PFA (g) | 0.25±0.04ab | 0.15±0.05b | 0.12±0.03b | 0.38±0.07a | 0.24±0.04ab | 0.20±0.08b |
| PFR (g) | 0.15±0.04ab | 0.07±0.01ab | 0.031±0.03b | 0.23±0.09ab | 0.27±0.13a | 0.21±0.06ab |
| PFT (g) | 0.40±0.08ab | 0.23±0.06b | 0.15±0.02b | 0.61±0.15a | 0.51±0.18ab | 0.41±0.14ab |
| PSA (g) | 0.011±0.002bc | 0.006±0.004c | 0.004±0.0006c | 0.026±0.006a | 0.018±0.003ab | 0.012±0.004bc |
| PSR (g) | 0.0102±0.003ab | 0.0074±0.0002ab | 0.0037±0.003b | 0.0178±0.006a | 0.019±0.007a | 0.0144±0.003ab |
| PST (g) | 0.021±0.004ab | 0.013±0.004 b | 0.008±0.002b | 0.044±0.012 a | 0.037±0.009a | 0.027±0.007 ab |
| RBSA/BSR | 1.14±0.19a | 0.79±0.54 a | 2.36±2.34a | 1.54±0.32a | 1.01±0.34a | 0.85±0.15a |
| LA (cm) | 7.09±1.7a | 3.60±1.562a | 1.14±0.455a | 6.36±1.516a | 4.20±1.127a | 3.14±1.09a |
| LR (cm) | 2.80±0.94a | 2.29±0.69a | 0.77±0.81a | 2.06±0.13a | 3±1.17a | 2.04±0.35a |
| N° de hojas | 2.90±0.08a | 2.73±0.09a | 0.67±0.36b | 3.73±0.74a | 2.82±1.10a | 2.71±0.45 ab |
| AGR(mg día-1) | 1±0.2ab | 0.55±0.2 b | 0.36±0.1b | 2±0.5a | 1.7±0.4 a | 1.2±0.4 ab |
| R:S | 0.88±0.17a | 1.63±1.12a | 0.94±0.94a | 0.66±0.1a | 1.05±0.31a | 1.17±0.18a |
| S:R | 1.14±0.20a | 0.79±0.54a | 2.36±2.3a | 1.54±0.3a | 1.01±0.34a | 0.85±0.15a |
| RMF (g (raíz) g-1 (planta)) | 0.46±0.04a | 0.57±0.17a | 0.4±0.25a | 0.4±0.05a | 0.50±0.07a | 0.53±0.04a |
| LMF (g (parte aérea) g-1 (planta)) | 0.52±0.04a | 0.41±0.17a | 0.59±0.25a | 0.59±0.05a | 0.48±0.07a | 0.45±0.04a |
El peso fresco de la parte aérea (PFA) varió entre 0.12±0.03 (M3: agua+30 g l-1 sacarosa) y 0.38±0.07 g (M4: MS concentración completa+30 g l-1 de sacarosa) (Cuadro 4), mientras que el peso seco de la parte aérea (PSA) se registró entre 0.004±0.0006 (M3) y 0.026±0.006 g (M4). Esto demuestra que existen diferencias entre los tratamientos con respecto a los valores registrados. Con relación al peso fresco (PFR) y seco de la raíz (PSR), los tratamientos con un medio basal compuesto por MS en distintas concentraciones fueron los que registraron los mayores valores de peso fresco y peso seco (Cuadro 4).
El mayor peso fresco (PFT) y seco total (PST) de las plantas se obtuvo con el tratamiento M4 (MS: concentración completa+30 g l-1 de sacarosa) 0.61±0.15 y 0.044±0.012 respectivamente, mientras que para la relación biomasa seca tallo y raíz (RBSA/BSR) no se encontraron diferencias significativas entre tratamientos, aunque la mayor relación se registró con el M4 (2.36±2.34).
Con respecto a la tasa de crecimiento absoluto (AGR) destacan los medios de cultivo compuestos por las sales de MS (Murashige y Skoog, 1962) con diferentes proporciones de sacarosa. Disminuyeron su incremento de crecimiento diario en la medida en que la concentración original de sales se diluía: completo (2±0.5 mg·d-1), 50% (1.7±0.4 mg·d-1) y 25% (1.2±0.4 mg·d-1); presentando diferencias significativas el último respecto a los anteriores.
En cuanto a la relación raíz:parte aérea (R:S), aunque no hubieron diferencias significativas entre tratamientos, solo M5 (MS: 50%+30 g l-1 sacarosa) y M6 (MS: 25%+30 g l-1 sacarosa) superaron la unidad (1.05±0.31 y 1.17±0.18 respectivamente), mientras que su inversa (S:R) tampoco demostró diferencias estadísticas.
En las relaciones de proporción de raíz (RMF) y parte aérea (LMF), todos los tratamientos analizados resultaron estadísticamente iguales y además demostraron por poco una igualdad de peso entre tallo y raíz (LMF) entre 0.41±0.17 y 0.59±0.25.
La acumulación de masa seca también depende de la composición nutricional del medio de cultivo. Como se evidencia en la Fig. 4, se encontraron diferencias entre los diferentes medios de cultivo utilizados, pero la mayor acumulación de masa seca la expresó M4 (MS: concentración completa+30 g l-1 de sacarosa) con 0.57±0.14 g de masa seca por plántula, seguido por M5 y M6 (0.47±0.17 y 0.39±0.14 g respectivamente).
Discusión
Respecto a la presencia del tegumento seminal y su influencia en el proceso germinativo, Popinigis (1997) ha demostrado que el tegumento de las semillas de moringa posee sustancias inhibidoras de la germinación. Por ello se recomienda inmersión en agua destilada a temperatura ambiente por 24 horas para aumentar la permeabilidad de la testa y así promover o facilitar la germinación, ya que además se logran remover las sustancias inhibidoras. Estos resultados también los han validado Padilla et al. (2012). Por su parte, Pardos (2004) ha demostrado que, cuando las semillas están mucho tiempo en remojo o en contacto con un ambiente húmedo, puede ocurrir pérdida de germinación y afectarse su viabilidad.
Existe como antecedente de germinación in vitro en moringa, la protrusión a los cinco días de siembra en medio semisólido de semillas sin testa, por lo que la utilización de medio líquido y biorreactores de inmersión temporal estarían mejorando el inicio del proceso de germinación. Por ello la integración de los sistemas automatizados con las pruebas de vigor consideradas tradicionales en la evaluación de la calidad de las semillas pueden contribuir al desarrollo de metodologías que permitan la estandarización de las pruebas de vigor (Marcos-Filho, 2010). Por otra parte, se han mejorado en todos los casos los resultados obtenidos por Matos Ruiz et al. (2016), quienes cultivaron semillas de Moringa oleifera sin testa en medio semisólido compuesto por el 100% de las sales MS, suplementado con 20 g l-1 de sacarosa, 1 mg l-1 de tiamina, 100 mg l-1 de mioinositol y sin reguladores del crecimiento por 21 días, alcanzando una germinación de entre 31.35 y 54.24%.
El porcentaje de germinación y el efecto de la remoción del tegumento es coincidente con lo informado por Sharaf-Eldin et al. (2017). Las diferencias en los valores de germinación están relacionadas con el potencial de germinación, ya que se ha demostrado que M. oleifera disminuye su potencial de germinación o la viabilidad después de dos meses de almacenamiento (Pérez et al., 2010).
Las tasas de germinación en vivero y con diferentes tratamientos pre-germinativos que no incluyen remoción del tegumento reportadas para la especie varían entre 85 y 99% para semillas frescas (Toral et al., 2013). Esto no difiere de los resultados de este estudio, pero sí supera el índice de velocidad de germinación (IVG) reportado por los mismos autores. Por su parte, Muhl et al. (2011) comprobaron que el promedio de tiempo medio de germinación (TMG) para la especie está registrado en 17 días para condiciones de incubadoras con el mismo rango de temperaturas que las manejadas en el presente ensayo, obteniéndose un menor valor en éste (13.02±0.39 días) y utilizando un medio basal compuesto por agua.
Los antecedentes acerca de indicadores de calidad fisiológica en la germinación in vitro de M. oleifera son, como la capacidad germinativa según la extensiva búsqueda bibliográfica realizada a la fecha, inexistentes. La viabilidad de las semillas se mide por su capacidad para germinar y establecer plántulas normales. Desde un punto de vista fisiológico representa la capacidad de mantenerse metabólicamente activas para producir, cuando las condiciones son adecuadas, la energía necesaria para germinar y establecer plántulas normales. Por otra parte, aunque la máxima viabilidad (o máxima capacidad germinativa) de las semillas se alcanza en su madurez fisiológica, las condiciones que provee la planta madre impiden su germinación (Copeland y McDonald, 1995).
La uniformidad en la germinación puede ser expresada como la varianza de los tiempos individuales de las semillas respecto al promedio del tiempo de la muestra evaluada. A la par asumimos que el tiempo para completar la germinación se comporta como una distribución normal y mientras mayor resulte dicho valor, mayor será la uniformidad (Pulido-Flores y Monks, 2013).
Con relación al peso fresco (PFR) y seco de la raíz (PSR), los resultados obtenidos tienen coincidencia con los alcanzados por Shahzad et al. (2014), que recomiendan el uso de MS (Murashige y Skoog, 1962) como medio basal para la obtención de plántulas mediante la germinación de semillas de M. oleifera. Los estudios que relacionan las raíces con la parte aérea (biomasa de raíz/biomasa de parte aérea) muestran que existe una interdependencia entre el sistema radical y la parte aérea de la planta y resaltan la importancia del equilibrio funcional entre las dos partes (Barrios et al., 2014).
En condiciones de turgencia plena, el peso fresco o húmedo es un buen estimador del volumen, ya que en general las variaciones en el peso específico de los tejidos vegetales son bajas. Esto es así debido a que el agua es el principal componente en casi todos los órganos y tejidos (las semillas son una notoria excepción). Sin embargo, el análisis clásico del crecimiento es un análisis de la acumulación de peso seco, que no estima bien el volumen, debido a que los tejidos pueden experimentar variaciones en su contenido porcentual de masa seca (ya que una proporción importante de los fotoasimilados almacenados en una célula pueden ser transitorios). En contrapartida, el peso seco es un muy buen estimador del carbono total de la planta, lo que permite analizar importantes aspectos de su fisiología (Di Benedetto y Tognetti, 2016).
La determinación de la tasa de crecimiento absoluta, de acuerdo con la etapa fisiológica del cultivo, permite valorar la absorción de nutrientes y acumulación de masa seca por la planta directamente relacionada con la fotosíntesis (Jiménez-Terry et al., 2013). Ñústez et al. (2009) describieron que la tasa de crecimiento absoluta es un índice fisiológico relacionado con el crecimiento de las plantas que no expresa la intensidad con que se produce el cambio, pero estima el ritmo de producción de masa seca por planta por unidad de tiempo. Particularmente se han encontrado antecedentes de mediciones de dicho parámetro en condiciones in vitro, en su mayoría relacionando calidades lumínicas con su expresión. Sin embargo, con reportes inexistentes en la especie y sin estudios vinculados con la influencia de la composición del medio basal sobre este índice de eficiencia fisiológica en particular, los resultados obtenidos permiten concluir que la tasa de crecimiento absoluto en M. oleifera en condiciones in vitro está estrechamente relacionada con la composición del medio de cultivo.
En general, las proporciones de peso entre los diferentes órganos cambian durante la ontogenia. Lo que se está cuantificando cuando se pesa un órgano en un determinado momento es el resultado de la distribución del carbono en etapas previas y no necesariamente indica cómo está siendo particionado el carbono al momento de la medición. Por este motivo, la relación raíz:parte aérea (R:S) puede mostrar valores muy superiores a la unidad en etapas tempranas, aun cuando el carbono se esté particionando preferentemente hacia la parte aérea. En consecuencia, las proporciones dan idea de la situación en un instante dado, pero no su proyección en el tiempo (Di Benedetto y Tognetti, 2016). La relación raíz:parte aérea, así como su inversa, la relación parte aérea:raíz, son útiles para caracterizar el equilibrio funcional de la planta en sus intercambios con el ambiente aéreo y subterráneo (Kang y Van Iersel, 2004). Finalmente, cabe destacar que es útil tener en cuenta que la relación raíz:parte aérea también puede expresarse en términos de áreas expuestas al ambiente, lo que generalmente les otorga una mayor significancia ecofisiológica (Di Benedetto y Tognetti, 2016).
Cuando se quiere estimar la partición de carbono asignado a cada órgano, se presenta el problema de que pequeños cambios en la asignación del carbono lleva a grandes cambios en estas relaciones. Justamente para evitar este problema se desarrollaron las relaciones RMF y LMF, en las que el denominador es el peso total de la planta (Poorter y Sack, 2012). Sin embargo, estas relaciones tienen a su vez la dificultad de que pequeños cambios en ellas pueden representar grandes modificaciones en el equilibrio funcional de la planta.
Los resultados obtenidos evidencian que la acumulación de masa seca también depende de la composición nutricional del medio de cultivo (Martínez-Villegas et al., 2015). La asimilación de masa seca y su distribución dentro de la planta son procesos importantes que determinan la productividad del cultivo; es comúnmente usada como parámetro para caracterizar el crecimiento (Tekalign y Hammes, 2005).
Conclusiones
La remoción de la testa de la semilla y la composición química del medio de cultivo influyen positivamente mejorando el proceso de germinación in vitro de M. oleifera. Por ello se recomienda el uso de MS como medio basal para la obtención de plántulas mediante la germinación de semillas de M. oleifera que, junto con la remoción de la testa, aceleran el proceso y posibilitan obtener plántulas que podrán ser utilizadas para experimentos de regeneración indirecta y/o directa para un escalado masivo de germoplasma.











 nueva página del texto (beta)
nueva página del texto (beta)