Introducción
El crecimiento de la población humana y sus actividades productivas se ha considerado como una de las principales causas de la modificación de los ecosistemas naturales (Boserup, 1965, 1981; Smil, 1991; Netting, 1993). Más de 75% de los biomas del mundo han sido alterados, quedando menos de 25% en condición prístina (Ellis y Ramkutty, 2008). Si bien actualmente las áreas urbanas solo ocupan 4% de la superficie terrestre, su efecto negativo sobre los ecosistemas naturales sobrepasa los límites a su alrededor (Grimm et al., 2008). Para 2050, 68% de la población humana se concentrará en áreas urbanas (ONU, 2018), de manera que éstas cada vez serán más grandes, sobre todo en los países en vías de desarrollo, provocando que la mitad de la población urbana viva en ciudades de más de 500,000 habitantes (UNPD, 2005).
El cambio de uso de suelo, la deforestación y urbanización han constituido un factor significativo en la extinción de especies silvestres incluyendo las arbóreas, causando una reducción de la superficie forestal (McDonald et al., 2008). Ante esto, se han creado las áreas naturales protegidas (ANPs) que representan los refugios de especies y ecosistemas originales bajo el escenario del crecimiento poblacional, con la intensión de detener los procesos adversos mencionados (Ghimire y Pimbert, 1997). La cantidad de ANPs ha aumentado en forma sostenida durante los últimos cien años (Pyke, 2007), de manera que la cercanía entre ambos tipos de áreas es cada vez mayor.
De acuerdo con 162 estudios realizados a nivel mundial, McDonald et al. (2009) encontraron que las áreas urbanas están impactando las áreas naturales protegidas a una distancia media o menor de 50 km. Identificaron 22 efectos importantes de las áreas urbanas sobre las áreas protegidas los cuales se correlacionaron con la proximidad al área urbana. Dos tercios de los efectos (p. ej. pérdida del hábitat) se presentaron en los 50 km alrededor del área urbana. En Europa, por ejemplo, los países tienen una densidad poblacional >40 personas/km2 con una distancia <10 km de sus poblaciones a las áreas naturales. En los Estados Unidos de América se tiene una densidad poblacional <40 personas/km2 con una distancia <50 km a las áreas naturales, y en Asia la cercanía poblacional a las áreas naturales aumentará dramáticamente (<5 km), disminuyendo la distancia media de 43 a 23 km para 2030 (McDonald et al., 2009). Sin embargo, hasta el día de hoy, estos son los pocos estudios que analizan esta problemática desde el punto de vista de conservación biológica.
Las ANPs presentan una alta variabilidad estructural y funcional, por lo que se ha dicho mucho acerca de su efectividad en la protección de la biodiversidad (Laurance et al., 2012). Bruner et al. (2001) encontraron que 80% de las ANPs en 22 países tropicales fueron efectivas en la protección de la biodiversidad y reducción de la deforestación, a pesar de que 70% contenía asentamientos humanos dentro de la reserva al momento del decreto. Sin embargo, en otro estudio, la mitad de ANPs en zonas tropicales alrededor del mundo con la población más cercana >50,000 habitantes no fueron efectivas y presentaron un grave deterioro, tanto a 3 km de distancia como en su interior, mientras que en la otra mitad fueron mínimamente efectivas, lo que muestra que las ANPs se encuentran íntimamente relacionadas con su entorno (Laurance et al., 2012).
La pérdida de superficie forestal para el caso particular de la selva tropical de Los Tuxtlas (Veracruz) en el sureste de México, se redujo aunque solo temporalmente a partir del decreto de reservas forestales (CONANP, 2006; UNESCO, 2006), pero después de una década se reinició la deforestación (Von Tanden et al., 2018), muy probablemente debido al crecimiento urbano a su alrededor (INEGI, 2010).
Considerando que el decreto de un ANP o Reserva de la Biosfera establece, entre otras cuestiones, que ningún nuevo asentamiento humano se puede dar dentro de esta área (DOF, 1998), y debido a la escasez de trabajos en México que analicen el efecto de los asentamientos humanos en la diversidad biológica de las áreas naturales, en el presente trabajo se analizó lo siguiente: 1) el efecto de la distancia y densidad del asentamiento humano más cercano al área natural sobre su diversidad arbórea para el caso del trópico, 2) el efecto de la distancia y densidad del asentamiento humano más cercano al área natural sobre el tipo de vegetación de las áreas naturales protegidas y 3) la relación entre la superficie forestal alrededor del área natural y el tamaño y distancia de los asentamientos humanos.
Como pregunta principal se replanteó para México la pregunta formulada para otras localidades del mundo (Bruner et al., 2001): ¿En realidad funcionan las ANPs para la conservación de la diversidad arbórea? y específicamente para el presente trabajo se formuló la pregunta ¿Cómo es el efecto del crecimiento de la población del asentamiento humano sobre la diversidad arbórea de las áreas naturales protegidas? Como hipótesis se planteó que las ANPs albergan mayor diversidad α de especies arbóreas que las áreas naturales no protegidas (ANnoPs), y que esta diversidad es mayor mientras las áreas sean más grandes, estén más alejadas de las poblaciones humanas y la densidad poblacional sea menor. Finalmente, se espera que los asentamientos humanos poblaciones más grandes y cercanos al área forestal se relacionen a una menor superficie forestal.
Materiales y Métodos
Recuperación de la información
Se recuperó información de internet por medio del buscador Google Académico™, utilizando seis y siete palabras clave con las siguientes estructuras de búsqueda respectivamente: 1) “riqueza” OR “diversidad” OR “estructura” AND “arbo*” AND “selva” AND “México”; 2) “riqueza” OR “diversidad” OR “estructura” AND “arbo*” AND “bosque” AND “tropical” AND “México”. La palabra clave “selva” se completó e intercambio por los distintos tipos de selva (alta perennifolia (SAP), mediana subperennifolia (SMSP), mediana subcaducifolia (SMSC) y baja caducifolia (SBC), y la palabra “bosque” por mesófilo de montaña (BMM) y de encino (BE), que son los tipos de vegetación tropical dominantes en el sureste de México. También se hizo una búsqueda de documentos en inglés con la siguiente estructura y palabras clave: “richness” OR “diversity” OR “structure” AND “tree” OR “forest” AND “tropical” AND “Mexico”. Se utilizó este buscador debido a que arrojó resultados de diversos tipos de documentos (libros y tesis) en comparación con otros medios como Scopus y Wiley especializados en artículos científicos, de tal manera que constituye un método más consistente o estandarizado para búsqueda de publicaciones científicas. De los documentos obtenidos se eligieron artículos científicos de revistas indexadas en JCR e índice de revistas del CONACyT, mediante su búsqueda directa en el catálogo de JCR (2017) y la página web del CONACyT, así como libros con ISBN y tesis relacionados con el tema. Se consideraron las fechas de publicación desde la más antigua a la más reciente para obtener datos más representativos y completos en el tiempo.
Selección y análisis de las variables
De los documentos seleccionados se extrajo la información para las siguientes variables: 1) tipo de vegetación (selva alta perennifolia (SAP), selva mediana subperennifolia (SMSP), selva mediana subcaducifolia (SMSC), selva baja caducifolia (SBC), bosque mesófilo de montaña (BMM) y bosque de encino (BE)), 2) tipo de área natural (protegida (ANP) y no protegida (ANnoP)), 3) antigüedad del decreto de protección del área (años), 4) área total de muestreo (ha), 5) superficie forestal donde se realizó el muestreo (km2), 6) diámetro mínimo a la altura del pecho (DAP<cm), 7) diversidad α (riqueza de especies), índice de Shannon, índice de Simpson, equidad, 8) distancia del área natural a la población más cercana y 9) tamaño poblacional (número de habitantes) de la población humana más cercana.
Se consideró la población más cercana al área natural, ya que es la que más impacta a través del cambio de uso del suelo y actividades de extracción y perturbación de los recursos naturales. La variable de antigüedad del decreto de protección de las ANPs se consideró para analizar cómo la distancia y tamaño de los asentamientos humanos cercanos las han afectado a través del tiempo, y poder contrastarla con las ANnoPs. Cuando la publicación carecía de dicha información, ésta se obtuvo de la siguiente manera: la distancia del área natural a la población más cercana se estimó mediante el medidor de distancia de Google Maps™, midiendo la distancia entre los puntos más cercanas de sus perímetros.
La superficie forestal y fragmentos donde se realizó el muestreo se estimó desde la plataforma de INEGI utilizando la herramienta “agregar polígono” ubicada en la parte superior derecha del mapa digital del Directorio Estadístico Nacional de Unidades Económicas del INEGI (DENUE, 2018) ubicado en su página principal. Cuando los estudios incluían vegetación en estados de regeneración natural se consideró únicamente la vegetación madura o con edades sucesionales >25 años. El número de habitantes de la población más cercana al área de estudio se obtuvo de los censos poblacionales del INEGI (1990, 2000, 2010) según el año de la publicación del trabajo, con la intención de usar el dato poblacional de cuando se estimó la diversidad del área.
La diversidad arbórea se tomó de los resultados de los manuscritos seleccionadas para el estudio y se consideró de acuerdo a su valor total o valor promedio de las áreas de muestreo si carecía del valor total. Cuando las áreas de muestreo estaban separadas más de 1 km entre sí, con sus respectivos valores de diversidad, se consideraron como independientes. Lo anterior debido a que a esa distancia en las comunidades arbóreas es común que se presente una variación en la composición florística (Segura et al., 2003), lo cual además incrementó el número de datos o casos del estudio.
Análisis de la relación entre las variables de diversidad, superficie, asentamientos humanos y antigüedad
Con las variables ya descritas, se analizaron las siguientes relaciones para todos los tipos de vegetación, juntos y por separado: área de muestreo-diversidad biológica (en sus distintos índices), diversidad biológica-distancia a la población más cercana, diversidad biológica-número de habitantes de la población más cercana, distancia a la población más cercana-superficie forestal, diversidad biológica-antigüedad del ANP, y número de habitantes de la población más cercana-antigüedad del ANP.
Comparación de datos de diversidad
El principal reto que se presentó para el análisis fue el comparar la diversidad α de especies arbóreas provenientes de trabajos que consideraron diferentes límites mínimos de DAP (1, 2, 2.5, 3, 3.12, 5, 10 y 20 cm) y área total de muestreo (0.1-4 ha) cuando no reportaban el resultado por hectárea.
Para poder hacer comparables los resultados se generaron dos modelos de regresión:
Primero, a partir de tres trabajos de selva baja caducifolia (Pineda-García et al., 2007; Martínez-Cruz et al., 2013; Méndez-Toribio et al., 2014) que sí incluían resultados de diversidad de las mismas parcelas con varios límites de DAP, se construyó el siguiente modelo de regresión lineal: Diversidad α=63.6195-4.2644*DAP (g.l.=16, r2=59.47%, p=0.0003). Con este modelo se calculó la diversidad α equivalente al DAP de 1 cm (que fue el límite reportado más frecuente) a partir de la diversidad α reportada en los diferentes trabajos. Lo anterior se hizo considerando el error estándar y residuales del modelo lineal obtenido.
Una vez ajustada la diversidad α al DAP de 1 cm, se procedió a estandarizar la variable a 0.1 ha de muestreo (que fue el área muestreada más frecuente). Para esto se usó un segundo modelo (polinomial) para describir con mayor aproximación la relación área-diversidad: diversidad α=37.6949+38.0351*área muestreada-5.06717*área muestreada2 (r2=14.4%, p=0.0003). Este modelo se usó para estimar la diversidad α de cada localidad en 0.1 ha, considerando el error estándar y residuales del modelo.
Con base en esos dos modelos, se estandarizó la diversidad α para el límite mínimo de 1 cm DAP y 0.1 ha de muestreo, que es la que se usó en lo sucesivo. Todo lo anterior fue realizado en Microsoft Excel ver. 2010 y Statgraphics Centurion ver. VII (STATGRAPHICS, 2014).
Análisis estadístico
Se usó la t de Student para comparar las medias de las variables de diversidad y poblacionales entre los dos tipos de áreas naturales. Para comparar las variables de diversidad y poblacionales entre los diferentes tipos de vegetación y áreas naturales al mismo tiempo se usó el ANOVA de dos vías con la prueba de medias de Tukey (p<0.05). Cuando se requirió transformar los datos para tener la distribución normal, se aplicaron las funciones raíz cuadrada para diversidad, logaritmo para las variables poblacionales y transformación Box-Cox (Zar, 1999). Para el análisis de la relación área muestreada-riqueza de especies, se aplicó la regresión logarítmica por ser la más adecuada (Rosenzweig, 1995). Para el análisis de la relación diversidad-variables poblacionales (distancia y densidad poblacional) se optó por un modelo general linealizado (GLM) del tipo de regresión logística en lugar de un modelo de regresión lineal simple, por ser el más recomendado para el análisis del efecto de las variables sociales como las poblacionales (Ludeke et al., 1990; Fox, 1997; Hosmer y Lemeshow, 2000; Vilar del Hoyo et al., 2008). La regresión logística se caracteriza por ajustar un modelo de regresión donde la variable respuesta Y tiene valores de proporciones entre 0 y 1. Relaciona la probabilidad de ocurrencia de una proporción entre 0 y 1 de una variable Y con la variable X, con lo cual se puede determinar cómo influye en la aparición de un suceso (p. ej., riqueza de especies) la presencia de una variable X; en este caso las variables poblacionales de distancia de la población más cercana y densidad poblacional. La fuerza o intensidad de la relación está dada por el porcentaje de desviación que es explicada por el modelo y que es equivalente al coeficiente de determinación (r2) de la regresión simple (Ludeke et al., 1990).
El análisis GLM se hizo de tipo multivariado, el cual es más completo ya que analiza cuál de las dos variables independientes (distancia y densidad poblacional) explican más el modelo. Se usó Statgraphics Centurion ver. VII (STATGRAPHIC, 2014).
Resultados
A partir de 60 documentos (Apéndice) se utilizaron 109 datos de diversidad arbolada de áreas naturales: 21 de BMM, 10 de BE, 17 de SAP, 19 de SBC, 7 de SMSC y 35 de SMSP; 67% correspondieron a ANnoPs y 33% a ANPs. Los estudios abarcaron 80.12 ha de muestreo que pretendieron representar 36,719.3 km2 de superficie forestal (área muestreada=0.002%). De estos 60 estudios, 46 fueron independientes y 14 tuvieron entre dos y 11 áreas de muestreo, de tal manera que 46 datos de diversidad fueron aislados y 63 fueron cercanos a una distancia mínima de 1 km entre sí, provenientes de 14 estudios. Estos últimos presentaron un coeficiente de variación de 25 a 70% dependiendo del estudio en particular.
De las variables utilizadas en el presente análisis, la superficie forestal (429.1%) y la densidad de la población más cercana (326.4%) fueron las que más variaron, mientras que el índice de equidad (25.1%) fue el que menos varió (Cuadro 1). La distancia a la población más cercana y el área muestreada en las áreas naturales también variaron por arriba de 100%. El coeficiente de variación, los valores medios, mínimos y máximos de la diversidad α y diversidad α ajustada fueron muy similares (Cuadro 1).
Cuadro 1: Valores medios de las variables utilizadas en el presente estudio, y sus medidas de dispersión. C.V.=Coeficiente de Variación.
| Variables del análisis | n | Media | Min. | Max. | C.V. (%) |
| Diversidad α | 105 | 57.5 | 4.0 | 200.0 | 73.7 |
| Diversidad α ajustada | 103 | 53.25 | 1.42 | 187.5 | 71.65 |
| Índice Shannon | 81 | 2.88 | 1.19 | 5.8 | 36.24 |
| Índice Simpson | 22 | 13.3 | 4.0 | 24.1 | 42.5 |
| Equitatividad | 46 | 0.71 | 0.22 | 0.98 | 25.1 |
| Área muestreada (ha) | 108 | 0.74 | 0.085 | 5.0 | 137.92 |
| Superficie forestal (ha) | 102 | 29,366.4 | 4.0 | 723,181.0 | 429.1 |
| Distancia a población más cercana (km) | 106 | 6.9 | 0.2 | 60.0 | 140.7 |
| No. habitantes población más cercana | 105 | 21,774.5 | 20.0 | 725,123.0 | 326.4 |
| Antigüedad de las ANP (años) | 36 | 16.1 | 1 | 36 | 58.13 |
Comparación de las áreas naturales
Las ANPs tuvieron mayor riqueza promedio de especies que las ANnoPs (67.2 vs 49.2 especies arbóreas ha-1) (t=1.97, p=0.05). Los demás índices de diversidad no presentaron diferencia entre estos dos tipos de reservas naturales. La población humana más cercana a la ANP es en promedio mucho mayor (40,320 vs. 16,403 habitantes, t=1.94, p=0.05) que la población más cercana a las ANnoPs, aunque esta se encuentra a una menor distancia media (12.1 km) que la población más cercana de las áreas no protegidas (4.8 km) (t=3.56, p=0.006).
En cuanto al tipo de vegetación de las reservas naturales, la diversidad α de SBC fue mayor que en BMM y BE (71 vs 27.4 y 27.1, p=0.004). El índice Shannon fue mayor en los BE, SAP y SMSC que en SBC y BMM (5, 4.2, 3.7 vs 2, 2.2, p=0.0000). La equitatividad fue mayor en SMSP que en SBC (0.76 vs 0.6, p=0.03) y la distancia de la población más cercana estuvo más retirada en SMSP que en SAP y BE (6.3 vs 2.9 y 2.8 km, p=0.02).
Relación área de muestreo-diversidad arbórea
Aunque con un valor bajo de R2 (6.9%), la relación del área muestreada y la diversidad α se ajusta a la relación asintótica típica de área-diversidad de especies (p<0.05) (Fig. 1). La relación del área de muestreo con el índice de Simpson también aumentó, aunque sin alcanzar la asíntota seguramente por un tamaño de muestra pequeño (p<0.05, R2=9.0%). Los demás índices de diversidad presentaron correlación con la diversidad α, por lo que no se consideró necesario presentar la gráfica de su relación con el área muestreada.
Relación diversidad arbórea-asentamientos humanos
La diversidad arbórea estuvo relacionada con la distancia de la población más cercana a las ANnoPs; a medida que la población más cercana de la reserva se aleja, la diversidad α y el índice Shannon aumentan, mientras que para las ANPs no hay relación significativa (Figs. 2A, B). Por el contrario, el índice Simpson disminuyó en las ANnoPs con el alejamiento de la población más cercana (Fig. 2C).
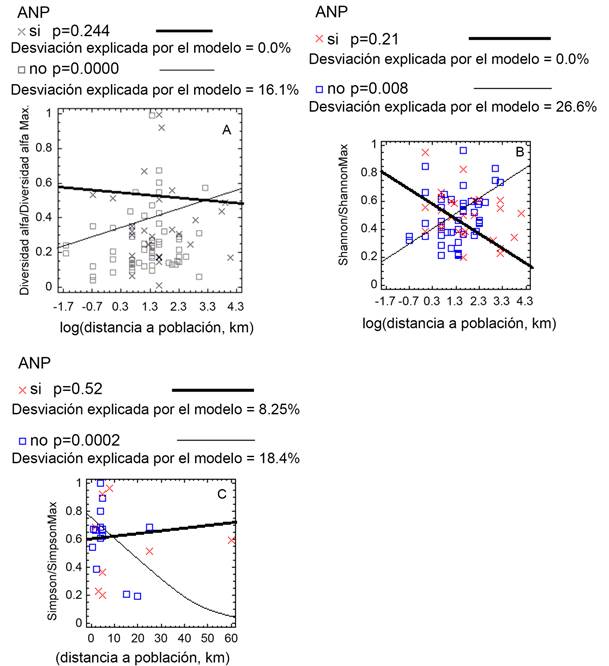
Figura 2: A. relación de la diversidad α con la distancia (km); B. relación del índice Shannon con la distancia; C. relación del índice Simpson con la distancia, en las áreas naturales protegidas (si) y no protegidas (no).
Hubo efecto del tamaño de la población sobre la diversidad arbórea de las ANnoPs. A medida que el tamaño de la población aumenta, tanto la diversidad α como los índices Shannon y Simpson disminuyen, mientras que en las ANPs no cambian significativamente a excepción del índice Simpson que aumenta con el incremento de la población (Figs. 3A-C).
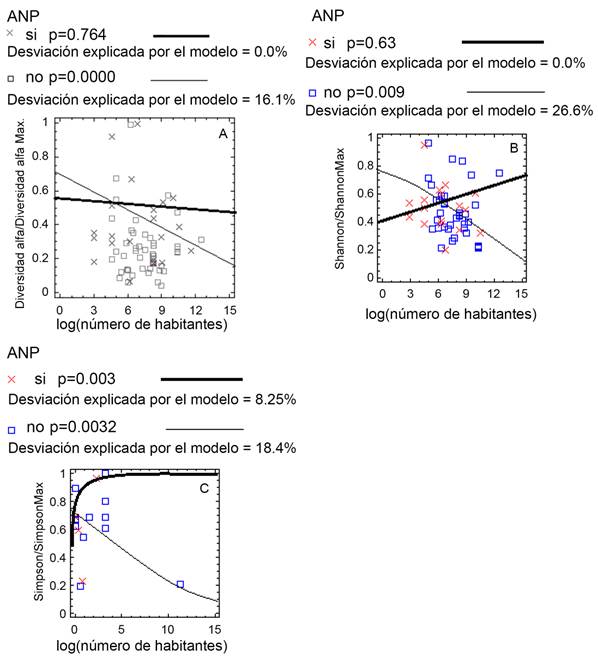
Figura 3: A. relación de la diversidad α con el tamaño de la población más cercana (número de habitantes); B. relación del índice Shannon con el tamaño de la población más cercana; C. relación del índice Simpson con el tamaño de la población más cercana en las áreas naturales protegidas (si) y no protegidas (no).
En cuanto a la equitatividad, no se presentó ninguna relación significativa con las variables poblacionales. Para el caso de las reservas naturales por tipos de vegetación, se observaron relaciones entre la diversidad α y los asentamientos poblacionales más cercanos.
Las ANnoPs de SMSC presentaron relación con su diversidad α y las variables poblacionales. A medida que aumentó la distancia de la población la diversidad α también aumentó (p=0.0002, desviación explicada por el modelo=6.4%) y en la proporción que aumentó el tamaño de la población, la diversidad α disminuyó (p=0.0000, desviación explicada por el modelo=11.6%). Para la SMSP, mientras se aleja la población más cercana, la diversidad α disminuye en los dos tipos de reservas (Fig. 4), mientras que, en SAP, solo disminuye en las ANPs (p=0.0003, desviación explicada por el modelo=3.77%). En el caso de las reservas de BMM, a medida que aumenta la densidad poblacional de la ciudad más cercana, la diversidad α disminuye en ambos tipos de reservas (Fig. 5A), mientras que con el alejamiento de las poblaciones, la diversidad α aumenta en las ANPs y disminuye en las ANnoPs (Fig. 5B). Finalmente, con el incremento de la distancia de las poblaciones más cercanas a los macizos forestales de las reservas naturales, la superficie de estos macizos aumenta en mayor proporción para las ANP (Fig. 6).
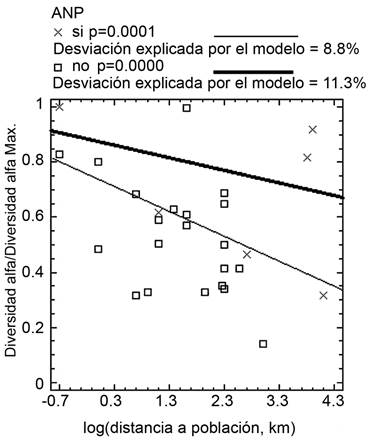
Figura 4: Relación de la diversidad α con la distancia (km) del asentamiento poblacional más cercano a las áreas naturales de selva mediana subperennifolia (SMSP).
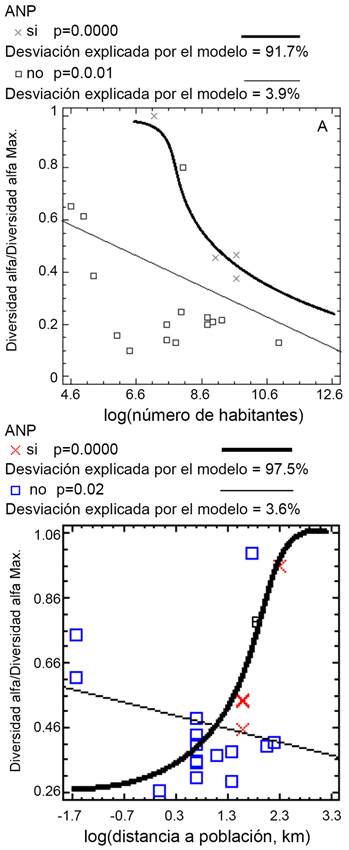
Figura 5: A. relación de la diversidad α con la densidad poblacional (número de habitantes); B. relación de la diversidad α con distancia del asentamiento poblacional más cercano a las áreas naturales de BMM.
Relación antigüedad del ANP-diversidad arbórea
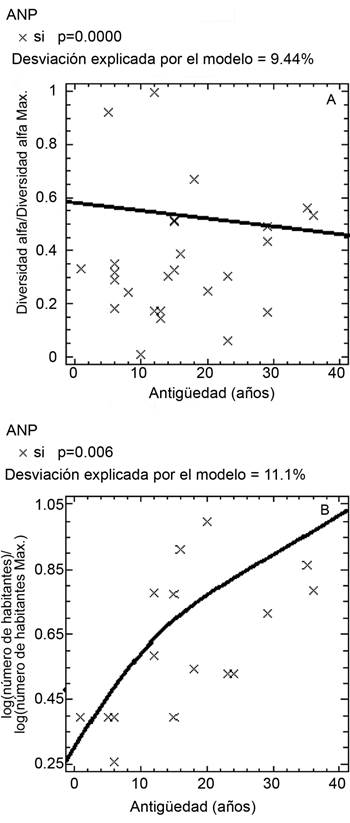
Mientras más antiguas son las ANPs de haber sido decretadas como reservas naturales, su diversidad arbórea disminuye y la densidad de su población más cercana aumenta (Figs. 7A, B). Para las demás variables de diversidad biológica, no se presentó ninguna relación significativa. Con base en el modelo de la relación diversidad α-antigüedad (α/αMax=exp(0.251091-0.0116193*antigüedad)/(1+exp (0.251091-0.0116193*antigüedad)) (Fig. 7A), la disminución de la diversidad transcurrida en 40 años equivale a 11.4% de las especies arbóreas.
Discusión
Relación área-diversidad arbórea
A pesar de un valor bajo de R2 y una amplia dispersión de puntos, la relación área muestreada-riqueza de especies fue de forma asintótica (Fig. 1). Esto probablemente se deba a la diferencia intrínseca de los tipos de vegetación o comunidad arbórea aquí analizados, ya que por naturaleza la diversidad y riqueza de especies se encuentran fuertemente asociadas al tipo de vegetación. Tal es el caso extremo de bosques de pinos o encinos y bosques de montaña o selvas altas perennifolias, de tal manera que la figura 1 refleja que una hectárea de dos tipos de vegetación arbórea distinta pueden contener una riqueza muy diferente. A pesar de lo anterior, tal como se ha reportado para muchas relaciones área-diversidad arbórea (Knapp et al., 2008), a medida que el área de muestreo aumentó en las áreas naturales, la diversidad arbórea también aumentó. El incremento de la riqueza fue como usualmente se presenta para las especies arbóreas, con una línea que alcanza una asíntota a partir de cierto valor de área. Dado que los datos de diversidad de estructura arbórea provenientes de áreas de muestreo de un mismo estudio son diferentes, estos se consideraron también independientes.
Acerca de la relación área-diversidad α, existen más trabajos disponibles en México en donde se ha encontrado una relación positiva del tamaño del fragmento con la diversidad. Dirzo et al. (2009) encontraron que la riqueza de especies leñosas >1 cm DAP en fragmentos de 700 a 40 ha decae linealmente de 138 a 102 especies, respectivamente. Sin embargo, esto no sucedió para el estado adulto (>10 cm DAP) donde la disminución de la riqueza no fue significativa. Así también, a partir de los datos reportados en Santana et al. (2014), se encuentra una relación positiva entre el área y la riqueza de especies arbóreas >1 cm DAP para 11 fragmentos de 208 a 1523 ha de bosque mesófilo de montaña en Michoacán, México. Lo mismo sucede con datos de área-riqueza para vegetación de bosque de encinos de diversos trabajos reportados por Escobar-Ocampo y Ochoa-Gaona (2007), y de helechos y licopodios de bosques mesófilos de diversos trabajos reportados por Carvajal-Hernandez et al. (2014) y Acebey et al. (2015) para Veracruz, México.
Relación diversidad arbórea-variables rurales y urbanas
Aunque sin un procedimiento estadístico de por medio (i.e. AICc) que avale la comparación de verosimilitud de los modelos de regresión empleados, se puede decir que de acuerdo con Ludeke et al. (1990) y Hosmer y Lemeshow (2000), la regresión logística resultó más adecuada que la regresión lineal simple para el análisis de la relación diversidad-variables poblacionales. Lo anterior por producir menos resultados significativos pero con mayor claridad, ya que con la regresión simple se obtuvieron siete resultados significativos más (no se presentan aquí) entre las variables humanas y las variables de diversidad arbórea, que no fueron significativas mediante el modelo de regresión logística y hubieran podido llevar a conclusiones erróneas o un error de tipo I.
La aproximación más común de diversidad de especies es la diversidad α (riqueza de especies) (Gaston, 2000; Purvis y Hector, 2000; Magurran, 2004). Las ANPs presentan una diversidad α mayor que las ANnoPs, a pesar de tener un asentamiento humano cercano de mayor densidad, lo cual seguramente se compensa por encontrarse más alejada. Las poblaciones cercanas parecen no afectar las ANPs, pero sí las ANnoPs que aumentan su diversidad a medida que la urbanización es más lejana. De manera similar, Von Tanden et al. (2018) encontraron que la distancia a la población más cercana fue una variable explicativa en el ANP Los Tuxtlas en Veracruz, tanto para la reforestación como para la desforestación, ya que la tala de árboles aumentaba con la presencia de asentamientos humanos. A mayores densidades poblacionales en ciudades a su alrededor, la riqueza en las ANnoPs decrece, pero no así en las ANPs, por lo que sí se puede confirmar un efecto negativo del crecimiento poblacional humano sobre la conservación de la riqueza biológica. Esto muy probablemente indica que las ANPs sí están cumpliendo su valor como protección de la biodiversidad a pesar de un efecto antropogénico adverso, preservando una mayor riqueza de especies.
En cuanto a la relación crecimiento poblacional-diversidad arbórea en áreas naturales, Vázquez-Torres y Onaindia (2008) encontraron menos especies arbóreas (>20 cm DAP) en un ANP que en una ANnoP de selva alta perennifolia en Los Tuxtlas, aunque tenían valores similares de diversidad de Shannon, respectivamente (83 y 101 especies; 3.511 y 3.391; p<0.05, p>0.05). Por el contrario, en el presente trabajo se encontró que la cercanía de la población humana pareciera no afectar la diversidad α en SAP y SMSP. En relación a esto, la solidez de este resultado se basa en que constituye una muestra de 16 y 33 áreas naturales respectivamente, a diferencia de casos específicos aislados como el anterior. Los resultados del presente trabajo coinciden con los de Bruner et al. (2001) y Laurance et al. (2012) para poblaciones <50,000 habitantes, en cuanto a que las ANPs en el trópico de México sí están funcionando como protectoras de la biodiversidad al menos para las especies arbóreas, a diferencia de Europa Central y Norte América, donde la densidad poblacional es mayor y las ANPs no funcionan como tal (McDonald et al., 2009).
Acorde a lo esperado acerca de la relación entre la diversidad arbórea y el tamaño y distancia de los asentamientos humanos, estos últimos sí tuvieron un efecto negativo sobre la diversidad arbórea de las ANnoPs, pero no así en las ANPs del trópico de México. La distancia de la población más cercana y su tamaño poblacional afectan la diversidad arbórea de las ANnoPs, ya que mientras la distancia es menor y su densidad poblacional es mayor, la diversidad arbórea se reduce. Por el contrario, este efecto no se observa para el caso de las ANPs, a pesar de ser más antiguas y estar sujetas a una mayor densidad poblacional (Fig. 7B). Este resultado también se puede observar para ANnoPs con ciertos tipos de vegetación, en particular como SMSC, donde la distancia corta y población grande también afecta su diversidad arbórea, y ANPs de BMM afectadas por el tamaño pero beneficiadas por la distancia de la población (Fig. 5B). Entre los factores que pueden estar involucrados en esta afectación se encuentran el contrabando de plantas y animales, cacería, tala, extracción de leña e incendios (Mcdonald et al., 2009). En Europa Central y Norte América, la riqueza de especies de aves, mariposas y líquenes es menor en áreas protegidas dentro que fuera de las ciudades (Blair, 1999; Knapp, et al., 2008).
Al reducirse la distancia entre el área natural y el área urbana, aumenta la interacción entre estos dos ambientes más de forma negativa (contaminación, calor, ruido, contrabando, menos agua, luz artificial, cacería, tala, extracción de leña, incendios, transmisión de enfermedades de plantas y animales, perturbación del suelo) que positiva (valor económico, turismo, conservación) (McDonald, et al., 2009). Las ANPs con mayor deterioro estuvieron altamente relacionadas con la perdida de cobertura forestal a su alrededor, siendo la protección externa un gran determinante para su protección interna, posiblemente mediante el involucramiento y beneficio de las comunidades a su alrededor (Laurance et al., 2012).
El deterioro o cambio de uso de suelo en el mosaico rural es un claro efecto de la presencia de asentamientos poblacionales. Lo anterior también se encuentra respaldado en el presente trabajo, al observarse que a medida que aumenta la distancia de la población más cercana, se incrementa el tamaño de todas las áreas naturales, tanto por separado (ANPs, ANnoPs) como en su conjunto (Fig. 6), indicando un claro efecto negativo de los asentamientos poblacionales sobre el cambio de uso de suelo en la proximidad de las áreas naturales.
En el presente trabajo no se encontró afectación en las ANPs para una media poblacional de 21,774 habitantes. Laurance et al. (2012) encontraron afectación en las ANPs por una media poblacional >50,000 habitantes, lo cual concuerda con el resultado anterior. Quizás un punto de análisis de trabajos subsecuentes puede ser constituido por la determinación del límite mínimo de densidad poblacional para una afectación en las ANPs del trópico de México.
En el presente trabajo se considera que el haber evaluado la diversidad arbórea con un límite mínimo de 1 cm de DAP seguramente representa un escenario distinto al que se encontraría si se hubiera evaluado con un límite mínimo de 10 o 20 cm de DAP, ya que el primer caso considera la regeneración temprana de las especies, mientras que el segundo, la diversidad afectada por actividades como la tala, y ello proporciona una menor riqueza de especies.
Por otro lado, el resultado aquí encontrado es notable considerando que las ANPs analizadas son relativamente jóvenes, pues presentan una mediana de 13 años desde su creación, en comparación con la mediana de 23 años de las ANPs de Bruner et al. (2001). A medida que las ANPs son más antiguas, están sujetas a una población más grande a su alrededor, por lo que seguramente su diversidad arbórea disminuye. En el presente estudio se obtuvo una reducción de la diversidad equivalente a 11.4% al cabo de 40 años de antigüedad, por lo que se considera que las ANPs pueden estar sufriendo esta disminución de diversidad arbórea, particularmente por causa de la densidad poblacional, siendo un factor importante de considerar por las dependencias relacionadas con su protección para prevenir su deterioro biológico a futuro.
Actualmente, la conservación de la biodiversidad en las áreas naturales rebasa el aspecto puramente biológico relacionado a la teoría de la biogeografía de islas, la cual sugiere que mientras el área es mayor aumenta la diversidad α. En un bioma actual, antropizado, el manejo del área per se, el diseño de su sistema de protección, y el presupuesto financiero para su funcionamiento adecuado ejercen mayor efecto que únicamente la conservación de más especies. En este panorama y en concordancia con Bruner et al. (2001) y Laurance et al. (2012), se puede afirmar que las ANPs en la zona tropical de México ayudan a la conservación de las especies. Tomando como base el trabajo de McDonald et al. (2009), y el presente trabajo en particular, una línea de investigación a futuro la puede constituir el diagnóstico de los agentes causales de los asentamientos humanos más cercanos que impactan y afectan a la diversidad arbórea de la reserva natural no protegida en el trópico de México.
Finalmente, se sugiere para próximos estudios similares considerar a detalle el tipo de ANP (si presenta manejo forestal o no, etc.), ya que el manejo por poblaciones indígenas conlleva un mantenimiento de la diversidad arbórea (Moguel y Toledo, 1999).











 nova página do texto(beta)
nova página do texto(beta)