Introducción
La familia Sarcoscyphaceae se ubica taxonómicamente en el Reino Fungi de la siguiente manera: Phylum Ascomycota, Subphylum Pezizomycotina, Clase Pezizomycetes, Subclase Pezizomycetidae, Orden Pezizales (Kirk et al., 2008). La familia es la quinta más numerosa del orden Pezizales, con 13 géneros y 102 especies y se caracteriza por presentar apotecios que varían en tamaños y formas, desde estructuras discoidales a cupuladas, sésiles, pseudoestipitados o estipitados, de colores brillantes por lo general de rojos a anaranjados, debido a la presencia de abundantes pigmentos carotenoides, siendo saprobios crecen principalmente en sustratos leñosos (Kirk et al., 2008). Microscópicamente, se diferencian por formar ascas suboperculadas, octosporadas, uniseriadas, unicelulares, globosas, cilíndricas, elipsoidales a fusoides con simetría bilateral, hialinas, lisas u ornamentadas con estrías longitudinales, reticuladas o verrugosas.
Esta familia se distribuye en regiones templadas del Hemisferio Norte y zonas tropicales del Hemisferio Sur (Butterfill y Spooner, 1995), siendo las zonas tropicales las que presentan mayor diversidad (Hansen y Pfister, 2006). La historia evolutiva de la familia Sarcoscyphaceae ha sido revisada por Harrington et al. (1999), señalándola como un grupo monofilético.
Existen diversos estudios a nivel mundial sobre esta familia, para África (Tibuhwa, 2011), Centroamérica (Denison, 1969, 1972; Calonge et al., 2006, Angelini y Medardi, 2012), China (Wang, 1997; Wen-Ying, 2003a, b), Europa (Butterfill y Spooner, 1995; Öpik et al., 2000, Spooner, 2002); Norte América (Seaver, 1928; Harrington, 1990; Pfister, 1979) y Taiwán (Wang, 2012). Otras obras importantes que incluyen revisiones de diferentes partes del mundo son las de Hansen et al. (1999), Weinstein et al. (2002) e Iturriaga y Pfister (2006).
En México, es común encontrar este tipo de hongos; sin embargo, no hay estudios específicos sobre este grupo. La primera cita de una especie de la familia Sarcoscyphaceae es de Berkeley (1867), quién registró a Wynnea gigantea Berk. & M.A. Curtis de Orizaba, Veracruz. Posteriormente, diversos autores han citado más especies en listados generales. Entre los más representativos tenemos los de Seaver (1928), Valenzuela et al. (1981), Martínez-Alfaro et al. (1983), Chacón y Bautista (1988), Cifuentes et al. (1990), Pompa-González y Cifuentes (1991), Medel et al. (1995) y Raymundo et al. (2013).
Tomando en cuenta la diversidad del país y del grupo en estudio, son pocas las especies de esta familia citadas en México, por lo que el objetivo de este trabajo fue incrementar el conocimiento en el país, a través de descripciones detalladas, analizando su distribución por tipo de vegetación y entidad.
Materiales y Métodos
El trabajo se realizó en dos partes, la primera constó de 14 exploraciones de campo en los estados de Jalisco, Michoacán, Nayarit, Oaxaca y San Luis Potosí entre 2013 y 2018, y en la segunda se revisó el herbario ENCB de la Escuela Nacional de Ciencias Biológicas del Instituto Politécnico Nacional (IPN), donde se estudió material procedente de los estados de Campeche, Chiapas, Coahuila, Colima, Estado de México, Guerrero, Hidalgo, Jalisco, Michoacán, Morelos, Nayarit, Oaxaca, Puebla, Querétaro, Quintana Roo, San Luis Potosí, Tamaulipas y Veracruz.
Todo el material se examinó siguiendo las técnicas tradicionales en la micología; después de la rehidratación en agua, se agregó KOH al 5%; algunas muestras se tiñeron con Azul de Algodón en Lactofenol; posteriormente se procedió a la observación en el microscopio óptico (MO) (K-7 Zeiss, Jena, Alemania). Para observar la ornamentación de las esporas se hizo mediante microscopia electrónica de barrido (MEB). Para esto se colocó una pequeña porción del himenio (no mayor a 5 mm de diámetro) sobre una cinta adhesiva doble, la cual se encontraba previamente adherida a un cilindro, después el himenio se maceró para el desprendimiento de las ascosporas. Por último, las muestras se metalizaron con oro y su observación se hizo en los microscopios JSM6360LV (Jeol, Peabody, MA., EUA), del Instituto de Biología (IB-UNAM) y JSM-5800LV (Jeol, Peabody, MA., EUA), de la Escuela Nacional de Ciencias Biológicas (ENCB-IPN). Los colores hacen referencia a la carta de color de Kornerup y Wanscher (1978). Los ejemplares se determinaron utilizando las obras de Denison (1969, 1972), Butterfill y Spooner (1995), Wang (1997, 2012), Hansen et al. (1999), Calonge et al. (2006), Iturriaga y Pfister (2006), Angelini y Medardi (2012).
Resultados
Se determinaron 18 especies de la familia Sarcoscyphaceae, las cuales están agrupadas en ocho géneros, de los cuales Cookeina Kuntze y Phillipsia Berk. son los más representados, con cinco y cuatro especies respectivamente. La clasificación seguida en este trabajo es de acuerdo a Kirk et al. (2008).
Taxonomía
Cookeina colensoi (Berk.) Seaver, Mycologia 5(4): 191. 1913. Fig. 1.
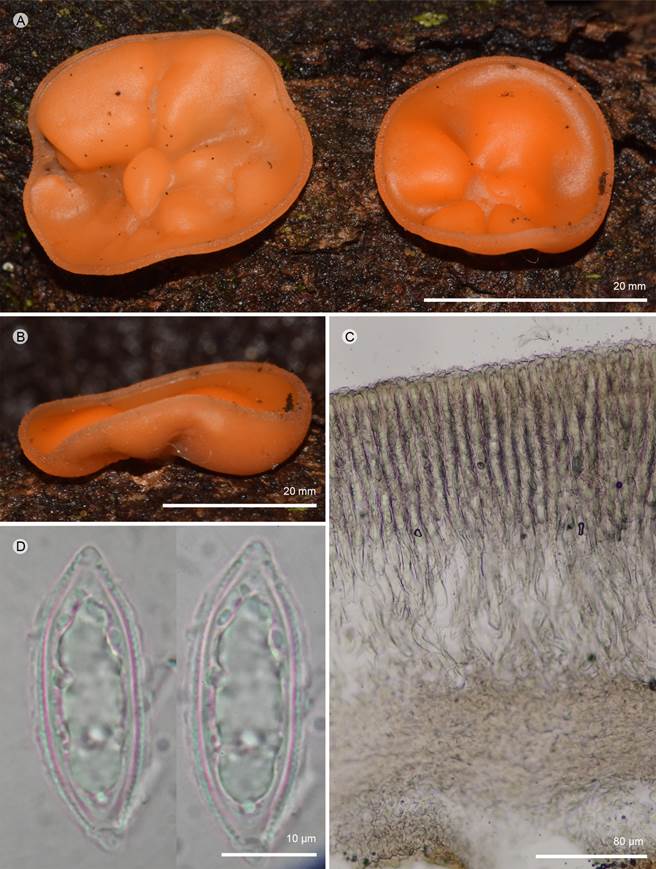
Figura 1: Cookeina colensoi (Berk.) Seaver. A, B. apotecios; C. corte longitudinal del apotecio; D. ascosporas. A-D: T. Raymundo 6892 (ENCB).
Apotecios 20-40 mm de diámetro, cupuliformes, sésiles o subestipitados, lisos, color naranja-amarillento (5A6) en fresco, pálido-amarillento cuando secos (30B4); estípite 5-10 × 1-3 mm, central o ligeramente excéntrico, cilíndrico, color pálido-amarillento (30A5), liso; superficie himenial lisa, color anaranjado-amarillo (5A8), superficie exterior color amarillo-pálido (5A3), lisa o con pequeños pelos imperceptibles a simple vista, estriada cuando seca; pelos 44-100 × 10-14 µm, forma triangular, fusionados a células del margen del excípulo medular; excípulo ectal 200 µm de grosor, textura globular a angulosa, células 12-14 × 14-16 µm, pared 1 µm de grosor, color amarillento (1A3); excípulo medular 300 µm de grosor, textura oblita a intrincada, hifas 2-5 µm de ancho, septadas, hialinas, se observa una capa de textura porrecta cerca del himenio 40-60 µm de ancho, células 3-5 µm de ancho, septadas, hialinas; subhimenio de textura intrincada; paráfisis 2-3 µm de ancho en la parte media, filiformes, septadas, anastomosadas, lanceoladas al ápice, 4 µm de ancho, sobresaliendo 6-8 µm de las ascas; ascas 350-400 × 16-20 µm, pared 2-3 µm de grosor, cilíndricas, base redondeada o estrechándose ligeramente, suboperculadas, inamiloides, hialinas, octospóricas; ascosporas 35-40 × 11-12 µm (x=40 × 12 µm, n=30) oblicuas a elípticas-fusoides, estrechándose hacia los polos, con un lado plano, inamiloides, hialinas, uniseriadas, presenta una gútula que abarca casi toda la espora o muchas gútulas pequeñas, pared 1 µm de grosor, lisas.
Hábitat: lignícola, gregario o solitario, crece sobre madera en descomposición, en bosque mesófilo de montaña.
Distribución: África, Australia, Oeste de India y Nueva Zelanda, (Seaver, 1928); China (Wang, 1997; Iturriaga y Pfister, 2006); Argentina, Australia, Brasil, Colombia, India, Jamaica, Madagascar, México, Nueva Zelanda (Iturriaga y Pfister, 2006); en México, Veracruz (Welden y Lemke, 1961; García-Romero et al., 1970; Welden et al., 1979); se cita por primera vez para Oaxaca, San Luis Potosí y Tamaulipas.
Material examinado: MÉXICO. Oaxaca, distrito Villa Alta, municipio Santiago Camotlán, Sierra Norte, 15.VII.2013, A. D. Gay 182 (ENCB). San Luis Potosí, municipio Tamasopo, Parque Recreativo Puente de Dios, 14.IX.2014, T. Raymundo 5318 (ENCB); loc. cit., R. Valenzuela 15720 (ENCB); loc. cit., 10.IX.2015, R. Valenzuela 16254 (ENCB). Tamaulipas, municipio Gómez-Farías, camino del ejido Alta Cima a la casa de piedra, 17.VIII.1981, R. Valenzuela 1221 (ENCB); loc. cit., 6.X.2017, T. Raymundo 6892 (ENCB), loc. cit. R. Valenzuela 17439 (ENCB).
Notas taxonómicas: Cookeina colensoi se caracteriza por presentar apotecios lisos y ascosporas lisas que se estrechan hacia los polos con un lado plano; es afín a C. venezuelae (Berk. & M.A. Curtis) Le Gal por la apariencia de apotecios lisos y los colores del mismo, pero se diferencia porque C. venezuelae presenta ascosporas con estrías longitudinales separadas, conectadas por finas estrías transversales (Iturriaga y Pfister, 2006).
Cookeina speciosa (Fr.) Dennis, Mycotaxon 51: 239. 1994. Fig. 2.
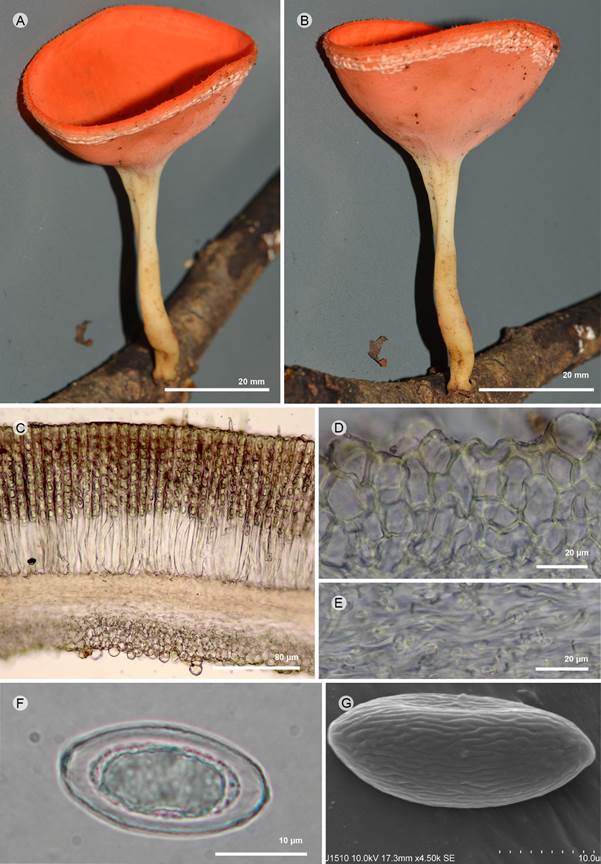
Figura 2: Cookeina speciosa (Fr.) Dennis. A, B. apotecio; C. corte longitudinal del apotecio; D. células del excípulo ectal; E. células del excípulo medular; F. ascospora; G. ascospora vista en MEB. A-F: R. Valenzuela 15577 (ENCB); G: I. Ortega-López 152 (ENCB).
Apotecios 30-40 mm de diámetro, cupuliformes, sésiles, subestipitados o estípitados, lisos, color rojo-mate (8A6-7) en fresco; estípite 5-60 × 2-5 mm, central, cilíndrico, color blanco (9A1), liso; superficie himenial lisa, color rojo-mate (8A6-7), superficie exterior concolora al himenio, lisa o ligeramente aterciopelada cuando joven, color blanquecino (9A2) debido a las vellosidades, borde con tres hileras de pelos blancos; pelos 200-250 × 150-190 µm, forma cónica, agrupados por paquetes de hifas paralelas que surgen de la periferia del excípulo ectal; excípulo ectal 275-425 µm de grosor, textura globular a angulosa, células 15-10 × 12.5-15.5 µm, pared de 1 µm de grosor, color amarillento (4B5); excípulo medular 150-175 µm de grosor, textura intrincada, hifas 3-5 µm de ancho, septadas, anastomosadas, hialinas; subhimenio no evidente; paráfisis 1-2 µm de ancho en la parte media, filiformes, septadas, lanceoladas en el ápice, con incrustaciones lipídicas, sobresalen ligeramente de las ascas; ascas 290-300 × 18-28 µm, pared 2 µm de grosor, cilíndricas, cónicas en la base, 3-4 µm, suboperculadas, inamiloides, octospóricas; ascosporas 27.5-30 × 17-18 µm (x=29 × 17 µm, n=30), ovoides a elipsoidales, hialinas, inamiloides, uniseriadas, pared 1 µm de grosor; en el MEB, ornamentación con estrías onduladas longitudinalmente, algunas anastomosadas, no paralelas.
Hábitat: lignícola, gregario, disperso, crece sobre madera en descomposición, en bosques tropical caducifolio y tropical perennifolio, muchas veces la madera se encuentra bajo la hojarasca, dando la apariencia de ser humícola.
Distribución: China (Wang, 1997; Iturriaga y Pfister, 2006); África, Brasil, Colombia, Costa Rica, Cuba, Filipinas, Guatemala, Guyana Francesa, Jamaica, Nueva Guinea, Panamá, República Dominicana, Trinidad, Uganda (Iturriaga y Pfister, 2006); recientemente de Colombia por Soto-Agudelo et al. (2016); en México se ha citado de Quintana Roo (Guzmán, 2003) en bosque tropical perennifolio; se cita por primera vez para Chiapas, Oaxaca y San Luis Potosí.
Material examinado: MÉXICO. Chiapas, municipio Ocozocoautla, Laguna Bélgica, 13.VII.1972, G. Guzmán 10408 (ENCB); loc. cit., 8.VII.2012, V. I. Álvarez 201 (ENCB). Oaxaca, distrito Teotitlán, municipio Santa María Chilchotla, región Cañada, 9.VII.2014, M. A. Gómez-Ariza s.n. (ENCB); loc. cit., R. Valenzuela 15577 (ENCB). Distrito Tuxtepec, municipio Santa María Jacatepec, región Papaloapan, Vega del Sol, 25.X.2013, I. Ortega-López 152 (ENCB), 155 (ENCB), 159 (ENCB). San Luis Potosí, municipio Ciudad Valles, km 28 de la carretera Ciudad Valles - Río Verde, El Sauz, 330 m, 21°56'31"N, 99°12'01.9"O, 22.IX.2003, R. Valenzuela 11401 (ENCB); loc. cit., V. Araiza s.n. (ENCB); loc. cit., 23.X.2005, R. Valenzuela 12890 (ENCB).
Notas taxonómicas: Cookeina speciosa se caracteriza por la presencia de tres hileras de pelos en el margen, y la ornamentación de la espora; es afín a C. sulcipes (Berk.) Kuntze y C. tricholoma (Mont.) Kuntze en las formas cupuliforme de los apotecios, pero se diferencia de estas porque no presenta pelos en todo el ascoma. Además, la ornamentación de las esporas de C. sulcipes y C. tricholoma presenta de 15 a 20 estrías longitudinales y paralelas, no así en la especie en estudio por tener las estrías onduladas y anastomosadas (Iturriaga y Pfister, 2006).
Cookeina sulcipes (Berk.) Kuntze, Revis. gen. pl. (Leipzig) 2: 849. 1891. Fig. 3.

Figura 3: Cookeina sulcipes (Berk.) Kuntze. A, B. apotecios; C. pelo hifal; D. corte longitudinal del apotecio; E. ascospora; F. ascopora vista en MEB. A: T. Raymundo 4446 (ENCB); B-E: T. Raymundo 7980 (ENCB); F: I. Ortega-López 182 (ENCB).
Apotecios 15-35 mm de diámetro, cupuliformes, estipitados, ornamentados, color rojo vivido a rojo escarlata (9A6-8) en fresco; estípite 35-55 × 2-4 mm, cilíndrico, central, color blanquecino (9A1), engrosándose hacia la parte superior, con pelos blanquecinos; superficie himenial lisa, color rojo vivido a rojo escarlata (9A6-8), superficie exterior concolora al himenio, con pelos blanquecinos, margen incurvado y borde pubescente; pelos 2000 × 40-50 μm en el ápice, 80-110 μm de ancho hacia la base, blanquecinos (9A1), densos en el margen, formados por cuatro o más hifas paralelas, se originan principalmente en el excípulo ectal, algunos en el excípulo medular; excípulo ectal 200-300 µm de grosor, textura globular, células 14-15 µm, pared 1 µm de grosor, color amarillento o amarillo-grisáceo (4B5); excípulo medular 200-350 µm de grosor, textura intrincada, hifas de 4-5 µm de diámetro, septadas, anastomosadas, hialinas o ligeramente amarillentas (4A4); subhimenio no es evidente; paráfisis 2-2.5 µm de ancho en la parte media, cilíndricas, simples o bifurcadas, septadas, anastomosadas; ascas 300-350 × 17-19 µm, cilíndricas, estipitadas, 15-20 × 1.5-2 µm en la base, pared 3 µm de grosor, suboperculadas, inamiloides, octospóricas; ascosporas 27-32 × 12-13 µm (x=30 × 13 µm, n=30) fusoides, cilíndricas, citriformes a elipsoidales, hialinas, inamiloides, uniseriadas, pared 1 µm de grosor, 1-2 gútulas; en el MEB, ornamentación presenta 15-20 estrías delgadas, longitudinales y paralelas entre sí.
Hábitat: lignícola, gregario, disperso, crece sobre madera en descomposición, en bosques tropical caducifolio y tropical perennifolio.
Distribución: Australia, India, Estados Unidos de América (Seaver, 1928), República Dominicana (Angelini y Medardi, 2012); recientemente descrito de Colombia por Soto-Agudelo et al. (2016); en México, se ha citado en Oaxaca para la cuenca del Papaloapan (Welden y Guzmán, 1978) y el Parque Nacional Lagunas de Chacahua (Raymundo et al. 2014), Tamaulipas, Reserva de la Biosfera El Cielo (García-Jiménez y Valenzuela, 2005); se cita por primera vez para Campeche, Jalisco, Nayarit y San Luis Potosí.
Material examinado: MÉXICO. Campeche, municipio Calakmul, Reserva de la Biosfera de Calakmul, El Ramonal, 16.XI.2006, T. Raymundo y R. Valenzuela 1398 (ENCB), 1399 (ENCB). Jalisco, municipio La Huerta, Estación de Biología Chamela, IBUNAM, Eje central, 22.IX.2012, T. Raymundo 4446 (ENCB); loc. cit., 28.IX.2010, T. Raymundo 3508 (ENCB); vereda Búho, 23.IX.2012, R. Valenzuela 14827 (ENCB). Nayarit, km 27 autopista Tépic - San Blas, 190 m, 21°31'45"N, 105°09'48"O, 29.IX.2018, T. Raymundo 7980 (ENCB); loc. cit., R. Valenzuela 18690 (ENCB). Oaxaca, distrito Miahuatlán, municipio Pluma Hidalgo, Sierra Sur, Finca Pacífico, 3.XI.2013, I. Ortega-López 182 (ENCB), 183 (ENCB). Distrito Tuxtepec, municipio Santa María Jacatepec, región Papaloapan, Vega del Sol, 25.X.2013, I. Ortega-López 153 (ENCB), 153a (ENCB), 153b (ENCB). San Luis Potosí, municipio Tamasopo, Parque Recreativo Puente de Dios, 14.IX.2014, R. Valenzuela 15734 (ENCB).
Notas taxonómicas: Cookeina sulcipes se caracteriza por presentar el himenio liso, los pelos se originan principalmente en el excípulo ectal y esporas citriformes; es afín a C. tricholoma por la presencia de pelos en todo el ascoma, pero se diferencia porque esta última presenta ascosporas más grandes (Iturriaga y Pfister, 2006).
Cookeina tricholoma (Mont.) Kuntze, Revis. gen. pl. (Leipzig) 2: 849. 1891. Fig. 4.

Figura 4: Cookeina tricholoma (Mont.) Kuntze. A, B. apotecios; C. corte longitudinal del apotecio; D. pelo hifal; E. ascosporas; F. ascosporas vistas en MEB. A: T. Raymundo y R. Valenzuela 1304 (ENCB); B-E: T. Raymundo 4002 (ENCB); F: I. Ortega-López 184 (ENCB).
Apotecios 15-30 mm de diámetro, cupuliformes, estipitados, lisos, color pálido amarillo-anaranjado (5A8), rosa pálido-naranja a naranja-intenso (6A6-8) en fresco; estípite 30-70 × 2-5 mm, cilíndrico, central, ensanchándose hacia la parte superior, color blanquecino-naranja pálido (5A3); superficie himenial rugosa, color amarillo cromo a naranja intenso (5A6-8), superficie exterior concolora al himenio, provista de pelos, margen ligeramente incurvado y borde pubescente; pelos 2500 × 40-45 µm, agrupados en paquetes de hifas paralelas, surgen del excípulo medular, color marrón amarillento pálido (6D7); excípulo ectal 300-350 µm de grosor, textura globular, células 9-10 µm de diámetro, pared 1 µm de grosor, color gris-marrón (5B1); excípulo medular 200-300 µm de grosor, textura intrincada, hifas 1.5-2.5 µm de ancho, septadas, anastomosadas, hialinas o ligeramente amarillentas (4A4); subhimenio no es evidente; paráfisis 2-2.5 µm de ancho, cilíndricas, simples o bifurcadas, septadas, anastomosadas, con un contenido granular; ascas 300-380 × 12-15 µm, cilíndricas, pared 2 µm de grosor, con una base cónica, suboperculadas, inamiloides, octospóricas; ascosporas 30-38 × 10-14 µm (x=34 × 11 µm, n=30), elipsoidales, hialinas, inamiloides, uniseriadas, bigutuladas, pared 1 µm de grosor; en el MEB, ornamentación presenta 15-20 estrías delgadas, longitudinales y paralelas entre sí.
Hábitat: lignícola, gregario, disperso, crece sobre madera en descomposición, bosques tropical caducifolio y tropical perennifolio.
Distribución: América Central, Australia, Filipinas, India, México (Seaver, 1928); China (Wang, 1997; Iturriaga y Pfister, 2006); África, Argentina, Brasil, Costa Rica, Guatemala, Guyana Francesa, Filipinas, Indonesia, México, Panamá, (Iturriaga y Pfister, 2006); República Dominicana (Iturriaga y Pfister, 2006; Angelini y Medardi, 2012); en México, Chiapas (Robles- Porras et al., 2006), Jalisco (Sánchez- Jacome y Guzmán-Dávalos, 2011), Oaxaca y Veracruz, Parque Nacional Lagunas de Chacahua (Raymundo et al., 2014) y para la región del Papaloapan (Welden y Guzmán, 1978); se cita por primera vez para el estado de Campeche y San Luis Potosí.
Material estudiado: MÉXICO. Campeche, municipio Calakmul, Reserva de la Biosfera Calakmul, camino a la zona arqueológica, 14.XI.2006, T. Raymundo y R. Valenzuela 1304 (ENCB). Jalisco, municipio La Huerta, Estación de Biología Chamela, IBUNAM, Eje Central, 28.IX.2010, T. Raymundo 3508 (ENCB); Vereda Buho, 17.IX.2011, T. Raymundo 4002 (ENCB), 4028 (ENCB), 4035 (ENCB), 4042 (ENCB); loc. cit., R. Valenzuela 14492 (ENCB), 14506 (ENCB), 14827 (ENCB). Oaxaca, distrito Juquila, municipio San Pedro Tututepec, 12.XI.2011, T. Raymundo 4144 (ENCB). Distrito Miahuatlán, municipio Pluma Hidalgo, Sierra Sur, La Finca Pacífico, 3.XI.2013, T. Raymundo 4953 (ENCB); loc. cit., 2.XI.2013, T. Raymundo 4934 (ENCB); loc. cit., R. Valenzuela 15336 (ENCB); loc. cit., 3.XI.2013, I. Ortega-López 184 (ENCB). San Luis Potosí, municipio Ciudad Valles, km 28 de la carretera Ciudad Valles - Río Verde, El Sauz, 330 m, 21°56'31"N, 99°12'01.9"O, R. Valenzuela 11139 (ENCB).
Notas taxonómicas: Cookeina tricholoma se caracteriza por presentar el himenio rugoso, los pelos se originan en el excípulo medular y esporas elipsoidales; es afín a C. sulcipes, por la presencia de pelos en todo el ascoma, pero se diferencia porque esta última presenta ascosporas más pequeñas (Ekanayaka et al., 2016).
Cookeina venezuelae (Berk. & M.A. Curtis) Le Gal, Discomyc. Madagascar (Paris): 239, 1953. Fig. 5.
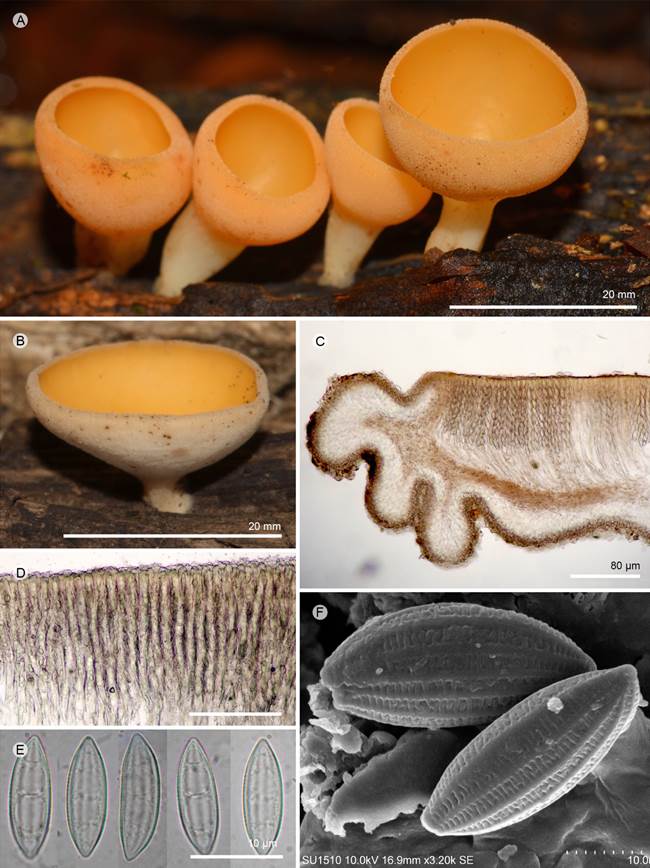
Figura 5: Cookeina venezuelae (Berk. & M.A. Curtis) Le Gal. A, B. apotecios; C. corte longitudinal del apotecio; D. ascas; E. ascosporas; F. ascosporas vista en MEB. A-E: R. Valenzuela 15732 (ENCB); F: I. Ortega-López 229 (ENCB).
Apotecios 10-25 mm de diámetro, cupuliformes, estipitados o pseudoestipitados, color rojo anaranjado (7A-B6) en fresco; estípite 10-35 × 2-4 mm, cilíndrico, central o excéntrico, venoso en la base siendo más evidente al secarse; superficie himenial lisa, color anaranjado (7A-B6), superficie exterior concolora al himenio con vellosidades apenas perceptibles a simple vista, margen entero y liso; excípulo ectal 90-180 µm de grosor, textura globular a angular, células 6-10 µm, pared 1 µm de grosor, color blanco-amarillento (3A2), presenta capa gelatinizada; excípulo medular 80-85 µm de grosor, textura porrecta, color blanco-amarillento (3A2), hifas en disposición paralela, 2-3 µm de ancho; subhimenio no es evidente; paráfisis 3-5 µm de ancho en su parte media, filiformes, septadas, ramificación simple, anastomosadas; ascas 275-350 x 10-14 µm, cilíndricas, pared 3 µm de grosor, estrechándose ligeramente hacia la base, suboperculadas, inamiloides, octospóricas; ascosporas 36-43 × 13-14 µm (x=39 × 13.5, n=30), elípticas a fusoides, color pálido-amarillentas (2A3), inamiloides, uniseriadas, pared 1 µm de grosor; en el MEB, ornamentación presenta estrías longitudinales separadas, conectadas por abundantes y finas estrías transversales.
Hábitat: lignícola, gregario, disperso, crece sobre corteza de ramas o troncos en descomposición, en bosque mesófilo de montaña.
Distribución: América Central al norte de América del Sur (Venezuela), Jamaica y Puerto Rico (Iturriaga y Pfister, 2006); en México se conoce de Hidalgo y Jalisco (Frutis y Guzmán, 1983; Herrera-Fonseca et al., 2002); se cita por primera vez para los estados de Nayarit, Oaxaca, San Luis Potosí y Tamaulipas.
Material examinado: MÉXICO. Nayarit, municipio Tepic, Reserva de la Biosfera Sierra San Juan, cerro San Juan, 2.X.2008, T. Raymundo 2480 (ENCB). Oaxaca, distrito Miahuatlán, municipio Pluma Hidalgo, Sierra Sur, La Finca Pacífico, 21.IX.2014, I. Ortega-López 229 (ENCB), 331 (ENCB), 335 (ENCB), 336 (ENCB). San Luis Potosí, municipio Tamasopo, Parque Recreativo Puente de Dios, 15.IX.2014, T. Raymundo 5331 (ENCB); loc, cit., R. Valenzuela 15720 (ENCB), 15732 (ENCB). Tamaulipas, municipio Gómez Farías, Pozitos, camino a La Perra, 10 km al norte del Rancho el Cielo, 10.VII.1987, R. Valenzuela 5823 (ENCB).
Notas taxonómicas: Cookeina venezuelae se caracteriza por apotecios lisos o con pequeñas vellosidades apenas visibles y la ornamentación de sus ascosporas; es afín a C. colensoi, por la apariencia de apotecios lisos, pero se diferencia por las ascosporas lisas.
Geodina guanacastensis Denison, Mycologia 57(4): 650. 1965. Fig. 6.
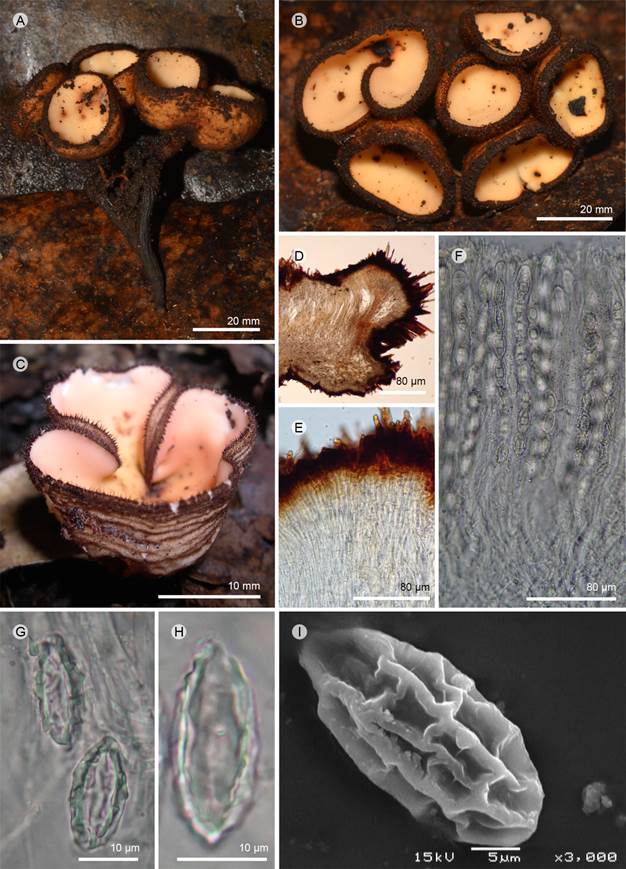
Figura 6: Geodina guanacastensis Denison. A-C. apotecios; D. corte longitudinal del apotecio; E. células del excípulo ectal; F. ascas; G, H. ascospora; I. ascospora vista en MEB. A-H: R. Valenzuela 15721 (ENCB); C, I: T. Raymundo 5330 (ENCB).
Apotecios 10-20 mm de diámetro, cupuliformes, estipitados, color naranja-grisáceos (6B5-4) en fresco; estípite 20-30 × 3-4 mm, cilíndrico, central, simple o ramificado, agrupándose 2-4 apotecios en las ramas, consistencia cartilaginosa; superficie himenial lisa, color naranja-grisáceo (6B5-4), superficie exterior color marrón oscuro (6F6-7), rugosa, con escasos pelos cortos, más abundantes y largos en el margen; pelos 200-800 × 12-20 µm, color marrón (6F6), originándose en el excípulo ectal, formados por paquetes de 4-8 hifas, marrón obscuras, paredes gruesas, 3-7 µm de diámetro; excípulo ectal 72-120 µm de grosor, textura angular a epidermoidea, células 4-16 × 3-8 µm, color naranja-marrón (6C6); excípulo medular 160-240 µm de grosor, textura intrincada, hifas de 5-7 µm de ancho, septadas, hialinas; subhimenio no es evidente; paráfisis 1-2 µm de ancho en la parte media, cilíndricas, subclavadas hacia el ápice, 3-4 µm de diámetro; ascas 350-400 × 15-18 µm, cilíndricas, pared 1-2 µm de grosor, estrechándose hacia la base, suboperculadas, octospóricas; ascosporas 24-28 (-30) × 11-14 µm (x=30 × 13 µm, n=30), considerando la ornamentación, elipsoidales, inamiloides, uniseriadas, hialinas, se observa una gútula central en el MO; en el MEB, ornamentación con crestas 2-3 µm de alto, longitudinales y transversales que se anastomosan para formar un retículo, alveolos 9-12 × 2.4-4.5 µm, irregulares en forma.
Hábitat: humícola, solitario, crece en bosques tropical caducifolio y tropical perennifolio.
Distribución: la especie se describió originalmente de Costa Rica (Denison, 1965); se registra por primera vez para México de los estados de Campeche, Jalisco y San Luis Potosí.
Material examinado: Campeche, municipio Calakmul, Reserva de la Biosfera de Calakmul, km 24 del camino a la zona arqueológica de Calakmul, El Ramonal, 17.XI.2006, T. Raymundo y R. Valenzuela 1486 (ENCB). Jalisco, municipio La Huerta, Estación de Biología Chamela, IBUNAM, Vereda Búho, 17.IX.2011, R. Valenzuela 14553 (ENCB). San Luis Potosí, municipio Tamasopo, Parque Recreativo Puente de Dios, 14.IX.2013, T. Raymundo 5330 (ENCB); loc. cit., R. Valenzuela 15721 (ENCB).
Notas taxonómicas: esta especie es la única dentro del género Geodina Denison, macroscópicamente se diferencia de otros géneros de la familia Sarcoscyphaceae, por el color marrón del ascoma, estípite ramificado, y los pelos marginales marrón oscuro, microscópicamente, las esporas reticuladas observadas en el MEB son un carácter distintivo.
Microstoma floccosum (Schwein.) Raitv, Eesti NSV Tead. Akad. Toim., Biol. ser. 14: 529. 1965. Fig. 7.
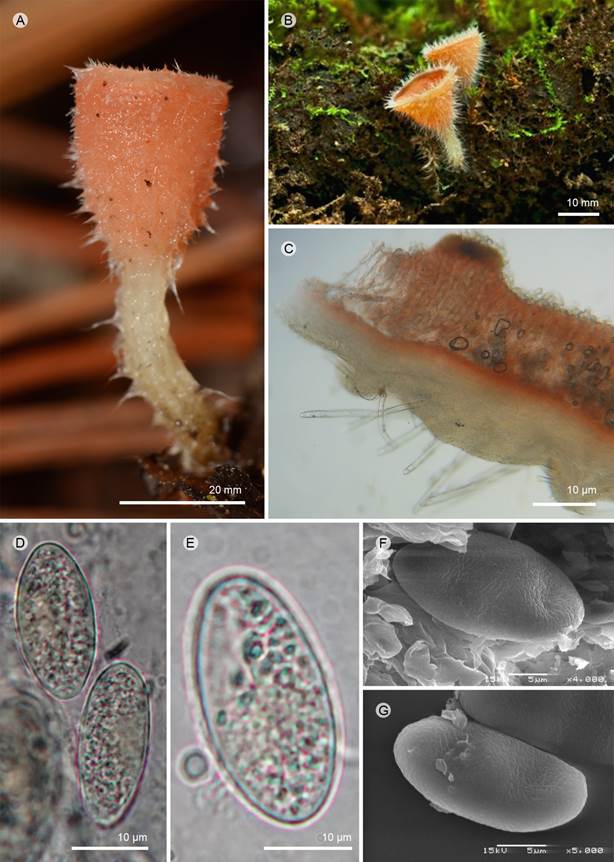
Figura 7: Microstoma floccosum (Schwein.) Raitv. A, B. apotecio; C. corte longitudinal del apotecio y pelo setoso; D, E. ascospora (100×); F, G. ascospora vista en MEB. A: A. D. Gay 184 (ENCB); B-G: I. Ortega-López 197 (ENCB).
Apotecios 5-12 mm de diámetro, cupuliformes, estípitados, color rojo-anaranjado (7A7) en fresco, consistencia corchosa a carnosa, pubescentes a floccosos; estípite de 15-22 × 5-8 mm, color anaranjado pálido (6A5-6), central, pubescente a floccoso, con pelos largos blanquecinos; superficie himenial lisa concolora al apotecio, superficie exterior color rosa a rojo pálido (7A4-5) a anaranjado pálido (6A5-6), cubierta de pelos largos blanquecinos, más evidentes en el margen; pelos 450-850 (-1200) × 17.6-19.2 μm, se originan en el excípulo ectal, hialinos septados, adelgazándose hacia el ápice; excípulo ectal 150-200 μm de grosor, textura globular, células 6.4-9.6 μm de diámetro, pared 1 µm de grosor, amarillentas (3A2-3); excípulo medular 70-95 μm de grosor, pálido amarillenta (3A2-3), textura porrecta, células 2.4 × 3.2 μm de ancho; subhimenio 19-28.5 μm de grosor, color amarillento (34A); paráfisis 210-248 × 2.4-3.2 μm, filiformes, sin septos, hialinas; ascas 246.4-302.4 × 19.2-20 μm, cilíndricas, pared 1 µm de grosor, suboperculadas, hialinas, octosporadas; ascosporas 25-30 × 13.6-15.2 μm (x=27 × 14 µm, n=30), cilíndricas, uniseriadas, lisas al MO, hialinas, presenta 2 a 5 gútulas, pared 0.8-1.6 μm de grosor; en el MEB, ornamentación finamente rugosa, formando un subreticulo muy delgado, poco profundo.
Hábitat: lignícola, gregario o solitario, crece sobre ramas caídas en bosque de coníferas, ocasiona pudrición suave en Abies hickelii Flous & Gaussen y A. religiosa (Kunth) Schltdl. & Cham.
Distribución: Estados Unidos de América (Harrington, 1998), Japón (Harada y Kudo, 2000); en México, Estado de México y Michoacán (Pompa-González y Cifuentes, 1991), Jalisco (Sánchez-Jacome y Guzmán-Dávalos, 2011), Oaxaca (Raymundo et al., 2013) y Tlaxcala (Pfister et al., 2008); se reporta por primera vez para el estado de Morelos.
Material examinado: MÉXICO. Michoacán, municipio Tingambato, carretera Uruapan - Pátzcuaro, 2 km al NE de Tingambato, Penderio, 18.VII.1980, G. Guzmán 18042 (ENCB). Morelos, municipio Huitzilac, Sierra de Tres Marías, km 55.5 de la antigua carretera México - Cuernavaca, Atlixtac, 28.VI.1970, G. Guzmán 7857 (ENCB); loc. cit. 10.VII.1982, S. Chacón 158 (ENCB); km 3 de Santa Rosa, camino Chalma a Lagunas de Zempoala, Sánchez Córdoba 399 (ENCB). Oaxaca, distrito Ixtlán, municipio Ixtlán de Juárez, Sierra Norte, Ixtepeji, 28.II.2014, I. Ortega-López 197 (ENCB). Municipio Santa Catarina Lachatao, El Pinabete, 19.VII.2013, A. D. Gay 184 (ENCB).
Notas taxónomicas: Microstoma floccosum se caracteriza por presentar apotecios pubescentes a floccosos, con vellosidades en todo el ascoma y la ornamentación en toda la ascospora; es afín a M. macrosporum (Y. Otani) Y. Harada & S. Kudo por las vellosidades en todo el ascoma, pero se diferencia en que el margen de M. macrosporun es lobulado y presenta esporas más grandes de 42-60 × 16-21 µm (Harada y Kudo, 2000).
Nanoscypha pulchra Denison, Mycologia 64(3): 617. 1972. Fig. 8.

Figura 8: Nanoscypha pulchra Denison. A, B. apotecios; C. corte longitudinal del apotecio; D. células del excípulo ectal; E. ascospora. A-E: A. Barrera 42 (ENCB).
Apotecios 10-20 mm de diámetro, discoidales a subcupuliformes, sésiles o subestipitados, color naranja-amarillento (5A3-4) en fresco; estípite 4 × 2 mm, ventricoso, color blanco-anaranjado (5A1-2), liso; superficie himenial lisa, color amarilla dorada (5A-B6), superficie exterior blanquecina, concolora al estípite, margen entero, liso; excípulo ectal 40-100 µm de grosor, de textura angularis, células 4-15 µm de diámetro, pared 1-2 µm de grosor; excípulo medular 100-250 µm, de textura intrincada, hifas 3-4 µm de diámetro, septadas; subhimenio no es evidente; paráfisis 2-3 µm de ancho en la parte media, apenas alargados hacia los ápices, cilíndricas subclavadas, septadas; ascas 200-250 × 12-13 µm, pared 1-2 µm de grosor, cilíndricas, con bases cónicas, suboperculadas, inamiloides, hialinas, con seis ascosporas, algunas ascas llegan a tener ocho ascosporas; ascosporas 17-20 × 11-12 µm (x=19 × 11 µm, n=30), de un lado desigual, elipsoidales a reniformes, uniseriadas, hialinas, lisas, presentan dos gútulas.
Hábitat: lignícola, gregario, crece en ramas y peciolos de hojas, en bosque de coníferas creciendo sobre ramas de Abies Mill.
Distribución: se ha citado de Costa Rica (Denison, 1972); se menciona por primera vez para México del Estado de México.
Material examinado: MÉXICO. Estado de México, municipio Amecameca, camino Amecameca - Tlamacas, Pasó de Cortés, 28.IX.1970, A. Barrera 42 (ENCB).
Notas taxonómicas: la característica principal para diferenciar a esta especie dentro del género es que presenta seis ascosporas dentro del asca. Algunas especies del género Phillipsia presentan esta característica en el asca, pero se diferencian por las esporas estriadas longitudinalmente y las ascosporas de N. pulchra son lisas.
Phillipsia crispata (Berk. & M.A. Curtis) Le Gal, Bull. Jard. bot. État Brux. 29: 103. 1959. Fig. 9.

Figura 9: Phillipsia crispata (Berk. & M.A. Curtis) Le Gal. A, B. apotecios; C. corte longitudinal del apotecio; E. células del excípulo ectal; F. ascas; G. ascospora; H. ascospora vista en MEB. A-B: T. Raymundo 3998 (ENCB); C-G: R. Valenzuela 18801 (ENCB); H: T. Raymundo y R. Valenzuela 1228a (ENCB).
Apotecios 20-35 mm de diámetro, cupuliformes o discoidales, sésiles o pseudoestipitados, color rubí oscuro (12F8); pseudoestípite 15-30 × 4-6 mm, cilíndrico a ventricoso, color blanquecino, liso; superficie himenial lisa, color rubí oscuro (12F8) a magenta oscuro (13F8), superficie exterior blanquecina (9A2), lisa, margen entero, glabro; excípulo ectal 40-80 µm de grosor, textura epidermoidea a prismática, células 14-16 × 8-10 µm, pared 1 µm de grosor; excípulo medular 100-200 µm de grosor, textura intrincada, hifas 1-4 µm de diámetro, septadas; subhimenio no es evidente; paráfisis 2-3 µm de diámetro, ápice 3-5 µm de diámetro, cilíndricas a subclavadas, simples, no ramificadas, septadas; ascas 360-400 × 14-18 µm, cilíndricas, estrechándose hacia la base, hialinas; ascosporas 22-30 × 12-13 µm, (x=26 × 13 µm, n=30), elipsoidales a fusoides, hialinas, inequilateras, los extremos agudos, uniseriadas, pared 2 µm de grosor; en el MEB, ornamentación presenta 12-14 estriaciones longitudinales, paralelas a lo largo de la espora.
Hábitat: lignícola, solitario a disperso, crece sobre madera en descomposición, en bosque tropical caducifolio.
Distribución: Costa Rica, Cuba y México (Denison 1969); en México se conoce de San Luis Potosí (Denison, 1969; García-Romero et al., 1970); se registra por primera vez para el estado de Jalisco.
Material examinado: MÉXICO. Jalisco, municipio La Huerta, Estación de Biología Chamela, IBUNAM, Vereda Búho, 17.IX.2011, T. Raymundo 3998 (ENCB), 4004 (ENCB), 4050 (ENCB); loc. cit., R. Valenzuela 14493 (ENCB), 14503 (ENCB). San Luis Potosí, municipio Ciudad Valles, km 28 de la carretera Ciudad Valles - Río Verde, El Sauz, 21°56'31"N, 99°12'01.9"O, 22.IX.2003, R. Valenzuela 11040 (ENCB). Municipio Rayón, 1 km antes de Potrero del Carnero, A. Arroyo y L. Cazares 18 (ENCB); km 88 autopista Ciudad Valles - Río Verde, 24.IX.2006, D. Dávila 30 (ENCB); loc. cit., T. Raymundo y R. Valenzuela 1228a (ENCB); km 15 al este de Rayón, carretera Ciudad Valles - Río Verde, 12.IX.1967, M. E. Sánchez 155b (ENCB); km 51 al este de Rayón, carretera Ciudad Valles - Río Verde, 02.X.2018, R. Valenzuela 18801 (ENCB). Municipio Tamasopo, km 64-65 carretera Ciudad Valles - Río Verde, 31.VIII.2009, D. Barrera y D. Dávila 32 (ENCB).
Notas taxonómicas: Phillipsia crispata se caracteriza por las tonalidades del himenio, rubí oscuro a magenta oscuro y por la ornamentación de las ascosporas; es afín a P. domingensis en las coloraciones rojizas del apotecio. Sin embargo, se diferencia por la ornamentación de la ascospora, la cual presenta de 5-6 surcos longitudinales (Denison, 1969).
Phillipsia domingensis Berk., J. Linn. Soc., Bot. 18: 388. 1881. Fig. 10.

Figura 10: Phillipsia domingensis Berk. A, B. apotecio; C. células del excípulo ectal; D, E. ascas; F. ascospora; G. ascospora vista en MEB. A-E: R. Valenzuela 15735; F-G: I. Ortega-López 159b (ENCB).
Apotecios 30-40 mm de diámetro, cupuliformes, sésiles o estipitados, color rojo vivido (10A8) en fresco; estípite 10-20 × 5-8 mm de diámetro, ventricoso, engrosándose hacia la parte superior, color blanquecino (9A1), marrón hacia la base (5E7), liso; superficie himenial color rojo (10A8), lisa, superficie exterior blanquecina (9A1), lisa, borde entero; excípulo ectal 80-100 µm de grosor, textura prismática, células 10-14 × 8-10 µm, pared 1 µm de grosor, color verde amarillento (30B8), en el margen hay una estructura formada por hifas perpendiculares al himenio que presenta estructuras granulares dispersas de aspecto vítreo; excípulo medular 100-120 µm de grosor, textura intrincada, hifas 3-4 µm de diámetro, septadas, color verde amarillento (30B8); subhimenio no es evidente; paráfisis 2-2.5 µm de diámetro, cilíndricas, simples o anastomosadas, septadas, pigmentadas, color rosa-rojizo (9A6); ascas 285-400 × 14-17 µm, cilíndricas, pared 2 µm de grosor, suboperculadas, hialinas, octospóricas; ascosporas 22-27 × 10-13 µm (x=24 × 11 µm, n=30), elipsoidales a fusoides, hialinas, asimétricas, uniseriadas; en el MEB, ornamentación presenta 5 o 6 surcos longitudinales en toda la espora.
Hábitat: lignícola, gregario o solitario, crece sobre madera en descomposición en bosques tropical caducifolio, tropical perennifolio y mesófilo de montaña.
Distribución: Brasil, Costa Rica, Ecuador, Estados Unidos de América, Puerto Rico, República Dominicana, Tailandia (Hansen et al., 1999); México, Caribe, Madagascar (Denison, 1969); Taiwán (Wang, 2012); Colombia por Soto-Agudelo et al. (2016); en México, Estado de México (Guzmán-Dávalos y Guzmán, 1979), Hidalgo (Raymundo et al., 2016), Jalisco (Guzmán y García-Saucedo, 1973; Guzmán-Dávalos et al., 1983), Morelos (Portugal et al.,1985), Oaxaca, región Papaloapan (Welden y Guzmán, 1978) y Costa del Pacífico (Raymundo et al., 2014), Quintana Roo (Guzmán 2003), Tamaulipas (Heredia, 1989) y Veracruz (Welden y Guzmán, 1978); se cita por primera vez para Chiapas y San Luis Potosí.
Material examinado: MÉXICO. Chiapas, municipio Ocozocoautla, Laguna Bélgica, 8.VII.2012, V. I. Álvarez 274 (ENCB), 279 (ENCB). Hidalgo, municipio Tlanchinol, 20.VIII.1988, R. Valenzuela 6706 (ENCB). Jalisco, municipio La Huerta, Estación de Biología Chamela, IBUNAM, Eje central, 18.IX.2011, M. J. Salazar 432 (ENCB); Vereda Búho, 17.IX.2011, R. Valenzuela 14493 (ENCB); loc. cit., T. Raymundo 4004 (ENCB), 4050 (ENCB), loc. cit., 23.IX.2012, T. Raymundo 4447 (ENCB). Oaxaca, distrito Tuxtepec, municipio Jacatepec, región Papaloapan, Vega de Sol, 25.X.2013, I. Ortega-López 159b (ENCB). San Luis Potosí, municipio Ciudad Valles, km 28 de la carretera Ciudad Valles - Río Verde, El Sauz, 21°56'31"N, 99°12'01.9"O, 23.X.2005, T. Raymundo y R. Valenzuela 811 (ENCB). Municipio Rayón, Las Guapas, 9.IX.2015, R. Valenzuela 16231 (ENCB). Municipio Tamasopo, Parque Recreativo Puente de Dios, 14.IX.2014, R. Valenzuela 15735 (ENCB); km 51 de carretera Ciudad Valles - Río Verde, 580 m, 21°54'24"N, 99°21'04"O, 2.XI.2018, T. Raymundo 8104 (ENCB); km 70 de la carretera Ciudad Valles - Río Verde, 9.IX.2015, R. Valenzuela 16246 (ENCB).
Notas taxonómicas: Phillipsia domingensis se caracteriza por presentar himenio liso de color rojo vivido, ascosporas fusoides y ornamentación surcada; es afín a P. crispata, en la coloración del apotecio y esporas fusoides, pero se diferencian en la ornamentación de las ascosporas, ya que P. crispata presenta 12-14 estrías longitudinales muy finas.
Phillipsia hartmannii (W. Phillips) Rifai, Verh. K. Ned. Akad. Wet., tweede sect. 57(3): 50. 1968. Fig. 11.
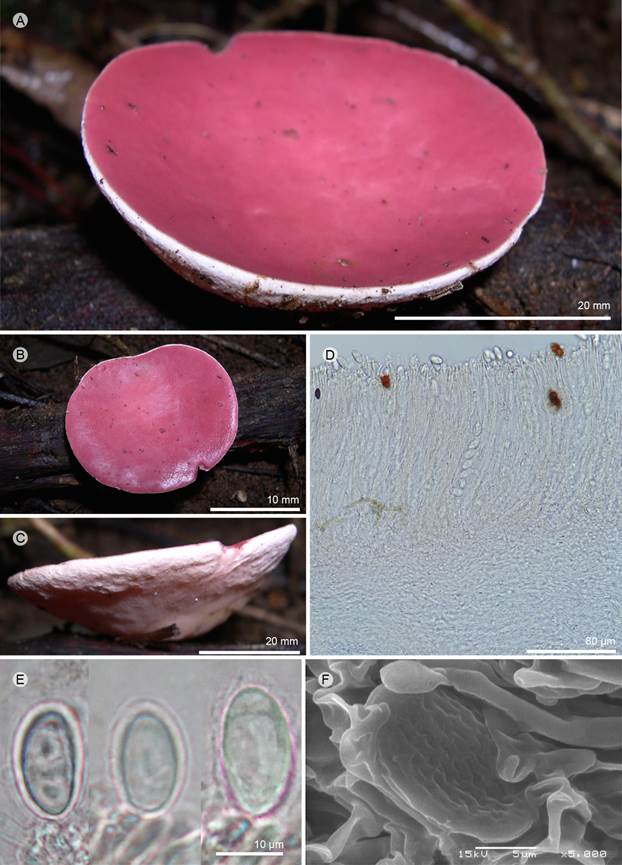
Figura 11: Phillipsia hartmannii (W. Phillips) Rifai. A-C. apotecios; D. corte longitudinal del apotecio; E. ascas; F. ascospora vista en MEB. A-F: T. Raymundo 3761 (ENCB).
Apotecios 20-35 mm de diámetro, cupuliformes, sésiles o subestipitados, color rosa (11D7, 11E7) en fresco; subestípite 10-20 × 3-5 mm, central o ligeramente excéntrico, ventricoso, se engrosa hacia la parte superior, color blanquecino, liso, cartilaginoso, margen entero; superficie himenial lisa, color rosa (11D-E7), superficie exterior blanquecina (9A1), de aspecto arrugado en seco, glabro o con pequeñas pústulas; excípulo ectal 60-200 µm de grosor, textura prismática a epidermoidea, células 6-12 µm de diámetro, presenta una capa de células paralelas; excípulo medular 150-300 µm de grosor, textura intrincada, hifas 2-4 µm de diámetro, septadas, hialinas; subhimenio no es evidente; paráfisis 1.5-2.5 µm, cilíndricas, septadas, ápices 2-3 µm de ancho; ascas 180-210 × 12-15 µm, cilíndricas, pared 2 µm de grosor, adelgazándose hacia la base, suboperculadas, hialinas, octospóricas; ascosporas 15-19 × 8-11 (x= 17 × 10 µm, n=30), elipsoidales, hialinas, asimétricas, con una o dos gotas lipídicas, uniseriadas; en el MEB, ornamentación presenta 5-9 estriaciones longitudinales, pero solo en un lado de la ascospora, el otro es liso.
Hábitat: lignícola, solitario a gregario, crece sobre madera en descomposición, en bosque tropical caducifolio.
Distribución: Australia, Congo (Denison, 1969); China (Wen-Ying, 2003a, b); Costa Rica (Denison, 1969; Calonge et al., 2003, 2006); en México se conoce de Oaxaca por Welden y Guzmán (1978); se cita por primera vez para los estados de Guerrero y San Luis Potosí.
Material examinado: MEXICO. Guerrero, municipio Cocula, Machito de las Flores, 11.III.2011, T. Raymundo 3761 (ENCB); loc. cit., R. Valenzuela 14356 (ENCB). San Luis Potosí, municipio Ciudad Valles, km 28 de la carretera Ciudad Valles - Río Verde, El Sauz, 21°56'31"N, 99°12'01.9"O, 25.IX. 2006, Negrete-Ramírez 13 (ENCB).
Notas taxonómicas: Phillipsia hartmannii se caracteriza por el color rosado en fresco del del apotecio. Además, presenta la ornamentación de las ascosporas solo de un lado y el otro liso; es afín a P. domingensis y P. crispata, por la coloración de los apotecios, pero, se diferencia porque estas últimas dos especies presentan ornamentación en toda la espora. Rifai (1968) y Denison (1969) consideraron a P. hartmannii y P. carnicolor sinónimas. Posteriormente, Calonge et al. (2006) apoyaron esta propuesta, y en este estudio concordamos con la propuesta de estos autores.
Phillipsia olivacea Rick, Brotéria, sér. bot. 25(2-3): 86. 1931. Fig. 12.
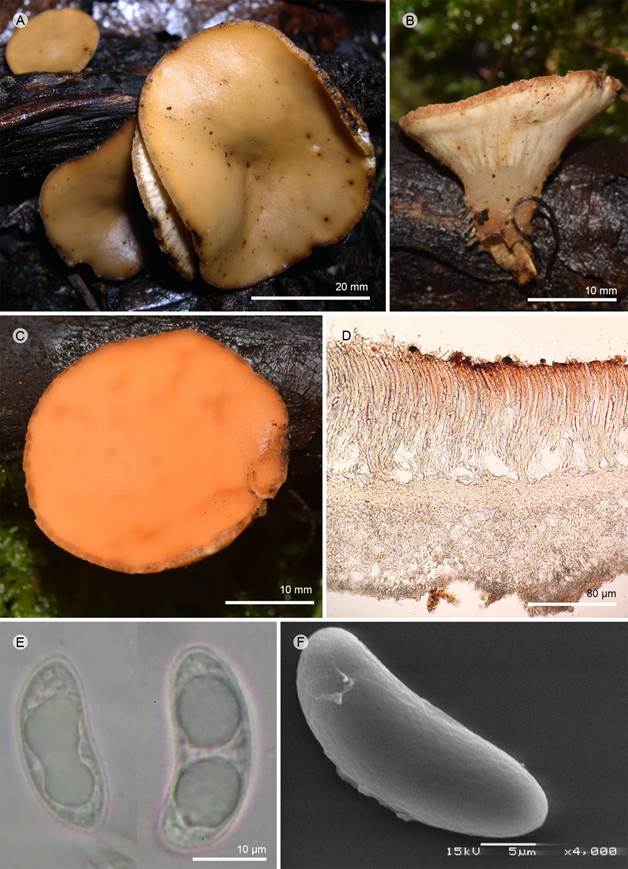
Figura 12: Phillipsia olivacea Rick. A-C. apotecios; D. corte longitudinal del apotecio; E. ascosporas; F. ascospora vista en MEB. A-F: T. Raymundo y R. Valenzuela 1228 (ENCB).
Apotecios 20-35 mm de diámetro, cupuliformes o discoidales, sésiles o subestipitados, color blanquecino anaranjado (5A3) a verde-grisáceo (30E-F7) en fresco; estípite 5-15 × 3-6 mm, cilíndrico, ventricoso, textura carnosa en fresco a corchosa-quebradiza en seco; superficie himenial lisa, color verde-grisáceo (30E-F7), superficie exterior lisa, color blanquecino anaranjado (5A3), margen entero; excípulo ectal 80-120 µm de grosor, textura prismática, células 6-8 × 10-14 µm de diámetro, hialino; excípulo medular, 600-1000 µm de grosor, textura intrincada, hifas 4-7 µm de diámetro, septadas, hialinas; subhimenio no es evidente; paráfisis 2-3 µm de ancho en la parte media, no exceden el tamaño de las ascas, cilíndricas, filiformes, anastomosadas en el ápice; ascas 400-450 × 14-16 µm, cilíndricas, pared 1-2 µm de grosor, adelgazándose hacia la base, hialinas; ascosporas 27-30 × 11-12 µm (x=29 × 12 µm, n=30), elipsoidales a reniformes, con los extremos redondeados, hialinas, con dos gútulas hacia los extremos, uniseriadas; en el MEB, ornamentación finamente rugosa en toda la espora.
Hábitat: lignícola, gregario, crece sobre madera en descomposición, gregarios en bosque tropical caducifolio.
Distribución: Argentina, Brasil, Ecuador y Venezuela (Hansen et al., 1999); Costa Rica (Hansen et al., 1999; Calonge et al., 2006); se cita por primera vez para México del estado de San Luis Potosí.
Material examinado: MÉXICO. San Luis Potosí, municipio Ciudad Valles, km 28 carretera Ciudad Valles - Río Verde, El Sauz, 21°56'31"N, 99°12'01.9"O, 25.IX.2006, K. Ramírez y A. Guzmán 8 (ENCB); loc. cit., M. Ramírez y E. Olvera 1 (ENCB). Municipio Rayón, km 88 autopista San Luis Potosí - Río Verde, 24.IX.2006, T. Raymundo y R. Valenzuela 1228 (ENCB). Municipio Tamasopo, km 51 de carretera Ciudad Valles - Río Verde, 580 m, 21°54'24"N, 99°21'04"O, 2.XI.2018, R. Valenzuela 18802 (ENCB).
Notas taxonómicas: Phillipsia olivacea se caracteriza por sus colores blanquecinos anaranjados a amarillentos verdes grisáceos, microscópicamente las esporas se observan lisas en el MO y finamente rugosas en el MEB; es afín a P. lutea Denison, por la coloración de sus apotecios, pero se diferencia en la ornamentación de las ascosporas que presenta 4-5 estrías longitudinales muy marcadas.
Pithya cupressina (Batsch) Fuckel, Jb. nassau. Ver. Naturk. 23-24: 317. 1870. Fig. 13.
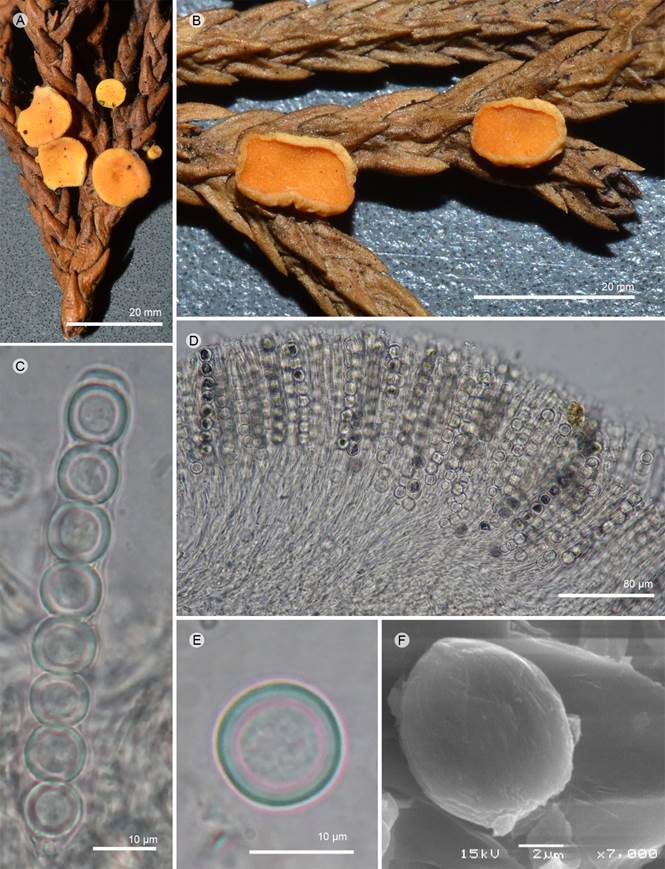
Figura 13: Pithya cupressina (Batsch) Fuckel. A, B. apotecios; C, D. ascas; E. ascospora; F. ascospora vista al MEB. A-F: M. Sánchez 749 (ENCB).
Apotecios 1-5 mm de diámetro, discoidales, sésiles, convexos o turbinados, pocas veces cupuliformes, color anaranjado (5A7) en fresco, textura carnosa cuando frescos a corchosa-cerosa cuando secos; superficie himenial color anaranjado (5A7), lisa, superficie externa concolora con el himenio, lisa; excípulo ectal 38-114 µm de grosor, textura angular o textura porrecta, células 12-22 × 8.8-14.4 µm, hialino; excípulo medular 152-515.9 µm de grosor, textura intrincada, hifas 2.4-4.8 µm de diámetro, septadas; subhimenio no es evidente; paráfisis 3-4 µm de diámetro en su parte media, ligeramente redondeadas en el ápice, septadas; ascas 200-264 × 11-13 µm, cilíndricas a clavadas, pared 1 µm de grosor, base cónica, suboperculadas, hialinas, octospóricas; ascosporas 10-12 µm de diámetro, esféricas, lisas, hialinas, uniseriadas, pared 1 µm de grosor, con una o varias gútulas.
Hábitat: gregario o solitario, foliícola, crece en bosque de coníferas sobre hojas de Cupressus L.
Distribución: en México se ha citado de Ciudad de México (Chacón y Guzmán, 1983; Valenzuela et al., 2004), Colima, Querétaro (GBIF, 2015), Estado de México, Hidalgo, Morelos (Valenzuela et al., 2004) y Veracruz (López y García, 2001); se cita por primera vez para Puebla.
Material examinado: MÉXICO. Estado de México, municipio Amecameca, entre Tlalmanalco y Amecameca, 2.XI.1969, J. Uribe 66 (ENCB). Morelos, municipio Huitzilac, Autopista México - Cuernavaca, Tres Marías, al pie de la carretera, 7.VIII.1968, G. Guzmán 6899 (ENCB). Puebla, municipio Honey, cascadas Arcoíris, 17.XI.2016, M. Sánchez 749 (ENCB). Veracruz, municipio Perote, Parque Nacional Cofre de Perote, faldas del Cofre de Perote, 30.X.1983, L. Guzmán-Dávalos 722 (ENCB).
Notas taxonómicas: esta especie ha sido mencionada como sinónimo de P. vulgaris Fuckel por Eckblad (1968); sin embargo, Denison (1972) mencionó que son especies distintas por la especificidad de los hospederos. Pithya vulgaris crece sobre ramas delgadas de Abies, Picea Link. y Pinus L. (Denison, 1972; Breitenbach y Kränzlin, 1984), mientras que P. cupressina crece sobre hojas de Cupressus y otras especies de la familia Cupressaceae. Además, señala que las esporas son más pequeñas en P. cupressina (10-12 µm) que en P. vulgaris (11-14 µm), aunado a que los apotecios son mas grandes en P. vulgaris.
Pithya vulgaris Fuckel, Jb. Nassau Ver. Naturk. 23-24: 317. 1870. Fig. 14.

Figura 14: Pithya vulgaris Fuckel. A. apotecios; B. corte longitudinal del apotecio; C. himenio y excípulo; D, E. ascas; F. ascospora vista al MEB. A-F: V. Valenzuela-Raymundo 84 (ENCB).
Apotecios 5-15 mm de diámetro, discoidales, sesilés o subestipitados, convexos o turbinados pocas veces cupuliformes, color amarillo intenso (4A6) a naranja intenso (5A6) en fresco, de textura carnosa cuando frescos a corchosa-quebradiza cuando secos; subestípite 4-6 × 1-2 mm, cónico, color blanquecino hacia la base; superficie himenial lisa, color amarillo intenso (4A6) a naranja intenso (5A6), superficie exterior lisa, concolora al himenio, margen entero a ligeramente peltado; excípulo ectal 60-100 µm de grosor, textura angular, células 8-12 µm de ancho, hialino; excípulo medular 100-300 µm de grosor, textura intrincada, hifas 4-6 µm de diámetro, septadas; subhimenio no es evidente; paráfisis 2-3 µm en su parte media, ligeramente cónica hacia el ápice, 3 µm de ancho, septadas; ascas 200-250 × 10-12 µm, cilíndricas a clavadas, pared 1 µm de grosor, base cónica, suboperculadas, hialinas, octospóricas; ascosporas 11-14 µm de diámetro, esféricas, lisas, hialinas, uniseriadas, pared 1 µm de grosor, con una gútula central.
Hábitat: lignícola, gregario o solitario, crece sobre ramas caídas en bosque de coníferas, ocasiona pudrición suave en Abies hickelii y A. religiosa.
Distribución: Costa Rica (Denison, 1972; Calonge et al., 2003); México, Europa por Denison (1972); en México se ha citado de Oaxaca en la Sierra Norte (Raymundo et al., 2013); se cita por primera vez para Coahuila, Hidalgo y Michoacán.
Material examinado: MÉXICO. Coahuila, municipio Arteaga, Sierra La Marta, cabañas El Renacer de la Sierra, 17.III.2018, T. Raymundo 7413 (ENCB); loc. cit., R. Valenzuela 18103 (ENCB). Hidalgo, municipio Mineral El Chico, La Estanzuela, 22.VII.1975, M. Medina e I. García s.n. (ENCB). Michoacán, municipio Ciudad Hidalgo, Parque Nacional Los Azufres, alrededores de Laguna Larga, 24.VII.2018. V. Valenzuela-Raymundo 84 (ENCB). Oaxaca, distrito Ixtlán, municipio Lachatao, Santa Martha Latuvi, El Pinabete, 3.IX.2011, T. Raymundo 3855 (ENCB), 3856 (ENCB), 3866 (ENCB); loc. cit., R. Valenzuela 14395 (ENCB).
Notas taxonómicas: esta especie es muy similar a P. cupressina como ya se mencionó previamente.
Sarcoscypha austriaca (O. Beck ex Sacc.) Boud., Hist. Class. Discom. Eur. (Paris): 55. 1907. Fig. 15.
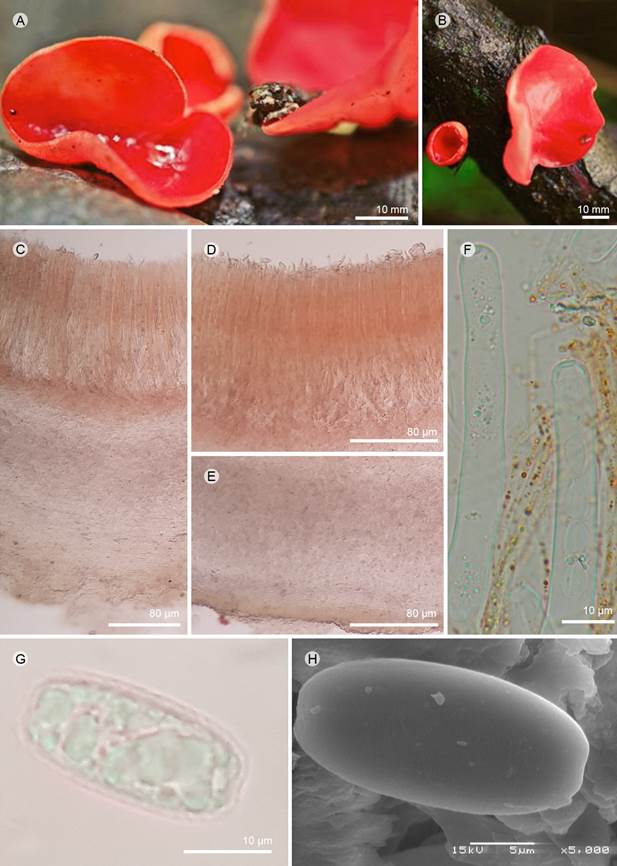
Figura 15: Sarcoscypha austriaca (O. Beck ex Sacc.) Boud. A, B. apotecios; C. corte longitudinal del apotecio; D. himenio; E. excípulo ectal y medular; F. ascas; G. ascospora; H. ascospora vista en MEB. A-H: I. Ortega-López 173 (ENCB).
Apotecios 20-30 mm de diámetro, cupuliformes, subestipitado, color rojo intenso (8A8) con línea color amarillo (3A8) en el borde del margen; subestípite 15-20 × 4-5 mm, cilíndrico, ensanchado ligeramente en la base, color blanquecino (9A1), liso, al secarse tiende a arrugarse a manera de estrías; superficie himenial color rojo intenso (8A8), lisa, superficie exterior concolora al himenio, lisa, margen entero; pelos proyectados al exterior, fuertemente curvados a rizados y entrelazados, 3-4 µm de ancho; excípulo ectal 270-280 µm espesor, textura porrecta, paralela al himenio, hifas 3-4 µm de ancho; excípulo medular 750-800 µm de espesor, textura intrincada, hifas 3-4 µm de ancho, septadas, color rojo-intenso (8A8); subhimenio no es evidente; paráfisis 2-2.5 µm de diámetro, bifurcadas, septadas, con pigmentos carotenoides, color rojo pastel (8A6); ascas 280-300 × 10-12 µm, cilíndricas, ventricosas hacia la base, hialinas, pared 1 µm de grosor, suboperculadas; ascosporas 22-28 × 9-12 µm (x=25 × 10.5 µm, n=30), elipsoidales, hialinas, lisas, truncadas, uniseriadas, capa gelatinosa que las envuelve, y queda en los extremos o desaparece al ser expulsadas.
Hábitat: lignícola, gregario o solitario, crece en bosque de encinos sobre madera enterrada en descomposición, haciendo parecer que los apotecios son humícolas.
Distribución: Canadá, Estados Unidos de América y Europa (Harrington, 1990; Beug et al., 2014); Estonia y Tanzania (Öpik et al., 2000); Gran Bretaña (Spooner, 2002; Tibuhwa, 2011); se cita por primera vez para México para el estado de Oaxaca.
Material examinado: MÉXICO. Oaxaca, distrito Ixtlán, municipio Santa María Ixtepejí, región Sierra Norte, La Cumbre, 26.X.2013, I. Ortega-López 173a (ENCB).
Notas taxonómicas: Sarcoscypha austriaca se caracteriza por presentar una línea de color amarillo en el margen y las ascosporas son truncadas en los extremos y el excípulo ectal tiene pelos fuertemente curvados o rizados y entrelazados. Es afín a S. coccinea (Gray) Boud. y S. dudleyi (Peck) Baral por el color rojo escarlata, los apotecios sésiles o subestípitados y la capa gelatinosa que envuelve las ascosporas, pero la primera se diferencia por tener las ascosporas más grandes y oblongo-elipsoidales, no truncadas y los pelos del exipulo ectal son rectos o ligeramente flexuosos y paralelos, mientras que la segunda no tiene la línea amarilla en el margen del apotecio, las ascosporas no truncadas y pelos del excípulo ectal ligeramente curvados (Harrington, 1990).
Sarcoscypha coccinea (Gray) Boud., Bull. Soc. mycol. Fr. 1: 103. 1885. Fig. 16.
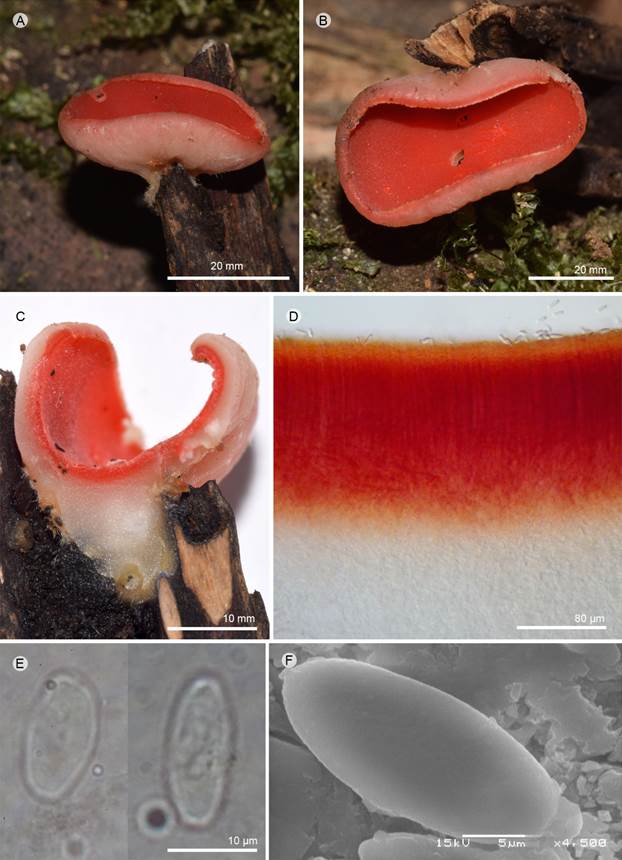
Figura 16: Sarcoscypha coccinea (Gray) Boud. A-C. apotecios; D. corte longitudinal del apotecio; E. ascosporas; F. ascospora vista en MEB. A-D: R. Valenzuela 16204 (ENCB). E-F: I. Ortega-López 100a (ENCB).
Apotecios 10-40 × 10-20 mm, cupuliformes a discoides, sésiles a subestipitados, color rojo intenso (10A8) a rojo pastel (9A4) en fresco; subestípite 20-40 × 10-15 mm, blanquecino, liso a ligeramente tomentoso, adelgazando hacia la base; superficie himenial lisa, rojo escarlata (9A8) a rojo (9A6), decolorando a rojo anaranjado (7A7), lisa, borde crenulado, superficie exterior blanquecina, lisa a tomentosa; pelos proyectados al exterior, rectos y paralelos o ligeramente flexuosos, 4-5 µm de ancho; excípulo ectal 20-40 µm de grosor, textura porrecta, células 3-4 × 2-3 µm de ancho; excípulo medular 150-280 µm de espesor, textura intrincada, hifas 2-3 µm de diámetro, septadas, contenido granular de color rojo rosado (9A6); subhimenio no es evidente; paráfisis 2-3.5 µm de diámetro, cilíndricas ligeramente ensanchadas hacia la base, de la misma longitud de las ascas sin sobresalir de ellas, con pigmentos carotenoides rojizos (8A6); ascas 240-300 × 13-16 µm, cilíndricas, estrechas hacia la base, hialinas, suboperculadas; ascosporas 24-34 × 11-14 µm (x=28 × 12 µm, n=30), cilíndricas-elipsoidales, no truncadas, hialinas, lisas, con dos gútulas en los extremos, capa gelatinosa que las envuelve, uniseriadas.
Hábitat: lignícola, solitaria a gregaria, crece en bosques de encinos y pino-encino sobre madera en descomposición.
Distribución: Canadá, Estados Unidos de América y Europa (Harrington, 1990); Estonia y Tanzania (Öpik et al., 2000); Gran Bretaña (Spooner, 2002); Norte América (Denison, 1972; Beug et al., 2014); en México se cita de Guerrero (Pompa-González y Cifuentes, 1991), Jalisco (Herrera-Fonseca et al., 2002) y Oaxaca para la región de Sierra Norte (Raymundo et al., 2013); se cita por primera vez para el estado de Querétaro.
Material examinado: MÉXICO. Oaxaca, distrito Mixe, municipio Tamazulápam del Espíritu Santo, Sierra Norte, Mixes, I. Ortega-López 133 (ENCB), 134 (ENCB). Querétaro, municipio San Joaquín, camino a La Pirámide, San Joaquín, 5.XI.1983, R. Valenzuela 2811 (ENCB); Parque San Joaquín, 29.IX.1984, R. Valenzuela 4210 (ENCB).
Notas taxonómicas: la especie se caracteriza por sus apotecios sésiles a subestipitados, las ascosporas grandes y el excípulo ectal presenta pelos proyectándose rectos a flexuosuos dispuestos paralelamente. Es afín a Sarcoscypha occidentalis (Schwein.) Sacc. por los colores del apotecio, pero se separa por sus apotecios estipitados, esporas más pequeñas (17-22 × 8-14 µm) y el excípulo ectal no tiene pelos proyectados (Harrington, 1990).
Sarcoscypha occidentalis (Schwein.) Sacc., Syll. fung. (Abellini) 8: 154, 1889. Fig. 17.
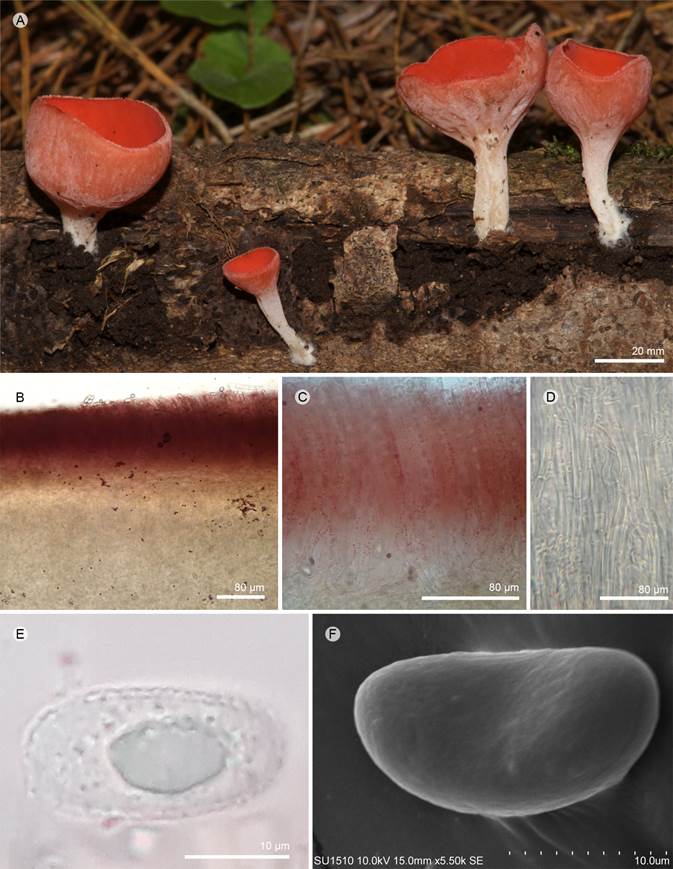
Figura 17: Sarcoscypha occidentalis (Schwein.) Sacc. A. apotecios; B. corte longitudinal del apotecio; C. himenio; D. excípulo medular; E. ascospora; F. ascospora vista en MEB. A-D: R. Valenzuela 16204 (ENCB); F: De la Huerta s.n. (ENCB).
Apotecios 10-20 mm de diámetro, cupuliformes, estipitados, color rojo (9A8) en fresco; estípite 15-40 × 2-5 mm, cilíndrico, central o excéntrico, blanquecino, ligeramente aterciopelado a glabro, glabrescente, pierde el tercipelo al madurar, adelgazándose hacia la base; superficie himenial lisa, color rojo (9A8), superficie exterior blanquecina, glabra, margen entero; excípulo ectal 100-200 µm de grosor, textura porrecta, células 4-6 × 2-3 µm, sin pelos proyectados al exterior; excípulo medular 300-600 µm de grosor, textura intrincada, hifas 3-4 µm de diámetro; subhimenio no es evidente; paráfisis 2-3 µm en su parte media, cilíndricas, ligeramente ensanchada hacia el ápice 3-4 µm de diámetro, anastomosadas, presenta pigmentos carotenoides; ascas 240-280 × 12-15 µm, cilíndricas, pared 2 µm de grosor, se estrechan ligeramente hacia la base, suboperculadas, hialinas, octospóricas; ascosporas 17-22 × 8-14 µm (x= 20 × 12, n=30), elipsoidales a subcilíndricas, hialinas, lisas, uniseriadas, con dos grandes gútulas y extremos romos a ligeramente truncados, capa gelatinosa delgada y desaparece con KOH.
Hábitat: lignícola, gregario o cespitoso, crece sobre madera en descomposición, en bosques tropical caducifolio y mesófilo de montaña.
Distribución: Estonia y Tanzania (Öpik et al., 2000); Gran Bretaña (Spooner, 2002); en México se conoce de Hidalgo y Morelos (Bautista et al., 1986; Chacón y Bautista, 1988); se cita por primera vez para Querétaro y San Luis Potosí.
Material examinado: MÉXICO. Hidalgo, municipio Acaxochitlán, Tzacuala, 16.VII.2015, R. Valenzuela 16181 (ENCB). Querétaro, municipio Jalpan, km 185 carretera Jalpán - Xilitla, Julilo, 01.X.1992, De la Huerta s.n. (ENCB). San Luis Potosí, municipio Ciudad Valles, km 28 carretera Ciudad Valles - Río Verde, cerca del Sauz, 25.IX.2006, R. Rivero 9 (ENCB).
Notas taxonómicas: Sarcoscypha occidentalis se caracteriza por tener apotecios estipitados, carecer de pelos en el excípulo ectal y su tamaño de esporas. Es afín a S. austriaca y S. coccinea por el color rojo de los apotecios y la capa gelatinosa que rodea la espora, pero ambas tienen ascosporas más grandes y pelos del excípulo ectal proyectados en la primera son risados y entrelazados y en la segunda rectos o ligeramente flexuosos (Harrington, 1990).
Wynnea americana Thaxt., Bot. Gaz. 39: 241. 1905. Fig. 18.
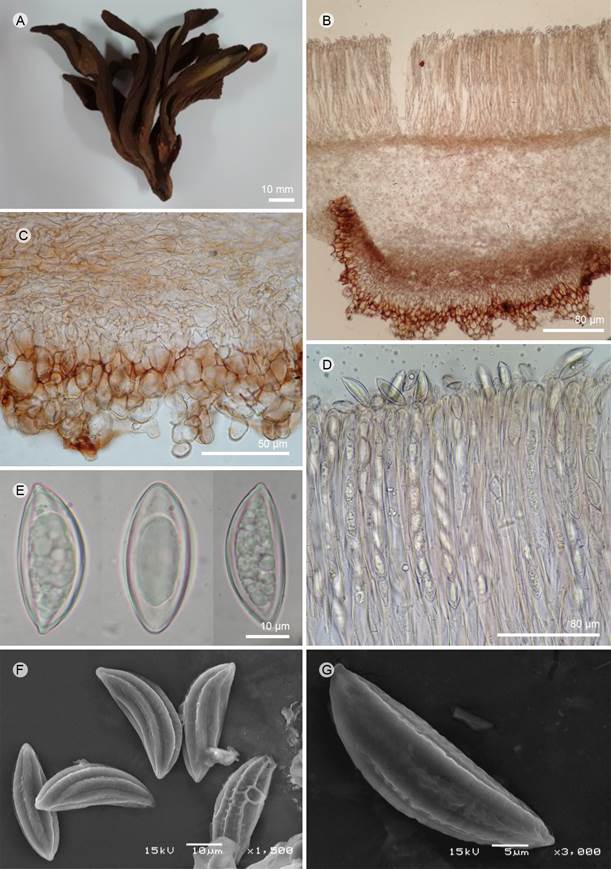
Figura 18: Wynnea americana Thaxt. A. apotecios; B. corte transversal de apotecio; C. células del excípulo ectal y medular; D. ascas; E. ascosporas; F, G. ascosporas vistas al MEB. A-E: B. N. Lara-Chávez y R. Alvarez-Oceguera 2 (ENCB); F-G: J. Pérez-Ortiz 1074 (ENCB).
Apotecios 20-100 mm de alto, se originan de un esclerocio, ramificados desde la base, en forma cóncava, otidioide; esclerocio basal, 30-50 × 20-30 mm, enterrado en el sustrato, grueso, firme, coriáceo cuando seco, probablemente carnoso cuando fresco, color marrón oscuro (8F6); superficie externa color marrón claro (8D5) a color marrón oscuro (8F6), la cual se torna de color ámbar oscuro en KOH, rugosa, furfurácea a finamente verrugosa, debido a proyecciones celulares que en el margen llegan a ser parecidas a pelos; superficie himenial lisa, rojo púrpura oscuro (13B8) a color marrón oscuro (8F6), reacciona con KOH, obscureciendo todas las partes, márgenes ligeramente incurvados cuando secos; excípulo ectal 250-300 µm de grosor, células 10-16 µm de diámetro, textura globular a angular, color rubí grisáceo (12D-E3); excípulo medular 200 µm de grosor, textura intrincada, células 8-15 µm de diámetro, color naranja pálido (5A3); subhimenio no es evidente; paráfisis simples o ramificadas, septadas, 4-7 µm de ancho, color marrón pálido en KOH, circinadas y rectas en el ápice; ascas 430-560 × 18-24 µm, elongadas a cilíndricas, pared 1.5-3 µm de grosor, estípite muy delgado y sinuoso, entrelazándose con los de las otras ascas, hialinas, suboperculadas, hialinas, octospóricas; ascosporas 30-40.5 × 12-15 µm, subcimbiformes (forma de canoa), con los extremos apiculados, pared 1-1.5 µm de grosor, hialinas, uniseriadas, en el MEB, ornamentación con estrías longitudinales a lo largo de la espora y con estrías transversales entre los surcos.
Hábitat: humícola, cespitoso a subcespitoso, creciendo en bosque de Pinus-Quercus.
Distribución: Costa Rica (Pfister, 1979; Calonge et al., 2003); Estados Unidos de América (Thaxter, 1905; Pfister, 1979); Japón (Pfister, 1979); en México se conoce del Estado de México (Valenzuela et al., 1981; Medel et al., 1995), Morelos (Chacón y Bautista, 1988) y Michoacán (Pompa-González y Cifuentes, 1991).
Material examinado: MÉXICO. Estado de México, municipio Amecameca, 1 km al noroeste de San Antonio, J. Pérez-Ortiz 1074 (ENCB). Michoacán, municipio Los Reyes, 5 km al norte de Pamatácuaro, 17.VII.2017, B. N. Lara-Chávez y R. Alvarez-Oceguera 2 (ENCB).
Notas taxonómicas: esta especie se caracteriza por formar apotecios otidioides originados de una base común, y por el tamaño de sus ascosporas; es similar a W. gigantea Berk. & M. A. Curtis y a W. macrotis (Berk.) Berk. La primera se separa por las esporas más pequeñas (24-30 × 10-13.5 µm), con los extremos romos redondeados y con las gotas de aceite grandes y pequeñas que raramente rellenan la cavidad de la espora. De la segunda se diferencia por las esporas más pequeñas también (28-31 × 12-13 µm) y ornamentación mas fina, menos profunda, el excípulo ectal presenta pelos hifoides curvados a espiralados. Wynnea gigantea y W. macrotis han sido citadas para México por Berkeley (1867) y Medel et al. (1995), para una descripción de las especies, ver ambos trabajos, dado que no tuvimos acceso a los especímenes.
Discusion
De los 13 géneros y 102 especies que presenta la familia Sarcoscyphaceae se determinaron 8 géneros y 18 especies para México, lo que equivale a 61% y 16.6 % respectivamente. Las 18 especies corresponden a 122 especímenes de los cuales Cookeina tricholoma, Phillipsia domingensis y C. sulcipes son las especies más frecuentes con 17, 14 y 13 ejemplares que corresponden a 14.7, 12.1 y 11.3%, respectivamente. No obstante, Phillipsia domingensis es la especie con mejor distribución al presentarse en 10 de los 20 estados representados, siguiéndole Pithya cupressina en ocho estados, C. sulcipes y C. tricholoma en seis. Por otro lado, Oaxaca y San Luis Potosí fueron los estados con mayor número de especies (11 cada uno), Jalisco (7), Estado de México, Hidalgo y Morelos (5), Tamaulipas y Veracruz (4), Campeche, Chiapas, Michoacán y Querétaro (3), mientras que Guerrero, Nayarit y Quintana Roo con dos especies, Ciudad de México, Coahuila, Colima, Puebla y Tlaxcala tienen uno.
Con respecto a los tipos de vegetación donde se desarrollan las especies estudiadas, tenemos que Cookeina speciosa, C. sulcipes, C. tricholoma, Geodina guanacastensis, Phillipsia crispata, P. dominguensis, P. hartmannii, P. olivacea y Sarcoscypha occidentalis son de afinidad tropical y las primeras cuatro incluyendo P. dominguensis fueron encontradas tanto en bosque tropical caducifolio como en bosque tropical perennifolio. Phillipsia crispata, P. hartmannii y P. olivacea se recolectaron exclusivamente en bosque tropical caducifolio; además, P. dominguensis y S. occidentalis se localizaron también en bosque mesófilo de montaña. Por otro lado, las especies que tuvieron distribución templada fueron Microstoma floccosum, Nanoscypha pulchra, Pithya cupressina, P. vulgaris, Sarcoscypha austriaca, S. coccinea y Wynnea americana, siendo las primeras cuatro de bosque de coníferas y las otras tres de bosque de encinos o de pino-encino. Por último, tenemos a Cookeina colensoi y C. venezuelae de influencia subtropical al crecer solamente en bosque mesófilo de montaña.
Las especies que tuvieron especificidad por el hospedero son Microstoma floccosum, Nanoscpha pulchra y Pithya vulgaris que en México se encontraron sobre ramas de Abies hickelii y A. religiosa, aunque Denison (1972) registra esta última especie creciendo sobre Picea en Estados Unidos de América, mientras que Breitenbach y Kränzlin (1984) la mencionan sobre Abies alba Mill., Picea abies (L.) H. Karst. y Pinus sylvestris L. en Europa. Asimismo, Pithya cupressina se recolectó en México sobre hojas de Cupressus spp.
Geodina guanacastensis, Nanoscypha pulchra, Phillipsia olivacea y Sarcoscypha austriaca se describen por primera vez para el país. La primera se encontró en bosque tropical caducifolio en Jalisco y San Luis Potosí; además, se localizó en bosque tropical perennifolio en la Reserva de la Biósfera Calakmul, Campeche. Nanoscypha pulchra se registra sobre Abies religiosa del Paso de Córtes en Amecameca, Estado de México; Phillipsia olivacea se describe de la Huasteca Potosina en San Luis Potosí, mientras que Sarcoscypha austriaca se ubicó en bosque de encino en la Sierra Norte de Oaxaca.
Conclusiones
La familia Sarcoscyphaceae se encuentra bien representada en México con 20 especies, incluidas Wynnea gigantea y W. macrotis, especies que han sido registradas como ya se mencionó anteriormente, lo que la hace una de las mejor estudiadas del Orden Pezizales en el Phylum Ascomycota. Todas las especies se pudieron diferenciar fácilmente a partir de las características macro y microscópicas, y con ayuda del MEB para observar la ornamentación de la esporas, aunque hubo pocas diferencias entre Cookeina tricholoma y C. sulcipes, las cuales fueron difícil de separar con estos caracteres y que podrían considerarse especies crípticas. Por lo tanto, este estudio da las bases para realizar el estudio filogenético de esta familia en México. La familia presenta una distribución destacadamente tropical con el 61.2% de las especies localizadas en bosques tropicales caducifolios, perennifolios y subtropicales, en comparación con el 38.8% de las especies templadas. Las especies de Sarcoscyphaceae con distribución restringida en regiones templadas presentan una mayor especificidad por el hospedero que en todos los casos se trata de coníferas.
Los hongos de este taxa se encuentran bien representados en la región neotropical de México, al ubicarse en 20 estados de los cuales Oaxaca y San Luis Potosí fueron los mejor estudiados.











 text new page (beta)
text new page (beta)



