Introducción
Las plantas melíferas son aquellas que, principalmente, producen néctar y polen, aunque también se consideran en esta categoría las especies vegetales que generan propóleos (Montoya-Bonilla et al., 2017). Estas plantas han sido estudiadas desde la antigüedad, principalmente por apicultores y meliponicultores, ya que las abejas y otros insectos dependen de ellas para alimentarse (de Jaime-Lorén y de Jaime-Ruiz, 2012). El estudio de las especies melíferas está relacionado con los inicios de la apicultura, debido a que los apicultores deben de conocer las plantas que producen néctar y polen útiles para las abejas y con base en ello, elegir el sitio ideal para instalar sus colmenas (Root, 1984). La interacción del hombre con las abejas es muy antigua. En las Cuevas de la Araña, Bicorp, España, se han encontrado pinturas rupestres del año 7000 a.C., en las cuales están representadas personas rodeadas por abejas (Pardo-García, 2005). Al igual en Egipto en las Tumbas de Luxor que datan de los años 1450-3550 a.C., se observa la extracción de miel usando humo (Pardo-García, 2005). La apicultura comenzó en la edad de bronce como actividad formalmente organizada. Desde entonces, se puso atención en las plantas que visitaban las abejas para recolectar néctar y polen (Pardo-García, 2005). A partir del siglo XX, los estudios de flora melífera han sido más rigurosos al incluir listados e inventarios florísticos de especies de importancia apícola, considerando nombres comunes y científicos, su hábitat, y los factores que afectan la producción de néctar en las flores durante el día (de Jaime-Lorén y de Jaime-Ruiz, 2012).
En América se han realizado estudios de flora melífera principalmente en el cono sur, en los cuales han documentado especies nectaríferas y poliníferas al analizar la presencia de polen en las muestras de mieles y las cargas corbiculares (Ortiz, 1990; Girón-Vanderhuck, 1995; Andrada, 2003; Naab y Tamame, 2007). Con base en el trabajo de Andrada (2003), se han clasificado las plantas que utilizan las abejas en tres categorías: poliníferas, nectaríferas o polen-nectaríferas, dependiendo de la presencia de granos de polen en las cargas corbiculares, las mieles o ambos productos. Estos estudios (Ortiz, 1990; Girón-Vanderhuck, 1995; Andrada, 2003; Naab y Tamame, 2007) concuerdan en que las familias Asteraceae y Fabaceae son las más aprovechadas por las abejas. Además, se ha documentado que en general las especies que son importantes fuentes de néctar para las abejas, también lo son de polen (Andrada, 2003).
México es el cuarto productor de miel y el tercer exportador a nivel mundial, de ahí la importancia de estudiar las plantas melíferas (Piedras-Gutiérrez y Quiroz-García, 2007). En nuestro país se han estudiado mieles y la flora melífera de distintas regiones, entre ellas la Sierra de Manantlán, Jalisco (Lorente-Adame, 1992), Colima (Santana-Michel et al., 1998), Chiapas (Villegas-Durán et al., 2002), Yucatán (Villanueva-Gutiérrez, 2005), el sur del Valle de México (Piedras-Gutiérrez y Quiroz-García, 2007), Campeche (Villalobos-Zapata y Mendoza-Vega, 2010), Zacatecas (Acosta-Castellanos et al., 2011), Tabasco (Córdova-Córdova et al., 2013) y el Valle de Mexicali, Baja California (Alaniz-Gutiérrez et al., 2017), entre otros. Los estados de Campeche, Chiapas y Yucatán destacan por la importancia histórica de la meliponicultura en la región, actividad que se remonta a la época de los mayas (Villegas-Durán et al., 2002). Hoy en día, estos tres estados están entre los principales productores de miel del país. Su producción es reconocida y apreciada en mercados nacionales e internacionales, lo cual se debe a la importancia que se ha dado al cuidado y estudio de la flora melífera y polinífera de la región, pues ésta no solo se utiliza para criar abejas, sino también para otros fines comerciales, especialmente las plantas con usos medicinales (Villalobos-Zapata y Mendoza-Vega, 2010). En el caso de Yucatán, la fragmentación de los ecosistemas con la consecuente pérdida de flora melífera ha provocado en algunos casos el declive y desplazamiento de las abejas sin aguijón Xunan kab (Melipona beecheii Bennett), especie que requiere hábitats bien conservados para prosperar (Villanueva-Gutiérrez et al., 2005).
En el municipio Pátzcuaro, Michoacán, se desconoce la importancia de la flora melífera, ya que hasta ahora no se cuenta con ningún trabajo que documente las plantas de interés apícola, a pesar de que está entre los diez municipios más productivos en el estado de Michoacán (Cambio de Michoacán, 2018), el cual ocupa el onceavo lugar en producción de miel a nivel nacional (SAGARPA, 2016).
El objetivo principal de este trabajo fue identificar las plantas melíferas que se desarrollan en la región centro-este del municipio Pátzcuaro, con base en la observación de las visitas que realiza Apis mellifera L. en la flora de esta zona, y con los análisis melisopalinológicos correspondientes.
Materiales y Métodos
Se revisaron artículos científicos de estudios de flora melífera, polinífera y nectarífera (Ortiz, 1990; Santana-Michel et al., 1998; Andrada 2003; Naab y Tamame, 2007; Roman y Palma, 2007; de Jaime-Lorén y de Jaime-Ruiz, 2012; Montoya-Bonilla et al., 2017) y análisis palinológicos de la miel (Girón-Vanderhuck, 1995; Piedras-Gutiérrez y Quiroz-García, 2007; Acosta-Castellanos et al., 2011; Córdova-Córdova et al., 2013; Alaniz-Gutiérrez et al., 2017), tesis (Lorente-Adame, 1992; Montoy-Koh, 2010), libros especializados de apicultura (Root, 1984) y flora melífera (Villegas-Durán et al., 2002), así como portales electrónicos (Pardo-García, 2005; SAGARPA, 2016) con el propósito de tener un panorama general de las investigaciones que se han realizado. Para delimitar el área de estudio se consideraron cuatro apiarios de referencia (Cerro Blanco, El Cristo, La Tinaja, Cuanajo) en los que se permitió el acceso para la toma de muestras de miel; éstos se encuentran instalados en la región centro-este del municipio Pátzcuaro (Cuadro 1, Fig. 1).
Cuadro 1: Apiarios de referencia para la extracción de miel, colecta de plantas y recorridos de campo del municipio Pátzcuaro, Michoacán, México.
| Número de Apiario | Localidad | Número de colmenas | Coordenadas | Altitud (m) |
| 1 | Cerro Blanco | 22 | 19°31’26.70”N 101°36’14.86”O | 2124 |
| 2 | El Cristo | 35 | 19°31’17.28”N 101°35’09.83”O | 2220 |
| 3 | La Tinaja | 22 | 19°31’27.22”N 101°31’33.73”O | 2235 |
| 4 | Cuanajo | 23 | 19°30’3.6”N 101°31’15.6’’O | 2230 |

Figura 1: Mapa con la ubicación de los apiarios de referencia del municipio Pátzcuaro, Michoacán, México.
Para documentar las plantas melíferas de la región, se realizaron observaciones directas de la visita de Apis mellifera, y se consultó a los apicultores encargados de los apiarios de referencia sobre las plantas visitadas por las abejas en esta región para producir la miel (Roman y Palma, 2007; Montoy-Koh, 2010). Esto se realizó en el periodo comprendido del 7 de septiembre de 2017 al 28 de abril de 2018. Semanalmente se recorrieron las zonas aledañas a los sitios donde están instalados los apiarios de referencia, que comprenden un kilómetro de radio tomando como punto de referencia cada uno de los apiarios. Las visitas de A. mellifera, para conseguir polen y néctar se documentaron con la toma de fotografías, mientras que su preferencia por las especies melíferas se determinó contando el número de abejas presentes en las plantas, en un área de 1 m² durante un minuto. Se clasificaron en abundantemente visitadas aquellas donde se observaron más de cinco abejas, regularmente visitadas de 3-5 abejas y escasamente visitadas en las que se observaron de 1-2 abejas por metro cuadrado (Cuadro 2).
Cuadro 2: Especies melíferas registradas en la región centro-este del municipio Pátzcuaro, Michoacán, México. Los ejemplares herborizados se encuentran depositados en el Herbario IEB.
| FAMILIA | Especie | Nombre común | Frecuencia de visita | Período de floración | Referencia del material colectado |
| Acanthaceae | Dicliptera peduncularis Nees | escasa | todo el año | F. Araujo 56 | |
| Asteraceae | Ageratina mairetiana (DC.) R.M. King & H. Rob. | abundante | marzo a abril | F. Araujo y M. Araujo 91 | |
| Aldama buddlejiformis (DC.) E.E. Schill. & Panero | regular | octubre a diciembre | F. Araujo y D. Araujo 70 | ||
| Baccharis heterophylla Kunth | jara china | abundante | florece todo el año con un pico de floración de abril a mayo | F. Araujo y M. Araujo 49 | |
| Baccharis pteronioides DC. | taracuata | regular | abril a mayo | F. Araujo y M. Araujo 90 | |
| Baccharis salicifolia (Ruiz & Pav.) Pers. | pescadillo blanco | abundante | julio a noviembre | F. Araujo y R. Redonda 18 | |
| Barkleyanthus salicifolius (Kunth) H. Rob. & Brettell | pescadillo | abundante | florece todo el año con un pico de floración de marzo a abril | F. Araujo y J. Araujo 77 | |
| Bidens odorata Cav. | aceitilla | abundante | agosto a diciembre | F. Araujo y D. Araujo 47 | |
| Bidens pilosa L. | aceitilla | regular | junio a noviembre | F. Araujo y R. Redonda 26 | |
| Cosmos bipinnatus Cav. | mirasol | escasa | septiembre a noviembre | F. Araujo y D. Araujo 46 | |
| Chromolaena collina (DC.) R.M. King & H. Rob. | regular | octubre a diciembre | F. Araujo y M. Araujo 61 | ||
| Chromolaena pulchella (Kunth) R.M. King & H. Rob. | escasa | septiembre a noviembre | F. Araujo y M. Araujo 50 | ||
| Critoniopsis tomentosa (Lex.) H. Rob. | escasa | enero a marzo | F. Araujo y M. Araujo 88 | ||
| Dahlia coccinea Cav. | dalia silvestre | escasa | junio a noviembre | F. Araujo y R. Redonda 19 | |
| Erigeron galeottii (A. Gray) Greene | escasa | julio a septiembre | F. Araujo y M. Araujo 28 | ||
| Heterotheca inuloides Cass. | árnica | escasa | enero a mayo | F. Araujo y M. Araujo 82 | |
| Lasianthea fruticosa (L.) K.M. Becker var. michoacana (S.F. Blake) K.M. Becker | regular | agosto a noviembre | F. Araujo y R. Redonda 16 | ||
| Melampodium perfoliatum (Cav.) Kunth | quesillo | escasa | agosto a noviembre | F. Araujo y M. Araujo 40 | |
| Montanoa grandiflora Alamán ex DC. | vara blanca | abundante | octubre a diciembre | F. Araujo y D. Araujo 69 | |
| Pseudognaphalium roseum (Kunth) Anderb. | gordolobo | escasa | noviembre a enero | F. Araujo y D. Araujo 73 | |
| Simsia amplexicaulis (Cav.) Pers. | abundante | septiembre a noviembre | F. Araujo y D. Araujo 48 | ||
| Smallanthus maculatus (Cav.) H. Rob. | regular | septiembre a diciembre | F. Araujo y M. Araujo 42 | ||
| Stevia ovata Will. var. ovata | nube | escasa | octubre a enero | F. Araujo y D. Araujo 68 | |
| Tagetes erecta L. | cincollaga | escasa | septiembre a noviembre | F. Araujo y M. Araujo 74 | |
| Taraxacum officinale F.H. Wigg. | diente de león | escasa | todo el año | F. Araujo 52 | |
| Tithonia tubiformis (Jacq.) Cass. | andan | regular | septiembre a noviembre | F. Araujo y M. Araujo 59 | |
| Verbesina fastigiata B.L. Rob. & Greenm. | regular | noviembre a enero | F. Araujo y D. Araujo 72 | ||
| Verbesina montanoifolia B.L. Rob. & Greenm. | capitaneja | abundante | octubre a diciembre | F. Araujo y D. Araujo 45 | |
| Verbesina tetraptera (Ortega) A. Gray | escasa | agosto a octubre | F. Araujo 8 | ||
| Vernonia alamanii DC. | escasa | noviembre a enero | F. Araujo y S. Araujo 79 | ||
| Wedelia acapulcensis Kunth var. hispida (Kunth) Strother | escasa | agosto a septiembre | F. Araujo 5 | ||
| Bignoniaceae | Amphilophium laxiflorum (DC.) L.G. Lohmann | escasa | todo el año | F. Araujo y M. Araujo 64 | |
| Boraginaceae | Borago officinalis L. | borraja | regular | septiembre a diciembre | F. Araujo y R. Redonda 51 |
| Phacelia platycarpa (Cav.) Spreng. | hierba del jicote | regular | junio a septiembre | F. Araujo 7 | |
| Brassicaceae | Brassica rapa L. | mostaza | regular | todo el año | F. Araujo 2 |
| Raphanus raphanistrum L. | rabanillo | regular | todo el año | F. Araujo y M. Araujo 41 | |
| Cactaceae | Opuntia fuliginosa Griffiths | nopal | abundante | enero a abril | F. Araujo y M. Araujo 87 |
| Campanulaceae | Lobelia fenestralis Cav. | escasa | agosto a diciembre | F. Araujo 1 | |
| Caryophyllaceae | Drymaria cordata (L.) Willd. ex Schult. | regular | septiembre a diciembre | F. Araujo y M. Araujo 38 | |
| Convolvulaceae | Ipomoea orizabensis (G. Pelletan) Ledeb. ex Steud. var. novogaliciana J.A. McDonald | trompetilla | regular | julio a noviembre | F. Araujo y R. Redonda 10 |
| Cucurbitaceae | Cucurbita pepo L. | calabaza | escasa | septiembre a noviembre | F. Araujo y M. Araujo 58 |
| Sechium edule (Jacq.) Sw. | chayote | abundante | agosto a diciembre | F. Araujo y M. Araujo 57 | |
| Sicyos microphyllus Kunth | chayotillo | abundante | agosto a noviembre | F. Araujo y R. Redonda 24 | |
| Ericaceae | Arbutus xalapensis Kunth | madroño | regular | enero a marzo | F. Araujo y M. Araujo 86 |
| Euphorbiaceae | Croton adspersus Benth. | regular | julio a octubre | F. Araujo y R. Redonda 17 | |
| Fabaceae | Acacia pennatula (Schltdl. & Cham.) Benth. | huizache | escasa | abril a mayo | F. Araujo et al. 92 |
| Acaciella angustissima (Mill.) Britton & Rose var. filicioides (Cav.) L. Rico | regular | agosto a noviembre | F. Araujo y M. Araujo 30 | ||
| Erythrina breviflora Sessé & Moc. ex DC. | frijol de coyote | regular | agosto a octubre | F. Araujo y M. Araujo 29 | |
| Eysenhardtia platycarpa Pennell & Saff. | abundante | septiembre a noviembre | F. Araujo y M. Araujo 63 | ||
| Eysenhardtia polystachya (Ortega) Sarg. | palo dulce | regular | junio a octubre | F. Araujo y R. Redonda 20 | |
| Marina nutans (Cav.) Barneby | escasa | octubre a noviembre | F. Araujo 66 | ||
| Phaseolus leptostachyus Benth. | escasa | agosto a octubre | F. Araujo y M. Araujo 31 | ||
| Phaseolus vulgaris L. | frijol | escasa | septiembre a noviembre | F. Araujo y M. Araujo 44 | |
| Trifolium mexicanum Hemsl. | escasa | julio a octubre | F. Araujo y M. Araujo 32 | ||
| Vicia sativa L. | janamargo | escasa | marzo a mayo | F. Araujo y M. Araujo 43 | |
| Iridaceae | Sisyrinchium tenuifolium Humb. & Bonpl. ex Willd. | escasa | junio a noviembre | F. Araujo 4 | |
| Lamiaceae | Hyptis mutabilis (Rich.) Briq. | regular | agosto a diciembre | F. Araujo y R. Redonda 15 | |
| Leonotis nepetifolia (L.) R. Br. | castillo | escasa | julio a febrero | F. Araujo y R. Redonda 11 | |
| Lepechinia caulescens (Ortega) Epling | escasa | agosto a septiembre | F. Araujo y R. Redonda 21 | ||
| Salvia lavanduloides Kunth | chía | regular | noviembre a enero | F. Araujo y D. Araujo 67 | |
| Salvia longispicata M. Martens & Galeotti | chía | regular | agosto a diciembre | F. Araujo y R. Redonda 13 | |
| Salvia polystachia Cav. | chía | regular | agosto a diciembre | F. Araujo y R. Redonda 14 | |
| Stachys keerlii Benth. | escasa | agosto a noviembre | F. Araujo 6 | ||
| Lauraceae | Persea americana Mill. | aguacate | regular | noviembre a mayo | F. Araujo y M. Araujo 89 |
| Loranthaceae | Psittacanthus calyculatus (DC.) G. Don | injerto naranja | escasa | julio a noviembre | F. Araujo y R. Redonda 22 |
| Malvaceae | Kearnemalvastrum lacteum (Aiton) D.M. Bates | regular | septiembre a diciembre | F. Araujo y M. Araujo 36 | |
| Sida rhombifolia L. | huinare | regular | septiembre a diciembre | F. Araujo y R. Redonda 9 | |
| Myrtaceae | Eucalyptus camaldulensis Dehnh. | eucalipto | regular | todo el año | F. Araujo y M. Araujo 96 |
| Eucalyptus globulus Labill. | eucalipto | regular | todo el año | F. Araujo y M. Araujo 97 | |
| Oleaceae | Fraxinus uhdei (Wenz.) Lingelsh. | fresno | regular | noviembre a febrero | F. Araujo y M. Araujo 98 |
| Onagraceae | Lopezia racemosa Cav. | perilla | abundante | septiembre a diciembre | F. Araujo y M. Araujo 37 |
| Papaveraceae | Argemone ochroleuca Sweet | chicalote | escasa | noviembre a junio | F. Araujo y M. Araujo 75 |
| Phytolaccaceae | Phytolacca icosandra L. | conguera | escasa | junio a diciembre | F. Araujo y R. Redonda 27 |
| Poaceae | Zea mays L. | maíz | nula | septiembre a octubre | F. Araujo y D. Araujo 71 |
| Polemoniaceae | Loeselia glandulosa (Cav.) G. Don | escasa | diciembre a enero | F. Araujo y M. Araujo 83 | |
| Polygalaceae | Monnina ciliolata Sessé & Moc. ex DC. | escasa | julio a enero | F. Araujo y M. Araujo 34 | |
| Resedaceae | Reseda luteola L. | cola de zorra | regular | noviembre a abril | F. Araujo y M. Araujo 76 |
| Rhamnaceae | Ceanothus caeruleus Lag. | membrillillo | regular | agosto a octubre y de diciembre a marzo | F. Araujo y M. Araujo 33 |
| Rosaceae | Crataegus mexicana DC. | tejocote | regular | octubre a abril, pico de floración de febrero a marzo | F. Araujo y M. Araujo 53 |
| Cydonia oblonga Mill. | membrillo | regular | octubre a abril, pico de floración de febrero a marzo | F. Araujo y M. Araujo 60 | |
| Eriobotrya japonica (Thunb.) Lindl. | níspero | regular | julio a agosto | F. Araujo y M. Araujo 81 | |
| Prunus persica (L.) Batsch. | durazno | regular | octubre a abril, pico de floración de febrero a marzo | F. Araujo y M. Araujo 62 | |
| Prunus serotina Ehrh. | capulín | regular | enero a abril | F. Araujo y M. Araujo 85 | |
| Rubus adenotrichos Schltdl. | zarza silvestre | regular | enero a abril | F. Araujo y M. Araujo 84 | |
| Rubus ulmifolius Schott | zarzamora | regular | todo el año | F. Araujo y M. Araujo 80 | |
| Rutaceae | Citrus limon (L.) Osbeck | limón | regular | todo el año | F. Araujo 54 |
| Salicaceae | Salix bonplandiana Kunth | sauce | regular | todo el año | F. Araujo y M. Araujo 78 |
| Solanaceae | Capsicum pubescens Ruiz & Pav. | chile | escasa | todo el año | F. Araujo 55 |
| Jaltomata procumbens (Cav.) J.L. Gentry | pichecua | escasa | julio a noviembre | F. Araujo y M. Araujo 39 | |
| Solanum nigrescens M. Martens & Galeotti | hierba mora | escasa | agosto a noviembre | F. Araujo y R. Redonda 23 | |
| Verbenaceae | Priva aspera Kunth | regular | junio a octubre | F. Araujo 3 | |
| Verbena carolina L. | escasa | junio a octubre | F. Araujo y R. Redonda 25 | ||
| Verbena menthifolia Benth. | escasa | abril a diciembre | F. Araujo y R. Redonda 12 |
Se recolectaron ejemplares de las especies vegetales en las que se observó la visita de abejas durante los recorridos. También se documentó el periodo de floración de cada especie, así como los problemas que las afectan, ya sean antropogénicos (cambio de uso de suelo) o naturales (presencia de plagas). Los ejemplares herborizados se encuentran depositados en el Herbario IEB (Instituto de Ecología, A.C., Centro Regional del Bajío).
Con la finalidad de conocer los tipos polínicos presentes en las mieles de los apiarios de referencia, se tomaron muestras en cada uno. La primer muestra se obtuvo el 15 de septiembre de 2017 de una colmena seleccionada al azar; en cada uno de los apiarios, la extracción de miel fue directamente de un panal desoperculado (panal cuyas celdas no han sido selladas con cera), tomado del alza melaria (compartimento superior a la cámara de cría, compuesto por panales donde se almacena la miel). La segunda toma se realizó el 10 de noviembre de 2017, las muestras corresponden a la cosecha obtenida en cada apiario; su extracción fue por desbaste (destrucción de las celdas de los panales) y escurrimiento. Para identificar y comparar los tipos polínicos hallados en las muestras de miel, se realizaron disociados de las anteras en solución acuosa de cada una de las especies colectadas en los sitios cercanos a los apiarios de referencia. Las muestras de polen de estos disociados se montaron en gelatina glicerinada para su preservación. Todas las muestras se observaron en campo claro, en un microscopio óptico Primo Star Zeiss (Carl Zeiss Microscopy GmbH, Jena, Alemania) a distintos aumentos. La identificación de los granos de polen se realizó con base en fotografías que se tomaron con ayuda de una cámara digital AxioCam ERc 5s (Carl Zeiss Microscopy GmbH, Jena, Alemania).
Para examinar los tipos polínicos de las muestras de miel, se siguió el método propuesto por Louveaux et al. (1978) con algunas modificaciones, colocando 1.5 g de cada muestra en microtubos Eppendorf. La miel se diluyó con agua destilada a 40 °C, manteniéndola en baño María durante 30 minutos. Las muestras se centrifugaron a 5000 rpm por 10 minutos; el precipitado obtenido se lavó con agua destilada a temperatura ambiente y se centrifugó nuevamente, repitiendo el procedimiento en tres ocasiones. El sedimento obtenido al final se utilizó para elaborar laminillas que se montaron en gelatina glicerinada.
La observación, identificación y conteo de los tipos polínicos en las muestras de miel se realizaron con ayuda de un microscopio óptico Primo Star Zeiss (Carl Zeiss Microscopy GmbH, Jena, Alemania). Se tomaron fotografías de cada tipo polínico con una cámara digital AxioCam ERc 5s (Carl Zeiss Microscopy GmbH, Jena, Alemania). Posteriormente, los tipos polínicos observados en las muestras de miel se compararon con los obtenidos de los disociados. Las clases de los granos de polen en las muestras de miel se establecieron con base en el porcentaje de presencia, considerando polen dominante aquel que está representado por 45% o más, polen secundario 16-44%, polen de menor importancia 4-15% y polen traza con 3% o menos (Louveaux et al., 1978).
Resultados
Con base en el número de ejemplares recolectados, se encontró que Apis mellifera visita y aprovecha 93 especies diferentes (Cuadro 2). Las plantas melíferas de la región centro-este de Pátzcuaro pertenecen a 33 familias botánicas, de las cuales Asteraceae (Figs. 2A-D’) y Fabaceae (Figs. 3A-J) son las más visitadas. Están representadas por 30 y diez especies, respectivamente; éstas equivalen a 32 y 10% de la flora melífera de la región. Las familias Lamiaceae (Figs. 3K-Q) y Rosaceae (Figs. 3R-X), con siete especies cada una, ocupan el tercer puesto de las especies de importancia melífera en la zona de estudio. Las 29 familias restantes (Fig. 4) incluyen de una a tres especies de importancia apícola cada una.

Figura 2: Especies de la familia Asteraceae de importancia melífera en la región centro-este del municipio Pátzcuaro, Michoacán, México. A. Ageratina mairetiana (DC.) R.M. King & H. Rob.; B. Aldama buddlejiformis (DC.) E.E. Schill. & Panero; C. Baccharis heterophylla Kunth; D. Baccharis pteronioides DC., E. Baccharis salicifolia (Ruiz & Pav.) Pers.; F. Barkleyanthus salicifolius (Kunth) H. Rob. & Brettell; G. Bidens odorata Cav.; H. Bidens pilosa L.; I. Chromolaena collina (DC.) R.M. King & H. Rob.; J. Chromolaena pulchella (Kunth) R.M. King & H. Rob.; K. Cosmos bipinnatus Cav.; L. Critoniopsis tomentosa (Lex.) H. Rob.; M. Dahlia coccinea Cav.; N. Erigeron galeottii (A. Gray) Greene; O. Heterotheca inuloides Cass.; P. Lasianthea fruticosa (L.) K.M. Becker var. michoacana (S.F. Blake) K.M. Becker; Q. Melampodium perfoliatum (Cav.) Kunth; R. Montanoa grandiflora Alamán ex DC.; S. Pseudognaphalium roseum (Kunth) Anderb.; T. Simsia amplexicaulis (Cav.) Pers.; U. Smallanthus maculatus (Cav.) H. Rob.; V. Stevia ovata Will. var. ovata; W. Tagetes erecta L.; X. Taraxacum officinale F.H. Wigg.; Y. Tithonia tubiformis (Jacq.) Cass.; Z. Verbesina fastigiata B.L. Rob. & Greenm.; A'. Verbesina montanoifolia B.L. Rob. & Greenm.; B'. Verbesina tetraptera (Ortega) A. Gray; C'. Vernonia alamanii DC.; D'. Wedelia acapulcensis Kunth var. hispida (Kunth) Strother. Fotografías A-D': Fernando Araujo Mondragón.

Figura 3: Especies melíferas de las familias Fabaceae, Lamiaceae y Rosaceae en la región centro-este del municipio Pátzcuaro, Michoacán, México. A. Acacia pennatula (Schltdl. & Cham.) Benth.; B. Acaciella angustissima (Mill.) Britton & Rose var. filicioides (Cav.) L. Rico; C. Eysenhardtia platycarpa Pennell & Saff.; D. Eysenhardtia polystachya (Ortega) Sarg.; E. Erythrina breviflora Sessé & Moc. ex DC.; F. Marina nutans (Cav.) Barneby; G. Phaseolus leptostachyus Benth.; H. Phaseolus vulgaris L.; I. Trifolium mexicanum Hemsl.; J. Vicia sativa L.; K. Hyptis mutabilis (Rich.) Briq.; L. Leonotis nepetifolia (L.) R. Br.; M. Lepechinia caulescens (Ortega) Epling; N. Salvia lavanduloides Kunth; O. Salvia longispicata M. Martens & Galeotti; P. Salvia polystachia Cav.; Q. Stachys keerlii Benth.; R. Crataegus mexicana DC.; S. Cydonia oblonga Mill.; T. Eriobotrya japonica (Thunb.) Lindl.; U. Prunus persica (L.) Batsch.; V. Prunus serotina Ehrh.; W. Rubus adenotrichos Schltdl.; X. Rubus ulmifolius Schott. Fotografías A-U: Fernando Araujo Mondragón; V-X: Moisés Araujo Mondragón.

Figura 4: Especies melíferas de varias familias de angiospermas en la región centro-este del municipio Pátzcuaro, Michoacán, México. A. Dicliptera peduncularis Nees (Acanthaeae); B. Amphilophium laxiflorum (DC.) L.G. Lohmann (Bignoniaceae); C. Borago officinalis L., D. Phacelia platycarpa (Cav.) Spreng. (Boraginaceae); E. Brassica rapa L., F. Raphanus raphanistrum L. (Brassicaceae); G. Opuntia fuliginosa Griffiths (Cactaceae); H. Lobelia fenestralis Cav. (Campanulaceae); I. Drymaria cordata (L.) Willd. ex Schult. (Caryophyllaceae); J. Ipomoea orizabensis (G. Pelletan) Ledeb. ex Steud. var. novogaliciana J.A. McDonald (Convolvulaceae); K. Cucurbita pepo L., L. Sechium edule (Jacq.) Sw., M. Sicyos microphyllus Kunth (Cuburbitaceae); N. Croton adspersus Benth. (Euphorbiaceae); O. Arbutus xalapensis Kunth (Ericaceae); P. Sisyrinchium tenuifolium Humb. & Bonpl. ex Willd. (Iridaceae); Q. Persea americana Mill. (Lauraceae); R. Psittacanthus calyculatus (DC.) G. Don (Loranthaceae); S. Kearnemalvastrum lacteum (Aiton) D.M. Bates, T. Sida rhombifolia L. (Malvaceae); U. Lopezia racemosa Cav. (Onagraceae); V. Argemone ochroleuca Sweet (Papaveraceae); W. Phytolacca icosandra L. (Phytolaccaceae); X. Loeselia glandulosa (Cav.) G. Don (Polemoniaceae); Y. Monnina ciliolata Sessé & Moc. ex DC. (Polygalaceae); Z. Ceanothus caeruleus Lag. (Rhamnaceae); A'. Reseda luteola L. (Resedaceae); B'. Citrus limon (L.) Osbeck (Rutaceae); C'. Salix bonplandiana Kunth (Salicaeae); D'. Capsicum pubescens Ruiz & Pav., E'. Jaltomata procumbens (Cav.) J.L. Gentry, F'. Solanum nigrescens M. Martens & Galeotti (Solanaceae); G'. Priva aspera Kunth, H'. Verbena carolina L., I'. Verbena menthifolia Benth. (Verbenaceae). Fotografías A-I': Fernando Araujo Mondragón.
Como resultado de los estudios melisopalinológicos se encontraron al menos 12 tipos polínicos que representan más de 16% de los granos de polen presentes en la miel; de los cuales, el polen de Salix bonplandiana Kunth y Asteraceae (Figs. 5A-D), particularmente de especies de la tribu Heliantheae, comparten las categorías dominante y secundario. En ésta última, también se encuentra el polen de Eucalyptus sp., Phytolacca icosandra L., Phacelia platycarpa (Cav.) Spreng., Sechium edule (Jacq.) Sw., Fraxinus uhdei (Wenz.) Lingelsh. y Lopezia racemosa Cav. (Figs. 5E-J). A continuación, se detallan los resultados de los análisis realizados en las muestras de miel obtenidas de los apiarios seleccionados.
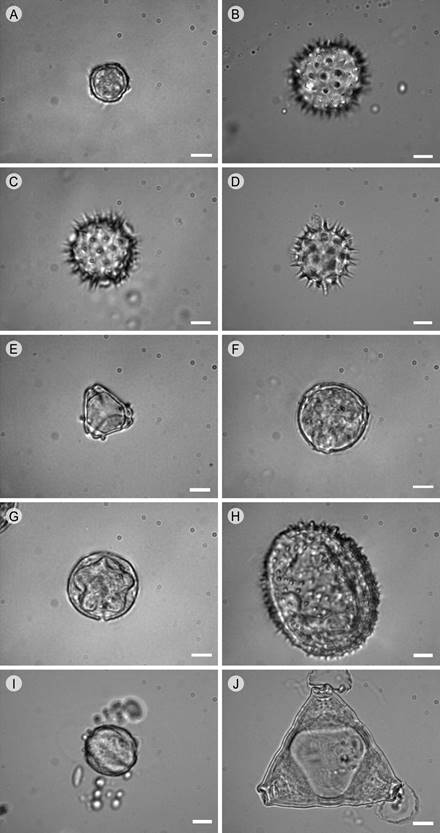
Figura 5: Tipos polínicos dominantes, secundarios y de menor importancia, presentes en la miel de cuatro apiarios de la región centro-este del municipio Pátzcuaro, Michoacán, México. A. polen de Salix bonplandiana Kunth; B-D. polen de Asteraceae, B. Montanoa grandiflora Alamán ex DC., C. Simsia amplexicaulis (Cav.) Pers, D. Smallanthus maculatus (Cav.); E. polen de Eucalyptus sp.; F. polen de Phytolacca icosandra L.; G. polen de Fraxinus uhdei (Wenz.) Lingelsh.; H. polen de Sechium edule (Jacq.) Sw.; I. polen de Phacelia platycarpa (Cav.) Spreng.; J. Lopezia racemosa Cav. Escala: 10 µm. Fotografías A-G: Fernando Araujo Mondragón; H-J: Rosario Redonda-Martínez.
1) Apiario Cerro Blanco
En el primer muestreo (septiembre) se contó un total de 162 granos de polen pertenecientes a 14 tipos polínicos de los cuales se identificaron 12 y dos son desconocidos (Cuadro 3). El tipo polínico dominante es de Salix bonplandiana con 50.6% de presencia, muy por arriba de los otros tipos polínicos, lo que indica que en este apiario, S. bonplandiana es un recurso florístico importante para Apis mellifera. En lo que respecta a los tipos polínicos no identificados, uno se considera de menor importancia y otro es traza.
Cuadro 3: Muestreo de miel del apiario Cerro Blanco, municipio Pátzcuaro, Michoacán, México.
| Primera muestra | ||||
| Tipo polínico | Familia/Especie | Número de granos | Porcentaje | Clase |
| 1 | Salix bonplandiana Kunth | 82 | 50.6 | Dominante |
| 2 | Phacelia platycarpa (Cav.) Spreng. | 19 | 11.7 | Menor importancia |
| 3 | Eriobotrya japonica (Thunb.) Lindl. | 15 | 9.3 | Menor importancia |
| 4 | No identificado | 12 | 7.4 | Menor importancia |
| 5 | Salvia polystachia Cav. | 11 | 6.8 | Menor importancia |
| 6 | Asteraceae | 6 | 3.7 | Traza |
| 7 | Eysenhardtia polystachya (Ortega) Sarg. | 3 | 1.9 | Traza |
| 8 | Eucalyptus sp. | 3 | 1.9 | Traza |
| 9 | Leonotis nepetifolia (L.) R. Br. | 2 | 1.2 | Traza |
| 10 | No identificado | 2 | 1.2 | Traza |
| 11 | Hyptis mutabilis (Rich.) Briq. | 2 | 1.2 | Traza |
| 12 | Salvia longispicata M. Martens & Galeotti | 2 | 1.2 | Traza |
| 13 | Raphanus raphanistrum L. | 2 | 1.2 | Traza |
| 14 | Capsicum pubescens Ruiz & Pav. | 1 | 0.6 | Traza |
| GRANOS TOTALES | 162 | |||
| Segunda muestra | ||||
| 1 | Asteraceae | 196 | 44.9 | Secundario |
| 2 | Salix bonplandiana Kunth | 99 | 22.7 | Secundario |
| 3 | Eucalyptus sp. | 25 | 5.7 | Menor importancia |
| 4 | No identificado | 18 | 4.1 | Menor importancia |
| 5 | No identificado | 17 | 3.9 | Traza |
| 6 | Lopezia racemosa Cav. | 13 | 3.0 | Traza |
| 7 | Eriobotrya japonica (Thunb.) Lindl. | 12 | 2.7 | Traza |
| 8 | Dicliptera peduncularis Nees | 10 | 2.3 | Traza |
| 9 | Fraxinus uhdei (Wenz.) Lingelsh. | 9 | 2.1 | Traza |
| 10 | Drymaria cordata (L.) Willd. ex Schult. | 7 | 1.6 | Traza |
| 11 | Raphanus raphanistrum L. | 7 | 1.6 | Traza |
| 12 | Verbena carolina L. | 5 | 1.1 | Traza |
| 13 | Brassica rapa L. | 4 | 0.9 | Traza |
| 14 | No identificado | 4 | 0.9 | Traza |
| 15 | No identificado | 2 | 0.5 | Traza |
| 16 | Hyptis mutabilis (Rich.) Briq. | 2 | 0.5 | Traza |
| 17 | Salvia lavanduloides Kunth | 2 | 0.5 | Traza |
| 18 | Salvia polystachia Cav. | 2 | 0.5 | Traza |
| 19 | Sicyos microphyllus Kunth | 1 | 0.2 | Traza |
| 20 | No identificado | 1 | 0.2 | Traza |
| 21 | Sida rhombifolia L. | 1 | 0.2 | Traza |
| GRANOS TOTALES | 437 | |||
En el segundo muestreo (noviembre) se contaron 437 granos de polen que representan 21 tipos polínicos, de los cuales se identificaron 16, mientras que cinco se desconocen (Cuadro 3). En esta muestra, dos tipos polínicos son de clase secundaria, el primero corresponde a Asteraceae (tribu Heliantheae) con 44.9%, el segundo a S. bonplandiana con 22.7%, confirmando que Asteraceae y S. bonplandiana representan una fuente importante de alimento para A. mellifera en este apiario. Los tipos polínicos no identificados se encuentran dentro de las clases de menor importancia y traza.
2) Apiario El Cristo
En el primer muestreo (septiembre) se encontró un total de 52 granos de polen pertenecientes a 13 tipos polínicos de los cuales se identificaron diez y tres no (Cuadro 4). El polen de Salix bonplandiana registró la mayor frecuencia y se agrupa en la clase secundario con 17.3%. Los tipos polínicos no identificados representan clases de menor importancia y traza.
Cuadro 4: Muestreo de miel del apiario El Cristo, municipio Pátzcuaro, Michoacán, México.
| Primera muestra | ||||
| Tipo polínico | Familia/Especie | Número de granos | Porcentaje | Clase |
| 1 | Salix bonplandiana Kunth | 9 | 17.3 | Secundario |
| 2 | No identificado | 7 | 13.5 | Menor importancia |
| 3 | Eucalyptus sp. | 7 | 13.5 | Menor importancia |
| 4 | Salvia longispicata M. Martens & Galeotti | 7 | 13.5 | Menor importancia |
| 5 | Phytolacca icosandra L. | 7 | 13.5 | Menor importancia |
| 6 | Asteraceae | 6 | 11.5 | Menor importancia |
| 7 | No identificado | 2 | 3.8 | Traza |
| 8 | Stachys keerllii Benth. | 2 | 3.8 | Traza |
| 9 | Jaltomata procumbens (Cav.) J.L. Gentry | 1 | 1.9 | Traza |
| 10 | Eriobotrya japonica (Thunb.) Lindl. | 1 | 1.9 | Traza |
| 11 | Raphanus raphanistrum L. | 1 | 1.9 | Traza |
| 12 | Zea mays L. | 1 | 1.9 | Traza |
| 13 | No identificado | 1 | 1.9 | Traza |
| TOTAL GRANOS | 52 | |||
| Segunda muestra | ||||
| 1 | Asteraceae | 352 | 73.0 | Dominante |
| 2 | Salix bonplandiana Kunth | 33 | 6.8 | Menor importancia |
| 3 | Eucalyptus sp. | 21 | 4.4 | Menor importancia |
| 4 | No identificado | 13 | 2.7 | Traza |
| 5 | Raphanus raphanistrum L. | 13 | 2.7 | Traza |
| 6 | Hyptis mutabilis (Rich.) Briq. | 7 | 1.5 | Traza |
| 7 | Brassica rapa L. | 7 | 1.5 | Traza |
| 8 | Eriobotrya japonica (Thunb.) Lindl. | 5 | 1.0 | Traza |
| 9 | Lopezia racemosa Cav. | 5 | 1.0 | Traza |
| 10 | Phytolacca icosandra L. | 5 | 1.0 | Traza |
| 11 | No identificado | 4 | 0.8 | Traza |
| 12 | Salvia polystachia Cav. | 4 | 0.8 | Traza |
| 13 | Sechium edule (Jacq.) Sw. | 3 | 0.6 | Traza |
| 14 | No identificado | 3 | 0.6 | Traza |
| 15 | No identificado | 2 | 0.4 | Traza |
| 16 | No identificado | 2 | 0.4 | Traza |
| 17 | Fraxinus uhdei (Wenz.) Lingelsh. | 1 | 0.2 | Traza |
| 18 | No identificado | 1 | 0.2 | Traza |
| 19 | No identificado | 1 | 0.2 | Traza |
| TOTAL GRANOS | 482 | |||
En el segundo muestreo (noviembre) se encontraron 482 granos de polen correspondientes a 19 tipos polínicos de los cuales se identificaron 12 y siete son desconocidos (Cuadro 4). El tipo polínico dominante es de Asteraceae (tribu Heliantheae) con una presencia de 73%, siendo un recurso valioso para Apis mellifera en este apiario. Los tipos polínicos no identificados se agrupan en la clase traza.
3) Apiario La Tinaja
En el primer muestreo (septiembre) se registró un total de 66 granos de polen pertenecientes a 11 tipos polínicos, seis se identificaron y cinco son desconocidos (Cuadro 5). Esta muestra presenta tres tipos polínicos de clase secundaria. El mayor porcentaje de presencia corresponde a Eucalyptus sp. con 36.4%, seguido de Phytolacca icosandra con 22.7%, y Phacelia platycarpa con 21.2%. En esta zona, Apis mellifera colecta de manera más homogénea considerando los recursos disponibles. Los tipos no identificados se presentan en bajos porcentajes, por lo que se agrupan en la clase traza.
Cuadro 5: Muestreo de miel del apiario La Tinaja, municipio Pátzcuaro, Michoacán, México.
| Primera muestra | ||||
| Tipo polínico | Familia/Especie | Número de granos | Porcentaje | Clase |
| 1 | Eucalyptus sp. | 24 | 36.4 | Secundario |
| 2 | Salvia longispicata M. Martens & Galeotti | 15 | 22.7 | Secundario |
| 3 | Phytolacca icosandra L. | 14 | 21.2 | Secundario |
| 4 | Phacelia platycarpa (Cav.) Spreng. | 4 | 6.1 | Menor importancia |
| 5 | Salix bonplandiana Kunth | 2 | 3.0 | Traza |
| 6 | Leonotis nepetifolia (L.) R. Br. | 2 | 3.0 | Traza |
| 7 | No identificado | 1 | 1.5 | Traza |
| 8 | No identificado | 1 | 1.5 | Traza |
| 9 | No identificado | 1 | 1.5 | Traza |
| 10 | No identificado | 1 | 1.5 | Traza |
| 11 | No identificado | 1 | 1.5 | Traza |
| TOTAL GRANOS | 66 | |||
| Segunda muestra | ||||
| 1 | Asteraceae | 345 | 68.0 | Dominante |
| 2 | Lopezia racemosa Cav. | 42 | 8.3 | Menor importancia |
| 3 | Salix bonplandiana Kunth | 16 | 3.2 | Traza |
| 4 | No identificado | 16 | 3.2 | Traza |
| 5 | Eucalyptus sp. | 15 | 3.0 | Traza |
| 6 | Fraxinus uhdei (Wenz.) Lingelsh. | 15 | 3.0 | Traza |
| 7 | Brassica rapa L. | 11 | 2.2 | Traza |
| 8 | Raphanus raphanistrum L. | 9 | 1.8 | Traza |
| 9 | Vicia sativa L. | 5 | 1.0 | Traza |
| 10 | Erythrina breviflora Sessé & Moc. ex DC. | 5 | 1.0 | Traza |
| 11 | Reseda luteola L. | 5 | 1.0 | Traza |
| 12 | Acaciella angustissima (Mill.) Britton & Rose var. filicioides (Cav.) L. Rico | 3 | 0.6 | Traza |
| 13 | No identificado | 3 | 0.6 | Traza |
| 14 | No identificado | 2 | 0.4 | Traza |
| 15 | Verbena carolina L. | 2 | 0.4 | Traza |
| 16 | No identificado | 2 | 0.4 | Traza |
| 17 | No identificado | 2 | 0.4 | Traza |
| 18 | Sechium edule (Jacq.) Sw. | 2 | 0.4 | Traza |
| 19 | No identificado | 1 | 0.2 | Traza |
| 20 | No identificado | 1 | 0.2 | Traza |
| 21 | No identificado | 1 | 0.2 | Traza |
| 22 | Citrus limon (L.) Osbeck | 1 | 0.2 | Traza |
| 23 | No identificado | 1 | 0.2 | Traza |
| 24 | No identificado | 1 | 0.2 | Traza |
| 25 | Hyptis mutabilis (Rich.) Briq. | 1 | 0.2 | Traza |
| TOTAL GRANOS | 507 | |||
El segundo muestreo (noviembre) arrojó la presencia de 507 granos de polen que representan 25 tipos polínicos, de los cuales se identificaron 15 y diez no (Cuadro 5). El polen de Asteraceae es la clase dominante con 68%, seguido de Lopezia racemosa con 8.3% y Salix bonplandiana con 3.2%. Nuevamente los tipos polínicos no identificados se ubican en la clase traza.
4) Apiario Cuanajo
En el primer muestreo (septiembre) se contaron un total de 57 granos de polen pertenecientes a nueve tipos polínicos de los cuales se identificaron ocho y uno se desconoce (Cuadro 6). Tres tipos polínicos son de clase secundaria; Phytolacca icosandra y Sechium edule representan 26.3% cada uno y Eucalyptus sp. 15.8%. El tipo polínico no identificado se ubicó en la clase traza.
Cuadro 6: Muestreo de miel del apiario Cuanajo, municipio Pátzcuaro, Michoacán, México.
| Primera muestra | ||||
| Tipo polínico | Familia/Especie | Número de granos | Porcentaje | Clase |
| 1 | Phytolacca icosandra L. | 15 | 26.3 | Secundario |
| 2 | Sechium edule (Jacq.) Sw. | 15 | 26.3 | Secundario |
| 3 | Eucalyptus sp. | 9 | 15.8 | Secundario |
| 4 | Salvia longispicata M. Martens & Galeotti | 7 | 12.3 | Menor importancia |
| 5 | Salix bonplandiana Kunth | 5 | 8.8 | Menor importancia |
| 6 | Raphanus raphanistrum L. | 3 | 5.3 | Menor importancia |
| 7 | Acaciella angustissima (Mill.) Britton & Rose var. filicioides (Cav.) L. Rico | 1 | 1.8 | Traza |
| 8 | No identificado | 1 | 1.8 | Traza |
| 9 | Lopezia racemosa Cav. | 1 | 1.8 | Traza |
| TOTAL GRANOS | 57 | |||
| Segunda muestra | ||||
| 1 | Fraxinus uhdei (Wenz.) Lingelsh. | 161 | 39.1 | Secundario |
| 2 | Asteraceae | 113 | 27.4 | Secundario |
| 3 | Raphanus raphanistrum L. | 47 | 11.4 | Menor importancia |
| 4 | Salix bonplandiana Kunth | 20 | 4.9 | Menor importancia |
| 5 | No identificado | 13 | 3.2 | Traza |
| 6 | No identificado | 8 | 1.9 | Traza |
| 7 | Phytolacca icosandra L. | 7 | 1.7 | Traza |
| 8 | Lopezia racemosa Cav. | 6 | 1.5 | Traza |
| 9 | Eucalyptus sp. | 6 | 1.5 | Traza |
| 10 | No identificado | 6 | 1.5 | Traza |
| 11 | Hyptis mutabilis (Rich.) Briq. | 5 | 1.2 | Traza |
| 12 | No identificado | 4 | 1.0 | Traza |
| 13 | No identificado | 4 | 1.0 | Traza |
| 14 | No identificado | 3 | 0.7 | Traza |
| 15 | Acaciella angustissima (Mill.) Britton & Rose var. filicioides (Cav.) L. Rico | 2 | 0.5 | Traza |
| 16 | No identificado | 2 | 0.5 | Traza |
| 17 | Marina nutans (Cav.) Barneby | 2 | 0.5 | Traza |
| 18 | Sicyos microphyllus Kunth | 1 | 0.2 | Traza |
| 19 | No identificado | 1 | 0.2 | Traza |
| 20 | Ceanothus caeruleus Lag. | 1 | 0.2 | Traza |
| TOTAL GRANOS | 412 | |||
En el segundo muestreo (noviembre) se encontraron 412 granos de polen que corresponden a 20 tipos polínicos; de éstos se identificaron 12, mientras que ocho se consideran desconocidos (Cuadro 6). En esta muestra, el polen de Fraxinus uhdei equivale a 39.1%, el de Asteraceae a 27.4%, y representan clase de polen secundario. Los tipos polínicos no identificados presentaron bajos porcentajes y se ubicaron en la clase traza.
De las 93 especies melíferas, 36.5% resultaron afectadas por cambio de uso del suelo (Figs. 6A-C), 35.5% se consideran malezas, 7.5% sufrieron daños por plagas y también son catalogadas como malezas, 4.3% son huéspedes de plantas parásitas. Solo el 16.2% no tiene riesgo alguno, ya que son árboles frutales o especies cultivadas. Las principales plagas que dañaron las especies melíferas de la región centro-este de Pátzcuaro fueron chapulines (Sphenarium purpurascens Charpentier) (Figs. 6D-F) y pulgones (Aphididae) (Figs. 6G-H). Los chapulines afectaron principalmente a Baccharis heterophylla Kunth, Montanoa grandiflora Alamán ex DC., Salvia longispicata M. Martens & Galeotti, Smallanthus maculatus (Cav.) H. Rob., Tithonia tubiformis (Jacq.) Cass. y Verbesina montanoifolia B.L. Rob. & Greenm, mientras que los pulgones (Aphididae) perjudicaron a Baccharis salicifolia (Ruiz & Pav.) Pers.

Figura 6: Problemas que afectan a las especies melíferas de la región centro-este del municipio Pátzcuaro, Michoacán, México. A-C. cambio de uso de suelo para instalar huertas de aguacate; D-F. chapulines alimentándose de las hojas de algunas especies melíferas, D. Salvia longispicata M. Martens & Galeotti; E. Tithonia tubiformis (Jacq.) Cass.; F. Verbesina montanoifolia B.L. Rob. & Greenm; G-H. plaga de pulgones en Baccharis salicifolia (Ruiz & Pav.) Pers.; G. inflorescencia; H. tallo. Fotografías A-C, F: Fernando Araujo Mondragón; D-E, G-H: Rosario Redonda-Martínez.
Discusión y conclusiones
Los principales tipos polínicos, registrados en el primer muestreo en los apiarios Cerro Blanco y El Cristo, correspondieron a Salix bonplandiana; en La Tinaja, Eucalyptus sp. representó la mayor frecuencia; mientras que en Cuanajo el polen más abundante fue de Phytolacca icosandra, siendo estas especies fuentes importantes de alimento para Apis mellifera. En este muestreo, la miel del apiario Cerro Blanco resultó monofloral, ya que la mayor cantidad de polen encontrado correspondió a Salix bonplandiana, mientras que las de los otros apiarios fueron multiflorales.
El segundo muestreo, obtenido de la cosecha de miel, presentó mayor número de granos y tipos polínicos, siendo el polen de Asteraceae (tribu Heliantheae) el más abundante, excepto en el apiario Cuanajo, donde el polen de Fraxinus uhdei se observó con mayor frecuencia y el de Asteraceae (tribu Heliantheae) representó el segundo tipo polínico, dejando claramente definida la importancia de esta familia para la cosecha de miel. En este muestreo todas las mieles resultaron multiflorales. En algunas muestras, el polen de Asteraceae superó el 45%; sin embargo, no se pueden considerar mieles monoflorales porque el polen pertenece a varias especies de compuestas de la tribu Heliantheae y no se observó dominancia de un polen particular.
Los resultados del análisis melisopalinológico concuerdan con el inventario florístico, en el cual, las especies de Asteraceae fueron las más abundantes (Cuadro 2); esto prueba que, en la región de estudio, las compuestas son una fuente importante de recursos para A. mellifera. Sin embargo, no se descarta la importancia de las otras familias, ya que, en el primer muestreo, las cantidades de polen de compuestas fueron mínimas, debido quizás a que había pocas especies en floración, y A. mellifera visitó las flores de otros grupos vegetales. En todos los muestreos los tipos polínicos no identificados se presentaron como polen de menor importancia y traza. Esto indica que A. mellifera aprovecha otros recursos florísticos que no se observaron, ni se colectaron durante los recorridos de campo.
Si bien algunas especies incluidas en el listado de plantas melíferas no se encontraron en los análisis melisopalinológicos, su importancia apícola se observó durante los recorridos de campo. Por ello, se consideran tan importantes como aquellas que se encontraron en las mieles, pues esas especies podrían ser valiosas para el desarrollo de las colmenas, o bien servir como fuente de alimento cuando las plantas preferidas por A. mellifera no se encuentran en floración o ésta se retrasa. Posiblemente ese sea el principal motivo por el que no se encuentran representadas en la miel cosechada.
Las diferencias existentes en los conteos de polen del primer y segundo muestreos podrían ser resultado del modo de extracción de la miel, ya que, en el primer muestreo, ésta se obtuvo directamente del panal cuidando que no entrara en contacto con el polen almacenado en celdas aledañas. Esto no ocurrió para el segundo muestreo, pues en éste, se tomó la miel de las cosechas de cada apiario y la extracción fue por desbaste de los panales y escurrimiento, existiendo así la posibilidad de que la miel entrara en contacto con polen almacenado en los panales que se cosecharon. Considerando lo anterior, se podría pensar que el modo de extracción de la miel influye en la cantidad de polen presente en las muestras o bien, que la miel es pobre en polen naturalmente (Louveaux et al., 1978).
La frecuencia de visita de abejas a las especies melíferas está influenciada por la disponibilidad de recursos, es decir, en los periodos de escasez, las abejas pueden visitar con mayor frecuencia una planta, situación que cambia cuando tienen más fuentes de alimento disponible, volviendo a su comportamiento de forrajeo más selectivo (Lorente-Adame, 1992). El tiempo ideal para verificar la visita de A. mellifera en las especies de interés apícola son los picos de floración, época en la que se registra mayor frecuencia de visitas. Otros factores a considerar son el horario y las condiciones climáticas, ya que las bajas temperaturas o lluvias constantes suprimen su actividad de forrajeo (Root, 1984). Debido a lo anterior, los mejores avistamientos fueron al medio día, particularmente en días soleados.
Para mejorar la producción apícola, se requiere conocer la flora melífera en las zonas donde se desarrolla esta actividad (Root, 1984), con la finalidad de realizar acciones de conservación, cuidado y mejoramiento en las estrategias de producción de miel. El conocimiento de las épocas de floración generado a través de la elaboración de calendarios florales permitirá conocer los tiempos en que las abejas tendrán alimento disponible en el campo, así como la temporada en que será necesario suministrar alimento a las colmenas durante los periodos de nula y escasa floración. Por este motivo, las plantas melíferas juegan un papel importante no solo en los ecosistemas, sino también para el sector apícola. No obstante, la erradicación manual o con herbicidas de las especies melíferas que son consideradas malezas disminuye la disponibilidad de recursos para las abejas, situación que se agrava cuando se presentan plagas de chapulines o pulgones que las defolian o afectan su desarrollo al succionar la savia, provocando con ello retrasos o ausencia de floración. La flora melífera también es perjudicada por el cambio de uso de suelo, principalmente para el establecimiento de huertas de aguacate (Figs. 6A-C). Con base en lo anterior, el presente trabajo busca ser una herramienta de consulta para los apicultores de Pátzcuaro y zonas vecinas, con el fin de que se inicien acciones de conservación de las plantas de interés apícola, lo cual se verá reflejado no solo en sus cosechas, sino también en el cuidado y conservación de la flora de la región.











 nueva página del texto (beta)
nueva página del texto (beta)



