Introducción
Vivimos en un mundo modificado, casi en su totalidad, por el humano (Vitousek et al., 1997; Hobbs et al., 2006, 2009). La principal causa de esta modificación es la destrucción de hábitats por el cambio de uso del suelo, motivado por el aumento de la frontera agropecuaria (Primack et al., 2000; Challenger y Dirzo, 2009; Laurance, 2010). Cada vez más predominan grandes extensiones de cultivos y pastizales donde se encuentran inmersas pequeñas áreas de vegetación original, las cuales tienen el potencial de resguardar al menos parte de la biodiversidad.
Se ha estimado que la mayor parte de la biodiversidad se encontrará en paisajes con algún grado de perturbación, o bien conservados, pero aislados (Vandermeer y Perfecto, 2007; Gardner et al., 2009). Lo anterior está perfectamente representado en las regiones tropicales del mundo, como es el caso de México, donde desde la década de 1970 se comenzó a documentar el proceso de degradación de las selvas tropicales por el impulso de un modelo de producción basado en el establecimiento de monocultivos y de la proliferación de la ganadería (Gómez-Pompa et al., 1972). Las actividades humanas regularmente tienen impactos negativos en los ecosistemas, llevándolos desde cambios en su estructura y composición de especies hasta su total desaparición. Desde hace unos años, hasta el día de hoy, se ha empezado a mostrar más interés en este tipo de ecosistemas, especialmente porque se ha demostrado que se encuentran muy amenazados (Trejo y Dirzo, 2000). De acuerdo con Trejo (2005), la tasa de deforestación en las selvas tropicales puede ser equiparado con la que se reporta para las selvas húmedas, las cuales están catalogadas como uno de los ecosistemas más amenazados.
El enfocar los esfuerzos de conservación y reconocimiento de la biodiversidad en ambientes alterados es una perspectiva real en un escenario de degradación contemporánea (Foley et al., 2005; Lindenmayer y Fischer, 2006; Wu y Hobbs, 2007; Hobbs et al., 2009; Kareiva y Marvier, 2011). Es un hecho que un paisaje con mayor complejidad estructural (dada por la presencia de fragmentos de vegetación en diferentes estados de sucesión, áreas de cultivo, zonas riparias y acahuales) podrá mantener una mayor biodiversidad (Lindenmayer y Fischer, 2006). Por lo menos tres beneficios se pueden mencionar de lo anterior: proveer de hábitat para algunas especies, permitir una mayor conectividad en el paisaje y reducir el efecto de borde (Fischer et al., 2006). Esta heterogeneidad del paisaje propiciará una mayor biodiversidad y por lo tanto una mayor redundancia ecológica que permita el mantenimiento de las funciones principales del ecosistema, y como consecuencia que tenga una mayor resiliencia (Chazdon, 2003; Fahring, 2003; Fischer et al., 2006; Fischer y Lindenmayer, 2007; Vandermeer y Perfecto, 2007; Gardner et al., 2009).
Por otra parte, la proporción de territorio cubierta por vegetación original y su estado de conservación aportan elementos para entender la capacidad que tiene un paisaje antropizado en la retención de biodiversidad. Inclusive se ha llegado a postular que un paisaje puede mantener los procesos y funciones fundamentales, aun cuando su cobertura vegetal lo constituyan especies exóticas o introducidas con fines, por ejemplo, de producción de materias primas, como la madera (Hobbs et al., 2006). Sin embargo, lo ideal es mantener paisajes en producción con remanentes de vegetación original en una cantidad y arreglo espacial tal, que permitan el mantenimiento de la biodiversidad y de las funciones de los ecosistemas (Chazdon, 2003, 2008; Fischer et al., 2006; Lindenmayer et al., 2008; Gardner et al., 2009).
México aún conserva la mayor parte de su selva tropical seca a nivel continental, en cerca de 38% (Portillo-Quintero y Sánchez-Azofeifa, 2010), pero al mismo tiempo este tipo de ecosistemas está subrepresentado en el Sistema Nacional de Áreas Protegidas (SINAP) del país (CONABIO et al., 2007), por lo que lo convierte en uno de los ecosistemas más vulnerables. Es evidente que su estudio se hace prioritario para diseñar estrategias de conservación efectivas (Sánchez-Azofeita et al., 2005).
La selva tropical seca se distribuye, principalmente, por toda la costa del Pacífico Mexicano y se extiende por Centroamérica hasta llegar a Panamá (Balvanera et al., 2000; Griscom y Ashton, 2011). En nuestro país, se extiende desde Sonora hasta Chiapas, particularmente en la planicie costera de Oaxaca, en donde hasta hace 50 años constituía el principal tipo de vegetación (Miranda y Hernández-X., 1963; Rzedowski, 1978; Challenger, 1998). Sin embargo, fuertes procesos de transformación del hábitat han reducido este ecosistema a fragmentos de vegetación esparcidos en una matriz antrópica, dominada principalmente por áreas destinadas a la agricultura y ganadería. En la región de La Venta, Oaxaca, se ha estimado que hasta 2011, la selva tropical seca cubría 27% del paisaje, restringida principalmente en las áreas de la Sierra de Tolistoque (Muñoz-Jiménez, 2014).
El presente estudio se desarrolló en la región de La Venta, Oaxaca, que presenta una heterogeneidad del paisaje producto de un proceso de transformación que se ha intensificado en los últimos 60 años. El objetivo principal de este trabajo fue estimar la diversidad vegetal de especies leñosas en los elementos predominantes de paisaje para inferir cómo cada especie puede contribuir en la retención de la biodiversidad. Nuestra contribución central es reconocer cada uno de los elementos del paisaje como potenciales de retención de diversidad vegetal capaces de mantener procesos ecológicos relevantes para la funcionalidad del ecosistema.
Materiales y Métodos
Área de estudio
El presente trabajo se realizó en la región de La Venta, municipio Juchitán de Zaragoza, Oaxaca, en la región fisiográfico-florística Istmo de Tehuantepec, México (García-Mendoza y Torres-Colin, 1999). El área de estudio se localiza entre las coordenadas 16°41'37", 16°26'45" de latitud norte y 94°52'41", 94°38'30" de longitud oeste; forma parte de la provincia fisiográfica Sierra Madre de Chiapas. Esta área está delimitada por cuatro microcuencas que abarcan una superficie total de 34,017 hectáreas (Fig. 1).
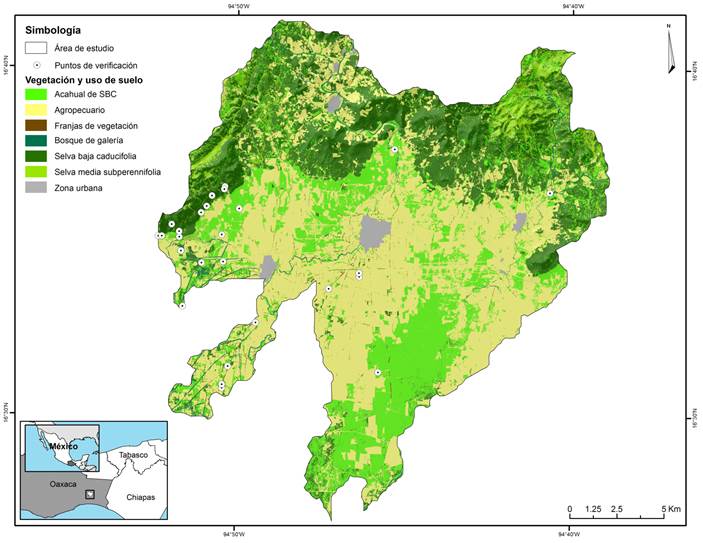
Figura 1: Área de estudio en la planicie costera de Oaxaca, México. Se señalan los sitios de muestreo seleccionados en cada elemento del paisaje donde se establecieron los cuadrantes de 50 × 2 m. SBC=Selva baja caducifolia.
El clima es cálido subhúmedo, con régimen de lluvias en verano (García, 1988), temperatura media anual superior a 26 °C y temperatura media del mes más frío nunca inferior a 18 °C. La precipitación media anual es de 823 mm; la precipitación media mensual varía considerablemente entre la temporada de secas y de lluvias, con valores medios entre 1.1 mm en enero y 201 mm en septiembre, siendo agosto y septiembre los meses con mayor precipitación (CONAGUA, 2010).
Actualmente, lo que predomina en el paisaje son las actividades agropecuarias en extensas superficies donde se pueden apreciar fragmentos de vegetación, principalmente de acahuales de selva baja caducifolia, que fue la vegetación que originalmente se distribuía por toda la planicie costera oaxaqueña (Miranda y Hernández-X., 1963; Rzedowski, 1978; Challenger, 1998).
Selección de sitios
La selección de los sitios para evaluar la diversidad vegetal del paisaje antropizado se realizó con la ayuda de una imagen de satélite clasificada y validada en campo. La imagen de satélite utilizada fue de alta resolución espacial (10 m en bandas multi-espectrales y 2.5 m en pancromáticas) tomada por el satélite SPOT el 28 de abril de 2011 (Muñoz-Jiménez, 2014). Con el análisis espectral de la imagen y con visitas de verificación en campo se lograron identificar siete clases o elementos del paisaje: selva mediana subperennifolia (SMS), selva baja caducifolia (SBC), acahual de SBC (ASBC), bosque de galería (BG), franjas de vegetación (FV), área agropecuaria (AGRO) y zona urbana (ZU); ésta última fue excluida de los análisis.
De manera sistemática se seleccionaron tres sitios (réplicas) por cada elemento de vegetación muestreado, verificando una distancia mínima de 1.5 km entre cada sitio para lograr una independencia entre ellos (Fig. 1).
Muestreo de la vegetación
Con la finalidad de determinar la composición, riqueza y diversidad de la vegetación presente en cada elemento de paisaje y en cada sitio de muestreo, se establecieron cinco transectos de 50 × 2 m dentro de los cuales cada planta >1 cm de diámetro a la altura del pecho (DAP) fue contabilizada, se registró el nombre de la especie y su DAP (Gentry, 1982; 1988). Las especies se identificaron basándose en los trabajos de Miranda y Hernández-X. (1963), Lorence y García-Mendoza (1989) y Cronquist (1981). Todos los nombres de las plantas y los autores fueron verificados en la base de datos de TROPICOS (2016) y el trabajo de Villaseñor (2016). En total, en cada elemento del paisaje se establecieron 15 transectos (tres réplicas por cinco transectos por réplica) obteniendo un área total de 0.15 ha que es un parámetro recomendado para describir la vegetación con un buen grado de representatividad.
Este método ha sido aplicado principalmente en las regiones neotropicales, más que en cualquier otra parte del mundo y ha sido empleado para comparar los patrones de diversidad de especies (Phillips y Miller, 2002).
Todos los ejemplares fueron resguardados en el Herbario del Centro de Investigaciones Tropicales de la Universidad Veracruzana (CITRO-UV). Las morfoespecies no se colectaron, sólo se registraron en campo. Éstas no se incluyeron para los análisis de diversidad.
Análisis de datos
Estimación de la diversidad alfa y beta
El esfuerzo de muestreo fue evaluado usando curvas de acumulación de especies y estimadores de riqueza por el estimador no paramétrico Chao1, que utiliza datos de abundancia de las especies (Colwell y Coddington, 1994; Escalante, 2003; Danoff-Burg y Chen, 2005). La construcción de las curvas de acumulación y las estimaciones de la riqueza se realizaron con el Programa EstimateS 7.52 (Colwell, 2000).
Para cada elemento de paisaje se calculó la diversidad de especies aplicando el índice de Shannon-Wiener (Magurran, 2003). Para su obtención se utilizó el número de individuos registrados en cada muestra. Para probar diferencias significativas entre la diversidad calculada para cada elemento del paisaje se aplico el método desarrollado por Hutcheson (1970) que emplea el estadístico t-student.
Para describir la composición de la comunidad vegetal presente en cada elemento de paisaje se calculó el índice de valor de importancia (IVI) de cada especie. Esta función se obtuvo mediante la siguiente fórmula:
IVI = DR + FR + DoR
Dónde:
DR=número de individuos/1000 m2 × 100
FR=número de transectos en los que aparece la especie/número total de transectos × 100
DoR=Área basal de todos los individuos de la especie/Área basal de toda la comunidad × 100
En consecuencia, al valor máximo de importancia para el contingente de especies con DAP>1 cm será 300%. Para fines de presentación de las gráficas, el IVI se relativizó de nuevo a 100%.
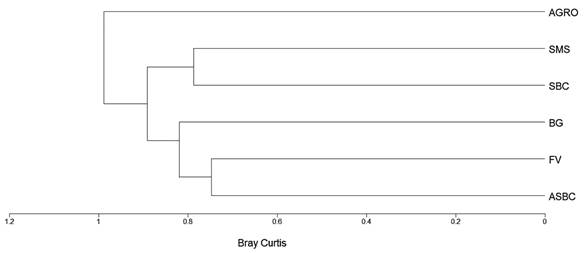
La diversidad beta que resguarda el paisaje antropizado en el estudio se calculó por medio del índice de disimilitud de Bray-Curtis. Éste es una medida de distancia y toma valores de 0 cuando un par de objetos (muestras) comparten las mismas especies y hasta infinito cuando no comparten ninguna. Para el cálculo del índice se utilizaron los valores de abundancia. El cálculo y la representación gráfica de las distancias (dendrograma) entre los elementos del paisaje fueron realizados usando el Programa MVSP 3.1 (Kovach Computing Services, 2018) seleccionando el algoritmo de agrupación llamado Centroide o Punto Medio No Ponderado (UPGMA) que es el más empleado en estudios de comunidades vegetales (Zar, 1998).
Resultados
Riqueza y composición florística
Se registró un total de 303 taxones en los seis elementos que comprenden el paisaje antropizado (Apéndice). De estos, 231 fueron identificados hasta nivel de especie, 38 a nivel de género y 34 se catalogaron como morfoespecies debido a dificultades en la identificación taxonómica. La SMS fue el elemento con mayor riqueza a todos los niveles taxonómicos, mientras que AGRO fue la más pobre con sólo 10 especies pertenecientes a siete géneros y cuatro familias (Cuadro 1).
Cuadro 1: Resumen de la riqueza florística de plantas con DAP>1 cm en el muestreo de 0.15 ha y promedio de especies por transecto (100 m2) en los seis elementos de paisaje. DE=Desviación Estándar. SMS=selva mediana subperennifolia; SBC=selva baja caducifolia; BG=bosque de galería; ASBC=acahual de selva baja caducifolia; FV=franjas de vegetación; AGRO=área agropecuaria.
| Elemento del paisaje | superficie (ha) | superficie % | Núm. de familias | Núm. de géneros | Núm. de especies | Promedio de especies por 100m2 | DE +/- |
| SMS | 1381.06 | 5 | 48 | 99 | 131 | 23 | 4 |
| SBC | 7819.25 | 23 | 32 | 78 | 114 | 22 | 5 |
| BG | 403.41 | 1 | 31 | 64 | 91 | 12 | 5 |
| ASBC | 8604.24 | 26 | 29 | 52 | 77 | 16 | 7 |
| FV | 329.62 | 1 | 25 | 36 | 48 | 11 | 3 |
| AGRO | 15,050.98 | 44 | 4 | 7 | 10 | 4 | 5 |
| Total | 34,017.00 | 100.00 | 57 | 156 | 303 | 15 | 8 |
En general la familia Fabaceae fue la mejor representada con 17% de las especies registradas en total. Le siguieron Euphorbiaceae (8%), Malpighiaceae (5.2%), Rubiaceae (5.2%) y Bignoniaceae (4.8%). Fabaceae también fue la mejor representada dentro de cada uno de los elementos del paisaje, excepto en la SMS donde ocupó el segundo lugar. Considerando las 10 familias mejor representadas en cada tipo de vegetación, destaca una composición diferencial, siendo Fabaceae el único elemento común a estos.
Tomando en cuenta las formas de vida en cada uno de los elementos, el grupo de los árboles es el mejor representado a escala del paisaje. Para las especies de SBC y SMS las especies arbóreas estuvieron representadas por 45 y 44% respectivamente. Esta tendencia se repitió para el BG donde se encontró que 45% de las especies correspondieron a esa forma de vida. También en el ASBC los árboles estuvieron ampliamente representados (34%); sin embargo, los arbustos son componentes importantes a nivel de especie (30%). Para la FV y AGRO la forma arbustiva fue la mejor representada (Fig. 2).
Estimación de la diversidad α
En las curvas de acumulación de especies se obtuvieron valores por debajo de los esperados del estimador Chao1. Sin embargo, se observó una tendencia general cercana a la asíntota para la mayoría de los elementos muestreados, excepto SBC en la cual se obtuvo un déficit de 49% de especies según el estimador Chao1 y la curva no alcanzó la asíntota (Cuadro 2). Los tipos de vegetación donde los muestreos fueron más completos, de acuerdo con los estimadores, fueron la FV (84% de las especies), SMS y ASBC (79% de las especies en ambos casos).
Cuadro 2: Complementariedad de especies en los seis elementos del paisaje con respecto al estimador Chao1 y sus Intervalos de Confianza (CI). SBC=selva baja caducifolia.
| Elemento del paisaje | Especies observadas | Estimador | ||
| 95% CI (límite inferior) | Chao1 | 95% CI (límite superior) | ||
| SMS | 131 | 170 | 191 | 230 |
| % registrado | 66 | |||
| SBC | 114 | 176 | 241 | 385 |
| % registrado | 47 | |||
| BG | 91 | 118 | 142 | 195 |
| % registrado | 64 | |||
| ASBC | 77 | 92 | 106 | 140 |
| % registrado | 73 | |||
| FV | 48 | 52 | 58 | 81 |
| % registrado | 83 | |||
| AGRO | 10 | 11 | 13 | 32 |
| % registrado | 77 | |||
La riqueza específica aumentó conforme la vegetación se presenta en mejor estado de conservación: la dirección del gradiente de la riqueza de especies fue SMS>SBC>BG>ASBC>FV>AGRO. La SMS presentó 18% más especies que el siguiente elemento conservado (SBC), el elemento que menos especies presentó fue AGRO con sólo 10 especies, es decir 15 veces menos que el elemento con mayor riqueza específica (Cuadro 3).
Cuadro 3: Valores de riqueza y diversidad de especies de acuerdo con el índice de Shannon-Wiener (H´) y de Equitatividad (E) en cada elemento de paisaje. Letras superíndices diferentes asume diferencias estadísticamente significativas a p<0.05. SMS=selva mediana subperennifolia; SBC=selva baja caducifolia; BG=bosque de galería; ASBC=acahual de selva baja caducifolia; FV=franjas de vegetación; AGRO=área agropecuaria.
| Elemento del paisaje | Riqueza | Núm. de Individuos | Índice de Shannon-Wiener | ||
| H´ | E | Varianza | |||
| SMS | 131 | 618 | 4.35a | 0.891 | 0.00153 |
| SBC | 114 | 926 | 3.80b | 0.802 | 0.00165 |
| BG | 91 | 444 | 3.63b,d | 0.804 | 0.00452 |
| ASBC | 77 | 724 | 3.53a,b,c | 0.812 | 0.00179 |
| FV | 48 | 605 | 2.99c, d | 0.773 | 0.00188 |
| AGRO | 10 | 66 | 1.32e | 0.572 | 0.02066 |
En términos de diversidad se repitió el mismo gradiente. De acuerdo con los valores obtenidos del índice de Shannon-Wiener, la SMS fue el elemento que albergó mayor diversidad (H´=4.35) y AGRO el de menor diversidad (H´=1.32). Así mismo, el BG registró una notable riqueza específica (91) y diversidad (H´=3.63), a pesar de que ocupa una superficie reducida dentro de paisaje. Finalmente, también se observó el mismo gradiente para los valores de equidad, en donde la SMS presentó valores cercanos a 1 mientras que AGRO mostró la menor con valores de 0.572 (Cuadro 3).
Al comparar los índices de diversidad mediante la prueba de t de Hutcheson, encontramos que AGRO fue el elemento con menor diversidad pues mostró diferencias significativas con todos los elementos. Por otro lado, SMS muestra diferencias con todos los elementos excepto con ASBC. Cabe resaltar que la SBC no difiere en términos de diversidad ni con BG ni con ASBC (Cuadro 3).
Análisis de los índices de valores de importancia (IVI)
Selva mediana subperennifolia (SMS)
En este elemento se encontró que la especie más importante fue Phyllostylon sp., la cual aporta 11% del IVI de toda la SMS; este alto valor está determinado principalmente en términos de área basal debido a que son árboles de gran envergadura. La siguiente especie en importancia fue Jacaratia mexicana A. DC. (8%), seguida de Pterocarpus rohrii Vahl (6%). En conjunto, estas tres especies suman 25% del IVI total. Otras especies que contribuyen cada una con 3% del valor total son Ficus cotinifolia Kunth, Allophylus cominia (L.) Sw. y Recchia mexicana Moc. & Sessé ex DC.; todas ellas presentan valores altos de área basal. En este elemento de paisaje encontramos 112 especies que contribuyen de manera individual con menos de 3% del IVI total y en conjunto suman 49%. En general, las 15 especies mejor representadas en la zona están asociadas con áreas de vegetación primaria, con excepción de Sapium lateriflorum Hemsl., la cual generalmente se asocia a zonas perturbadas.
Selva baja caducifolia (SBC)
En este elemento del paisaje se registró que la especie más importante fue Allophylus cominia, la cual por si sola aporta 19% del IVI total de toda el área muestreada para este elemento; este valor alto está determinado principalmente en términos de área basal. La siguiente especie en importancia fue Simira rhodoclada (Standl.) Steyerm., cuyo 7% de IVI está determinado tanto por sus valores de área basal como de su abundancia relativa. Por su parte, Croton ovalifolius Vahl y Allophylus sp. presentaron un IVI de 6 y 5% respectivamente. En total, estas cuatro especies suman 37% del IVI total. Resalta como un componente estructural y fisonómico Acanthocereus sp., cactácea columnar típica de selvas bajas; su contribución al IVI (2%) fue principalmente en términos de área basal.
Otras especies que contribuyeron con entre 3 y 2% con el IVI total fueron Vachellia pennatula (Schltdl. & Cham.) Seigler & Ebinger, Erythroxylum areolatum L., Chione venosa (Sw.) Urb., Lonchocarpus rugosus Benth. y Croton arboreus Millsp. En general, todas las especies están asociadas a bosques primarios excepto Cnidoscolus multilobus (Pax) I.M. Johnst. que está asociada a ambientes modificados. Resalta que dentro de las primeras 15 especies, cuatro son arbustivas y logran sumar 18% del IVI total. Esta forma de vida resulta estructuralmente importante en este elemento de paisaje.
Bosque de galería (BG)
En este elemento se encontró que la especie más importante fue Guazuma ulmifolia Lam., por si sola aporta 12% del IVI total en este elemento; este valor alto está determinado principalmente en términos de área basal. Esta especie es de carácter heliófilo y es compatible con la apertura que puede llegar a tener este tipo de vegetación. Las siguientes especies en importancia fueron Matayba oppositifolia Britton y Astianthus viminalis Baill. con 11 y 10% respectivamente cuyo IVI está determinado tanto por su valor de área basal como por su abundancia relativa. Por su parte, Exothea paniculata (Juss.) Radlk. y Pithecellobium dulce (Roxb.) Benth. presentaron un IVI de 7 y 4% respectivamente. En total, estas cinco especies suman 45% del valor de IVI. Las 82 especies restantes que fueron registradas en este elemento de paisaje contribuyeron con 36% del IVI total.
Como se esperaba, en el grupo de las primeras 15 resaltan especies propias de vegetación ribereña tales como Matayba glaberrima Radlk., Matayba oppositifolia, Exothea paniculata, Astianthus viminalis y Ficus yoponensis Desv., las cuales aportan 31.5% del IVI total en este elemento de paisaje.
Acahual de selva baja caducifolia (ASBC)
En este elemento se registró que la especie más importante fue Vachellia pennatula, la cual aporta 17% del IVI del total calculado para el ASBC; este alto valor está determinado principalmente en términos de área basal. La siguiente especie en importancia es Lysiloma divaricatum (Jacq.) J.F. Macbr. (8%) seguida de Croton ovalifolius y Gliricidia sepium (Jacq.) Kunth con 6% de IVI cada una. En conjunto, estas cuatro especies suman 32% del IVI total. En este elemento del paisaje encontramos 69 especies que contribuyen de manera individual con menos de 1% de IVI total y en conjunto suman 33%; la mayoría de estas especies contribuyen por efecto de su frecuencia y abundancia debido a que poseen poca área basal. Dentro de las primeras 15, ocho especies son características de vegetación alterada y representan 48% del IVI total. No obstante, también se reconocieron especies con afinidades de zonas conservadas; por ejemplo, Erythroxylum havanense Jacq. Además, también se registró Sabal mexicana Mart., una especie con afinidad al disturbio la cual puede cambiar la fisonomía de este tipo de sitios.
Franjas de vegetación (FV)
En este elemento se encontró que la especie más importante fue Guazuma ulmifolia que aporta 20.5% del IVI de toda la zona; este alto valor está determinado principalmente en términos de área basal. La siguiente especie en importancia es Pithecellobium dulce (11%) seguida de Croton ovalifolius y Enterolobium cyclocarpum (Jacq.) Griseb. con 8% del IVI cada una. En conjunto, estas cuatro especies suman 47.6% del IVI total. En este elemento de paisaje se registraron 34 especies que de manera individual contribuyen con menos de 1% de IVI total y en conjunto suman 16%; la mayoría de estas especies contribuyen por efecto de área basal. Debido a su origen (vegetación de galería promovida por el manejo de canales de riego), las especies presentes tienen una afinidad heliófila y muchas de ellas son resistentes al ramoneo (Pithecellobium dulce, P. lanceolatum Benth. y Sabal mexicana).
Área agropecuaria (AGRO)
En este elemento la especie más importante fue Sabal mexicana, la cual aporta 42% del IVI de toda el área agropecuaria; este valor está determinado principalmente en términos de área basal. La siguiente especie en importancia fue Vachellia farnesiana (L.) Wight & Arn. (35%) y en tercer lugar Vachellia pennatula aportó 5% en su valor de importancia. Las especies restantes (7) sólo contribuyen con 23% del IVI total. Todas las especies registradas en este elemento se ven favorecidas por los disturbios.
Estimación de la diversidad β
Los valores calculados con el índice de Bray-Curtis (IBC) en todos los casos resultaron valores cercanos a 1, lo que indica que en el paisaje de estudio existe un marcado recambio de especies entre los seis elementos del paisaje. Los elementos que presentaron menores valores de disimilitud fueron ASBC y FV (IBC: 0.744) que comparten 24 especies, seguidos de la SMS y SBC (IBC: 0.784) y que compartieron 57 especies. El BG presentó más afinidad de especies con el ASBC y FV, aunque con bajos valores de disimilitud (IBC: 0.816). El BG compartió 27 especies con el ASBC y 22 con la FV. El AGRO fue el elemento del paisaje que presentó una composición distinta con todos los elementos del paisaje (IBC: 0.988) compartiendo pocas especies con cada uno de ellos (Cuadro 4, Fig. 3).
Cuadro 4: Matriz con los valores de disimilaridad de Bray-Curtis (de la diagonal hacia la izquierda y hacia abajo) y especies compartidas entre cada uno de los elementos del paisaje (diagonal a la derecha y hacia arriba), la diagonal en negritas indica el número de especies en cada elemento del paisaje. SMS=selva mediana subperennifolia; SBC=selva baja caducifolia; BG=bosque de galería; ASBC=acahual de selva baja caducifolia; FV=franjas de vegetación; AGRO=área agropecuaria.
| Elemento del paisaje | SMS | SBC | ASBC | BG | FV | AGRO |
| SMS | 131 | 57 | 30 | 34 | 12 | 3 |
| SBC | 0.784 | 114 | 42 | 35 | 17 | 4 |
| ASBC | 0.899 | 0.798 | 91 | 27 | 24 | 8 |
| BG | 0.888 | 0.897 | 0.812 | 77 | 22 | 6 |
| FV | 0.943 | 0.9 | 0.744 | 0.819 | 48 | 7 |
| AGRO | 0.982 | 0.988 | 0.93 | 0.968 | 0.929 | 10 |
Discusión
La historia de transformación de La Venta, Oaxaca, se ha intensificado en los últimos 60 años, resultando en la pérdida de cobertura vegetal original, principalmente de la selva baja caducifolia, lo cual puede significar una pérdida de riqueza y diversidad de especies vegetales (Pérez-García et al., 2001; Muñoz-Jiménez, 2014). Los resultados de este trabajo demuestran que, pese a la alteración de la zona, en el paisaje todavía se puede encontrar una diversidad de vegetación importante. Las especies registradas están concentradas principalmente en las serranías, cubiertas por selva baja caducifolia y en las partes de las cañadas con selva mediana subperennifolia; esta última resulta ser el elemento del paisaje más diverso. La riqueza general de especies de plantas equivale al 60% de la reportada (n=746) para la región de Nizanda, localizada a 10 km al oeste del área de estudio (López-Olmedo et al., 2006), pero 38% mayor a la registrada (n=204) en bosques tropicales secos de Centroamérica (Gillespie et al., 2000).
La diversidad de plantas también se distribuye en acahuales, bosques de galería e inclusive en pequeñas franjas de vegetación. A pesar de cubrir un bajo porcentaje de paisaje (<1%), dichos elementos aportan una cantidad notable de especies de plantas, principalmente el elemento del paisaje de bosque de galería, el cual alberga 94 especies de plantas leñosas, riqueza usualmente ignorada en términos de conservación.
Los patrones de composición, estructura, riqueza y diversidad reportados en este estudio concuerdan con lo descrito para los bosques tropicales secos que se caracterizan por presentar una alta densidad de especies por cada 100 m2, una variación de la riqueza y diversidad entre sitios, así como un alto valor de recambio o diversidad β (Gillespie et al., 2000; Kalacska et al., 2004; Trejo, 2005). Con excepción de la familia Fabaceae, que fue la familia mejor representada en todos los elementos del paisaje (excepto en SMS), las familias de plantas registradas cambian en su presencia y representatividad. Esta familia se reconoce como el componente dominante en los bosques tropicales secos de México y Centroamérica (Rzedowski, 1978). Considerando los valores de importancia de las especies en cada elemento del paisaje, no se observó una dominancia de alguna especie común entre los elementos. La dominancia específica cambia en todos los elementos de paisaje. Ni siquiera las especies del género Bursera Jacq. ex L. obtuvieron los mayores valores de importancia a pesar de que suele ser el género dominante en las selvas tropicales secas de México (Pennington y Sarukhán, 1998; Balvanera et al., 2000).
El análisis de la diversidad β obtuvo un valor elevado, lo cual sugiere que los elementos de paisaje comparten poco la composición de especies, y de hecho es característico de las selvas secas donde se ha reportado una alta variación de la riqueza de especies entre sitios (Rzedowski, 1998; Balvanera et al., 2002; Kalacska et al., 2004; Sánchez-Azofeifa et al., 2005; Miles et al., 2006). Esto concuerda también con el estudio de Trejo y Dirzo (2000), quienes reportaron un importante recambio de especies teniendo como consecuencia valores altos de diversidad regional (diversidad β y γ).
Lo anterior se ha asociado a la heterogeneidad ambiental característica de las regiones donde se establece la selva baja caducifolia (Trejo y Dirzo, 2002). También se pudo observar una clara distinción de las especies asociadas a la SBC del resto de los componentes del paisaje. Este dato es contrario a lo esperado, ya que se hipotetizaba que la SBC sería el inóculo de diversidad vegetal que “provee” de propágulos a las zonas alteradas dentro del paisaje. Es decir, las zonas alteradas son nichos nuevos para especies pioneras o invasoras que logran establecerse y detonar procesos de sucesión natural (Fischer y Lindemayer, 2007; Griscom y Ashton, 2011).
Por otro lado, es indudable la capacidad de resguardo de diversidad que tienen las zonas bien conservadas; por ejemplo, la gran mayoría de las especies en SMS y SBC representan valores bajos de IVI (90 y 87% respectivamente), lo cual está asociado con alta resiliencia del sistema que se incrementa en las siguientes etapas sucesionales como en los ASBC (Díaz y Cabido, 2001). Esta capacidad es compartida en el bosque de galería en donde 84% de las especies tienen valores de importancia menores a 3%. Tal reserva de especies se va perdiendo en zonas totalmente antrópicas, ya que para las FV, 69% de las especies tiene valores pequeños de IVI (aumentando la dominancia de pocas especies), y para la AGRO se registró una baja riqueza de especies (n=10) con valores bajos de IVI, es decir, representa el elemento con el mayor grado de antropización.
La zona con vegetación mejor conservada por los atributos ecológicos medidos en el presente estudio se concentra principalmente en la Sierra de Tolistoque. La Sierra de Tolistoque está cubierta principalmente por SBC y en las partes de las cañadas por la SMS. Esta misma configuración de los dos mencionados elementos del paisaje fue descrita en la región de Nizanda (Pérez-García et al., 2001). Se debe resaltar que, a pesar de que la SMS ocupa un porcentaje pequeño del paisaje antropizado, alberga la mayor riqueza florística, además de caracterizarse por una mayor complejidad estructural que debe estar creando condiciones microambientales propicias para el mantenimiento de biodiversidad (Challenger y Soberón, 2009).
Tomando en cuenta la riqueza específica registrada en cada elemento de paisaje se puede establecer un gradiente que va de las zonas mejor conservadas en la Sierra de Tolistoque a las más perturbadas, representadas por las áreas agropecuarias. Entre estos dos extremos destacan el bosque de galería y las franjas de vegetación por su importancia en el mantenimiento de la funcionalidad y continuidad de los procesos del ecosistema, que han sido ampliamente estudiados principalmente para las selvas húmedas (Harvey et al., 2004). Se ha documentado que aún elementos que proporcionalmente cubren un bajo porcentaje del paisaje pueden albergar una riqueza alta de especies de plantas. Por ejemplo, en la región de Los Tuxtlas, los cercos vivos, similares en forma a las franjas de vegetación descritas en este estudio, albergan un importante componente de especies de la vegetación original (Dirzo et al., 2009). Más allá de la riqueza que se reporta en las cercas vivas, está la composición de especies, registrándose especies propias de la vegetación primaria, que proveen de recursos (alimento y refugio) a la vida silvestre, haciendo la matriz de paisaje menos inhóspita para la fauna silvestre que aún se registra por esa región (Harvey et al., 2004; Pejchar et al., 2008; Pulido y Renfijo, 2011). Es probable que el bosque de galería y las franjas de vegetación descritas en este estudio estén jugando una función similar a la descrita en esa región del trópico mexicano.
Cada uno de los elementos del paisaje descritos probablemente esté jugando un papel importante en la retención de biodiversidad. Por un lado, los elementos como la SMS y la SBC pueden estar funcionando como fuentes de alimentación y refugio de especies de flora y fauna más asociadas a hábitats conservados, mientras que el BG y las FV pueden estar contribuyendo a la conectividad del paisaje, al funcionar como corredores biológicos o puntos de relevo. Entre tanto, la presencia de acahuales de varias edades puede representar refugio de las especies con menos movilidad presentes en la planicie y, por lo tanto, su mantenimiento dentro del paisaje se hace prioritario para la conservación de la biodiversidad regional (Fisher et al., 2006; Arroyo-Rodríguez et al., 2009).











 nueva página del texto (beta)
nueva página del texto (beta)