Introducción
La familia Asteraceae presenta una distribución cosmopolita, en Sudamérica integra 20% de la flora en zona andina y patagónica; las especies de esta familia son abundantes en regiones montañosas y zonas áridas, mientras que en la selva tropical son escasas (Cabrera, 1978; Stevens, 2001onwards). En Argentina la familia cuenta con 222 géneros y 1490 especies (Zuloaga y Morrone, 1999; Katinas et al., 2007) distribuidas en tres subfamilias: Barnadesioideae, Asteroideae y Cichorioideae, y 17 tribus (Katinas et al., 2007). En la subfamilia Asteroideae tribu Helenieae se encuentra el género Flaveria Juss. (Novara y Petenatti, 2000).
Flaveria posee 23 especies americanas, distribuidas desde el centro y sur de los Estados Unidos de América hasta el norte de Centroamérica y el Caribe, y desde Venezuela hasta el centro de Argentina (Powell, 1978). Morfológicamente, el género se caracteriza por la similitud y reducción de sus partes florales en numerosas especies, por lo que los caracteres para la identificación de sus especies se basan en su distribución, hábitat, follaje, número de capítulos y presencia y/o ausencia de flores liguladas (Powell, 1978). Este género ha sido ampliamente estudiado por presentar especies con metabolismo fotosíntetico C3, C4 y formas intermedias (Powell, 1978).
Flaveria bidentis (L.) Kuntze y F. haumanii Dimitri & Orfila son las únicas especies representantes del género en Argentina, se distribuyen en las regiones noroeste, noreste, Cuyo, Pampeana y Patagónica. Flaveria bidentis habita entre 0-3000 m s.n.m, mientras que F. haumanii entre 0-1500 m s.n.m. (Bártoli et al., 2008). Ambos taxones son hierbas nativas, anuales, con ramificaciones simpódicas dicotómicas; hojas opuestas sésiles, lanceoladas, trinervadas y aserradas. Flaveria bidentis presenta una altura de 1.20 m o más, con hojas anchamente lanceoladas y los capítulos dispuestos en cimas densas, mientras que F. haumanii alcanza una altura de 0.60 m, con hojas angostamente lanceoladas y los capítulos dispuestos en cimas laxas (Petenatti y Ariza Espinar, 1997; Zuloaga y Morrone, 1999; Novara y Petenatti, 2000; Bártoli et al., 2008).
Flaveria bidentis y F. haumanii son vulgarmente conocidas como “balda”, “fique”, “contrayerba”, “flor amarilla” y “mata gusano”, habitan orillas de ríos y lagunas, suelen encontrarse en terrenos modificados, márgenes de caminos y en campos de cultivo (Novara y Petenatti, 2000).
Ambas especies se utilizan para aliviar diversas dolencias, empleándoselas como alexifármaco, emenagogo, digestivo, excitante, tónico, antiparasitario, antidiarreico, antitusígeno, antiséptico y, además, como insecticida (Novara y Petenatti, 2000; Pastor de Abram y Zelada, 2006). Sus flores y hojas son utilizadas como colorantes para teñir diversos tejidos de color amarillo, naranja y verde; ocasionalmente se utilizan como plantas ornamentales (Katinas y Gutiérrez, 2013). Desde el punto de vista agroecológico F. bidentis es considerada maleza de cultivos de soja, de caña de azúcar y de hortalizas (Parra et al., 2006, 2007), mientras que F. haumanii no se considera como tal.
Los antecedentes anatómicos para la familia son citados por Metcalfe y Chalk (1950), quienes hacen referencia a los tipos de estomas anomocíticos y anisocíticos; mientras que para Flaveria citan la presencia de canales con resina en el córtex o la endodermis del tallo, que a veces se extiende a la lámina de la hoja. Petenatti et al. (2005) determinaron el índice estomático y número de estomas en Flaveria bidentis y F. haumanii y analizaron su morfología foliar. Apóstolo (2005) menciona para F. bidentis la presencia de tricomas uniseriados, ceras epicuticulares, cristales y estructura Kranz.
Químicamente se ha informado que el género posee diversos flavonoides del grupo sulfatado, los más comunes son flavonas, flavonoles y sus glicósidos (Cabrera y Juliani, 1976, 1977, 1979; Powell, 1978; Varin et al., 1987; Agnese et al., 1999).
Debido a la escasa información acerca de la anatomía y química de estas especies, el objetivo del presente trabajo fue caracterizar la anatomía foliar y caulinar de Flaveria bidentis y F. haumanii, y cuantificar los constituyentes fenólicos foliares de ambas especies.
Materiales y Métodos
Área de estudio
El material vegetal correspondiente a hoja y tallo de Flaveria bidentis y F. haumanii fue recolectado en la provincia de Santiago del Estero (Argentina) en las localidades del Zanjón (27º51'05.89"S; 64º14'34.19"O) e Isla Verde (28°38'27.87"S; 64º05'12.35"O), respectivamente (Figs. 1A-C).
Material estudiado
Los materiales estudiados fueron depositados en el herbario fanerógamico de la Fundación Miguel Lillo (LIL).
Material examinado: Flaveria bidentis: ARGENTINA. Provincia Santiago del Estero, departamento San Pedro, localidad Zanjón, 27º51'05.89"S; 64º14'34.19"O, 09.V.2014, V. de los A. Páez s.n (LIL 613.740 A, B). Flaveria haumanii: ARGENTINA. Provincia Santiago del Estero, departamento Ojo de Agua, localidad Isla Verde, 28°38'27.87"S; 64º05'12.35"O, 09.V.2014, V. de los A. Páez s.n (LIL 613.733 A, B, C).
Anatomía foliar y caulinar
Para cada especie analizada se seleccionaron cinco individuos al azar; de cada uno de ellos se extrajeron cinco hojas maduras y cinco porciones de tallo correspondientes al sector medio de la planta. Las muestras foliares y caulinares fueron fijadas en FAA (ácido acético, formaldehido, agua y alcohol 1:2:7:10).
Para el análisis de las epidermis y venación foliar se empleó la técnica de diafanizado, propuesta por Dizeo de Strittmatter (D’Ambrogio de Argüeso, 1986); mientras que para la descripción de la venación foliar se utilizó la terminología de Hickey (1974).
Para el estudio estructural de la lámina y el tallo se realizaron cortes transversales y longitudinales a “mano libre”, en el primer caso de la porción media, mientras que en el tallo, los cortes fueron seriados en toda su longitud (D’Ambrogio de Argüeso, 1986). Las tinciones utilizadas fueron violeta de cresilo y una doble tinción de azul astra-safranina. Las pruebas histoquímicas empleadas fueron lugol para detección de almidón, y cloruro férrico para compuestos fenólicos (D’Ambrogio de Argüeso, 1986). Los preparados transitorios fueron montados en agua glicerina (1:1), de acuerdo a lo propuesto por D’Ambrogio de Argüeso (1986). Los preparados permanentes se obtuvieron de material vegetal fijado según Karnovsky (1965), que se deshidrataron pasando por una serie de alcoholes y acetona, se secaron con punto crítico y posteriormente se recubrieron con oro-paladio. (Dorador, Ion Spotter, JFC 1100 Joel Japón).
Para cada muestra foliar se analizaron 10 campos ópticos y se calcularon las siguientes variables, tanto en la superficie adaxial como abaxial: a) índice estomático (Wilkinson, 1979), b) densidad estomática (mm2), c) longitud de los tricomas (µm) y densidad (mm2), d) espesor de la epidermis y mesofilo (µm). Las variables cuantificadas en la muestra de tallo fueron: a) número de capas de los diferentes tejidos que forman la corteza, b) número de haces vasculares, c) número de conductos secretores. Todas las variables detalladas fueron realizadas en ambas especies.
Para la clasificación de los estomas se empleó la terminología propuesta por Dilcher (1974).
Las observaciones se realizaron en un microscopio estereoscópico (Olympus SZX7, Olympus Co., Tokio, Japón), microscopio óptico (Axiostar Plus, Carl Zeiss, Göttingen, Alemania), microscopio óptico de luz polarizada (AXIO Lab. A1, Carl Zeiss, Göttingen, Alemania), y microscopio electrónico de barrido (Zeiss Supra 55VP, Carl Zeiss, Oberkochen, Alemania) del Centro Integral de Microscopía Eléctronica (CIME) INSIBIO-UNT-CONICET. Las fotomicrografías fueron tomadas con cámara digital Canon, Power Shot A620, 7.1 M.P.
Los datos se examinaron estadísticamente mediante el análisis de varianza y pruebas de diferencias de medias con el test de Tukey (p<0.05). Se empleó el programa estadístico InfoStat versión 2012 (Di Rienzo et al., 2012).
Análisis fitoquímico foliar
Para el análisis fitoquímico, se emplearon 5 gramos de hojas secas de cada especie y se realizó una extracción asistida por microondas en tres etapas. Etapa 1: etanol 80%, etapa 2: etanol 50%, etapa 3: agua destilada. Los extractos fueron filtrados, el volumen del solvente se redujo en evaporador rotatorio (Rotavapor R-100 con bomba de vacio V-100, Büchi, Suiza), el remanente se secó en estufa (TDC40, Dalvo, China). Con cada extracto seco se calculó el rendimiento (Peso material vegetal seco/Peso extracto seco). Los extractos conservados a -4 ºC fueron analizados mediante técnicas fotocolorimétricas para determinar contenido total de: fenoles (FenT) (Singleton et al., 1999), flavonoides (FlavT) (Chang et al., 2002), ácidos hidroxicinámicos (AHCT) (Dao y Friedman, 1992) y orto-dihidroxifenoles (ODF) (Chang et al., 2002). La presencia de taninos, saponinas y alcaloides se estimó cualitativamente mediante el ensayo con albumina sérica bovina (Ricco et al., 2008), índice de espuma (Harborne, 1989) y reacción al tubo con el reactivo de Dragendorff, respectivamente (Farnsworth, 1996).
Para cada ensayo, las determinaciones fueron realizadas por triplicado y los valores presentados corresponden a la media y su desviación estándar.
Resultados
Arquitectura foliar
Las láminas de Flaveria bidentis (Fig. 2 A) y F. haumanii son enteras, elípticas angostas y simétricas con ápice y base aguda, de textura cartácea.
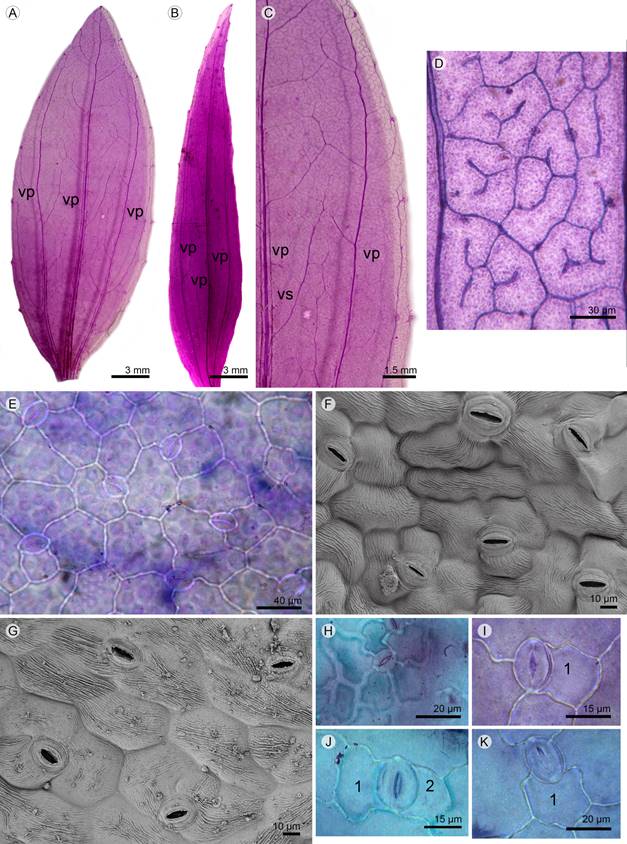
Figura 2: Venación y epidermis foliar de Flaveria bidentis (L.) Kuntze y F. haumanii Dimitri & Orfila, en vista superficial. A-D. venación: A. aspecto de la lámina elíptica simétrica en F. bidentis; B. aspecto de la lámina ovada lanceolada asimétrica en F. haumanii; C. detalle del margen crenado en F. bidentis; D. areola con vénula simple y ramificada una y dos veces en F. haumanii. E-K. anatomía foliar: E. epidermis adaxial de F. bidentis; F. epidermis abaxial de F. bidentis en MEB; G. epidermis abaxial de F. haumanii en MEB; H. estoma anomocítico; I. estoma hemiparacítico; J. estoma braquiparacitico; K. estoma polocítico. Abreviaciones: vp=vena primaria, vs=vena secundaria, 1 y 2=células subsidiarias.
En F. haumanii puede ser, además, ovada lanceolada y asimétrica (Fig. 2 B). El margen es suavemente crenado en F. bidentis (Fig. 2 C) y crenado en F. haumanii. Ambos taxones presentan una venación primaria trinervada, acródroma de posición basal, desarrollo perfecto y recorrido derecho; las venas principales laterales reducen su espesor desde la porción media hacia el ápice de la lámina; mientras que las venas secundarias presentan un ángulo de divergencia agudo, uniforme, de grosor delgado a capilar, con recorrido curvado uniformemente (Figs. 2A-C). La venación terciaria de F. bidentis y F. haumanii muestra un modelo reticulado al azar, mientras que la venación cuaternaria es de tamaño fino, con trayectoria en ángulo recto. Las areolas de ambas especies poseen disposición al azar, son de forma triangular, cuadrangular y poligonal; las vénulas, cuando están presentes, pueden ser simples curvadas y ramificadas una o dos veces (Fig. 2 D).
Anatomía foliar
En vista paradermal, la lámina foliar presenta células epidérmicas poliédricas, es anfiestomática y con cutícula estriada en las dos especies. En F. bidentis las células epidérmicas poseen paredes rectas a curvas en superficie adaxial (Fig. 2 E), mientras que en la superficie abaxial las paredes son levemente sinuosas (Fig. 2F). En F. haumanii las paredes de las células son rectas, curvas a levemente sinuosas en superficie adaxial y abaxial (Fig. 2 G). Los estomas presentes en las especies son de tipo anomocítico (Fig. 2H), hemiparacítico (Fig. 2I), braquiparacítico (Fig. 2J) y polocítico (Fig. 2 K) y se observó la presencia de estomas gemelos (Fig. 3A).
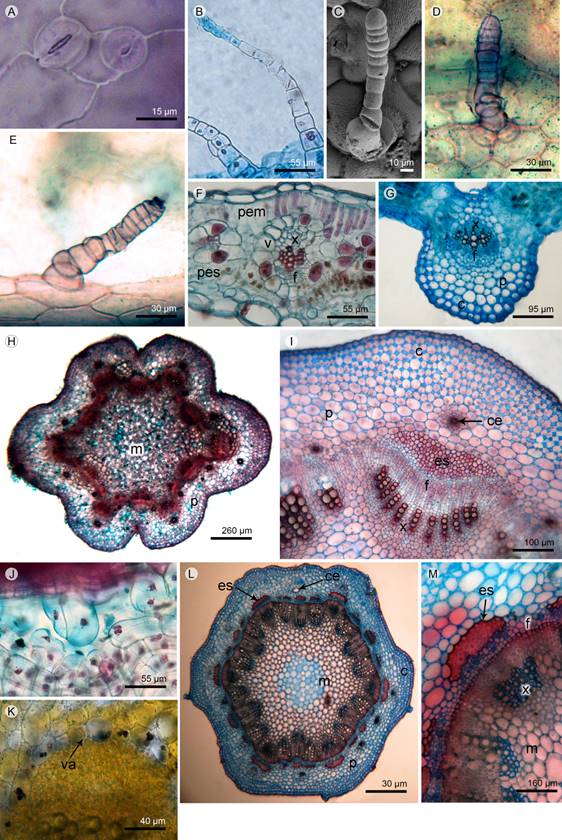
Figura 3: Anatomía foliar y caulinar de Flaveria bidentis (L.) Kuntze y F. haumanii Dimitri & Orfila. A-G. epidermis foliar: A. estomas gemelos en F. haumanii; B. tricoma glandular pluricelular uniseriado, largo; C. tricoma glandular pluricelular uniseriado, corto en MEB; D. tricoma glandular pluricelular biseriado en la porción basal; E. tricoma glandular pluricelular biseriado en la porción apical; F. lámina dorsiventral, anfistomática en Flaveria bidentis; G. haz vascular colateral de vena primaria en F. haumanii. H-M. Tallo: H. estructura primaria; I. haces vasculares colaterales, J. corte longitudinal de conducto secretor; K. vaina amilífera; L. estructura secundaria temprana; M. detalle de xilema y floema continuos por actividad del cambium. Abreviaciones: c=colénquima angular, ce=conducto ezquizógeno, es=esclerénquima, f=floema, m=médula, p=parénquima, pem=parénquima empalizado, pes=parénquima en esponjoso, x=xilema, v=vaina, va=vaina amilífera.
En el Cuadro 1 se muestra el índice y la densidad estomática de las especies estudiadas.
Cuadro 1: Índice estomático, densidad de estomas y tricomas, y espesor de epidermis y lámina en Flaveria bidentis (L.) Kuntze y F. haumanii Dimitri & Orfila. EAD: epidermis adaxial, EAB: epidermis abaxial, NE: número de estomas, CE: número de células epidérmicas, NT: número de tricomas. Letras distintas indican diferencias significativas (p<0.05).
| Especies | Flaveria bidentis (L.) Kuntze | Flaveria haumanii Dimitri & Orfila | ||
| EAD | EAB | EAD | EAB | |
| Índice estomático (NE/CE+NE)*100 | 17.86±2.6a | 18.34±3.91ab | 19.84±3.66b | 18.40±3.49ab |
| Densidad de estomas (NE/mm2) | 115.38±4.06a | 152.17±3.91b | 138.55±3.78b | 173.91±3.78c |
| Densidad de tricomas (NT/mm2) | 58.79±3.98a | 2.37±3.94b | 3.31±3.79c | 3.31±3.89c |
| Espesor de epidermis (µm) | 27.1±6.6a | 32±7.4b | 31.5±7.53b | 34.9±7.3b |
| Espesor de la lámina (µm) | 173±2.55a | 139.65±3.13b | ||
El índice estomático en la epidermis abaxial y adaxial fue de 18.34(±3.91) y de 17.86(±2.06) para F. bidentis; mientras que para F. haumanii fue de 18.40(±3.49) y de 19.84(±3.66), observándose diferencias significativas en la epidermis superior de ambas especies (Cuadro 1). La densidad estomática, en los dos taxones, muestra que la epidermis abaxial presenta diferencia significativa en relación con la superficie adaxial de la lámina. Flaveria haumanii evidenció la mayor diferencia significativa en superficie abaxial respecto de F. bidentis para la misma superficie.
En F. bidentis y F. haumanii se observaron tricomas glandulares pluricelulares uniseriados, ocasionalmente pluriseriados en la porción basal y apical (Figs. 3B-E). En F. bidentis estos tricomas están presentes en ambas superficies y se distribuyen uniformemente en toda la lámina, la longitud varía entre 123.31(±6.84) y 328.79(±23.87) µm. En F. haumanii la longitud varía entre 85.02(±10.51) y 390.19(±56.22) µm, los de menor longitud se distribuyen en ambas superficies de la lámina, mientras que los de mayor longitud se ubican solamente en la porción basal de la misma. En el Cuadro 1 se presenta la densidad de tricomas glandulares en las especies analizadas, donde se evidencia diferencia significativa en ambas epidermis en F. bidentis, mientras que en F. haumanii no se encontraron diferencias significativas entre las superficies. La mayor cantidad de tricomas se observó en la epidermis adaxial de F. bidentis.
En sección transversal, la lámina de los taxones es dorsiventral (Fig. 3F). La epidermis superior e inferior de F. bidentis presentó un espesor promedio de 27.1(±6.6) y 32(±7.4) µm, mientras que en F. haumanii es de 31.5(±7.53) y 34.9(±7.3) µm. La epidermis adaxial de F. bidentis presentó diferencias significativas (Cuadro 1). En ambas especies el parénquima en empalizada posee 1-2 estratos y el esponjoso de 3-4 estratos, el espesor promedio del mesófilo fue de 173(±2.55) µm en F. bidentis y de 139.65(±3.13) µm en F. haumanii (Cuadro 1). Las venas primarias de las especies estudiadas presentan haz vascular colateral, con casquete de colénquima hacia floema y esclerénquima hacia xilema (Fig. 3G). Los nervios secundarios y terciarios son colaterales, con vaina parenquimática, casquete de colénquima en floema y clorénquima radial.
En las dos especies analizadas se registraron conductos secretores esquizógenos en el parénquima, generalmente asociados a los nervios primarios, secundarios, terciarios, tanto en xilema como en floema. Además, presentan colénquima angular subepidérmico a la altura del nervio medio, hacia ambas superficies y en los márgenes de la lámina.
Anatomía caulinar
La anatomía del tallo de F. bidentis y F. haumanii es similar (Figs. 3H-M). En estadío de plántula la sección transversal presentó contorno ondulado (Fig. 3H) y de circular a hexagonal en etapa adulta (Fig. 3L).
Durante el crecimiento primario, se observó epidermis unistrata con cutícula estriada, colénquima angular subepidérmico de 2-5 estratos y parénquima cortical de 5-9 estratos; el parénquima presentó conductos secretores esquizógenos cuyo número varió de 7-8 en F. bidentis y 16-18 en F. haumanii (Figs. 3I, J, L); internamente se observó una vaina amílifera (Fig. 3K). El tejido vascular se organizó en haces vasculares colaterales con casquete de colénquima o esclerénquima hacia floema, el número de haces fue de 12-15 en F. bidentis y 22 en F. haumanii; internamente se presentó una médula parenquimática (Fig. 3I).
El crecimiento del tallo secundario temprano presentó el cambium, xilema y floema continuos, próximo al floema se observó esclerénquima (Fig. 3M); el resto de los tejidos son similares a la estructura primaria descrita anteriormente, solo se observó variación en el número de capas del colénquima subepidérmico (5-6 capas), el parénquima cortical (8-11 capas) y los conductos secretores (23-26). La médula parenquimática se observó parcialmente lignificada (Fig. 3L). El crecimiento secundario típico no fue observado en ninguna de las especies estudiadas.
Caracterización fitoquímica
Las diferencias en cuanto al rendimiento de extracto obtenido a partir de las hojas de F. bidentis y F. haumanii, no fueron marcadas. Flaveria bidentis tuvo un rendimiento de 1.33 g de extracto (26.7%), mientras que en F. haumanii de 1.59 g (31.9%). Los resultados de las técnicas fotocolorimétricas empleadas indican que F. haumanii posee mayor contenido total de fenoles, flavonoides y ácidos hidroxicinámicos, comparados con F. bidentis, solo el contenido de los orto-dihidroxifenoles totales fue ligeramente superior en F. bidentis (Cuadro 2).
Cuadro 2: Análisis fitoquímico de Flaveria bidentis (L.) Kuntze y F. haumanii Dimitri & Orfila. Los valores representan la media de tres repeticiones ± la desviación estándar (DE).
| Análisis fitoquímico foliar | Flaveria bidentis (L.) Kuntze | Flaveria haumanii Dimitri & Orfila |
| Rendimiento | 26.7% | 31.9% |
| Fenoles totales (FT) (mgEAG/gmv) | 56.35±0.23 | 62.81±0.12 |
| Flavonoides totales (FlavT) (mgEQ/gmv) | 84.36±0.34 | 97.30±0.38 |
| Ácidos hidroxicinámicos totales (AHCT) (mgEAC/ gmveg) | 113.25±0.64 | 137.40±0.54 |
| o-dihidroxifenoles totales (ODF) (mgCat/gmveg) | 32.04±0.31 | 29.51±0.27 |
Mediante las pruebas cualitativas, no se evidenció la presencia de taninos, saponinas y alcaloides.
Discusión
La morfología foliar de F. bidentis y F. haumanii descrita por otros autores se caracteriza por sus hojas opuestas, sésiles, trinervadas, glabras o glanduloso-pubescentes; ovadas o elípticas, serradas en el margen en F. bidentis, lineares o angostamente elípticas, ligeramente serradas en el margen en F. haumanii (Petenatti y Ariza Espinar, 1997; Novara y Petenatti, 2000; Bártoli et al., 2008; Katinas y Gutiérrez, 2013). Sin embargo, en este trabajo las hojas de las especies estudiadas son pubescentes y la forma de la lámina de F. haumanii es ovada-lanceolada, asimétrica, a diferencia de lo descrito por los autores antes mencionados. Anderberg et al. (2007) citan para la familia venación paralelopinnada, pinnada, palmatopinnada o palmada. Gutiérrez et al. (2015) mencionan que la lámina de F. bidentis y F. haumanii es trinervada; sin embargo, no la caracteriza arquitecturalmente. Las especies aquí estudiadas presentaron venación acródroma, la cual se describe por primera vez.
En lo referente a la anatomía foliar, Metcalfe y Chalk (1950) citan para la familia la presencia de estomas anomocíticos y anisocíticos. En los taxones estudiados se registraron estomas anomocíticos, hemiparacíticos, braquiparacíticos y polocíticos. El índice estomático citado por Petenatti et al. (2005) para Flaveria bidentis, en epidermis adaxial y abaxial, fue de 20-22.22 y 15.38-20 respectivamente, y en F. haumanii fue de 21.87-23.33 y 17.5-20. Los resultados aquí obtenidos indican que el índice estomático, en epidermis adaxial y abaxial fue de 17.86(±2.06) y 18.34(±3.91) en F. bidentis, y de 19.84(±3.66) y 18.40(±3.49) en F. haumanii. Puede observarse que este índice es ligeramente menor en la epidermis superior de ambas especies si se compara con los datos obtenidos por Petenatti et al. (2005). Probablemente esto se relaciona con las diferentes condiciones ambientales del sitio de recolección de las muestras aquí analizadas. Es conocido que el índice estomático en una especie puede verse afectado por las condiciones ambientales, entre hojas de la misma planta y entre sectores de una misma hoja (Esau, 1972; Roth et al., 1986; Brownlee, 2001). En lo concerniente a la densidad estomática, los datos citados en este trabajo son los primeros, encontrándose diferencias significativas entre los taxones.
En relación a los tricomas en Asteraceae, es común la presencia de tricomas glandulares (Metcalfe y Chalk, 1950). En las especies analizadas se observaron tricomas glandulares, pluricelulares, uniseriados y biseriados, a diferencia de lo registrado por Apóstolo (2005), quien citó para F. bidentis solamente la presencia de tricomas uniseriados. En los taxones estudiados la lámina foliar es dorsiventral, con estructura Kranz, la que solamente fue citada para F. bidentis por Powell (1978), Apóstolo (2005), McKown et al. (2005) y Anderberg et al. (2007).
La presencia de canales secretores fue mencionada para el género por Metcalfe y Chalk (1950), quienes los observaron en el córtex y la endodermis del tallo, los que pueden extenderse a la lámina de la hoja; estos canales no fueron observados en las especies en cuestión. En este trabajo, se evidenció la presencia de conductos secretores esquizógenos en hoja y tallo, los que se caracterizan por presentar un epitelio unistratificado con células secretoras que se ubican hacia la luz del conducto; esto es mencionado para otras especies de la familia (Castro et al., 1997; Melo-De-Pinna y Menezes, 2002; Simon et al., 2002; Lapp et al., 2004; Delbón et al., 2007; Molares et al., 2009). La prueba histoquímica resultó positiva para fenoles en los conductos esquizógenos de ambas especies. La presencia de fenoles también fue citada en Flourencia campestris Griseb. y F. oolepis S.F. Blake, especies pertenecientes a la familia Asteraceae (Delbón et al., 2007). Apóstolo (2005) menciona para F. bidentis la presencia de ceras epicuticulares y cristales, que no fueron observados en las muestras analizadas.
En lo referente al tallo, la estructura primaria y secundaria se menciona por primera vez en este trabajo.
Químicamente los compuestos fenólicos son esenciales para la fisiología de la planta y juegan un papel importante en la defensa pasiva como barreras bioquímicas preformadas (Cruz Borruel et al., 2006). Flavonoides mono y tetrasulfatados han sido usados tradicionalmente como marcadores quimiosistemáticos para las especies de Flaveria (Varin y Ibrahim, 1991). Agnese et al. (1999) llevaron a cabo análisis en F. bidentis en busca de esta familia de compuestos, los cuales revelaron que esta planta sintetiza dos derivados con características únicas: quercetina-3,7,3´, 4-tetrasulfato y quercetina-3-acetil-7, 3´,4-trisulfato, mientras que F. haumanii sintetiza isorhamnetin-3,7-disulfato e isorhamnetin-3-monosulfato, utilizándose este criterio químico como elemento de valor diagnóstico. En este trabajo se determinó la presencia de otros compuestos fenólicos, ácidos hidroxicinámicos y orto-dihidroxifenoles junto con fenoles y flavonoides totales.
A pesar de haber cuantificado por primera vez diferentes grupos de compuestos fenólicos, no se observaron diferencias significativas para emplear estos perfiles químicos en la identificación de las especies. Por lo tanto, se debería seguir explorando a los flavonoides como compuestos con valor diagnóstico e investigar otros compuestos fenólicos no sulfatados.
Conclusiones
Flaveria bidentis y F. haumanii pueden diferenciarse por la densidad de estomas, densidad de tricomas, y por el tamaño y ubicación de los últimos en la lámina; mientras que en el tallo la diferencia se presentó en la cantidad de haces vasculares y de conductos secretores. Entre las características que comparten se encuentran la nerviación, tipos de estomas y tricomas en la hoja y estructura Kranz, el crecimiento primario y secundario del tallo, y la presencia de conductos secretores en tallo y hoja. La cuantificación de compuestos fenólicos permitió establecer un perfil químico para ambas especies con escasas diferencias diagnósticas.
Contribución de autores
VAP, MTS y SC diseñaron la presente investigación y colectaron el material. VAP y PLA aplicaron las técnicas histológicas convencionales y se encargaron de la adquisición de datos y su interpretación anatómica. EL realizó la caracterización fitoquímica foliar y adquisición de datos. Todos los autores contribuyeron a la discusión, revisión y aprobación del manuscrito final.











 nueva página del texto (beta)
nueva página del texto (beta)




