Introducción
La mayoría de los ecosistemas están continuamente influenciados por perturbaciones de origen natural y antrópica, lo que ha ocasionado que alrededor de un tercio de los hábitats del planeta se encuentren severamente degradados (Fernández et al., 2010). Para México se ha reportado que aún existe 71.3% de vegetación original (alrededor de 139.1 millones de hectáreas) (SEMARNAT, 2013), mientras que para el estado de Veracruz la vegetación original ha reducido su superficie en más de 85% (Castillo-Campos et al., 2011). Sin embargo, Ellis et al. (2011) reportan que aún queda 26% de cobertura de vegetación, incluyendo sitios perturbados, del cual sólo 8.6% es vegetación original. Veracruz ocupa el primer lugar en pérdida y fragmentación de vegetación natural a nivel nacional debido a los cambios de uso de suelo provocados por la expansión agropecuaria y urbana o por la apertura de carreteras (Ellis et al., 2011). Este deterioro ecológico es grave ya que Veracruz es reconocido por su alta diversidad florística, posicionándose como el tercer estado con mayor número de plantas vasculares del país, sólo superado por Chiapas y Oaxaca (SEMARNAT, 2013; Villaseñor y Ortiz, 2014).
Las características del estado de Veracruz permiten la presencia de diferentes tipos de vegetación en distancias relativamente cortas con una amplia heterogeneidad ambiental y topográfica, que va desde el nivel del mar hasta más de 5000 metros de altitud (Gómez-Pompa et al., 2010). Ejemplo de lo anterior es la región central donde se ubica el gradiente altitudinal que inicia en la llanura costera del centro del estado y termina en las partes altas del Cofre de Perote en su porción este (Carvajal-Hernández y Krömer, 2015; Gómez-Díaz et al., 2017a). La importancia de esta región radica en su ubicación, ya que es donde convergen dos regiones biogeográficas, la neártica y la neotropical, las cuales permiten la presencia de especies templadas y tropicales en un área relativamente pequeña (Carvajal-Hernández et al., 2017). A lo largo del gradiente se encuentran tipos de vegetación que por su reducida extensión están considerados dentro de los 25 focos rojos para el estado, por la reducción de su superficie (Ellis et al., 2011); tal es el caso de la selva mediana subcaducifolia, el bosque mesófilo de montaña, bosque de pino (Pinus L.), bosque de oyamel (Abies Mill.), bosque de pino-encino (Pinus-Quercus L.) y encinar tropical (INEGI, 2005). Por lo anterior, dicha región se considera prioritaria para la conservación de la biodiversidad (hotspot) por la Organización Internacional de Conservación (Mittermeier et al., 2004) y por la Comisión Nacional para el Conocimiento y Uso de la Biodiversidad (CONABIO, 2011).
Se estima que para Veracruz la riqueza florística oscila entre 7855 (Castillo-Campos et al., 2011) y 8497 especies vegetales (Villaseñor, 2016), donde la forma de vida predominante es el estrato herbáceo (4601 especies), seguido de los arbustos (1527) y árboles (1177) (Castillo-Campos et al., 2011). Los arbustos representan casi 20% del total de las especies, lo cual los convierte en un grupo importante no sólo en términos florísticos, sino también ecológicos y estructurales. De acuerdo con estudios que incluyen este grupo, las familias más ricas en especies a nivel nacional son Asteraceae, Boraginaceae, Euphorbiaceae, Fabaceae y Rubiaceae (Trejo, 1998; Salas-Morales, 2002; Castillo-Campos et al., 2011; Villaseñor y Ortiz, 2012).
Morfológicamente, los arbustos son similares a los árboles; sin embargo, difieren en que en los primeros la ramificación crece cerca o por debajo del nivel del suelo, mientras que los árboles normalmente presentan un tronco principal y la ramificación empieza más arriba del nivel del suelo (Moreno, 1984). Los arbustos cumplen funciones importantes dentro de los ecosistemas como son el frenar el desgaste del relieve al reducir el impacto de las gotas de lluvia, el levantamiento hidráulico en ecosistemas áridos, y participan como nodrizas en el establecimiento de otras plantas (Espinoza et al., 1988; Shachak et al., 1998; Gutiérrez y Squeo, 2004).
Estudios de gradientes altitudinales realizados en México sugieren que la mayor riqueza de arbustos se encuentra en la zona de transición entre los ecosistemas templado-húmedos y templado-secos (Granados-Sánchez y Sánchez-González, 2003; De León-Mata et al., 2013). Por otro lado, para Costa Rica, Veintimilla-Ramos (2013) reportó que las especies de arbustos tienden a crecer en las partes planas y de pendientes suaves, debido a que hay mayor acumulación de materia orgánica y humedad.
Respecto al impacto humano, se tiene registrado que a medida que disminuye el tamaño de los fragmentos de vegetación, el aislamiento de las especies se incrementa, reduciendo la riqueza y presencia de especies primarias (Arroyo-Rodríguez et al., 2011), lo que da paso a especies pioneras de vida corta (menos de uno a cuatro años) (Gómez-Pompa, 1971).
Entre las familias que tienen mayor riqueza de arbustos y que caracterizan las comunidades de vegetación secundaria en México están Fabaceae, Asteraceae, Euphorbiaceae y Convolvulaceae (Castillo-Campos et al., 2011; García et al., 2012).
Desde las primeras exploraciones botánicas hasta años recientes se han realizado múltiples trabajos florísticos en diferentes regiones de Veracruz (Márquez et al., 1981; Castillo-Campos, 1985, 2003; Castillo-Campos y Medina-Abreo, 1996; Arroyo-Rodríguez et al., 2009; Krömer et al., 2013), los cuales han permitido inventariar las especies presentes y generar más de 170 fascículos de la Flora de Veracruz. Sin embargo, se sabe muy poco sobre cómo varía la riqueza de los grupos vegetales a lo largo de gradientes de elevación y perturbación en una zona transicional entre las regiones tropical y subtropical. A la fecha, pocos trabajos en grupos específicos han estudiado los patrones de riqueza y distribución de especies en dichos gradientes. Entre los más relevantes se encuentran los estudios de Carvajal-Hernández et al. (2017) y Gómez-Díaz et al. (2017 b), quienes estudiaron los helechos y licófitos, así como las herbáceas angiospermas en el mismo gradiente del Cofre de Perote, encontrando que la mayor riqueza de ambos grupos se concentra en elevaciones intermedias.
Debido a la heterogeneidad espacial que se presenta en Veracruz y a la fuerte presión antrópica sobre los ecosistemas naturales, es importante realizar inventarios, con la misma metodología, que permitan analizar cómo los arbustos se comportan a nivel regional frente a factores bióticos y abióticos, así como ante las perturbaciones antrópicas.
Las preguntas sustanciales que se abordan en este estudio son: 1) ¿cómo influyen la elevación y la perturbación en los patrones de riqueza y distribución de los arbustos en el gradiente del Cofre de Perote? y 2) ¿cómo varía la riqueza y composición de especies de arbustos en diferentes grados de perturbación a diferentes elevaciones? Esto nos ayudará a proporcionar información detallada sobre los patrones de riqueza y distribución de especies, como un paso más concreto y aproximado hacia la definición de áreas prioritarias para la conservación de este complejo mosaico de vegetación.
Materiales y Métodos
Área de estudio
El gradiente altitudinal se ubica en la región central del estado de Veracruz y se extiende en dirección este desde el nivel del mar, en la zona de La Mancha, hasta la parte alta del volcán Cofre de Perote a 3500 m s.n.m. (Fig. 1). La zona superior a 1500 m forma parte del Cinturón Volcánico Transmexicano, mientras que en las partes bajas se encuentran pequeños lomeríos, así como la Sierra de Manuel Díaz, una formación montañosa ubicada frente al mar. Finalmente, a nivel del mar se encuentran las lagunas costeras “La Mancha-El Llano”, que forman parte de la zona decretada como sitio Ramsar (Geissert y Enríquez, 2011; Carvajal-Hernández y Krömer, 2015).
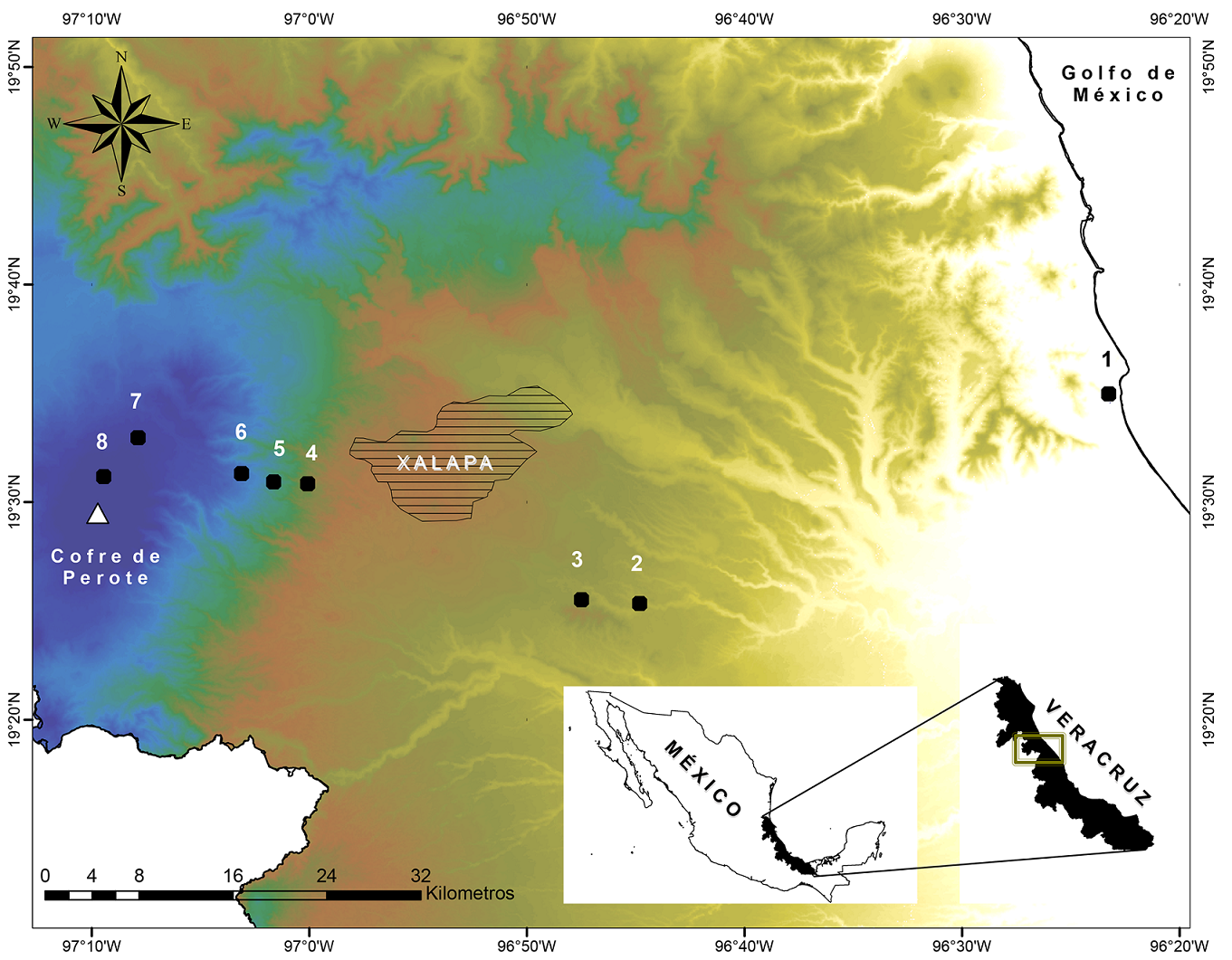
Figura 1: Ubicación de los ocho sitios de estudio a lo largo de un gradiente elevacional en la región central del estado de Veracruz, México. Los números corresponden a cada uno de los pisos elevacionales (m): 1=20 (La Mancha), 2=500 (Palmarejo), 3=1000 (Chavarrillo), 4=1500 (Los Capulines), 5=2000 (El Zapotal), 6=2500 (Encinal), 7=3000 (Los Pescados), 8=3500 (El Conejo).
Las variadas características fisiográficas y climáticas que se presentan a lo largo del gradiente dan origen a diferentes ambientes, desde los secos con altas temperaturas en altitudes bajas, hasta los climas templados y fríos en la parte alta (Castillo-Campos et al., 2011). De acuerdo con datos de la Comisión Nacional del Agua (CONAGUA, 2010), la temperatura promedio anual muestra una disminución lineal con el aumento de la altitud, mientras que la precipitación promedio anual varía de acuerdo con la elevación, siendo mayor (aprox. 1800 mm) en las partes medias y menor (800 mm) en los extremos del gradiente (Cuadro 1). De acuerdo con la clasificación de INEGI (2005) pueden distinguirse dentro del gradiente (20-3500 m s.n.m) seis tipos de vegetación presentes en cada piso elevacional: i) selva mediana subcaducifolia (20 y 500 m), ii) encinar tropical (500 y 1000 m), iii) bosque mesófilo de montaña (1500 y 2000 m), iv) bosque de Pinus-Quercus (2500 m), v) bosque de Pinus (3000 m), y vi) bosque de Abies (3500 m) (Carvajal-Hernández y Krömer, 2015; Gómez-Díaz et al., 2017a).
Cuadro 1: Riqueza de especies de arbustos por piso elevacional y tipo de vegetación: selva mediana subcaducifolia (SMS), encinar tropical (ET), bosque mesófilo de montaña (BMM), bosque de Pinus-Quercus (BPQ), bosque de Pinus (BP) y bosque de Abies (BA), en diferentes ambientes naturales y derivados de la acción antrópica: bosque conservado (conservado), bosque perturbado (perturbado) y bosque secundario (secundario), en donde el número antes del paréntesis corresponde al número de especies totales, el primero dentro del paréntesis al número de familias y el tercero al de géneros. Además, se muestra la riqueza estimada por Chao1 y el déficit de las especies observadas con respecto a las estimadas (%), la riqueza estimada por el modelo de Clench, así como el número de cuadros para alcanzar la asíntota predicha (cuadros). Se presentan datos de temperatura (°C) y precipitación anual (mm).
| Sitio | Elevación (m) | Tipo de vegetación | Temperatura °C | Precipitación mm | Conservado | Perturbado | Secundario | Total | Chao1 (déficit %) | Clench (cuadros) |
| La Mancha | 20 | SMS | 25 | 800 | 20(12/16) | 16(11/16) | 12(9/11) | 26 | 28(10) | 35(230) |
| Palmarejo | 500 | SMS/ET | 21 | 900 | 11(10/10) | 13(11/12) | 24(16/24) | 38 | 39(2) | 59(729) |
| Chavarrillo | 1000 | ET | 21 | 900 | 24(13/18) | 21(15/19) | 32(18/27) | 49 | 62(22) | 70(778) |
| Los Capulines | 1500 | BMM | 19 | 1800 | 9(8/9) | 13(11/11) | 8(5/5) | 20 | 20(0) | 27(795) |
| El Zapotal | 2000 | BMM | 18 | 1800 | 15(11/15) | 20(7/12) | 16(6/8) | 32 | 37(14) | 50(715) |
| Encinal | 2500 | BPQ | 12 | 1900 | 17(11/15) | 14(7/12) | 8(6/8) | 25 | 26(7) | 36(291) |
| Los Pescados | 3000 | BP | 10 | 800 | 7(4/7) | 11(6/9) | 9(6/8) | 14 | 14(0) | 17(310) |
| El Conejo | 3500 | BA | 9 | 800 | 8(5/8) | 3(2/3) | 6(4/5) | 10 | 10(0) | 13(449) |
Trabajo de campo
El muestreo de los arbustos se realizó entre junio de 2015 y octubre de 2016. A lo largo del gradiente (20-3500 m), se seleccionaron ocho sitios de estudio a distintas altitudes, en intervalos de aproximadamente 500 m de altitud entre cada uno (a partir de aquí se referirán como pisos elevacionales) (Fig. 1). En cada piso se buscaron tres diferentes ambientes boscosos con distintos grados de perturbación (a partir de aquí se referirán como tipos de hábitats).
Se muestreó un total de 120 parcelas de 20 m × 20 m (4.8 ha), 15 en cada uno de los ocho pisos elevacionales; divididas, a su vez, en tres hábitats (Carvajal-Hernández y Krömer, 2015; Gómez-Díaz et al., 2017a):1) bosque conservado (BC), que son bosques con más de 50 años de no ser sometidos a algún tipo de perturbación, 2) bosque perturbado (BP), aquellos que aún mantienen la estructura de un bosque conservado con árboles remanentes, pero que están sometidos a una influencia antrópica moderada y 3) bosque secundario (BS), aquellos donde se taló por completo la vegetación original y ha sido regenerada por un periodo de 20 años. Los hábitats se seleccionaron con base en los criterios descritos por Newbold et al. (2015), tomando en cuenta el grado de intensidad de actividades humanas dentro de los bosques.
En cada parcela se registró el número de individuos de las especies presentes, así como su altura y área basal (AB≥1 cm) (Mostacedo y Fredericksen, 2000). Se consideró como arbusto toda planta que se ramificara desde la base y cumpliera con las características descritas por Moreno (1984). Se recolectaron especímenes en triplicado de cada especie en cada piso elevacional en los tres hábitats y se herborizaron siguiendo las recomendaciones de Sánchez-González y González (2007). Los ejemplares fueron depositados en el herbario del Centro de Investigaciones Tropicales (CITRO) de la Universidad Veracruzana y parcialmente en el Herbario Nacional (MEXU) del Instituto de Biología de la Universidad Nacional Autónoma de México.
Para la determinación de los ejemplares colectados se usó literatura botánica especializada (p. ej. el manual para la identificación de los géneros y familias de plantas leñosas de Gentry (1996), Flora del Bajío (Rzedowski y Calderón de Rzedowski, 1989-2018) y Flora de Veracruz (Fay, 1980; Fernández-Nava, 1986; Hernández, 1987; Sánchez-Vindas, 1990; Fryxell, 1992; Durán-Espinosa, 2001, 2006; Molina-Paniagua y Lorea-Hernández, 2001) el cotejo de ejemplares en los herbarios MEXU y/o XAL, del Instituto de Ecología, A.C., y la consulta a especialistas de las familias Asteraceae y Rubiaceae. Una vez realizada la identificación, se elaboró un listado de especies, el cual se actualizó siguiendo la clasificación del Angiosperm Phylogeny Group (Stevens, 2001 onwards; APG IV, 2016). Para la correcta nomenclatura de las mismas y sus autores se consultó la base de datos del Jardín Botánico de Missouri (TROPICOS, 2017), como la base del International Plant Names Index (IPNI, 2017). Posteriormente, se realizó una búsqueda exhaustiva de literatura para estar seguros de incluir solamente arbustos, ya que las especies que resultaron no serlo se excluyeron del listado final. Se determinó el estatus de protección legal de las especies de acuerdo con la Norma Oficial Mexicana NOM-059-SEMARNAT-2010 (SEMARNAT, 2010) y su estatus de conservación con base en las categorías de la Lista Roja de Especies Amenazadas de la Unión Internacional para la Conservación de la Naturaleza (IUCN, 2017). Finalmente, con apoyo de distintas floras mencionadas arriba se analizó la distribución geográfica para poder determinar las especies endémicas de Veracruz y/o México.
Análisis de datos
Se utilizó el programa EstimateS 9.1.0 (Colwell, 2009) para obtener los valores del estimador no paramétrico de riqueza Chao1, el cual está basado en la abundancia de las especies, además de ser sensible a la presencia de especies únicas (singletons) y especies representadas por dos individuos (doubletons) (Colwell, 2009). Así mismo, se utilizó un modelo paramétrico de Clench, que predice que la probabilidad de encontrar una nueva especie aumentará (hasta un máximo) conforme mayor sea el esfuerzo de muestreo; es decir, la probabilidad de añadir especies nuevas eventualmente disminuye, pero el trabajo de campo la aumenta (Soberón y Llorente, 1993). La ecuación de Clench utilizada fue:
donde:
S = riqueza de especies
t = esfuerzo de muestreo (tamaño de la muestra)
a y b =constantes
Utilizamos modelos lineales generalizados (MLGs) para examinar la relación entre la riqueza de especies con la elevación y el hábitat. Los MLGs son una extensión de los modelos lineales simples que permiten modelar los datos usando otras distribuciones distintas a la Normal. La elección de la distribución afecta las suposiciones que se hacen respecto a las variaciones, ya que la relación entre la varianza y la media es conocida para muchas distribuciones (Guisan et al., 2002). Debido a que la variable dependiente no siguió una distribución normal, se eligió una estructura de error adecuada a la naturaleza de esta variable. Elegimos la estructura de error binomial negativo para el MLG con la función “descdist” del paquete R “fithistrplus” versión 1.0-7 (Delignette-Muller et al., 2017). Para incluir una relación no lineal de la variable dependiente con la altitud, se incluyó un término cuadrático. Utilizamos como variables independientes elevación, elevación2, hábitat y sus interacciones de dos y tres vías en estos modelos. Se construyeron seis MLGs con diferentes combinaciones de las variables independientes. Usando el criterio de información de Akaike corregido por sesgos (AICc), se identificó el MLG que mejor explicase la riqueza de especies. Finalmente, se calculó el D2 del mejor modelo. Todos los análisis se realizaron en R versión 3.3 (R Core Team, 2017).
Para explorar los patrones de la distribución de la diversidad de especies entre los pisos elevacionales y hábitats, se realizó un escalamiento multidimensional no-métrico (NMDS, por sus siglas en inglés), utilizando la matriz de distancia euclidiana de la abundancia de las especies. Este método de ordenación multivariante se basa en la proximidad entre objetos y permite reducir la dimensionalidad de los datos sin una transformación a priori (Clarke, 1993). El método NMDS es reconocido por los ecólogos como un método no paramétrico robusto para la representación de los valores globales de rotación dentro de una matriz en un espacio de baja dimensión (Faith et al., 1987). Se produjeron gráficos de NMDS para cada piso elevacional utilizando las matrices de distancia. Los ejes de las figuras resultantes están en unidades arbitrarias donde los hábitats similares se encuentran uno cerca del otro en el espacio bidimensional y los hábitats menos similares se encuentran más separados.
La similitud de la composición de especies de arbustos se comparó mediante el análisis multivariado permutacional de la varianza (ADONIS2), que es una función para el análisis y la partición de sumas de cuadrados utilizando matrices de distancias semimétricas y métricas. En la medida en que divide las sumas de cuadrados de un conjunto de datos multivariados, es directamente análoga a MANOVA (análisis de varianza multivariado), es decir, además de identificar si los cambios en las variables independientes tienen efectos significativos en las dependientes, la técnica también intenta identificar las interacciones entre las variables independientes y su grado de asociación con las dependientes. Esta prueba divide matrices de distancia entre fuentes de variación y ajusta modelos lineales (p. ej. factores, regresión polinomial) a matrices de distancia; usando una prueba de permutación con relaciones pseudo-F del paquete de R “vegan”.
Para identificar cómo contribuye cada especie a la disimilitud de las elevaciones y hábitats se utilizó el análisis no-paramétrico SIMPER, que usa generalmente el valor de Bray-Curtis como medida de similitud (Clarke, 1993).
Resultados
Riqueza de especies
En las 120 parcelas de muestreo se registraron 118 especies y 14 morfoespecies de arbustos, agrupadas en 88 géneros y 41 familias (Apéndice). Los géneros con mayor número de especies fueron Miconia Ruiz & Pav. y Psychotria L. (cinco cada uno). La familia Rubiaceae es la más rica con 16 especies, seguida de Asteraceae (13) y Euphorbiaceae (nueve). Se registraron seis especies endémicas para México, de las cuales Acalypha schlechtendaliana Müll. Arg., Myrcia aromatica Schltdl. y Eugenia rhombea (O. Berg) Krug & Urb se encontraron en la selva mediana subcaducifolia de la elevación de 500 m y el encinar tropical de 1000 m, Salix paradoxa Kunth en el bosque de Pinus y Abies en elevaciones de 3000 y 3500 m, mientras que Rubus humistratus Steud. y Ribes affine Kunth se registraron únicamente en el bosque de Abies a los 3000 m.
De la lista total de especies, ninguna se encuentra en la NOM-059-SEMARNAT-2010 (SEMARNAT, 2010) y únicamente Oreopanax echinops (Schltdl. & Cham.) Decne. & Planch. está en categoría Vulnerable según la Lista Roja de la IUCN (2017), registrándose en el bosque mesófilo de montaña en una elevación de 2000 m. Los valores de Chao1 muestran que se tiene entre 80 y 100% de las especies estimadas en cada uno de los pisos elevacionales; sin embargo, en el piso de 1000 m se tuvo un déficit de 22%. Por otro lado, los resultados del modelo de Clench reflejan que el número de especies estimadas para cada piso oscilan entre 13 y 70, teniendo el déficit más alto entre el número de cuadros y los cuadros estimados para alcanzar la asíntota en los pisos de 500 y 1000 m respectivamente (Cuadro 1).
Patrones de riqueza y distribución a lo largo de los gradientes
El mejor modelo para estimar la riqueza fue el que incluyó las interacciones entre elevación, elevación2 y hábitat, con un valor de AICc=541 y un D2 de 0.42 (p=0.001). La elevación tiene efecto importante en la riqueza de arbustos (p=0.001). El modelo siguió un patrón no lineal con un pico de riqueza de especies en el encinar tropical de la elevación de 1000 m (49 especies) y la selva mediana subcaducifolia a 500 m (38), decreciendo a partir de 1500 m en el bosque mesófilo de montaña (20 y 32) hasta el extremo superior en bosque de Pinus-Quercus (25), bosque de Pinus (14) y Abies (10) (Cuadro 1, Fig. 2). El hábitat por si solo explica muy poco la distribución de las especies (BP: p=0.421 BS: p=0.188); sin embargo, la interacción entre hábitat y elevación es más significativa (p<0.001), principalmente en el bosque secundario del encinar tropical de la elevación de 1000 m (Cuadro 2, Fig. 2).
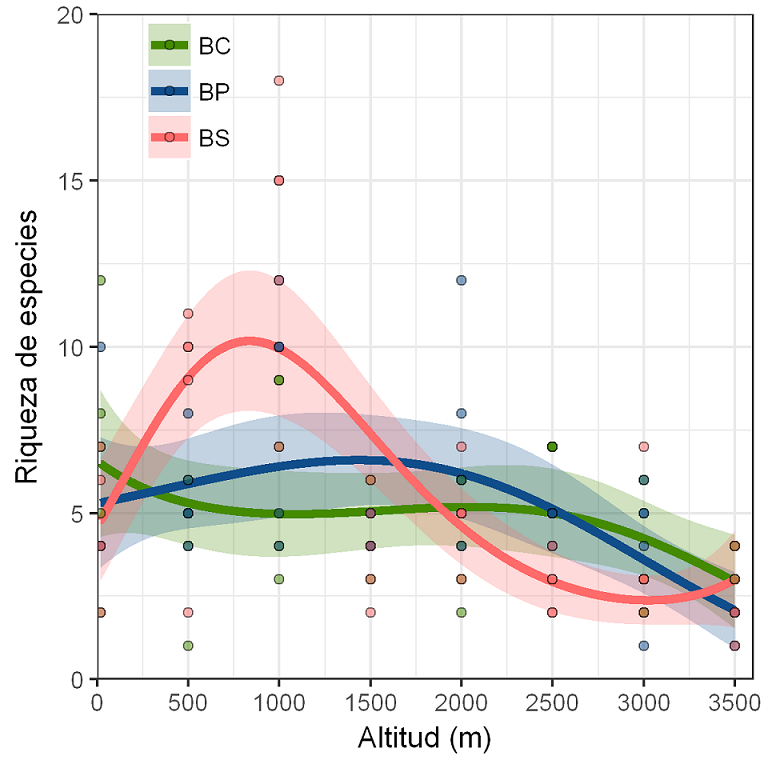
Figura 2: Patrones de riqueza de arbustos a lo largo de gradientes de elevación y perturbación en la vertiente este de Cofre de Perote, centro de Veracruz, México. Se ajustaron las líneas a un modelo lineal generalizado con error binomial negativo (MLG), donde las siglas y los colores corresponden a los hábitats establecidos en cada piso elevacional: bosque conservado (BC=verde), bosque perturbado (BP=azul) y bosque secundario (BS=rojo).
Cuadro 2: Estimaciones de parámetros a partir del modelo lineal generalizado. Los parámetros vinculan la diversidad α de arbustos a variables explicativas ambientales, a lo largo de un gradiente altitudinal en el centro de Veracruz, México. Los términos altitud2 y altitud: altitud2, fueron incluidos para representar la relación no lineal encontrada en esta variable. Las estimaciones están en la escala estandarizada ± error estándar. Marcamos estimaciones significativas con asteriscos (*** <0.001).
| Término | Coeficiente | Valor p |
| Intercepto | 6.563±0.101 | <0.001*** |
| Altitud | 0.999±0.001 | 0.231 |
| Altitud2 | 1.000±0.001 | 0.238 |
| Bosque perturbado | 0.807±0.181 | 0.421 |
| Bosque secundario | 0.700±0.181 | 0.188 |
| Altitud: Altitud2 | 1.000±0.001 | 0.191 |
| Altitud: Bosque perturbado | 1.001±0.001 | 0.261 |
| Altitud: Bosque secundario | 1.003±0.001 | <0.001*** |
| Altitud2: Bosque perturbado | 1.000±0.001 | 0.438 |
| Altitud2: Bosque secundario | 1.000±0.001 | <0.001*** |
| Altitud: Altitud2: Bosque perturbado | 1.000±0.001 | 0.652 |
| Altitud: Altitud2: Bosque secundario | 1.000±0.001 | <0.001*** |
El escalamiento multidimensional no-métrico (NMDS) de la abundancia de las especies por elevación y hábitat muestra que la distribución de los arbustos está explicada por la elevación con un R2 de 0.26 (p=0.001), observándose una separación entre las elevaciones bajas (20-1000 m), medias (1500-2000 m) y altas (2500-3500 m) (stress=0.157), mientras que la influencia del hábitat por sí sola no explica una gran proporción de la varianza con un R2 de 0.03 (p=0.001) (Fig. 3). Sin embargo, la interacción elevación y hábitat con un R2 de 0.19 (p=0.001) refleja que el hábitat secundario es diferente al conservado y perturbado en el piso de 1000 m (Fig. 4).
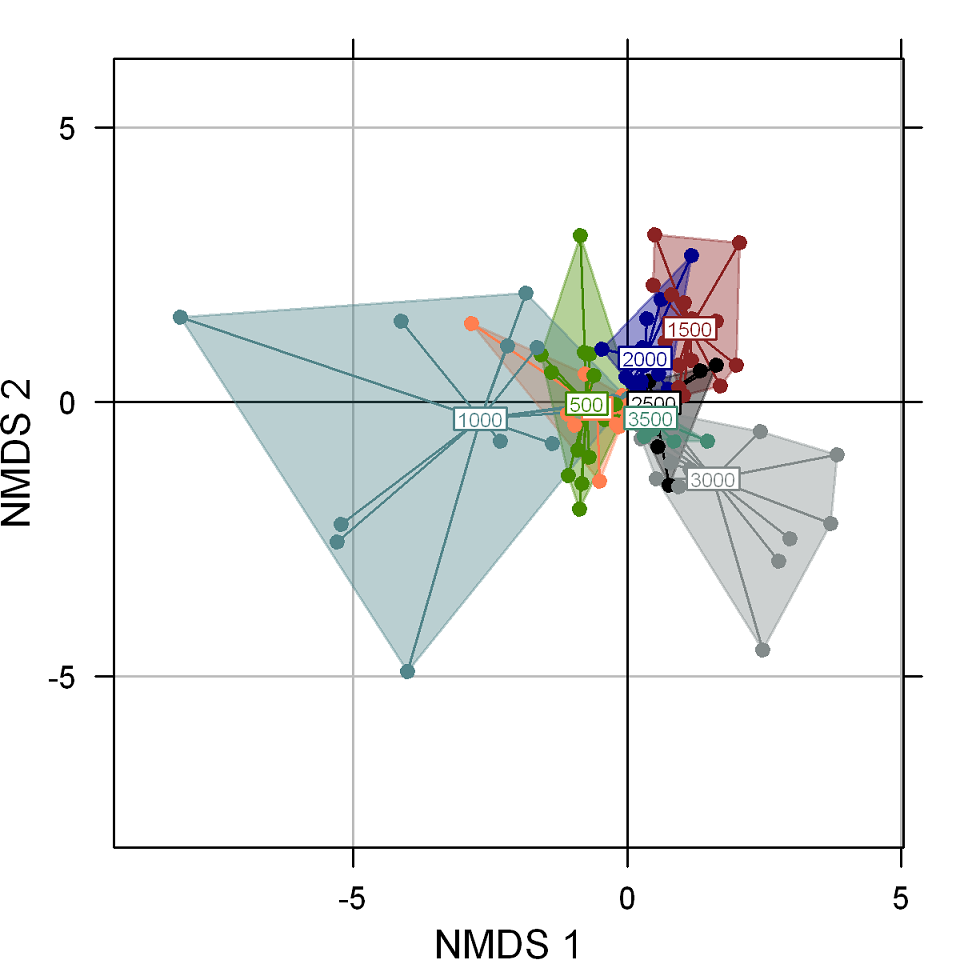
Figura 3: Escalamiento multidimensional no-métrico (NMDS) de cada piso elevacional de un gradiente en la vertiente este de Cofre de Perote, centro de Veracruz, México. La posición de cada sitio de muestreo en la ordenación está indicada por las altitudes: 0-3500 m (stress: 0.157, p=0.001), los ejes (NMDS-1 y 2) corresponden a las dimensiones que contienen la mayor cantidad de varianza de las variables.
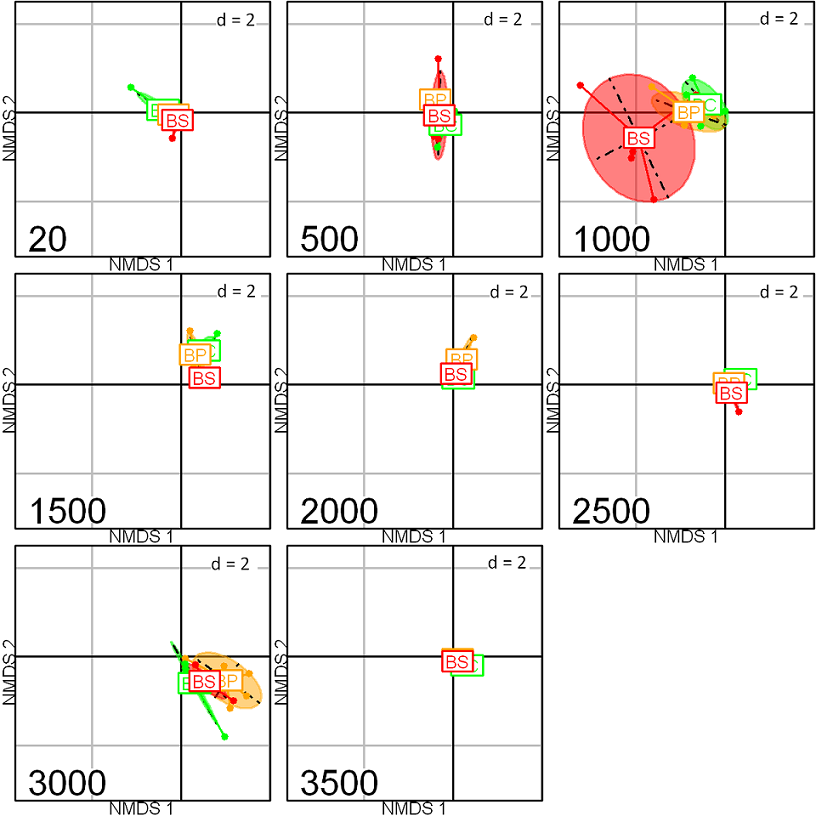
Figura 4: Escalamiento multidimensional no-métrico (NMDS) de los tres hábitats por cada piso elevacional de un gradiente en la vertiente este de Cofre de Perote, centro de Veracruz, México. La posición de los hábitats está indicada por las siglas BC: bosque conservado en color verde, BP: bosque perturbado en color amarillo, BS: bosque secundario en color rojo (stress: 0.157, p=0.001), los ejes (NMDS-1 y 2) corresponden a las dimensiones que contienen la mayor cantidad de varianza de las variables.
Los valores del análisis SIMPER muestran que, de las 132 especies de arbustos registradas, únicamente 21 contribuyen con 50% a la disimilitud y agrupamiento de las elevaciones según el origen de las especies y tipo de vegetación (Cuadro 3). Las elevaciones bajas (20, 500 y 1000 m) están separadas principalmente por ocho especies exclusivas de la selva mediana subcaducifolia y encinar tropical. Entre las principales están Piper amalago L. con la mayor contribución de 4.53 en la selva mediana subcaducifolia del piso de 20 m, seguido de Eugenia capuli (Schltdl. & Cham.) Hook. & Arn. y Randia laetevirens Standl., quienes tienen mayor contribución en el encinar tropical de 1000 m. Las elevaciones intermedias (1500-2000 m) se separan principalmente por seis especies exclusivas de bosque mesófilo de montaña, donde Moussonia deppeana (Schltdl. & Cham.) Hanst., Hoffmannia excelsa (Kunth) K. Schum., Roldana schaffneri (Sch. Bip. ex Klatt) H. Rob. & Brettell y Piper lapathifolium (Kunth) Steud. tienen su mayor contribución en el bosque mesófilo de 1500 m. Por otro lado, se encuentran las especies exclusivas de bosques templados de las elevaciones de 2500, 3000 y 3500 m (bosque de Pinus-Quercus, Pinus y Abies), de las cuales Baccharis conferta Kunth, Acaena elongata L. y Ribes ciliatum Humb. & Bonpl. ex Roem. & Schult. son las que contribuyen más a la disimilitud de estos bosques teniendo su mayor aporte en el bosque de Abies de 3000 m (Cuadro 3).
Cuadro 3: Valores del análisis de SIMPER, se presentan las especies que contribuyen 50% en la diferenciación de los sitios a lo largo del gradiente elevacional de Cofre de Perote, centro de Veracruz, México. Los números corresponden a cada uno de los pisos elevacionales (m): 1=20, 2=500, 3=1000, 4=1500, 5=2000, 6=2500, 7=3000, 8=3500.
| Especie | Contribución (%) | Acumulado (%) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Baccharis conferta Kunth | 5.08 | 5.08 | 0 | 0 | 0 | 0 | 0 | 1.2 | 3.53 | 2 |
| Piper amalago L. | 4.38 | 9.46 | 4.53 | 0.47 | 0.47 | 1.13 | 0 | 0 | 0 | 0 |
| Acaena elongata L. | 3.86 | 13.32 | 0 | 0 | 0 | 0 | 0 | 1 | 4.4 | 0.4 |
| Moussonia deppeana (Schltdl. & Cham.) Hanst. | 3.80 | 17.12 | 0 | 0 | 0 | 5.53 | 0.67 | 0 | 0 | 0 |
| Ribes ciliatum Humb. & Bonpl. ex Roem. & Schult. | 2.68 | 19.80 | 0 | 0 | 0 | 0 | 0 | 0 | 2.33 | 1.87 |
| Hoffmannia excelsa (Kunth) K. Schum. | 2.65 | 22.44 | 0 | 0 | 0 | 2.13 | 1.6 | 0 | 0 | 0 |
| Fuchsia microphylla Kunth | 2.48 | 24.92 | 0 | 0 | 0 | 0 | 0.47 | 2.53 | 0 | 0.2 |
| Ribes microphyllum Kunth | 2.24 | 27.16 | 0 | 0 | 0 | 0 | 0 | 0 | 1.67 | 1.33 |
| Eugenia capuli (Schltdl. & Cham.) Hook. & Arn. | 2.19 | 29.34 | 0.73 | 0.47 | 3.67 | 0 | 0 | 0 | 0 | 0 |
| Ardisia compressa Kunth | 2.03 | 31.37 | 0 | 2.2 | 0 | 0.46 | 1 | 0 | 0 | 0 |
| Roldana schaffneri (Sch. Bip. ex Klatt) H. Rob. & Brettell | 1.99 | 33.36 | 0 | 0 | 0 | 3.4 | 0 | 0 | 0 | 0 |
| Randia laetevirens Standl. | 1.97 | 35.33 | 0.33 | 0.6 | 2.93 | 0 | 0 | 0 | 0 | 0 |
| Xylosma flexuosa (Kunth) Hemsl. | 1.92 | 37.25 | 0.2 | 0 | 0.07 | 3 | 0 | 0 | 0 | 0 |
| Eugenia rhombea (O. Berg) Krug & Urb. | 1.83 | 39.08 | 0 | 0.2 | 4.13 | 0 | 0 | 0 | 0 | 0 |
| Piper lapathifolium (Kunth) Steud. | 1.81 | 40.88 | 0 | 0 | 0 | 3.07 | 0 | 0 | 0 | 0 |
| Ageratina glabrata (Kunth) R.M. King & H. Rob. | 1.80 | 42.68 | 0 | 0 | 0 | 0 | 0 | 0 | 3.13 | 0 |
| Barkleyanthus salicifolius (Kunth) H. Rob. & Brettell | 1.76 | 44.44 | 0 | 0 | 0 | 0 | 0 | 0 | 2.6 | 0.47 |
| Casearia corymbosa Kunth | 1.71 | 46.14 | 0.47 | 0.67 | 0.2 | 0.87 | 0 | 0 | 0 | 0 |
| Arbutus xalapensis Kunth | 1.58 | 47.72 | 0 | 0 | 0 | 0 | 0 | 0 | 3.07 | 0 |
| Bonellia macrocarpa subsp. pungens (A. Gray) B. Ståhl & Källersjö | 1.53 | 49.25 | 0.93 | 0.13 | 0.87 | 0 | 0 | 0 | 0 | 0 |
| Acalypha schlechtendaliana Müll. Arg. | 1.52 | 50.76 | 0 | 1.6 | 0.53 | 0 | 0 | 0 | 0 | 0 |
Discusión
Riqueza de especies
La riqueza estimada de especies de arbustos para Veracruz es de 1527 (Castillo-Campos et al., 2011), por lo tanto, las 118 especies y 14 morfoespecies registradas en este estudio representan aproximadamente 8.6% de la riqueza total del estado. Los valores de las especies observadas son cercanos a los estimados por Chao1 (en general más de 80%), lo cual indica un muestreo satisfactorio. El déficit observado en el piso elevacional de 1000 m se debe al alto número de taxa únicos y duplicados; sin embargo, los valores del modelo de Clench sugieren que para alcanzar la asíntota se necesitaría incrementar entre 15 y 50 veces más el número de cuadrantes (Cuadro 1). Por lo tanto, se considera que, a pesar del número de muestras reducido, el muestreo es satisfactorio ya que las especies registradas por piso elevacional representan entre 64 y 82% de las especies estimadas por el modelo.
El número de especies de arbustos registrado en este estudio resulta alto (132 especies) si se compara con los resultados de otros gradientes elevacionales realizados en algunos estados de México y otros países (p. ej. Vázquez-García y Givnish, 1998; Chawla et al., 2008; Mazzola et al., 2008; De León-Mata et al., 2013; Ramos et al., 2015) (Cuadro 4). La baja riqueza de los otros estudios se debe a la corta longitud de sus gradientes, menor superficie y menos tipos de vegetación muestreados. Al contrario, en este estudio se muestreó mayor superficie (4.8 ha) y un gradiente completo, es decir, desde el nivel del mar hasta las partes altas de las montañas, además de incluir más tipos de vegetación y heterogeneidad ambiental. Sin embargo, si contrastamos la riqueza de arbustos con las 155 especies de helechos y licófitos reportadas por Carvajal-Hernández y Krömer (2015) y sobre todo las 264 especies de herbáceas angiospermas registradas por Gómez-Díaz et al. (2017a) en el mismo gradiente, esta resulta baja. Estos últimos grupos tienen más disponibilidad de nichos por su menor tamaño, además de crecer sobre el suelo, rocas y, en el caso de muchos helechos epífitos, sobre los árboles. Así, estos dos grupos se ven favorecidos por las temperaturas templadas y altos niveles de precipitación y humedad ambiental que brinda el bosque mesófilo, razón por la cual la mayor riqueza de ambos grupos se registró en elevaciones intermedias, contrario a lo observado en arbustos, los cuales se benefician por la estacionalidad que actúa sobre la fenología de la vegetación y los climas cálido-secos que propician su crecimiento (Rzedowski, 2006; Challenger y Soberón, 2008).
Cuadro 4: Riqueza de arbustos y otros grupos registrada en gradientes elevacionales ubicados en otros países y estados de México, indicando su rango elevacional y superficie muestreada.
| Región, País | Elevación (m) | Superficie (ha) | Grupo | Número de especies | Referencia |
| Este estudio | 20-3500 | 4.8 | Arbustos | 132 | --------------------- |
| Durango, México | 2131-2556 | 0.282 | Arbustos | 21 | De León-Mata et al., 2013 |
| Jalisco, México | 1500-2500 | 2.8 | Arbustos | 76 | Vázquez-García y Givnish, 1998 |
| Sierras de Lihue Calel, Argentina | 380-547 | 11.25 | Arbustos | 26 | Mazzola et al., 2008 |
| Valle interandino, Perú | 1720-2957 | 0.016 | Arbustos | 18 | Ramos et al., 2015 |
| Himalaya, India | 1500-5600 | - | Arbustos | 29 | Chawla et al., 2008 |
| Veracruz, México | 20-3500 | 4.8 | Helechos y licófitos | 155 | Carvajal-Hernández y Krömer, 2015 |
| Veracruz, México | 20-3500 | 4.8 | Herbáceas angiospermas | 264 | Gómez-Díaz et al., 2017a |
Patrones de riqueza y distribución a lo largo de los gradientes
El decremento de especies a partir de los 1500 m, así como la agrupación y restricción de las especies por elevación y tipo de vegetación observada en el MSD y SIMPER (Cuadro 3, Fig. 3), se deben al recambio de especies neotropicales a neárticas, ya que a partir de la franja media del gradiente (1500 m) hacia el extremo superior (3500 m) pertenece al Cinturón Volcánico Transmexicano. En este dominan especies de origen neártico como Fuchsia microphylla Kunth, Acaena elongata, Ribes ciliatum, Baccharis conferta y Moussonia deppeana, que son capaces de crecer en bosques templados con temperaturas bajas como el bosque de Pinus y Abies, así como en el bosque mesófilo de montaña con alta humedad y precipitación (Whittaker, 1956; Palmer y Cowling, 1994; Rzedowski, 2006; Espinosa et al., 2008). La agrupación y separación de especies en elevaciones bajas (20, 500 y 1000 m) se debe a que más de 50% de los taxa registrados pertenecen a familias de origen neotropical y pantropical, las cuales suelen limitar su distribución a bosques situados en elevaciones bajas. Lo mismo ha sido reportado por Vázquez-García y Givnish (1998), quienes observaron que 17 familias restringen su distribución a elevaciones bajas de la Sierra de Manantlán, Jalisco. Por otro lado, el pico de riqueza observado en el encinar tropical situado a 1000 m se debe a la fenología de este tipo de vegetación. De acuerdo con Challenger y Soberón (2008), estos encinares son caducifolios y de corta estatura formando bosques semiabiertos en las áreas de transición de clima más seco y cálido. Esto permite la germinación y rápido crecimiento del estrato arbustivo, así como la convergencia de especies de distintas comunidades vegetales como Achatocarpus nigricans Triana, Sapranthus microcarpus (Donn. Sm.) R.E. Fr., Wimmeria concolor Schltdl. & Cham. y Myrcia aromatica presentes en la selva mediana subcaducifolia y encinar tropical (Chazdon, 2003).
Efecto de la perturbación sobre el hábitat
Los hábitats secundarios de la selva mediana subcaducifolia de 500 m y del encinar tropical de 1000 m contienen la mayor cantidad de especies, mientras que el hábitat conservado y perturbado muestran valores más bajos (Fig. 4). Lo anterior indica que cambios en la estructura del bosque, causados por la acción humana, pueden incrementar la riqueza total de estos fragmentos de bosque, pero al mismo tiempo modificar la composición florística de arbustos al haber una pérdida de especies de 7 a 26% pasando de un hábitat conservado a uno secundario. Esto explica la clara separación de los hábitats en la elevación de 1000 m observada en el MDS entre hábitats de cada elevación (Fig. 4). Esta pérdida puede deberse a la vulnerabilidad de especies humbrófilas con requerimientos microclimáticos específicos que brinda un hábitat conservado. Sin embargo, la alteración del hábitat conservado propicia las condiciones necesarias para la llegada y crecimiento de especies secundarias mayormente heliófilas, las cuales suelen verse favorecidas por la mayor entrada de luz en hábitats antropizados (p. ej. Chileranthemum trifidum Oerst., Verbesina persicifolia D.C., Adelia barbinervis Schltdl. & Cham. y Euphorbia schlechtendalii Boiss.).
El efecto de la perturbación y fragmentación sobre la riqueza de especies en bosques de tierras bajas está ampliamente documentado (p. ej. Magrach et al., 2014; Leicht-Young y Pavlovic, 2015; Schnitzer, 2015). En el sur de Veracruz y en la zona costera del centro del estado, Zambrano et al. (2014) y Mesa-Sierra y Laborde (2017) encontraron que las semillas y plántulas del sotobosque podrían verse afectadas por condiciones microclimáticas alteradas en un paisaje fragmentado, ya que estas especies parecen estar adaptadas a condiciones moderadas de humedad y temperatura que, respectivamente, disminuyen y aumentan con la intensidad de uso del bosque (Dale et al., 2001). Como ejemplos de lo anterior destacan Perrottetia ovata Hemsl., Piper nudum C. DC., Psychotria graciliflora Benth. y Randia sp., las cuales fueron registradas únicamente en los hábitats conservados de las elevaciones de 500 y 1000 m.
Un patrón similar ha sido reportado por Carvajal-Hernández y Krömer (2015) y Gómez-Díaz et al. (2017a) en la parte media de este gradiente, donde cambios en la estructura del bosque mesófilo de montaña, debido a la perturbación, pueden ocasionar la pérdida de especies con requerimientos microambientales específicos. Esto mismo, pero en menor proporción, se hace evidente en arbustos ya que especies como Oreopanax capitatus (Jacq.) Decne. & Planch. y Oreopanax echinops se registraron únicamente en el bosque mesófilo conservado. Esto amenaza sobre todo a la última, ya que es una especie en categoría de riesgo y es posible que la continua perturbación y fragmentación de su hábitat ocasione su extinción local.
La protección de las especies detona un tema importante reflejando la escasa información florística y ecológica sobre este y otros grupos. Es importante mencionar que ninguna especie de arbusto registrada en este estudio aparece en la NOM-059-SEMARNAT-2010 (SEMARNAT, 2010), que protege a especies nativas de flora y fauna. Esto se puede deber a que dicho listado de plantas está incompleto o desactualizado. Hay especies nuevas, raras o endémicas como Hoffmannia arqueonervosa Cast.-Campos y Psychotria perotensis Cast.-Campos (Castillo-Campos et al., 2009; 2013), que han sido descubiertas recientemente en fragmentos cercanos al gradiente y por lo tanto deberían ser consideradas como amenazadas. Igualmente, hay especies de otros grupos que son endémicas de la region central de Veracruz como, por ejemplo, Monstera florescanoana Croat, T. Krömer & Acebey, Peperomia chazaroi G. Mathieu & T. Krömer y Resinanthus aromaticus (Cast.-Campos & Lorence) Borhidi (Croat et al., 2010; Gómez-Pompa, 2010; Mathieu et al., 2015), que están en riesgo por la reducción de sus poblaciones y presión antrópica ejercida sobre las comunidades vegetales donde habitan. Por lo anterior, es importante estudiar los patrones ecológicos de las especies en conjunto, ya que estos no están distribuidos de manera puntual, sino que responden de manera diferente a factores bióticos y abióticos.
Conclusión
De acuerdo con la búsqueda exhaustiva de literatura se puede decir que este estudio es el primero en el Neotrópico en considerar y analizar los arbustos como un grupo individual a lo largo de un gradiente completo, con distintos grados de perturbación, utilizando un método de muestreo uniforme y comparable. Este hecho nos permite tener una idea aproximada de la resiliencia de las especies frente a los disturbios antrópicos, ya que determinados cambios dentro de la estructura de los bosques podrían ocasionar la pérdida de especies con requerimientos microclimáticos específicos y, en consecuencia, alterar procesos dentro de los ecosistemas.
Por otro lado, la implementación de una metodología estandarizada ha permitido detectar que existen fragmentos de bosque conservado hasta secundario son altamente ricos en especies y al mismo tiempo susceptibles. Por lo tanto, sirven como zonas estratégicas de amortiguación y refugio de plantas, y así podrían y deberían considerarse en futuros planes de conservación en esta región amenazada por la degradación ambiental, independientemente de la intensidad de su uso. Tomando en cuenta la riqueza de arbustos reportada en este estudio junto con la de helechos, angiospermas herbáceas y lianas leñosas de este mismo gradiente, se puede decir que los bosques de la ladera este del Cofre de Perote resguarda una considerable riqueza florística equivalente a 8% de las 7800 especies estimadas para Veracruz (Castillo-Campos et al., 2011; Bautista-Bello, 2018).
Por esta razón, es necesario plantear iniciativas de preservación, ya que sólo 2% de la extensión superficial de esta área está bajo protección federal y 0.8% está bajo protección estatal debido a la nueva Reserva del Archipiélago (Gómez-Díaz et al., 2018). Además, esta es un área que alberga varias comunidades vegetales como la selva mediana subcaducifolia, el encinar tropical y el bosque mesófilo de montaña, que están consideradas entre los tipos de vegetación con mayor amenaza por el cambio de uso de suelo a nivel nacional y estatal. Por lo anterior, es necesario detectar los tipos de perturbación predominantes para su control y restricción a nivel regional, así como frenar la expansión agrícola y evaluar la viabilidad e implementación de programas de pago por servicios ambientales que promuevan la permanencia y el mantenimiento de estos ecosistemas.











 nueva página del texto (beta)
nueva página del texto (beta)



