Introducción
Los agaves cultivados o silvestres son parte del paisaje del estado de Oaxaca, en donde Agave angustifolia Haw. y A. karwinskii Zucc. (Agavaceae) son plantas de importancia cultural y económica para sus pobladores, además de formar parte de diversos tipos de vegetación como el matorral xerófilo y el bosque tropical caducifolio. Sus usos son variados, en especial los jugos de tallos y base de hojas cocidos que se utilizan para preparar el mezcal; su elaboración tradicional se ha conservado por generaciones de grupos indígenas de Oaxaca, los cuales identifican a los agaves y al mezcal como un símbolo de identidad cultural (García-Mendoza et al., 2004; Vázquez-Pérez, 2015).
Agave angustifolia crece de manera silvestre en toda la sierra occidental del sur y sureste de México. En Oaxaca es conocido como espadín; por su alta producción en azúcares, tiempo de maduración (5-7 años) y fácil propagación por hijuelos, se ha convertido en el principal maguey cultivado en el estado destinado a la producción de mezcal. También se usan otros agaves silvestres como A. karwinskii que posee distintas variedades y formas morfológicas silvestres y manejadas, se le conoce con diferentes nombres comunes: cuishe, san martín y tobasiche, en los Valles Centrales; mientras que bicuishe y madrecuishe son los nombres empleados en la Sierra Sur de Oaxaca. Esta especie se caracteriza por tener un tallo largo (caulinar) que se utiliza también para la producción del mezcal en forma artesanal a nivel local (García-Mendoza et al., 2004; Vázquez-Pérez, 2015).
Diversas investigaciones indican que los hongos micorrizógenos arbusculares (HMA, Glomeromycota) se asocian con las raíces de agaves, como Agave marmorata Roezl, A. salmiana Otto ex Salm-Dyck (Camargo-Ricalde et al., 2003), A. lechuguilla Torr., A. striata Zucc. (García-Sánchez et al., 2008), A. potatorum Zucc. (Carballar-Hernández et al., 2013) y A. angustifolia (Ochoa-Meza et al., 2009). La simbiosis de los HMA con los agaves puede ser de gran importancia para su supervivencia y nutrición en los ecosistemas áridos y semiáridos que habitan, debido a que en estos ambientes se presentan altas temperaturas, poca disponibilidad de agua, fósforo y nitrógeno en el suelo (Montaño et al., 2008). Debido a la relevancia de los agaves mezcaleros y a su simbiosis con los HMA, se han realizado estudios enfocados a determinar la diversidad de estos hongos presentes en los suelos en donde crecen A. karwinskii, A. marmorata y A. potatorum de los Valles Centrales (Carballar-Hernández et al., 2013), así como de A. potatorum en la región Mixteca de Oaxaca (Hernández-Morales et al., 2014), con el fin de utilizar consorcios de HMA potencialmente eficientes para el cultivo de los agaves mezcaleros (Robles-Martínez et al., 2013).
En los Valles Centrales de Oaxaca, Carballar-Hernández (2009) y Carballar-Hernández et al. (2013) registraron en A. marmorata, A. karwinskii y A. potatorum una amplia diversidad de especies de HMA en condiciones naturales; principalmente de las familias Acaulosporaceae y Glomeraceae. Asimismo, reportaron morfoespecies del género Acaulospora Gerd. & Trappe con caracteres morfológicos diferentes a los de las especies de HMA ya descritas, lo cual sugiere que en el suelo de los agaves hay una diversidad taxonómica de HMA aún desconocida. Así, al estudiar los HMA asociados con A. angustifolia y A. karwinskii en los Valles Centrales y en la Sierra Sur de Oaxaca, en la presente investigación, se identificaron tres especies del género Acaulospora y una de Paraglomus J.B. Morton & D. Redecker no registradas con anterioridad en ecosistemas de México (Alarcón et al., 2012; Montaño et al., 2012), particularmente en agaves (Carballar-Hernández et al., 2013; Robles-Martínez et al., 2013). De esta manera, los objetivos de este estudio son reportar y presentar las descripciones taxonómicas de cuatro nuevos registros de especies de HMA para México, provenientes del estado de Oaxaca, asociados al suelo de dos especies de agaves mezcaleros: A. angustifolia y A. karwinskii.
Materiales y Métodos
El muestreo se realizó en la Región de los Valles Centrales y en la Región de la Sierra Sur de Oaxaca; ambas pertenecen a la Provincia Biogeográfica Sierra Madre del Sur. El clima es semi-seco cálido a semi-cálido (BSh) con lluvias en verano. Los suelos que predominan son Regosoles, Leptosoles, Calcisoles y Phaeozems. La vegetación comprende selvas bajas caducifolias y matorrales xerófilos que se encuentran fuertemente alterados y fragmentados por las actividades agropecuarias (INEGI, 2010).
El muestreo de suelo rizosférico se hizo durante la temporada de secas (enero 2016) en nueve sitios de muestreo (S), cinco en los Valles Centrales (S1 al S5) y cuatro en la Sierra Sur (S6 al S9) (Cuadro 1). En cada uno de ellos se seleccionaron tres plantas diferentes de A. karwinskii o de A. angustifolia y, de cada agave, se recolectó una muestra compuesta de suelo a partir de tres sub-muestras de 600g c/u, tomadas alrededor de la base de la planta a una profundidad de 0 a 20 cm. Se colocaron en bolsas de plástico negras para su traslado al Laboratorio de Edafología de la Universidad Autónoma Metropolitana, Iztapalapa (UAM-IZ). Asimismo, se establecieron macetas para la propagación de los HMA con el suelo recolectado (500 g/maceta) en condiciones de invernadero para obtener esporas recién formadas (Stutz y Morton, 1996). Las plantas hospederas fueron maíz (Zea mays L.) y una leguminosa (Leucaena sp.) conocida como guaje. El período de propagación fue de seis meses con riegos cada tercer día.
La extracción de esporas de HMA se hizo por el método de tamizado en húmedo y decantación (Gerdemann y Nicolson, 1963), usando 100 g de suelo por cada muestra. Para separar las esporas del material mineral y orgánico del suelo se centrifugó en una solución de sacarosa al 60%. Por medio de un microscopio estereoscópico (Leica Zoom 2000, Nueva York, EUA) se separaron los morfotipos de los HMA, se contabilizaron y se realizaron preparaciones permanentes de las esporas con alcohol polivinílico en lactoglicerol (PVLG) y PVLG con reactivo de Melzer (1:1, v/v) como lo recomienda la International Culture Collection of (Vesicular) Arbuscular Mycorrhizal Fungi (INVAM, 2017). De esta manera se observaron al microscopio óptico (Olympus BX41, Tokio, Japón) con contraste de interferencia de Nomarski y se tomaron microfotografías con una cámara Olympus (C5060, Tokio, Japón).
Cuadro 1: Sitios de recolecta de suelo asociado a Agave angustifolia Haw. y Agave karwinskii Zucc. en los Valles Centrales (S1-S5) y Sierra Sur (S6-S9) de Oaxaca, México. * Según la localidad, los pobladores nombran y conocen a Agave karwinskii como cuishe, san martín, tobasiche, bicuishe o madrecuishe; mientras que al Agave angustifolia, como espadín. Metros sobre el nivel del mar (m s.n.m.), pH es el activo relación 1:2.5 (suelo:agua), porcentaje materia orgánica (MO), fósforo disponible (P)(Olsen et al., 1954).
| Sitio | Coordenadas | Altitud (m s.n.m.) | Especie vegetal | Características del sitio y condiciones edáficas en donde crecen los agaves mezcaleros |
| S1, San Pedro Totolapan | 16º40'58''N 96º18'23''O | 940 | Agave karwinskii (cuishe*) | Matorral xerófilo semi-conservado y poblaciones silvestres de agave. Suelo franco-arenoso, pH: 7.52 (H2O), MO: 2.68%, P: 4 mg kg-1. |
| S9, San Luis Amatlán, Miahuatlán | 16°22'23.4''N 96°28'39.9''O | 1555 | Agave karwinskii (madrecuishe*) | Matorral xerófilo y selva baja caducifolia semi-conservada con leguminosas, gramíneas y agaves silvestres. Suelo franco-arenoso, pH: 8.0, MO: 4.09%, P: 0.25 mg kg-1. |
La determinación taxonómica de las especies de HMA se basó en el reconocimiento, comparación y contraste de los caracteres morfológicos de sus esporas y la reacción al reactivo de Melzer de las capas que constituyen la pared. Las esporas se midieron con una reglilla micrométrica acoplada a uno de los oculares del microscopio y su coloración se obtuvo con una fórmula de porcentajes de azul, magenta, amarillo y negro (INVAM, 2017). Esta información se contrastó con las descripciones de las especies de Glomeromycota conocidas y disponibles en “arbuscular mycorrhizal fungi phylogeny (Schüβler, 2017), en el INVAM (2017) y en descripciones e ilustraciones de HMA propuesto por Blaszkowski (2017). Para describir las paredes de las esporas de Acaulospora se siguió la terminología empleada por Oehl et al. (2012); para las esporas de Paraglomus se empleó la terminología de Oehl y Sieverding (2004) y Aragão de Mello et al. (2013). Los ejemplares biológicos de referencia se depositaron en el Herbario de la Escuela Nacional de Ciencias Biológicas (ENCB) (acrónimo de acuerdo con Holmgren et al., 1990) del Instituto Politécnico Nacional (IPN) y respaldos en el laboratorio de Edafología de la Universidad Autónoma Metropolitana, Iztapalapa (UAM-IZ) que están disponibles para su consulta.
Para caracterizar el ambiente edáfico donde crecen los agaves y los HMA se practicaron los siguientes análisis de acuerdo con los procedimientos propuestos en Jackson (1976) y Van Reeuwijk (1999): pH por medio de un potenciómetro (Thermo Scientific, Orion Star, Singapur), en una relación 1:2.5 suelo-agua, la textura por el método de Bouyoucos, la materia orgánica (MOS) por combustión húmeda por el método de Walkley & Black y el fósforo disponible por el método de Olsen (Olsen et al., 1954). Las bases extraíbles calcio (Ca++), magnesio (Mg++), sodio (Na+) y potasio (K+) se extrajeron con una solución de acetato de amonio 1N, pH 7; así el Ca++ y Mg++ fueron valorados por el método de Versenato (EDTA), mientras que el Na+ y el K+ se determinaron por medio de flamometría de emisión (Flame Photometer M410, Corning; Halstead, Essex Inglaterra).
Taxonomía
Acaulospora minutaOehl, Tchabi, Hount., Palenz., I.C. Sánchez & G.A. Silva, J. Appl. Bot. Food Qual. 84: 214. 2011. TIPO: BENIN. Sur de Guinea, 08°20'N; 01°51'E, sabana natural, XII.2006, F. Oehl F0366 (holotipo: 3343 (ZT), isotipo: 3344 (ZT)). MycoBank MB 561834. Figs. 1A-D.
Esporas solitarias en el suelo dispuestas lateralmente sobre restos del sáculo esporífero que es hialino, esporas color anaranjado claro (0/10/40/0), globosas, 150-170 µm de diámetro, al romperse la pared de la espora se divide en tres grupos, pared externa (OW), intermedia (MW) e interna (IW); la pared más externa (OW) con tres capas (OWL1-L3), ninguna de las capas reaccionó al reactivo de Melzer, juntas tienen un grosor de 4.8 µm; OWL1 evanescente, ausente en esporas maduras; OWL2 color anaranjado claro (0/10/40/0), laminada, 3.1 µm de grosor, cubierta de diminutas depresiones regulares, 1.18-1.52 µm de diámetro, profundidad menor a 1 µm, separación entre 0.9 y 1.8 µm, de distribución homogénea, OWL3 similar en color a OWL2, menor a 1 µm de grosor; la pared intermedia (MW) con dos capas hialinas (MWL1-L2), no reaccionaron al reactivo de Melzer, semiflexibles, fuertemente adheridas que hace pensar que se trata de una sola capa, ambas capas miden 1.3-1.5 µm de grosor, la pared interna (IW) con tres capas (IWL1-L3) hialinas, semiflexibles, en conjunto miden 2.57 µm; IWL1 menos de 1 µm de grosor con pequeñas granulaciones sobre su superficie; IWL2 1.3 µm de grosor, reaccionó al reactivo de Melzer cambiando su coloración de hialina a rosada (0/30/20/0); IWL3 midió menos de 0.5 µm de grosor; cicatriz subcircular, 13.5 µm de ancho y 15.5 µm de largo; el borde de su circunferencia engrosado y ornamentado con las diminutas depresiones.
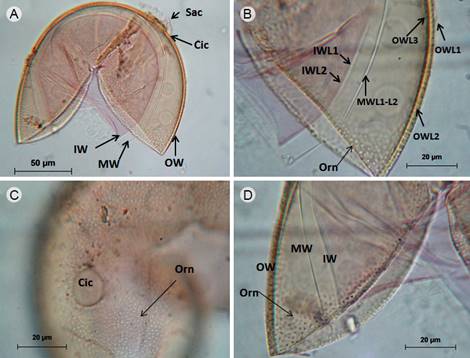
Figura 1: Acaulospora minuta Oehl, Tchabi, Hount., Palenz., I.C. Sánchez & G.A. Silva. A-D. esporas en reactivo de Melzer, A. espora con una cicatriz (Cic), restos del sáculo (Sac) y pared de la espora que se divide en externa (OW), intermedia (MW) e interna (IW); B. OW constituida de tres capas (OWL1-L3) con ornamentación (Orn) en OWL2 , MW con dos capas (MWL1-L2), IW con tres capas (IWL1-L3), únicamente la capa IWL2 reaccionó al reactivo de Melzer, IWL3 al medir menos de 0.5 µm de grosor es una capa difícil de observar por estar fuertemente adherida a IWL2; C. detalle de la cicatriz (Cic) y de la ornamentación (Orn) de la espora en la pared laminada; D. detalle de la ornamentación (Orn) que consiste en depresiones sobre la capa laminada de OW, mientras que las capas intermedias (MW) e internas (IW) son hialinas y lisas; solo la capa más interna de IW reaccionó ligeramente al reactivo de Melzer.
Hábitat y distribución: Acaulospora minuta solo se había reportado de Benin, del Oeste Sub-Sahariano de África en el suelo de siete sitios de sabana natural y de zonas de cultivo con Dioscorea spp. En invernadero A. minuta formó simbiosis micorrízica con plantas como D. cayenensis Lam., D. rotundata Poir. y Sorghum bicolor Pers. (Oehl et al., 2011). Ahora también se distribuye en el sureste mexicano en el estado de Oaxaca, en la rizósfera de A. karwinskii.
Material examinado: MÉXICO. Oaxaca, municipio San Agustín Amatengo (S3), Valles Centrales de Oaxaca, 1387 m s.n.m., 16°31'05.8''N, 96°47'08.2''O, en la rizósfera de Agave karwinskii (san martín): suelo arenoso-franco (79.2% arena, 16.4% limo y 4.4% arcilla), neutro (pH: 7.28, H2O), medianamente rico en MO (3.26%), muy pobre en fósforo disponible (0.7 mg kg-1), con altos contenidos de calcio (15 cmoles(+)kg-1) y magnesio (7.5 cmoles(+)kg-1) y bajos en potasio (0.29 cmoles(+)kg-1) y sodio (0.14 cmoles(+)kg-1), 20.I.2016, J. Y. Salmerón-Castro 008a (ENCB).
Comentarios taxonómicos: El género Acaulospora está constituido por 55 especies formalmente descritas; de ellas, casi 65% presenta esporas con algún tipo de ornamentación en la pared laminada (Oehl et al., 2012; Schüβler, 2017) como son espinas (A. spinosa Walker & Trappe), tubérculos (A. tuberculata Janos & Trappe), depresiones (A. scrobiculata Trappe), verrugas (A. ignota Blaszk., Góralska, Chwat & Goto), pliegues cerebriformes (A. rehmii Sieverd. & S. Toro) o una doble ornamentación que consiste de espinas o depresiones encerradas por un retículo (A. bireticulata F.M. Rothwell & Trappe o A. reducta Oehl, B.T. Goto & C.M.R. Pereira). Debido a que A. minuta posee esporas con una pared laminada cubierta con depresiones diminutas (<2µm de diámetro) distribuidas de forma regular, puede ser diferenciada de A. cavernata Blaszk., A. excavata Ingleby & C. Walker, A. foveata Trappe & Janos, A. reducta y A. verna Blaszk., que presentan depresiones de mayor tamaño (>4 µm de diámetro) en la capa laminada. Acaulospora minuta difiere de A. baetica Palenz., Oehl, Azcón-Aguilar & G.A. Silva, A. herrerae E. Furrazola, B.T. Goto, G.A. Silva, Sieverd. & Oehl, A. lacunosa J.B. Morton, A. nivalis Oehl, Palenz., Sánchez-Castro, G.A. Silva & Sieverd., A. scrobiculata y A. sieverdingii Oehl, Sýkorová, Blaszk. & G.A. Silva, porque las depresiones en las capas laminadas son más grandes e irregulares en comparación con las depresiones regulares diminutas en diámetro de A. minuta. Asimismo, difiere de A. alpina Oehl, Sýkorová & Sieverd., que presenta depresiones regulares sobre la capa laminada, pero que son de forma cónica y más grandes y espaciadas que en A. minuta. Otras especies como A. paulinae Blasz. o A. punctata Oehl, Palenz., Sánchez-Castro, G.A. Silva, C. Castillo & Sieverd., presentan esporas ornamentadas con depresiones, pero a diferencia de A. minuta son más grandes en diámetro, profundidad y distancia de separación entre ellas (Oehl et al., 2012; Pereira et al., 2015).
Acaulospora papillosa C.M.R. Pereira & Oehl. Phytotaxa 260(1): 16. 2016. TIPO: BRASIL. Pernambuco, Tamandaré, Reserva Biológica de Saltinho, 8°43'09''S, 35°10'11''O, bosque tropical húmedo, 01.IV.2015, C. M. R. Pereira 87964 (URM) (isotipos: 87965-87967 (URM), 55192 (ZT)). MycoBank MB 814407. Figs. 2A-E.
Esporas solitarias en el suelo, sin presencia del sáculo esporífero; blancas con tonalidades de amarillo (0/0/40/0), globosas, 62-82 µm de diámetro, al romperse, la pared de la espora se divide en tres grupos, pared externa (OW), intermedia (MW) e interna (IW); la pared externa (OW) con tres capas (OWL1-L3), ninguna de las capas reaccionó al reactivo de Melzer, juntas 3.4 µm de grosor, OWL1 evanescente, hialina, 1.1-2.2 µm de grosor, cubierta de finas papilas, 0.7 µm de diámetro, separación entre ellas 1.2 µm; OWL2 color amarillo claro (0/0/40/0), laminada, lisa, 1.8-2.4 µm de grosor; OWL3 hialina, semiflexible, menor a 1 µm de grosor, fuertemente adherida a OWL2; la pared intermedia (MW) con dos capas subhialinas (MWL1-L2), no reaccionan al reactivo de Melzer, semiflexibles, ambas miden 1.2 µm de grosor; la pared interna (IW) con dos capas (IWL1-L2) hialinas, semiflexibles; IWL1, menor de 1 µm, con granulaciones sobre su superficie como la mayoría de las especies de Acaulospora (Oehl et al., 2012); IWL2 1.5 µm de grosor, reaccionó al reactivo de Melzer cambiando su coloración hialina a púrpura rojizo (20/80/40/0) o púrpura intenso (40/80/40/0).
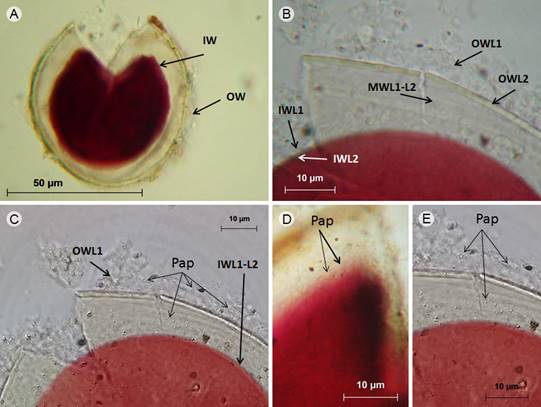
Figura 2: Acaulospora papillosa C.M.R. Pereira & Oehl. A-E. esporas en reactivo de Melzer, A. espora con pared externa (OW) e interna (IW); B. detalle de la capa evanescente, hialina (OWL1) y laminada (OWL2) en OW; de las capas hialinas intermedias (MWL1-L2) y de las dos capa hialinas internas (IWL1-L2) en donde sólo la capa IWL2 reaccionó al reactivo de Melzer; C. vista de las papilas (Pap) sobre OWL1 y pared interna con dos capas (IWL1-L2); D. papilas (Pap) vistas en primer plano; E. detalle de la ornamentación que consiste de finas papilas (Pap) sobre la capa más externa (OWL1).
Hábitat y distribución: Acaulospora papillosa solo se había reportado del suelo recuperado de un bosque tropical húmedo en Pernambuco, Brasil. En cultivos puros A. papillosa formó simbiosis micorrízica arbuscular con Zea mays (Pereira et al., 2016). Ahora también se distribuye en el sureste mexicano en el estado de Oaxaca, asociado al suelo de los agaves mezcaleros A. angustifolia y A. karwinskii.
Material examinado: MÉXICO. Oaxaca, municipio Ejutla (S2), km 50 carretera Oaxaca - Ejutla, Valles Centrales de Oaxaca, 1508 m s.n.m., 16°38'31''N, 96°44'04.2''O, en la rizósfera de A. angustifolia (espadín): suelo franco-arenoso (63.4% arena, 20.2% limo y 16.4% arcilla), neutro (pH: 7.19, H2O), medianamente rico en MO (2.16%), muy pobre en fósforo disponible (0.8 mg kg-1), con altos contenidos de calcio (28 cmoles(+)kg-1), magnesio (6.7 cmoles(+)kg-1) y potasio (0.65 cmoles(+)kg-1) y bajo en sodio (0.18 cmoles(+)kg-1), 20.I.2016, J. Y. Salmerón-Castro 004 (ENCB). Municipio San Agustín Amatengo (S4), Valles Centrales de Oaxaca, 1387 m s.n.m., 16°31'05.8''N, 96°47'08.2''O, en la rizósfera de A. karwinskii (tobasiche): suelo franco-arenoso (63.2% arena, 18.2% limo y 18.4% arcilla), ligeramente alcalino (pH: 7.86, H2O), medianamente rico en MO (2.51%) y muy pobre en fósforo disponible (0.4 mg kg-1), 20.I.2016, J. Y. Salmerón-Castro 006 (UAMIZ), 007 (UAMIZ). Municipio San Luis Amatlán, Miahuatlán (S6), Sierra Sur de Oaxaca, 1525 m s.n.m., 16°22'28.7''N y 96°39'11.1''O, en la rizosfera de A. karwinskii (madrecuishe): suelo franco-arenoso (57.6% arena, 26% limo y 16.4% arcilla), ligeramente alcalino (pH: 8.02, H2O), rico en MO: 5.72%, muy pobre en fósforo disponible (1.2 mg kg-1); con altos contenidos de calcio (28.5 cmoles(+)kg-1) y magnesio (7.9 cmoles(+)kg-1), mediano en potasio (0.43 cmoles(+)kg-1) y bajo en sodio (0.13 cmoles(+)kg-1), 21.I.2016, J. Y. Salmerón-Castro 016 (UAMIZ).
Comentarios taxonómicos: Acaulospora papillosa puede ser reconocida por las pequeñas papilas en la capa evanescente (OWL1) de la pared de las esporas, ya que en la mayoría de las especies de Acaulospora con ornamentaciones como espinas (A. spinosa), tubérculos (A. tuberculata), depresiones (A. scrobiculata), verrugas (A. ignota), pliegues cerebriformes (A. rehmii) o doble ornamentación (A. bireticulata o A. reducta) se presentan en la pared laminada (OWL2) (Oehl et al., 2012; Schüβler, 2017). Las únicas especies de Acaulospora con una capa externa (OWL1) con ornamentaciones son A. pustulata, A. tortuosa (Palenzuela et al., 2013) y A. colliculosa (Kaonongbua et al., 2010). Las dos primeras especies al presentar una ornamentación de pústulas o estructuras como hifas irregulares muy grandes difieren de las diminutas papilas presentes en A. papillosa; mientras que A. colliculosa además de presentar protuberancias hemisféricas mayores a 1 µm de diámetro, presenta dos cicatrices que revelan su formación entrofosporoide y no acaulosporoide como en A. papillosa. Acaulospora papillosa puede ser confundida con A. morrowiae Spain & N.C. Schenck o A. rugosa J.B. Morton, por su similitud en el tamaño de las esporas; sin embargo, ninguna de estas especies presenta ornamentación en la capa evanescente como A. papillosa.
Acaulospora reductaOehl, B.T. Goto & C.M.R. Pereira, Mycotaxon 130(4): 986. 2016. TIPO: BRASIL. Pernambuco, Goiana, Estación experimental de Itapirema, 13 m s.n.m., 7°38'20''S, 34°57'10''O, plantaciones agrícolas con Manihot esculenta Crantz, 1.VI.2011, C. M. R. Pereira s.n. (holotipo: 87697 (URM), isotipos: 87698 (URM), 55894 (ZT)). MycoBank 812332. Figs. 3A-F.
Esporas libres en el suelo y no en esporocarpos, cicatriz en forma de estrella irregular, 14.5 µm de ancho, 17.8 µm de largo; restos del sáculo esporífero color amarillo claro (0/10/40/0), esporas color anaranjado (0/20/60/0), 150 µm de diámetro, al romperse la pared de las esporas se divide en tres grupos, pared externa (OW), intermedia (MW) e interna (IW); la pared más externa (OW) con tres capas (OWL1-L3), ninguna de estas capas reaccionó al reactivo de Melzer; OWL1 hialina, semipermanente, de 2 µm de grosor; OWL2 color anaranjado (0/20/60/0), laminada, 5.8-9.5 µm de grosor, con grandes depresiones, algunas circulares, 5.9 µm de diámetro, otras subcirculares, 7.8 µm de largo, 5.2 µm de ancho, la mayoría de forma irregular, hasta 7.8 µm de ancho, 17.9 µm de largo, 2-4 µm de profundidad, las depresiones de textura rugosa interna con pequeñas depresiones, menos de 1 µm de diámetro; OWL3 similar en color a OWL2, menor a 1 µm de grosor; la pared intermedia (MW) con dos capas hialinas (MWL1-L2), que no reaccionaron al reactivo de Melzer, semiflexibles, fuertemente adheridas entre ellas, casi 2 µm de grosor; la pared interna (IW) con al menos dos capas (IWL1-L2) hialinas, semiflexibles; IWL1 1.6 µm de grosor con excrecencias sobre su superficie; IWL2 3.1 µm de grosor con reacción al reactivo de Melzer tiñéndose hacia una coloración púrpura-rosado (0/60/30/10). De acuerdo a Pereira et al. (2015), la pared interna IW de A. reducta presenta tres capas; sin embargo, no fue posible distinguir la tercera capa IWL3 en nuestra revisión, probablemente por su delgadez y por estar fuertemente adherida a IWL2.
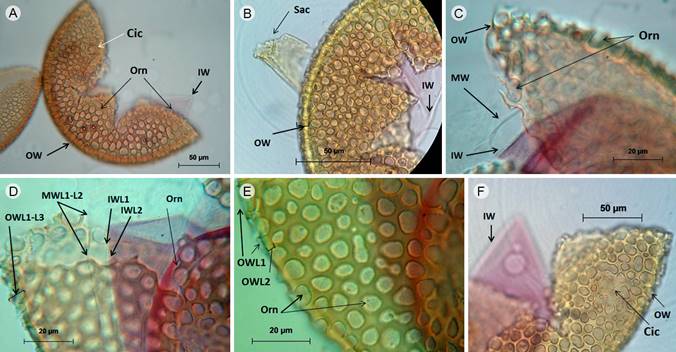
Figura 3: Acaulospora reducta Oehl, B.T. Goto & C.M.R. Pereira. A-F. esporas en reactivo de Melzer (solo la segunda capa interna (IWL2) hialina se tiñe púrpura-rosado (0/60/30/10) en el reactivo de Melzer), A. detalle de la ornamentación (Orn), cicatriz (Cic), pared externa (OW) e interna (IW) de la espora; B. espora con restos del sáculo (Sac), pared externa (OW) e interna (IW); C. espora con la pared externa (OW), intermedia (MW) e interna (IW) y detalle de la ornamentación (Orn); D. número de capas (L) en la pared externa (OWL1-L3), intermedia (MWL1-L2) e interna (IWL1-L2) con detalle de la ornamentación (Orn) en OW; E. espora con la capa hialina más externa (OWL1) y la capa laminada (OWL2) que muestra la ornamentación (Orn) consistente de grandes depresiones y en su interior tienen otras depresiones pequeñas; F. espora con cicatriz (Cic) en la pared externa (OW) y reacción del reactivo de Melzer en la pared interna (IW).
Hábitat y distribución: Acaulospora reducta solo se había reportado del suelo recuperado de bosque tropical húmedo, de regiones semiáridas en la “Caatinga” y de una sabana en “El Cerrado” del trópico brasileño (Pereira et al., 2015). Ahora también se distribuye en el sureste mexicano en el estado de Oaxaca, asociado a la rizósfera de Agave karwinskii.
Material examinado: MÉXICO. Oaxaca, municipio de San Agustín Amatengo (S3), Valles Centrales de Oaxaca, 1387 m s.n.m., 16°31'05.8''N y 96°47'08.2''O, en suelo rizosférico de Agave karwinskii (san martín): suelo arenoso-franco (79.2% arena, 16.4% limo y 4.4% arcilla), neutro (pH: 7.28, H2O), medianamente rico en materia orgánica (3.26%), muy pobre en fósforo disponible (0.7 mg kg-1); con altos contenidos de calcio (15 cmoles(+)kg-1) y magnesio (7.5 cmoles(+)kg-1) y bajos en potasio (0.29 cmoles(+)kg-1) y sodio (0.14 cmoles(+)kg-1), 20.I.2016, J. Y. Salmerón-Castro 008b (ENCB).
Comentarios taxonómicos: Acaulospora reducta, al presentar esporas con una pared laminada (OWL2) con doble ornamentación consistente de grandes depresiones irregulares (7.8-5.2 × 7.8-17.9 µm) y una rugosidad que consiste de pequeñas depresiones en su interior (<1 µm) puede ser fácilmente diferenciada de otras especies del género Acaulospora (Oehl et al., 2012). Solo Acaulospora bireticulata, A. elegans Trappe & Gerd. y A. denticulata Sieverd. & Toro (Oehl et al., 2012) tienen doble ornamentación; sin embargo, estas especies no presentan depresiones en la capa laminada como A. reducta, sino proyecciones poligonales redondeados en la punta y encerrados por un retículo (A. bireticulata y A. elegans) o sin este retículo (A. denticulata). Acaulospora reducta puede confundirse con A. excavata y A. verna ya que estas especies también presentan esporas ornamentadas con grandes depresiones en la capa laminada; sin embargo, el análisis detallado de las ornamentaciones permite diferenciarlas. En A. excavata las depresiones son más circulares y homogéneas en cuanto a su diámetro y profundidad, además de que la superficie de los hoyos es lisa, mientras que en A. reducta las depresiones son más irregulares y están ornamentadas en su interior. Por último, Acaulospora reducta difiere de A. verna en el tamaño promedio de las esporas (150 µm vs 75 µm) y en que la superficie interna de las depresiones está ornamentada y no es lisa como en A. verna (Pereira et al., 2015).
Paraglomus bolivianum (Sieverd. & Oehl) Oehl & G.A. Silva, J. Appl. Bot. Food. Quality. 86: 115. 2013. = Pacispora boliviana Sieverd. & Oehl, J. Appl. Bot. 78: 79. 2004. TIPO: BOLIVIA. Santa Cruz de la Sierra, Gran Chaco, 550 m s.n.m., 18°05'S; 63°20'O, pastizal degradado en un ecosistema semiárido, s.f., s.c. (Nr. 35-3501 (ZT)). MycoBank 488665. Figs. 4A-D.
Esporocarpos desconocidos; esporas solitarias en el suelo, color pardo claro (0/20/80/0), globosas, 85-90 µm de diámetro; al romperse la pared de la espora se separa en dos grupos, pared externa (OW) e interna (IW); la pared externa con tres capas (OWL1-OWL3) que no reaccionan al reactivo de Melzer; OWL1 hialina, semi-permanente, lisa, 2.8 µm de grosor, ausente en esporas maduras; OWL2 color pardo claro (0/20/80/0), permanente, laminada, 3.1 µm de grosor, ornamentada con depresiones, 3.6 µm de diámetro, 1.5 µm de profundidad, separadas 2.5 µm en promedio; OWL3 pardo muy claro (0/0/20/0), permanente, lisa, menor a 1 µm de grosor, fuertemente adherida a OWL2; la pared interna (IW) con tres capas (IWL1-L3) hialinas que no reaccionan al reactivo de Melzer, juntas 3.1 µm de grosor; IWL1 menor a 0.7 µm; IWL2 1.9 µm y IWL3 menor a 0.5 µm de grosor; hifa de sostén sub-hialina, recta, 5.9 µm de amplitud en la base de la espora, con dos capas (HWL1-L2) continuas con la pared externa de la espora, juntas 2.2 µm de grosor, poro de la hifa de sostén cerrado por un septo que se origina de la capa OWL3.
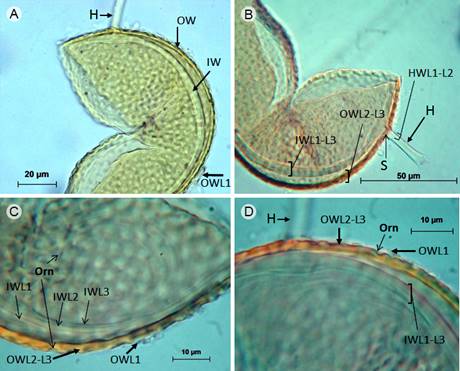
Figura 4: Paraglomus bolivianum (Sieverd. & Oehl) Oehl & G.A. Silva = Pacispora boliviana Sieverd. & Oehl. A-D. esporas en reactivo de Melzer sin reacción, A. espora con hifa (H) y dos grupos de paredes, una externa (OW) y una interna (IW), en OW se aprecian restos de la capa hialina más externa (OWL1); B. pared externa con una capa laminada (OWL2) y una permanente (OWL3), pared interna constituida por tres capas hialinas (IWL1-L3) y detalle de la hifa (H) con un septo (S) y dos capas (HWL1-L2) que son continuas con la pared externa de la espora; C. capa hialina (OWL1), laminada OWL2 y capa permanente OWL3 en la pared externa de la espora, nótese la ornamentación (Orn) en la capa laminada (OWL2) consistente de grandes depresiones, además detalle de las tres capas (IWL1, IWL2 y IWL3) hialinas en la pared interna de la espora; D. espora con hifa (H) presentando la capa hialina (OWL1), laminada (OWL2) y permanente (OWL3) en la pared externa de la espora y detalle de las tres capas hialinas (IWL1-L3) en la pared interna de la espora.
Hábitat y distribución: Paraglomus bolivianum solo se había reportado de Suramérica, de Santa Cruz, Bolivia, en un pastizal (pH: 6.5) y de Pernambuco, Brasil, en bosque seco “Caatinga” (pH: 5.2-6.8) y vegetación costera ((pH: 5.1) (Oehl y Sieverding, 2004; Aragão de Mello et al., 2013)). Ahora se distribuye también en el sureste mexicano en el estado de Oaxaca, asociado a la rizósfera de Agave angustifolia y A. karwinskii.
Material examinado: MÉXICO. Oaxaca, municipio San Pedro Totolapan (S1), Valles Centrales de Oaxaca, 940 m s.n.m., 16º40'58''N, 96º18'23''O, en suelo rizosférico de A. karwinskii (cuishe): suelo franco-arenoso (66% arena, 27.6% limo y 6.4% arcilla), neutro (pH: 7.52, H2O), medianamente rico en materia orgánica (2.68%), muy pobre en fósforo disponible (4 mg kg-1); con altos contenidos de calcio (21.2 cmoles(+)kg-1) y magnesio (16.5 cmoles(+)kg-1) y bajos en potasio (0.45 cmoles(+)kg-1) y sodio (0.18 cmoles(+)kg-1), 20.I.2016, J. Y. Salmerón-Castro 002 (ENCB). Municipio Ejutla (S2), km 50 carretera Oaxaca - Ejutla, Valles Centrales de Oaxaca, 1508 m s.n.m., 16°38'31''N, 96°44'04.2''O, en la rizósfera de A. angustifolia: suelo franco-arenoso (63.4% arena, 20.2% limo y 16.4% arcilla), neutro (pH: 7.19, H2O), medianamente rico en MO (2.16%), muy pobre en fósforo disponible (0.8 mg kg-1), con altos contenidos de calcio (28 cmoles(+)kg-1), magnesio (6.7 cmoles(+)kg-1) y potasio (0.65 cmoles(+)kg-1) y bajo en sodio (0.18 cmoles(+)kg-1), 20.I.2016, J. Y. Salmerón-Castro 003 (UAMIZ), 006 (UAMIZ).
Comentarios taxonómicos: Paraglomus bolivianum es la única especie conocida de Paraglomerales que presenta esporas pigmentadas y una ornamentación con depresiones en la capa OWL2 muy grandes y profundas (en promedio 3.6 µm de diámetro, 1.5 µm de profundidad y una separación de 2.5 µm) en comparación con P. pernambucanum Oehl, C.M. Mello, Magna & G.A. Silva que tiene esporas hialinas o ligeramente amarillas y una capa laminada con depresiones más pequeñas (0.5-1.1 µm de diámetro, 0.5-1.0 µm de profundidad y 1.3-2.4 µm de separación entre ellas) y superficiales (Aragão de Mello et al., 2013). Paraglomus brasilianum (Spain & J. Miranda) Morton & Redecker es otra especie del género que presenta una capa OWL2 con ornamentación pero con un patrón finamente reticulado (INVAM, 2017) y no en depresiones como en P. bolivianum o P. pernambucanum. En el caso de P. occultum (C. Walker) J.B. Morton & D. Redecker, P. laccatum (Blaszk.) Renker, Blaszk. & Buscot, P. majewskii Blaszk. & Kovács y P. turpe Oehl, V.M. Santos & Palenz. estos HMA forman esporas hialinas a subhialinas y sin ninguna ornamentación en la capa laminada OWL2, así que pueden ser fácilmente diferenciadas de las esporas pardo claro y ornamentadas de P. bolivianum (Blaszkowski et al., 2012; Oehl et al., 2016; INVAM, 2017).
Paraglomus bolivianum fue descrito originalmente como Pacispora boliviana Sieverd. & Oehl debido a que todas las especies que conforman el género Pacispora Sieverd. & Oehl presentan esporas tipo glomoide con una pared compuesta de dos grupos; cada grupo está constituido por tres capas y por lo regular la segunda capa interna (IWL2) reacciona al reactivo de Melzer (Oehl y Sieverding, 2004). De esta manera, P. bolivianum se puede diferenciar de Pacispora franciscana Sieverd. & Oehl y P. robigina Sieverd. & Oehl porque son especies de HMA con esporas sin ornamentaciones en la capa OWL2, y la capa IWL2 reacciona al reactivo de Melzer. Asimismo, P. bolivianum, al presentar esporas con una capa laminada con grandes depresiones y sin reacción al reactivo de Melzer en ninguna de sus capas (Figs. 4A-D), se puede diferenciar de Pacispora chimonobambusae (C.G. Wu & Y.S. Liu) Sieverd. & Ochl ex C. Walker, Vestberg & Schuessler, P. dominikii Sieverd. & Oehl, P. scintillans (S.L. Rose & trappe) Sieverd. & Oehl ex C. Walker, Vestberg & Schuessler, P. coralloidea Sieverd. & Oehl y P. patagonica (Novas & Fracchia) C. Walker, Vestberg & Schuessler porque en estas especies las esporas presentan una capa OWL2 con una ornamentación consistente de proyecciones semejantes a tubos o verrugas y la capa IWL2 tiene reacción al reactivo de Melzer (Oehl y Sieverding, 2004; Novas et al., 2005).
Discusión
Esta investigación indicó que en el suelo rizosférico de Agave angustifolia y de A. karwinskii de los Valles Centrales y Sierra Sur de Oaxaca, México, hay una riqueza de especies aún no conocida como ocurrió con Acaulospora minuta (Fig. 1), A. papillosa (Fig. 2), A. reducta (Fig. 3) y Paraglomus bolivianum (Fig. 4) que solo se habían registrado en África (A. minuta) o Suramérica (Bolivia y Brasil) (Oehl y Sieverding, 2004; Oehl et al., 2011; Aragão de Mello et al., 2013; Pereira et al., 2015, 2016). Lo anterior sugería que tenían una distribución restringida. Estas especies de HMA representan cuatro nuevos registros para México, puesto que no habían sido reportadas con anterioridad en ecosistemas naturales ni en agro-ecosistemas mexicanos (Violi et al., 2008; Alarcón et al., 2012; Méndez-Cortés et al., 2012; Montaño et al., 2012; Chimal-Sánchez et al., 2015, 2016; Posada et al., 2016; Álvarez et al., 2017; Carballar-Hernández et al., 2017; Varela-Fregoso et al., 2017); sobre todo en agaves mezcaleros de Oaxaca (Carballar-Hernández, 2009; Carballar-Hernández et al., 2013) o de otros estados del país (Ochoa-Meza et al., 2009; Trinidad-Cruz et al., 2017). Así, en México ahora se contabilizan 148 especies de hongos formadores de micorriza arbuscular, riqueza que representa casi 50% de los HMA formalmente descritos mundialmente (Schüβler, 2017). Es conveniente señalar que en México aún son escasos los trabajos que cuentan con una descripción taxonómica como la presentada en este estudio, así como respaldos de herbario que permitan estudios posteriores relacionados con su diversidad, distribución, taxonomía, tipos de hospederos y condiciones edáficas específicas para su desarrollo, entre otras. Finalmente, la interacción de los HMA con los agaves que se usan en la producción del mezcal, como A. angustifolia y A. karwinskii, puede ser de gran utilidad para preservar, propagar y conservar este recurso vegetal de lento crecimiento, establecidos en suelos con regímenes hídricos secos y baja disponibilidad de fósforo (Cuadro 1), sumado a que los agaves están amenazados por su comercialización y explotación de los ecosistemas naturales sin un plan de manejo a corto y largo plazo; por lo que el uso de inoculantes micorrízicos podría ser una opción viable en la producción de agaves mezcaleros.
Contribución de autores
NVP e IRJ conformaron la idea y el diseño experimental. Todos los autores, a excepción de LVF, salieron a campo para la recolecta de las muestras de suelo. JYSC y ECHS extrajeron las esporas de los HMA del suelo. IRJ y JYSC establecieron las macetas de propagación e hicieron los análisis del suelo. ECHS y LVF realizaron la determinación taxonómica de los HMA y tomaron las fotografías. ECHS ilustró las leyendas de las esporas de HMA con la correspondiente nomenclatura. ECHS e IRJ escribieron el artículo en donde todos los autores contribuyeron a la conformación de resultados, discusión, revisión y aprobación del manuscrito final.











 nova página do texto(beta)
nova página do texto(beta)



