Introducción
Los estudios de diversos autores, para conocer la ficoflora del Golfo de México (González-González et al., 1996; Littler y Littler, 2000; Ortega et al., 2001; Garduño-Solórzano et al., 2005), han sido realizados principalmente en los estados de Tamaulipas, Veracruz, Campeche y Yucatán. El conocimiento que se tiene de la flora ficológica de Tabasco es escaso, lo que se refleja en el bajo número de reportes de especies para el estado. Como lo señalan Quiroz-González et al. (2017) los estudios de mayor importancia realizados sobre las algas marinas en Tabasco son los de Orozco-Vega y Dreckmann (1995), Ramírez (1996), Dreckmann y De Lara-Issasi (2000), y Sentíes y Dreckmann (2013), quienes en total dan a conocer 71 taxa de macroalgas marinas para el litoral tabasqueño, de las cuales 39 corresponden a las algas rojas.
El objetivo de este estudio es contribuir al conocimiento ficoflorístico de algas marinas Rhodophyta del estado de Tabasco. Se presenta un listado florístico y se incluyen las descripciones e ilustraciones de los nuevos registros para este estado.
Materiales y métodos
Zona de estudio
El estado de Tabasco está ubicado en el sureste de la República Mexicana entre las coordenadas 17°15'00" y 18°39'07" de latitud Norte y 90°50'23" y 94°07'49" de longitud Oeste. Limita al norte con el Golfo de México, al noroeste con Campeche, al sureste con Guatemala, al sur con Chiapas y al oeste con Veracruz. El clima es de tipo cálido-húmedo, con una media anual de 26 °C (West et al., 1985).
Su zona costera posee una ligera inclinación hacia el Golfo de México; se caracteriza por ser una planicie sedimentaria originada de la fuente interior de los ríos y la consecuente sedimentación se hace a través de humedales, estuarios, llanuras de inundación, manglares y/o pantanos marinos. Las playas bajas arenosas están constituidas principalmente por arcillas, limos, arenas y materia orgánica; también se presentan sedimentos no consolidados, los cuales están sujetos a la acción constante del oleaje (West et al., 1985). Dichas características no favorecen el desarrollo de muchas especies de algas bentónicas.
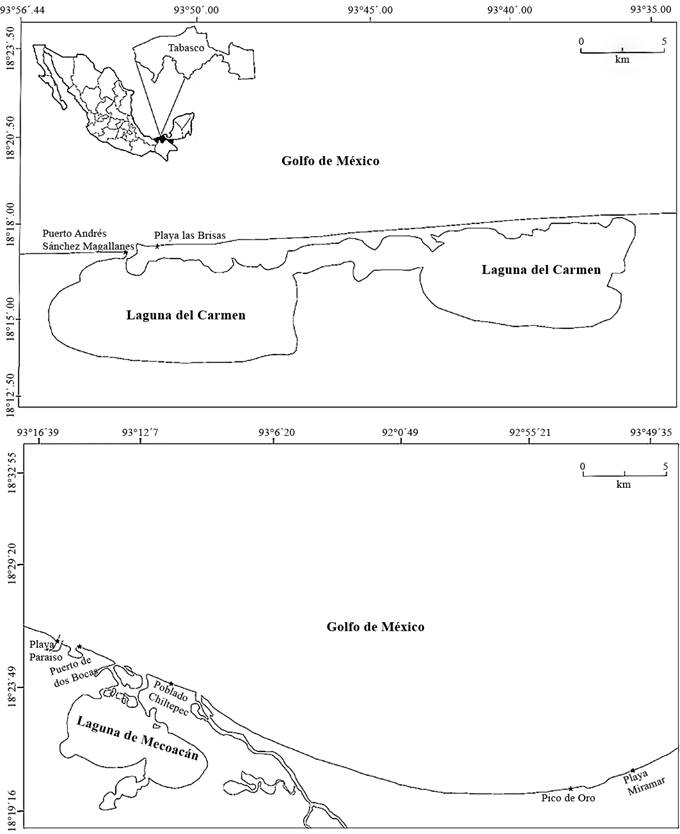
El litoral del estado de Tabasco presenta 191 km de longitud (Sánchez y Barba, 2005). Las localidades de estudio pertenecen a los municipios de Cárdenas, Centla y Paraíso (Cuadro 1, Fig. 1). Cárdenas presenta cerca de 67 km de costa y posee varias lagunas costeras de extensión considerable, tales como las lagunas El Carmen, Pajonal, Machona y Redonda. No se encuentran desembocaduras de ríos en este municipio. Centla tiene cerca de 75 km de costa en donde desembocan los ríos González, Grijalva, San Pedro y San Pablo. Paraíso posee alrededor de 38 km de costa y en su territorio se encuentra la Laguna de Mecoacán, la cual es de gran importancia económica. En su costa desembocan los ríos Seco, González y Verde.
Cuadro 1 Localidades de muestreo en el estado de Tabasco, México.
| Municipio | Localidad | Georreferencia |
|---|---|---|
| Cárdenas | Puerto Andrés Sánchez Magallanes | 18°17'42.91"N / 93°50'49.33"O |
| Playa las Brisas | 18°17'26.65"N / 93°52'20.38"O | |
| Centla | Playa Pico de Oro | 18°27'30.86"N / 92°51'17.57"O |
| Playa Miramar | 18°29'00.34"N / 92°47'44.65"O | |
| Paraíso | Playa Paraíso | 18°25'47.93"N / 93°12'4.60"O |
| Puerto de dos Bocas | 18°26'39.77"N / 93°07'12.29"O | |
| Poblado Chiltepec | 18°25'43.29"N / 93°05'00.88"O |
Trabajo de herbario y de campo
Se realizó una revisión del material ficológico procedente de Tabasco en las colecciones de los herbarios de la Facultad de Ciencias (FCME) de la Universidad Nacional Autónoma de México y en el herbario de la Universidad Juárez Autónoma de Tabasco (UJAT). Con los datos recabados se determinaron los sitios y la temporada de muestreo para el trabajo de campo.
Paralelamente se efectuaron tres exploraciones ficológicas en la zona de estudio durante la época de secas (en mayo de 2012) y la época de lluvias (en octubre de 2012). Los organismos se recolectaron manualmente con espátula y navaja de campo en la zona intermareal y en las escolleras. Para cada ejemplar se tomaron las georreferencias con un GPS (GARMIN 60 CSx, Kansas, EUA) y se anotaron datos ecológicos como epifitismo y tipo de sustrato. Las muestras se trasladaron al herbario de la Universidad Juárez Autónoma de Tabasco (UJAT) y se fijaron con formol a 4% en agua de mar (Lot y Chiang, 1986).
Se llevó a cabo una búsqueda bibliográfica para conocer los registros de algas rojas previamente señalados para el litoral tabasqueño.
Procesamiento y descripción de muestras
Los ejemplares se observaron con estereoscopio (Olympus SZ2-IL-ST, Tokio, Japón y ZEIGEN ZEZEZ2100, Cd. Mx., México). Se realizaron preparaciones semipermanentes y en fresco, se llevaron a cabo cortes histológicos o de secciones del talo en forma transversal. Los cortes se realizaron manualmente con una navaja de disección, los montajes semipermanentes se fijaron con gelatina glicerinada a 75%, teñida con cristal violeta (Castellaro et al., 2007). Para la observación y toma de medidas celulares se empleó un microscopio compuesto (Olympus modelo CX31RTSF, Tokio, Japón). Se realizaron las descripciones e ilustraciones de los nuevos registros.
Identificación taxonómica
Se determinó el material ficológico con el uso de las siguientes obras: Taylor (1960), Littler et al. (1989), Littler y Littler (2000), De la Garza (2003) y Peruzzi et al. (2009). Para la actualización nomenclatural se consultó AlgaeBase (Guiry y Guiry, 2017) y para el arreglo filogenético de clase y orden se utilizó a Mitsunobu et al. (2017); las familias, géneros y especies tienen un arreglo alfabético. Además, se compararon caracteres taxonómicos con los citados por Ramírez (1995), Mendoza-González y Mateo-Cid (1996), Guimarães et al. (2004), Castro-Nunes (2007), Fernández (2008), Ardito y García (2009), Morón y Ardito (2010), Solé y Pardo (2010), Solé y Suárez (2010) y Won et al. (2011).
Se integraron los números de cada preparación y las especies identificadas en la base de datos del sistema de información de la sección de algas del herbario FCME de la Universidad Nacional Autónoma de México y del herbario de la Universidad Juárez Autónoma de Tabasco (UJAT). Las muestras fueron depositadas en este último.
Resultados
Con este estudio, para Tabasco se registran en total 52 especies de rodofitas marinas, pertenecientes a 32 géneros, 17 familias y 10 órdenes (Cuadro 2). Se presentan además dos ejemplares que solo fueron identificados a nivel de género. De las especies listadas en este trabajo, 12 son nuevos registros para Tabasco. Los órdenes con mayor riqueza de especies son Ceramiales y Gracilariales con 24 y 9 especies, respectivamente. A su vez las familias con mayor número de especies fueron Rhodomelaceae y Gracilariaceae con 14 y 8 cada una, mientras que el género más diverso fue Gracilaria con ocho. Con este trabajo el número de taxa de Rhodophyceae para Tabasco ascendió de 39 a 52, lo que representa 20% de las especies reportadas para el Golfo de México (Cuadro 2).
Cuadro 2 Especies de Rhodophyta registradas para Tabasco. Localidades: Puerto Andrés Sánchez Magallanes (SM), Playa las Brisas (PB), Pico de Oro (PO), Playa Miramar (PM), Puerto de dos Bocas (PDB), Playa Paraíso Escollera Oeste (PPEO), Poblado Chiltepec (PCH). Especies reportadas en otras obras para Tabasco pero donde no se especifica la localidad: TAB. Sustratos: rocas (escolleras) (Ro), animales (An), flotadoras (Fl), arena (Ar), algas (epífitas) (Al ), limo (Li), placas de cemento (Pc), plásticos (Pl), pastos marinos (Pm), costales (Co), cuerdas (Cu), dragas (D), troncos (Tr), telas (Te). Acrónimos: Colección Algas (CA), Herbario de la Universidad Juárez Autónoma de Tabasco (UJAT), Golfo de México (GM), Herbario de la Facultad de Ciencias de la UNAM (FCME). ND: datos no determinados. *Nuevo registro para el estado de Tabasco. 1Orozco-Vega y Dreckmann (1995), 2Ramírez (1996), 3Dreckmann y De Lara-Isassi (2000), 4Ortega et al. (2001), 5Sentíes y Dreckmann (2013).
| Localidades | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Cárdenas | Centla | Paraíso | TAB | Sustrato | Referencias de herbario | ||||||
| Taxa | SM | PB | PO | PM | PDB | PPEO | PCH | FCME | UJAT | ||
| Bangiophyceae | |||||||||||
| Bangiales | |||||||||||
| Bangiaceae | |||||||||||
| Bangia fuscopurpurea (Dillwyn) Lyngbye* | - | - | - | - | - | X | - | - | Al | GM391 | - |
| Compsopogonophyceae | |||||||||||
| Erythropeltidales | |||||||||||
| Erythrotrichiaceae | |||||||||||
| Erythrotrichia carnea (Dillwyn) J. Agardh2,5 | X | - | - | - | - | - | - | - | Al | GM391 | - |
| Sahlingia subintegra (Rosenvinge) Kornmann* | X | - | - | - | - | - | - | - | Al | - | CA132 |
| Florideophyceae | |||||||||||
| Corallinales | |||||||||||
| Corallinaceae | |||||||||||
| Jania adhaerens J.V. Lamouroux* | - | - | - | - | - | X | - | - | Ro | GM394 GM396 GM398 GM399 GM400 GM403 |
CA3 |
| J. cubensis Montagne ex Kützing5 | - | - | - | - | - | - | - | X | ND | - | - |
| Pneophyllum fragile Kützing5 | - | - | - | - | - | - | - | X | ND | - | - |
| Bonnemaisoniales | |||||||||||
| Bonnemaisoniaceae | |||||||||||
| Asparagopsis taxiformis(Delile) Trevis5 | - | - | - | - | - | - | - | X | ND | - | - |
| Ceramiales | |||||||||||
| Ceramiaceae | |||||||||||
| Aglaothamnion boergesenii(Aponte & D.L. Ballantine) L’Hardy-Halos & Rueness1,5 | - | - | - | - | - | - | - | X | ND | - | - |
| Callithamnion corymbosum (Smith) Lyngbye2,5 | - | - | - | - | - | - | - | X | Al | - | - |
| Centroceras clavulatum (C. Agardh) Montagne2,5 | X | - | - | - | - | X | - | - | Al, An, Ro, D |
- | CA131 CA132 CA134 CA150 CA163 CA164 CA179 |
| Ceramium cimbricum H.E. Petersen5 | - | - | - | - | - | - | - | X | ND | - | - |
| C. leptozonum M. Howe2,5 | - | - | - | - | - | - | - | X | Al, Tr | - | - |
| Ceramium sp. | - | X | - | - | - | - | - | - | Fl | - | CA100 |
| Dasyaceae | |||||||||||
| Dasya baillouviana (S.G. Gmelin) Montagne2,5 | - | - | - | - | - | - | - | X | An, Li | - | - |
| Delesseriaceae | |||||||||||
| Caloglossa leprieurii (Montagne) G. Martens* | - | - | - | - | - | - | X | - | Co | - | CA117 |
| Rhodomelaceae | |||||||||||
| Acanthophora spicifera (M. Vahl) Børgesen2,5 | X | - | - | - | - | - | - | - | An, Tr, Ar, Ro |
- | CA128 CA130 CA133 CA137 CA141 CA154 CA166 CA186 CA170 CA178 |
| Bryocladia cuspidata (J. Agardh) De Toni2,5 | X | - | - | - | - | - | - | - | Ro, D | - | CA132 |
| B. thyrsigera (J. Agardh) F. Schmitz* | X | - | - | - | X | - | - | - | An, Pc | - | CA129 CA134 |
| Chondria leptacremon (Mevill ex G. Murray) De Toni2,5 | - | - | - | - | - | - | - | X | ND | - | - |
| Ch. littoralis Harvey1,5 | - | - | - | - | - | - | - | X | ND | - | - |
| Ch. polyrhiza Collins & Hervey1,5 | - | - | - | - | - | - | - | X | ND | - | - |
| Melanothamnus ferulaceus(Suhr ex J. Agardh) Díaz-Tapia & Maggs5 | - | - | - | - | - | - | - | X | ND | - | - |
| M. sphaerocarpus (Børgesen) Díaz-Tapia & Maggs1,2,4,5 | X | - | - | - | - | - | - | - | Al, Pm | - | CA130 CA148 |
| Neosiphonia flaccidissimaHollenberg* | - | - | - | - | X | - | - | - | Al, Pc | - | CA123 |
| Palisada perforata (Bory) K.W. Nam2,5 | - | - | - | - | - | - | - | X | ND, Pc | - | - |
| Polysiphonia denudata(Dillwyn) Greville ex Harvey* | - | - | - | - | - | - | X | - | Co | - | CA117 |
| P. havanensis Montagne2,5 | - | - | - | - | - | - | - | X | Li | - | - |
| P. sertularioides (Grateloup) J. Agardh2,5 | X | - | - | - | - | - | - | - | Al, Li | - | - |
| P. subtilissima Montagne2,5 | X | - | - | - | - | X | - | - | An, Al, Ro |
- | CA83 |
| Spyridiaceae | |||||||||||
| Spyridia filamentosa (Wulfen) Harvey | X | - | - | - | - | - | - | - | Li | - | CA167 CA202 |
| S. hypnoides (Bory) Papenfuss5 | X | ND | |||||||||
| Wrangeliaceae | |||||||||||
| Tiffaniella gorgonea (Montagne) Doty & Meñez5 | - | - | - | - | - | - | - | X | ND | - | - |
| Gelidiales | |||||||||||
| Gelidiaceae | |||||||||||
| Gelidium pusillum (Stackhouse) Le Jolis2,5 | X | - | - | - | - | - | - | - | Ro, An | - | - |
| Gigartinales | |||||||||||
| Cystocloniaceae | |||||||||||
| Hypnea cervicornis J. Agardh2 | - | X | - | - | X | - | - | - | Cu, D | - | - |
| H. musciformis (Wulfen) J.V. Lamouroux2,5 | X | - | - | - | - | - | - | - | Al | - | CA93 |
| H. spinella (C. Agardh) Kützing2,5 | X | - | - | - | - | - | - | - | ND | - | - |
| H. valentiae (Turner) Montagne* | X | - | - | - | X | X | - | - | Al, Pm, Ar, Ro, Li |
GM391 GM394 GM402 |
CA120 CA128 CA130 CA133 CA139 CA141 CA142 CA145 CA212 |
| Solieriaceae | |||||||||||
| Agardhiella subulata (C. Agardh) Kraft & M.J. Wynne5 | - | - | - | - | - | - | - | X | ND | - | - |
| Eucheuma isiforme (C. Agardh) J. Agardh5 | - | - | - | - | - | - | - | X | ND | - | - |
| Gracilariales | |||||||||||
| Gracilariaceae | |||||||||||
| Gracilaria blodgettii Harvey2,5 | X | - | - | - | - | - | - | - | An, Ro, Li |
- | CA136 CA137 CA146 CA147 CA155 CA168 CA245 CA247 |
| G. caudata J. Agardh5 | - | - | - | - | - | - | - | X | ND | - | - |
| G. cervicornis (Turner) J. Agardh2,5 | X | - | - | - | - | - | - | - | D | - | - |
| G. damaecornis J. Agardh2,5 | X | - | - | - | - | - | - | - | D | - | - |
| G. foliifera (Forsskål) Børgesen2,5 | X | - | - | - | - | - | - | - | ND | - | - |
| G. pacifica I.A. Abbott1 | - | - | - | - | - | - | - | X | ND | - | - |
| G. tikvahiae McLachlan* | - | - | - | - | X | - | - | - | Ar, Ro | - | CA212 |
| G. venezuelensis W.R. Taylor* | X | - | - | - | - | - | - | - | Ro, Li | - | CA136 CA153 CA156 CA173 |
| Gracilaria sp. | - | - | - | - | X | - | - | - | Ro | - | CA84 |
| Gracilariopsis tenuifrons (C.J. Bird & E.C. Oliveira) Fredericq & Hommersand2 | X | - | - | - | - | - | - | - | An | - | - |
| Halymeniales | |||||||||||
| Halymeniaceae | |||||||||||
| Grateloupia filicina (J.V. Lamouroux) C. Agardh2,5 | X | - | - | - | X | - | - | - | Al, An, Ro, Pl, Pc, Cu |
- | CA129 CA163 CA174 CA122 |
| Halymenia floresii (Clemente) C. Agardh5 | - | - | - | - | - | - | - | X | ND | - | - |
| Rhodymeniales Lomentariaceae | |||||||||||
| Lomentaria uncinataManeghini5 | - | - | - | - | - | - | - | X | ND | - | - |
| Rhodymeniaceae | |||||||||||
| Chrysymenia enteromorphaHarvey5 | - | - | - | - | - | - | - | X | ND | - | - |
| Rhodymenia pseudopalmata (J.V. Lamouroux) P.C. Silva* | X | - | - | - | - | - | - | - | Pl | GM71 GM394 GM400 GM403 GM406 |
CA3 CA179 |
El municipio con mayor número de especies fue Cárdenas con 24 seguido de Paraíso con 13. Cinco especies se encontraron en ambos municipios. La localidad con el mayor número de especies registradas (22) fue el Puerto Andrés Sánchez Magallanes (Cuadro 2).
Las algas se encontraron sobre distintos sustratos: 59% de las especies sobre arena, limo y sustratos artificiales como escolleras, dragas, placas de cemento, basura (plásticos, cuerdas), costales y telas, 41% en otras algas, pastos marinos, troncos y conchas de animales. Únicamente Ceramium sp. se reporta como flotadora, aunque se desconoce si se trata de una especie flotadora como tal, o si es bentónica y se desprendió del sustrato (Cuadro 2). Las escolleras fueron el sustrato más frecuente seguidas de los de tipo biótico como las algas y conchas de ostión (Crassostrea virginica Gmelin).
Se encontraron 13 especies de algas epífitas de otras algas y/o de pastos marinos (Thalassia testudinum K.D. Koening): Erythrotrichia carnea (Dillwyn) J. Agardh, Bangia fuscopurpurea (Dillwyn) Lyngbye, Sahlingia subintegra (Rosenvinge) Kornmann, Callithamnion corymbosum (Smith) Lyngbye, Centroceras clavulatum (C. Agardh) Montagne, Ceramium leptozonum M. Howe, Hypnea valentiae (Turner) Montagne, Hypnea musciformis (Wulfen) J.V. Lamouroux, Grateloupia filicina (J.V. Lamouroux) C. Agardh, Neosiphonia flaccidissima (Hollenberg) M.S. Kim & I.K. Lee,Melanothamnus sphaerocarpus (Børgesen) Díaz-Tapia & Maggs, Polysiphonia subtilissima Montagne y P. sertularioides (Grateloup) J. Agardh. De éstas, Erythrotrichia carnea y Sahlingia subintegra se encontraron únicamente como epífitas, es decir no se les observó en ningún otro sustrato.
Descripciones morfológicas
Rhodophyta
Bangiophyceae
Bangiales
Bangiaceae
Bangia fuscopurpurea (Dillwyn) Lyngbye, Tent. Hydrophytol. Dan. 83. 1819. TIPO: INGLATERRA. Dunraven Castle, W. W. Young s.n. (no localizado). Fig. 2A.

Figura 2: A. Bangia fuscopurpurea (Dillwyn) Lyngbye: aspecto del talo. B, C. Sahlingia subintegra (Rosenvinge) Kornmann: B. aspecto del talo; C. detalle células bifurcadas. D, E. Jania adhaerens V. Lamouroux: D. aspecto del talo; E. genículas (GE) e intergenículas (IN). F. Caloglossa leprieurii (Montagne) G. Martens: aspecto del talo. G, H. Bryocladia thyrsigera (J. Agardh) F. Schmitz: G. aspecto del talo; H. corte transversal. I-K. Polysiphonia denudata (Dillwyn) Greville ex Harvey: I. rama tetrasporangil (TE); J. talo con cistocarpos; K. cistocarpos con caposporas recién liberadas (CI). L. Spyridia filamentosa (J. Agardh) F. Schmitz: aspecto y corte transversal.
Talo filamentoso, gregario, hasta 3 mm de largo, color púrpura, lubricoso, uniseriado, sin ramificar; pared celular gruesa, con constricciones, 20-32 µm de ancho; células de tamaño y forma irregular, 90-110 µm de diámetro, 82-115 µm de largo.
Hábitat: epífita de Chaetomorpha antennina Bory (Kützing).
Ejemplares examinados: MÉXICO. Tabasco, municipio Paraíso, Playa Paraíso, Escollera Oeste, 15.XIII.1989, D. León GM391 (FCME).
Compsopogonophyceae
Erythropeltidales
Erythrotrichiaceae
Sahlingia subintegra (Rosenvinge) Kornmann, Br. Phycol. J. 24: 227, fig. 13. 1989. TIPO: DINAMARCA. Møllegrund, Skagerrak, off Hirshals. Sin colector. Figs. 2B, C.
Talos diminutos, 13-67 µm de diámetro, color rojo a rosa, monostromáticos; células dispuestas de forma radial para formar un disco, células centrales 2-3 µm de diámetro, 2-4 µm de largo, el resto de las células alargadas, 2-3.5 µm de diámetro, 2.5-7 µm de largo, células marginales con una bifurcación.
Hábitat: epífita estricta de Chaetomorpha antennina.
Ejemplares examinados: MÉXICO. Tabasco, municipio Cárdenas, Puerto Andrés Sánchez Magallanes, 27.X.2012, N. Quiroz CA132 (UJAT).
Florideophyceae
Corallinales
Corallinaceae
Jania adhaerens J.V. Lamouroux, Hist. Polyp. Corall. Flex: 270. 1816. TIPO: MAR MEDITERRÁNEO. Sin localidad. Figs. 2D, E.
Talo erecto, gregario, hasta 4 cm de alto, color rosa claro; ramificación dicotómica, hasta quinto orden, en un solo plano; ramas cilíndricas, 90-200 µm de diámetro que se adelgazan hacia los ápices; intergenículas fuertemente calcificadas, 0.3-0.8 mm de largo, se constriñen hacia las genículas; genículas sin calcificar, aparecen en la base de las ramas, en intervalos regulares entre estas; células elongadas, en una sola fila, 5-10 µm de diámetro, 30-70 µm de largo; células medulares longitudinalmente dispuestas en filas paralelas, 62-74 µm de longitud; células corticales rectangulares a redondeadas, 7.5 µm de diámetro; conceptáculos tetrasporangiales en forma de copa, 180-320 µm de diámetro, en la zona de surgimiento de las ramas, al final de una intergenícula; tetrasporangio oval a elíptico, 40-60 µm de diámetro, 80-110 µm de longitud.
Hábitat: rocas formadoras de escollera.
Ejemplares examinados: MÉXICO. Tabasco, municipio Paraíso, Playa Paraíso Escollera Oeste, 15.VIII.1989, D. León GM394 (FCME), GM396 (FCME), GM398 (FCME), GM399 (FCME), GM400 (FCME), GM403 (FCME).
Ceramiales
Delesseriaceae
Caloglossa leprieurii (Montagne) G. Martens, Flora 52: 234, 237. 1869. TIPO: GUYANA FRANCESA. Sinnamary, al noreste de Cayena septentrional, Leprieur (no localizado). Fig. 2F.
Talo laminar erecto, hasta 4-5 cm de largo, 5-10 mm de ancho en las porciones basales, en la región media 350-500 µm de ancho, en los ápices 25-50 µm de ancho, constreñido hacia la base, color café-verdoso a violeta-verdoso; ramificación dicotómica; lámina monostromática; 1 nervadura central formada por 3 hileras de células, cada célula de forma rectangular, 5-7 µm de ancho, 12-54 µm de largo, el resto de las células son poliédricas dispuestas en hileras diagonales que van del margen del talo a la nervadura, 5-7 µm de ancho, 6-17 µm de largo; formación de rizoides en las constricciones, así como de segmentos del talo, también proliferan desde las nervaduras; no se observaron estructuras reproductivas.
Hábitat: sobre sustrato artificial (costales).
Ejemplares examinados: MÉXICO. Tabasco, municipio Paraíso, Poblado Chiltepec, 05.VII.2012, M. Ortiz CA117 (UJAT).
Rhodomelaceae
Bryocladia thyrsigera (J. Agardh) F. Schmitz, Fauna und Flora des Golfes von Neapel, Monographie 26: 169. 1901. TIPO: ITALIA. Sin localidad. Figs. 2G, H.
Talo hasta 10 cm de alto, color púrpura-rojizo a negro; ejes principales erectos, ecorticados, 90-140 µm de diámetro; ramificación alterna y radial en más de un plano, de hasta cuarto orden; ramillas pinnadas, curvadas hacia el eje principal, rígidas; 10 células pericentrales, 1 célula axial, células poliédricas o romboides, 18-26 µm de diámetro, 42-60 µm de largo; no se observaron estructuras reproductivas.
Hábitat: placas de cemento, conchas de moluscos.
Ejemplares examinados: MÉXICO. Tabasco, municipio Cárdenas, Puerto Andrés Sánchez Magallanes, 27.X.2012, N. Quiroz et al. CA129 (UJAT), CA134 (UJAT). Municipio Paraíso, Puerto de dos Bocas, 25.X.2012, N. Quiroz et al. CA123 (UJAT).
Neosiphonia flaccidissima (Hollenberg) M.S. Kim & I.K. Lee, Phycol. Res. 47: 279. 1999. TIPO: ESTADOS UNIDOS DE AMÉRICA. California, Laguna Beach, Orange County, G. J. Hollenberg 2269 (no localizado).
Talo filamentoso, aspecto fino, color pardo-rojizo; ejes postrados 65-80 µm de diámetro, rizoides 10-20 µm de diámetro, 125-650 µm de largo; ejes erectos sin diferenciación de un eje principal, 40-55 µm de diámetro, hacia la zona apical el talo se adelgaza, 15-25 µm de diámetro; ramificaciones alternas, irregulares o pseudodicotómicas; ápice con presencia de una sola célula apical; 4 células pericentrales, 1 célula axial; tricoblastos en espiral, 1.2-2.4 µm de diámetro, 18-40 µm de largo.
Hábitat: epífita de Grateloupia filicina.
Ejemplares examinados: MÉXICO. Tabasco, municipio Paraíso, Puerto de dos Bocas, 25.X.2012, N. Quiroz et al. CA122 (UJAT).
Nota: esta especie es incierta ya que Guiry y Guiry (2017) la consideran como sinónimo de Neosiphonia sertularioides; sin embargo, Díaz-Tapia et al. (20179 señalan que el material tipo es del Mediterráneo y la especie del Atlántico no pertenece al género Melanothamnus ni a otros géneros relacionados. Por lo pronto retenemos esta especie con su nombre original.
Polysiphonia denudata (Dillwyn) Greville ex Harvey, English Flora 5(1): 332. 1833. TIPO: INGLATERRA. Southampton. Sin colector. Figs. 2I-K.
Talo filamentoso, hasta 8 cm de alto, color rojo vino; ejes principales erectos, 30-70 µm de diámetro hacia la zona media, 170-250 µm de diámetro en la región basal, con 3-4 hileras de células, tienden a adelgazar hacia los ápices; ramificación pseudodicotómica, ramas alternas hasta cuarto orden; 6 células pericentrales, 1 célula axial; ápices bifurcados, sumamente corticados, algunos monosifónicos, 10-25 µm de diámetro; tricoblastos ausentes; cistocarpos ovoides, 180-200 µm de diámetro.
Hábitat: sobre sustrato artificial (costales).
Ejemplares examinados: MÉXICO. Tabasco, municipio Paraíso, Poblado Chiltepec, 05.VII.2012, M. Ortiz CA117 (UJAT).
Spyridiaceae
Spyridia filamentosa (Wulfen) Harvey, English Flora 5(1): 336. 1833. TIPO: MAR ADRIÁTICO. Vienna, sin colector. Fig. 2L.
Talo filamentoso, de aspecto plumoso, 6.5 cm de alto, color rosa a pardo oscuro; ejes principales 1-1.5 mm de diámetro; ramificación alterno-dística, de hasta segundo orden; ramas secundarias dispuestas de forma dística o alterna en más de un plano, 66-100 µm de diámetro; ramillas insertas radialmente 20-46 µm de diámetro, 0.5-1.5 mm de longitud, sin ramificar, segmentos ecorticados, 45-95 µm de longitud; ramillas con una sola célula apical; células superficiales en una sola hilera; no se observaron estructuras reproductivas.
Hábitat: limo.
Ejemplares examinados: MÉXICO. Tabasco, municipio Cárdenas, Puerto Andrés Sánchez Magallanes, 27.X.2012, A. Córdova CA167 (UJAT), CA202 (UJAT).
Gigartinales
Cystocloniaceae
Hypnea valentiae (Turner) Montagne, Hist. Nat. Iles Canaries 3: 161. 1841. TIPO: MAR ROJO. Lord Valentia s.n. (holotipo: BM (ex K)). Figs. 3A-C.

Figura 3: A-C. Hypnea valentiae (Turner) Montagne: A. aspecto del talo; B. detalle del talo con ramas con forma de estrella (ES); C. corte transversal, célula central (CC) y células pericentrales (CP). D, E. Gracilaria tikvahiae McLachlan: D. aspecto del talo; E. corte transversal. F. Gracilaria venezuelensis W.R. Taylor: aspecto del talo. G-I. Rhodymenia pseudopalmata (J.V. Lamouroux) P.C. Silva: G. corte transversal; H. detalle del corte transversal, se observan células medulares; I. aspecto del talo.
Talo cilíndrico, diámetro 0.5-1 mm, hasta 2 cm de largo, color amarillo verdoso; ramificaciones irregulares de primer orden, en diferentes planos, enredadas, surgen de una base; ramas curvean hacia adentro con dirección a la base, ápices aguzados, ligeramente más aplanados que el resto del talo, ramas cortas parecen pequeños espolones o espinas, que en algunas zonas se conglomeran dando la apariencia de una estrella; 5 células pericentrales, 1 célula axial, 42-100 µm de diámetro, células medulares hialinas, ovaladas, poliédrica e irregular, de paredes gruesas; corteza 2 células de espesor, células corticales fuertemente pigmentadas de un tono color pardo amarillo, de forma ovalada a irregular, 7.5-12.5 µm de diámetro; cistocarpo 250 µm de diámetro, 185 µm de largo.
Hábitat: epífita de pastos marinos. Gracilariales.
Ejemplares examinados: MÉXICO. Tabasco, municipio Cárdenas, Puerto Andrés Sánchez Magallanes, 27.X.2012, N. Quiroz et al. CA128 (UJAT), CA130 (UJAT), CA133 (UJAT), CA139 (UJAT), CA141 (UJAT), CA142 (UJAT), CA145 (UJAT); loc. cit., 02.IX.2012, O. Hernández CA120(UJAT). Municipio Paraíso, Playa Paraíso Escollera Oeste, 15.VIII.1989, D. León GM391 (FCME), GM394 (FCME), GM402 (FCME); Puerto de dos Bocas, 26.V.2008, G. Hernández CA212 (UJAT).
Gracilariaceae
Gracilaria tikvahiae McLachlan, Phycologia 18: 19. 1979. TIPO: CANADÁ. Barrachois Harbour, Colchester Co., Nova Scotia (holotipo: NRCC). Figs. 3D-E.
Talo liso, color café-rojizo, cilíndrico que se adelgaza hacia los ápices, 7.1-11.5 cm de largo, 1-2.5 mm de ancho; ramificación pseudodicotómica hacia la base, se torna irregular y radial en el resto del talo; ápices dicotómicos o tricotómicos, ligeramente curvados hacia adentro, 0.3-0.5 mm de diámetro; células medulares de forma poliédrica con bordes romos, paredes anchas, 30-75 µm de diámetro, 2 capas de células corticales, poliédricas a irregulares; no se observaron estructuras reproductivas.
Hábitat: arena y rocas.
Ejemplares examinados: MÉXICO. Tabasco, municipio Paraíso, Puerto de dos Bocas, 26.V.2008, G. Hernández CA212 (UJAT).
Gracilaria venezuelensis W.R. Taylor, Allan Hancock Atlantic Exped. Rept. 2: 110. 1942. TIPO: VENEZUELA. Cubagua, Isla Margarita, W. R. Taylor-39-482 (holotipo: MICH). Fig. 3F.
Talo color púrpura-verdoso, aplanado en las zonas axilares y apicales; ramificaciones dicotómicas que se tornan más abundantes hacia los ápices; médula formada por 3 hileras de células poliédricas hialinas de paredes gruesas, células 65-120 µm de diámetro, 65-80 µm de largo; no se observaron estructuras reproductivas.
Hábitat: rocas.
Ejemplares examinados: MÉXICO. Tabasco, municipio Cárdenas, Puerto Andrés Sánchez Magallanes, 27.X.2012, L. Cabrera CA156 (UJAT); loc. cit., 27.X. 2012, J. Camarero CA173 (UJAT); loc. cit., 27.X. 2012, A. Guillermo CA153 (UJAT); loc. cit., 27.X.2012, N. Quiroz et al. CA136(UJAT).
Rhodymeniales
Rhodymeniaceae
Rhodymenia pseudopalmata (J.V. Lamouroux) P.C. Silva, Univ. Calif. Publ. Bot. 25: 265. 1952. TIPO: ESTADOS UNIDOS DE AMÉRICA. Sin localidad. Figs. 3G-I.
Talo comprimido, 5 cm de alto, 2-3 mm de ancho, color púrpura; márgenes con ondulaciones, bordes de los ápices romos y algunos ligeramente aguzados; ramificado dicotómicamente, en sección transversal 2 hileras de células medulares, poliédricas a irregulares, hialinas, 19-120 µm de diámetro, 2 hileras de células subcorticales, 5-10.5 µm, 2 capas de células de la corteza, fuertemente pigmentadas color rosa intenso, 2.5-5 µm diámetro; no se observaron estructuras reproductivas.
Hábitat: sobre sustrato artificial (plástico).
Ejemplares examinados: MÉXICO. Tabasco, municipio Cárdenas, Puerto Andrés Sánchez Magallanes, 27.X.2012, J. Arias CA3 (UJAT), CA179 (UJAT), GM71 (UJAT), GM394 (UJAT), GM400 (UJAT), GM403 (UJAT), GM406 (FCME).
Discusión
Tomando en cuenta la información obtenida en el presente estudio y la revisión bibliográfica (Orozco-Vega y Dreckmann, 1995; Ramírez, 1996; Sentíes y Dreckmann, 2013) del grupo, en el estado de Tabasco, se han registrado 52 especies de rodofitas, ubicadas en tres clases, nueve ordenes, 17 familias y 32 géneros. De éstas, 21 especies se identificaron en el presente trabajo, de las cuales 10 fueron reportadas por Ramírez (1996) y más recientemente 10 por Sentíes y Dreckmann (2013) (Cuadro 2). Se presentan 12 nuevos registros de especies, que representan 8% del número total de macroalgas marinas citadas para el Atlántico mexicano (Pedroche y Sentíes, 2003), así como 14% del número de especies para el Golfo de México (Ortega et al., 2001).
Según lo presentado por Ortega et al. (2001), Callejas-Jiménez et al. (2005), González-Gándara et al. (2007), Galicia-García et al. (2013), Mateo-Cid et al. (2013) y Sentíes y Dreckmann (2013), las rodofitas determinadas en el área de estudio presentan afinidad con las reportadas en Veracruz y Campeche. De las 52 especies de rodofitas registradas para Tabasco, hay una coincidencia para el litoral de Campeche de 36 especies, mientras que 39 también son similares para Veracruz, mostrando 70-76% de distribución continua entre las tres entidades federativas.
Como lo señalan Zavala et al. (2005) y Quiroz-González et al. (2017), la afinidad que muestra Tabasco respecto a los estados colindantes puede explicarse por la presencia de corrientes costeras de la plataforma de Tamaulipas que circulan sobre Veracruz y Tabasco, hasta Campeche, especialmente en otoño e invierno. Estas corrientes tropicales asociadas a los intervalos de temperatura determinan qué especies son las que migrarán, y de acuerdo a las características físicas de muchas costas, definirán que especies se establecerán (Ramírez, 1996).
En comparación con el conocimiento que se tiene sobre la biodiversidad de algas rojas en el resto de los estados costeros del país, Tabasco aún presenta una riqueza específica baja de Rhodophyta, tomando en cuenta que el resto de las entidades, con excepción de Chiapas, presentan entre 70 y 452 especies en sus inventarios florísticos. Los registros en los estados del Golfo de México oscilan entre 87 y 230 especies (Pedroche y Sentíes, 2003) y presentan una diferencia notable respecto al número de especies registradas para Tabasco. Esto no implica una falta de distribución continua sino una falta de exploraciones ficológicas exhaustivas tal como se han llevado a cabo en el resto de los estados costeros del país.
La localidad con mayor número de especies fue el Puerto Andrés Sánchez Magallanes (Cárdenas) con 15, mientras que en el municipio Centla no se presentaron registros. Esta distribución de las especies está directamente relacionada con las características del área de estudio. La ausencia de algas en Centla podría deberse a la pobreza de sustratos sólidos, donde se fijan las algas en mayor proporción, ya que dicha localidad se define por playas limo-arcillosas y desembocaduras de los ríos González, Grijalva, así como del río San Pedro y San Pablo, mismos que modifican el aporte de nutrientes, sedimentos y salinidad de la costa (Quiroz-González et al., 2017).
Taylor (1960) señala que los sustratos expuestos al oleaje, como las escolleras, exhiben diversidad de algas marinas, tal como sucede en la Escollera del Puerto Andrés Sánchez Magallanes. Especies como Centroceras clavulatum, Acanthophora spicifera, Bryocladia cuspidata, Polysiphonia subtilissima, Gelidium pusillum, Hypnea valentiae, Gracilaria blodgettii y Grateloupia filicina toleran exposición al fuerte oleaje y a la desecación y son comunes en estos sitios. Este tipo de sustratos artificiales son una influencia de origen humano cada vez más común, mismos que comenzaron a citarse en estudios ficológicos a partir de 1958 (Garduño-Solórzano et al., 2005).
Las conchas de moluscos fueron los sustratos de origen animal más comunes, mismos que son considerados hospederos de numerosas comunidades algales dado que representan una excelente forma de dispersión. Seis especies (Centroceras clavulatum, Acanthophora spicifera, Bryocladia thyrsigera, Polisyphonia subtilissima, Gracilaria blodgettii y G. filicina) se encontraron sobre conchas, siendo las de ostión (Crassostrea virginica) las más comunes. Acanthophora spicifera se observó sobre algunos caracoles con vida que no fueron identificados taxonómicamente. Melanothamnus sphaerocarpus e Hypnea valentiae se observaron como epífitas de pastos marinos (Thalassia testudinum), la primera ha sido reportada por otros autores para el mismo sustrato (Mateo-Cid et al., 2013). Trece especies se presentaron como epífitas de algas y pastos marinos, de las cuales Bangia fuscopurpurea, Erythrotrichia carnea y Sahlingia subintegra fueron epífitas en especies de rodofitas como Acanthophora spicifera y Gracilaria blodgetti, y en clorofitas como Chaetomorpha antennina y Cladophora vagabunda. Grateloupia filicina e Hypnea valentiae se registraron sobre mayor número de sustratos (seis y cinco respectivamente). Esta baja especificidad al sustrato pudiera explicarse por lo mencionado por Darley (1987) quienes lo asocian con un ambiente eutrofizado, donde la gran cantidad de nutrientes enmascaran las interacciones químicas que generan la especificidad, disminuyéndola drásticamente y permitiendo que el alga se encuentre en gran variedad sustratos.
La ausencia de sustratos adecuados para el establecimiento de las algas en Tabasco es la principal razón para la poca riqueza especifica registrada hasta el momento, debido a la falta de sustratos rocosos, y a la prevalencia de sitios arenosos o con desembocaduras de ríos que modifican el aporte de nutrientes y la salinidad, situación que se suma a la falta de exploraciones ficológicas en la región.
Con base en Dawes (1991), la ficoflora del estado de Tabasco queda comprendida dentro del intervalo de distribución tropical de las algas marinas en relación con la temperatura del agua (25 °C), aspecto también señalado por Sentíes y Dreckmann (2013) quienes, basados en el índice de Cheney (1977), mencionan que la flora algal está cercana a iniciar una zona de transición hacia la flora caribeña. Destacan el valor biogeográfico de Tabasco, dada su condición de región aislada en términos de la dinámica geológica y oceanográfica, además de sus características de aguas someras y calmadas.
Gracilaria pacifica únicamente ha sido registrada por Orozco-Vega y Dreckmann en 1995 para la laguna de Mecoacán. Si bien en el presente trabajo se incluye en el listado taxonómico, es importante llevar a cabo una evaluación de si se trata realmente de esta especie o más bien de una determinación errónea debido a que ha sido registrada para las costas del Pacífico mexicano.
De las 52 especies de rodofitas listadas para el estado de Tabasco 10 han sido señaladas con algún tipo de uso medicinal, alimenticio o industrial, lo que incrementa el interés en su estudio (Quiroz-González y Rivas-Acuña, 2014).
Conclusiones
Se considera importante continuar realizando exploraciones ficológicas a lo largo de la costa del estado de Tabasco, principalmente en el municipio Centla y en las lagunas costeras como Laguna del Carmen y Mecoacán, con el fin de profundizar el conocimiento de la ficoflora de la región en la zona intermareal e inclusive sublitoral. Información adicional sobre la distribución, la estacionalidad, la morfología, la anatomía y la reproducción de las algas son importantes de abordar, ya que repercuten en nuevas investigaciones útiles en la solución de problemas taxonómicos y el aprovechamiento sustentable de recursos algales.
Contribución de autores: NQ, DL y MR llevaron a cabo las recolectas de material en las áreas de muestreo. NQ realizó la revisión del material de herbario, la elaboración de preparaciones, la toma de medidas, y la identificación y descripción de los ejemplares. DL y MR corroboraron la identificación taxonómica. NQ escribió el manuscrito con el apoyo de DL y MR. Todos los autores contribuyeron a la discusión, revisión y aprobación del manuscrito final.
Financiamiento: El estudio no tuvo financiamiento por parte de ningún proyecto.











 text new page (beta)
text new page (beta)