Introducción
Las zonas mineras representan alrededor de 1% de la superficie terrestre (Šálek, 2012), registrando en los últimos dos años un aumento superior a 13% (Lira et al., 2013). En el año 2012, 22% de las minas a cielo abierto se encontraban en América Latina y el Caribe y actualmente más de 85% de las grandes explotaciones planificadas de la región son a cielo abierto (David et al., 2013).
En México la minería es una industria floreciente. En la actualidad 7% de la extracción está representado por los productos de grava y arenas (INEGI, 2009). Para el estado de Nuevo León, las actividades de exploración se limitan a productos no metálicos, destacando las empresas productoras de yeso, barita, caliza y arcillas, entre otros (INEGI, 2011).
La minería a cielo abierto consiste en retirar la vegetación y el suelo y, cuando es necesario, la voladura de la roca madre para obtener acceso al recurso deseado. Esta actividad se desarrolla con frecuencia en espacios naturales cuyo valor paisajístico y ecológico se ven mermados por la severa alteración que reciben (Jorba y Vallejo, 2006). Cuando se concluye con las actividades de aprovechamiento, surge la necesidad de mitigar los daños ocasionados por estas y emprender acciones de restauración para revertir sus efectos de manera parcial (Batty, 2005; Boyer y Wratten, 2010; Biswas et al., 2013; Mata et al., 2014). Las prácticas más comunes son el establecimiento de material edáfico (Blanco y Lal, 2010), la exclusión del área (Meuser, 2012) y la revegetación (Werner et al., 2001). Como resultado del establecimiento de material edáfico y la exclusión del área de actividades productivas, se ve favorecido el establecimiento de las comunidades vegetales propias de las localidades (Zhao et al., 2012; Li et al., 2013).
En México, las actuaciones de restauración ecológica implementadas post-minería han sido escasamente evaluadas y su efectividad raramente documentada. Debido a este escaso conocimiento, aún no se ha determinado si estas prácticas son recomendadas.
El objetivo general de la presente investigación fue evaluar la efectividad del tratamiento de restauración ecológica a mediano plazo (siete años), en el matorral bajo procesos de aprovechamiento a cielo abierto de material calizo, en el noreste de México.
Materiales y métodos
Área de estudio
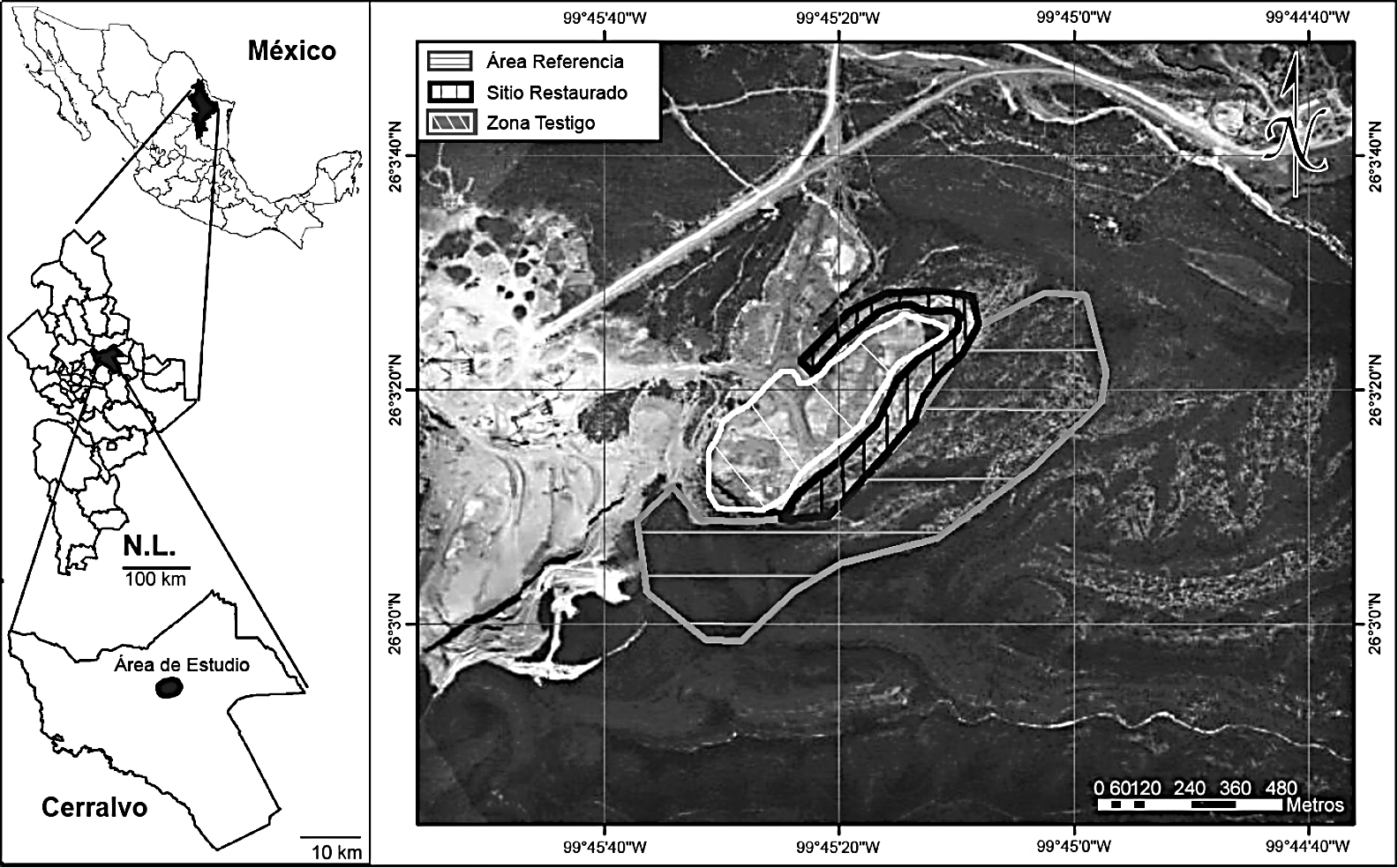
El estudio se realizó en las instalaciones de una pedrera con actividad minera a cielo abierto, la cual se localiza en las coordenadas 26°03'N, 99°44'O, con una altitud de 444 m, ubicado a 12 km al suroeste de la cabecera municipal de Cerralvo, Nuevo León, en el noreste de México (Fig. 1).
El área de estudio se ubica dentro de la Sierra de Picachos, considerada como una de las Regiones Prioritarias para la Conservación. La vegetación predominante es matorral espinoso tamaulipeco (MET). El clima del área corresponde al tipo semiárido, templado (BSlhw), con lluvias en verano, la temperatura media anual varía entre 21.3 y 27.4 °C. Los meses de mayor precipitación pluvial son septiembre y octubre, con un promedio anual de 596.6 mm (Pronatura e ITESM, 2002).
Diseño experimental
Durante siete años (2000-2006) se realizó la extracción de material calizo mediante procesos de voladuras a cielo abierto (fragmentación de roca) en una superficie de 85,580.00 m2, resultando en un área de roca madre expuesta para el 2006. Derivado de lo anterior se eligió inducir la recuperación de material vegetal en una superficie de 23,520.00 m2, utilizando como técnica la restauración activa. La restauración activa consistió en depositar material rocoso y edáfico (económicamente no aprovechable) compuesto de suelo aluvial y restos de impurezas de roca caliza silícea, resultantes de la separación de los conglomerados de roca caliza que fueron aprovechados. No fue necesaria la colocación directa de un banco de semillas externo a la zona, ya que el área de restauración colinda con un área de referencia, de la cual se presume que a partir de ella ocurrió la dispersión hídrica y eólica del material genético florístico que aterrizó, germinó y creció en el área. Esta área fue excluida mediante un cerco perimetral para evitar cualquier actividad productiva (principalmente la pecuaria).
Para determinar la efectividad del tratamiento se evaluó la composición florística y diversidad de tres áreas: 1) restaurada (RES), la cual fue aprovechada y posteriormente tratada con restauración activa (descrita anteriormente), 2) no restaurada (NRES), la cual fue aprovechada pero no restaurada y 3) referencia (REF), que fue una comunidad vegetal madura de matorral espinoso tamaulipeco, contigua a la mina sin perturbación registrada. No existe registro histórico de alguna actividad productiva que implicara remoción total o parcial de la vegetación (como ganadería, matarrasa, agricultura, etc.) en el área de referencia (REF). Además, se tiene la certeza que no se han desarrollado actividades que hayan causado algún tipo de perturbación, al menos desde que el área fue destinada a procesos de minería a cielo abierto hace más de 15 años (Fig. 2).

Figura 2 Áreas evaluadas: 1. área de estudio sometida a procesos de fragmentación de roca; 2. área restaurada durante siete años (RES); 3. área no restaurada (NRES); 4. área de referencia (REF) caracterizada por la presencia de vegetación natural.
Siete años después de la actividad minera y de restauración (en septiembre de 2013) se establecieron 36 sitios de muestreo de 10 x 10 m (100 m2), 12 en cada área, distribuidos aleatoriamente. Se realizó un censo de todas las especies vegetales (≥10 cm de altura). A cada individuo se le efectuaron mediciones dasométricas de altura total (h) y de diámetro de copa (dcopa). Las especies fueron identificadas por personal calificado de la Universidad Autónoma de Nuevo León.
Análisis de la vegetación
Para estimar la diversidad alfa se generó una curva de rarefacción (Oksanen et al., 2006). Esta curva, además de tomar en consideración el número de especies presentes, considera la abundancia relativa de cada uno de ellas en la comunidad. La rarefacción implica construir una curva suavizada de acumulación de especies mediante un remuestreo al azar de los datos. Se usó como variable independiente el número de individuos del conjunto de especies, y como variable dependiente su riqueza (Gotelli y Colwell, 2001).
La riqueza de especies se calculó como el número de especies presentes en el sitio (S); además, se utilizó el índice de Margalef (DMg). La diversidad, en términos del grado de heterogeneidad dentro de las especies, se calculó con el índice de Shannon-Weiner (H'). A continuación se describen dichos índices:
donde S es el número de especies presentes, N es el número total de individuos y ni es el número de individuos de la especie i.
Para la caracterización de la estructura vertical de las especies se utilizó el índice de distribución vertical de especies (A) (Del Río et al., 2003; Pretzsch, 2009). Este índice A puede tomar como valor mínimo de 0 y un valor máximo (Amax) variable dependiendo de la comunidad. Un valor A=0 significa que el rodal está constituido por una sola especie que ocurre en un sólo estrato. Amax se alcanza cuando la totalidad de las especies ocurren en la misma proporción tanto en el rodal como en los diferentes estratos (Corral et al., 2005; Pretzsch, 2009). Para la estimación de distribución vertical de las especies, se definieron tres zonas de altura basado en Pretzsch (2009): zona I: 80%-100% de la altura máxima de la vegetación en el área, zona II: 50%-80%, y zona III: de 0 a 50%. El índice A sirve para determinar la diversidad estructural en cuanto a la distribución vertical de las especies y se calcula con la siguiente fórmula:
donde S=número de especies presentes, Z=número de estratos de altura, pij =porcentaje de especies en cada zona, y se estima mediante la siguiente ecuación pij =nij /N; donde nij =número de individuos de la misma especie (i) en la zona (j) y N=número total de individuos.
Finalmente se utilizó el índice de valor de importancia ecológica por taxon (IVI) para detectar las especies más importantes en el área de estudio. Para esto se estimaron los parámetros ecológicos de abundancia (ARi), dominancia (DRi) y frecuencia (FRi) relativas de cada especie (Magurran, 2004).
Para la estimación de la abundancia relativa se empleó la siguiente ecuación:
donde Ai es la abundancia absoluta, ARi es la abundancia relativa de la especie i respecto a la abundancia total, Ni es el número de individuos de la especie i, y S la superficie de muestreo (ha).
La dominancia relativa se evaluó mediante
donde Di es la dominancia absoluta, donde DRi es la dominancia relativa de la especie respecto a la dominancia total, Ab el área de copa de la especie i, y S la superficie muestreada (ha).
La frecuencia relativa se obtuvo con la siguiente ecuación:
donde Fi es la frecuencia absoluta, FRi es la frecuencia relativa de la especie i respecto a la frecuencia total, Pi es el número de sitios en la que está presente la especie i y NS el número total de sitios de muestreo.
El índice de valor de importancia (IVI) se definió como:
Análisis estadísticos
Para la comparación estadística de los índices de riqueza y diversidad de especies de las comunidades vegetales, se utilizó la prueba de t de Student con la adaptación de Welch para evitar la heterocedasticidad. Los análisis estadísticos y gráficos se realizaron con el uso del programa R v3.0.3 (R Development Core Team, 2011), mediante los paquetes doBy (Robison-Cox y Leidi, 2012) y R Studio v. 0.98, ggplot2 (Wickham y Chang, 2015).
Resultados y discusión
El área no restaurada (NRES) no registró regeneración de la comunidad vegetal y por ende los contrastes de hipótesis se llevaron a cabo para el área restaurada y referencia. Este resultado puede deberse a la exposición de la roca madre y la ausencia de material edáfico donde pudieran establecerse plántulas o rebrotes asociados a semillas y propágulos de la vegetación original. La disponibilidad del sitio, de semillas y propágulos, así como la de recursos (como la presencia de suelo) son factores que afectan los patrones de sucesión y regeneración de las comunidades vegetales en un sitio dado (Pikett y McDonnell, 1989).
Para el área restaurada y referencia, se registraron 38 especies, pertenecientes a 36 géneros y 20 familias (Cuadro 1). La familia con mayor número de especies fue Fabaceae con nueve. Su presencia puede ser explicada por la tolerancia que este grupo presenta ante las condiciones de sequía edáfica características del área de estudio, ya que esta familia presenta valores más altos en el potencial hídrico del xilema al pre-amanecer y al mediodía, bajo condiciones de falta de agua, respecto a otras especies (Domínguez et al., 2013). Asimismo, su presencia está asociada a una baja disponibilidad de nitrógeno en el suelo; diversos estudios sugieren que las condiciones desfavorables de hábitat propician su establecimiento (Pequeño et al., 2012).
Cuadro 1 Familia, nombre científico y forma de crecimiento. Abundancia absoluta (número por hectárea), Dominancia (metros cuadrados por hectárea), Frecuencia absoluta (repeticiones por sitio de muestreo) e Índice de valor de importancia (IVI, porcentaje) para los tres sitios evaluados en el matorral espinoso tamaulipeco. La clasificación taxonómica sigue la propuesta de APG IV (2016).
| Familia y nombre científico | Forma de crecimiento | Área Restaurada | Área Referencia | ||||||||||||
| Abundancia | Dominancia | Frecuencia | IVI | Abundancia | Dominancia | Frecuencia | IVI | ||||||||
| N/ha | Ar | m2/ha | Dr | Abs. | Rel. | N/ha | Ar | m2/ha | Dr | Abs. | Rel. | ||||
| Asparagaceae | |||||||||||||||
| - Yucca filifera Chabaud | Arbórea | 17 | 0.24 | 0.64 | 0.01 | 17 | 3.51 | 1.25 | 17 | 0.27 | 25.66 | 0.33 | 17 | 2.04 | 0.88 |
| Asteraceae | |||||||||||||||
| - Brickellia veronicifolia (Kunth) A. Gray. | Arbustiva | 4550 | 66.3 | 5734 | 90.3 | 100 | 21.1 | 59.2 | - | - | - | - | - | - | - |
| - Chromolaena odorata (L.) R.M. King & H. Rob. | Arbustiva | - | - | - | - | - | - | - | 67 | 1.08 | 0.95 | 0.01 | 8 | 1.02 | 0.71 |
| - Haploesthes greggii A. Gray | Arbustiva | 133 | 1.94 | 9.82 | 0.15 | 25 | 5.26 | 2.45 | - | - | - | - | - | - | - |
| Boraginaceae | |||||||||||||||
| - Cordia boissieri A. DC. | Arbórea | 33 | 0.49 | 25.74 | 0.41 | 17 | 3.51 | 1.47 | 167 | 2.7 | 1058 | 13.5 | 58 | 7.14 | 7.79 |
| Ebenaceae | |||||||||||||||
| - Diospyros texana Scheele | Arbórea | - | - | - | - | - | - | - | 158 | 2.57 | 406.4 | 5.2 | 8 | 1.02 | 2.93 |
| Fabaceae | |||||||||||||||
| - Acacia berlandieri Benth. | Arbustiva | 25 | 0.36 | 18.41 | 0.29 | 8 | 1.75 | 0.8 | 417 | 6.77 | 1120 | 14.3 | 33 | 4.08 | 8.39 |
| - Acacia farnesiana (L.) Willd. | Arbustiva | 108 | 1.58 | 20.66 | 0.33 | 25 | 5.26 | 2.39 | 17 | 0.27 | 121.8 | 1.56 | 17 | 2.04 | 1.29 |
| - Acacia rigidula Benth. | Arbustiva | 17 | 0.24 | 20.58 | 0.32 | 17 | 3.51 | 1.36 | 558 | 9.05 | 1592 | 20.4 | 92 | 11.1 | 13.6 |
| - Cercidium macrum I.M. Johnst. | Arbórea | - | - | - | - | - | - | - | 33 | 0.54 | 106.2 | 1.36 | 17 | 2.04 | 1.31 |
| - Havardia pallens (Benth.) Britton & Rose | Arbórea | 17 | 0.24 | 18.93 | 0.3 | 8 | 1.75 | 0.77 | 17 | 0.27 | 9.9 | 0.13 | 8 | 1.02 | 0.47 |
| - Senna lindheimeriana (Scheele) H.S. Irwin & Barneby | Arbustiva | 267 | 3.88 | 141.9 | 2.22 | 25 | 5.26 | 3.79 | - | - | - | - | - | - | - |
| - Parthenium incanum Kunth | Arbustiva | - | - | - | - | - | - | - | 167 | 2.7 | 100.4 | 1.28 | 25 | 3.06 | 2.35 |
| - Prosopis glandulosa Torr. | Arbórea | - | - | - | - | - | - | - | 8 | 0.14 | 121 | 1.55 | 8 | 1.02 | 0.9 |
| - Sophora secundiflora (Ortega) Lag. ex DC. | Arbustiva | - | - | - | - | - | - | - | 150 | 2.44 | 155.8 | 1.99 | 25 | 3.06 | 2.5 |
| Loasaceae | |||||||||||||||
| - Cevallia sinuata Lag. | Arbustiva | 317 | 4.61 | 24.14 | 0.38 | 17 | 3.51 | 2.83 | 58 | 0.95 | 7.17 | 0.09 | 17 | 2.04 | 1.03 |
| Malvaceae | |||||||||||||||
| - Abutilon dugesii S. Watson | Arbustiva | 142 | 2.06 | 88.84 | 1.39 | 42 | 8.77 | 4.08 | 75 | 1.22 | 28.86 | 0.37 | 33 | 4.08 | 1.89 |
| - Malvastrum coromandelianum (L.) Garcke | Herbácea | 8 | 0.12 | 0.59 | 0.01 | 8 | 1.75 | 0.63 | - | - | - | - | - | - | - |
| - Meximalva filipes (A. Gray) Fryxell | Arbustiva | 67 | 0.97 | 25.58 | 0.4 | 42 | 8.77 | 3.38 | 33 | 0.54 | 7.92 | 0.1 | 8 | 1.02 | 0.55 |
| - Waltheria indica L. | Arbustiva | 100 | 1.46 | 4.93 | 0.08 | 25 | 5.26 | 2.27 | - | - | - | - | - | - | - |
| Oleaceae | |||||||||||||||
| - Forestiera angustifolia Torr. | Arbórea | - | - | - | - | - | - | - | 17 | 0.27 | 8.38 | 0.11 | 17 | 2.04 | 0.81 |
| Passifloraceae | |||||||||||||||
| - Turnera diffusa Willd. ex Schult. | Arbustiva | - | - | - | - | - | - | - | 142 | 2.3 | 15.65 | 0.2 | 8 | 1.02 | 1.17 |
| Poaceae | |||||||||||||||
| - Aristida adscensionis L. | Herbácea | 383 | 5.58 | 19.09 | 0.3 | 8 | 1.75 | 2.55 | - | - | - | - | - | - | - |
| - Aristida divaricata Humb. & Bonpl. ex Willd. | Herbácea | 17 | 0.24 | 1.84 | 0.03 | 8 | 1.75 | 0.68 | - | - | - | - | - | - | - |
| - Melinis repens (Willd.) Zizka | Herbácea | 358 | 5.22 | 44.67 | 0.7 | 8 | 1.75 | 2.56 | - | - | - | - | - | - | - |
| Primulaceae | |||||||||||||||
| - Anagallis arvensis L. | Herbácea | 8 | 0.12 | 0.05 | 0 | 8 | 1.75 | 0.63 | - | - | - | - | - | - | - |
| Rhamnaceae | |||||||||||||||
| - Condalia hookeri M.C. Johnst. | Arbórea | - | - | - | - | - | - | - | 175 | 2.84 | 2.89 | 0.04 | 25 | 3.06 | 1.98 |
| - Rhamnus humboldtiana Willd. ex Schult. | Arbustiva | 83 | 1.21 | 45.17 | 0.71 | 17 | 3.51 | 1.81 | 492 | 7.98 | 177.1 | 2.26 | 50 | 6.12 | 5.46 |
| Rubiaceae | |||||||||||||||
| - Randia laetevirens Standl. | Arbórea | - | - | - | - | - | - | - | 25 | 0.41 | 25.18 | 0.32 | 25 | 3.06 | 1.26 |
| Rutaceae | |||||||||||||||
| - Decatropis bicolor (Zucc.) Radlk. | Arbórea | - | - | - | - | - | - | - | 317 | 5.14 | 169.3 | 2.16 | 33 | 4.08 | 3.78 |
| - Zanthoxylum fagara (L.) Sarg. | Arbórea | - | - | - | - | - | - | - | 383 | 6.22 | 1196 | 15.3 | 75 | 9.18 | 10.2 |
| Sapindaceae | |||||||||||||||
| - Dodonaea viscosa (L.) Jacq. | Arbustiva | 150 | 2.18 | 92.08 | 1.45 | 8 | 1.75 | 1.8 | - | - | - | - | - | - | - |
| Sapotaceae | |||||||||||||||
| - Sideroxylon lanuginosum Michx. | Arbórea | - | - | - | - | - | - | - | 167 | 2.71 | 546.6 | 6.99 | 33 | 4.08 | 4.59 |
| Scrophulariaceae | |||||||||||||||
| - Leucophyllum frutescens (Berland.) I.M. Johnst. | Arbustiva | 25 | 0.36 | 9.58 | 0.15 | 17 | 3.51 | 1.34 | 608 | 9.88 | 411.6 | 5.26 | 75 | 9.18 | 8.11 |
| Solanaceae | |||||||||||||||
| - Lycium berlandieri Dunal | Arbustiva | - | - | - | - | - | - | - | 17 | 0.27 | 25.66 | 0.33 | 17 | 2.04 | 0.88 |
| Verbenaceae | |||||||||||||||
| - Aloysia macrostachya (Torr.) Moldenke | Arbustiva | - | - | - | - | - | - | - | 92 | 1.49 | 9.75 | 0.12 | 17 | 2.04 | 1.22 |
| - Lippia graveolens Kunth | Arbustiva | 42 | 0.61 | 6.66 | 0.1 | 25 | 5.26 | 1.99 | 1750 | 28.4 | 317.5 | 4.06 | 50 | 6.12 | 12.9 |
| Zygophyllaceae | |||||||||||||||
| - Porlieria angustifolia (Engelm.) A. Gray | Arbustiva | - | - | - | - | - | - | - | 33 | 0.54 | 51.31 | 0.66 | 17 | 2.04 | 1.08 |
| SUMA | 6867 | 100 | 6354 | 100 | 475 | 100 | 100 | 6160 | 100 | 7819 | 100 | 816 | 100 | 100 | |
Riqueza y diversidad de especies
La curva de rarefacción mostró valores similares de riqueza máxima esperada, el área de referencia no presentó asintonía debido a que existe una alta proporción de especies que tienen una baja abundancia relativa en la comunidad. Sin embargo, el área restaurada mostró la asintonía al registrar 870 individuos para lograr la riqueza máxima teórica de especies (Fig. 3).
La riqueza de especies (S) fue diferente entre el área restaurada y el área de referencia (t=2.72; g.l. =20.55; p=0.012) (Fig. 4). En el área de referencia se tiene la mayor riqueza de especies en comparación con el área restaurada con 8.167±3.433 y 4.750±2.701 respectivamente (Promedio ± Desvest). El índice Margalef (DMg) fue distinto para estas dos áreas (t=3.34; g.l. =20.50; p=0.003), siendo mayor en el área referencia (1.78±0.73), en comparación con el área restaurada (0.87±0.58). Así como en nuestro estudio, otros (Mata et al., 2014) han demostrado que las acciones de restauración activa resultan ser efectivas en términos de recuperación de la riqueza de especies en comparación con las acciones de restauración pasiva.

Figura 4 A. riqueza de especies; B. índice de Margalef; C. índice de Shannon de las áreas (referencia, restaurada y no restaurada) de estudio.
El índice de diversidad Shannon-Weiner fue bajo en el área restaurada con relación al área referencia (t=3.66; g.l.=21.89; p=0.001); el área restaurada mostró valores de 0.69±0.54, mientras que el área referencia 1.54±0.58. Esta diferencia puede ser explicada debido a la abundancia de la especie Brickellia veronicifolia (Kunth) A. Gray. con un gran número de individuos de una sola especie. Con respecto a otros estudios, tanto los valores de diversidad del área restaurada como la referencia mostraron valores de diversidad inferiores a los reportados por Mora et al. (2013) para un MET caracterizado en la región. De manera similar, en un estudio que evaluó la regeneración después de agricultura y matarrasa, Jiménez et al. (2013) observaron una mayor diversidad de especies que la reportada en este trabajo. A pesar de esto los valores de diversidad del presente estudio demuestran valores superiores a los reportados por Pequeño et al. (2012) para una zona de regeneración pasiva después de la ganadería.
Distribución vertical
Tanto el área referencia como la restaurada presentaron similitud en la distribución vertical de especies, cuyos valores de A=2.7 y 2.0, respectivamente, no arrojaron diferencias estadísticas (t=0.84; g.l. =21.36; p=0.410). El área referencia mostró valores promedios de A 1.7 y Amax 3.1 y en el área restaurada se registraron valores de A y Amax en 1.5 y 2.5, respectivamente. Estos valores indican que las comunidades vegetales de las dos áreas presentan poca diversidad en la distribución vertical de especies, mostrando la predominancia del estrato bajo. En el área referencia, Acacia rigidula Bent. y Cordia boissieri A. DC. se encuentran en los tres estratos, con mayor presencia en el I y II (alto y medio) y presencia mínima en el III (bajo), caso contrario a Lippia graveolens Kunth., la cual tiene mayor presencia en el estrato bajo. Sánchez et al. (2011) señalan que L. graveolens es una especie abundante en el matorral bajo espinoso y matorral alto subinerme. Se trata de una especie con amplio rango de distribución y con gran adaptabilidad debido a su elevada plasticidad, tolerancia ecológica y marcadas diferencias, incluso estructurales, condicionadas por la heterogeneidad ambiental de los hábitats en los que se establece, observada a través de la variabilidad de los factores externos a los que se expone.
Las comunidades vegetales presentan un bajo porcentaje de individuos en los estratos altos. El área referencia tiene una altura máxima de 5 m, con presencia de 0.8% de los individuos, y el área restaurada alcanza los 2.74 m, con 4.5% de los individuos. La dominancia de los estratos bajo y medio registrada en el sitio restaurado puede deberse a la densidad de Brickellia veronicifolia (96%) y a que esta especie facilita el establecimiento de las especies presentes en los demás niveles (Cuadro 2).
Cuadro 2 Distribución vertical (Pretzsch) de las especies en las áreas (referencia y restaurada) de estudio.
| Índice de Pretzsch | |||
| Zona Referencia | |||
| Estrato | Altura (Porcentaje) | Individuos (Total) | Porcentaje (%) |
| I | 5 m (100%) | 6 | 0.8 |
| II | 4 m (80%) | 62 | 8.4 |
| III | 2.5 m (50%) | 672 | 90.8 |
| Total | 740 | 100 | |
| Zona Restaurada | |||
| Estrato | Altura (Porcentaje) | Individuos (Total) | Porcentaje (%) |
| I | 2.74 m (100%) | 37 | 4.5 |
| II | 2.19 m (80%) | 177 | 21.5 |
| III | 1.37 m (50%) | 610 | 74.0 |
| Total | 824 | 100 | |
Indicadores ecológicos
La abundancia de los individuos fue diferente entre el área restaurada y el área de referencia (t=0.44; g.l. =21.88; p=0.661). El primero mostró los valores más altos de abundancia de especies (6867±3723 N/ha), seguido por el área de referencia (6160±4011 N/ha). Esto puede ser explicado por los patrones de abundancia y dominancia característicos de las primeras etapas sucesionales, donde los individuos de pioneros tienen una alta abundancia. La dominancia (cobertura foliar) presentó similitud estadística entre las dos áreas (t=0.572; g.l.=14.05; p=0.576; AR=7815±1621 m2/ha y SR=6353±3723 m2/ha).
No existe diferencia estadística en las áreas evaluadas para los parámetros ecológicos de abundancia y dominancia, debido a la presencia de Brickellia veronicifolia, la cual tiene una alta existencia en el área restaurada, presentando altos valores de densidad pero no alta cobertura. La densidad de las dos áreas evaluadas es superior a lo reportado por Mora et al. (2013a) y Canizales et al. (2009), quienes realizaron caracterizaciones estructurales de comunidades maduras del matorral espinoso tamaulipeco y del matorral submontano, respectivamente. No obstante, la cobertura del área foliar fue menor a lo reportado por los autores antes mencionados.
En cuanto a la frecuencia relativa a nivel especie para el área restaurada, Brickellia veronicifolia (presente en todos los sitios), Abutilon dugesii S. Watson., Meximalva filipes (A. Gray) Fryx. y Senna lindheimeriana (Scheele) H.S. Irwin & Barneby representan 38% del total para este sitio de muestreo. En el área de referencia, Acacia rigidula, Leucophyllum frutescens (Berland.) I.M. Johnst y Zanthoxylum fagara (L) Sarg. corresponden a una tercera parte de la presencia de especies para esta área (Cuadro 1).
En el área restaurada, la especie con mayor valor de importancia es Brickellia veronicifolia con 59%, seguida por Abutilon dugesii y Senna lindheimeriana con 4.08% y 3.79%, respectivamente; estas especies suelen estar asociadas a áreas muy perturbadas. Estos resultados son similares a los registrados por Díaz et al. (2005) en una mina contaminada por metales pesados en el estado de Zacatecas. En el área referencia, las especies con mayor peso ecológico fueron Acacia rigidula, Lippia graveolens y Zanthoxylum fagara con 13.55%, 12.87% y 10.23% (Fig. 5). Estos resultados corroboran lo mencionado por Estrada et al. (2011) y Mora et al. (2013b), en el cual señalan a estas especies como pioneras en los matorrales del Noreste de México.
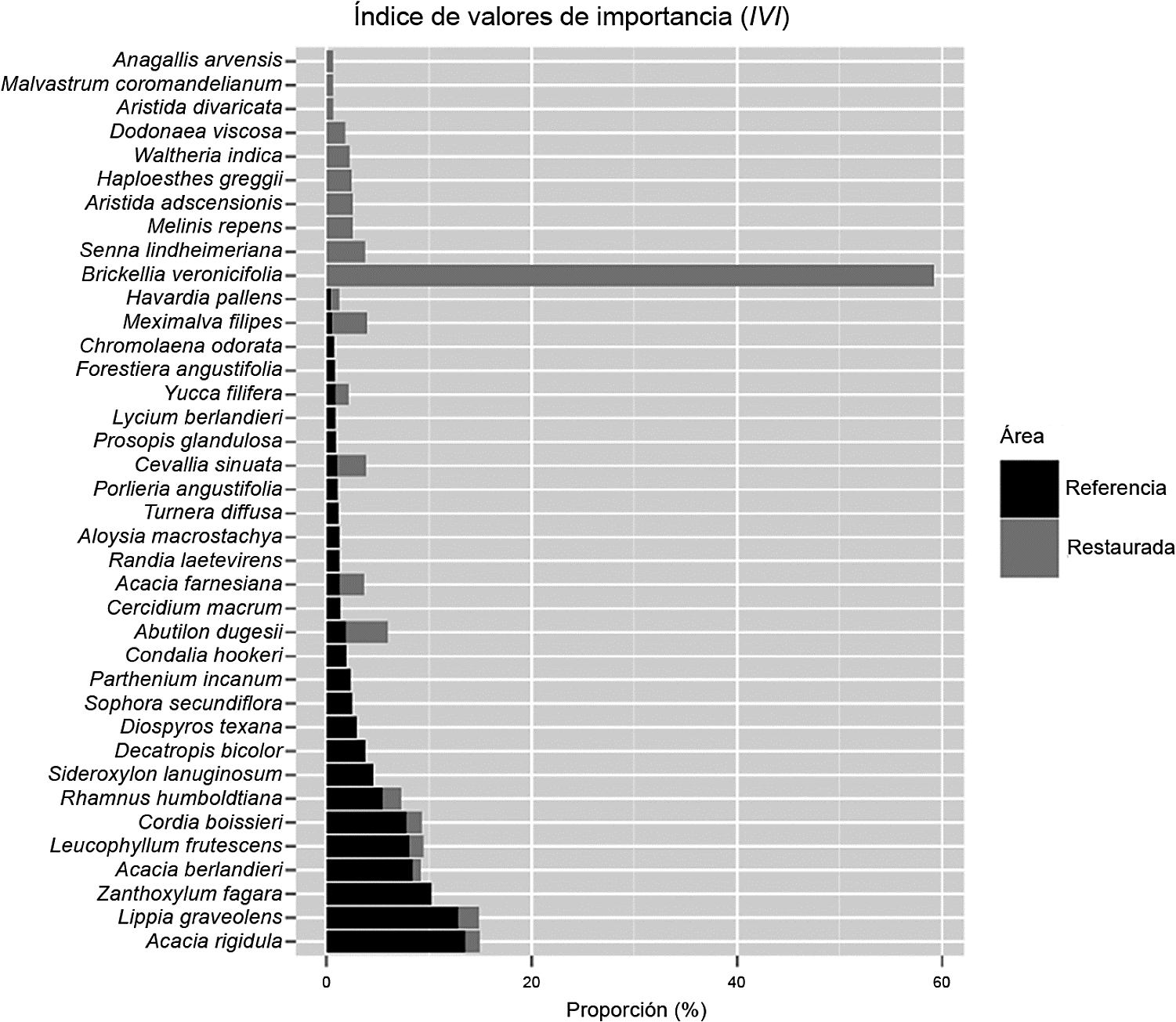
Figura 5 Índice de valor de importancia de las especies en las áreas (referencia y restaurada) de estudio.
La especie Brickellia veronicifolia es una planta arbustiva de la familia Asteraceae y una pionera no característica de alguna fase sucesional del MET (Alanis et al., 2013; Jiménez et al., 2013); ha sido reportada para el estado de Nuevo León del matorral submontano (Estrada et al., 2011) y del matorral xerófilo y de bosques de encino del Parque Nacional Cumbre de Monterrey (Estrada et al., 2013). Los resultados en esta investigación concuerdan con los reportados por Carrillo y González (2006), Hernández et al. (2009) y Ortega (2012), quienes señalan a esta especie como importante en áreas regeneradas después de actividades mineras. Su alta presencia se debe a que se desarrolla bien sobre lutita y caliza, y es pionera en ecosistemas degradados por actividades mineras, debido a sus sistemas de raíces profundas, las cuales pueden establecerse sobre suelos pobres y altamente rocosos. Otra estrategia evolutiva es su gran cantidad de semillas pequeñas con cerdas plumosas, estas últimas características de diásporas con dispersión pogonócora (Martínez et al., 2012), que les confiere una alta eficiencia a la dispersión en largas distancias (Cain et al., 2012). Asimismo, Brickellia veronicifolia pierde la parte aérea en los períodos críticos del año (hemicriptófita), lo que le permite adaptarse a las condiciones de carencia de agua y escapar de factores que ponen en peligro su supervivencia en estos hábitats (Franco, 2005). Carrillo y González (2006) determinaron que es una especie que acumula altas concentraciones de cadmio, plomo, zinc y cobre, lo que facilita su establecimiento en áreas contaminadas con estos elementos característicos de zonas de explotación minera. Lo anterior resulta altamente nocivo para otras especies las cuales no los asimilan e interfieren en las funciones fotosintéticas (Abrol et al., 1993; Kastori et al., 1998) de absorción de nutrientes (Woolhouse, 1983), en su crecimiento y supervivencia.
Díaz et al. (2005) señalan que la familia Asteraceae tiende a establecer asociaciones (especies herbáceas, arbustivas, entre otras) para ayudar a restablecer la fertilidad del suelo y acelerar la sucesión ecológica, lo cual se muestra en el presente trabajo con la representatividad registrada en el área restaurada. Estrada et al. (2011) mencionan que la asociación que existe entre las especies en el área referencia es de porte bajo y mediano, entre 1 y ≤2.5 m de altura, común para el MET distribuido principalmente en la parte centro-norte del estado.
Conclusiones
Con los resultados de la presente investigación se concluye lo siguiente: 1) La restauración activa en áreas sujetas a explotación de material calizo mediante la técnica de voladuras, con el depósito de material rocoso y edáfico, y su exclusión de actividades productivas, genera condiciones favorables para el establecimiento de comunidades vegetales que favorecen la regeneración del MET, 2) La familia con mayor presencia en el área restaurada fue Fabaceae, debido a la tolerancia que este grupo presenta ante las condiciones de sequía edáfica, a sus valores altos en el potencial hídrico del xilema, y a que se desarrolla en suelos con baja disponibilidad de nitrógeno, 3) El índice de Pretzsch confirma la existencia de dos estratos en las comunidades vegetales, la cobertura de las especies que se están regenerando, y de las especies vegetales maduras, 4) La especie Brickellia veronicifolia de la familia Asteraceae es la de mayor representatividad en el área restaurada, y por su alta tolerancia a la presencia de metales pesados, puede ser utilizada en la restauración de zonas sometidas a la explotación minera.
La presente investigación proporcionó datos cuantitativos sobre la restauración pasiva en un área postminería a cielo abierto en el MET, generando información fitosociológica de la comunidad vegetal y elementos cuantitativos que servirán de base para futuros programas de manejo, restauración y rehabilitación del ecosistema.











 nueva página del texto (beta)
nueva página del texto (beta)