Introducción
La espora de los helechos es una célula haploide cubierta por la perina que contiene el protoplasma, y la exina que protege a la célula del ambiente externo (Raghavan, 1989; Tryon, 1990). La espora de los helechos podría parecer una estructura simple comparada con la semilla de las angiospermas; sin embargo, en el protoplasma de la célula ocurre una compleja actividad proteínica que promueve la maduración, germinación y formación del gametofito (Suo et al., 2015). Diversos estudios han demostrado que la luz es un factor determinante en la germinación de las esporas de helechos (Simabukuro et al., 1993; Pivetta et al. 2000; Hiendlmeyer y Randi, 2007; Pérez-García et al., 2007; Riaño et al., 2015). Es ampliamente reconocido que la germinación de las esporas de los helechos con fotoblastimo positivo (o la promoción de la germinación por exposición a la luz con alta proporción de rojo: rojo-lejano), al igual que en las semillas, está regulada por fitocromos (Tsuboi et al., 2012). El fitocromo inactivo Pr y el fitocromo fisiológicamente activo Pfr tienen distinto espectro de absorción y por lo tanto la calidad de la luz determina el equilibrio entre ellos (Rensing et al., 2016). Con los fitocromos, la semilla fotoblástica puede detectar los cambios espectrales de la luz dentro de la comunidad vegetal y evitar micrositios adversos para la supervivencia de la plántula (Smith, 2000). Además de la calidad de la luz, el efecto de ésta en la germinación de las esporas y semillas fotoblásticas positivas depende de la densidad de flujo fotónico (Rahghavan 1989; Pérez-García et al., 2007; Wu et al., 2010; Riaño et al., 2015). En la semilla de las angiospermas la velocidad de la germinación es una función del potencial hídrico del sustrato y recientemente se mostró la respuesta de la espora de especies de helechos del bosque mesófilo de montaña frente a la disminución en la disponibilidad del agua (Riaño et al., 2015). También se ha relacionado la sensibilidad de la germinación de las esporas de los helechos con la temperatura (Pérez-García y Riba, 1982; Ranal, 1999) y con la interacción de la temperatura con la luz (Pérez-García et al., 2007).
Los requerimientos ambientales para iniciar la germinación pueden ser diferentes entre las especies y ayudan a explicar la coexistencia de éstas, que a su vez favorecen la diversidad en los ecosistemas (Pérez-García y Riba, 1982; Orozco-Segovia y Vázquez-Yanes, 1989; Riaño et al., 2015). La aparente ausencia de interacciones con dispersores o polinizadores en los helechos los convierte en un modelo adecuado para evaluar el efecto de las condiciones abióticas sobre la germinación (Barrington, 1993). Los requerimientos de la germinación de algunas especies de helechos de ecosistemas templados y tropicales han sido correlacionados con la distribución natural de éstas (Warne y Lloyd, 1980; Pérez-García y Riba 1982; Riaño et al., 2015). Esos estudios mostraron que las esporas de especies cuyos esporofitos crecen en ambientes de sombra germinan mejor en condiciones similares al interior del bosque, tales como menor temperatura, poca luz y alta disponibilidad de agua, mientras que las que se distribuyen en ambientes abiertos o expuestos germinan en un rango más amplio de temperatura, luz y disponibilidad de agua. Sin embargo, las especies de helechos halófitos que habitan ecosistemas costeros que pueden crecer tanto bajo sombra como en completa luz de sol tienen esporas que prefieren germinar en sustratos no salados, por lo que la asociación entre germinación y distribución del esporofito podría no existir en ese grupo de plantas (Lloyd y Buckley 1986; Pangua et al., 2009). La respuesta de la germinación de la espora a la presencia/ausencia de luz, incremento en la cantidad de luz e irradiancia solar y densidad de plantas fue estudiada en Blechnum brasiliense Desv. y B. glandulosum Kaulf. ex Link (Blechnaceae), pero los resultados no fueron relacionados con su distribución o preferencia de hábitat (Weinberg y Voeller, 1969; Simabukuro et al., 1993; Piveta et al., 2000; Hiendlmeyer y Randi 2007).
En este trabajo se presenta un estudio sobre la relación entre la frecuencia de esporofitos en el bosque y el comportamiento germinativo de la espora de Blechnum appendiculatum Willd. y Blechnum schiedeanum (Schltdl. ex C. Presl) Hieron. en un bosque mesófilo de montaña en México. Ambas especies se distribuyen en América, desde México hasta Argentina, y pueden encontrarse creciendo juntas, aunque ocupan diferentes microhábitats. Blechnum appendiculatum se distribuye en ambientes relativamente abiertos, mientras que B. schiedeanum habita lugares sombríos y húmedos en cañadas (Pérez-García y Mendoza-Ruiz, 2009). Se espera que si la luz y el agua son recursos limitantes para la germinación, ambas especies disminuirán fuertemente la germinación conforme disminuya la humedad disponible, la aumentarán conforme aumente la cantidad de luz y mostrarán mayor germinación bajo luz blanca y roja, en comparación con la germinación con luz rojo: rojo-lejano y oscuridad. Si existe correspondencia entre la distribución del esporofito y la germinación, la germinación de las esporas de B. appendiculatum será favorecida con luz enriquecida en rojo, mientras que B. schiedeanum tendrá mayor probabilidad de germinar en luz enriquecida en rojo-lejano. Blechnum appendiculatum mostrará mayor requerimiento de luz y menor requerimiento de humedad para germinar, en comparación con B. schiedeanum.
Materiales y métodos
Especies de estudio
Blechnum appendiculatum es un helecho herbáceo monomórfico con hojas de 20 a 45 cm de largo, característico del bosque mesófilo de montaña y en México también de bosques de Quercus y Pinus (Velazco-Macías et al., 2011). Blechnum schiedeanum es un helecho herbáceo dimórfico con hojas de hasta 160 cm de largo que habita ambientes sombríos y húmedos en cañadas con suelos volcánicos en el bosque mesófilo de montaña y de Pinus-Liquidambar (Pérez-García y Mendoza-Ruiz, 2009). Las esporas de ambas especies son monoletas, elipsoidales a esferoidales, de color pardo amarillento. Blechnum appendiculatum tiene esporas más pequeñas (37-49 μm largo × 24-31 μm ancho) en comparación con B. schiedeanum (64-74 μm largo × 4-54 μm ancho) (Mendoza-Ruiz y Pérez-García, 2009).
Las esporas se obtuvieron de pinnas fértiles de al menos 10 individuos por especie, colectados en remanentes del bosque mesófilo de montaña en Coatepec, Veracruz. Las pinnas con soros fueron colocadas en sobres de papel y se dejaron secar a temperatura ambiente por tres días para inducir la dehiscencia. Las esporas se separaron de residuos de hoja y esporangios con un tamiz de 0.074 mm, se colocaron dentro de un frasco y fueron guardadas en viales de cristal sellados a 4 °C. Previo a la siembra, fueron depositados 0.01 g de esporas por especie en tubos Eppendorf de 1.5 ml y sometidas a un proceso de desinfección con 1 ml de cloro 1% durante 10 minutos. Posteriormente el cloro se remplazó por 1 ml de agua destilada.
Calidad y cantidad de luz
En los experimentos de calidad y cantidad de luz se utilizaron 5 cajas de Petri de 6 cm de diámetro por especie y por tratamiento de luz. En cada caja fueron esparcidos 25 µl de la solución de agua con esporas desinfectadas sobre agar bacteriológico 1%. Para evaluar el efecto de la calidad de la luz, se utilizaron cuatro tratamientos de luz: blanca, rojo, rojo-lejano y oscuridad. La iluminación de los dos primeros tratamientos fue proporcionada por cuatro lámparas fluorescentes (GE, luz blanca y fría, 20 W), el tercer tratamiento por dos focos incandescentes (13 W) y el último no tuvo iluminación. En el tratamiento con luz blanca la proporción rojo: rojo-lejano (R:FR) fue 2.24 y la densidad de flujo fotónico fotosintéticamente activo (PPFD) fue 114 µmol m-2 s-1. En los tratamientos de luz roja y rojo-lejano las cajas fueron cubiertas con combinaciones de acetatos con diferentes propiedades espectrales (Lee Filters, Londres, Inglaterra). Para lograr el tratamiento de luz roja se utilizó una cubierta de acetato rojo (Filtro rojo 182) con R:FR de 1.90 y PPFD de 20.51 µmol m-2 s-1. En el caso del tratamiento rojo-lejano las cajas fueron cubiertas con una combinación de acetatos rojo (Filtro rojo 182) y azul (Filtro azul 071) con R:FR de 0.46 y PPFD de 0.28 µmol m-2 s-1. Para lograr el tratamiento de germinación en la obscuridad, las cajas Petri fueron cubiertas con doble capa de papel aluminio y el R:FR fue 0. Las características de la calidad espectral de la luz fueron determinadas con un espectroradiómetro (LI-COR LI-1800, Lincoln, EUA). El espectro de luz roja y rojo-lejano fue delimitado de 654 a 666 y 724 a 736 nm, respectivamente (Rojas-Aréchiga et al., 1997; De la Rosa y Briones, 2010).
Para probar el efecto de la intensidad de luz blanca en la germinación, las esporas fueron expuestas a seis tratamientos de luz: 110, 0.68, 0.27, 0.19, 0.04 y 0 μmol m-2 s-1. La luz fue proporcionada por cuatro lámparas fluorescentes (LG, luz blanca y fría, 20 W). El tratamiento con 0 μmol m-2 s-1 se logró cubriendo las cajas Petri con doble capa de papel aluminio. El resto de los tratamientos se realizó cubriendo las cajas con bolsas plásticas y cinta gris. La PPFD fue registrada con un sensor LI-190SA conectado a un datalogger (LI-COR LI-1000, Lincoln, EUA).
Potencial hídrico
Para determinar los requerimientos de agua en la germinación, las esporas se colocaron en siete soluciones de polietilenglicol (PEG) de alto peso molecular (Sigma-Aldrich PEG 8000, Madison, EUA), equivalente a potenciales hídricos de -0.06, -0.12, -0.27, -0.37, -0.52, -0.88 y -1.05 MPa y en agua destilada con 0.0 MPa. Se utilizaron 5 tubos Eppendorf de 1.5 ml por especie y por concentración de solución de PEG. El agua de la solución de 1 ml de agua con esporas desinfectadas se remplazó por 1 ml de solución PEG. La cantidad de PEG en cada solución fue calculada usando el programa “Solute potential and molal-molal-g water interconversion” (Michel y Radcliffe, 1995). Experimentos de germinación han mostrado que las soluciones PEG con alto peso molecular (>6000) son inertes y no tienen efectos tóxicos en semillas (Dodd y Donovan, 1999; Almansouri et al., 2001; De la Rosa y Briones, 2010; Singh et al., 2013) y esporas de helechos (Riaño et al., 2015). El potencial hídrico de cada solución fue verificado con un osmómetro (Vapro 5520El, Logan, EUA).
Las cajas Petri y tubos Eppendorf con las esporas se colocaron en cámaras de germinación (Lab-Line, EUA), a 25 °C ± 2 °C y fotoperiodo de 12 h de luz. La germinación de las esporas se registró después de 30 días en los experimentos de luz y cada semana durante un mes en el experimento de potencial hídrico. La espora se consideró germinada cuando se observó la primera célula protálica o rizoidal. Para estimar el porcentaje de germinación en los experimentos de luz se colocó una hoja cuadriculada debajo de cada caja de Petri y se registraron las esporas germinadas y no germinadas en 4 campos de observación por caja con un microscopio estereoscópico (National Optical & Scientific Instruments, Inc. 400TBL, Texas, EUA). Cada campo de observación tuvo entre 120 y 390 esporas. En el experimento de potencial hídrico, se colocaron y esparcieron 25 µl de cada solución de PEG con esporas en 1 portaobjetos. Previamente, cada tubo Eppendorf fue agitado vigorosamente para que las esporas quedaran suspendidas de manera uniforme. Con ayuda de un microscopio óptico (SWIFT, M2250 Fisher Scientific, Waltham, EUA) se contabilizaron las esporas germinadas y no germinadas en 4 campos de observación. Cada campo de observación tuvo entre 302 y 406 esporas.
Zona de estudio y censo de especies
En un rodal de bosque mesófilo de montaña en la localidad de El Riscal, Coatepec, Veracruz (19°28'55.1"N y 96°59'47.6"O; 1600 m s.n.m.), se establecieron 6 transectos perpendiculares (3 transectos de 80 m, 2 de 90 m y 1 de 100 m de largo) desde el arroyo hasta la parte alta de una ladera. Los transectos se dividieron en cuadrantes de 10 m2 y se contaron todos los individuos de las especies seleccionadas. Debido a que en El Riscal fue muy baja la densidad de plantas de B. appendiculatum, se localizó otro remanente de bosque mesófilo de montaña en la reserva La Granada, Coatepec, Veracruz (19º28'44.8"N y 97º01'11"O; 1691 m s.n.m.). Se trazaron 6 transectos de 10 m de largo por 1 m de ancho; cada transecto fue dividido en cuadrantes de 1 m2 y se contaron todos los individuos de B. appendiculatum. La menor superficie muestreada para B. appendiculatum con respecto a B. schiedeanum se debió a la diferencia de tamaño entre las especies. Con el objetivo de estimar la proporción de luz que recibe cada cuadrante se calculó el porcentaje de PPFD horizontal a 1 m de altura con un sensor LI-190SA conectado a una datalogger LI-1000 (LI-COR, Lincoln, EUA), colocado en un lugar completamente expuesto y programado para medir el PPFD cada minuto y con otro sensor similar conectado a otro datalogger, con el que se registró el PPFD en cada cuadrante en la mañana de un día nublado (B. appendiculatum: 06.III.2013; B. schiedeanum: 22.II.2013). Se empleó la fórmula utilizada por Machado y Reich (1999) y Riaño y Briones (2013):
Análisis de datos
Los resultados de los experimentos se analizaron con modelos lineales generalizados con distribución quasibinomial para reducir la sobredispersión de los datos (Crawley, 2007). El efecto de la calidad y cantidad de la luz y potencial hídrico sobre la germinación de las especies se probó analizando la devianza de una manera similar a un análisis de varianza con dos factores. Las diferencias entre los tratamientos se evaluaron utilizando pruebas de contrastes. El tratamiento de oscuridad se removió de los análisis estadísticos de calidad y cantidad de luz debido a que la germinación fue cero. Para describir la relación funcional entre la germinación y la calidad o la cantidad de luz se ajustaron modelos de regresión no lineal. Para describir la relación entre la germinación y el potencial hídrico se ajustaron modelos de regresión múltiple. Los análisis de devianza se realizaron con el programa R, versión 2.8.1 (R Development core team, 2008) y los de regresión con Statistica, versión 7 (StatSoft 1984-2004). El nivel de significancia para todos los casos fue de P=0.05.
Resultados
Calidad de luz
La germinación fue significativamente menor (P<0.001) en luz rojo-lejano en comparación con la luz roja y blanca en las dos especies (Cuadro 1). La germinación se incrementó de manera similar con el aumento en la proporción de luz rojo: rojo-lejano en ambas especies (P>0.05; Fig. 1).

Cuadro 1: Análisis de devianza del efecto de la calidad, cantidad de luz y potencial hídrico en la germinación de las esporas de Blechnum appendiculatum Willd. y Blechnum schiedeanum (Schltdl. ex Presl) Hieron.
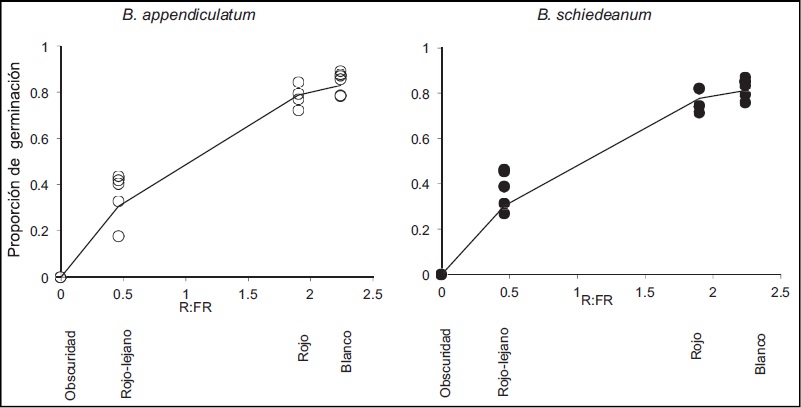
Figura 1: Germinación de las esporas de dos especies del género Blechnum L. bajo cuatro tratamientos de calidad de luz. En el eje X se indica la proporción de rojo: rojo-lejano (R:FR). Cada punto corresponde a una caja de Petri. N=5. Los datos fueron ajustados a un modelo de regresión no lineal: B. appendiculatum Willd. [0.932509-0.931052exp(1.013394×R:FR)], P<0.000001, r2=0.97; B. schiedeanum (Schltdl. ex Presl) Hieron. [0.867925-0.865972exp(1.213344×R:FR)], P<0.000001, r2=0.99.
Cantidad de luz
En las dos especies la germinación se incrementó significativamente (P<0.001) con la cantidad de luz (Cuadro 1). En promedio las esporas de B. appendiculatum germinaron más que las de B. schiedeanum y en ambas especies la germinación fue >60% con 0.04 µmol m-2 s-1; Fig. 2).

Figura 2: Efecto de la cantidad de luz (densidad de flujo fotónico fotosintéticamente activo, PPFD) sobre la germinación de las esporas de dos helechos. Los valores del eje X están en escala logarítmica base 10. Cada punto corresponde a una caja de Petri. N=5. B. appendiculatum Willd.[0.90327-0.90327exp(56.90213×PPFD)], P<0.000001, r2=0.99; B. schiedeanum (Schltdl. ex Presl) Hieron. [0.74183-0.74177exp(43.68432×PPFD)], P<0.000001, r2=0.97.
Potencial hídrico
La disminución en el potencial hídrico redujo significativamente la proporción de germinación, pero el efecto del potencial hídrico fue distinto entre las especies (P<0.001, Cuadro 1). En ambas especies la mayor germinación se observó a 0 MPa, pero B. appendiculatum alcanzó 30.2% en el tratamiento con menor potencial hídrico (-1.05 MPa), mientras que B. schiedeanum mostró mayor inhibición en el brote de la espora (10.6%) (Prueba de contrastes: t=10.14, Gl=63, P<0.001) (Fig. 3).
Distribución de las especies
La frecuencia de los esporofitos de los helechos estudiados estuvo asociada con la cantidad de luz en el bosque (Fig. 4). Blechnum schiedeanum solamente se encontró en el interior del dosel, creciendo preferentemente en ambientes lumínicos con muy bajos valores de PPFD relativo (0.1-3%), en comparación con B. appendiculatum que se observó creciendo en el borde del bosque en un gradiente lumínico mucho más amplio (1-55% PPFD relativo), con mayor frecuencia entre 3-9% de PPFD relativo.

Figura 4: Número de esporofitos de Blechnum appendiculatum Willd. en La Granada (60 m2) y Blechnum schiedeanum (Schltdl. ex Presl) Hieron. en El Riscal (520 m2), creciendo en un gradiente lumínico estimado como el porcentaje de la densidad de flujo fotónico fotosintéticamente activo (PPFD) con respecto a un sitio abierto.
Discusión
Efecto de la calidad y cantidad de luz en la germinación
La baja cantidad de luz necesaria para la germinación y la capacidad de germinar a distintas calidades de luz sugiere que B. appendiculatum y B. schiedeanum poseen fotoreceptores que actúan como indicadores del grado de apertura del dosel o de la remoción de la hojarasca en el piso del bosque (Vázquez-Yanes y Orozco-Segovia, 1990; de Wit y Pierik, 2016). Fitocromos y otros receptores de luz han sido importantes para la percepción y acople al medio ambiente de los organismos y se encuentran en hongos, bacterias, algas y plantas con semilla y sin semillas (Rensing et al., 2016). Nuestros experimentos de calidad de luz muestran que la germinación de las dos especies de Blechnum L. fue máxima con valores de R:FR>1 semejantes a la luz del día en los claros y bordes del bosque y fue parcialmente inhibida con valores de R:FR<1 y semejantes a los de la luz que llega al piso del bosque después de haber sido filtrada por la vegetación (Smith, 2000). Una respuesta en la germinación de las esporas similar al patrón encontrado para las dos especies de Blechnum ha sido reportada para los helechos Adiantum capillus-veneris L. (Furuya et al., 1997; Tsuboi et al., 2012), Cheilanthes concolor (Langsd. & Fisch.) R.M. Tryon & A.F. Tryon (Colli y Perez, 1999), Dryopteris filix-mas (L.) Schott (Büning y Mohr, 1955, en Raghavan, 1989), Lygodium hetererodoxum Kunze (Pérez-García et al., 1994) y Pteris vittata L. (Furuya et al., 1997). Las esporas de Blechnum appendiculatum y B. schiedeanum son fotoblásticas positivas debido a que la germinación fue promovida en los tratamientos con luz y completamente inhibida en la oscuridad, tal como fue previamente reportado para ambas especies por Mendoza-Ruiz y Pérez-García (2009). El fotoblastismo positivo es común en las semillas (Smith, 1982) y ha sido observado desde el s. XIX en la espora de helechos herbáceos (Wienberg y Voeller, 1969), arborescentes (Weinberg y Voeller, 1969; Randy y Felippe, 1988 (en Colli y Perez, 1999); Simabukuro et al., 1993; Riaño et al., 2015) y epífitos (Weinberg y Voeller, 1969; Esteves y Felippe, 1985, 1991 (en Colli y Perez, 1999); Simabukuro et al., 1993). Por otro lado, ha sido demostrado que las esporas de los helechos terrestres Pteridium aquilinum (L.) Kuhn, Polypodium feei (Bory) Mett. y Polystichum munitum (Kaulf.) C. Presl. y de los helechos epifitos Polypodium pleopeltifolium Raddi y P. polypodioides (L.) E.G. Andrews & Windham germinan en completa oscuridad en las mismas condiciones en que lo hacen con iluminación, aunque en baja proporción (Weinberg y Voeller, 1969; Esteves y Felippe, 1985).
El incremento de la germinación con el aumento de la cantidad de luz observado para B. appendiculatum y B. schiedeanum fue reportado para los helechos terrestres Asplenium serra Langs. & Fisch, Blechnum brasiliense Desv., B. glandulosum Link, Campyloneurum phyllitidis (L.) Presl., Cyathea delgadii Sternb., Polypodium fraxinifolium Jacq., Tectaria heracleifolia (Willd.) Underw., T. incisa Cav., T. mexicana (Fee) C.V. Morton, T. transiens (Fee) C.V. Morton, Thelypteris chrysodioides (Fee) C.V. Morton y Rumohra adiantiformis (G. Forst.) Ching (Simabukuro et al., 1993; Brum y Randi, 2002; Pérez-García et al., 2007); así como para los helechos arborescentes Alsophila firma (Baker) D.S. Conant, Cyathea delgadii Sternb., C. divergens Kunze y Lophosoria quadripinnata (J.F. Gmel.) C. Chr. (Simabukuro et al., 1993; Riaño et al., 2015). Por otro lado, la inhibición de la germinación por altos niveles de irradiancia solar (42%-72%) ha sido observada en las esporas de Blechnum brasiliense, Cyathea delgadii, Dicksonia sellowiana Hook. y Rumohra adiantiformis (G.Forst.) Ching (Brum y Randi, 2002; Renner y Randi, 2004; Hiendlmeyer y Randi, 2007). La germinación de la espora de las especies de helechos fotoblásticos positivos podría ser una respuesta de baja fluencia controlada por la detección de los cambios en la proporción R:FR a través del fitocromo A, que es altamente sensible a baja densidad de flujo fotónico en el espectro de la luz blanca (Raghavan, 1989; Pérez-García et al., 2007; Wu et al., 2010), mientras que la fotoinhibición de la germinación por alta irradiancia solar podría ser un mecanismo para desalentar la germinación de la espora de los helechos bajo condiciones de campo en donde los gametofitos y plántulas del esporofito estarían sujetas a condiciones estresantes de sequía (Hiendlmeyer y Randi, 2007).
Efecto del potencial hídrico en la germinación
El efecto de la disminución de la disponibilidad de agua sobre la germinación de la espora de los helechos es casi desconocido (Riaño et al., 2015). Aunque B. appendiculatum y B. schiedeanum registraron su mayor germinación en el tratamiento con mayor disponibilidad de humedad en el presente estudio, la primera especie alcanzó mayor germinación en el tratamiento con menor disponibilidad de humedad (-1.05 MPa) en comparación con la segunda especie. El comportamiento germinativo de ambas especies a la disminución del potencial hídrico se correlacionó con la distribución de los esporofitos en el bosque, pues B. appendiculatum se observó creciendo en el borde del bosque en donde la evaporación del agua y la cantidad de agua en el suelo suele ser más alta y más baja, respectivamente, en comparación con los sitios en el interior del bosque en donde se encontró con mayor frecuencia a B. schiedeanum. La respuesta germinativa al efecto del potencial hídrico del sustrato también estuvo asociada con la distribución de tres especies de helechos arborescentes que coexisten en el bosque mesófilo de montaña (Riaño et al., 2015). El helecho arborescente Lophosoria quadripinnata, prefiere crecer en espacios abiertos del bosque y fue la especie que exhibió la más alta tolerancia al efecto de la disminución de la disponibilidad de agua en la germinación, en oposición a los helechos arborescentes Alsophila firma y Cyathea divergens, que prefieren establecerse en sitios de sombra (Riaño y Briones, 2013). Es conocido que las especies de plantas con semillas que crecen en condiciones secas tienen semillas capaces de germinar a potenciales hídricos más negativos que las especies de los ambientes húmedos (Evans y Etherington, 1990; Flores y Briones, 2001). La germinación en bajos niveles de humedad también fue descrita para Cheilanthes feei Moore, una especie de helecho ampliamente distribuida en Norteamérica en sitios totalmente abiertos en acantilados de suelo calizo (Nondorf et al., 2003).
Preferencia de hábitat
El género Blechnum con aproximadamente 200 especies tiene amplia distribución mundial, aunque la mayor diversidad de especies se encuentra en las regiones tropicales; en México crecen alrededor de 15 especies (Mendoza-Ruiz y Pérez-García, 2009). En algunas regiones pueden encontrarse varias especies de Blechnum creciendo juntas y su presencia podría estar asociada a la diferenciación en el nicho ecológico. En un bosque templado chileno se encontró que la coexistencia de tres especies de Blechnum estuvo explicada por la segregación de las especies a lo largo de un gradiente lumínico en el sotobosque y por la habilidad fisiológica y morfológica en el uso de la luz por la hoja del esporofito (Saldaña et al., 2010). Aunque B. appendiculatum es un helecho con amplia distribución en México (Mickel y Smith, 2004; Velazco-Macías et al., 2011), nuestros resultados sugieren que a nivel local los esporofitos prefieren un hábitat de borde de bosque. Por otro lado, B. schiedeanum solo se registró en el interior del bosque, como fue observado por Pérez-García y Mendoza-Ruiz (2009). Las diferencias observadas en la frecuencia de individuos, con relación al hábitat lumínico y la correspondencia del comportamiento fisiológico de la espora con respecto a la disponibilidad de agua, apoyan la hipótesis de que la coexistencia de B. appendiculatum y B. schiedeanum en el sitio de estudio ocurre por diferenciación en el nicho ecológico desde etapas tempranas del desarrollo del individuo. En un estudio con ocho especies de Blechnum, Mendoza-Ruiz y Pérez-García (2009) encontraron que el tamaño de la espora estuvo asociado a la duración de la fase de pre-germinación, con las especies con esporas más pequeñas germinando más temprano que las especies con las esporas más grandes. Nosotros no registramos la velocidad de germinación, pero encontramos que la especie con esporas más pequeñas mostró mayor capacidad para germinar con menor disponibilidad hídrica, en comparación con la especie con mayor tamaño de espora. Por lo tanto, nosotros sugerimos que las diferencias en las preferencias del hábitat por las especies de Blechnum podrían estar determinadas desde el nicho de regeneración de las especies, como ha sido recientemente propuesto para helechos arborescentes (Riaño et al., 2015). El inmenso grupo de las especies de helechos espera la investigación de éste fenómeno.
En conclusión, las esporas de B. appendiculatum y B. schiedeanum son fotoblásticas positivas y tienen la capacidad de germinar a muy bajas cantidades de luz, pero su germinación es inhibida por la baja proporción de rojo: rojo-lejano. La humedad del sustrato puede limitar la germinación de las dos especies a ambientes húmedos del bosque, pero B. appendiculatum tiene el potencial germinativo de colonizar ambientes más secos en comparación con B. schiedeanum. En ambientes con dosel relativamente cerrado B. schiedeanum fue abundante, mientras que B. appendiculatum ocurrió con mayor frecuencia en ambientes abiertos. El comportamiento germinativo puede promover la coexistencia de B. appendiculatum y B. schiedeanum en el bosque mesófilo de montaña.











 nueva página del texto (beta)
nueva página del texto (beta)




