Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Acta botánica mexicana
versión On-line ISSN 2448-7589versión impresa ISSN 0187-7151
Act. Bot. Mex no.93 Pátzcuaro oct. 2010
Rescate de embriones en híbridos intergenéricos Helianthus annuus x Tithonia rotundifolia
Embryo rescue of intergeneric hybrids Helianthus annuus x Tithonia rotundifolia
Martha Gómez–Martínez, M. Humberto Reyes–Valdés*, Juan Manuel Martínez–Reyna, Leticia Escobedo–Bocardo y Hermila T. García–Osuna
Universidad Autónoma Agraria Antonio Narro, Departamento de Fitomejoramiento, Buenavista, 25315 Saltillo, Coahuila, México.
*Autor para correspondencia:
mhreyes@uaaan.mx, mathgenome@gmail.com
Recibido en enero de 2009
Aceptado en julio de 2010
RESUMEN
En esta investigación se desarrolló una técnica in vitro para producir y propagar híbridos intergenéricos a partir de semillas inmaduras producto del cruzamiento del girasol cultivado Helianthus annuus L. con la especie silvestre Tithonia rotundifolia (Mill.) S. F. Blake. Para el rescate de embriones inmaduros en cultivo de tejidos el mayor éxito se obtuvo con el uso secuencial de tres medios basados en el de Murashige–Skoog: a) con adición de aminoácidos y el regulador de crecimiento BAP para germinación, b) sin aminoácidos y con BAP para micropropagación, y c) sin vitaminas y con el regulador de crecimiento ANA para enraizamiento. Los aminoácidos se agregaron como fuente de nitrógeno orgánico. A partir de una plántula se lograron obtener 130 en buenas condiciones de sanidad. Veinte de ellas se llevaron a aclimatación, y solamente una generó botones y llegó a floración inconclusa, por lo que aún se requiere estandarizar las condiciones de aclimatación. En particular, se necesita establecer tratamientos que permitan definir con claridad las condiciones específicas para aclimatar el híbrido, a través de la prueba de diferentes mezclas de sustratos y soluciones nutritivas bajo condiciones ambientales controladas. Se recomienda probar el manejo de retardantes y aminoácidos, así como realizar modificaciones en la intensidad de luz.
Palabras clave: cruzamientos intergenéricos, Helianthus annuus, rescate de embriones, Tithonia rotundifolia.
ABSTRACT
In this research an in vitro technique was developed for production and propagation of intergeneric hybrids from immature seeds produced by crossing the domestic sunflower Helianthus annuus and the wild species Tithonia rotundifolia (Mill.) S. F. Blake. For embryo rescue in tissue culture the greatest success was obtained with the sequential use of three Murashige–Skoog based media: a) with amino acids and growth regulator BAP for germination, b) without amino acids and with BAP for micropropagation, and c) without vitamins and growth regulator ANA for root development. The amino acids were added as a source of organic nitrogen. From a single seedling a total of 130 healthy plantlets were obtained. Twenty of them were taken for acclimatization, and only one reached an incomplete flowering stage. Therefore, standardizing acclimatization conditions is still required. In particular, it is necessary to establish treatments that allow a clear definition of the specific conditions for the acclimatization of the hybrid, through the test of different substrate mixtures and nutritive solutions under controlled environmental conditions. It is recommended to try the use of retardants and amino acids, as well as modifications in light intensity.
Key words: embryo rescue, Helianthus annuus, intergeneric crossing, Tithonia rotundifolia.
INTRODUCCIÓN
Los géneros Helianthus y Tithonia pertenecen a la familia de las asteráceas y son nativos de América. Helianthus annuus L. tiene representantes tanto silvestres como domésticos; estos últimos, los girasoles cultivados, tienen importancia económica mundial en la producción de aceite comestible y como ornamentales. Tithonia rotundifolia (Mill.) S. F. Blake se encuentra distribuida en forma silvestre en los trópicos húmedos y sub–húmedos de Centro y Sudamérica, Asia y África (George et. al., 2001). Se le considera una especie con potencial ornamental, y se explota en forma comercial como planta para jardín, de la cual existen algunas variedades registradas fuera de México.
Los miembros de T. rotundifolia son plantas anuales grandes, que tienen características ornamentales deseables para transferirse al girasol cultivado: pubescencia suave, tonos naranja, pedúnculo largo y aroma dulce. Asimismo, su potencial decorativo podría beneficiarse de algunas características del girasol cultivado como resistencia a heladas, insensibilidad al fotoperíodo y capítulos grandes. De aquí se desprende que la hibridación intergenérica entre ambas especies puede, además de su importancia básica en el conocimiento de las relaciones genómicas en asteráceas, servir como una manera de desarrollar un nuevo cultivar ornamental.
A la fecha existen solamente dos reportes de hibridación entre H. annuus y T. rotundifolia. Cristov y Panayotov (1991) realizaron cruzamientos amplios entre las dos especies con obtención de plantas fértiles, pero no demostraron a nivel molecular su naturaleza híbrida. Los únicos reportes en los que se demuestra ésta a través de análisis de DNA son los de Reyes–Valdés et al. (2005) y Luévanos–Escareño et al. (2010), quienes obtuvieron híbridos intergenéricos estériles, de la cruza entre la línea androestéril HA 89 de H. annuus y una población de T. rotundifolia colectada en Iguala, Guerrero. La naturaleza híbrida se demostró a través de AFLPs (Vos et al., 1995) y se descartó el fenómeno de mezcla parcial mediante el cálculo de distancias euclidianas.
En nuestra experiencia, la eficiencia de cruzamiento entre estas dos especies es bastante baja, y la mayor parte de la semilla que se obtiene de los mismos está mal desarrollada y no tiene capacidad de germinar. De aquí se desprende la importancia de lograr una metodología para producir híbridos masivamente y poder así estudiarlos y posiblemente inducirles poliploidía con el fin de recuperar su fertilidad. Por ello, el rescate de embriones se plantea como una de las mejores alternativas.
El cultivo de embriones inmaduros consiste en su aislamiento y crecimiento in vitro, en condiciones estériles, con el fin de obtener una planta viable (Pierik, 1990). Estos se originan en semillas no acabadas de madurar. Las posibilidades de éxito en cultivo y regeneración en el laboratorio dependen de varios factores, entre los cuales resulta clave el estado de desarrollo del embrión en el momento de ser aislado (Sharma et al., 1996; Pellegrineschi et al., 1997; Tian and Wang, 2008). En estado inmaduro tiene un alto potencial morfogénico y se usa frecuentemente para la regeneración de plantas en especies en las cuales la regeneración con otros explantes es difícil.
MATERIALES Y MÉTODOS
El material utilizado como explante consistió de embriones inmaduros obtenidos del cruzamiento del girasol cultivado (línea CMS HA89) x Tithonia rotundifolia (Accesión 26). Se trabajó en condiciones asépticas en una campana de flujo laminar. Todos los medios, instrumentos y recipientes de cultivo fueron esterilizados con vapor húmedo en una autoclave durante 20 minutos bajo una presión de 1kg/cm2 y a una temperatura de 120–121 °C.
Se extirparon 46 y 40 embriones procedentes de semillas mal desarrolladas del híbrido (13 y 22 días después de la polinización). Se desinfectaron con alcohol etílico a 70% por 1 minuto, posteriormente en hipoclorito de sodio, con una concentración de cloro activo de 1.2%, por 15 minutos y enjuagados tres veces con agua estéril desionizada. La desinfección se llevó al cabo en la campana de flujo laminar del cuarto de siembra.
Se utilizaron tres medios (Cuadro 1), variantes del de Murashige y Skoog (1962) para la obtención de planta completa a partir de embriones inmaduros: MI para la emergencia del embrión, MII para la propagación del material vegetal y MIII para su enraizamiento.

Las semillas desinfectadas se extirparon bajo un estereomicroscopio con pinza, aguja y escalpelo de disección. Se retiraron los tejidos periféricos de las semillas y se colocaron en un recipiente de vidrio conteniendo Medio I, y se incubaron en oscuridad de 6 a 8 semanas a una temperatura de 24 °C ± 2 °C. Cuando los embriones comenzaron a desarrollarse en plántulas, se colocaron en Medio II con un fotoperíodo de 16 horas de luz 8 horas de oscuridad de 2 a 4 semanas para su micropropagación.
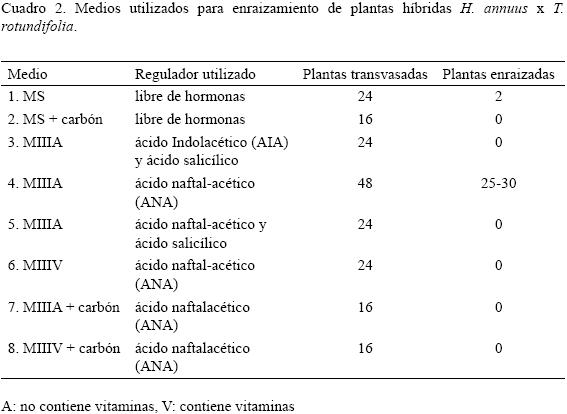
Se prepararon ocho medios con diferentes reguladores de crecimiento para obtener plantas completas (con raíz): 1) MS libre de hormonas, 2) MS libre de hormonas + 1.5 g/l de carbón activado, 3) MIIIA, sin vitaminas, con 0.0002 g/l de AIA (ácido indolacético) y 0.000138 g/l de ácido salicílico, 4) MIIIA, sin vitaminas y con 0.0001 g/l de regulador de crecimiento ANA (ácido naftalacético), 5) MIIIA, sin vitaminas, con 0.0002 g/l de ANA y 0.000138 g/l de ácido salicílico, 6) MIIIV, con vitaminas y 0.0001 g/l de ANA, 7) MIIIA, con 1.5 g/l de carbón activado y 0.0001 g/l de ANA y 8) MIIIV, con vitaminas, 1.5 g/l de carbón activado y 0.0001 g/l de ANA. De tres a cuatro plántulas fueron colocadas por frasco con un total de cinco contenedores por tratamiento y trasladados a la cámara de crecimiento con temperatura de 24 ± 2 °C y un fotoperíodo de 16 horas de luz y ocho horas de oscuridad.
La técnica de rescate de embriones se modificó con un cambio en el medio para enraizamiento basado en el B5 (Gamborg et al., 1968), que fue aplicado exitosamente por Chandler y Beard (1983) para rescate de embriones de híbridos entre especies de Helianthus y Freyssinet y Freyssinet (1988) en Helianthus annuus. Se hicieron modificaciones en el regulador de crecimiento y su concentración, en la cantidad de sacarosa y en la concentración de agar, la cual si es demasiado baja provoca hiperhidratación.
Una vez obtenida la raíz completa, el medio fue retirado de la misma en 20 plantas con agua de la llave. Las raíces se sumergieron en una solución de 3.125 g de Cuprimicin 500 como bactericida–fungicida en 500 ml agua desionizada por dos minutos para protegerlas de posibles enfermedades. La parte basal de la planta se colocó en una solución de 0.625 g de Raizal® 400 en 100 ml de agua desionizada, por tres minutos para el fortalecimiento de la raíz y finalmente las plantas enraizadas (2 a 5 cm) se transfirieron a macetas con una mezcla 3:1 de peat–moss/vermiculita y arena que se mantuvieron en el laboratorio.
Las plantas fueron inicialmente cubiertas con bolsas de plástico y gradualmente expuestas (cada tercer día) a humedad ambiental. Después de 10 días se transfirieron a condiciones regulares de invernadero, donde comenzó su desarrollo y maduración.
RESULTADOS Y DISCUSIÓN
Tres plántulas emergieron de la siembra de los 86 embriones en medio MI después de seis semanas, con una longitud de entre 0.5 a 1.0 cm. Cinco más lo hicieron de 8 a 9 semanas con medidas entre 1.5 a 2.5 cm. Siete de las ocho plántulas fueron deshechadas por hiperhidratación. Esta condición es un estado disfuncional presente en plantas cultivadas in vitro y está asociado al estrés oxidativo (Chakrabarty et al., 2006). Entre los principales factores que contribuyen al desarrollo de esta alteración se encuentra una alta humedad dentro del recipiente y la presencia de agua libre en los sustratos que dificulta la transpiración del explante. A partir de la plántula sobreviviente se logró obtener 130 micropropagadas en buenas condiciones.
De los ocho medios de crecimiento utilizados para el parta inducir raíz en la planta, la mejor respuesta la dió el Medio 4 (MIIIA sin vitaminas y con 0.0001 g/l de ANA) con obtención de cinco plantas enraizadas en los primeros cuatro días de su trasvase con longitudes de 3 a 4.5 cm y llegaron a medir 12 cm a los 10 días. Posteriormente la inducción se hizo en 23 plantas más para tener al final un 52% de enraizamiento. Por otro lado, en el Medio 1 (libre de hormonas) se obtuvo un 8.3% de 24 plantas transvasadas. Con los medios restantes no hubo inducción debido a la ausencia de vitaminas y a la alta concentración de reguladores de crecimiento (Cuadro 2).
De las 20 plantas que fueron aclimatadas primero en condiciones de laboratorio y después en invernadero, solamente dos lograron desarrollarse. Una generó dos botones, de los cuales uno llegó a floración inconclusa, pero no pudieron adaptarse normalmente ya que aún falta definir las condiciones de aclimatación (Fig. 1). Una alternativa para lograr el desarrollo óptimo en etapa posterior a condiciones in vitro después del empleo de retardantes, es la aplicación foliar de giberelinas o aminoácidos. El suministro de aminoácidos regula el contenido hídrico de la planta. Actúan como catalizadores que regulan el crecimiento a través de mecanismos enzimáticos (Sánchez, 2002) o son precursores de poliaminas, las cuales tienen funciones estructurales que afectan diversas propiedades biológicas.

CONCLUSIONES
Tres medios MS adicionados con diferentes concentraciones de reguladores de crecimiento (ANA y BAP), aminoácidos (alanina, glutamina, serina, triptófano y cisteína) y agar, permitieron el rescate de embriones híbridos de semillas mal desarrolladas, para desarrollar plántulas. El primer medio, para germinación, contiene aminoácidos y BAP, el segundo, para micropropagación, contiene BAP y el tercero, para enraizamiento, no incluye vitaminas y contiene ANA como regulador de crecimiento.
Ya que los cruzamientos H. annuus × T. rotundifolia producen en su gran mayoría aquenios sin desarrollo completo, la técnica de rescate de embriones, que resultó exitosa para la etapa in vitro de este trabajo, puede promover el desarrollo intensivo de híbridos con potencial ornamental. Sin embargo, en esta investigación solamente se obtuvieron plantas con poco crecimiento y que no llegaron a la madurez, por lo que aún se requiere estandarizar las condiciones de aclimatación a través de la prueba de diferentes mezclas de sustratos y soluciones nutritivas bajo ambientes controlados. En especial, se debe probar el manejo de retardantes y aminoácidos, y realizar modificaciones en la intensidad de luz.
LITERATURA CITADA
Chandler, J. M. y B. H. Beard. 1983. Embryo culture of Helianthus hybrids. Crop Sci. 23: 1004–1007. [ Links ]
Cristov, M. y I. Panayotov. 1991. Hybrids between the genera Helianthus and Tithonia and their study. Helia 14: 27–34. [ Links ]
Chakrabarty, D., S. Y. Park, M. B. Ali, K. S. Shin y K. Y. Pack. 2006. Hyperhydricity in apple: ultraestructural and physiological aspects. Tree Physiol. 26: 377–388. [ Links ]
Freyssinet, M. y G. Freyssinet. 1988. Fertile plant regeneration from sunflower (Helianthus annuus L.) immature embryos. Plant Science 56: 177–181. [ Links ]
Gamborg, O., R. Miller y K. Ojima. 1968. Nutrient requirements of suspension cultures of soybean root cells. Exp. Cell Res. 50: 151–158. [ Links ]
George, T. S., P. J. Gregory, J. S. Robinson, R. J. Buresh y B. A. Jama. 2001. Tithonia diversifolia: variants in leaf nutrient concentration and implications for biomass transfer. Agroforest. Syst. 52: 199–205. [ Links ]
Luévanos–Escareño, M. P., M. H. Reyes–Valdés, J. A. Villarreal–Quintanilla y R. Rodríguez–Herrera. 2010. Obtención de híbridos intergenéricos Helianthus annuus x Tithonia rotundifolia y su análisis morfológico y molecular. Acta Bot. Mex. 90: 105–118. [ Links ]
Murashige, T. y F. Skoog. 1962. A revised medium for rapid growth and bioassay with tobacco tissue culture. Physiol. Plant. 15: 473–497. [ Links ]
Pellegrineschi, A., C. A. Fatokun, G. Thottappilly y A. A. Adepoju. 1997. Cowpea embryo rescue. 1. Influence of culture media composition on plant recovery from isolated immature embryos. Plant Cell Rep. 17: 133–138. [ Links ]
Pierik, R. L. M. 1990. Cultivo de embriones en cultivo in vitro de las plantas superiores. Ediciones Mundi–Prensa. Madrid. pp. 139–147. [ Links ]
Reyes–Valdés, M. H., M. Gómez–Martínez, O. Martínez y F. Hernández Godínez. 2005. Intergeneric hybrid between cultivated sunflower (Helianthus annuus L.) and Tithonia rotundifolia (Mill.) Blake. Helia 28: 61–68. [ Links ]
Sánchez, S. A. 2002. Mejora en la eficiencia de los quelatos de hierro sintéticos a través de sustancias húmicas y aminoácidos. Tesis doctoral. Facultad de Ciencias, Universidad de Alicante. Alicante, España. 623 pp. [ Links ]
Sharma, D. R., R. Kaur y K. Kumar. 1996. Embryo rescue in plants – a review. Euphytica 89: 5–337. [ Links ]
Tian, L. y Y. Wang. 2008. Seedless grape breeding for disease resistance by using embryo rescue. Vitis 47: 15–19. [ Links ]
Vos, P., R. Hogers, M. Bleker, M. Reijans, T. Van de Lee, M. Hornes, A. Frijters, J. Pot, J. Peleman, M. Kuiper y M. Zabeau. 1995. AFLP: a new technique for DNA fingerprinting. Nucl. Acids Res. 23: 4407–4414. [ Links ]














