Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Acta botánica mexicana
versión On-line ISSN 2448-7589versión impresa ISSN 0187-7151
Act. Bot. Mex no.82 Pátzcuaro ene. 2008
Cambios en la estructura de la asociación de diatomeas epifitas de Macrocystis pyrifera (L.) C. Ag.
Changes in the structure of the epiphytic diatom assemblage of Macrocystis pyrifera (L.) C. Ag.
Uri Argumedo Hernández y David. A. Siqueiros Beltrones*
Instituto Politécnico Nacional, Centro Interdisciplinario de Ciencias Marinas, Departamento de Plancton y Ecología Marina, Apdo. postal 592, 23000 La Paz, Baja California Sur, México.
Recibido en junio de 2005
Aceptado en octubre de 2007
RESUMEN
Con el objetivo de determinar la estructura de la asociación de diatomeas que colonizan láminas apicales de Macrocystis pyrifera en las costas de la península de Baja California y detectar sus posibles cambios temporales, se recolectaron mensualmente cuatro frondas de la especie, de febrero a agosto del 2003, en un manto en El Sauzal, Baja California. Las diatomeas de cinco láminas de cada fronda fueron tratadas y montadas en preparaciones permanentes y examinadas en términos de su número y contenido florístico. La distribución de las abundancias de la asociación concordó con el patrón general descrito para asociaciones de diatomeas (pocas especies abundantes y muchas raras). El número de taxa fue alto (171), pero la riqueza por muestra fue heterogénea y en general baja (6 –51 taxa). La diversidad y la equidad fueron bajas: 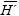 = 2.1 (máx = 3.8, mín = 0.3), y
= 2.1 (máx = 3.8, mín = 0.3), y 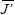 = 0.45. Las diatomeas más abundantes fueron Rhoicosphenia genuflexa (Kützing) Medlin, Gomphonemopsis pseudexigua (Simonsen) Medlin, Tabularia investiens (W. Smith) Williams y Round y Cocconeis costata var. pacifica (Grunow) Grunow, mismas que pueden considerarse constituyentes permanentes de la asociación; R. genuflexa dominó en cinco meses; mientras que en junio prevaleció G. pseudexigua, y en febrero C. costata var. pacifica. La estructura y la composición florística de la asociación de diatomeas epifitas no variaron en láminas de diferente posición (en un intervalo hasta de 2.5 m de longitud de la fronda de Macrocystis). Las diferencias en la estructura y composición de las especies entre frondas de una misma fecha se atribuyen a la edad de las láminas; se sugiere que las más maduras exportan diatomeas que colonizan rápidamente a las láminas jóvenes. Cambios en la estructura y en los taxa de diatomeas que separan a febrero y junio se asocian con periodos de transición.
= 0.45. Las diatomeas más abundantes fueron Rhoicosphenia genuflexa (Kützing) Medlin, Gomphonemopsis pseudexigua (Simonsen) Medlin, Tabularia investiens (W. Smith) Williams y Round y Cocconeis costata var. pacifica (Grunow) Grunow, mismas que pueden considerarse constituyentes permanentes de la asociación; R. genuflexa dominó en cinco meses; mientras que en junio prevaleció G. pseudexigua, y en febrero C. costata var. pacifica. La estructura y la composición florística de la asociación de diatomeas epifitas no variaron en láminas de diferente posición (en un intervalo hasta de 2.5 m de longitud de la fronda de Macrocystis). Las diferencias en la estructura y composición de las especies entre frondas de una misma fecha se atribuyen a la edad de las láminas; se sugiere que las más maduras exportan diatomeas que colonizan rápidamente a las láminas jóvenes. Cambios en la estructura y en los taxa de diatomeas que separan a febrero y junio se asocian con periodos de transición.
Palabras clave: Baja California, diatomeas epifitas, diversidad, Macrocystis pyrifera, México.
ABSTRACT
To determine the structure of the epiphytic diatom assemblage and its potential time variations on apical blades of Macrocystis pyrifera from the coasts of the Baja California peninsula four fronds of M. pyrifera were collected monthly from February to August 2003 in El Sauzal, B.C.; the diatoms from 5 blades per frond were mounted on permanent slides and examined floristically and quantitatively. The structure of the assemblage followed the general pattern for most diatom associations, i. e., few abundant species and many rare or uncommon taxa. Species richness reached 171 diatom taxa, however S per sample was heterogeneous (6 – 51 taxa) and in general low. Also, low values of diversity and equitability were estimated: 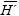 = 2.1 (max = 3.8, min = 0.3), and
= 2.1 (max = 3.8, min = 0.3), and 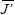 = 0.45. The most abundant taxa were Rhoicosphenia genuflexa (Kützing) Medlin, Gomphonemopsis pseudexigua (Simonsen) Medlin, tabularia investiens (W.Smith) Williams & Round, and Cocconeis costata var. pacifica (Grunow) Grunow. All are considered permanent constituents of the diatom assemblage on M. pyrifera, inasmuch in five dates R. genuflexa dominated, whilst in June G. pseudexigua was the most abundant taxon, and C. costata var. pacifica dominated in February. Species composition and structure of the diatom assemblage in blades with different position did not change significantly down to the length of 2.5 m of Macrocystis fronds. Differences in structure and species composition between fronds from a same date suggest that mature blades export species to the new blades. Temporal changes in species composition and structure of the diatom assemblage showed to be significant in February and June. This may be associated to transitional periods.
= 0.45. The most abundant taxa were Rhoicosphenia genuflexa (Kützing) Medlin, Gomphonemopsis pseudexigua (Simonsen) Medlin, tabularia investiens (W.Smith) Williams & Round, and Cocconeis costata var. pacifica (Grunow) Grunow. All are considered permanent constituents of the diatom assemblage on M. pyrifera, inasmuch in five dates R. genuflexa dominated, whilst in June G. pseudexigua was the most abundant taxon, and C. costata var. pacifica dominated in February. Species composition and structure of the diatom assemblage in blades with different position did not change significantly down to the length of 2.5 m of Macrocystis fronds. Differences in structure and species composition between fronds from a same date suggest that mature blades export species to the new blades. Temporal changes in species composition and structure of the diatom assemblage showed to be significant in February and June. This may be associated to transitional periods.
Key words: Baja California, diversity, epiphytic diatoms, Macrocystis, Mexico.
INTRODUCCIÓN
La fracción mayoritaria de la flora epifitica que habita sobre macrofitas marinas la constituyen las diatomeas (Kita y Harada, 1962; Jacobs y Noten, 1980), las cuales en general, presentan menor riqueza específica y densidad sobre sustratos no vivos que sobre macroalgas (McIntire y Overton, 1971; Main y McIntire, 1974). En cualquier caso, es evidente que muchas de ellas colonizan a las macrofitas a pesar de sus defensas; se aprecia así una cierta relación epifita–hospedero (Siqueiros–Beltrones, 2002b). Esta preferencia de sustrato se ha atribuido tan sólo a la naturaleza oportunista de muchas diatomeas y a la ulterior modulación de la superficie para fijación por pocas especies pioneras (Sieburth y Thomas, 1973; McIntire y Moore, 1977; Siqueiros–Beltrones et al., 1985).
Son característicos del paisaje costero los mantos de Macrocystis pyrifera, cuyas poblaciones se distribuyen de manera discontinua por el litoral noroccidental de la península de Baja California hasta Punta San Roque, Baja California Sur, que es el límite meridional de su área (Ladah et al., 1999). Estos mantos son el hábitat de especies animales con alto valor comercial como la langosta y el abulón (Guzmán del Próo et al., 1971). Sus láminas sirven de sustrato para gran número de epifitos, como esponjas, tunicados, anfípodos, hidrozoarios, briozoarios, poliquetos, macroalgas y muchas diatomeas (Foster y Schiel, 1985). No obstante lo anterior, las macroalgas han sido poco estudiadas como sustratos vivos para el desarrollo de películas de diatomeas epifitas en la región.
En los trabajos recientes se observó (Siqueiros–Beltrones et al., 2001; Siqueiros–Beltrones et al., 2002), que las láminas de M. pyrifera albergan gran cantidad de diatomeas y en particular se desarrolla una (cocconeis costata var. pacificó) que forma un extenso mosaico que sirve, a su vez, como sustrato para otras especies; las diferencias observadas en las asociaciones o asociación de diatomeas, entre láminas recolectadas en fechas distintas, podrían estar evidenciando un reemplazamiento estacional (Siqueiros–Beltrones et al., 2002).
De acuerdo con lo anterior, el objetivo de esta investigación fue describir la estructura de la asociación de diatomeas epifitas que se desarrolla sobre láminas apicales de M. pyrifera y sus posibles variaciones temporales, examinando parámetros clásicos como: riqueza y diversidad de especies, dominancia y similitud. De acuerdo con lo anterior, se propusieron dos hipótesis nulas.
Ho 1) La estructura de la asociación madura de diatomeas epifitas de M. pyrifera no variará significativamente entre láminas apicales, o entre frondas recolectadas para una misma fecha.
Ho 2) La estructura de la asociación no variará significativamente a lo largo del periodo de estudio.
En relación con las hipótesis propuestas, se cumplieron los siguientes objetivos específicos:
a) Determinar la composición y abundancia de especies de diatomeas epifitas que colonizan las láminas apicales de M. pyrifera de la zona de El Sauzal, B. C.
b) Determinar las especies más abundantes en la asociación, así como sus constancias.
c) Calcular la diversidad y equidad de la asociación de diatomeas y sus variaciones mensuales, y determinar si existen diferencias significativas entre láminas, entre frondas en un mismo mes, así como entre meses.
ÁREA DE ESTUDIO
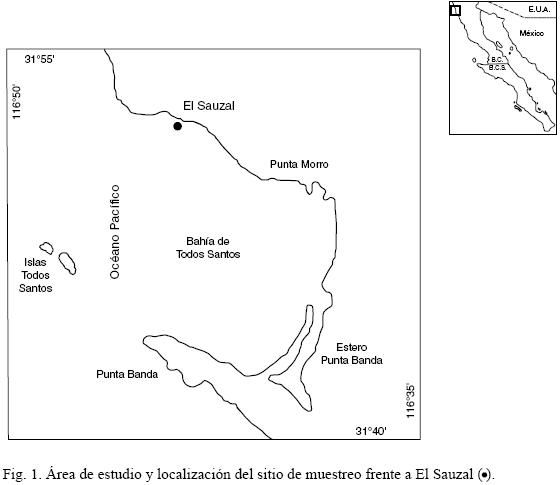
El manto de M. pyrifera representado se localiza a 500 m de la línea de costa en los 31°53'46'' N y 116°42'33" W, al norte de la Bahía de Todos Santos, a la altura de El Sauzal, Baja California (Fig. 1). Las frondas miden unos 25 m de longitud, de los que cerca de 10 m se encuentran de manera horizontal en la superficie del agua. Aproximadamente 90% de dicha bahía tiene profundidades entre 10 y 50 m y el resto forma parte de un cañón localizado entre las islas Todos Santos y Punta Banda. La mayor parte de los litorales son arenosos, pero al norte y al sur son rocosos (Bonfil y Carvacho, 1989). Desde El Sauzal hasta cerca de Punta Morro, la playa es angosta, formada básicamente por cantos rodados (Cruz–Colín y Cupul–Magaña, 1997). La salinidad registrada es de 33 a 34 UPS (Jiménez–Pérez, 1989). Morales–Zúñiga (1977) observó que la temperatura superficial del mar varió entre 12° C (febrero) y 22.5° C (agosto). Durante el periodo de muestreo varió de 16° a 21.5° C (Cuadro 1).

MÉTODOS
Recolecta de frondas.
Se realizaron siete recolectas mensuales, de febrero a agosto de 2003, con el fin de representar los talos de la época más fría (febrero) y cálida (agosto) en la región.
Las frondas de M. pyrifera se diferenciaron en tres tipos:
Frondas jóvenes. Láminas con pocos briozoarios (casi nulo epifitismo por diatomeas).
Frondas maduras. La mayoría de las láminas muy colonizadas por briozoarios.
Frondas viejas. Láminas deterioradas e incompletas y cubiertas casi enteramente por briozoarios.
Mensualmente se tomaron al azar cuatro frondas, maduras o viejas, con el fin de examinar la asociación en su fase madura o clímax. De cada una de ellas se eliminó el primer metro apical, por tratarse de láminas muy jóvenes con escaso o nulo epifitismo por diatomeas. Se utilizó entonces la siguiente porción, que incluyó 20 láminas, ubicadas en una porción de ca. 1.5 m (Fig. 2); en algunas ocasiones, se encontraron láminas jóvenes intercaladas. Las frondas recolectadas se secaron al sol y se enviaron a la ciudad de La Paz, en donde se prepararon para examinar la asociación de diatomeas.
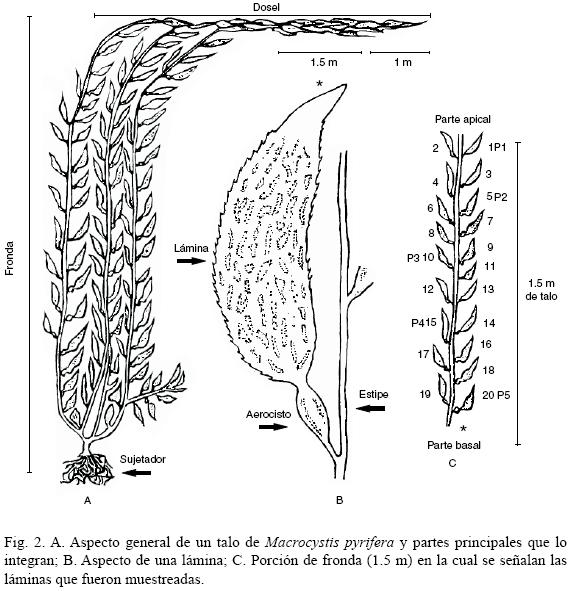
De cada fronda se desprendieron arbitrariamente la primera, quinta, décima, décima quinta y vigésima láminas (Fig. 2) para obtener las muestras de diatomeas. Cada lámina se hidrató con agua destilada y se raspó por ambos lados con un portaobjetos, obteniéndose un concentrado que se vació en tubos de ensaye. Estos se agitaron para homogeneizar; se tomó una alícuota de 1 ml que se oxidó con una mezcla de 3 ml de ácido nítrico y 5 ml de alcohol comercial; la proporción de reactivos se adecuó a la cantidad de materia orgánica y la alícuota oxidada se lavó con agua destilada hasta obtener un pH > 6 (Siqueiros–Beltrones y Voltolina, 2000).
Con las alícuotas limpias se elaboraron preparaciones permanentes por triplicado utilizando Pleurax (I.R. = 1.7) como medio de montaje; éstas se integraron a la colección de diatomeas del Centro Interdisciplinario de Ciencias Marinas.
Para elaborar la lista florística de diatomeas epifitas, de cada lámina de M. pyrifera tratada se revisó una preparación, la cual se barrió bajo un microscopio con contraste de fases a 1000X y se tomaron fotografías de los especimenes representativos.
La identificación de las diatomeas se hizo con apoyo de literatura reciente (Hartley et al., 1996; Witkowski et al., 2000), así como de literatura para la región (Siqueiros–Beltrones, 2002a). Las actualizaciones nomenclaturales y taxonómicas se basaron en Round et al. (1990) y Fountanier y Kociolek (1999).
Análisis cuantitativo
Para determinar la abundancia de especies, se contaron 500 valvas por laminilla, de acuerdo con el método de Siqueiros–Beltrones (2002a). En algunas muestras las diatomeas fueron escasas por lo que en nueve el conteo no alcanzó las 500 valvas.
La medida de dominancia por especie se determinó mediante el índice de valor biológico (IVB) (Sanders, 1960), considerando aquellos taxa que representaron 85% de la abundancia total para una fecha (abril). El IVB se calculó con el paquete ANACOM (Sistema para el Análisis de las Comunidades) versión 3.0 (De La Cruz–Agüero, 1994).
Estructura de la asociación de diatomeas epifitas
Para el análisis de la estructura de la asociación de diatomeas se aplicaron índices ecológicos derivados de la teoría de la información: diversidad de especies y equidad (Brower y Zar, 1984). La diversidad se calculó utilizando la fórmula de Shannon (H'):

donde: Pi es la proporción de individuos encontrados en la iésima especie, calculado como  ; ni es la abundancia de la especie i en la muestra y N es el número total de individuos en la muestra (Magurran, 1988).
; ni es la abundancia de la especie i en la muestra y N es el número total de individuos en la muestra (Magurran, 1988).
A los valores calculados de H' se les aplicó la prueba de Kolmogorov–Smirnov para probar normalidad (a = 0.05); asimismo, se determinó la homoscedasticidad (Sokal y Rohlf, 1969) para cada uno de los factores mediante la prueba de Bartlett (a = 0.05).
Dado que las magnitudes de H' por mes fueron diferentes entre las cuatro frondas examinadas, no pudieron utilizarse como repeticiones. Por ello, se hizo un análisis de variación, anidando el factor fronda con el factor mes (a=0.05). Esto se basó en un análisis de varianza con los valores de H', considerando: posición de la lámina, fronda y mes. Finalmente se hicieron pruebas a posteriori de Tukey para determinar en dónde se presentaban las diferencias (Sokal y Rohlf, 1969). Las pruebas estadísticas se hicieron mediante el programa Statistica versión 6.0. Para estos cálculos, las láminas fueron consideradas repeticiones y se sumaron las abundancias de las cinco láminas por fronda, debido a que no se encontraron diferencias significativas en H' entre láminas de una misma fronda.
La equidad se calculó mediante el índice de Pielou (J ), como una medida de la homogeneidad de distribución de los individuos entre los taxa (Pielou, 1969):
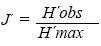
donde: H' max = log2 S, y Hobs = diversidad observada.
Las similitudes entre frondas recolectadas en un determinado mes, así como entre las distintas fechas, y entre láminas de una misma fronda, fueron calculadas con base en dos índices.
1.– El índice de Jaccard (presencia y ausencia de taxa) según la siguiente fórmula (Magurran, 1988):

donde: s1 y s2 = número de especies en los conjuntos 1 y 2, respectivamente; c = número de especies comunes a ambas muestras. CCj varía entre 1 (completa similitud) y 0 (sin elementos compartidos).
2.– El índice de Bray–Curtis que se considera como una medida de la diferencia entre las abundancias de cada especie presente (Brower y Zar, 1984), y se expresa mediante:

donde: xi = abundancia o densidad de especies i en un conjunto 1; yi = abundancia de las especies en el otro.
Las aplicaciones de ambos índices de similitud, se calcularon con base en algoritmos de unión simple. Se utilizó el programa BioDiversity Professional (1997).
RESULTADOS
Los resultados indican que existe una sola asociación de diatomeas epifitas, cuya composición específica es constante en tiempo y espacio. Asimismo, la estructura de la asociación se conserva en espacio, por lo que la primera hipótesis nula se acepta. Sin embargo, de un mes a otro se notan cambios en su estructura, dados por variaciones en las proporciones de las especies. Así se refuta la segunda hipótesis nula, ya que la estructura de la asociación de diatomeas epifitas de Macrocystis pyrifera varió temporalmente.
La asociación estuvo conformada por 171 taxa. Para cada mes de estudio se consideró como especie muy abundante aquella con >10 000 valvas, abundante >300 a <10 000, común >100 a <300, poco común >20 a <100 y rara <20. Aplicando tales criterios, la agrupación de diatomeas epifitas de M. pyrifera se caracterizó por incluir un taxon muy abundante, 15 abundantes, 19 comunes, 34 poco comunes y 91 raros.
De acuerdo con el IVB, 24 especies son las de mayor importancia numérica en la asociación (Cuadro 2), cada una de las primeras cinco tuvieron valores superiores a 5%: Rhoicosphenia genuflexa, Tabularia investiens, Gomphonemopsis pseudexigua, Navicula sp. 1 y Navicula pavillardii, las siguientes 19 contribuyeron con más de 1% del total. Las diatomeas que registraron una amplia distribución temporal y de probable residencia permanente sobre M. pyrifera fueron: R. genuflexa, T. investiens y G. pseudexigua. En todos los meses la especie más importante representó entre 17 y 18% de abundancia relativa (n = 500). R. genuflexa fue la prevaleciente en cinco meses, mientras que en febrero cocconeis costata var. pacifica, y en junio Gomphonemopsis pseudexigua fueron las más numerosas.

Aunque la riqueza total de especies fue alta, las magnitudes por muestra (lámina) fueron heterogéneas (mín. = 6 taxa, en febrero; máx. = 51, en abril). Así, la diversidad de la asociación de diatomeas epifitas de láminas de M. pyrifera en El Sauzal, B.C., mostró en general valores bajos, con variaciones de H' entre 0.3 y 3.8 (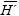 = 2.1). De manera correspondiente, la equidad (J') osciló entre 0.1 y 0.7 (
= 2.1). De manera correspondiente, la equidad (J') osciló entre 0.1 y 0.7 (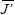 = 0.45).
= 0.45).
El análisis de varianza (anidado) aplicado a valores de H' detectó diferencias significativas entre las frondas de cada mes; mediante la prueba de Tukey se determinó que dichas discrepancias eran entre las frondas recolectadas en mayo, junio, julio, y agosto. Por otro lado, las frondas de febrero, marzo, y abril, no presentaron tales diferencias.
Cuatro de las frondas fueron estadísticamente distintas del resto (una de junio, una de agosto, una de abril y una de mayo), hecho aparentemente relacionado con la edad de las mismas (jóvenes en este caso). De éstas, la de junio registró el mayor porcentaje de dominancia en una sola fronda (93.4%) debido a la abundancia de Gomphonemopsis pseudexigua y presentó diferencias significativas en H' con casi todas las frondas de las otras fechas, excepto una de agosto y dos de febrero.
Variación mensual
La asociación de diatomeas epifitas (Fig. 3) presentó en febrero los valores más bajos de diversidad (H' de 1.1 a 1.8), equidad (J' de 0.36 a 0.52.), riqueza específica por fronda (Sf de 9 a 12), así como por mes (Sm de 39). En marzo, aunque los valores de H' se consideran medianos (2.6 a 3), la J' aumentó (0.50 a 0.62), al igual que la Sf (23 a 34) y la Sm (98). En abril, la H' varió entre 2.5 y 3.3, y estuvo entre la más alta calculada; la J' osciló entre 0.49 y 0.61, la Sf aumentó (35 a 43); y la Sm fue la más alta (114). Para mayo, la H' disminuyó (1.4 a 2.8) y se presentó la J' más baja (0.3), así como una Sf (24 a 34) Sm (85) menor. En junio, la H' bajó aún más (0.5 a 2.2), del mismo modo que la Sf (10), aunque la Sm se mantuvo igual que en mayo (85). En julio la H' (1.3 a 2.8) y J' (0.48 a 0.70) incrementaron, aunque siguieron siendo bajos; la Sf aumentó (23 a 40), al igual que la Sm (111). En agosto disminuyó la H' (1.1 a 2.4) y la J' (0.38 a 0.52), pero no la Sm (89), ni la Sf (23 a 30).

La riqueza específica fue alta por mes; sin embargo, por fronda se considera baja, debido a una menor equidad promedio (0.45) y una alta dominancia (IVB).
El hecho de que en algunos meses se mantuviera una riqueza específica muy similar, no implicó que la estructura de la asociación fuera la misma, ya que algunas especies, sobre todo las raras, se presentaron en unos meses y en otros no; incluso la dominante cambió; en las muestras de mayo (con 85 taxa) se presentó R. genuflexa como la especie prevaleciente, mientras que en junio (con 86 taxa) lo fue G. pseudexigua.
El análisis de varianza anidado detectó diferencias significativas en los valores de H' entre meses (a = 0.05). La prueba de Tukey indicó que tales discrepancias eran entre la mayoría de los meses, pero no entre los pares de febrero–junio, marzo–abril, mayo–julio–agosto, y agosto–mayo. Lo anterior indica la existencia de un reemplazamiento continuo de los taxa, sobre todo de especies raras y poco comunes; mientras que las abundantes tienen permanencia y abundancia temporales marcadas.
Similitud de Bray–Curtis por lámina de cada mes
La técnica de clasificación de Bray–Curtis generó siete dendrogramas, de los cuales sólo se muestran dos, ya que el comportamiento que se presentó fue generalizado. En febrero (línea de corte a 80% de similitud) se definió un solo grupo (Fig. 4), debido a una dominancia exclusiva de Cocconeis costata var. pacifica (66–89%) en la mayoría de las láminas, aunque en algunas Cocconeis speciosa fue codominante (57%).

En marzo, la definición de los grupos fue a menor nivel (corte a 70%); cuatro láminas no se acomodaron con la mayoría y dos de ellas formaron un conjunto aparte (Fig. 5). Rhoicosphenia genuflexa dominó en los grupos I y II; en las láminas restantes la diatomea más común fue Cocconeis costata var. pacifica, que fue menos abundante en los grupos I (2–11%), y II (18–38%).
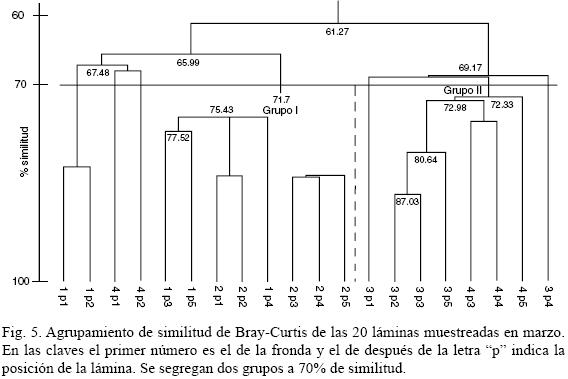
En abril (corte a 75%), se observó igualmente la formación de dos grupos; aunque R. genuflexa dominó en todas las láminas y la separación se debió principalmente a diferencias en la abundancia de Navicula pavillardii.
En mayo (corte a 80%), se definió un grupo en el que R. genuflexa dominó en todas las láminas con 51–87%, excepto en una aislada, en donde Diploneis subcincta (17%) presentó el porcentaje mayor.
En junio (corte a 75%) se reconocieron también dos grupos. En el I, R. genuflexa fue dominante (46–70%) pero en el II su importancia disminuye a <1%, y Gomphonemopsis. pseudexigua, que en el conjunto I registra valores entre 7 y 37%, en el II prevalece con 59–97%.
En julio (corte a 80%) hubo un solo grupo. Nuevamente, R. genuflexa fue la más común en casi todas las láminas.
En agosto (corte a 80%), se aprecia un grupo; R. genuflexa fue la especie dominante (54–86%). En láminas aisladas su abundancia disminuye y prevalece G. pseudexigua.
Mediante la técnica de Bray–Curtis, en marzo, abril y junio se observó la existencia de conjuntos discrepantes en láminas de una misma fronda, y a pesar de que presentaron altos porcentajes de similitud (72.3, 82 y 93.7%, respectivamente), hubo divergencias en algunas frondas recolectadas por mes. En síntesis, los agrupamientos responden básicamente a la abundancia de R. genuflexa a lo largo del periodo y la codominancia de otros taxa en los distintos meses.
Similitud de Jaccard por lámina de cada mes
Este análisis no produjo agrupamientos en ningún mes, con líneas de corte similares a las aplicadas con la técnica de clasificación de Bray–Curtis. Ello se debió a la presencia de muchas especies raras y poco comunes, heterogéneamente distribuidas, hecho que indicó similitud entre láminas de diferente posición. Lo anterior, aunado al resultado obtenido mediante el coeficiente de Bray–Curtis, sugiere la existencia de una sola asociación de diatomeas (por lo menos en los 2.5 m apicales de las frondas), lo que es congruente con los valores calculados para los parámetros de la estructura (H' y J ).
Similitud de la asociación entre frondas de diferentes meses
En el análisis sumario de las frondas de todos los meses, mediante la técnica de clasificación de Bray–Curtis, a nivel de corte de 75% se apreció la existencia de dos conjuntos principales: I) el constituido por las muestras de febrero, y II) el formado por la mayoría de las frondas restantes, aunque nueve de estas últimas quedaron aisladas (Fig. 6). La separación del grupo I, fue causada principalmente por la dominancia de C. costata var.pacifica (26–89%), que en otros meses fue poco común. En el grupo II, R. genuflexa fue el taxon determinante. La técnica de Jaccard no generó grupos, al mismo nivel de corte. De acuerdo con lo anterior, interpretamos que se trata de una misma asociación en todas las frondas muestreadas durante todo el período de muestreo, excepto febrero (Fig. 6). Lo que sugiere que, durante la época fría (febrero), cuando se presentan ciertas condiciones ambientales (vientos, nubosidad, corrientes), éstas propician el desarrollo de una asociación diferente.

Similitud entre meses
Para medir la similitud (Bray Curtis) entre meses, se hizo la comparación a partir de la suma de las abundancias de cada taxon agrupando todas las frondas de cada mes. Así, fijando la línea de corte a 67%, se definieron tres conjuntos (Fig. 7). El grupo I integrado por febrero, y el III por junio; mientras que el II incluyó al resto de los meses. La separación de febrero como grupo se debe nuevamente a que C. costata var. pacifica dominó con un 58.7%, mientras que en el resto de los meses el máximo porcentaje alcanzado fue 13.5% (marzo).
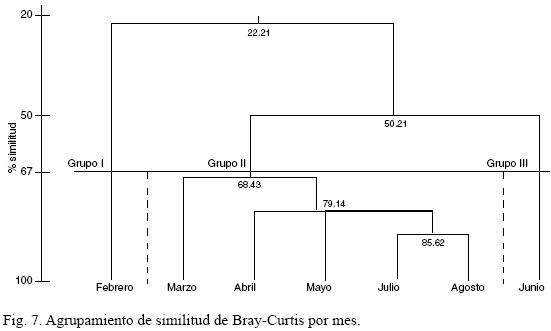
Para el conjunto II, la especie dominante fue Rhoicosphenia genuflexa, con porcentajes de abundancia de 40.7 a 66.7. En el grupo III (junio), R. genuflexa disminuyó su valor a 25.1%, mientras que Gomphonemopsispseudexigua presentó porcentajes de abundancia hasta de 55.4, y en el resto de los meses alcanzó 11.7% de abundancia máxima. Con base en esto, se puede afirmar que la segregación de los tres grupos responde a la alternancia de los taxa dominantes.
En la clasificación obtenida utilizando presencia–ausencia de especies y tomando el mismo nivel de corte (67%) que en el procedimiento anterior, no se generaron grupos (Fig. 8). Sin embargo, dado que los niveles de afinidad de Jaccard fueron generalmente menores, se puede rescatar que, a un nivel aceptable de similitud (60%), febrero queda segregado del resto de los meses.
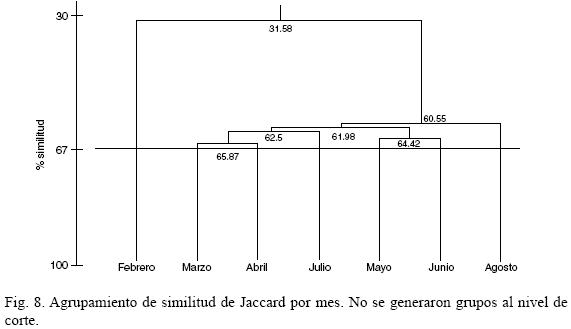
La ausencia de grupos evidenciada mediante la técnica de Jaccard indica principalmente que las especies raras están variando mes con mes. de manera diferente, con la clasificación de Bray–Curtis se segregan como distintos febrero y junio. Lo anterior sugiere que la florística de la asociación es similar en todo el lapso estudiado, sin embargo se presentan cambios en la estructura a nivel de las proporciones de los taxa. Si bien, Cocconeis costata var. pacifica se registró en todos los meses, sólo fue dominante en febrero, al igual que lo fue en junio Gomphonemopsis pseudexigua.
DISCUSIÓN
La riqueza de especies de diatomeas sobre Macrocystis pyrifera (S = 171) se considera elevada por tratarse de un solo tipo de sustrato, ya que aunque en otro estudio de diatomeas epifitas sobre algas de la región se registraron 236 taxa, dicho inventario incluyó ocho especies de macroalgas (Siqueiros–Beltrones y Valenzuela–Romero, 2004).
En general, se evidencia que la Bahía de Todos Santos resguarda una gran cantidad de especies de diatomeas bentónicas que se distribuyen diferencialmente de acuerdo con el tipo de hábitat y en esta ocasión se pudieron sumar 137 taxa a los ya identificados para la bahía en cubetas de cultivo de abulón (Siqueiros–Beltrones, 2002b); otros 41 taxa coinciden en ambos estudios. Asimismo, cabe considerar un elevado registro previo de 253 taxa en sedimentos de esta zona (Siqueiros Beltrones et al., 1991).
Comparando con otros sustratos, como las raíces de Rhizophora mangle L. en Bahía Magdalena, B. C. S., la riqueza en M. pyrifera es cercana a la registrada (174 taxa) por Siqueiros–Beltrones et al. (2005) y mayor (86) que la de López–Fuerte y Siqueiros–Beltrones (2006). Sin embargo, resulta menor que la encontrada en hojas de Zostera marina L. (235 taxa), en San Quintín, B. C. (Siqueiros–Beltrones et al., 1985), y en las costas de Francia (191) (Jacobs y Noten, 1980). Empero, los pastos marinos se encuentran en contacto más cercano con los sedimentos, por lo que se adicionan especies epipélicas a las epifitas de Z. marina, pues estas a menudo se posan en el sustrato.
Aunque resulta menos evidente, la asociación de diatomeas en láminas apicales de M. pyrifera, también está sujeta a contaminación por diatomeas de los sedimentos (epipélicas), así como de la columna de agua (planctónicas), que bien pueden quedar atrapadas en las láminas y sobrevivir, e inclusive proliferar. Así, M. pyrifera se considera un sustrato que puede ser aprovechado por un gran número de especies, ya que ofrece amplia área de fijación sin ser necesariamente un sustrato específico. De este modo, M. pyrifera representa un hábitat favorable para el desarrollo de diatomeas, lo cual se refleja en la alta riqueza observada. La supuesta actividad anticolonizante de los taninos de M. pyrifera posiblemente resulta mitigada por especies resistentes como cocconeis costata var. pacifica, la cual reviste totalmente la superficie de las láminas y sobre la cubierta que forma se adhieren muchos organismos, tales como agrupaciones tubulares de Navicula sp., mismas que a su vez sirven de sustrato a colonias de climacosphenia moniligera (Siqueiros–Beltrones et al., 2002).
Es conducente hipotetizar que la elevada riqueza observada responde también a la heterogeneidad de los microhábitats que resultan, tanto de las características propias de las láminas, como de los cambios debidos a la colonización y los procesos sucesionales subsecuentes. Éstos explicarían las diferencias observadas en la asociación de láminas viejas, las cuales son similares a los cambios sucesionales observados por Siqueiros–Beltrones (2002b). Asimismo, explican por qué taxa a menudo identificados como dominantes (Rhoicosphenia genuflexa, Gomphonemopsis pseudexigua, Tabularia investiens y cocconeis costata var. pacifica) llegan a ser catalogados como raros. Lo anterior denota una complejidad de los procesos de colonización y sucesión en este sustrato vivo, en escalas de tiempo pequeñas, más que una variación estacional (Anderson, 1995) de las asociaciones de microorganismos.
Aunque en este estudio no fue posible apreciar tales escalas, el análisis mensual proporcionó información sobre las etapas maduras (clímax), las cuales se manifestaron en cada uno de los meses. Así, al medir la madurez de sucesión con base en los patrones generales descritos para diatomeas bentónicas, i.e., mediante el incremento en la estructura vertical de la asociación (Hudon y Bourget, 1981; Korte y Blinn, 1983), las formas erectas que resultan muy abundantes, tales como R. genuflexa, T. investiens y G. pseudexigua, pueden tomarse como indicadores de fases clímax en las láminas de M. pyrifera. No obstante, este patrón puede alterarse, como se ha visto en asociaciones de diatomeas epilíticas, en donde ocurren cambios de poblaciones de pinnularia, Nitzschia y Licmophora (erectas), hacia poblaciones características de especies postradas como las de los géneros: cocconeis, Achnanthes y Navicula (MacLulich, 1986).
Por otra parte, las variaciones observadas también están sujetas a factores que podrían actuar a mesoescala, debido a diferencias de ubicación latitudinal. Así, la asociación de diatomeas epifitas en láminas apicales de M. pyrifera de la zona de El Sauzal, es distinta de las de la zona de Punta Eugenia y Bahía Tortugas, B.C.S., y de Eréndira, B.C. examinadas por Siqueiros–Beltrones et al. (2002). Lo anterior se atribuye principalmente a variaciones en la abundancia de cocconeis costata var. pacifica, la cual fue dominante de mayo a noviembre en otros sitios (Siqueiros–Beltrones et al., 2002), pero en El Sauzal sólo en febrero. Asimismo, agrupaciones de climacosphenia moniligera asociadas a colonias tubulares de Navicula sp. y registradas ambas como abundantes (Siqueiros–Beltrones et al., 2002), no figuraron en El Sauzal.
Las láminas examinadas de Macrocystis pyrifera forman parte del dosel del manto; ello sugiere que en general, todas se hallaban en condiciones físicas y químicas similares, incluyendo la irradiancia, cuya intensidad favorece la biomasa total y la diversidad de las diatomeas epibentónicas (Hudon y Bourget, 1983). Por ello, las variaciones observadas en la estructura de la asociación de diatomeas epifitas de M. pyrifera podrían reflejar cambios temporales en las condiciones ambientales. Sin embargo, de acuerdo con lo anterior, la complejidad de las variaciones exhibidas por la asociación de diatomeas epifitas en un sustrato como M. pyrifera, rebasa la resolución de las observaciones hechas hasta ahora.
La estructura de la asociación estudiada sobre M. pyrifera en El Sauzal coincide con el patrón general de las comunidades de diatomeas bentónicas (Siqueiros Beltrones, 2002a); esto es, pocas especies abundantes y muchas raras o poco comunes. Los valores de diversidad (H' ) fueron bajos y similares a los calculados para asociaciones de diatomeas de habitats extremosos de pozas hipersalinas; en dichos ambientes se han registrado entre 45 y 67 taxa y pocas especies por muestra, lo que sugiere condiciones severas que favorecen a pocos taxa (Siqueiros–Beltrones, 1988; 1990). No obstante, en ambos casos la comunidad es estable y en equilibrio con las condiciones ambientales existentes y puede estar indicando etapas finales de una sucesión ecológica.
La heterogeneidad en los posibles microambientes podría ser la causa de las diferencias en la estructura de la asociación de diatomeas epifitas en frondas de un mismo mes, o en láminas de una misma fronda; v. gr., talos con varias frondas propician efectos de auto–sombreado y la exposición a diferentes patrones de irradiancia; los que llegan a determinar la estructuración de asociaciones de diatomeas epifitas (Main y McIntire, 1974). En este respecto también debe tomarse en cuenta la edad de las láminas, ya que en el mismo tiempo y espacio pueden encontrarse frondas maduras, senescentes y jóvenes; tal variación puede observarse incluso en la misma fronda, lo cual implica diferencias morfológicas, químicas, fisiológicas y ecológicas (Van–Alstyne et al., 2001).
Asimismo, debe considerarse la capacidad de las diatomeas de colonizar rápidamente un sustrato, ya que en algunas láminas de M. pyrifera aparentemente jóvenes había abundantes valvas, incluyendo formas erectas características de etapas maduras. Es factible que la colonización en las láminas jóvenes se diera a partir de las proliferaciones en láminas maduras, que en un proceso degenerativo se desprenden en forma de grumos (Siqueiros–Beltrones, 2002b) y a su vez podrían llegar a láminas jóvenes. De esta manera, la iniciación de dichas colonizaciones dependerá de los taxa que son exportados, los que proliferan saltándose las primeras etapas sucesionales en sustitución de las especies pioneras.
CONCLUSIONES
Las diatomeas epifitas de M. pyrifera del sitio de estudio conforman una sola asociación distribuida heterogéneamente en el manto examinado. Dicha asociación exhibe variaciones estacionales, así como cambios menores entre frondas de cada fecha, mismos que se atribuyen a la definición de microhábitats por efecto de auto–sombreado, edad del talo, y al oportunismo de las diatomeas. En consecuencia, la complejidad de las variaciones en dichas asociaciones rebasa la resolución de las observaciones hechas en este trabajo. Sin embargo, sobre la base de la poca información existente, incluyendo este estudio, se sugiere que en los mantos de M. pyrifera distribuidos a lo largo de la península de Baja California se definen asociaciones distintas de diatomeas epifitas.
Por otra parte, la estructura de la asociación de diatomeas en láminas jóvenes es definida por las mismas especies que son importantes en las láminas maduras. Tal ausencia de las etapas iniciales de sucesión sugiere que la colonización se da por diatomeas exportadas desde las láminas maduras adyacentes, por lo que las especies pioneras son escasas.
AGRADECIMIENTOS
Se recibió apoyo parcial a través de los proyectos SIQBD5288/ 40778 (Consejo Nacional de Ciencia y Tecnología) y CGPI–20030211 y CGPI–20040024 (Instituto Politécnico Nacional). Damos gracias al grupo de trabajo de la Dra. Pilar Sánchez Saavedra por su apoyo en los muestreos y a Armando Pacheco Ayub, del Centro de Investigaciones del Noroeste, quién proporcionó los datos de temperatura. Asimismo, agradecemos la meticulosa revisión editorial y de dos árbitros anónimos a nuestro manuscrito.
LITERATURA CITADA
Anderson, M. J. 1995. Variation in biofilms colonizing artificial surfaces: seasonal effects and effects of grazers. J. Mar. Biol. Ass. U.K. 95: 705–714. [ Links ]
BioDiversity Professional (1997). The Natural History Museum and The Scottish Association for Marine Science (http://www.nrmc.demon.co.uk). [ Links ]
Bonfil, R. y A. Carvacho. 1989. Los cangrejos de la Bahía de Todos Santos, Baja California. Parte I. Dromiidae, Leucosiidae, Majidae y Parthenopidae (Crustacea: Decapoda: Brachyura). Ciencias Marinas 15(2): 79–109. [ Links ]
Brower, J. E. y J. H. Zar. 1984. Field and laboratory methods for general ecology. Wm. C. Brown Co. Dubuque, Iowa. 226 pp. [ Links ]
Cruz–Colín, M. E. y L. A. Cupul–Magaña. 1997. Erosión y aporte sedimentario de los cantiles marinos de la Bahía de Todos Santos, Baja California, en el periodo de 1970 a 1991. Ciencias Marinas 23(3): 303–315. [ Links ]
De La Cruz–Agüero, G. 1994. Sistema de análisis de comunidades. Versión 3.0. Departamento de Pesquerías y Biología Marina. Centro Interdisciplinario de Ciencias Marinas, Instituto Politécnico Nacional. La Paz, B.C.S. 99 pp. [ Links ]
Foster, S. M. y D. R. Schiel. 1985. The ecology of giant kelp forests in California: a community profile. Technical report. San Jose State Univ., Moss Landing, CA. 169 pp. [ Links ]
Fountanier, E. y J. P. Kociolek. 1999. Catalogue of the diatom genera. Diatom Research 14(1): 1–190. [ Links ]
Guzmán del Próo, S., S. De la Campa de Guzmán y J. L. Granados–Gallegos. 1971. El sargazo gigante (Macrocystis pyrifera) y su explotación en Baja California. Rev. Soc. Mex. Hist. Nat. 32(12): 15–57. [ Links ]
Hartley, B., H. G. Barber y J. R. Carter. 1996. An atlas of British diatoms. (P. A. Sims, Ed.) Biopress Ltd. Bristol. 601 pp. [ Links ]
Hudon, C. y E. Bourget. 1981. Initial colonization of artificial substrate: community development and structure studies by scanning electron microscopy. Can. Jour. Fish. Aquat. Sci. 38: 1371–1384. [ Links ]
Hudon, C. y E. Bourget. 1983. The effect of light on the vertical structure of epibenthic diatom communities. Botanica Marina 24: 317–330. [ Links ]
Jacobs, R. P. W. N. y T. M. P. A. Noten. 1980. The annual patterns of the diatoms in the epiphyton of eelgrass (Zostera marina) at Roscoff, France. Aquat. Bot. 8: 355–370. [ Links ]
Jiménez–Pérez, L. C. 1989. Variación temporal del zooplancton de la Bahía de Todos Santos, Baja California, México. Ciencias Marinas 53(3): 81–96. [ Links ]
Kita, T. y E. Harada. 1962. Studies on the epiphytic communities. 1. Abundance and distribution of microalgae and small animals on the Zostera marina blades. Publ. Seto Mar. Biol. Lab. 10(2): 245–257. [ Links ]
Korte, V. L. y D. W. Blinn. 1983. Diatom colonization on artificial substrata in pool and riffle zones studied by light and scanning electron microscopy. J. Phycol. 19: 332–341. [ Links ]
Ladah, L. B., J. A. Zertuche–González y G. Hernández–Carmona. 1999. Giant kelp (Macrocystis pyrifera, Phaeophyceae) recruitment near its southern limit in Baja California alters mass disappearance during ENSO 1997–1998. J. Phycol. 35: 1106-1112. [ Links ]
Lluch–Cota, S. E., C. A. Pacheco–Ayub, J. J. Bautista–Romero, S. Hernández–Vázquez y D. B. Lluch–Cota. 2000. Colección de información ambiental para el Pacífico mexicano CD–ROM. Centro de Investigaciones Biológicas del Noroeste – Consejo Nacional de Ciencia y Tecnología. [ Links ]
López–Fuerte, F. O. y D. A. Siqueiros–Beltrones. 2006. Distribución y estructura de asociaciones de diatomeas en sedimentos de un sistema de manglar. Hidrobiológica 16(1): 23–33. [ Links ]
MacLulich, J. H. 1986. Colonization of bare rock surfaces by microflora in a rocky intertidal habitat. Mar. Ecol. Progr. Ser. 32: 91–96. [ Links ]
Magurran, A. E. 1988. Ecological diversity and its measurement. Princenton Univ. Londres. 179 pp. [ Links ]
Main, S. y C. D. McIntire. 1974. The distribution of epiphytic diatoms in Yaquina Estuary, Oregon (U.S.A.). Botanica Marina 17(2): 88–89. [ Links ]
McIntire, C. D. y W. W. Moore. 1977. Marine littoral diatoms: ecological considerations. pp 33–371. In: Werner, D. (ed.). The biology of diatoms. Botanical Monographs. University of California Press. Berkeley. 498 pp. [ Links ]
McIntire, C. D. y W. S. Overton. 1971. Distributional patterns in assemblages of attached diatoms from Yaquina Estuary, Oregon. Ecology 52: 758–777. [ Links ]
Morales–Zúñiga, C. 1977. Variaciones estacionales de la temperatura en la Bahía de Todos Santos, B.C. Ciencias Marinas 4(1): 23 – 33. [ Links ]
Pielou, E. C. 1969. An introduction to mathematical ecology. Wiley Interscience. Nueva York. 286 pp. [ Links ]
Round, F. E., R. M. Crawford y D. G. Mann. 1990. The diatoms. Biology and morphology of the genera. Cambridge University Press. Cambridge. 747 pp. [ Links ]
Sanders, H. L. 1960. Benthic studies in Buzzard Bay III. The structure of the soft–bottom community. Limnol. Oceanogr. 5: 138–153. [ Links ]
Sieburth, J. M. y C. Thomas. 1973. Fouling on eelgrass (Zostera marina). J. Phycol. 24: 132–140. [ Links ]
Siqueiros–Beltrones, D. A. 1988. Diatomeas bentónicas de la Laguna Figueroa, Baja California. Ciencias Marinas 14(2): 85–112. [ Links ]
Siqueiros–Beltrones, D. A. 1990. Estructura de las asociaciones de diatomeas bentónicas en un ambiente hipersalino. Ciencias Marinas 16(1): 101–127. [ Links ]
Siqueiros–Beltrones, D. A. 2002a. Diatomeas bentónicas de la península de Baja California; diversidad y potencial ecológico. Secretaría de Educación Pública–Universidad Autónoma de Baja California Sur–Centro Interdisciplinario de Ciencias Marinas, Instituto Politécnico Nacional. La Paz, B.C.S. 102 pp. [ Links ]
Siqueiros–Beltrones, D. A. 2002b. Succession of benthic diatom assemblages in culture buckets for abalone (Haliotis spp.) post–larvae. In: John, J. (Ed.). Proceedings of the 15th International Diatom Symposium. Perth, W. Australia (28 Sep.–2 Oct., 1998). pp. 421–441. [ Links ]
Siqueiros–Beltrones, D. A., S. E. Ibarra–Obando y D. H. Loya–Salina. 1985. Una aproximación a la estructura florística de las diatomeas epifitas de Zostera marina y sus variaciones temporales en Bahía Falsa, San Quintín, B.C. Ciencias Marinas 11(3): 69–88. [ Links ]
Siqueiros–Beltrones, D. A., S. E. Ibarra–Obando y M. Poumián–Tapia. 1991. Composición y estructura de las asociaciones de diatomeas bentónicas del estero de Punta Banda en otoño de 1983–1986. Ciencias Marinas 17(1): 119–138. [ Links ]
Siqueiros–Beltrones, D. A. y D. Voltolina. 2000. Grazing selectivity of red abalone Haliotis rufescens postlarvae on benthic diatom films under culture conditions. World Aquaculture 31(2): 239–246. [ Links ]
Siqueiros–Beltrones, D. A., E. Serviere–Zaragoza y U. Argumedo–Hernández. 2001. First record of the diatom Cocconeis notata Petit living inside the hydroteca of a hydrozoan epiphyte of Macrocystis pyrifera (L.) C. Ag. Oceánides 16(2): 135–138. [ Links ]
Siqueiros–Beltrones, D. A., E. Serviere–Zaragoza y U. Argumedo–Hernández. 2002. Epiphytic diatoms of Macrocystis pyrifera (L.) C. AG. from the Baja California Península, México. Oceánides 17(1): 31–39. [ Links ]
Siqueiros–Beltrones, D. A. y G. Valenzuela–Romero. 2004. Benthic diatoms assemblages in an abalone (Haliotis spp.) habitat in the Baja California peninsula. Pacific Science 58(3): 435–446. [ Links ]
Siqueiros–Beltrones, D. A., F. O. López–Fuerte e I. Gárate–Lizárraga. 2005. Structure of diatom assemblages living on prop roots of the red mangrove Rhizophora mangle L. from the West Coast of Baja California Sur, México. Pacific Science 59(1): 79–96. [ Links ]
Sokal, R. R. y F. J. Rohlf. 1969. Biometría. Principios y métodos estadísticos en la investigación biológica. H. Blume Ediciones. Madrid. 832 pp. [ Links ]
Van–Alstyne, K. L., S. L. Whitman y J. M. Ehlig. 2001. Differences in herbivore preferences, phlorotannin production, and nutritional quality between juvenile and adult tissues from marine brown algae. Marine Biology 139: 201–210. [ Links ]
Witkowski, A., H. Lange–Bertalot y D. Metzeltin. 2000. Diatom flora of marine coasts. In: Lange–Bertalot, H. (ed.). Iconographia Diatomologica, Vol. 7. Koeltz Scientific Books. Königstein. 925 pp. [ Links ]
* Becario del Programa Estímulo al Desempeño de los Investigadores (EDI) y Comisión de Fomento de Actividades Académicas (COFAA) del Instituto Politécnico Nacional (IPN).














