Introducción
Los hidrocarburos aromáticos policíclicos (HAPs) son compuestos orgánicos producidos por la combustión incompleta de fuentes naturales, erupciones volcánicas o incendios forestales y de fuentes antropogénicas (humo de fuegos domésticos de leña y carbón, hollín y humo industrial, incineradores, escapes de los automóviles, cigarrillos, etc.) (Abdel-Shafy y Mansour, 2016). A los HAPs se les puede encontrar en agua potable, cosméticos, aditivos alimentarios y en emisiones industriales tales como CO2, CO, NOx, compuestos orgánicos volátiles, y partículas emitidas por la industria metalúrgica, la construcción, la minería y otras industrias que generan polvo y partículas en suspensión (Adekunle, Oyekunle, Ola, Obisesan y Maxakato, 2018; Mojiri, Zhou, Ohashi, Ozaki y Kindaichi, 2019). Dentro de los efectos conocidos de los HAPs, se destaca su capacidad carcinogénica, mutagénica y teratogénica (EMA, 2016), así como disruptores endocrinos (DE) que impactan en la regulación de los procesos vitales, incluido el desarrollo, el crecimiento, el metabolismo y la reproducción de los seres vivos (Pulster et al., 2020; Roldán-Wong, Kidd, Ceballos, Rivera y Arellano, 2020). Los HAPs pueden ser de bajo peso molecular (LMW-PAH), que consisten en dos o tres anillos aromáticos fusionados, como naftaleno, fenantreno, antraceno y fluoreno, y de alto peso molecular (HMW-PAH), que consisten en cuatro o más anillos como fluoranteno, pireno, benzo(a)antraceno y benzo(a)pireno (BaP) (Stogiannidis y Laane 2015; Abdel-Shafy y Mansour, 2016).
El BaP es el compuesto más tóxico y mejor caracterizado de la familia de los HAPs (Defois et al., 2017). Según la Agencia Internacional de Investigación en Cáncer (IARC por sus siglas en inglés), el BaP se encuentra dentro del grupo 1 de los principales carcinógenos en humanos (incluso a bajas concentraciones), mostrando tener un gran potencial tumoral en modelos experimentales in vivo (IARC, 2012; Pogribny, 2018). Este compuesto se encuentra presente en numerosos productos utilizados cotidianamente entre los que destacan el humo de cigarrillo, los cosméticos y productos de higiene personal (Adekunle et al., 2018; Choodum et al., 2021), así como en alimentos fritos, asados a la parrilla o ahumados sometidos a altas temperaturas (Abdel-Shafy y Mansour, 2016). El BaP se ha encontrado en muestras ambientales (aire, agua, suelo, sedimentos), productos alimentarios agrícolas, mariscos (plancton, ostras y algunos peces) y puede acumularse gradualmente en el ambiente y en seres vivos expuestos (Chen et al., 2012; Chen, Diao y Zhou, 2018; Gwak et al., 2022). Debido a su estructura química y alto peso molecular, el BaP es altamente resistente a la biodegradación. Se han propuesto varias prácticas para tratar y eliminar el BaP, incluyendo la biorremediación microbiana, la fitorremediación y la micorremediación, que implican el uso de microorganismos, plantas o una combinación de ambos. Estas prácticas utilizan diferentes procesos metabólicos para eliminar el BaP, lo que conduce a cambios en su estructura y propiedades tóxicas. Como resultado, se obtienen compuestos inorgánicos inocuos (Gianfreda, Rao, Scelza y de la Luz Mora, 2016). Por consiguiente, los residuos de BaP en compartimentos ambientales se acumulan y biomagnifican en la cadena alimentaria, se calcula que el consumo medio diario de BaP a través de los alimentos oscila entre unos pocos nanogramos y microgramos, dependiendo las fuentes (Sahin, Ulusoy, Alemdar, Erdogan y Agaoglu, 2020).
La presente es una revisión descriptiva exhaustiva de artículos científicos sobre el BaP desde una perspectiva ecotoxicológica destacando las principales fuentes de exposición, los sitios donde ha sido detectado y los efectos en la salud de los seres vivos y en los ecosistemas, así como también las implementaciones biotecnológicas para la biorremediación de los ecosistemas contaminados con este hidrocarburo policíclico aromático.
Desarrollo del Tema
Dispersión y transporte del BaP
La estructura del benzo(a)pireno, también llamado 3,4-benzopireno está compuesta por cinco anillos benceno fusionados (Figura 1). Es un compuesto volátil y soluble con sustancias orgánicas lipofílicas, y por ello, puede difundirse y transportarse a través de las membranas celulares, convirtiéndose en un contaminante ubicuo en los ecosistemas (Nzila y Musa, 2021).
Figura 1: Estructura tridimensional del benzo(a)pireno. Elaborado con el software KingDraw 3.0.20 (Qingyuan Co, 2021).
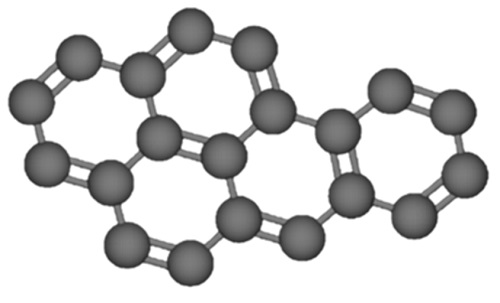
Figure 1: The three-dimensional structure of benzo(a)pyrene. Created with KingDraw 3.0.20 (Qingyuan Co, 2021).
La dispersión de este compuesto ocurre a través del aire, agua, suelo, sedimentos y aguas residuales, encontrándose en algunos organismos como ostras, peces y mamíferos, siendo los suelos superficiales donde usualmente se deposita por deposición atmosférica o por escorrentía urbana. (Gaspare, Machiwa, Mdachi, Streck y Brack, 2009; Corrales, Thornton, White y Willett, 2014; Peña-Guzmán et al., 2019; Martins et al., 2020; Coffin, Magnuson, Vliet, Volz y Schlenk, 2020). La presencia BaP en los últimos tiempos es más común que nunca, debido a las actividades humanas y a la creciente industrialización en todo el mundo, que generan la mayor parte de las emisiones de BaP y, en menor medida, naturales, incluidos los incendios forestales y las erupciones volcánicas (Saravanakumar et al., 2022).
Presencia del BaP en el medio ambiente
Este contaminante puede ser absorbido mediante inhalación, ingesta o absorción cutánea, vías que favorecen su paso a través de la placenta (Kelman y Springer, 1982; PHE, 2018; Xue, Liu, Tian, y Feng, 2023).
Debido a sus características lipofílicas, este compuesto puede acumularse en el cuerpo de los seres vivos, comprometiendo la salud de los organismos (EPA, 2017). Las actividades antropogénicas han ido en aumento desde 1950 (United Nations, 2021), concordando estrechamente con el incremento de las concentraciones de contaminantes en el ambiente. El incremento de BaP está registrado a partir de la segunda mitad del siglo veinte, coincidiendo con el aumento de la tendencia del uso de productos de cuidado personal (Vecchiato et al., 2020).
A causa de su alta hidrofobicidad, el BaP se encuentra en grandes concentraciones en los sedimentos acuáticos y en el suelo, pero en bajas concentraciones en las aguas superficiales (Ortiz-Salinas, Cram y Sommer, 2012). Las cantidades de BaP en el aire exterior superan con frecuencia las normas permitidas. La inhalación de concentraciones extremadamente elevadas de BaP en el aire interior supone un importante peligro para la salud de los escolares y los niños de guardería, así como para los trabajadores de las fábricas de aluminio y las instalaciones de coquería (Zubizarreta-Sola, Martínez, Rivas, Gómez y Sanz, 2018; Bukowska, Mokra y Michałowicz, 2022; Xue et al., 2023).
Se ha detectado BaP en el hielo del glaciar del monte Elbrús, el pico más alto de Rusia y Europa (5642 m de altitud), mostrando un incremento de 1-1.5 a 4 ng L-1 entre los años 1990 y 2005 (Vecchiato, et al., 2020). De igual forma, el monitoreo en el aire ártico de las concentraciones del BaP entre 1992 a 2015 indican que no disminuyeron, a pesar de las reducciones de las emisiones globales de HAPs (Yu et al., 2019). Por otro lado, Adekunle et al. (2018), demuestran que BaP fue el cuarto compuesto tóxico presente en productos plásticos como platos desechables, barriles, tapas de lapiceros y tazones, detectando una concentración que osciló entre 407.1 µg L-1 y 679.39 µg L-1. En cuanto a los productos de cuidado personal, el BaP fue el tercer compuesto con potencial tóxico presente en brillo de labios, tintes, pinturas, gel de cabello, limpiadores faciales y cremas para peinar, hallándose concentraciones que van de 0.003 μg g-1 a 5306.20 μg g-1, siendo las pinturas, con 5306.20 μg, el producto con mayor concentración de BaP (Adekunle et al., 2018). Es importante mencionar que, de acuerdo a los autores, el brillo de labios fue el producto con mayor concentración de HAPs, conteniendo 15 834.20 μg g-1, siendo el quireno, benzopireno y pireno los que destacan con las mayores concentraciones.
En México los reportes disponibles sobre el BaP son limitados, sin embargo, existen algunos registros donde se señala que la concentración de este contaminante ha fluctuado durante el transcurso de los años. En la Ciudad de México se detectó una disminución de BaP en el aire del 40% (0.416 ng m-3-0.130 ng m-3), mostrando una tendencia similar a la registrada en el periodo 2006-2007 (0.451 ng m-3-0.286 ng m-3) (Amador-Muñoz, Martínez, Gómez y Peralta, 2020), y si bien esto representa un buen porcentaje de reducción, la concentración de BaP supera el límite permitido de acuerdo a la OMS (0.12 ng m-3), (WHO, 2006).
Efectos del BaP sobre la salud humana y otros seres vivos
Diversas investigaciones han demostrado el efecto que tiene BaP en mamíferos, a nivel reproductivo, en el desarrollo embrionario y como disruptor endócrino (DE), así como el papel que podría jugar como factor desencadenante de alergia asmática y rinitis alérgica (Miller, 2013; Reddy, Girish y Reddy, 2015; Sheweita, Al-Shora y Hassan, 2016; Wang et al., 2019; Jorge et al., 2021; Maio et al., 2022). De igual forma, distintos autores han reportado el efecto que tiene en anfibios, aves, invertebrados acuáticos y plantas. Choi, Dostal, Pastorkova, Rossner y Sram (2021) llevaron a cabo un estudio de campo en infantes de 5 años oriundos de Ostrava, República Checa, ciudad históricamente industrial y con alto nivel de actividad minera de carbón tomando como control a niños originarios de la región Bohemia Meridional, considerada una zona menos industrializada. Los resultados de la investigación muestran que la exposición en la infancia al BaP ambiental se asocia significativamente con el asma diagnosticado clínicamente en los niños, siendo más predominante en infantes con fenotipo obeso. En niños con asma no atópica, los casos se asocian con una mediana de BaP significativamente más alta (11.16 ng L-1) en comparación con la de los controles no atópicos (3.83 ng L-1). Dentro de los ensayos llevados a cabo en células de origen animal, se encuentra el realizado por Caiment, Gaj, Claessen y Kleinjans (2015) donde evaluaron la capacidad carcinogénica del BaP en hepatocitos, postulando que dada la continua exposición a BaP en el medio ambiente, en presencia conjunta de agentes alquilantes como las nitrosaminas, la tasa de mutación en el ADN aumentaría, conduciendo en última instancia al desarrollo de cáncer. Staal et al. (2007) observaron de igual forma que en células del hígado el BaP forma aductos de ADN, lo cual supone el inicio de la carcinogénesis. Adicional a ello, se sabe que la exposición a BaP puede resultar en la generación de especies reactivas de oxígeno (EROs) de manera exacerbada, provocando efectos tóxicos celulares generando otras enfermedades metabólicas e inmunológicas (Cui, Chen, Chen, Peng y Wang, 2019).
En China se evaluó la presencia de BaP en diferentes alimentos, detectándose principalmente en carne de cerdo (195.30 ng g-1), siendo la leche la que menor contenía (8.73 ng g-1). Los valores promedio de las dosis de exposición diaria equivalentes de BaP para niños, adolescentes, adultos y adultos mayores de sexo masculino se estimaron en 392.42, 511.01, 571.56 y 532.56 ng d-1, respectivamente, mientras que las mujeres eran 355.16, 440.51, 487.64 y 444.85 ng d-1, respectivamente. Lo que indica un riesgo potencial alto de padecer cáncer oral en la población (Huang et al., 2023).
Además de los efectos cancerígenos bien establecidos de BaP (Staal et al., 2007; Caiment et al., 2015), se ha demostrado que este compuesto causa disfunción mitocondrial, al interrumpir la generación de ATP y las actividades de Na+/K+-ATPasa y Ca2+/Mg2+-ATPasa, lo que lleva a la muerte celular por apoptosis y necrosis (Jiang et al., 2011).
Así mismo, el BaP interfiere con el proceso reproductivo a través de su interacción con la proteína reguladora aguda esteroidogénica (StAR) (Reddy et al., 2015), la cual es responsable de la producción de andrógenos en machos (Miller, 2013). Jorge et al. (2021) demostraron que en ratas juveniles expuestas por vía oral a 0.1, 1 y 10 μg kg-1 día-1, se compromete el comportamiento copulatorio de los machos desde la dosis más baja (0.1 μg kg-1 día-1), mostrando disminución en la calidad del esperma, del peso de la glándula tiroidea y de los niveles de testosterona. Estos resultados muestran que el sistema reproductor masculino es susceptible a BaP durante la etapa prepuberal, lo que produce efectos negativos a largo plazo en el sistema reproductor masculino.
Otra investigación indicó que el suministro de 5 mg kg-1 de BaP en ratas macho (de 75 días de nacidas) disminuían significativamente los niveles de testosterona, estradiol y progesterona, afectando negativamente al sistema reproductivo a través del aumento del estrés oxidativo, la inhibición de las actividades de las enzimas antioxidantes y la disminución de la concentración de hormonas (Sheweita et al., 2016).
Por otro lado, diversos estudios han demostrado que la exposición a BaP puede afectar a peces y anfibios de distintas formas. Aguilar et al. (2021), analizaron en México las concentraciones de HAPs en Gambusia yucatana, una especie de pez endémico de la Península de Yucatán que es altamente sensible a la presencia de HAPs en el ambiente. Se expusieron a alevines de G. yucatana a concentraciones de 3.89, 9.27 y 19.51 μg L-1 de HAPs por 72 horas encontrando cambios como el aumento en la expresión hepática en genes relacionados a la reproducción, principalmente a concentraciones de 9.27 μg L-1 y 19.51 μg L-1. Al realizar el análisis de los compuestos se encontró que el BaP era el contaminante que estaba en mayor concentración, bioacumulándose en todas las concentraciones probadas. Los niveles más altos de bioacumulación (0.2 μg g-1) ocurrió en la concentración más alta de HAPs (19.51 μg L-1), con 2.5 μg L-1 de BaP en el agua (Aguilar et al., 2021).
De manera análoga, Feng et al. (2020), probaron el efecto de 10 μg L-1 de BaP en G. affinis, un pez de agua dulce ampliamente distribuido en el oeste de Estados Unidos de América y el noreste de México. A partir de la secuenciación del transcriptoma del hígado de G. affinis, los autores observaron que la presencia de BaP afecta la respuesta inmune y aumenta el consumo de todo el almacenamiento de energía disponible para activar los mecanismos de desintoxicación en G. affinis (Feng et al., 2020). Así mismo, Cai et al. (2018) demostraron que la exposición a corto plazo a 0.6 μg L-1 de BaP puede afectar negativamente la desintoxicación y el metabolismo de lípidos en el hígado de Mugilogobius chulae, posiblemente por la supresión de la expresión de numerosos genes involucrados en el retículo endoplásmico que están implicados en la digestión y absorción de grasas.
Por otro lado, entre los ensayos en anfibios destaca el llevado a cabo por Regnault et al. (2014), en el cual observaron que el metabolismo lipídico de Xenopus tropicalis se vio afectado por el BaP a una concentración cercana a la que se encuentra en aguas altamente contaminadas (10 μg L-1), lo cual provocó hepatotoxicidad a corto plazo. Esta desregulación de la fisiología hepática puede conducir a un deterioro metabólico general en anfibios expuestos crónicamente a contaminantes, lo que demostraría que los xenobióticos podrían desempeñar en la disminución global de las poblaciones de anfibios (Regnault, et al., 2014). Usal et al. (2019) evaluaron el efecto endocrino del triclosán y del BaP en hembras de la especie del anfibio Silurana tropicalis (también conocida como Xenopus tropicalis), mediante la exposición a una mezcla de estos compuestos a concentraciones (50 ng L-1 cada uno) durante 12 meses. Se demostró que la exposición a ambientes con altas concentraciones de DE puede conducir a graves alteraciones metabólicas en los anfibios, así como también afectar negativamente la fecundidad de la progenie que se expone en la etapa de gametos y contribuir al declive de la población de anfibios.
Así como los anfibios son organismos sensibles a la presencia de contaminantes, diversos investigadores han demostrado que los invertebrados acuáticos como las ostras sirven como organismos centinelas en estudios de contaminación (Guzmán-García, Martínez, Rodríguez, González y Vázquez, 2007; García-Rico, Tejeda, Jara, y Gómez, 2011; Toledo-Ibarra et al., 2016).
Estos organismos concentran estos compuestos a niveles muy por encima de los que se encuentran en el agua de mar circundante (Baumard, Budzinski y Garrigues, 1998; Neff, 2002), gracias a que la captación de HAPs por la ostra es rápida, mientras que la cinética de purificación es lenta y puede llevar meses (Francioni et al., 2007). En las costas de Brasil y Tanzania se ha reportado la presencia y bioacumulación de BaP en las ostras presentes en esas zonas, producto de la alta actividad petrolera (Martins et al., 2020; Gaspare et al., 2009.
Tanto en el ensayo de Martins et al. (2020) como el de Gaspare et al. (2009), las concentraciones máximas de BaP reportadas (8.52 ng g-1 y 11 ng g-1 respectivamente) no representan un riesgo para la salud humana mediante la ingesta, ya que, de acuerdo a Llobet, Falco, Bocio y Domingo (2006), para aumentar el riesgo de cáncer sería necesaria una ingesta de BaP de aproximadamente 50 ng día-1, lo que equivaldría a un consumo diario de 224 g de ostras (Gaspare et al., 2009). No obstante, es necesario tomar en cuenta que la ingesta solo corresponde a un tipo de absorción de BaP, y que en la vida cotidiana los seres vivos se encuentran expuestos constantemente al BaP por distintas fuentes y con distintas rutas de absorción.
De acuerdo con la Comisión Regulatoria de Estados Unidos y de la Comunidad Europea, la concentración máxima de BaP en alimentos oscila entre 1.0 μg kg-1 -6.0 μg kg-1 dependiendo del producto alimenticio (Cuadro 1).
Cuadro 1: Concentraciones máximas de BaP en factores abióticos de acuerdo a la Comisión Regulatoria de Estados Unidos (EPA) 2015/1933 y de la Comunidad Europea (EC) No. 420/2011. (Caruso y Alaburda 2008; Kukare, Bartkevics y Viksna, 2010; Sahin, Ulusoy, Alemdar, Erdogan y Agaoglu, 2020).
Table 1: The maximum concentrations of benzo(a)pyrene (BaP) in abiotic factors according to the regulatory commission of the United States (EPA) 2015/1933 and the European Community (EC) No. 420/2011. (Caruso y Alaburda 2008; Kukare, Bartkevics and Viksna, 2010; Sahin, Ulusoy, Alemdar, Erdogan y Agaoglu, 2020).
| Producto alimenticio | Concentración máxima |
| μg kg-1 | |
| Aceite, grasas y pescados | 2.0 |
| Cacao en grano y productos derivados Crustáceos, carnes y pescados ahumados | 5.0 5.0 (hasta 31.08.2014) 2.0 (a partir del 1.09.2014) |
| Moluscos bivalvos (ahumados) | 6.0 |
| Alimentos para bebes e infantes (a base de cereales procesados) | 1.0 |
| Fórmula infantil | 1.0 |
Continuando con los efectos que ocasiona el BaP en organismos acuáticos, Petersen, Heiaas y Tollefsen (2014) realizaron ensayos con Skeletonema pseudocostatum, un alga que se encuentra presente en zonas costeras y que es altamente sensible a los contaminantes. S. pseudocostatum fue expuesta a 11 contaminantes que habitualmente se encuentran en aguas residuales y afluentes industriales, reportando en los análisis toxicológicos al BaP como el cuarto contaminante más tóxico que afecta el crecimiento del alga.
Los resultados indicaron que estos contaminantes, de manera individual y conjunta, inhiben el crecimiento algal, teniendo implicaciones en el ecosistema acuático ya que las algas son importantes para la fijación de carbono en los océanos, proporcionando alimento y oxígeno al ecosistema acuático (Petersen et al., 2014).
Desde la óptica de las células vegetales, diversos estudios han reportado el efecto del BaP en diversas plantas. Los HAPs incluyendo el BaP pueden ser absorbidos de los suelos contaminados por varias plantas y acumularse tanto en la raíz como en la parte aérea, provocando la inhibición de la formación de pelos radiculares, la longitud de la raíz, disminuyendo el tamaño y el número de hojas, la longitud de los brotes y tener efecto negativo en la biomasa en diferentes plantas (Sivaram, Logeshwaran, Lockington, Naidu y Megharaj, 2018; Fedorenko et al., 2021). La bioacumulación de BaP por cebada (Hordeum sativum distichum), provoca un daño estructural y ultraestructural que depende de la concentración de BaP, teniendo mayor efecto en la raíz, provocando daños citológicos e histológicos (Fedorenko et al., 2021).
La ultraestructura y organización de mitocondrias, retículo endoplásmico y dictiosomas se ven afectados.
Baghali et al. (2011) realizaron ensayos en polen de girasoles (Helianthus annuusL.), donde probaron el efecto del BaP en distintas concentraciones (0.002, 0.02 y 0.04 g L-1).
En todas las plantas tratadas con BaP observaron anormalidades durante el desarrollo del polen, mostrando un menor tamaño en los sacos de polen, así como un aumento de dos a tres veces el tamaño del polen y la formación de cuerpos de inclusión como signo de bioacumulación de BaP. Estos efectos fueron observados en todas las concentraciones probadas, pero en mayor medida en la concentración de 0.04 g L-1, reportando que a esta concentración el 68% de las plantas presentaba las características mencionadas.
De manera análoga observaron que la fertilidad de los granos de polen pasó del 97% (grupo control) al 85, 50 y 35% en los grupos tratados con 0.002, 0.02 y 0.4 g L-1 de BaP respectivamente.
Al analizar molecularmente el patrón de proteínas de los granos de polen, se observó la aparición de nuevas proteínas, indicando que existe la posibilidad de que BaP pueda ser un agente que conlleve a la formación de proteínas desintoxicantes que, por otro lado, también pueden actuar como alérgenos.
En este estudio concluyeron que el BaP induce varias anomalías en el desarrollo del polen y el patrón de bandeo proteico, que a su vez puede afectar la fertilidad, la expresión genética y la supervivencia de las plantas (Baghali et al., 2011).
En resumen, el BaP es una sustancia tóxica que puede tener efectos negativos en la salud humana y otros seres vivos, incluyendo efectos cancerígenos, problemas respiratorios, daño genético, problemas reproductivos e impacto en la fauna y flora (Figura 2).
Biorremediación
Este compuesto es muy resistente a la biodegradación porque tiene cinco anillos aromáticos fusionados (Nzila y Musa, 2021). Debido a su estructura y el alto peso molecular, el BaP tiende a acumularse en el medio ambiente, donde puede causar daños irreversibles (Liu et al. 2019). Las estrategias biológicas que involucran organismos vivos (como microorganismos, plantas, asociaciones planta-microorganismos, etc.) son las que parecen más respetuosas con el medio ambiente y, en muchos casos, pueden modificar en gran medida la estructura y las propiedades toxicológicas de los contaminantes, pudiendo resultar en la conversión completa de la molécula en productos finales inorgánicos inocuos (Gianfreda et al., 2016). Dentro de las estrategias biológicas más destacadas se encuentran biorremediación microbiana (Bianco, Race, Papiro y Esposito, 2020; Biache et al., 2017; Lu et al., 2019), la fitorremediación (Sushkova et al. 2018) y la micorremediación (García-Delgado Alfaro y Eymar, 2015; Vieira, Magrini, Bonugli, Rodrigues y Sette, 2018).
El BaP se involucra en los procesos metabólicos de las plantas a través de las células vegetales o en los espacios intercelulares, debido a sus propiedades lipofílicas (Alagić et al., 2016). La forma de bioacumulación de los PAH puede avanzar a través del estoma por acumulación en el tejido intercelular de la planta (Alagić et al., 2016; Patowary, Patowary, Devi, Kalita y Deka, 2016). Debido a ello existen plantas que son utilizadas en la fitorremediación, ya que el BaP puede concentrarse en las capas de la membrana lipídica de la planta principalmente al caer de la atmósfera sobre la superficie de la hoja (Alagić et al., 2016). Por otro lado, los derivados de BaP solubles en agua se mueven hacia las membranas celulares causando su daño y aumentando la permeabilidad de la membrana (Sivaram et al., 2018). Entre los ensayos realizados para encontrar plantas candidatas para remover el BaP del entorno se encuentra el de Sushkova et al. (2018), quienes evaluaron la capacidad de degradación y bioacumulación del BaP en plantas de soya (Hordeum sativum distichum). Los resultados de su estudio indicaron que al utilizar este sistema en suelo contaminado con BaP, el contenido de éste disminuye un 50% del contenido inicial en 48 meses. Estudios similares señalan que al utilizar pasto de Sudán, vetiver, maíz y girasol durante 50 días se elimina del 6 al 14% del BaP en suelo (Sivaram et al., 2018). De forma particular, Liu et al. (2019) realizaron ensayos sobre los efectos del BaP en el compostaje y en la comunidad microbiana de aguas residuales. Los autores señalan que durante el proceso de compostaje removió eficientemente el BaP, acelerando el proceso de descomposición de silicatos y minerales, facilitando el intercambio de metales pesados. Como punto a recalcar, se menciona que la temperatura durante el proceso de compostaje no fue lo suficientemente elevada como para volatilizar el BaP y liberarlos a la atmósfera, además de que no se produjeron lixiviados, por lo que el BaP no causó contaminación en aire ni en agua durante el proceso de composta.
Biodegradación de BaP
Entre estas tecnologías, la remediación microbiana se ha considerado como una de las soluciones clave. De acuerdo con Nzila y Musa (2021), el uso de la tecnología bacteriana está fuertemente sustentada por los múltiples ensayos exitosos donde fueron utilizadas bacterias para la mineralización y degradación del BaP. Por ejemplo, Biache et al. (2017), durante cinco meses y mediante lotes de biolecho que estimularon el crecimiento de bacterias y hongos en distintos suelos contaminados con BaP. Detectaron que este contaminante disminuyó de 69.4 μg g-1 a 30.3 μg g-1 en el suelo de la planta de gas, de 82.8 μg g-1 a 71.4 μg g-1 en la planta de coque y, de forma peculiar, aumentó de 6.0 μg g-1 a 7.8 μg/g en suelo de la zona de tratamiento de madera. Por otro lado, Cao, Wang, Liu, Jia y Sun (2020) analizaron la eficacia de remoción de BaP en suelo proveniente de planta de gas con Stenotrophomonas maltophilia (VUN10,010), un consorcio bacteriano (VUN 10,009) y Penicillium janthinellum (VUO10,201), mostrando que individualmente se degradaba el BaP de 10-15%, mientras que este porcentaje incrementaba a más del 40% al utilizar pireno como factor de crecimiento.
En 2017, Guevara-Luna aisló en Guerrero, México la cepa termofílica Bacillus licheniformis M2-7, demostrando que puede ser candidata para realizar la biotransformación de BaP en un corto tiempo (3 a 24 horas), por lo cual se puede emplear en estrategias de biodegradación acopladas a cultivos de otros microorganismos y así favorecer la mineralización del BaP (Guevara-Luna et al., 2018). Por otro lado, Lily, Bahuguna, Dangwal y Garg (2009) reportaron que la cepa de B. subtilis BMT4i (MTCC 9447) puede degradar el BaP con una eficiencia del 84.66% después de 28 días de incubación. De manera similar, Abdelhaleem, Zein, Azeiz, Sharaf y Abdelhadi (2019) encontraron que distintas especies pertenecientes al género Bacillus son capaces de degradar los HAPs, destacando de igual forma a B. subtilis EMCC 4454 como la cepa con la más alta eficiencia de degradación en presencia de los HAPs mutagénicos y cancerígenos. Entre otros géneros bacterianos reportados con la capacidad de degradar BaP se encuentra la bacteria rizosférica Serratia marcescens S2I7, la cual asociada a Melia azedarach (especie arbórea ornamental en Sudáfrica y América) es altamente efectiva para biorremediar suelos contaminados con BaP (Kotoky y Pandey, 2020). También han sido identificadas bacterias patógenas de humanos por su capacidad de biodegradar el BaP; Nzila y Musa (2021) reportaron recientemente que la bacteria halofílica Staphylococcus haemoliticus es capaz de biodegradar BaP, así como también Meng, Li, Bao y Sun (2019) mencionan que Pseudomonas aeruginosa posee la misma propiedad de biodegradación, sin embargo, debido a que ambos géneros son de importancia médica estos no pueden ser utilizados como método de biorremediación. En el Cuadro 2 se destacan, de forma sintetizada, los principales microorganismos y consorcios bacterianos que han sido reportados con la capacidad de degradar más del 50% del BaP.
Cuadro 2: Microorganismos y consorcios microbianos capaces de degradar benzo(a)pyrene (BaP). Tabla modificada de Kumar, Devlina y Nilanjana (2020)).
Table 2: Microorganisms and microbial consortia capable of degrading benzo(a)pyrene (BaP). Modified table from Kumar, Devlina and Nilanjana (2020).
| Origen | Nombre de especie | Concentración y degradación | Referencia |
| Bacterias | P. aeruginosa BT-1 | 50 mg L-1 por 25 días (61.32%) | Meng, Li, Bao y Sun (2019) |
| B. thuringiensis | 0.5 mg L-1 por 9 días (80%) | Lu et al. (2019) | |
| C. cellulans CWS2 | 10 mg L-1 por 13 días (78.8%) | Qin et al. (2018) | |
| M. maritypicum CB7 | 10 mg L-1 por 30 días (69%) | Mansouri, Abbes y Landoulsi (2017) | |
| Hongos | Tinctoporellus sp. CBMAI1061 | 0.02 mg L-1 por 7días (50%) | Vieira, Magrini, Bonugli, Rodrigues y Sette, 2018 (2018) |
| Marasmiellus sp. CBMAI 1062 | 0.02 mg L-1 por 7días (97.2%) | ||
| Pleurotus ostreatus | 7.56 mg kg-1 por 21 días (59%) | García-Delgado, Alfaro y Eymar (2015) | |
| Levaduras | Rhodotorula sp. NS01 | 10 mg L-1 por 7 días (52%) | Mandal y Das (2017) |
| Pichia anomala | 1.91 mg L-1 por 10 días (63.8%) | Hesham et al. (2006) | |
| Consorcio microbiano | YC01 (Rhodotorula sp. NS01, Hanseniaspora opuntiae NS02 y Debaryomyces hansenii NS03) | 50 mg L-1 por 6 días (76%) | Mandal, Selvi y Das (2016) |
| Candida maltose, Pichia anomala, Sporidiobolus salmonicolor, Pichia guilliermondii. | 1.99 mg kg-1 por 42 días (76%) | Hesham et al. (2006) |
Conclusión
El benzo(a)pireno se encuentra ampliamente distribuido en aire, agua y suelo, así como también en alimentos, cigarros, productos de cuidado personal y maquillaje. Debido a su naturaleza hidrofóbica le confiere la capacidad de permear en las membranas biológicas, por lo que se bioacumula en distintos organismos causando daños a nivel sistémico y pasando a lo largo de la cadena trófica. Dentro de los efectos que tiene este contaminante se encuentra su gran potencial como genotóxico, mutágeno y teratogénico, así como también afecta la fertilidad y el equilibrio de los ecosistemas. La presencia de este contaminante en elementos o productos de la vida cotidiana es alta y pudiera tener implicaciones en la salud humana y en los ecosistemas, por lo que es necesario monitorear e informar a la sociedad sobre su presencia. La biodegradación del BaP se presenta como una alternativa viable para la utilización de microorganismos y otros organismos vivos para descontaminar suelos, aguas y otros tipos de medios naturales o artificiales contaminados.
Contribución de los Autores
Conceptualización, análisis formal, revisión y edición: V.M.C. Validación, administración del proyecto, adquisición de fondo: V. M. C. Redacción original, Investigación, metodología, escritura: A.R.B.O. Escritura: revisión y edición: A.R.B.O., J.M.A.C., R.C.L., S.M.C.G.G. y V.M.C. Investigación, escritura: preparación del borrador original, escritura: revisión y edición: A.R.B.O., J.M.A.C., R.C.L., S.M.C.G.G. y V.M.C.











 nueva página del texto (beta)
nueva página del texto (beta)




