Introducción
El frijol común (Phaseolus vulgaris L.) representa una de las principales fuentes de calorías y proteínas consumida a nivel mundial (Terán, Lema, Webster y Singh, 2009). La producción de este cultivo en Sinaloa, México, es de gran importancia debido a la superficie sembrada; tan solo en el ciclo agrícola otoño-invierno 2020 se establecieron aproximadamente 82 323 hectáreas y se obtuvo una producción total de 139 233 toneladas, para dar con un rendimiento de 1.7 Mg ha-1 (SIAP, 2020). En este contexto, factores como el cambio climático (Kanyenga, Kasongo, Kizungu, Nachigera y Kalonji, 2016), déficit hídrico (Emam, Shekoofa, Salehi y Jalali, 2010), problemas de suelo, así como prácticas inadecuadas de manejo agronómico son las que limitan la productividad de este cultivo (Rodríguez y Creamer, 2014).
En regiones del noroeste de México, la mayoría de los suelos son de reacción alcalina y pobres en materia orgánica (INEGI, 2019). En este sentido, la baja disponibilidad de nutrientes como el fósforo (P) ha sido uno de los principales factores que limitan el crecimiento vegetativo y radicular de diferentes cultivos (Kochian, 2012). Algunos autores mencionan que una mejora en la fertilización con P se puede lograr mediante el uso de rizobacterias promotoras del crecimiento vegetal (PGPR), lo que a su vez incrementa la productividad y la fertilidad del suelo (García y Delgado, 2016; Heppell et al., 2016; Whiters, Sylvester, Jones, Healey y Talboys, 2014). Dichos microorganismos modifican el crecimiento vegetal a través de mecanismos como la fijación de nitrógeno (N), acidificación del medio y la producción de reguladores de crecimiento (Simpson et al., 2011). Lo anterior, se traduce en un incremento en la absorción de agua y nutrientes (Kochian, 2012).
De la gran cantidad de PGPR, Bacillus subtilis representa una opción importante de considerar en la producción de cultivos. Lo anterior es debido a que solubiliza el P fijado en suelos alcalinos ricos en compuestos cálcicos (Swain, Laxminarayana y Ray, 2012; Cisneros, Sánchez y Menjivar, 2017), es muy termo-tolerante (Swain et al., 2012; Sakil-Munna, Tahera, Mohibul-Hassan, Nur y Noor, 2015), promueve la producción de reguladores de crecimiento, el crecimiento y la absorción de nutrientes (Prakash y Arora, 2019). Bacillus subtilis constituye incluso una oportunidad de biofortificar algunos granos de interés alimenticio para el ser humano (Zaidi, Usmani, Singh y Musarrat, 2006).
El cultivo de frijol tiene un ciclo productivo corto lo cual permite un estudio detallado de patrón de absorción de nutrientes. Resultados previos indican que, al inicio de la estación de crecimiento, el cultivo tiene una etapa de lenta acumulación nutrimental, seguida por una etapa de acumulación intensa y finalmente una etapa de declinación (Lima, Nascimento y Junior, 2016). Bertsch-Hernández (2004) menciona la importancia de identificar correctamente los patrones de absorción nutrimental del cultivo en etapas fenológicas debido a que con ello se pueden desarrollar prácticas de manejo que incrementen la absorción, acumulación de minerales en tejidos y eficiencia en la absorción de estos evitando con ello un evento de estrés nutrimental durante el ciclo de crecimiento.
En el noreste de México específicamente en el estado de Sinaloa, es limitada la información acerca de la concentración, distribución y acumulación nutrimental en el cultivo de frijol que pueda ayudar a mejorar sus prácticas de fertilización. En esta región los productores fertilizan únicamente con N sin considerar los requerimientos del resto de los nutrientes del cultivo. Lo anterior genera una ineficiencia en la absorción de los fertilizantes especialmente cuando se utilizan fuentes poco solubles y métodos de aplicación inapropiados. De acuerdo con Peres-Sorato, Mazzetti, Andriani y Gomes (2013), la concentración y la absorción de nutrientes en frijol varía dependiendo de la fertilidad del suelo y la dosis de fertilizantes aplicados. Por consiguiente, el objetivo de este estudio consistió en evaluar el efecto del P y la inoculación de la semilla con Bacillus subtilis (Bs) en la concentración, distribución y acumulación de macronutrientes en el cultivo de frijol para las condiciones agroclimáticas del noroeste de México.
Materiales y Métodos
Ubicación del experimento
El trabajo se realizó durante el ciclo agrícola otoño-invierno 2017 en la unidad experimental de la Empresa Química Internacional Aplicada S.A de C.V. El suelo empleado presentó textura franco-arcillosa (32% de arcilla, 36% de limo y 32% de arena), bajo en materia orgánica (< 1.0%) y densidad aparente de 1.15 g cm-3, con una salinidad baja (0.69 dS m-1), y un pH alcalino (7.6). Las concentraciones de macronutrientes fueron 145, 32, 760, 3950 y 590 mg kg-1, para N, P (Olsen), potasio (K), calcio (Ca) y magnesio (Mg), respectivamente. Las técnicas de siembra para producción que se emplearon de este cultivo, fueron las recomendadas por Salinas-Pérez et al. (2012).
Diseño experimental
Se levantaron camas de siembra separadas a 0.80 m. Los tratamientos se distribuyeron bajo un diseño de parcelas divididas en bloques al azar con tres repeticiones. La parcela principal constó de cuatro dosis de P (0, 25, 50 y 100 kg de P2O5 ha-1) y la sub-parcela consistió en la inoculación o no de la semilla con Bacillus subtilis Q11® (Bs). Para el proceso de inoculación con Bs, se utilizaron 5.0 mL de solución preparada a una concentración de 2×108 UFC mL-1 por cada kilogramo de semilla (Quimia, Ahome, México). La parcela fue de 64.0 m2 y constó de ocho camas de siembra orientadas de norte a sur, separadas a 0.80 m con una longitud de 10.0 m. A su vez, la parcela se dividió a la mitad y cada mitad constituyó la subparcela (32 m2).
Se utilizó semilla de frijol variedad Azufrado Higuera a una densidad de 180 000 plantas ha-1. La siembra se realizó en suelo húmedo. Además del P, se aplicaron 150 kg ha-1 de N al momento de la siembra. Para la programación del riego se utilizó la plataforma IRRIMODEL (Sifuentes, Quintana, Macías y González, 2012), la cual estima la variación de la humedad del suelo en la zona radicular de acuerdo con la metodología propuesta por Ojeda, Sifuentes, Slack y Carrillo (2004). Adicionalmente, se estableció un criterio de riego del 50% de la humedad aprovechable y se verificó el contenido de humedad usando TDR (Time Domain Reflectometry®). El control de plagas fue exitoso siguiendo las recomendaciones de la guía de asistencia técnica agrícola para el área de influencia del campo en Sinaloa (Apodaca-Sánchez, 20161).
Muestreo y extracción de macronutrientes
Para estimar la concentración total y absorción mineral del cultivo, se realizaron muestreos destructivos de tejido vegetal de los diferentes órganos de la planta (hojas, tallos, vainas) en cuatro etapas fenológicas: a) tercera hoja trifoliada (25 días después de la siembra [dds]), b) floración (45 dds), c) llenado de grano (75 dds) y d) madurez fisiológica (105 dds). Se cosecharon las plantas ubicadas sobre un metro lineal del surco central de cada sub-parcela. El material vegetal fue lavado y sumergido en solución ácida realizada con agua destilada y ácido sulfúrico (50:50) para posteriormente ser sometidas a secado (70 °C) en horno por 72 h. Una vez que se obtuvo peso constante de las muestras, se molieron para analizar en laboratorio la concentración de nutrientes.
Las variables evaluadas fueron la biomasa acumulada, la concentración macronutrientes contenidas en cada muestreo, así como la acumulación de los mismos durante la estación de crecimiento. El N total fue estimado por digestión Kjeldhal (Bradstreet, 1965; Moréis, 1983). El contenido de P total se estimó por digestión húmeda con ácido nítrico (HNO3) y acido perclórico (HClO4) (Mengel y Kirby, 2000). Los materiales filtrados obtenidos mediante la digestión húmeda para fósforo, fueron utilizados para la determinación de potasio. Se utilizó el método de emisión de llama-flamometría, mientras que para la determinación de calcio (Ca) y magnesio (Mg) se utilizó un espectrofotómetro de absorción atómica. La cantidad de cada nutriente absorbido y distribuido dentro de los órganos de la planta fue estimado al multiplicar el peso seco por la concentración de cada macronutriente.
Análisis estadístico
Los resultados de rendimiento y crecimiento del cultivo de frijol han sido presentados en un documento publicado previamente (Ruelas-Islas, Reyes, Núñez, Flores y Villarreal, 2018). Los datos obtenidos de la concentración y absorción mineral fueron sujetos a análisis de varianza considerando cada etapa fenológica. Para la comparación de medias se utilizó la prueba de Tukey (P = 0.05) (Wong-González, 2010). Los valores de absorción se graficaron versus tiempo, se realizaron modelos de regresión polinomial para generar las curvas de absorción nutrimental. En todas las determinaciones estadísticas se utilizó al paquete estadístico Minitab (2017).
Resultados y Discusión
Acumulación de biomasa
No se identificó interacción entre la aplicación de P y la inoculación con Bs (P × Bs; P > 0.05) en la producción de biomasa en ninguna de las etapas fenológicas del cultivo (Cuadro 1). La acumulación de biomasa en las etapas de 3ra hoja trifoliada y floración no se afectó por los tratamientos evaluados. Al llegar al llenado de grano, la biomasa se incrementó significativamente al aplicar 50 y 100 kg ha-1 de P con respecto a 0 o 25 kg ha-1 de P (P < 0.006). En madurez fisiológica, la mayor acumulación de biomasa seca se obtuvo al aplicar 50 kg ha-1 de P y la menor fue con 0 kg ha-1 de P. Las dosis de 100 kg ha-1de P redujeron significativamente dicha acumulación (P < 0.007). Por otra parte, en la etapa de llenado grano y madurez fisiológica, el cultivo respondió favorablemente a la inoculación Bs a la semilla (P < 0.024), (Cuadro 1).
Cuadro 1: Acumulación de biomasa seca en el cultivo de frijol (kg ha-1) por efecto de la aplicación de fósforo y Bacillus subtilis.
Table 1: Dry biomass accumulation in common bean (kg ha-1) as a function of phosphorus doses and Bacillus subtilis.
| Fósforo (P) | 3ra hoja trifoliada | Floración | Llenado de grano | Madurez fisiológica |
| 0 kg ha-1 P2O5 | 352 (±47)‡ | 1054 (±198) | 5089 (±134)b† | 4494 (±102)c |
| 25 kg ha-1 P2O5 | 360 (±52) | 1288 (±101) | 5729 (±127)b | 5611 (±135)ab |
| 50 kg ha-1 P2O5 | 413 (±68) | 1310 (±127) | 6497 (±101)a | 6341 (±142)a |
| 100 kg ha-1 P2O5 | 397 (±62) | 1382 (±105) | 6331 (±121)a | 5547 (±105)b |
| Probabilidad | 0.645 | 0.443 | 0.006 | 0.007 |
| B. subtilis (Bs) | ||||
| Inoculación | 373 (±36) | 1319 (±149) | 6232.8 (±147)a | 6143.0 (±142)a |
| Control | 388 (±44) | 1153 (±136) | 5589.8 (±134)b | 4854.0 (±167)b |
| Probabilidad | 0.675 | 0.219 | 0.024 | 0.001 |
| Interacción P × Bs | ||||
| Probabilidad | 0.426 | 0.827 | 0.335 | 0.268 |
† Valores con letras diferentes en cada columna son significativamente diferentes. Tukey (P = 0.05). ‡ Desviación estándar.
† Values with different letters on each column indicate significant differences. Tukey (P = 0.05). ‡ Standard deviation.
Concentración de N
La concentración de N y su distribución en los diferentes órganos de la planta y en las diferentes etapas fenológicas fue afectada por la interacción de los dos factores evaluados (P × Bs; P < 0.010) (Cuadro 2), excepto en las vainas durante la etapa del llenado de grano y madurez fisiológica (P > 0.05). La combinación de 100 kg ha-1 de P e inoculación con Bs indujeron favorablemente a una mayor concentración de N en las hojas en etapa de tercera hoja trifoliada y floración. Al llegar el cultivo a etapa de llenado de grano, las dosis de P por encima de los 50 kg ha-1, más la inoculación con Bs incrementaron la concentración de N en las hojas. La dosis de 50 kg ha-1 de P y la combinación de 100 kg ha-1 de P, más la inoculación con Bs mostraron las mayores concentraciones de N en madurez fisiológica. Se observó que la menor concentración de N en hojas resultó en los tratamientos sin P y sin inoculación con Bs.
Cuadro 2: Concentración de N en órganos vegetativos y reproductivos del cultivo de frijol en diferentes etapas fenológicas.
Table 2: Nitrogen concentration on vegetative and reproductive organs in common bean at different phenological stages.
| Fósforo (P) | Tercera hoja trifoliada | Floración | Llenado de grano | Madurez fisiológica | ||||||
| Hojas | Tallos | Hojas | Tallos | Hojas | Tallos | Vainas | Hojas | Tallos | Vainas | |
| - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - Concentración (%) - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - | ||||||||||
| 0 kg ha-1 P2O5 | 2.75 (±0.27)b† | 2.09 (±0.21)b | 3.18 (±0.75) | 3.07 (±0.09)b | 3.07 (±0.50)b | 2.99 (±0.75)b | 2.48 (±0.27)b | 2.60 (±0.18)b | 2.90 (±0.39)b | 2.52 (±0.15)b |
| 25 kg ha-1 P2O5 | 3.15 (±0.71)ab | 2.53 (±0.29)ab | 3.73 (±0.55) | 3.38 (±0.39)ab | 2.83 (±0.28)b | 3.40 (±0.32)ab | 2.67 (±0.36)a | 2.72 (±0.25)b | 3.10 (±0.57)b | 2.69 (±0.13)a |
| 50 kg ha-1 P2O5 | 3.88 (±0.42)a | 2.89 (±0.81)a | 4.21 (±0.85) | 3.99 (±0.02)a | 3.96 (±0.92)a | 3.83 (±0.79)a | 2.69 (±0.43)a | 3.36 (±0.17)a | 4.18 (±1.37)a | 2.73 (±0.14)a |
| 100 kg ha-1 P2O5 | 4.05 (±0.60)a | 2.57 (±0.72)ab | 4.51 (±1.30) | 3.15 (±0.13)b | 4.01 (±0.97)a | 2.73 (±0.48)b | 2.26 (±0.67)b | 3.25 (±0.32)a | 3.74 (±0.54)ab | 2.27 (±0.12)b |
| Probabilidad | 0.001 | 0.002 | 0.093 | 0.039 | 0.020 | <0.001 | 0.015 | <0.001 | 0.050 | 0.011 |
| B. subtilis (Bs) | ||||||||||
| Inoculación | 3.91 (±3.00)a | 2.92 (±0.56)a | 4.68 (±0.76)a | 3.70 (±0.78)a | 4.06 (±0.85)a | 3.75 (±0.54)a | 2.62 (±0.47) | 3.09 (±0.33) | 4.10 (±0.90)a | 2.65 (±0.48) |
| Control | 3.00 (±3.91)b | 2.11 (±0.32)b | 3.13 (±0.41)b | 3.09 (±0.14)b | 2.88 (±0.27)b | 2.73 (±0.46)b | 2.43 (±0.43) | 2.88 (±0.45) | 2.86 (±0.32)b | 2.54 (±0.33) |
| Probabilidad | <0.001 | <0.001 | <0.001 | 0.010 | <0.001 | <0.001 | 0.066 | 0.206 | <0.001 | 0.061 |
| Interacción P × Bs | ||||||||||
| 0 + Inoculación | 3.00 (±0.00)e | 2.25 (±0.16)bc | 3.86 (±0.15)c | 3.10 (±0.11)c | 3.51 (±0.22)b | 3.66 (±0.15)b | 2.35 (±0.19) | 2.71 (±0.22)cd | 3.20 (±0.30)d | 2.34 (±0.77) |
| 0 + Control | 2.50 (±0.00)f | 1.92 (±0.28)c | 2.50 (±0.00)e | 3.04 (±0.06)c | 2.63 (±0.11)d | 2.32 (±0.24)d | 2.61 (±0.09) | 2.50 (±0.00)d | 2.61 (±0.22)e | 2.62 (±0.84) |
| 25 + Inoculación | 3.80 (±0.00)c | 2.70 (±0.26)b | 4.20 (±0.30)c | 3.70 (±0.20)b | 3.04 (±0.26)c | 3.66 (±0.15)b | 2.74 (±0.16) | 2.94 (±0.12)bc | 3.40 (±0.20)c | 2.75 (±0.91) |
| 25 + Control | 2.50 (±0.00)f | 2.36 (±0.35)bc | 3.26 (±0.15)d | 3.06 (±0.22)c | 2.63 (±0.11)d | 3.14 (±0.17)c | 2.61 (±0.23) | 2.50 (±0.00)d | 2.61 (±0.22)e | 2.63 (±0.84) |
| 50 + Inoculación | 4.26 (±0.05)b | 3.55 (±0.08)a | 4.96 (±0.28)b | 4.90 (±0.40)a | 4.80 (±0.20)a | 4.53 (±0.30)a | 2.93 (±0.73) | 3.23 (±0.15)ab | 5.43 (±0.23)a | 2.90 (±0.53) |
| 50 + Control | 3.50 (±0.00)d | 2.24 (±0.16)bc | 3.45 (±0.12)cd | 3.08 (±0.10)c | 3.13 (±0.11)c | 3.14 (±0.16)c | 2.46 (±0.09) | 3.50 (±0.00)a | 2.94 (±0.12)de | 2.45 (±0.54) |
| 100 + Inoculación | 4.60 (±0.10)a | 3.21 (±0.25)ab | 5.70 (±0.20)a | 3.11 (±0.12)c | 4.90 (±0.10)a | 3.14 (±0.17)c | 2.46 (±0.59) | 3.48 (±0.13)a | 4.20 (±0.30)b | 2.46 (±0.61) |
| 100 + Control | 3.50 (±0.00)d | 1.94 (±0.49)c | 3.33 (±0.20)d | 3.19 (±0.16)c | 3.13 (±0.11)c | 2.32 (±0.24)d | 2.07 (±0.56) | 3.02 (±0.29)bc | 3.28 (±0.15)cd | 2.01 (±0.47) |
| Probabilidad | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | 0.005 | 0.052 | <0.001 | <0.001 | 0.052 |
† Valores con letras diferentes en cada columna son significativamente diferentes. Tukey (P = 0.05). ‡ Desviación estándar.
† Values with different letters on each column indicate significant differences. Tukey (P = 0.05). ‡ Standard deviation.
La mayor concentración de N en tallos se encontró en los tratamientos con dosis mayores a los 50 kg ha-1 de P más inoculación con Bs en la etapa de tercera hoja trifoliada. En el resto de las etapas fenológicas, la mayor concentración de N se encontró con la aplicación de 50 kg ha-1 de P más la inoculación con Bs. Por otro lado, la mayor concentración de N en las vainas fue afectada por la dosis de P (P < 0.015) encontrando las mayores concentraciones en las dosis de 50 y 100 kg ha-1 de P. De manera general, las mayores concentraciones de N se encontraron en las hojas, seguida por los tallos y finalmente por las vainas (Cuadro 2).
Concentración de P
La concentración de P en las hojas y tallos en las diferentes etapas fenológicas fue afectada significativamente por la interacción de los factores evaluados (P × Bs; P < 0.04), (Cuadro 3). La combinación de las dosis de 50 o 100 kg ha-1 de P más inoculación con Bs resultó con la mayor concentración de P en las hojas en las etapas de tercera hoja trifoliada y llenado de grano; mientras que la mayor concentración de P en las hojas resultó con la dosis de 50 kg ha-1 en combinación con Bs en las etapas de floración y madurez fisiológica.
Cuadro 3: Concentración de P en órganos vegetativos y reproductivos del cultivo de frijol en diferentes etapas fenológicas.
Table 3: Phosphorus concentration on vegetative and reproductive organs in common bean at different phenological stages.
| Fósforo (P) | Tercera hoja trifoliada | Floración | Llenado de grano | Madurez fisiológica | ||||||
| Hojas | Tallos | Hojas | Tallos | Hojas | Tallos | Vainas | Hojas | Tallos | Vainas | |
| - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - Concentración (%) - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - | ||||||||||
| 0 kg ha-1 P2O5 | 0.17 (±0.08) | 0.18 (±0.07) b | 0.23 (±0.06) | 0.24 (±0.04) b | 0.22 (±0.04) ab | 0.29 (±0.13) | 0.30 (±0.04) | 0.15 (±0.06) c | 0.15 (±0.11)b | 0.32 (±0.04) |
| 25 kg ha-1 P2O5 | 0.21 (±0.12) | 0.22 (±0.08) ab | 0.28 (±0.02) | 0.32 (±0.08) b | 0.19 (±0.01) b | 0.30 (±0.04) | 0.29 (±0.09) | 0.19 (±0.05) b | 0.24 (±0.08)ab | 0.28 (±0.08) |
| 50 kg ha-1 P2O5 | 0.25 (±0.17) | 0.32 (±0.13) a | 0.37 (±0.11) | 0.52 (±0.19) a | 0.29 (±0.07) a | 0.29 (±0.18) | 0.31 (±0.07) | 0.23 (±0.14) a | 0.36 (±0.13)a | 0.33 (±0.08) |
| 100 kg ha-1 P2O5 | 0.25 (±0.17) | 0.30 (±0.07) a | 0.31 (±0.09) | 0.27 (±0.05) b | 0.29 (±0.07) a | 0.18 (±0.09) | 0.28 (±0.06) | 0.22 (±0.09) a | 0.28 (±0.02)a | 0.28 (±0.07) |
| Probabilidad | 0.068 | 0.004 | 0.057 | 0.001 | 0.019 | 0.359 | 0.975 | 0.536 | 0.013 | 0.905 |
| B. subtilis (Bs) | ||||||||||
| Inoculación | 0.35 (±0.10) a† | 0.33 (±0.08) a | 0.36 (±0.09) a | 0.40 (±0.18) a | 0.29 (±0.07) a | 0.35 (±0.07)a | 0.35 (±0.02)a | 0.27 (±0.06) a | 0.32 (±0.11)a | 0.34 (±0.03)a |
| Control | 0.10 (±0.35) b | 0.17 (±0.05) b | 0.24 (±0.04) b | 0.27 (±0.06) b | 0.20 (±0.02) b | 0.17 (±0.10)b | 0.25 (±0.03)b | 0.12 (±0.03) b | 0.20 (±0.09)b | 0.23 (±0.04)b |
| Probabilidad | <0.001 | <0.001 | <0.001 | 0.030 | 0.002 | <0.001 | <0.001 | <0.001 | 0.009 | 0.001 |
| Interacción P × Bs | ||||||||||
| 0 + Inoculación | 0.24 (±0.04) c | 0.24 (±0.04) d | 0.30 (±0.00) bc | 0.27 (±0.00) cd | 0.25 (±0.05) b | 0.39 (±0.07)ab | 0.23 (±0.07) | 0.21 (±0.01) c | 0.23 (±0.11)b | 0.33 (±0.06) |
| 0 + Control | 0.10 (±0.00) d | 0.11 (±0.01) e | 0.17 (±0.01) d | 0.20 (±0.02) d | 0.19 (±0.01) c | 0.19 (±0.08)cd | 0.38 (±0.04) | 0.10 (±0.00) d | 0.07 (±0.02)c | 0.34 (±0.08) |
| 25 + Inoculación | 0.32 (±0.02) b | 0.29 (±0.01) c | 0.30 (±0.00) bc | 0.39 (±0.07) b | 0.20 (±0.00) bc | 0.34 (±0.03)ab | 0.25 (±0.05) | 0.24 (±0.01) bc | 0.30 (±0.02)b | 0.35 (±0.05) |
| 25 + Control | 0.10 (±0.00) d | 0.15 (±0.04) e | 0.27 (±0.02) cd | 0.26 (±0.03) d | 0.19 (±0.02) c | 0.26 (±0.02)bc | 0.33 (±0.07) | 0.15 (±0.04) d | 0.19 (±0.10)b | 0.33 (±0.04) |
| 50 + Inoculación | 0.41 (±0.28) a | 0.44 (±0.01) a | 0.48 (±0.02) a | 0.70 (±0.00) a | 0.35 (±0.05) a | 0.42 (±0.07)a | 0.28 (±0.09) | 0.36 (±0.03) a | 0.48 (±0.07)a | 0.29 (±0.07) |
| 50 + Control | 0.10 (±0.00) d | 0.21 (±0.03) d | 0.27 (±0.02) cd | 0.35 (±0.05) bc | 0.23 (±0.01) bc | 0.15 (±0.17)cd | 0.34 (±0.07) | 0.10 (±0.00) d | 0.25 (±0.05)b | 0.30 (±0.03) |
| 100 + Inoculación | 0.41 (±0.28) a | 0.36 (±0.02) b | 0.36 (±0.11) b | 0.27 (±0.04)cd | 0.35 (±0.02) a | 0.27 (±0.05)bc | 0.20 (±0.05) | 0.29 (±0.05) b | 0.28 (±0.02)b | 0.31 (±0.04) |
| 100 + Control | 0.10 (±0.00) d | 0.23 (±0.01) d | 0.27 (±0.02) cd | 0.28 (±0.07)cd | 0.22 (±0.01) bc | 0.10 (±0.00)d | 0.36 (±0.06) | 0.15 (±0.04) d | 0.28 (±0.01)b | 0.30 (±0.03) |
| Probabilidad | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | 0.002 | 0.502 | <0.001 | 0.040 | 0.324 |
† Valores con letras diferentes en cada columna son significativamente diferentes. Tukey (P = 0.05). ‡ Desviación estándar.
† Values with different letters on each column indicate significant differences. Tukey (P = 0.05). ‡ Standard deviation.
Se encontró que los tallos tuvieron una mayor concentración de P cuando se aplicó 50 kg ha-1 de P en combinación con Bs en las etapas de tercera hoja trifoliada, floración y madurez fisiológica. Sin embargo, los tratamientos con mayor concentración de P fueron aquellos inoculados con Bs, a excepción de la dosis de 100 kg ha-1 en combinación con Bs, pero en la etapa de llenado de grano. Por otro lado, las concentraciones de P en las vainas fueron afectadas solo por la inoculación con Bs (P < 0.001). Se observó que las mayores concentraciones de P en los diferentes órganos de la planta y en las diferentes etapas fenológicas, se encontraron en los tratamientos que fueron inoculados con Bs (Cuadro 3).
La concentración de K en los tallos y hojas de la planta en las diferentes etapas fenológicas, resultó afectada por la interacción de los factores evaluados (P × Bs; P < 0.001) (Cuadro 4). La mayor concentración de K en las hojas se encontró cuando se combinó la dosis de 50 o 100 kg ha-1 de P más la inoculación con Bs en las etapas de tercera hoja trifoliada y madurez fisiológica. Sin embargo, la mayor concentración de K se encontró en plantas donde se aplicó la dosis de 100 kg ha-1 de P en combinación con Bs en las etapas fenológicas de floración y llenado de grano.
Cuadro 4: Concentración de K en órganos vegetativos y reproductivos del cultivo de frijol en diferentes etapas fenológicas.
Table 4: Potassium concentration on vegetative and reproductive organs in common bean at different phenological stages.
| Fósforo (P) | Tercera hoja trifoliada | Floración | Llenado de grano | Madurez fisiológica | ||||||
| Hojas | Tallos | Hojas | Tallos | Hojas | Tallos | Vainas | Hojas | Tallos | Vainas | |
| - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - Concentración (%) - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - | ||||||||||
| 0 kg ha-1 P2O5 | 2.40 (±0.82) b† | 0.80 (±0.48) c | 2.94 (±1.41) b | 5.26 (±1.07) | 4.10 (±1.14) | 6.01 (±0.22) | 1.90 (±0.23) | 3.84 (±0.38) c | 3.90 (±0.26)b | 1.88 (±0.08) |
| 25 kg ha-1 P2O5 | 3.38 (±0.53) ab | 2.05 (±0.75) bc | 4.20 (±0.48) ab | 5.24 (±1.04) | 4.29 (±1.34) | 6.01 (±0.22) | 1.95 (±0.45) | 4.11 (±0.48) bc | 3.98 (±0.36)b | 1.92 (±0.06) |
| 50 kg ha-1 P2O5 | 3.80 (±0.04) a | 2.56 (±1.32) b | 4.96 (±0.86) a | 5.73 (±0.84) | 4.33 (±0.97) | 6.63 (±0.86) | 2.03 (±0.15) | 5.31 (±1.47) ab | 6.88 (±1.28)a | 2.12 (±0.07) |
| 100 kg ha-1 P2O5 | 3.91 (±0.96) a | 3.80 (±1.28) a | 5.52 (±1.43) a | 5.85 (±0.72) | 4.98 (±1.49) | 6.79 (±1.03) | 1.91 (±0.53) | 5.65 (±1.27) a | 6.88 (±0.47)a | 1.89 (±0.07) |
| Probabilidad | 0.026 | 0.001 | 0.005 | 0.570 | 0.649 | 0.133 | 0.8 | <0.001 | <0.001 | 0.743 |
| B. subtilis (Bs) | ||||||||||
| Inoculación | 4.12 (±0.75) a | 3.06 (±1.61) a | 5.29 (±1.14) a | 6.27 (±0.45) a | 5.54 (±0.53) a | 6.86 (±0.76)a | 2.02 (±0.23)a | 5.51 (±1.26) a | 5.24 (±1.70) | 2.20 (±0.05)a |
| Control | 2.62 (±0.59) b | 1.54 (±0.74) b | 3.52 (±1.01) b | 4.76 (±0.53) b | 3.30 (±0.29) b | 5.86 (±0.09)b | 1.70 (±0.19)b | 3.94 (±0.48) b | 4.26 (±0.92) | 1.78 (±0.03)b |
| Probabilidad | <0.001 | 0.003 | <0.001 | <0.001 | <0.001 | <0.001 | 0.001 | <0.001 | 0.090 | 0.001 |
| Interacción P × Bs | ||||||||||
| 0 + Inoculación | 3.13 (±0.05) c | 0.86 (±0.75) de | 4.22 (±0.10) c | 6.23 (±0.25) a | 5.14 (±0.17) b | 6.16 (±0.20)b | 1.58 (±0.33) | 4.14 (±0.17) bcd | 4.10 (±0.10)de | 1.48 (±0.07) |
| 0 + Control | 1.66 (±0.28) d | 0.73 (±0.05) e | 1.66 (±0.28) d | 4.30 (±0.17) c | 3.06 (±0.05) d | 5.86 (±0.11)b | 2.20 (±0.55) | 3.53 (±0.25) e | 3.71 (±0.22)e | 2.21 (±0.03) |
| 25 + Inoculación | 3.86 (±0.12) b | 2.70 (±0.20) c | 4.40 (±0.52) c | 6.18 (±0.17) a | 5.51 (±0.22) b | 6.16 (±0.20)b | 1.81 (±0.24) | 4.51 (±0.22) b | 4.24 (±0.25)cd | 1.87 (±0.08) |
| 25 + Control | 2.90 (±0.00) c | 1.40 (±0.36) d | 4.00 (±0.43) c | 4.30 (±0.17) c | 3.06 (±0.05) d | 5.86 (±0.11)b | 2.10 (±0.15) | 3.71 (±0.22) de | 3.71 (±0.22)e | 2.11 (±0.06) |
| 50 + Inoculación | 4.71 (±0.52) a | 5.00 (±0.20) a | 5.73 (±0.25) b | 6.30 (±0.87) a | 5.20 (±0.26) b | 7.40 (±0.30)a | 1.75 (±0.57) | 6.61 (±0.18) a | 8.02 (±0.06)a | 1.65 (±0.08) |
| 50 + Control | 2.90 (±0.00) c | 2.60 (±0.17) c | 4.20 (±0.17) c | 5.16 (±0.20) b | 3.46 (±0.25) cd | 5.86 (±0.11)b | 2.31 (±0.42) | 4.02 (±0.58) cde | 5.73 (±0.45)b | 2.41 (±0.09) |
| 100 + Inoculación | 4.78 (±0.22) a | 3.70 (±0.30) b | 6.83 (±0.20) a | 6.40 (±0.50) a | 6.33 (±0.25) a | 7.72 (±0.24)a | 1.66 (±0.68) | 6.80 (±0.20) a | 4.60 (±0.36)c | 1.76 (±0.07g) |
| 100 + Control | 3.04 (±0.03) c | 1.43 (±0.45) d | 4.22 (±0.10) c | 5.30 (±0.36) b | 3.63 (±0.20) c | 5.86 (±0.11)b | 2.17 (±0.48) | 4.50 (±0.20) bc | 3.90 (±0.26)de | 2.127 |
| Probabilidad | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | 0.705 | <0.001 | <0.001 | 0.843 |
† Valores con letras diferentes en cada columna son significativamente diferentes. Tukey (P = 0.05). ‡ Desviación estándar.
† Values with different letters on each column indicate significant differences. Tukey (P = 0.05). ‡ Standard deviation.
La mayor concentración de K en los tallos se encontró con la aplicación de la dosis de 50 kg ha-1 de P e inoculación con Bs en etapa de primera hoja trifoliada y madurez fisiológica. En la etapa de floración se observó que la inoculación con Bs en los tratamientos favoreció a una mayor concentración de K. Finalmente, las mayores concentraciones de K en tallos se obtuvieron con la combinación de 50 o 100 kg ha-1 de P inoculadas con Bs en la etapa de llenado de grano. Por otro lado, las concentraciones de K en las vainas solo respondieron al tratamiento de inoculación con Bs (Cuadro 4).
Concentración de Ca
La concentración de Ca en los tallos y en hojas de la planta fue afectada por la interacción de los factores evaluados (P × Bs; P < 0.050) (Cuadro 5) en las diferentes etapas fenológicas. La combinación de 50 kg ha-1 de P con la inoculación de Bs resultó en mayor concentración de Ca en las hojas en las etapas de tercera hoja trifoliada y madurez fisiológica. Por otra parte, se encontró la mayor concentración de Ca en las hojas cuando se aplicaron las dosis de 25 y 50 kg ha-1 de P más la inoculación de Bs en la etapa de floración; mientras que la mayor concentración de Ca en dichos órganos se encontró con la dosis 100 kg ha-1 de P más la inoculación con Bs en la etapa de llenado de grano.
Cuadro 5: Concentración de Ca en órganos vegetativos y reproductivos del cultivo de frijol en diferentes etapas fenológicas.
Table 5: Calcium concentration on vegetative and reproductive organs in common bean at different phenological stages.
| Fósforo (P) Etapa fenológica | Tercera hoja trifoliada | Floración | Llenado de grano | Madurez fisiológica | ||||||
| Hojas | Tallos | Hojas | Tallos | Hojas | Tallos | Vainas | Hojas | Tallos | Vainas | |
| - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - Concentración (%) - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - | ||||||||||
| 0 kg ha-1 P2O5 | 2.09 (±0.42) b† | 1.19 (±0.34) | 0.78 (±0.56) | 0.49 (±0.08) b | 5.42 (±0.99) b | 1.26 (±0.15)b | 0.95 (±0.05) | 1.10 (±0.35) c | 1.09 (±0.18)b | 0.87 (±0.06) |
| 25 kg ha-1 P2O5 | 2.39 (±0.42) ab | 1.35 (±0.25) | 0.95 (±0.94) | 0.56 (±0.12) b | 5.80 (±0.62) b | 1.26 (±0.15)b | 0.92 (±0.05) | 1.49 (±0.37) c | 2.21 (±1.15)a | 0.88 (±0.08) |
| 50 kg ha-1 P2O5 | 2.76 (±0.40) a | 1.30 (±0.22) | 1.40 (±0.44) | 0.76 (±0.19) a | 6.50 (±1.29) ab | 2.24 (±1.08)a | 0.96 (±0.08) | 5.98 (±1.71) a | 2.55 (±0.26)a | 0.94 (±0.05) |
| 100 kg ha-1 P2O5 | 2.60 (±0.25) a | 1.26 (±0.17) | 1.33 (±0.18) | 0.46 (±0.09) b | 7.44 (±1.05) a | 1.81 (±0.70)ab | 1.00 (±0.04) | 4.28 (±0.52) b | 2.74 (±0.39)a | 1.02 (±0.06) |
| Probabilidad | 0.036 | 0.761 | 0.248 | 0.004 | 0.014 | 0.047 | 0.215 | <0.001 | 0.002 | 0.216 |
| B. subtilis (Bs) | ||||||||||
| Inoculación | 2.75 (±0.28) a | 1.49 (±0.11) a | 1.59 (±0.25) a | 0.66 (±0.18) a | 7.17 (±0.94) a | 2.06 (±0.87)a | 1.00 (±0.02)a | 3.84 (±2.57) | 2.19 (±0.88) | 0.99 (±0.04)a |
| Control | 2.17 (±0.37) b | 1.07 (±0.11) b | 0.64 (±0.50) b | 0.47 (±0.09) b | 5.40 (±0.76) b | 1.22 (±0.11)b | 0.92 (±0.03)b | 2.58 (±1.71) | 2.05 (±0.97) | 0.89 (±0.05)b |
| Probabilidad | <0.001 | <0.001 | <0.001 | 0.003 | <0.001 | 0.003 | 0.007 | 0.170 | 0.245 | 0.007 |
| Interacción P × Bs | ||||||||||
| 0 + Inoculación | 2.42 (±0.10) bcd | 1.49 (±0.12) a | 1.24 (±0.06) bc | 0.53 (±0.11) cd | 6.30 (±0.21) c | 1.30 (±0.20)c | 0.90 (±0.06) | 1.40 (±0.20) cd | 1.13 (±0.15)bc | 0.89 (±0.05) |
| 0 + Control | 1.75 (±0.30) e | 0.90 (±0.10) c | 0.32 (±0.41) d | 0.46 (±0.05) de | 4.53 (±0.25) e | 1.22 (±0.13)c | 1.01 (±0.08) | 0.80 (±0.00) d | 0.85 (±0.02)c | 1.11 (±0.06) |
| 25 + Inoculación | 2.65 (±0.11) bc | 1.57 (±0.07) a | 1.81 (±0.11) a | 0.66 (±0.07) b | 6.35 (±0.18) c | 1.30 (±0.20)c | 0.89 (±0.06) | 1.83 (±0.08) c | 2.30 (±0.21)ab | 0.88 (±0.07) |
| 25 + Control | 2.13 (±0.49) de | 1.12 (±0.04) b | 0.08 (±0.01) d | 0.40 (±0.05) e | 5.25 (±0.20) d | 1.22 (±0.13)c | 0.96 (±0.08) | 1.16 (±0.15) d | 2.12 (±1.35)ab | 0.98 (±0.05) |
| 50 + Inoculación | 3.12 (±0.00) a | 1.49 (±0.14) a | 1.81 (±0.08) a | 0.93 (±0.08) a | 7.66 (±0.20) b | 3.23 (±0.15)a | 0.94 (±0.07) | 7.46 (±0.76) a | 2.76 (±0.11)a | 0.94 (±0.07) |
| 50 + Control | 2.40 (±0.12) cd | 1.12 (±0.04) b | 1.00 (±0.00) c | 0.59 (±0.05) bc | 5.33 (±0.25) d | 1.26 (±0.09)c | 0.97 (±0.06) | 4.50 (±0.45) b | 2.33 (±0.15)a | 0.97 (±0.06) |
| 100 + Inoculación | 2.80 (±0.15) ab | 1.41 (±0.12) a | 1.49 (±0.01) ab | 0.52 (±0.02) cde | 8.38 (±0.23) a | 2.43 (±0.25)b | 0.95 (±0.05) | 4.70 (±0.20) b | 2.59 (±0.56)a | 0.95 (±0.08) |
| 100 + Control | 2.40 (±0.12) cd | 1.12 (±0.04) b | 1.17 (±0.07) bc | 0.46 (±0.10) de | 6.50 (±1.05) c | 1.19 (±0.15)c | 1.06 (±0.08) | 3.86 (±0.35) b | 2.88 (±0.12)a | 1.01 (±0.05) |
| Probabilidad | <0.001 | 0.001 | <0.001 | <0.001 | <0.001 | <0.001 | 0.704 | <0.001 | 0.001 | 0.405 |
† Valores con letras diferentes en cada columna son significativamente diferentes. Tukey (P = 0.05). ‡ Desviación estándar.
† Values with different letters on each column indicate significant differences. Tukey (P = 0.05). ‡ Standard deviation.
Durante la etapa de tercera hoja trifoliada, las mayores concentraciones de Ca en tallos, se obtuvieron siempre que se inoculó con Bs. En las etapas fenológicas de floración y llenado de grano, la mayor concentración se obtuvo cuando se aplicó la dosis de 50 kg ha-1 de P más la inoculación con Bs; En la etapa de madurez fisiológica, la mayor concentración de Ca se obtuvo cuando se utilizó P con o sin inoculación de Bs. Finalmente, la concentración de Ca en las vainas fue afectada solo por el factor de inoculación con Bs (Cuadro 5).
Concentración de Mg
En todas las etapas fenológicas, la concentración de Mg en las hojas y los tallos de la planta fue afectada por la interacción de los dos factores evaluados (P × Bs; P < 0.050), (Cuadro 6). Una excepción lo fue la concentración de Mg en las hojas en la etapa de floración (P × Bs; P = 0.426). En la etapa de tercera hoja trifoliada, la inoculación con Bs en combinación con la dosis de 50 kg ha-1 de P incrementó la concentración de Mg en las hojas, mientras que en el control dicha concentración se redujo. En la etapa de llenado de grano, la mayor concentración de Mg en hojas fue en el tratamiento de 100 kg ha-1 de P e inoculación con Bs, mientras que el menor valor fue en tratamiento solamente inoculado.
Cuadro 6: Concentración de Mg en órganos vegetativos y reproductivos del cultivo de frijol en diferentes etapas fenológicas.
Table 6: Magnesium concentration on vegetative and reproductive organs in common bean at different phenological stages.
| Fósforo (P) Etapa fenológica | Tercera hoja trifoliada | Floración | Llenado de grano | Madurez fisiológica | ||||||
| Hojas | Tallos | Hojas | Tallos | Hojas | Tallos | Vainas | Hojas | Tallos | Vainas | |
| - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - Concentración (%) - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - | ||||||||||
| 0 kg ha-1 P2O5 | 0.62 (±0.62) | 0.48 (±0.24) | 0.37 (±0.28) | 0.34 (±0.24) | 1.32 (±0.37) b | 0.34 (±0.24) | 0.88 (±0.05) | 1.07 (±0.64) b | 0.19 (±0.07) | 0.98 (±0.07) |
| 25 kg ha-1 P2O5 | 0.58 (±0.06) | 0.33 (±0.25) | 0.29 (±0.21) | 0.24 (±0.12) | 1.55 (±0.60) b | 0.24 (±0.12) | 0.77 (±0.03) | 1.23 (±0.82) b | 0.21 (±0.09) | 0.76 (±0.06) |
| 50 kg ha-1 P2O5 | 0.64 (±0.13) | 0.37 (±0.19) | 0.43 (±0.11) | 0.31 (±0.16) | 1.72 (±0.50) b | 0.37 (±0.24) | 0.81 (±0.02) | 1.72 (±0.50) ab | 0.31 (±0.16) | 0.91 (±0.04) |
| 100 kg ha-1 P2O5 | 0.61 (±0.09) | 0.32 (±0.13) | 0.26 (±0.08) | 0.24 (±0.06) | 2.36 (±0.30) a | 0.46 (±0.28) | 0.87 (±0.05) | 2.45 (±0.35) a | 0.24 (±0.06) | 0.88 (±0.06) |
| Probabilidad | 0.791 | 0.566 | 0.460 | 0.604 | 0.006 | 0.447 | 0.156 | 0.003 | 0.238 | 0.158 |
| B. subtilis (Bs) | ||||||||||
| Inoculación | 0.69 (±0.06) a† | 0.52 (±0.09) a | 0.37 (±0.24) | 0.40 (±0.13)a | 2.10 (±0.36) a | 0.54 (±0.16)a | 0.90(±0.35)a | 2.11 (±0.44) a | 0.31 (±0.09)a | 0.91 (±0.02)a |
| Control | 0.54 (±0.05) b | 0.22 (±0.18) b | 0.31 (±0.11) | 0.16 (±0.06)b | 1.38 (±0.54) b | 0.16 (±0.06)b | 0.75(±0.35)b | 1.13 (±0.75) b | 0.16 (±0.06)b | 0.77 (±0.03)b |
| Probabilidad | <0.001 | <0.001 | 0.427 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 |
| Interacción P × Bs | ||||||||||
| 0 + Inoculación | 0.70 (±0.04) ab | 0.55 (±0.13) a | 0.27 (±0.08) | 0.55 (±0.11)a | 1.64 (±0.17) c | 0.55 (±0.11)a | 0.77 (±0.35) | 1.64 (±0.17) cd | 0.25 (±0.00)bc | 0.87 (±0.04) |
| 0 + Control | 0.54 (±0.06) c | 0.41 (±0.34) ab | 0.47 (±0.40) | 0.13 (±0.05)e | 1.00 (±0.00) d | 0.13 (±0.05)c | 0.98 (±0.35) | 0.50 (±0.10) e | 0.13 (±0.05)d | 0.99 (±0.06) |
| 25 + Inoculación | 0.63 (±0.02) bc | 0.56 (±0.09) a | 0.36 (±0.01) | 0.34 (±0.07)bc | 2.10 (±0.10) ab | 0.34 (±0.07)b | 0.71 (±0.35) | 1.96 (±0.25) bc | 0.29 (±0.02)b | 0.74 (±0.03) |
| 25 + Control | 0.54 (±0.06) c | 0.10 (±0.00) c | 0.23 (±0.31) | 0.14 (±0.05)e | 1.00 (±0.00) d | 0.14 (±0.05)c | 0.83 (±0.35) | 0.50 (±0.10) e | 0.14 (±0.05)d | 0.85 (±0.05) |
| 50 + Inoculación | 0.75 (±0.08) a | 0.54 (±0.07) a | 0.52 (±0.06) | 0.46 (±0.06)ab | 2.11 (±0.12) ab | 0.58 (±0.13)a | 0.74 (±0.35) | 2.11 (±0.12) b | 0.46 (±0.06)a | 0.84 (±0.05) |
| 50 + Control | 0.54 (±0.06) c | 0.20 (±0.00) bc | 0.33 (±0.05) | 0.17 (±0.04)de | 1.34 (±0.41) cd | 0.17 (±0.04)c | 0.89 (±0.35) | 1.34 (±0.41) d | 0.17 (±0.04)cd | 0.89 (±0.06) |
| 100 + Inoculación | 0.68 (±0.03) ab | 0.44 (±0.03) a | 0.33 (±0.05) | 0.26 (±0.05)cd | 2.54 (±0.27) a | 0.71 (±0.12)a | 0.79 (±0.35) | 2.72 (±0.19) a | 0.26 (±0.05)b | 0.89 (±0.07) |
| 100 + Control | 0.54 (±0.06) c | 0.20 (±0.00) bc | 0.20 (±0.00) | 0.21 (±0.08)de | 2.18 (±0.23) ab | 0.21 (±0.08)bc | 0.95 (±0.35) | 2.18 (±0.23) b | 0.21 (±0.08)bcd | 0.94 (±0.04) |
| Probabilidad | 0.001 | 0.003 | 0.426 | <0.001 | <0.001 | <0.001 | 0.846 | <0.001 | 0.001 | 0.475 |
† Valores con letras diferentes en cada columna son significativamente diferentes. Tukey (P = 0.05). ‡ Desviación estándar.
† Values with different letters on each column indicate significant differences. Tukey (P = 0.05). ‡ Standard deviation.
En la etapa de hoja trifoliada, se obtuvo la mayor concentración de Mg en los tallos cuando solamente se inoculó con Bs o cuando se inoculó con Bs y se fertilizó con P. Durante la floración, la mayor concentración de Mg apareció cuando solo se inoculó con Bs. Durante el llenado de grano, sucedió lo mismo, aunque también las más altas concentraciones de Mg aparecieron cuando se inoculó con Bs y se combinó con dosis mayores de P 50 kg ha-1. Finalmente, durante la madurez fisiológica, la mayor concentración de Mg sucedió cuando se inoculó con Bs y se aplicó una dosis de 50 P kg ha-1. Por último, la concentración de Mg en las vainas en las etapas de llenado de grano y madurez fisiológica, resultó afectada solo por la inoculación de Bs (P < 0.050), (Cuadro 6).
Absorción de macronutrientes
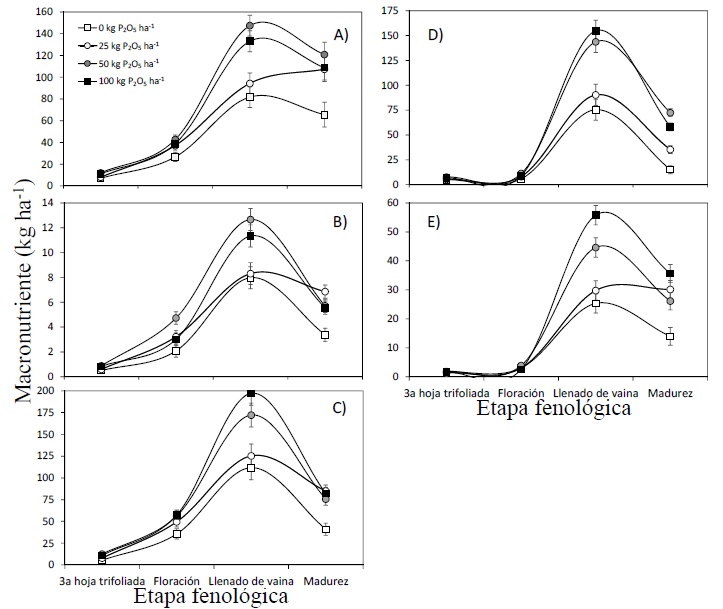
Debido a que no se encontró interacción en la absorción de macronutrientes por efecto de los factores evaluados (P × Bs; P > 0.050), se explica la respuesta de cada factor por separado. La absorción de N resultó afectada por la dosis de P desde la floración hasta la madurez del cultivo (Figura 1A). La aplicación de P realzó la absorción de N en floración (43 kg ha-1), pero en llenado de grano, se requirieron dosis de P por encima de los 50 kg ha-1 para hacer la diferencia con el testigo. La máxima acumulación de N se llevó a cabo durante el llenado de grano y fue en promedio de 114 kg ha-1. Finalmente, al llegar a la madurez fisiológica, la aplicación de P superó en la absorción de N en comparación al tratamiento testigo.
La absorción de P en el cultivo resultó afectada por la dosis de P desde la etapa de floración hasta la madurez fisiológica del cultivo (Figura 1B). En floración se requirió de la dosis de 50 kg P para hacer la diferencia entre los tratamientos evaluados. En la etapa de llenado de grano, se requirieron de dosis de 50 a 100 kg de P para una absorción promedio de 12 kg ha-1 de P. Al llegar a la etapa de madurez fisiológica, la aplicación de las distintas dosis de P superó en la absorción del mismo en comparación al tratamiento testigo, cuya absorción promedio fue de 5.3 kilogramos por hectárea.
La absorción de K aumentó gradualmente desde floración maximizando en etapa de llenado de grano para posteriormente declinar al final del ciclo. Se aprecia que las dosis por encima de 50 kg de P promovieron una absorción máxima de 178.4 kg ha-1 de K en comparación con las dosis menores (Figura 1C).
La absorción de Ca fue relativamente constante hasta la etapa de floración, posteriormente se maximizó exponencialmente en llenado de grano, declinando al final del ciclo. Se puede observar que las dosis de 50 y 100 kg ha-1 de P contribuyeron fuertemente a una mayor absorción de Ca en comparación con las dosis menores. Se encontró que al fertilizar con dosis mayores de 50 kg de P se alcanzó una absorción máxima de 152 kg ha-1 de Ca en etapa de máxima demanda (llenado de grano) (Figura 1D). La cantidad de Ca absorbido disminuyó drásticamente en madurez de aproximadamente 90 kg ha-1 para todas las dosis empleadas.
La máxima absorción de Mg ocurrió en la etapa de llenado de grano (57.6 kg ha-1), (Figura 1E) y se obtuvo con la aplicación de 100 kg de P, seguida de la dosis de 50 kg de P y finalmente el resto de las dosis. Al llegar el cultivo a madurez fisiológica, la máxima absorción de Mg fue en el orden de 100, 50 y 25 kg ha-1 de P y el testigo sin fertilizar con P con valores de 37, 32, 28 y 17 kg ha-1 de Ca respectivamente. De manera general, se encontró que la absorción total de macronutrientes fue en el siguiente orden preferencial K> N> Ca> Mg> P.
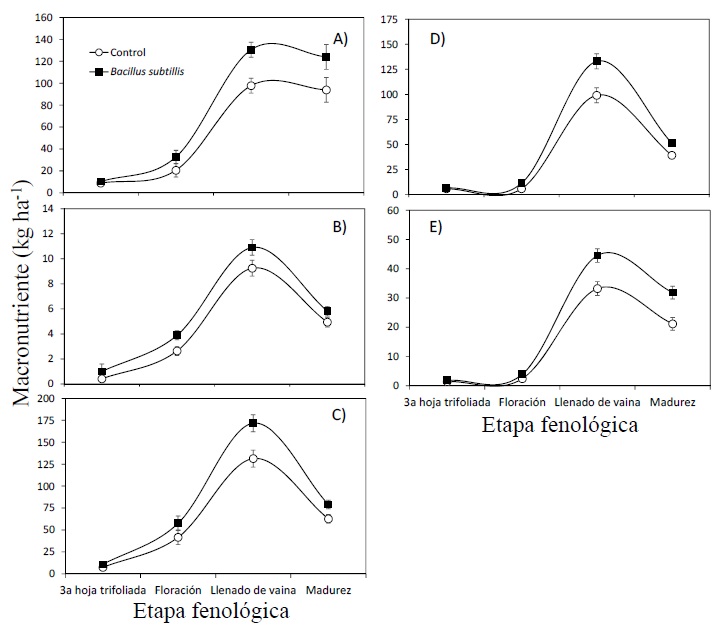
Adicionalmente se pudo observar que, en la mayoría de las etapas fenológicas, la inoculación con Bs superó al tratamiento testigo (Figura 2). Para el caso de N (Figura 2A), la absorción aumento gradualmente desde la floración hasta la madurez fisiológica del cultivo. La mayor cantidad de N absorbido ocurrió en la etapa de llenado grano, en la cual el cultivo acumuló la cantidad de 138 kg ha-1 de N. Para el caso de la absorción de P, las diferencias entre los tratamientos de inoculación y control fueron las mismas que para el caso de la absorción de N. se cuantificó que la mayor absorción fue de 11.7 kg ha-1 de P en la etapa anteriormente mencionada (Figura 2B).
La absorción de K, Ca y Mg por el cultivo fue influenciada favorablemente por el tratamiento inoculación con Bs, desde la etapa de llenado de grano hasta la madurez fisiológica. La mayor absorción de K fue 174.3 kg ha-1 (Figura 2C); 127.4 kg ha-1 de Ca (Figura 2D) y 46.7 kg ha-1 de Mg (Figura 2E).
En este estudio la aplicación de dosis de P e inoculación con Bs proporcionaron información general sobre la acumulación de biomasa, así como la concentración, distribución y absorción de macronutrientes en el cultivo de frijol. Los resultados demostraron que ambos factores actuaron por separado en las variables evaluadas. Al respecto, Chimdi, Negasa y Chala (2022), indican que la interacción de ambos factores solo es posible, cuando las concentraciones de P en suelo suelen ser limitantes para el crecimiento del cultivo. Turuko y Mohammed (2014), mencionan que cuando se identifica respuesta, esta se refleja en un incremento del peso seco de los tallos y en el número y peso de las vainas.
La máxima acumulación de biomasa seca en el cultivo se produjo durante la etapa de llenado de grano. Los máximos valores de biomasa seca resultaron en dosis mayores a 50 kg ha-1 de P y ahí se mantuvieron. Fageria y Baligar (2016) y Gómez, Vadez, Hernández, Sánchez y Toscano (1996) mencionan que la producción de biomasa no siempre está en relación lineal con el suministro de P, y que es común observar que, a mayor dosis de P aplicado, se disminuye la recuperación del mismo por la planta, modificando así la eficiencia en la absorción y distribución. Algunas excepciones encontradas con la respuesta a las dosis de P se encuentran condicionadas al genotipo estudiado (Attar, Blavet, Selim, Abdelhamid y Drevon 2012).
Algunos estudios muestran que existen respuestas variables o baja eficiencia agronómica de distintos cultivos cuando se suministran lo que se consideran dosis altas de P, y que ello se debe principalmente a los siguientes efectos: 1) cambios de pH en la solución del suelo después de la fertilización (Hopkins, 2015), 2) baja absorción o efecto limitante de otros nutrientes (Mengel y Kirkby, 2000), y 3) gran parte del P aplicado queda atado en la zona de contacto (Havlin, Beaton, Tisdale y Nelson, 2005). Dicho proceso se ha reportado en cultivos como maíz (Zea mays) (Hussein, 2009), frijol común (Gidago, Beyene y Worku, 2011; Girma, Demelash y Ayele, 2014) y frijol soya (Glycine max) (Devi et al., 2012).
De manera general, los resultados de concentración de macronutrientes en tejidos de la planta son similares a lo reportado por Lata-Tenesaca, Villaseñor y Chabla (2017), quienes encontraron que las hojas acumularon la mayor cantidad de nutrientes. De acuerdo a Urzúa (2005), el cultivo de frijol tiene altas concentraciones de N especialmente en las hojas y granos. Mientras que Puentes-Páramo, Menjivar, Gómez y Aranzazu (2014) encontraron relativamente bajas concentraciones de P y Mg en tejidos, argumentando que el Mg tiende a acumularse en los tejidos foliares dependiendo la edad de la planta.
Así mismo, la mayor concentración de K encontrada en los tallos concuerda con los hallazgos de Basimine-Geant et al. (2020), quienes mencionan que en algunos casos este nutriente es acumulado en mayor cantidad en este órgano que el N o P. También mencionan que posteriormente es translocado a las hojas y frutos de la planta. En nuestro estudio se observó que al final del ciclo, la reducción de Ca en las hojas y tallos fue atribuida principalmente a la abscisión de hojas y senescencia del cultivo ya que la movilización de este nutriente hacia los tejidos foliares es reducida.
La mejoría en la adquisición de N por la raíz de las plantas está asociada al aumento en la velocidad de mineralización de la materia orgánica en el suelo y a la potencialización de la fijación biológica del N producida por Bacillus spp. (Singh et al., 2016). Por ejemplo, en maíz fertilizado y cultivado en suelo, Bacillus pumilus S1r1 incrementó la capacidad de fijación de nitrógeno por la raíz, hasta alcanzar a absorber un 30.5% más de N con relación al control sin inoculación con bacteria (Kuan, Othman, Abdul-Rahim y Shamsuddin, 2016). Incluso en sistemas acuapónicos en donde se utiliza solución nutritiva, la adición de Bacillus spp., ha demostrado su efectividad al aumentar la producción de biomasa en plantas de lechuga (Lactuca sativa), así como incrementar la cantidad de fósforo en los tejidos, además de lograr una mayor concentración de clorofila en las hojas (da Silva y Fitzsimmons, 2016).
Al igual que Bacillus subtilis solubiliza el P haciéndolo disponible a la planta, lo mismo hace con el K del suelo. Al respecto, Singh-Meena, Maurya y Verma (2014) indican que la actuación de B. subtilis estriba en movilizar y solubilizar K, silicatos y el aluminio de minerales insolubles. Así mismo, genera la producción de ácidos orgánicos con cargas negativas (citrato, malato y oxalato). Lo anterior permite una mayor absorción de minerales y repercute en el incremento de la concentración de N, K, Ca y hierro en las hojas y los frutos de las plantas (Veresoglou et al., 2011).
Armada, Azcon, López, Calvo y Ruiz (2015) encontraron que la aplicación de Bacillus megatherium, B. thuringiensis y Bacillus spp., incrementó las concentraciones de Mg, Zn, Mn y Cu en el tejido foliar en plantas de lavanda (Lavandula angustifolia) y salvia (Salvia officinalis) bajo condiciones de sequía. Resultados similares han sido reportados en el cultivo de garbanzo (Cicer arietinum) (Abd-Allah et al., 2018).
Adicionalmente, el patrón de acumulación de nutrientes durante el desarrollo del cultivo de frijol mostró un comportamiento sigmoidal, lo cual es similar al reportado por da Cunha, Chaves, Kano, Braga y de Olivera (2020) (Figura 1 y 2). El periodo de máxima absorción de nutrientes fue entre la floración y el llenado de grano, y concordó con la máxima acumulación de materia seca del cultivo ( Cuadro 1). El orden preferencial de absorción de nutrientes en este estudio es muy similar a lo encontrado por Lata-Tenesaca et al. (2017), quienes reportaron una absorción total en el orden N>K>Ca>Mg>P; Por su parte, Peres-Soratto et al. (2013) y Facco-Pergoraro, Oliveira, Goncalves, Koiti y Figueiredo (2014) reportaron que la preferencia en absorción fue N> K> Ca> P> Mg> S y K>N>Ca>P>Mg respectivamente.
Por otro lado, al aplicar 50 y 100 kg ha-1 de P, la absorción de N superó a la dosis de 25 kg ha-1 de P y al testigo, en casi un 80%. Así mismo, la aplicación de 50 y 100 kg de P, incrementó la acumulación de N, P, K y Ca. Al respecto, Fageria, Zimmermann y Baligar (1995) encontraron que conforme se incrementó la dosis de P, se incrementó la absorción de macronutrientes en cultivos de arroz (Oryza sativa), trigo (Triticum aestivum), maíz y frijol. Por otro lado, la inoculación con Bs incrementó en todo momento la acumulación de los macronutrientes N, P, K, Ca y Mg. Al respecto, los resultados concuerdan con los de Solanki et al. (2014) y Singh, Prasad y Goel (2018) quienes reportaron que la inoculación con PGPR incrementan la absorción de macronutrientes como N y P, así como la del hierro.
Con respecto a la inoculación de semilla con B. subtilis, Lastochkina et al. (2021) indican que, con esta práctica, el cultivo manifiesta un incremento en la longitud radicular, además de un aumento en la concentración de lignina. Igualmente, estudios señalan que B. subtilis promueve un incremento en el peso seco de la raíz, además de que, fisiológicamente reduce la conductancia estomática promoviendo una mayor eficiencia en el uso del agua (Coelho-de Lima et al., 2019). En este sentido, cuando las plantas poseen un mayor número de raíces, éstas proveen una mayor adquisición de agua y nutrientes necesarios para la producción de biomasa aérea (Abdolzadeh, Wang, Veneklaas y Lambers, 2010).
Se encontró que el proceso de inoculación con la cepa B. subtilis Q11® promovió una mayor absorción de P durante el ciclo del cultivo, por consiguiente, un mayor crecimiento de raíz está fuertemente asociado a una mayor absorción de nutrientes favoreciendo así un mayor crecimiento de la parte aérea en las dos últimas etapas de desarrollo. Además, el proceso de solubilizacion puede reponer aquellos nutrientes en la solución del suelo que han sido tomados por las plantas. Estos resultados son similares a lo reportado por García y Delgado (2016) quienes probaron que la cepa de B. subtilis QST713 fue altamente efectiva al aumentar la absorción de P en las plantas, independientemente de la solubilidad de la fuente aplicada (fertilizante) o de la capacidad de adsorción del medio. Así mismo, argumentaron que el beneficio en la absorción de P podría atribuirse principalmente al aumento en la solubilización desde la rizósfera y con ello un mayor crecimiento radicular.
Según lo indicado por Yao et al., (2006), la biofertilización con B. subtilis FZB 241® puede aumentar el crecimiento de las plantas al movilizar y tomar más nutrientes del medio. Sin embargo, mencionan que la efectividad de los productos depende de las condiciones climáticas, tipo de suelo, nivel de fertilidad, así como de la presencia de nutrientes en el medio. Por otra parte, Murugan, Swaminathan, Niemsdorff y Karthikeyan (2011) también argumentaron que la aplicación de biofertilizantes a base de Rhizobium leguminosarum-phaseoli o Pseudomonas fluorescens en combinación con estiércol aumentó la disponibilidad de C, N y P, la población microbiana en la zona de raíces, así como la productividad de frijol negro (Vigna mungo L.).
De acuerdo a la interacción de P × Bs, esta afectó la concentración de todos los macronutrientes en los órganos de la planta, con excepción de las vainas en las etapas de llenado de grano y madurez fisiológica. El sinergismo entre bacterias promotoras de crecimiento vegetal (PGPR) y la fertilización mineral ha sido documentado. La función de Bs Q11® es asociativa con la fertilización mineral, y estriba en que Bacillus spp. tiene la capacidad de mineralizar N de la materia orgánica del suelo, incrementar la fijación de N, producir auxinas y acidificar el medio de crecimiento (Elkoca, Turan y Donmez, 2010). Esto último repercute en una solubilización de fosfatos, potasio y micronutrientes, haciéndolos mayormente disponibles al cultivo (Acurio-Vasconez et al., 2020).
Finalmente, algunos autores proponen que la disponibilidad de nutrientes en suelos está determinada en gran medida por el estado iónico en el que los nutrientes alcanzan la superficie radicular (Bray, 1954) y que ello influencia parcialmente la efectividad de las aplicaciones de fertilizantes (Havlin et al., 2005). No obstante, la habilidad del sistema radicular está fuertemente influenciado por propiedades físicas del suelo, así como el daño que ocasionan ciertas plagas al alimentarse principalmente de raíces jóvenes.
Conclusiones
La acumulación y distribución de la biomasa seca en la planta de frijol resultó afectada de forma independiente por la fertilización con P y la inoculación a la semilla con B. subtilis. Sin embargo, la combinación de ambos factores, afectó la concentración de macronutrientes en los órganos de la planta en la mayoría de las diferentes etapas fenológicas del cultivo. Una excepción ocurrió en las vainas del cultivo. Lo anterior es de importancia sobre todo si se justifica como biofortificar el grano para consumo alimenticio, de tal manera que habría que buscar alternativas diferentes para lograr este objetivo.
No se identificó interacción en la absorción de macronutrientes por efecto de los factores evaluados. Generalmente las dosis de 50 y 100 kg ha-1 de P fueron las que incrementaron la mayor cantidad de macroelementos en la etapa de llenado de vaina, lo que concuerda con la mayoría de los reportes encontrados en la literatura. Por otro lado, la inoculación a la semilla con B. subtilis, incrementó significativamente la absorción de los macronutrientes en la etapa de llenado de vaina. Al respecto, es una alternativa para la reducción del uso de fertilizante fosforado y a una reducción en los costos de producción.
Disponibilidad de Datos
Los conjuntos de datos utilizados o analizados durante el estudio actual están disponibles del autor correspondiente a solicitud razonable.











 nueva página del texto (beta)
nueva página del texto (beta)