Introducción
Entre las leguminosas, el frijol es considerado una fuente básica de alimento y sustituto de otros nutrimentos en diversas regiones y culturas (Mazón-Suástegui, Ojeda, García, Batista y Abasolo, 2020b), sobre todo en países donde el ingreso per cápita limita la adquisición de alimentos de alto valor proteico con mayor valor económico, como los productos cárnicos de origen animal (Reyes-Rivas, Padilla, Pérez y López, 2008).
El frijol común (Phaseolus vulgaris L.) es la leguminosa más importante para consumo directo en el mundo y constituye una fuente importante de proteínas, calorías y minerales en la dieta de muchos países en desarrollo (Suárez-Martínez et al., 2016; Mazón-Suástegui et al., 2020a). Existen especies de frijol naturalmente resistentes a condiciones de estrés climático, hídrico y biológico, y tal es el caso del frijol Tépari (Phaseolus acutifolius Gray) (Jiménez-Galindo y Acosta-Gallegos, 2012).
Los sistemas agrícolas modernos tienen como objetivo garantizar una producción agrícola sostenible, y, por lo tanto, impulsan la búsqueda de nuevos recursos naturales para encontrar soluciones ecológicas para la protección de los cultivos e incrementar su rendimiento. Las bacterias promotoras del crecimiento de las plantas colonizan activamente las áreas de la raíz y estimulan su desarrollo a través de mecanismos directos o indirectos. Dentro de los mecanismos directos se pueden citar la síntesis de algunas fitohormonas como el ácido indol-3-acético (AIA), el ácido giberélico, citocinas y etileno (Mohapatra, Verma, Dutta y Panda, 2014), el suministro de nutrientes a la planta a través de la producción de sideróforos (Khamna, Yokota y Lumyong, 2009; Nimnoimn, Pongsilp y Lumyong, 2010), la fijación de nitrógeno (Ekpo y Nkanang, 2010) y la solubilización de fosfatos (Jog, Pandya, Nareshkumar y Rajkumar, 2014). Uno de los principales mecanismos indirectos, mediante el cual actúan las bacterias promotoras del crecimiento de las plantas, es el control de fitopatógenos mediante diversos procesos de competencia y exclusión (Chen et al., 2018).
El género Streptomyces incluye bacterias Gram-positivas, formadoras de micelio, el cual está ganando interés en la agricultura por su acción promotora del crecimiento de las plantas y como agente de control biológico. Este género de actinobacterias comprende más de 500 especies ubicuas en la naturaleza, que pueden vivir libremente en el suelo o bien, como simbiontes de organismos eucariotas, desde hongos hasta plantas, insectos y animales marinos (Seipke, Kaltenpoth y Hutchings, 2012). Se ha demostrado que algunas cepas de Streptomyces pueden colonizar la raíz de las plantas y vivir como endófitos en las raíces de numerosos cultivos (Bonaldi et al., 2015), así como suprimir patógenos de las plantas e incluso promover el crecimiento de las mismas (Doumbou, Akimov, Côté, Charest y Beaulieu, 2001; Palaniyandi, Yang, Zhang y Suh, 2013) a través de la producción de auxinas o sideróforos (Sadeghi et al., 2012). Se ha reportado por igual, efectos positivos de la aplicación de Streptomyces en la germinación de semillas (El-Tarabily, 2008) y en la producción de metabolitos secundarios de utilidad e interés agronómico (Watve, Tickoo, Jog y Bhole, 2001).
Por lo anterior, el objetivo del presente estudio fue evaluar el efecto de la cepa de Streptomyces sp. RL8 como promotora de la germinación y crecimiento inicial de frijol Tépari (Phaseolus acutifolius Gray), bajo condiciones controladas.
Materiales y Métodos
Hongos fitopatógenos
Los hongos fitopatógenos Fusarium sp. (dos cepas; aisladas respectivamente del tallo de plantas de tabaco y de tomate), Rhizoctonia solani Kühn, Sclerotium rolfsii Sacc., Sclerotinia sclerotiorum (Lib.) de Bary y Macrophomina phaseolina (Tassi) Goid., son conocidos por sus efectos nocivos en el cultivo del frijol, y fueron seleccionados para el desarrollo de estudios de antagonismo ante la cepa de Streptomyces sp. RL8. Estas cepas fueron obtenidas de la colección de hongos fitopatógenos del Laboratorio de microbiología del centro de bioactivos químicos de la Universidad Central de Las Villas, Cuba (LM-CBQ-UCLV), las cuales fueron resembradas en medio de cultivo agar-papa-dextrosa (APD) y conservadas a temperatura de 4 grados centigrados.
Streptomyces sp. RL8
La cepa de Streptomyces sp. RL8, inicialmente aislada de sedimentos marinos y caracterizada por García-Bernal et al. (2015), se obtuvo del LM-CBQ-UCLV.
Actividad antagónica in vitro de Streptomyces sp. RL8 frente a hongos fitopatógenos
A fin de determinar la capacidad antagonista in vitro de la cepa RL8 frente a los fitopatógenos antes descritos, ésta se sembró en placas Petri conteniendo agar-caseína-almidón (ACA) a pH 7 y se incubó durante siete días a temperatura de 28 °C para permitir su crecimiento, esporulación y producción de metabolitos secundarios. Los hongos fitopatógenos se sembraron en APD y se incubaron a 28 ºC durante tres días, previo a la realización del ensayo de antagonismo.
Se realizó un ensayo de reto de la cepa RL8 frente a los hongos fitopatógenos, aplicando la técnica de cultivo dual en placas de Petri de 90 mm de diámetro con medio de cultivo APD (Dávila-Medina, Gallegos, Hernández, Ochoa y Flores, 2013; Wu et al., 2016; Sellem et al., 2017). En el centro de la placa se colocó un disco de 6 mm de diámetro de micelio del hongo fitopatógeno (tomado del crecimiento en placa de Petri inoculada con suspensión micelial en medio de cultivo APD). En los bordes de la placa se colocaron dos discos de 6 mm con micelio del actinomiceto. También se sembraron discos de 6 mm de diámetro de los hongos fitopatógenos en el centro de placas de APD sin actinomicetos (como control). Todas las placas se incubaron a 28 ºC durante siete días y se midió el diámetro del área de inhibición para cada pareja de hongo fitopatógeno-actinomiceto (Cuesta, García-de-la-Fuente, Abad y Fornes, 2012; Misk y Franco, 2011). Adicionalmente, se evaluó el porcentaje de inhibición del crecimiento radial (PICR) para cada pareja de hongo fitopatógeno-actinomiceto, mediante la fórmula descrita por Crawford, Lynch, Whipps y Ousley (1993); Misk y Franco (2011); Cuesta et al. (2012), basada en el crecimiento micelial (CM).
Producción de sideróforos
Para la detección de sideróforos se utilizó crome azurol S (CAS), un compuesto quelante de hierro que utiliza un complejo hierro-colorante que cambia su coloración (de azul a anaranjado), al perder hierro. La cepa RL8 se sembró por el método de estrías sobre placas con agar CAS. Para preparar un litro de medio agar CAS se disolvieron 60.5 mg de CAS en 50 mL de agua; el producto resultante se mezcló con 10 mL de una solución que contenía FeCl3·6H2O 1 mM disuelto en HCl 10 mM. La solución resultante se añadió lentamente y con agitación a otra solución que contenía 72.9 mg de HDTMA disuelto en 40 mL de agua. La mezcla resultante (solución 1) se esterilizó, al igual que otra solución (solución 2) que contenía 750 mL H2O, 100 mL medio mínimo M9 (10x), 15 g agar, 30.24 g Pipes y NaOH para ajustar el pH a 6.8, de acuerdo a Srimathi y Suji (2018).
Después de enfriar a 50 ºC, se mezclaron 50 mL de la solución 1 con 450 mL de la solución 2, añadiéndose a esta mezcla acetato sódico 50 mM, NH4Cl 2 mM y 1.5 μL de la solución de trazas del medio M9 anteriormente descrito. Las placas fueron sembradas colocando un punto de cultivo en el agar, e incubadas a 28 ºC durante siete días. La aparición de zonas anaranjadas alrededor de las colonias, fue considerada como evidencia del desarrollo de microorganismos productores de sideróforos (Payne, 1994).
Solubilización de fosfatos
Para determinar la capacidad de la cepa de Streptomyces sp. RL8 para solubilizar fosfatos, la misma se sembró en placas de Petri con medio Pikovskaya (glucosa, 10 g; Ca3(PO4) 2.5 g; (NH4)2SO4, 0.5 g; NaCl, 0.2 g; MgSO4·7H2O, 0.1 g; KCl, 0.2 g; extracto de levadura, 0.5 g; MnSO4·H2O, 0.002 g; y FeSO4·7H2O, 0.002 g, suplementado con 1% de agar purificado para 1 L de agua destilada) y se incubaron a 28 °C durante siete días. La formación de halos de aclaramiento alrededor de las colonias se tomó como un indicador positivo a la prueba realizada (Nautiyal, 1999; Franco-Correa et al., 2010; Misk y Franco, 2011). La medición de los halos de aclaramiento se llevó a cabo al tercer y sexto día del ensayo.
Efecto de la cepa Streptomyces sp. RL8 en la germinación y crecimiento inicial de Phaseolus acutifolius gray.
Se aplicó un diseño experimental completamente al azar, con un tratamiento basado en Streptomyces sp. RL8 (T) y un tratamiento control con agua destilada (C), con cuatro réplicas por tratamiento y 10 semillas por réplica.
Desarrollo experimental
La cepa RL8 se cultivó en caldo triptona-soya y se incubó con agitación a 28 °C durante siete días. Después del tiempo de incubación, el cultivo se centrifugó a 4 696 × g a 4 °C durante 10 min, eliminando el sobrenadante y lavando dos veces con agua destilada estéril. La biomasa resultante se re-suspendió en agua destilada estéril, en la proporción requerida para obtener una densidad óptica equivalente a 1.0 (a 600 nm), a fin de obtener una concentración final de trabajo de 1 x 109 UFC mL-1 (García-Bernal et al., 2015).
Se utilizaron semillas certificadas de frijol Tépari (Phaseolus acutifolius Gray). Previo al experimento se realizó una prueba de germinación utilizando la metodología ISTA (2010). Las semillas se desinfectaron previamente mediante inmersión en una solución de hipoclorito de sodio al 1.5% durante 15 min y luego en etanol al 70% durante 5 min (Collado et al. 2013). Posteriormente las semillas se enjuagaron con agua destilada estéril, se secaron con papel esterilizado y fueron embebidas durante 30 min en el tratamiento bacteriano RL8 (T) o en el tratamiento control con agua destilada (C). Finalmente, las semillas desinfectadas y embebidas se colocaron en cajas Petri (150 × 15 mm) esterilizadas previamente en autoclave, cubriendo el fondo con una lámina de papel de filtro esterilizado. Este papel se utilizó como sustrato y fue humedecido con 20 mL de agua destilada por caja. La incubación de las semillas se realizó durante siete días en una cámara de germinación (Lumistell®, modelo IES-OS, serie 1408-88-01) a temperatura de 28 °C, 80% de humedad y 12 h diarias de luz continua.
El tratamiento (RL8) fue aplicado diariamente a cada placa (1 mL) y en el caso del grupo control se aplicó agua destilada estéril. A los siete días se procedió a determinar las variables morfométricas de las plántulas procedentes de cada tratamiento.
Porcentaje y tasa de germinación
La germinación se registró diariamente durante siete días, considerando como semilla germinada cuando la radícula presentó alrededor de 1 mm de longitud y el porcentaje de germinación (PG) se determinó al concluir ese periodo. La tasa de germinación (TG) se calculó aplicando la ecuación propuesta por Maguire (1962), en la cual es equivalente a M:
Dónde: n1, n2, … n10 es el número de semillas germinadas en los tiempos t1, t2, … t7.
Variables morfométricas
Al finalizar el experimento en caja Petri (7 días in vitro), se procedió a determinar la longitud del tallo (LT) y longitud de la raíz (LR) de las plántulas y ambas variables se determinaron empleando una regla graduada. La biomasa fresca de la parte aérea y de la raíz (BFPA y BFR) se determinó mediante una balanza analítica (Mettler Toledo®, modelo AG204). Los tejidos vegetales previamente divididos en parte aérea y raíz se colocaron por separado en bolsas de papel, se pesaron y se colocaron en una estufa de secado (Shel-Lab®, modelo FX-5, serie-1000203) a temperatura de 70 °C durante 48 h hasta su deshidratación completa y se pesaron nuevamente para determinar la biomasa seca correspondiente (BSPA y BSR).
Análisis estadístico
Se realizó un análisis de varianza (ANOVA) y cuando se encontró diferencia significativa entre tratamientos, se utilizó la prueba de comparación múltiple de medias (Tukey HSD, (P ≤ 0.05), usando el programa estadístico Statistica v. 10.0 para Windows (StatSoft, 2011).
Resultados y Discusión
Para caracterizar la cepa Streptomyces sp. RL8, se determinó su actividad antifúngica y su capacidad de producir sideróforos y solubilizar fosfatos inorgánicos, propiedades específicas que la convierten en un agente promotor del crecimiento de las plantas, particularmente del frijol Tépari Phaseolus acutifolius Gray.
La cepa Streptomyces sp. RL8 se evaluó in vitro mediante el método de difusión en agar frente a varias especies de hongos fitopatógenos, incluyendo dos cepas de Fusarium sp., una aislada del tallo del tabaco y otra del tallo del tomate, así como las cepas R. solani, M. phaseolina y S. rolfsii, aisladas del frijol común Phaseolus vulgaris.
La cepa RL8 mostró actividad frente a la mayoría de los hongos fitopatógenos evaluados. La cepa de Fusarium sp. aislada del tallo del tabaco se inhibió en un 55.25% y la misma cepa aislada del tallo del tomate, en un 44.44%. El PICR de R. solani fue de 53.03%. M. phaseolina fue la cepa fúngica más susceptible a la actividad antagonista de Streptomyces sp. RL8, con un PICR de 79.77% (Figura 1), mientras que el fitopatógeno con mayor resistencia al antagonismo de la cepa RL8, fue S. rolfsii (Figura 2).
Figura 1: Imagen ilustrativa de la actividad antagonista in vitro de la cepa Streptomyces sp. RL8 contra Macrophomina phaseolina. Inhibición del desarrollo del hongo fitopatógeno (A); Reto de RL8 frente al hongo fitopatógeno (B). Fotografía de Milagro García-Bernal; Centro de Bioactivos Químicos, Universidad Central de las Villas, Cuba (2018).
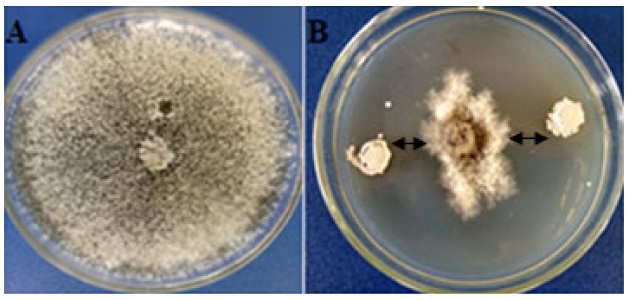
Figure 1: Illustrative image of the in vitro antagonist activity of Streptomyces sp. RL8 strain against Macrophomina phaseolina. Inhibition of the development of the phytopathogenic fungus (A); Challenge of RL8 against the phytopathogenic fungus (B). Photograph by Milagro García-Bernal; Centro de Bioactivos Químicos, Universidad Central de las Villas, Cuba (2018).
Figura 2: Evaluación de la actividad antagonista de la cepa Streptomyces sp. RL8 frente a hongos fitopatógenos de plantas, en función del porcentaje de inhibición del crecimiento radial (PICR). Fusarium sp. aislado del tallo de plantas de tabaco (1), Rhizoctonia solani (2), Macrophomina phaseolina (3), Fusarium sp. aislado del tallo plantas de tomate (4) y Sclerotium rolfsii (5). Letras distintas muestran diferencia estadística significativa (P< 0.05). E
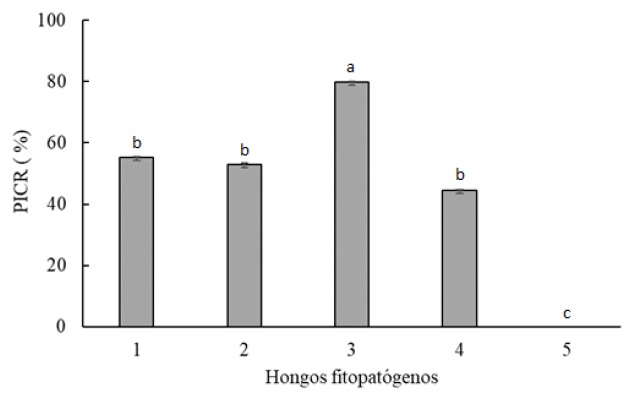
Figure 2: valuation of the antagonist activity of the Streptomyces sp. RL8 strain against plant pathogenic fungi, based on the percentage of radial growth inhibition (PICR). Fusarium sp. isolated from the stem of tobacco plants (1), Rhizoctonia solani (2), Macrophomina phaseolina (3), Fusarium sp. isolated from the stem of tomato plants (4) and Sclerotium rolfsii (5). Different letters show significant statistical difference (P <0.05).
Existen muchas investigaciones sobre la utilización de los actinomicetos como promotores del crecimiento de las plantas, y entre sus características favorables está poseer actividad antibacteriana o antifúngica (Jog, Nareshkumar y Rajkumar, 2016; Evangelista-Martínez, 2014). Muchas especies de actinomicetos, particularmente las que pertenecen al género Streptomyces, son bien conocidas como agentes de control biológico con actividad antimicótica, que inhiben el desarrollo de varios hongos fitopatógenos (Joo, 2005; Errakhi, Bouteau, Lebrihi y Barakate, 2007).
Evangelista-Martínez, Contreras, Corona y Gastélum (2020) observó una amplia actividad antagonista de la cepa Streptomyces spp. CACIS-1.16CA contra Colletotrichum sp., Alternaria sp., Aspergillus sp., Botrytis sp., Rhizoctonia sp., y Rhizopus sp. Por lo anterior, el manejo de fitopatógenos utilizando Streptomyces es una opción viable y una alternativa a los agentes químicos utilizados para su control en la agricultura (Heydary y Pessarakli, 2010; Talubnak y Soytong, 2010).
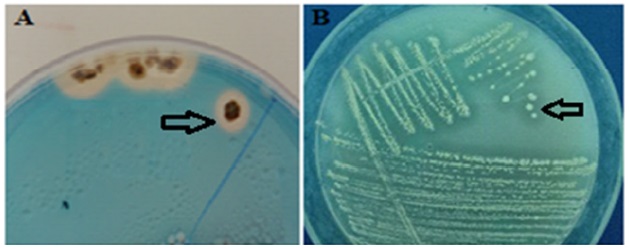
Se sabe que las especies de Streptomyces producen sideróforos, los cuales inhiben el crecimiento de fitopatógenos al limitar el hierro en la rizosfera (Khamna et al., 2009; Gopalakrishnan, Srinivas, Vidya y Rathore, 2013; Gopalakrishnan et al., 2014). La cepa RL8 produjo sideróforos, ya que se observó un halo de color naranja alrededor de las colonias cultivadas en el medio agar CAS (Figura 3A). Este medio de cultivo, con una coloración azul al momento de su preparación, se torna naranja en aquellas zonas donde crecen microorganismos con la capacidad de producir sideróforos (Aguado-Santacruz, Moreno, Jiménez, García y Preciado, 2012).
La cepa RL8 creció en medio Pikovskaya y la presencia de una zona clara alrededor de las colonias indicó cualitativamente la solubilización de fosfatos (Figura 3B). Jog, Nareshkumar y Rajkumar (2012) sugirieron que las cepas Streptomyces rochei, Streptomyces carpinensis y Streptomyces thermolilacinus tienen la capacidad de producir sideróforos en medio de agar CAS. Estas características son típicas de las actinobacterias asociadas a plantas; propiedades que se han relacionado con la promoción del crecimiento vegetal (Bouizgarne y Aouamar, 2014; Carvalho, Ma, Oliveira y Freitas, 2017).
El fósforo (P) es un nutriente esencial para el crecimiento y desarrollo de los cultivos (Díaz y Torrent, 2016; Wei et al., 2017). Las bacterias solubilizadoras de fosfatos (BSF), asociadas con la rizosfera de la planta, hacen que el fósforo mineral esté más fácilmente disponible para la absorción de la planta, al transformar su forma insoluble en otras formas disponibles para el cultivo. El efecto de las bacterias solubilizadoras de fosfatos (BSF) en las plantas se considera un mecanismo para mejorar su crecimiento y, por lo tanto, su productividad biológica (Maroniche, Rubio, Consiglio y Perticari, 2016).
Las BSF alteran la plasticidad de las semillas y de las raíces al cambiar la composición del suelo. Por ejemplo, las rizobacterias que promueven el crecimiento de las plantas pueden mejorar la solubilidad de los nutrientes minerales al liberar ácidos orgánicos, y, por lo tanto, aumentar la biomasa vegetativa y la acumulación de N y P en los tejidos de las plantas, estimulando su crecimiento (Zahir, Arshad y Frankenberger, 2004).
Durante el desarrollo del presente estudio, la cepa RL8 del actinomiceto Streptomyces sp. exhibió la capacidad para solubilizar fosfatos, de manera que podría considerarse una BSF con acción potencial sobre la plasticidad de semillas y raíces de algunas plantas de interés agrícola.
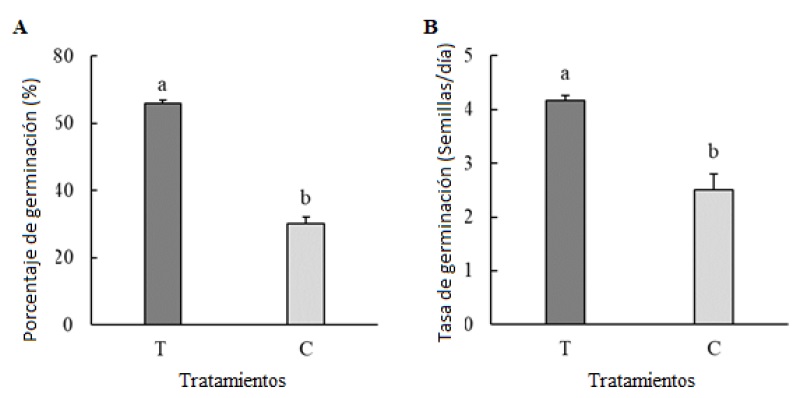
En la Figura 4 se muestran los resultados obtenidos en términos del porcentaje (PG %) y de la tasa (TG Semillas por día) de germinación de semillas de Phaseolus acutifolius Gray tratadas con Streptomyces sp. RL8. Los grupos experimentales mostraron diferencias significativas (P ≤ 0.05) en PG y TG, ya que al aplicar RL8 (T) se obtuvo una mayor respuesta en la germinación (65.83%) con respecto al grupo control (C) no tratado con RL8 que sólo fue de 30% (Figura 4A). Con relación al efecto de la cepa RL8 en la tasa de germinación, se encontraron diferencias significativas (P ≤ 0.05) con respecto al grupo control (C) (Figura 4B).
Figura 4: Efecto de Streptomyces sp. RL8 en el porcentaje de germinación (PG, A) y tasa de germinación (TG, B), de Phaseolus acutifolius Gray. T = Tratamiento bacteriano (RL8); C = Tratamiento control (Agua destilada estéril). Letras distintas muestran diferencia estadística significativa (P < 0.05).
En este estudio se demostró que el tratamiento con la cepa de Streptomyces sp. RL8 aumentó el porcentaje de germinación y la tasa de germinación de las semillas de frijol Tépari, al compararlas con el grupo control no tratado con esta actinobacteria. Este hallazgo es consistente con el resultado obtenido por Rae-Hyun y Song (2007), quienes reportaron que la aplicación de Rhodopseudomonas KL9 y Rhodopseudomonas BL6 incrementó el porcentaje de germinación de las semillas de tomate en un 31.8 y 7.6% respectivamente, en relación con las semillas del grupo control no tratadas.
Las diferencias en el incremento del porcentaje de germinación pueden depender del nivel de colonización bacteriana en la semilla, de las propiedades del recubrimiento de la semilla y de la cantidad de sustancias bacterianas que pueden penetrar en la semilla (Sturz y Nowak, 2000). Nuestros resultados coinciden con Lasudee, Tokuyama, Lumyong y Pathom-aree (2018) quienes afirman que el aislado de Streptomyces thermocarboxydus S3 aumentó el porcentaje de germinación de semillas de frijol Mungo, en comparación con el grupo control no tratado con este actinomiceto.
En un estudio realizado por Dochhil, Dkhar y Barman (2013), se describe la evidencia de actividad de dos cepas de Streptomyces spp. aisladas de Centella asiatica, como promotoras de la germinación de semillas y del crecimiento de las plantas, debido a que estas cepas realizan la síntesis de la hormona de crecimiento latente ácido indol acético (AIA). Por otro lado, Conn, Walker y Franco (2008) trataron semillas de Arabidopsis thaliana con Streptomyces spp. endofítico y Micromonospora spp. antes de la siembra, y observaron que las mismas estaban protegidas contra la infección por Erwinia carotovora y Fusarium oxysporum. Estos autores afirman también que estos microorganismos indujeron la expresión de los mecanismos de defensa de la planta contra estos fitopatógenos, observación que implica que los antagonistas microbianos inicialmente penetraron las semillas durante su germinación y posteriormente colonizaron las plántulas.
Durante la presente investigación, se pudo apreciar que hubo diferencias significativas en todas las variables morfométricas evaluadas (LT, LR, BFPA, BSPA, BFR y BSR) en el crecimiento inicial del frijol Tépari, con respecto al grupo control no tratado. Con respeto a la longitud del tallo (LT) y la longitud de la raíz (LR), se observaron diferencias significativas de estas mismas variables, al aplicar el tratamiento RL8, con respecto al grupo control no tratado (Figura 5). Igualmente, se observó un incremento en LT (13.09%) y en LR (16.33%), comparado con el grupo control no tratado.
En términos generales, se observaron diferencias significativas en todas las variables morfométricas evaluadas (Cuadro 1). Las plantas tratadas con la cepa RL8 presentaron mayor BFPA (2736.75), BSPA (608.75 mg), BFR (347.0) y BSR (101.25 mg), con respecto al grupo control no tratado.
Cuadro 1: Efecto de la cepa Streptomyces sp. RL8 en la producción de biomasa vegetal en plantas de frijol Tépari Phaseolus acutifolius Gray.
Table 1: Effect of the Streptomyces sp. RL8 strain in the production of plant biomass in Tépari bean Phaseolus acutifolius Gray plants.
| Tratamientos | BFPA | BFR | BSPA | BSR |
| - - - - - - - - - - - - - - - - - - mg- - - - - - - - - - - - - - | ||||
| T | 2736.75a | 347.0a | 608.75a | 101.25a |
| C | 1846.75b | 115.75b | 361.5b | 58.25b |
BFPA = biomasa fresca de parte aérea; BFR = biomasa fresca de la raíz; BSPA = biomasa seca parte aérea; BSR = biomasa seca de la raíz. Valores expresados como media±desviación estándar; medias con diferentes letras en la columna difieren significativamente (P < 0.05).
BFPA = fresh aerial part biomass; BFR = fresh root biomass; BSPA = aerial part dry biomass; DRB = root dry biomass. Values expressed as mean±standard deviation; means with different letters in the column differ significantly (P < 0.05).
Nuestros resultados coinciden con Dobbelaere et al. (2002), quienes informaron que la inoculación de Azospirillum brasilense en plantas de trigo y maíz produjo un aumento en el peso seco de la raíz y el peso seco de la parte aérea de las plantas tratadas. De igual manera, otros investigadores dieron a conocer incrementos en altura y peso seco de varias plantas estudiadas, en repuesta a su inoculación con agentes bacterianos promotores del crecimiento vegetal (Biswas, Ladha, J. K y Dazzo, 2000; Hilali, Przvost, Broughton y Antoun, 2001). Passari et al. (2016), en un estudio realizado, afirmaron que las actinobacterias endofíticas pueden aumentar la longitud y el peso de las raíces y los brotes de las plantas, así como el crecimiento general de la planta huésped. Los resultados obtenidos durante la presente investigación demuestran sin lugar a dudas un efecto positivo de la aplicación de la cepa RL8 como agente biológico promotor del crecimiento inicial de frijol Tépari (Phaseolus acutifolius Gray) bajo condiciones controladas. En este caso, los nutrientes movilizados por la actinobacteria RL8, muy probablemente contribuyeron de manera significativa para obtener un mayor crecimiento y desarrollo de las plantas de frijol.
Conclusiones
Los resultados obtenidos durante el presente estudio proporcionaron una fuerte evidencia de que la cepa Streptomyces sp. RL8 exhibe actividad in vitro frente a los hongos fitopatógenos Fusarium sp., Rhizoctonia solani Kühn, Sclerotinia sclerotiorum (Lib.) de Bary y Macrophomina phaseolina (Tassi) Goid, a escala experimental. La cepa RL8 produjo sideróforos, solubilizó fosfatos y mejoró la germinación de las semillas de frijol Tépari (Phaseolus acutifolius Gray), actuando como un eficaz promotor del crecimiento de esta especie de gran potencial agronómico, durante su etapa inicial del desarrollo en ambiente controlado. Esto permite asumir que la cepa RL8 es una actinobacteria utilizable en el control biológico de fitopatógenos fúngicos, y que adicionalmente, promueve la productividad del frijol Tépari, por lo que se sugiere su aplicación a escala piloto, independientemente de continuar su evaluación en condiciones de invernadero y campo, para confirmar su potencial aplicabilidad productiva en sistemas de producción orgánica y convencional.
Fondos
El estudio fue financiado por CONACYT, Programa Presupuestario F003 “Programas Nacionales Estratégicos de Ciencia, Tecnología y Vinculación con los Sectores Social, Público y Privado”, proyecto CIENCIA BÁSICA No. 258282 y PROINNOVA No. 241777, a cargo de JMMS.
Contribución de los Autores
Diseño conceptual del estudio, administración del proyecto de investigación, revisión y validación de manuscritos: J.M.M.S. Conceptualización, análisis y revisión: R.M.M. Conceptualización, análisis y preparación del manuscrito original, revisión y edición: M.G.B. Software, revisión y edición: M.G.B y C.M.O.S. Metodología, revisión y edición: F.A.P. y G.F.A.O.











 nova página do texto(beta)
nova página do texto(beta)