Introducción
El sector agropecuario ecuatoriano constituye un pilar fundamental para el desarrollo socioeconómico del país. En la región Amazónica, la agricultura es la principal fuente de empleo en el sector rural. El café, plátano, maíz, yuca, piña y caña de azúcar son cultivos representativos de la zona, asimismo se ha implementado el cultivo de arroz (Caicedo, 2020). No obstante, la productividad agrícola en la zona es baja debido a la mala calidad del suelo por diversos contaminantes. Este factor ha limitado el óptimo establecimiento de los agroecosistemas en la región Amazónica del Ecuador (Bravo et al., 2017; Vargas, Nicolalde, Calero y Vizuete, 2018).
El término calidad es subjetivo y se pueden encontrar diversas definiciones de calidad de suelo, según diferentes autores (Estrada-Herrera et al., 2017). Mientras unos autores lo definen de manera sencilla como la condición de un suelo para un uso determinado (Gregorich, Carter, Angers, Monreal y Ellert, 1994), otros indican que la calidad de suelo se refiere a la condición de éste para mantener el crecimiento de las plantas sin que ocurra degradación ni daños en el medio ambiente (Acton y Gregorich, 1995). Un concepto más amplio define la calidad como la capacidad de un tipo específico de suelo para funcionar, dentro de los límites de los ecosistemas naturales o gestionados, para mantener la productividad de las plantas y los animales, mantener o mejorar la calidad del agua y el aire, y respaldar la salud humana y los hábitat (Karlen et al., 1997; Bünemann et al., 2018; Muñoz-Rojas, 2018).
La calidad de los suelos, en función de la fertilidad y productividad, requiere ser mejorada y conservada para alcanzar la sustentabilidad de los agroecosistemas (Hou, Bolan, Tsang, Kirkham y O’Connor, 2020; Tahat, Alananbeh, Othman y Leskovar, 2020). Para esto se debe evaluar la calidad, primeramente, tomando en cuenta variables que determinen la fertilidad del mismo. Este concepto ha sido el indicador más usado para medir el estado y la manera como se comportan los suelos agrícolas y forestales (Brady, 1990; Havlin, Tisdale, Nelson y Beaton, 1999). Por otro lado, la fertilidad del suelo es un concepto más amplio, que integra los atributos químicos (CIC, pH, capacidad amortiguadora, nutrientes) físicos (estructura, porosidad, textura, color) y biológicos (microorganismos, principalmente bacterias y hongos) del suelo (Bautista-Cruz, Etchevers, del Castillo y Gutiérrez, 2004; Wilson, 2017).
Se han realizado diversos trabajos con la finalidad de evaluar la fertilidad del suelo. En la mayoría se estudian por separado los atributos mencionados anteriormente (Adams, ZaVala y Morales, 2008; Bravo et al., 2017). Sin embargo, aún son escasas las investigaciones que integran estos atributos (López-Hernández, Hernández y Güerere, 2008; Castillo-Valdez, Etchevers, Hidalgo y Aguirre, 2021), con variables ambientales y espectrales como el índice de diferencia normalizada (NDVI: normalized difference vegetation index) y el índice de vegetación mejorado (EVI: enhanced vegetation index). Con un estudio conjunto se daría una explicación integral (Tarqui, 2018; Barreiro y Diezma, 2020; Mogollón y Rivas, 2021), que proporcione suficiente información para tomar decisiones y gestionar este recurso de manera sostenible.
Por lo anterior, el objetivo de este trabajo fue identificar el potencial agrícola de suelos ubicados en la región nororiental de la Amazonía Ecuatoriana, a partir de variables físico-químicas, microbiológicas y ambientales, con la finalidad de evaluar el estado actual de los suelos y generar información útil para facilitar el manejo de este recurso por parte de agricultores y tomadores de decisiones. Esto ayudará también a generar estrategias y optimizar metodologías para mejorar el suelo, tales como la biorremediación, fertilización, prácticas de manejo, entre otras.
Materiales y Métodos
Sitio de estudio
La zona de estudio comprende parte de la región nororiental de la Amazonia Ecuatoriana, específicamente de la zona Chone I y II, de la parroquia rural Pacayacu, perteneciente al cantón Lago Agrio en la provincia Sucumbíos. La zona presenta área con relieves altamente ondulados y disectados, suelos en terrazas fluviales aledañas a los ríos con las siguientes condiciones climáticas: helofania (11h), humedad (87%), presión (1 015.60 mbar), punto de rocío (20 ºC), altitud (300 m de altitud), pluviosidad (2800 a 3500 mm por año). Además, presenta una cobertura vegetal y uso de suelo con la siguiente distribución: bosque intervenido (5.72%), bosque natural (66.31%), cultivo de ciclo corto (7.77%) y pasto (20.20%), (GADPR PACAYACU, 2021).
Muestras de suelo
Las muestras de suelo se tomaron de los principales agroecosistemas de la zona, siguiendo la metodología y recomendaciones descritas por Osorio (2012). En cada lugar se tomó una muestra compuesta a partir de cinco submuestras tomadas al azar, recorriendo el terreno en zig-zag. En cada punto se tomó un área de 40 cm×40 cm del suelo removiendo las plantas y hojarasca de la superficie, posteriormente, con una pala se hizo un hueco en forma de “V” de 20 cm de profundidad y se tomaron 200 g de suelo que fueron transferidos a un balde limpio. Las herramientas se limpiaron después de tomar cada submuestra. Finalmente, las submuestras se mezclaron en el balde para obtener homogeneidad y se tomó 1 kg de suelo que se introdujo a una bolsa plástica limpia que se etiquetó con el nombre y número del terreno muestreado y con un código de identificación. En cada sitio de muestreo se registraron datos de los cultivos que se realizan, sector, y coordenadas geográficas (Cuadro 1). Las muestras se trasladaron a los laboratorios correspondientes lo más pronto posible para determinar variables físico-químicas, y biológicas a una temperatura de refrigeración de entre 4 y 10 grados centígrados.
Table 1: Soil sampling sites in the northeastern region of the Ecuadorian Amazon.
| Suelo | Sector | Cultivo | Coordenadas |
|---|---|---|---|
| S1 | Chone 1 | Pastos | 0° 11' 58.9" N 76° 31' 23.8" O |
| S2 | Chone 2 | Caña de azúcar, café | 0° 12' 08.9" N 76° 31' 09.4" O |
| S3 | Chone 1 | Pastos | 0° 11' 54.4" N 76° 30' 98.7" O |
| S4 | Chone 2 | Coco, café, pasto, aguacate, cacao, guaba, achiote, uva de árbol | 0° 12' 59.0" N 76° 30' 77.7" O |
| S5 | Chone 1 | Palma africana | 0° 10' 98.5" N 76° 31' 44.6" O |
| S6 | Chone 1 | Pastos | 0° 10' 99.8" N 76° 31' 27.2" O |
| S7 | Chone 2 | Cacao, plátano, café, caña de azúcar. | 0° 12' 40.5" N 76° 30' 88.2" O |
| S8 | Chone 2 | Naranja, cacao, coco, bambú, cabuya | 0° 12' 25.5" N 76° 30' 90.5" O |
| S9 | Chone 1 | Pastos | 0° 11' 84.0" N 76° 31' 14.7" O |
| S10 | Chone 1 | Guaba, caña de azúcar, limón, coco | 0° 11' 52.3" N 76° 31' 15.9" O |
Determinación físico-química de muestras de suelo
El análisis físico-químico se realizó en el laboratorio del Instituto Nacional de Investigaciones Agropecuarias (INIAP) unidad Pichilingue del cantón Quevedo, provincia Los Ríos, donde se determinaron las siguiente variables: pH , N, P, K, Ca, Mg, S, Fe, Cu, Mn, Zn, B, materia orgánica, textura, acidez intercambiable (Al, Al+H), Conductividad eléctrica (C.E.). Así mismo, se determinaron la densidad aparente (D.A.) y la humedad gravitatoria (H.G.). La determinación de estas variables se realizó mediante metodologías estandarizadas en el laboratorio de referencia (INIAP). El pH se determinó con la mezcla suelo: agua (1:2.5), el N, P y B por colorimetría, el S por turbidimetría, los elementos K, Ca, Mg, Cu, Fe, Mn y Zn por absorción atómica. La determinación de la C.E., fue mediante un conductímetro, el porcentaje de materia orgánica (M.O.) se determinó por el método Walkley Black y Al + H mediante la titulación con NaOH (Walkley y Armstrong, 1934). Además, se realizó un análisis de plomo (Pb) y cadmio (Cd) utilizando como instrumento de análisis un espectrofotómetro de absorción atómica acoplado a un horno de grafito (EEA-HGA), usando el método de extracción en suelo (semitotal) (agua regia (HNO3-HCL) relación 3:1).
Se usaron atributos del suelo que involucran pH, NH4, P, S, materia orgánica, conductividad eléctrica, capacidad de intercambio catiónico, cationes intercambiables (Ca, Mg, K, Na, Mn, B, Al) y metales pesados (Zn, Cu, Cd, Pb, Fe) para describir sus características. Las variables para definir el índice de fertilidad potencial (IFP) del suelo fueron seleccionadas por la relación con la densidad de cargas negativas de los suelos (Cuadro 2). Para la definición del IFP se utilizaron dos ecuaciones descritas por Prieto-Méndez, Prieto, Acevedo y Méndez (2013), dependiendo si el límite máximo de la variable hace referencia a la mejor condición de fertilidad (Ecuación 1) o si el límite máximo de la variable hace referencia a la peor condición de fertilidad (Ecuación 2). Donde, Vobs = valor de las variables observado en el análisis de laboratorio, Vmin = valor mínimo de las variables, Vmax= valor máximo de las variables (Cuadro 2)
Cuadro 2: Valores mínimos y máximos de variables edáficas, determinantes del índice de fertilidad potencial (IFP) de suelos agrícolas.
Table 2: Minimum and maximum values of edaphic variables, determinants of the potential fertility index (PFI) of agricultural soils.
| Variables | Unidad | Límites | |
| Mínimo | Máximo | ||
| pH | 3.50 | 7.00 | |
| SR - Bases | 0.01 | 1.00 | |
| SR - Al+H | 0.01 | 1.00 | |
| C.O. | mg kg-1 | 1.00 | 23 250.00 |
SR = saturación relativa; C.O. = carbono orgánico.
SR = relative saturation; C.O. = organic carbon.
Conteo de bacterias por el método de recuento en placa por siembra en superficie
Para evaluar la carga bacteriana total en cada muestra de suelo (Unidades Formadora de Colonias: UFC/gr), se utilizó la metodología de recuento en placa, que consiste en realizar diluciones seriadas 1:10 y extender 100µl de cada dilución en una placa; las placas se incuban hasta que las colonias son apreciables para su recuento (Hoben y Somasegaran, 1982). Previamente, se preparó un medio de cultivo general Tripticasa Soya Agar (TSA) para favorecer el crecimiento de bacterias mesófilas. Se procesó el suelo siguiendo metodologías estandarizadas (Osorio, 2012). Las placas se incubaron a 35 ºC. Después de 24-48 h, se determinó el número total de UFC por conteo directo utilizando un contador de colonias. Adicionalmente, con la finalidad de obtener bacterias del género Pseudomonas y Bacillus, por ser las bacterias más representativas del suelo y con más uso en procesos de biorremediación y control biológico, las muestras fueron inoculadas en medio de cultivo King B y sometidas a temperaturas elevadas para favorecer la producción de endosporas. Finalmente, se conservaron las cepas para futuros trabajos.
Análisis espaciales y espectrales
Para buscar una relación entre el ambiente, la condición de los suelos y su potencial para uso agrícola, se realizaron análisis espaciales y espectrales que describen las condiciones del paisaje en los sitios de estudio. El potencial de las métricas espectrales como el índice de vegetación de diferencia normalizada (NDVI) y derivadas del NDVI para el monitoreo de la vegetación es importante, para obtener una mayor comprensión de las relaciones paisaje-calidad del suelo (Verhulst et al., 2009). Estas métricas son sensibles a la condición del suelo, las características topográficas y la fenología de la vegetación (Ayalew, Deumlich, Šarapatka y Doktor, 2020).
En cada uno de los puntos de muestreo del suelo se creó una parcela digital circular de 500 m de diámetro (área de 19.63 ha y perímetro externo de 1570.8 m), en las cuales se midieron una serie de indicadores relacionados con la estructura de los hábitats (usos del suelo, tipos de ecosistemas) y disposición espacial de factores socio-ambientales basado en la distancia a centros poblados. Se emplearon como variables para la descripción espectral del área de cada parcela los índices de reflectancia en la longitud de onda del infrarrojo cercano (NIR: near infrared reflectance) por tener intervalos de longitud de onda en los cuales la reflectancia de la vegetación tiene los mayores valores porcentuales según las firmas espectrales definidas (NASA, 2013). Así mismo, se obtuvieron dos índices de vegetación: el índice de diferencia normalizada (NDVI: normalized difference vegetation index) y el índice de vegetación mejorado (EVI: enhanced vegetation index).
Los datos espectrales se obtuvieron de las imágenes del producto MODIS13A1 que se obtienen por los satélites Terra y Aqua (resolución 250 m), del escenario h10v08. La resolución temporal es de 16 días por lo que se lograron dos valores mensuales entre 01/05/21 y 31/09/21 (total 210 registros). Se utilizaron solo los datos de mayor confiabilidad (píxeles marcados como “good data, use with confidence”) en la capa de pixel reliability, y se excluyeron todos aquellos donde se detectaban nubes, sombras de nubes y niveles de aerosoles elevados. Con este filtro se redujo la muestra a 47 valores. Se obtuvieron los promedios por cada punto de muestreo ya que las variaciones mensuales no eran de interés. Los datos fueron tomados a través de la plataforma AρρEEARS (application for extracting and exploring analysis ready samples) del servicio USGS de los Estados Unidos.
Se utilizó la herramienta IDW (ponderación de distancia inversa) de ArcGis v10.4 (Esri, 2015), para representar espacialmente la variación de la concentración de metales pesados como plomo, cadmio y aluminio entre las zonas de influencia (3 km) alrededor de los puntos de muestreo. Este método utiliza una interpolación que estima los valores para las celdas de un ráster a partir de una cantidad limitada de puntos georreferenciados (puntos de muestreo), calculando valores promedios de los datos de la muestra en la vecindad de cada celda geoprocesada. Cuanto más cerca está un punto del centro de la celda que se está estimando (concentraciones químicas), mayor influencia o peso tendrá en el proceso de cálculo del promedio (Cañada, 2008). De esta manera se pudo identificar geográficamente, cuáles zonas alrededor del área de estudio tendrían mayor o menor concentración de metales, con vistas a la utilización como zona de cultivo o para objetivos de remediación.
Análisis estadístico
Para los análisis estadísticos de los datos se hizo una correlación múltiple, en donde se consideraron todas las variables físico-químicas que influyen en mayor o menor grado en la fertilidad del suelo. En base al análisis de correlaciones, las que resultaron positivas se les hizo una análisis de regresión lineal múltiple. Para lo anterior se utilizaron los programas estadísticos GraphPrint ver.1.01 (Plus 4/World, 1992) y XLSTAT ver. 2014 (Addinsoft, 2014). Para identificar las diferencias en el conteo de UFC en muestras de suelos, los datos se sometieron a una prueba de ADEVA (P< 0.05), tomando en cuenta los criterios de normalidad y homocedasticidad. Para esto se utilizó el programa estadístico InfoStat ver. 2017 (Di-Rienzo et al., 2017).
Resultados y Discusión
La cantidad de partículas sólidas asociadas a la arena y a la arcilla, fue más variable en comparación a lo observado a nivel de limo, siendo el contenido de arena, limo y arcilla de 283±115.5, 278±52.4 y 439±124.9 g kg-1, respectivamente (Cuadro 3). Si se considera la proporción promedio de arena, limo y arcilla, los suelos evaluados se encuentran dentro de la clase textural arcillosa de acuerdo al triángulo de textura de suelo del USDA (United States Department of Agriculture) (Schoeneberger, Wysocki y Benham, 2012). Esta clase textural se asocia dominantemente a suelos desarrollados, lo que concuerda al relacionar la ubicación del sitio de estudio con el mapa de suelos del Ecuador, ya que la localidad de Pacayacu (sitio de estudio) en la provincia Sucumbíos (región nororiental de la Amazonía Ecuatoriana) tiene suelos pertenecientes al orden inceptisol.
Cuadro 3: Estadística descriptiva de variables físicas, químicas y ambientales de suelos agrícolas de la zona nororiental de la Amazonía Ecuatoriana.
Table 3: Descriptive statistics of physical, chemical and environmental variables of agricultural soils in the northeastern zone of the Ecuadorian Amazon.
| Variables | Unidad | Media ± SD | EE | Mínimo | Máximo |
| Físicas | |||||
| Arena | g kg-1 | 283.00 ± 115.59 | 38.53 | 130.00 | 490.00 |
| Limo | g kg-1 | 278.00 ± 52.50 | 17.50 | 180.00 | 360.00 |
| Arcilla | g kg-1 | 439.00 ± 124.94 | 41.64 | 230.00 | 630.00 |
| CMAA | g g-1 | 0.31 ± 0.05 | 0.01 | 0.23 | 0.38 |
| Químicas | |||||
| N-NH4 | mg kg-1 | 23.60 ± 10.99 | 3.66 | 12.00 | 40. 00 |
| P | mg kg-1 | 5.50 ± 1.63 | 0.54 | 3.00 | 9.00 |
| K | mEq 100 mL-1 | 0.17± 0.21 | 0.07 | 0.06 | 0.80 |
| Ca | mEq 100 mL-1 | 6.30 ± 0.46 | 0.15 | 6.00 | 7.00 |
| Mg | mEq 100 mL-1 | 0.82 ± 0.22 | 0.07 | 0.60 | 1.20 |
| S | mg kg-1 | 8.70 ± 2.37 | 0.79 | 6.00 | 14.00 |
| Zn | mg kg-1 | 4.00 ± 2.83 | 0.94 | 1.40 | 11.20 |
| Cu | mg kg-1 | 4.99 ± 1.79 | 0.60 | 2.70 | 8.80 |
| Fe | mg kg-1 | 232.60 ± 48.92 | 16.31 | 150.00 | 289.00 |
| Mn | mg kg-1 | 45.24 ± 42.62 | 14.21 | 2.20 | 135.00 |
| B | mg kg-1 | 0.23 ± 0.02 | 0.01 | 0.20 | 0.27 |
| pH | 4.74 ± 0.38 | 0.13 | 3.90 | 5.30 | |
| Al | mEq 100 mL-1 | 3.72 ± 2.03 | 0.68 | 1.37 | 7.51 |
| Al + H | mEq 100 mL-1 | 5.79 ± 2.82 | 0.94 | 1.96 | 10.52 |
| CICE | mEq 100 mL-1 | 13.10 ± 3.23 | 1.08 | 9.62 | 19.74 |
| Ca Mg-1 | 7.76 ± 2.10 | 0.70 | 3.30 | 10.00 | |
| Mg K-1 | 10.29 ± 4.11 | 1.37 | 4.29 | 17.50 | |
| (Ca + Mg) K-1 | 83.44 ± 22.19 | 7.40 | 47.14 | 117.14 | |
| SR - Bases | 0.58 ± 0.12 | 0.04 | 0.45 | 0.81 | |
| SR - Al + H | 0.42 ± 0.12 | 0.04 | 0.19 | 0.55 | |
| Ambientales | |||||
| C.O. | mg kg-1 | 8023.26 ± 1889.31 | 629.77 | 5813.95 | 10 465.12 |
| Cd | mg kg-1 | 0.13 ± 0.05 | 0.02 | 0.04 | 0.24 |
| Pb | mg kg-1 | 59.35 ± 7.42 | 2.47 | 46.10 | 73.60 |
CMAA = capacidad máxima de almacenamiento de agua, CICE = capacidad de intercambio catiónico efectivo, SR = saturación relativa, C.O. = carbono orgánico, SD = desviación estándar, EE = error estándar de la media, n = 10.
CMAA = maximum water storage capacity, CICE = effective cation exchange capacity, SR = relative saturation, C.O. = organic carbon, SD = standard deviation, EE = standard error of the mean, n = 10.
Los inceptisoles desarrollados en zonas tropicales (abundante precipitación) suelen llegar a tener aluminio intercambiable (Al+3) en niveles tóxicos para los cultivos (Nogueirol, Monteiro, Gratão, Borgo y Azevedo, 2015), lo que concuerda con el presente estudio, en donde se observó un nivel promedio de Al y Al+H de 3.7 y 5.7 mEq 100 mL-1 respectivamente, con una saturación relativa de bases (SR-Bases) de 0.58 y en consecuencia una saturación de Al+H del 42% (Cuadro 3).
En suelos cultivados con baja saturación de bases (<90%) y alta saturación de Al (>10%) permiten evidenciar un mal manejo de la fertilidad del suelo (Whitley, Moir y Almond, 2019), lo que explica dominantemente el desbalance de bases (K, Ca, Mg) observado en el presente estudio. Las relaciones observadas de Ca Mg-1, Mg K-1 y (Ca+Mg) K-1 fueron de 7.7, 10.2 y 83.4, respectivamente (Cuadro 3). Por ejemplo, la relación Ca Mg-1 de 7.7 es superior a 4±1 (valor más frecuente reportado como adecuado en la literatura técnica), lo que sugiere que las plantas eventualmente pueden estar sujetas a carencias de Mg, por una interferencia a nivel edáfico entre los iones Mg y Ca.
Una saturación de Al+H superior a los valores agronómicamente aceptables generalmente coincide con un pH (4.7) ácido (Cuadro 3), condición que debe ser observada debido a que el pH del suelo controla la biodisponibilidad de metales pesados como el Cd y el Pb (Draszawka-Bołzan, 2017). En los suelos evaluados, la concentración de Cd y Pb fue de 0.13 y 59.35 mg kg-1, respectivamente (Cuadro 3), y no superaron los valores máximos establecidos por regulación del CCME (Canadian Council of Ministers of the Environment) Emurotu y Onianwa, 2017), de 1.4 y 70 mg kg-1, respectivamente.
En el Cuadro 4 se observa una relación significativa directa entre el pH y el Ca y Mg, con coeficientes de correlación (r) de 0.67 y 0.80, respectivamente. Se observó una relación significativa inversa entre la SR-Bases y las variables Al (r = -0.81), Al+H (r = -0.94) y CICE (r = -0.84), y una relación significativa directa con la variable (Ca+Mg) K-1 (r = 0.84) (Cuadro 5). Las correlaciones descritas, aportan criterios que permiten explicar de manera más amplia la baja biodisponibilidad de los microelementos esenciales (excepto Mo) que se observa en los suelos a medida que disminuye el pH (Jones, 2012). El C.O. también muestra una relación significativa directa con la variable SR-Bases (r = 0.66) (Cuadro 5), lo que sugiere que el C.O. también está relacionado con la biodisponibilidad de los elementos esenciales para las plantas.
Cuadro 4: Análisis de correlación entre variables físico-químicas de suelos agrícolas de la zona nororiental de la Amazonía ecuatoriana.
Table 4: Correlation analysis between physical-chemical variables of agricultural soils in the northeastern zone of the Ecuadorian Amazon.
| Arena | Limo | Arcilla | CMAA | NH4 | P | K | Ca | Mg | S | Zn | Cu | Fe | Mn | |
| Arena | 1.00 | |||||||||||||
| Limo | -0.04 | 1.00 | ||||||||||||
| Arcilla | -0.91 | -0.38 | 1.00 | |||||||||||
| CMAA | -0.37 | 0.00 | 0.34 | 1.00 | ||||||||||
| NH4 | 0.39 | -0.32 | -0.23 | -0.10 | 1.00 | |||||||||
| P | 0.11 | 0.46 | -0.30 | -0.21 | 0.16 | 1.00 | ||||||||
| K | 0.07 | -0.21 | 0.02 | 0.01 | 0.31 | -0.11 | 1.00 | |||||||
| Ca | 0.36 | 0.27 | -0.45 | -0.06 | -0.20 | -0.20 | -0.20 | 1.00 | ||||||
| Mg | 0.65 | 0.39 | -0.77 | -0.08 | -0.06 | 0.06 | -0.33 | 0.84 | 1.00 | |||||
| S | -0.20 | 0.11 | 0.14 | 0.30 | -0.55 | 0.07 | -0.10 | -0.19 | -0.24 | 1.00 | ||||
| Zn | 0.33 | 0.50 | -0.51 | -0.29 | 0.27 | 0.62 | -0.23 | 0.45 | 0.47 | -0.10 | 1.00 | |||
| Cu | 0.37 | 0.64 | -0.61 | -0.08 | 0.10 | 0.63 | -0.22 | 0.31 | 0.44 | 0.30 | 0.86 | 1.00 | ||
| Fe | 0.56 | 0.36 | -0.67 | -0.50 | 0.39 | 0.42 | -0.01 | 0.03 | 0.24 | 0.05 | 0.59 | 0.70 | 1.00 | |
| Mn | 0.38 | 0.50 | -0.56 | -0.06 | -0.13 | 0.06 | 0.14 | 0.78 | 0.62 | 0.12 | 0.63 | 0.64 | 0.33 | 1.00 |
| B | -0.34 | 0.26 | 0.21 | -0.04 | -0.69 | -0.34 | -0.27 | 0.57 | 0.32 | -0.05 | -0.13 | -0.24 | -0.36 | 0.21 |
| pH | 0.33 | 0.57 | -0.54 | 0.19 | -0.54 | 0.10 | -0.32 | 0.67 | 0.81 | 0.20 | 0.24 | 0.41 | -0.03 | 0.59 |
| Al | -0.29 | 0.70 | -0.03 | 0.23 | -0.01 | 0.34 | -0.14 | 0.40 | 0.23 | -0.04 | 0.68 | 0.60 | 0.16 | 0.56 |
| Al+H | -0.31 | 0.54 | 0.06 | 0.16 | 0.15 | 0.26 | -0.19 | 0.23 | 0.05 | 0.03 | 0.66 | 0.59 | 0.35 | 0.40 |
| CICE | -0.14 | 0.56 | -0.11 | 0.13 | 0.14 | 0.23 | -0.23 | 0.45 | 0.27 | -0.03 | 0.76 | 0.66 | 0.36 | 0.57 |
| Ca Mg-1 | -0.61 | -0.50 | 0.78 | 0.02 | -0.10 | -0.25 | 0.34 | -0.75 | -0.92 | 0.22 | -0.70 | -0.67 | -0.33 | -0.69 |
| Mg K-1 | 0.66 | 0.16 | -0.67 | -0.26 | -0.06 | 0.16 | -0.27 | 0.68 | 0.79 | -0.20 | 0.49 | 0.38 | 0.08 | 0.56 |
| (Ca+Mg) K-1 | 0.23 | -0.27 | -0.10 | -0.24 | -0.38 | -0.09 | -0.13 | 0.15 | 0.21 | -0.06 | -0.24 | -0.33 | -0.47 | -0.06 |
| SR-Bases | 0.50 | -0.48 | -0.26 | -0.23 | -0.15 | -0.26 | 0.14 | 0.06 | 0.21 | -0.07 | -0.46 | -0.43 | -0.28 | -0.14 |
| SR-Al+H | -0.50 | 0.48 | 0.26 | 0.23 | 0.15 | 0.26 | -0.14 | -0.06 | -0.21 | 0.07 | 0.46 | 0.43 | 0.28 | 0.14 |
| C.O. | -0.14 | -0.50 | 0.33 | -0.11 | -0.48 | -0.61 | -0.06 | 0.24 | 0.02 | -0.10 | -0.55 | -0.72 | -0.70 | -0.16 |
| Cd | 0.12 | -0.42 | 0.06 | 0.06 | 0.70 | -0.32 | 0.11 | -0.28 | -0.24 | -0.24 | -0.14 | -0.14 | 0.35 | -0.33 |
| Pb | -0.77 | -0.01 | 0.72 | 0.39 | -0.20 | -0.38 | 0.24 | 0.08 | -0.40 | 0.06 | -0.15 | -0.28 | -0.44 | 0.09 |
CMAA = capacidad máxima de almacenamiento de agua, CICE = capacidad de intercambio catiónico efectivo, SR = saturación relativa, C.O. = carbono orgánico, valores resaltados en negritas representan coeficientes de regresión significativos (P < 0.05). n = 10.
CMAA = maximum water storage capacity, CICE = effective cation exchange capacity, SR = relative saturation, C.O. = organic carbon, values highlighted in bold represent significant regression coefficients (P < 0.05). n = 10.
Cuadro 5: Análisis de correlación entre variables físicas, químicas y ambientales de suelos agrícolas de la zona nororiental de la Amazonía ecuatoriana.
Table 5: Correlation analysis between physical, chemical and environmental variables of agricultural soils in the northeastern zone of the Ecuadorian Amazon.
| B | pH | Al | Al+H | CICE | Ca Mg-1 | Mg K-1 | (Ca+Mg) K-1 | SR-Bases | SR-Al+H | C.O. | Cd | Pb | |
| B | 1.00 | ||||||||||||
| pH | 0.44 | 1.00 | |||||||||||
| Al | 0.21 | 0.26 | 1.00 | ||||||||||
| Al+H | 0.07 | -0.03 | 0.91 | 1.00 | |||||||||
| CICE | 0.14 | 0.15 | 0.93 | 0.97 | 1.00 | ||||||||
| Ca Mg-1 | -0.06 | -0.72 | -0.46 | -0.29 | -0.49 | 1.00 | |||||||
| Mg K-1 | 0.07 | 0.66 | 0.06 | -0.17 | 0.06 | -0.81 | 1.00 | ||||||
| (Ca+Mg) K-1 | 0.15 | 0.33 | -0.52 | -0.75 | -0.64 | -0.08 | 0.61 | 1.00 | |||||
| SR-Bases | -0.01 | 0.22 | -0.81 | -0.95 | -0.84 | 0.02 | 0.45 | 0.84 | 1.00 | ||||
| SR-Al+H | 0.01 | -0.22 | 0.81 | 0.95 | 0.84 | -0.02 | -0.45 | -0.84 | -1.00 | 1.00 | |||
| C.O. | 0.55 | 0.10 | -0.51 | -0.62 | -0.55 | 0.25 | 0.21 | 0.73 | 0.66 | -0.66 | 1.00 | ||
| Cd | -0.40 | -0.62 | -0.18 | 0.17 | 0.09 | 0.22 | -0.49 | -0.63 | -0.26 | 0.26 | -0.33 | 1.00 | |
| Pb | 0.44 | -0.26 | 0.47 | 0.49 | 0.41 | 0.39 | -0.52 | -0.42 | -0.55 | 0.55 | 0.14 | 0.05 | 1.00 |
SR = saturación relativa, C.O. = carbono orgánico, valores resaltados en negritas representan coeficientes de regresión significativos (P < 0.05). n = 10.
SR = relative saturation, C.O. = organic carbon, values highlighted in bold represent significant regression coefficients (P < 0.05). n = 10.
El índice de fertilidad del suelo definido a partir de las variables edáficas pH, C.O., SR-Bases y SR-Al+H, tuvo un valor promedio de 0.47 ± 0.09 (Cuadro 6), con un valor mínimo de 0.33 (Suelo 1) y un valor máximo de 0.65 (Suelo 8). Los mayores valores de fertilidad potencial se obtuvieron de la variable SR-Al+H para varias muestras de suelo (Suelo 4 y 8).
Cuadro 6: Variables edáficas e índice de fertilidad potencial (IFP) de suelos agrícolas de la zona nororiental de la Amazonía ecuatoriana.
Table 6: Edaphic variables and potential fertility index (IFP) of agricultural soils in the northeastern zone of the Ecuadorian Amazon.
| Variables | Índice de fertilidad potencial (IFP) de cada suelo por variable | |||||||||
| Suelo 1 | Suelo 2 | Suelo 3 | Suelo 4 | Suelo 5 | Suelo 6 | Suelo 7 | Suelo 8 | Suelo 9 | Suelo 10 | |
| pH | 0.11 | 0.29 | 0.26 | 0.31 | 0.37 | 0.40 | 0.43 | 0.51 | 0.40 | 0.46 |
| C.O. | 0.30 | 0.43 | 0.35 | 0.45 | 0.30 | 0.25 | 0.25 | 0.45 | 0.25 | 0.43 |
| SR - Bases | 0.44 | 0.67 | 0.67 | 0.69 | 0.46 | 0.46 | 0.46 | 0.81 | 0.64 | 0.50 |
| SR - Al+H | 0.45 | 0.68 | 0.68 | 0.70 | 0.47 | 0.47 | 0.47 | 0.82 | 0.65 | 0.51 |
| IFP promedio | 0.33 | 0.51 | 0.49 | 0.54 | 0.40 | 0.39 | 0.40 | 0.65 | 0.48 | 0.47 |
SR = saturación relativa; C.O. = carbono orgánico; IFP = índice de fertilidad potencial. El IFP varía de 0 a 1 (valor 1 asociado al mejor IFP).
SR = relative saturation, C.O. = organic carbon; IFP = index of potential fertility. The IFP ranges from 0 to 1 (value 1 associated with the best IFP).
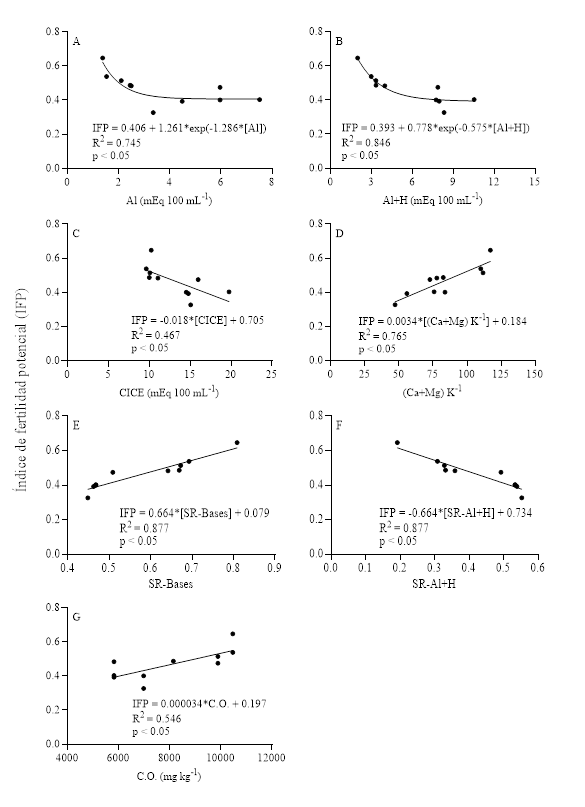
El análisis de regresión entre las variables edáficas evaluadas y el IFP indicó que las variaciones en el IFP pueden ser explicadas de forma significativa a partir de las variables Al, Al+H (acidez potencial), CICE, (Ca+Mg) K-1, SR-Bases, SR-Al+H y C.O. (Figura 1). Las variables Al y Al+H se relacionaron de forma exponencial inversa con el IFP (Figura 1A y 1B), mientras que la CICE y SR-Al+H se relacionaron negativamente con el IFP (Figura 1C y 1F). Finalmente, las variables (Ca+Mg) K-1, SR-Bases y CO se relacionaron positivamente con el IFP (Figura 1D, 1E, 1G).
En términos generales, estas relaciones inversas y positivas entre las variables edáficas y el IFP pueden ser explicadas a partir de la química y la fertilidad de los suelos, excepto la relación lineal inversa observada entre la CICE y el IFP (Figura 1C), debido a que la CICE se asocia a la capacidad del suelo de retener elementos químicos (Ca, Mg, K) que contribuyen a mejorar la fertilidad de los suelos (Jones, 2012). Esto se corrobora en la Figura 1D. Lo observado en la Figura 1C es posible explicarlo señalando la existencia de un balance negativo entre las entradas y salidas, balance que en suelos ácidos estaría provocando que los sitios de intercambio se ocupen por H y Al (elementos que causan una caída en el IFP como se ve en la Figura 1A, 1F).
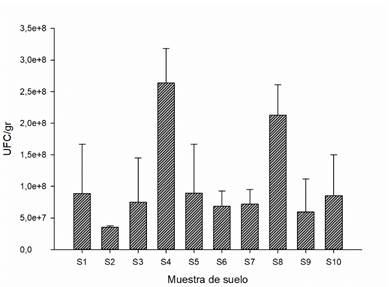
El conteo de bacterias para cada una de las muestras de suelo analizadas no mostró diferencias significativas, sin embargo, los suelos S4 y S8 presentaron los valores más altos de UFC/gr con 2.64×108 y 2.13×108, respectivamente. El resto de las muestras de suelo presentaron valores de entre 3.53×107 hasta 8.95×107 UFC/gr de suelo (Figura 2). En suelos fértiles las poblaciones de bacterias varían entre 108-1010 UFC/g de suelo (Janssen, Yates, Grinton, Taylor y Sait, 2002; Otero, 20111), lo cual confirma que los valores encontrados de UFC fueron bajos. Este bajo conteo de bacterias se puede relacionar con dos factores: (1) el tamaño de la comunidad bacteriana en suelo, que está relacionado con el contenido de materia orgánica (Zagal y Córdova, 2005; García, Cárdenas y Silva, 2018). En este estudio, el contenido de materia orgánica fue bajo (< 2%) en todos los suelos, lo que sugiere que los suelos de esta zona presentan degradación y es necesario implementar estrategias para su recuperación. (2) El pH ácido o alcalino inhibe la actividad bacteriana, pues la mayoría crece en la neutralidad (en rangos de 6.0 hasta 8.5) (Buckman y Buckman, 1991), y en todos los suelos muestreados el pH tuvo un rango de ácido a muy ácido. En cuanto a la obtención de cepas, se lograron observar cepas de bacterias del género Pseudomonas y Bacillus, que son los géneros más representativos en suelos agrícolas (Osorio-Vega, 2009) y con más usos en procesos de recuperación de suelos (Quintana y Valerio, 2013; Corrales-Ramírez, Caycedo, Gomez, Ramos y Rodríguez, 2017; Luján, 2019; Alvillo-Rivera, Garrido, Buitrón, Thangarasu y Rosano, 2021; Sharma, 2021; Asiandu, Wahyudi y Sari, 2021; Siddique, Gul, Ozturk y Altay, 2021). Sin embargo, es necesario tomar medidas para favorecer el crecimiento de estos y otros géneros bacterianos que son importantes para el establecimiento de suelos con potencial agrícola, ya que el conteo de bacterias fue bajo. En este sentido, cabe mencionar que las cepas aisladas se conservaron para futuros estudios, con el objetivo de conocer su potencial en la recuperación de la fertilidad de los suelos de la zona de estudio.
En cuanto a las características ambientales, en todas las áreas de muestreo el bioclima fue pluvial. La zona se clasifica como zona de intervención según la clasificación de ecosistemas de Ecuador continental. El 70% de las áreas estuvieron en el uso de suelo tierra agropecuaria-pastizal, y el resto en la clasificación cultivo permanente (20%), otras tierras agrícolas (7%) y zona antrópica (3%). Estuvieron a una distancia promedio de 814 ± 372 m de los poblados. El punto más cercano estuvo a 326.33 m y el más alejado a 1389.36 m de los poblados.
Para las variables relacionadas con las propiedades espectrales de las áreas de muestreo, la mayor dispersión de los datos se observó en la variable NIR, que mide la reflectancia en la longitud de onda del infrarrojo cercano (Cuadro 6). La menor variación se observó en el índice de vegetación de diferencia normalizada, según el coeficiente de variación (Cuadro 7). Los valores mínimos y máximos de ambos índices de vegetación van desde valores bajos (EVI = 0.44) relacionado con poca vegetación, a valores altos (EVI = 0.62; NDVI = 0.84) que indican presencia de vegetación densa y saludable, que pueden ser de vegetación arbustiva y zonas de cultivos. De igual forma, la mejor representación de la reflectancia de la vegetación la dio el NDVI con un promedio de 0.77 ± 0.05.
Cuadro 7: Estadísticos descriptivos de las variables espectrales tomadas a partir de sensores remotos en zonas de muestreo de suelos de la región nororiental de la Amazonía Ecuatoriana.
Table 7: Descriptive statistics of the spectral variables taken from remote sensors in soil sampling areas of the northeastern region of the Ecuadorian Amazon.
| Variable | Media | SD | CV | EE | Mínimo | Máximo |
| Índice de vegetación mejorado (EVI) | 0.51 | 0.05 | 0.10 | 0.01 | 0.44 | 0.62 |
| Índice de vegetación de diferencia normalizada (NDVI) | 0.77 | 0.05 | 0.06 | 0.01 | 0.64 | 0.84 |
| Infrarrojo cercano (NIR) | 0.35 | 0.04 | 0.12 | 0.01 | 0.31 | 0.43 |
SD = desviación estándar; CV = coeficiente de variación; EE = error estándar.
SD = standard deviation; CV = coefficient of variation; EE = standard error.
La distribución de datos de las variables espectrales en las 10 zonas de muestreo se aproximó a una distribución normal, fundamentalmente en el NDVI (Figura 3). En este caso, la mayoría de datos estuvo entre los valores de 0.75 a 0.8 que indican presencia de vegetación. El potencial de las métricas NDVI y derivadas del NDVI para el monitoreo de la vegetación es importante, para obtener una mayor comprensión de las relaciones paisaje-calidad del suelo (Verhulst et al., 2009), al ser sensible a la condición del suelo, las características topográficas y la fenología de la vegetación (Ayalew et al., 2020). Se ha demostrado que el NDVI es sensible a las características biofísicas de la vegetación, como el área foliar, la producción primaria neta y los niveles de actividad fotosintética (Rundquist, Harrington y Goodin, 2000; Stoms y Hargrove, 2000). Debido a su capacidad para integrar la cobertura terrestre y las condiciones biofísicas, el NDVI es útil para evaluar las condiciones de las cuencas hidrográficas regionales (Griffith, 2002a), donde se utiliza un alto porcentaje para cultivos perennes y rotativos, así como para tierras agropecuarias.
Figura 3: Histograma de distribución de los valores de índice de vegetación mejorado (EVI), índice de vegetación diferencia normalizada (NDVI) y reflectancia en la longitud de onda del infrarrojo cercano (NIR), obtenidos de muestras de suelo de la región nororiental en la Amazonía Ecuatoriana. Línea roja indica la distribución normal.

Figure 3: Histogram of distribution of the values of enhanced vegetation index (EVI), normalized difference vegetation index (NDVI) and reflectance in the near infrared (NIR) wavelength, obtained from soil samples of the northeastern region in the Ecuadorian Amazon. Red line indicates normal distribution.
La razón por la que el NDVI y los índices derivados pueden tener ciertas ventajas en este tipo de estudios, sobre las proporciones simples de cobertura terrestre, es porque son integradores biofísicos de las condiciones en todo un paisaje (Griffith, Martinko, Whistler y Price, 2002b; Ayalew et al., 2020). El uso de NDVI y métricas derivadas en estudios de calidad de la vegetación y suelo también puede capturar cambios temporales, a diferencia del uso de suelo estático y de los mapas de cobertura, que no capturan la variación dentro de la clase y que normalmente no se actualizan anualmente. Además, debido a que los valores del NDVI son datos de intervalo en oposición a las categorías nominales de uso y cobertura del suelo, pueden capturar la variabilidad dentro de la clase de un tipo de cobertura del suelo (Griffith et al., 2002b). Por ello, es importante continuar con el uso del índice en este tipo de estudios, donde se podría incluso predecir las zonas con mayor calidad del suelo para diferentes usos.
Los niveles de metales pesados que se obtuvieron de las muestras de suelo, se representaron espacialmente para observar el patrón de disminución de las concentraciones en un área de influencia de 3 km (Figura 4). Estos mapas de distribución espacial juegan un papel vital en la identificación de las zonas seguras e inseguras y para proporcionar la información de referencia necesaria para prevenir y controlar una mayor contaminación de los suelos (Adimalla, 2019a; Adimalla, Qian y Wang 2019b). Para el aluminio y el plomo se observó un patrón similar. Los puntos ubicados en el área central de la zona de muestreo tuvieron los mayores valores de concentración y alrededor de esta área aparecen las zonas más contaminadas dentro de la zona agrícola. Esto sugiere el papel principal de la aplicación de fertilizantes químicos y derrames de hidrocarburos en las tierras de cultivos agrícolas como la principal fuente de contaminantes.
El cadmio tuvo mayor concentración hacia la zona norte, con menor rango espacial de suelos afectados (Figura 4). El uso de fertilizantes orgánicos y químicos tiene una afectación directa en la presencia de cadmio en el suelo. La unión de los tres contaminantes en un único mapa indicó que toda el área central de la zona de muestreo tiene altos niveles de estos contaminantes, así como la zona de influencia alrededor de estos puntos. Es decir, que esta zona donde aparecen los poblados Chone 1, Chone 2 y San Antonio, requiere acciones de remediación de los suelos, si es que se consideran para mejorar su producción agrícola. Además, los niveles más altos de metales en los suelos alrededor de estos poblados, también son causados por el abono de desechos municipales además de los fertilizantes químicos (Andersson, Ottesen y Langedal, 2010; Li, Wu, Qian y Zhou, 2016; Adimalla y Wang, 2018). El resto de puntos al norte y al sur de la zona de muestreo tuvieron valores más bajos de estos metales pesados.
Conclusiones
La concentración de las variables químicas fue baja, y las concentraciones de Al tóxicas, indicando un balance negativo para la calidad de los suelos estudiados. El análisis de regresión entre las variables edáficas evaluadas y el IFP señalan la existencia de un balance negativo entre las entradas y salidas, balance que en suelos ácidos estaría provocando que los sitios de intercambio se ocupen por H y Al. Las correlaciones descritas, aportan criterios que permiten explicar la baja biodisponibilidad de los microelementos esenciales. El contenido de materia orgánica fue menor al 2% mientas que la concentración de Cd y Pb fue de 0.13 y 59.35 mg kg-1, respectivamente.
El 70% de las áreas estuvieron en el uso de suelo tierra agropecuaria-pastizal, y el resto en la clasificación cultivo permanente, otras tierras agrícolas y zona antrópica. Los valores mínimos y máximos de ambos índices de vegetación van desde valores bajos (EVI=0.44) relacionado con poca vegetación, a valores altos (EVI = 0.62; NDVI = 0.84) que indican presencia de vegetación densa y saludable que pueden ser de vegetación arbustiva y zonas de cultivos.
Finalmente, el conteo de bacterias totales fue bajo en todos los suelos, siendo un indicador potencial de degradación de los suelos. Por estas razones, es necesario implementar procesos de biorremediación, con la finalidad de mejorar las características del suelo, degradando o biotransformando los contaminantes, particularmente los metales como el aluminio. De acuerdo a lo anterior, los poblados Chone 1 y Chone 2, requieren acciones de remediación de los suelos, para mejorar su producción agrícola.
Fondos
Fondo Competitivo de Investigación Científica y Tecnológica (FOCICYT) 7ma Convocatoria, a través del proyecto “Evaluación de soluciones minerales ultradiluidas con efecto agro-homeopático sobre características morfológicas y agronómicas de maíz (Zea mays)”.
Contribución de los Autores
Investigación, conceptualización, validación, administración del proyecto, adquisición de fondo: F.A.P. Investigación, toma de datos, diseño, revisión: G.J.T.Z. Análisis de datos variables químicas y físicas, edición cuadros: G.H.V.M. Análisis de datos, revisión y edición: A.V.C.M. Análisis de variables ambientales, revisión final y edición: Y.F.S. Edición, diseño de figuras: C.A.N.C.











 nueva página del texto (beta)
nueva página del texto (beta)