Introducción
Las características de los suelos son variables debido a sus interacciones con el medio físico, biótico y con las actividades humanas, que pueden alterar su composición. Esto ocurre con los suelos ácidos, que han aumentado su cobertura en los últimos 100 años, debido a la aplicación excesiva de fertilizantes nitrogenados, el exceso de materia orgánica añadida al suelo y los episodios de lluvia ácida (Weil y Brady, 2017). Los suelos ácidos poseen valores de pH < 5.5 durante la mayor parte del año (FAO, 2021). El valor de pH del suelo esta ligado con el poder amortiguador, que es una de las características del suelo más importantes para el desarrollo óptimo de las plantas, debido a que permite tolerar o generar cambios en el pH a causa de los iones disueltos, los minerales y los espacios llenos de agua o aire (Weil y Brady, 2017). Cuando ocurren procesos de acidificación del suelo, se debe a que existe una gran cantidad de iones hidrógeno (H+) en solución que superan a otros iones disueltos, disminuyendo así el pH del suelo.
De manera natural los suelos ácidos se distribuyen en zonas templadas y tropicales. En las zonas templadas, los suelos ácidos son predominantemente orgánicos (espodosoles, alfisoles, inceptisoles e histosoles). Mientras que, en las zonas tropicales, los suelos son ácido-minerales entre los que predominan los ultisoles y los oxisoles (Von Uexküll y Mutert, 1995). En cambio, los suelos ácidos originados por las actividades humanas están en función de la demanda de producción agrícola. Generalmente se explotan intensamente suelos con poca capacidad amortiguadora para resistir los efectos de una acidez inducida, liberando algunos elementos a la solución del suelo, como el aluminio (Al). Puesto que el Al es el tercer elemento más abundante en la corteza terrestre, es común encontrarlo en los minerales del suelo en formas cristalinas o amorfas, como los aluminosilicatos, oxihidróxidos y complejos orgánicos, que no están disponibles para reacciones químicas o biológicas (Kisnieriené y Lapeikaité, 2015; Weil y Brady, 2017).
Sin embargo, si el suelo se encuentra bajo condiciones ácidas el Al se vuelve soluble. Esto se origina por el exceso de H+ que son adsorbidos en la superficie de los minerales, lo que causa un colapso en su red cristalina que libera el Al en forma de catión (Al3+) a la solución del suelo. Otra parte del Al es adsorbido en los sitios de intercambio de los minerales y desplaza cationes esenciales para las plantas como son Ca, K, N, Mg, P, S, Mo. De esta forma el Al puede ser absorbido por las plantas y cuando las concentraciones en el suelo son de 10 µM o mayores, las plantas presentan condiciones muy desfavorables para su desarrollo. Inclusive, si la acidez llega a alcanzar valores de pH < 3 en el suelo comienza la solubilización del óxido de hierro cristalino (ferrihidrita), lo que lleva a la liberación de iones Fe3+. Además, bajo estas condiciones casi el 100% de los cationes disponibles están conformados por Al3+ y, sólo una porción menor al 1% por H+, Fe3+ y Mn2+(Kisnieriené y Lapeikaité, 2015; Weil y Brady, 2017). La principal característica fitotóxica del Al es el daño en el ápice de la raíz, originado por su deformación y una rápida inhibición de su elongación, como consecuencia se afecta la absorción de agua y, al no existir elementos esenciales disponibles se originan deficiencias nutritivas severas que pueden generar una disminución de la biomasa e inclusive la muerte de la planta (Ma, Ryan y Delhaize, 2001; Casierra-Posada y Aguilar-Avendaño, 2007).
No obstante, existen plantas nativas de suelos ácidos como Camellia sinensis o Melastoma malabathricum y, otras especies cultivables como Oryza sativa y Zea mays, que han generado mecanismos ante la presencia de Al disponible en el suelo, permitiendo su crecimiento y desarrollo (Ma et al., 2001; Pilon-Smits, Quinn, Tapken, Malagoli y Schiavon, 2009). En general, se pueden distinguir dos vías para evitar la toxicidad del Al. El primer mecanismo es la exclusión, donde las células de la raíz producen exudados que son liberados en la rizosfera para hacer menos soluble el Al y reducir su movilidad; las sustancias liberadas pueden ser ácidos orgánicos como el ac. oxálico, ac. málico o ac. cítrico, compuestos fenólicos o polisacáridos en forma de mucílago (Panda y Baluŝka, 2015). El segundo mecanismo es la acumulación, que puede darse en las paredes celulares cuando el Al desplaza a los iones de calcio de las pectinas, también implica la entrada del Al a las células y su secuestro en las vacuolas de la raíz o de las hojas en formas no tóxicas, es decir, que el Al se une con aniones de ácidos orgánicos, como Al:Oxalato, Al:Citrato o Al:Malato (Ma et al., 2001; Watanabe y Osaki, 2001).
Por lo anterior, se considera que las plantas tolerantes a Al son capaces de generar exudados para evitar su ingreso a los tejidos y su translocación es mínima o nula, mientras que, las plantas acumuladoras poseen mecanismos internos que permiten ingresar, transportar y secuestrar el Al en la parte aérea de las plantas. Cuando el Al ingresa a las células de la raíz es capaz de almacenarse en todos sus tejidos, desde la rizodermis hasta los vasos del xilema; luego es transportado por el sistema vascular del tallo hasta las hojas. Los sitios de almacén en las hojas de especies acumuladoras varían entre cada especie, en algunas el Al se distribuye en todos los tejidos, en otras solo en la epidermis, el mesófilo o los haces vasculares (Haridasan, Paviani y Schiavini, 1986; Bressan, Coan y Habermann, 2016).
El estudio de las respuestas que el Al genera en las plantas es muy diverso, pero una parte fundamental es determinar en qué órganos, tejidos o células se almacena el Al. Para lograrlo se requiere hacer visible su presencia, por ello, deben utilizarse colorantes que en su estructura química posean afinidad hacia el Al. Otra variable esencial es la cuantificación de las concentraciones del Al acumulado en los órganos o tejidos. Generalmente las investigaciones se basan en las cantidades de Al presentes en las hojas, se ha establecido que las plantas con menos de 1000 mg kg-1 representan especies no acumuladoras, por otro lado, se consideran especies acumuladoras cuando son capaces de secuestrar más de 1000 mg kg-1 de Al en sus hojas (Jansen, Broadley, Robbrecht y Smets, 2002). Para medir estas concentraciones existen dos grupos de técnicas, las de cuantificación elemental donde sólo se cuantifica la concentración del Al, en contraste, las técnicas de cuantificación multielemental son capaces de calcular las concentraciones del Al y de los aniones orgánicos con los que se une; finalmente existen técnicas que permiten realizar una cuantificación elemental in situ, o sea, que se miden las concentraciones de Al y al mismo tiempo se determina el tejido o células donde se acumula.
Debido a que no todas las plantas responden de igual forma ante la presencia del Al, que los suelos ácidos siguen incrementado día a día por la explotación agrícola o forestal, es de vital importancia revisar cuáles son las técnicas que existen actualmente para localizar y cuantificar el Al en los tejidos vegetales. Si bien se conocen las respuestas tóxicas que genera este elemento en algunas especies, o los mecanismos de respuesta, aún existen especies vegetales en las que se desconoce cuál es el efecto que tiene. Por ello, en la presente revisión se realizó una compilación de las técnicas utilizadas en la localización y cuantificación del Al en las plantas. Además, se presenta un diagrama de flujo al lector para seleccionar la técnica más adecuada a sus intereses de investigación.
Materiales y Métodos
Para identificar las publicaciones sobre las técnicas utilizadas en la localización y cuantificación del Al en tejidos vegetales, se realizó una búsqueda utilizando los portales web de Science Direct© 2020 Elsevier y Scientific Electronic Library Online (SciELO). En cada portal se escribieron las palabras clave: “aluminum in plants”, “aluminium in tissues plants”, “aluminum toxicity”. Después de revisar las técnicas encontradas en las publicaciones, se realizó una división en dos categorías: (i) las técnicas de localización o distribución in situ de aluminio, (ii) las técnicas de cuantificación que se subdividen en tres: a) técnicas de cuantificación total de aluminio, b) técnicas de cuantificación multielemental y c) las técnicas de cuantificación in situ. Únicamente se tomaron en cuenta las referencias más significativas a partir de 1986, de ellas se efectuó una compilación de las familias y especies vegetales (Cuadro 1).
Table 1: Plant families and species whose tissues were analyzed to find aluminum.
| Familia | Especies |
|---|---|
| Brassicaceae | Arabidopsis thaliana (L.) Heynh. Lupinus albus L. |
| Cucurbitaceae | Cucumis sativus L. |
| Cupressaceae | Cryptomeria japonica (Thunb. Ex Lf) D.Don |
| Fabaceae | Cicer arietinum L. Glicyne max (L.) Merr. Medicago sativa L. Pisum sativum L. |
| Hydrangeaceae | Hydrangea macrophylla (Thunb.) Ser. |
| Melastomataceae | Conostegia xalapensis (Bonpl.) D. Don ex DC. Melastoma malabathricum L. Miconia albicans (Sw.) Steud, M. ferruginata DC., M. pohliana Cogn., M. rubiginosa (Bonpl.) DC. Microlicia fasciculata Mart. ex Naud. |
| Musaceae | Mussa spp. |
| Myrtaceae | Eucalyptus camaldulensis Dehnh. |
| Pinaceae | Pinus taeda L., P. thunbergii Parl. |
| Poaceae | Andropogon virginicus L. Brachiaria sp Eremochloa ophiuroides (Munro) Hack. Hordeum vulgare L. Miscanthus sinensis Andersson Oryza sativa L. Phragmites australis (Cav.) Trin. ex Steud. Triticum aestivum L. Zea mays L. |
| Polygonaceae | Fagopyrum esculentum Moench cv. Lifago y cv. Jianxi, F. tataricum cv. Rotundatum, F. homotropicum cv. Mianshawan, Rumex acetosa L. |
| Rubiaceae | Alberta minor Baillon Canthium confertum Korth Coccocypselum canescens Willd. ex Roem. & Schult. Coptosapelta olaciformis Elm Faramea marginata Cham. Gouldia terminalis (Hook. & Arn.) Palicourea rígida Kunth Saprosma arboreum Blume |
| Rutaceae | Poncirus trifoliata (L.) Raf. |
| Solanaceae | Solanum paniculatum L. |
| Symplocaceae | Symplocos paniculate (Thunb.) Miq. |
| Theaceae | Camellia sinensis (L.) Kuntze |
| Vochysiaceae | Callisthene major Mart. Qualea grandiflora Mart., Q. multiflora Mart., Q. parviflora Mart. Vochysia elliptica Mart., V. pyramidalis Mart., V. rufa Mart., V. thyrsoidea Pohl |
Las pruebas histoquímicas como técnicas de localización in situ del aluminio
Las plantas poseen una estrecha relación entre su ambiente y la organización de sus tejidos, el resultado de esta interacción puede generar la acumulación de diversas sustancias como almidón, compuestos fenólicos, calosa, elementos metálicos, etc. (Sandoval, 2005). Una manera de identificar estas sustancias es mediante pruebas histoquímicas, que se basan en la unión del tejido con algún colorante que posee estructuras químicas llamadas cromóforos o fluoróforos. Dichas estructuras reaccionan con los componentes celulares específicos y producen pigmentaciones o precipitados en los tejidos, que revelan la presencia del elemento o compuesto de interés. En el Cuadro 2 se enlistan los colorantes utilizados para la detección de Al en diversas familias vegetales.
Table 2: Plant Families and histochemical techniques applied to the determination of aluminum.
Los cromóforos son moléculas orgánicas que poseen un radical benceno o unión triple de N en su estructura química, que revelan un color luego de unirse a los grupos hidroxilo, carboxilo, amino u otros iones en las células. Para facilitar la reacción debe utilizarse un mordiente entre la estructura celular y el colorante, los mordientes pueden ser sales de metales divalentes o trivalentes (Sandoval, 2005). Después de la tinción, la muestra se coloca bajo la iluminación de campo claro de un microscopio fotónico para observar una coloración especifica. Por otro lado, los fluoróforos son grupos funcionales de una molécula orgánica, que pueden unirse con otra molécula o ion blanco. Luego de la tinción, la muestra se excita a una longitud de onda específica para que el fluoróforo absorba energía y la emita en otra longitud de onda dentro del espectro visible, esta señal es detectada bajo microscopia confocal o de fluorescencia. La cantidad de energía emitida y su longitud de onda dependen del propio fluorofóro y el medio en el que este disuelto (Tice, Parker y De Mason, 1992).
Hematoxilina (C16H14O6). Este es el colorante más común y utilizado en los estudios reportados en la mayoría de las publicaciones, por lo general, este colorante es empleado para determinar la absorción de Al en raíces completas de plántulas, y hasta el 2011, De Andrade y colaboradores probaron este colorante sobre secciones histológicas de hojas. La interacción de este colorante con el Al muestra una coloración violeta intenso (Bressan et al., 2016). Durante su preparación, la hematoxilina debe oxidarse a hemateína, por lo general, se utiliza yodato de sodio como agente oxidante y el Al en el organismo actúa como mordiente (Kiernan, 2015). La solución recién preparada tiene un color ámbar intenso, debido a su exposición al O2 atmosférico continúa oxidándose y cambiando de color. Una vez que la solución obtiene un color marrón opaco, carece de eficacia como colorante. Si esto ocurre, se debe preparar una solución nueva, según sea necesario. La tasa de oxidación se puede reducir manteniendo la solución de tinción bien tapada a 4 °C. Las soluciones deben ser neutras o ligeramente ácidas, ya que la alcalinidad favorece la rápida oxidación y reduce su vida útil. La tasa de oxidación se puede reducir añadiendo glicerol o alcohol a la solución (Kiernan, 2015). Una de las ventajas de aplicar esta prueba es que se realiza en un corto tiempo y puede aplicarse en cualquier tejido u órgano de la planta. La desventaja de esta tinción utilizada en raíces completas o cortes frescos es que las observaciones deben realizarse de manera inmediata, pues los tejidos deben mantenerse hidratados. Por otro lado, este colorante puede revelar la presencia de otros metales como el Fe (coloración negra) y Sn (coloración roja) (Kiernan, 2015; Bressan et al., 2016).
Violeta de pirocatecol (C19H14O7S). Este colorante se ha utilizado en la detección espectrofotométrica y electroquímica de adsorción del Al en agua (Wang, Stass y Horst, 2004). Hasta que Watanabe, Osaki, Yoshihara y Tadano (1998), lo emplearon como colorante sobre secciones histológicas de hoja y raíz en la especie acumuladora de Al, Melastoma malabathricum. Esta prueba histoquímica revela un color azul ante la presencia de Al. El colorante debe estar disuelto en una solución amortiguadora de hexamina-hidróxido de amonio, pH 6.2. La hexamina actúa como mordiente, para disminuir su oxidación el pH del amortiguador debe ser neutro, la estabilidad del pH está dado por la presencia de amoníaco o formaldehído. La solución debe mantenerse bien cerrada a 4 °C y, se recomienda prepararla 24 h antes de utilizarse para estabilizar el pH de la misma. Una desventaja es que el violeta de pirocatecol no sólo reacciona con el Al, sino también con otros iones metálicos como el Fe3+, Zn2+, Cu2+ (Wang et al., 2004). En el caso del Fe, para evitar su interferencia se sugiere realizar una reacción de reducción, para mayor detalle del protocolo se recomienda consultar a Dougal y Wilson (1974).
Aluminon o Sal de triamonio del ácido aurin tricarboxilico (C22H23N3O9). Este colorante se usa para detectar Al en un medio ácido (pH 4), la coloración que se obtiene es roja y también tiñe de azul los núcleos celulares (Kiernan, 2015). A pH > 6 disminuye su sensibilidad para detectar Al. También la temperatura es un factor importante y, para obtener una coloración más intensa el colorante se deja reposar sobre los tejidos una hora. Sin embargo, el aluminon no es un reactivo específico del Al, esto se debe a que también se produce coloración en presencia de Fe3+o Be2+, e incluso afecta la intensidad de la coloración formada. Otros factores que intervienen en la detección del Al con aluminon es la composición celular y el pH intercelular. Asimismo, se han encontrado resultados falsos negativos al aplicar este colorante y se han obtenido resultados variables en muestras histológicas incluidas en resinas tipo epoxi (Bressan et al., 2016). Por lo tanto, el uso de este colorante no es muy recomendable para la localización del Al en los tejidos vegetales.
Cromo azurol S (C23H13Cl2Na3O9S). Este es un colorante utilizado desde hace más de 40 años para identificar Al en los tejidos vegetales. La coloración azul indica la presencia de Al, la solución del colorante debe estar disuelta en un amortiguador de acetato de sodio a pH 4.82 (Bressan et al., 2016). La aplicación del cromo azurol S comparado con la hematoxilina sobre especies acumuladoras de Al probó ser más sensible (Bressan et al., 2016). Por otra parte, Wehr et al. (2010), realizaron una comparación entre distintos colorantes y determinaron que sólo el cromo azurol S mostró una sensibilidad mayor para detectar Al. Lo anterior, lo comprobaron al realizar pruebas con geles de pectinas y tejidos de raíz, en las que la coloración permaneció estable durante varias semanas al conservar las muestras a 4 ºC. Esto sugiere que el cromo azurol S forma una unión estrecha con los iones de Al, incluso por su estructura química puede formar largas cadenas con el Al, si este se encuentra en solución (Wehr et al., 2010).
Morin (2′,3,4′,5,7-Pentahidroxiflavona). Este es uno de los colorantes más usados en el análisis del Al en tejidos vegetales, debido a que posee una alta especificidad y por su estructura química posee cinco grupos funcionales para formar enlaces con el Al. Este colorante debe estar disuelto en una solución amortiguadora de acetato de amonio, pH 5 (Browne, McColl y Driscoll, 1990). El morin se aplica sobre secciones histológicas frescas o fijadas que se observan bajo microscopía confocal. Para que pueda observarse la unión con el Al es necesario emitir una longitud de onda de excitación a 420 nm y la longitud de onda de emisión debe ser 510 nm, esto permite observar una señal de color verde en el microscopio confocal (Tice et al.,1992). El límite de detección de esta técnica es de 2 nm (Lian et al., 2003). Por otro lado, el morin es capaz de localizar el Al que se encuentra asociados a los grupos fosfatos en el núcleo (Crawford, Marshall y Wilkens, 1998; Zhang, Liu, Pang, Cai y Qi, 2002). Sin embargo, no puede detectar el Al estrechamente unido a las pectinas de la pared celular (Eticha, Staß y Horst, 2005). También se demostró que este colorante no puede unirse con el Al que está ligado a aniones de ácidos orgánicos (Klug, Specht y Horst, 2011). Con base en lo anterior, se debe tomar en cuenta que, a mayor estabilidad de unión entre el Al y los aniones de ácidos orgánicos (Al:malato (1:1) > Al:oxalato (1:3) > Al:citrato (1:1)) se revela una menor intensidad de señal de la unión entre el morin y el Al (Klug et al., 2011).
Lumogallion (Ácido 5-cloro-3 -[(2,4-dihidroxifenil) diazenil] -2-hidroxibencenosulfónico). Es otro colorante fluorescente para localizar Al en tejidos vegetales. El Al se une en el centro de la molécula del lumogallion, para que se realice la unión con este metal, el colorante debe estar disuelto en amortiguador de acetos, pH 5.2. Luego de teñir las secciones histológicas, se observan bajo microscopía confocal. Su longitud de onda de excitación es de 488 nm y su longitud de emisión es de 520 nm, que muestra una señal verde en el campo de observación. El lumogallion posee una sensibilidad a Al mucho mayor que cualquier otro reactivo de tinción bajo un microscopio láser confocal (Kataoka, Iikura y Nakanishi, 1997). Otra ventaja de este fluorocromo es que puede unirse al Al extracelular o intracelular (Reyna-Llorens, Corrales, Poschenrieder, Barceló y Cruz-Ortega, 2015; Riaz et al., 2018), e incluso es capaz de detectar el Al unido a aniones de ácidos orgánicos y, únicamente se reportan cambios en la intensidad de la fluorescencia debido al proceso de fijación (Silva et al., 2000); se sugiere omitir estos pasos y realizar la tinción en secciones histológicas frescas o congeladas, sobretodo si se trata de especies no acumuladoras, pues el Al puede perderse.
Técnicas de cuantificación
Las técnicas de cuantificación elemental o multielemental por lo general requieren la destrucción total y solubilización de la muestra. Esta destrucción puede realizarse por combustión o digestión de la muestra con ácidos fuertes (Tezotto et al., 2013). En contraste, existen técnicas que no requieren la destrucción de la muestra, el análisis se realiza sobre su superficie, e incluso se pueden generar imágenes de los tejidos y obtener la distribución elemental si los analizadores están acoplados a microscopios electrónicos (Lombi, Scheckelc y Kempson, 2011; van der Ent et al., 2019; Padilla-Cuevas, Yee, Merino, Hidalgo y Etchevers, 2020). Las técnicas de cuantificación útiles para la determinación de Al en los tejidos vegetales aparecen en el Cuadro 3, mientras que, en el Cuadro 4 se presentan algunas características de cada técnica y, en el Cuadro 5 se mencionan las familias vegetales a las que se han aplicado estas técnicas para cuantificar Al.
Table 3: Techniques used to quantify aluminum in plant tissues.
| Cuantificación elemental | Cuantificación multielemental | Cuantificación elemental in situ |
|---|---|---|
| Espectrofotometría (Spectrophotometry) | Espectrometría de emisión atómica con plasma inductivamente acoplado (ICP-AES, Inductively Coupled Plasma Atomic Emission Spectrometry) | Microscopia electrónica con rayos X de energía dispersiva (EM-EDS, Electron Microscopy with Energy Dispersive X Ray) |
| Espectrometría de absorción atómica (AAS, Atomic Absorption Spectrometry) | Espectrometría de masas por atomización con plasma inductivamente acoplado (ICP-MS, Inductive Coupling Plasma Mass Spectrometry) | Ablación láser con espectrometría de masas por atomización con plasma inductivamente acoplado (LA-ICP-MS, Laser Ablation Inductive Coupling Plasma Mass Spectrometry). |
| Espectrometría de rayos X (X ray Spectrometry) | Espectrometría de Resonancia Magnética Nuclear (Nuclear Magnetic Resonance Spectrometry) | Cromatografía líquida de alta eficacia (HPLC, High Performance Liquid Chromatography) |
Table 4: Summary of techniques to quantify aluminum.
| Técnica | Límite de detección | Fuente de excitación | Fuente de detección |
|---|---|---|---|
| Spec | ≈ 2 nm | Lámpara | Fotones |
| ASS | FAAS-mg kg-1 GFAAS- µg kg-1 | Llama/Horno 1700 a 3200°C | Señal óptica / electrónica |
| X ray S | < 1 mg kg-1 | Rayos X | Rayos X |
| NMR | 200 MHz | Campo Magnético | Ondas radio |
| IPC-MS | µg kg-1 | Plasma de 6000 - 8500ºC | Iones |
| IPC-AES | µg kg-1 | Plasma de ≈ 9700°C | Iones |
| HLPC | < 1 µg | No aplica | Iones |
| SEM-EDS | >100 mg kg-1 | Electrones | Rayos X |
| LA-ICP-MS | < 1 mg kg-1 | Láser | Iones |
Cuadro 5: Plant families and techniques used to quantify aluminum.
Técnicas modificadas de Helaluddin, Khalid, Alaama y Abbas (2016), Skoog, Holler y Crouch (2018), van der Ent et al. (2019) y Padilla-Cuevas, Yee, Merino, Hidalgo y Etchevers (2020).
Modified techniques from Helaluddin, Khalid, Alaama and Abbas (2016), Skoog, Holler and Crouch (2018), van der Ent et al. (2019) and Padilla-Cuevas, Yee, Merino, Hidalgo and Etchevers (2020).
Técnicas de cuantificación elemental
Espectrofotometría. La espectrofotometría se ocupa de medir la cantidad de luz que puede absorber una sustancia química al determinar la intensidad de la luz cuando un haz se hace pasar a través de la solución que contiene a la muestra. El principio básico consiste en que cada elemento o sustancia absorbe o transmite luz en un cierto rango de longitud de onda de la radiación ultravioleta (185 - 400 nm), visible (400 - 700 nm) o infrarroja (700 - 15000 nm, Germer, Zwinkels y Tsai, 2014). La determinación espectrofotométrica de los elementos suele ir precedida por la separación de los componentes principales de la muestra, adicionalmente puede realizarse alguna prueba colorimétrica. En estas pruebas debe tenerse precaución con cambios de pH de la muestra o la intervención de otro elemento, si estos factores varían durante las mediciones se pueden generar sobreestimaciones o subestimaciones en la concentración.
La cuantificación del Al por espectrofotometría utiliza los mismos cromóforos descritos en el apartado anterior p. ej.: (Salazar-Chavarria, Sánchez-Nieto y Cruz-Ortega, 2020; Sun et al., 2020). También existen métodos enzimáticos-colorimétricos para determinar la concentración de los ácidos orgánicos asociados al aluminio p. ej.: (Reyna-Llorens et al., 2015).
Espectrometría de absorción atómica. Esta técnica mide la concentración del elemento de interés (Al) pasando luz a una longitud de onda específica, a través de la matriz que se encuentra en forma de una nube de átomos. La luz es emitida a la matriz por una fuente de radiación de un elemento en particular, también es conocida como lámpara de cátodo hueco o una lámpara de descarga sin electrodos (Helaluddin, Khalid, Alaama y Abbas, 2016; Skoog, Holler y Crouch, 2018). La absorción de la radiación de la matriz se hace pasar por un monocromador (serie de lentes y espejos) que elimina la luz dispersa de otras longitudes de onda, para dirigir la radiación hacia un detector, que convierte la señal de luz en una señal eléctrica proporcional. Posteriormente, un procesador de señales genera un gráfico donde aparecen las lecturas de los datos (Beaty y Kerber, 1993; Skoog et al., 2018). Cabe señalar que la concentración generalmente se determina a partir de una curva de calibración, que se obtiene utilizando estándares de concentración conocida (González-Santana et al., 2012). La cantidad de muestra requerida es de al menos 1 g, el límite de detección es de mg kg-1 (Helaluddin et al., 2016). Durante el procesamiento de la muestra y su análisis deben controlarse muy bien las condiciones de humedad, para evitar interferencias durante la medición (Skoog et al.,2018).
Espectrometría de absorción atómica de flama. La espectrometría de absorción atómica de flama es una técnica de análisis rápida y precisa. Esta técnica posee un atomizador de flama de acetileno u óxido nitroso, entre otros tipos (Beaty y Kerber, 1993; Helaluddin et al., 2016). La función de la flama es suministrar a la matriz una cantidad de energía suficiente (≈ 2000-2500 °C) para disociar sus moléculas, enlaces y llevar al estado fundamental a sus átomos; para luego dirigir la muestra (Lajunen y Perämäki, 2004). El tiempo de análisis por elemento es de 10 a 15 s, con muy buena precisión. El límite de detección para la mayoría de los elementos es de mg kg-1 (Lajunen y Perämäki, 2004). Sin embargo, Skoog et al. (2018) mencionan que el límite de detección para el aluminio es de 30 partes por billon.
Espectrometría de absorción atómica de horno de grafito. En ocasiones, las concentraciones elementales que deseamos detectar son demasiado bajas (trazas, µg kg-1). Por lo que, debemos recurrir a técnicas que poseen complementos en los equipos de espectrometría de absorción, que mejoran notablemente su sensibilidad. Un ejemplo es el horno de grafito, que está programado para calentarse por etapas, que incluyen el secado para eliminar el disolvente, la incineración y atomización de los componentes de la matriz (Beaty y Kerber, 1993). La muestra atomizada y la trayectoria de la luz se retienen durante un período de tiempo prolongado, que mejora la sensibilidad de cuantificación. A diferencia de la flama, el tiempo de análisis por elemento es de 5 a 6 min, pero el horno de grafito analiza soluciones, lodos, o muestras sólidas. Una ventaja es que requiere cantidades muy pequeñas de muestra (5-20 µL) y el límite de detección para el aluminio es 0.03-0.1 µg kg-1 (Brown y Milton, 2005; Helaluddin et al., 2016).
Espectroscopia de rayos X. Se basa en la medida de la emisión, absorción, dispersión, fluorescencia y difracción de la radiación electromagnética. Los rayos X son radiación electromagnética de longitud de onda corta, que se producen por la desaceleración de fotones, electrones o protones de alta energía al incidir en un blanco metálico. Esto produce transiciones electrónicas de excitación y expulsión de electrones en los orbitales internos, que generan un vacío en este orbital. Luego, otros electrones con niveles energéticos mayores y más externos, llenan estos espacios vacíos y se generan los rayos X. El intervalo de longitud de onda de los rayos X es entre 0.01-10 nm (van der Ent et al., 2019; Padilla-Cuevas et al., 2020). Dada la extensión de esta técnica y los alcances de esta revisión, únicamente se hace mención que los rayos X se pueden generar de varias formas según Skoog et al. (2018): (i) por bombardeo con un haz de electrones de alta energía a un objetivo metálico, (ii) por el uso de un haz primario de rayos X sobre una muestra que luego genera una haz secundario de fluorescencia de rayos X (XRF), (iii) a través de una fuente radiactiva que desintegra la muestra y origina la emisión de rayos X y, (iv) por medio de una fuente de radiación de sincrotrón. Una ventaja de estas técnicas que utilizan rayos X es que pueden determinar cualquier elemento con número atómico mayor al sodio (Skoog et al., 2018). Sin embargo, una desventaja es que la espectrometría de rayos X no puede distinguir los complejos de un estado de oxidación, así como algunos complejos que contienen ligandos con funcionalidades de coordinación muy similares (van der Ent et al., 2019).
Espectrometría de resonancia magnética nuclear. Esta técnica mide la absorción de la radiación electromagnética en la región de radiofrecuencia entre 4-900 MHz. A diferencia de la absorción ultravioleta, visible e infrarroja, en este proceso de absorción participan núcleos de átomos en lugar de electrones externos (Skoog et al., 2018). Esta técnica espectroscópica se basa en las propiedades magnéticas de muestras sólidas, líquidas y gaseosas, de las que se identifican las estructuras de los compuestos orgánicos, especialmente después de la síntesis o el aislamiento de productos (Gauglitz y Moore, 2014). Su principio se basa en el hecho de que algunos núcleos atómicos tienen un momento angular y un momento magnético, o la propiedad especial llamada espín nuclear. En el núcleo atómico los espines nucleares se encuentran distribuidos al azar, pero al exponerlos a un campo magnético se genera un desdoblamiento de sus niveles de energía, pues los espines se orientan en dirección y en contra del campo magnético generado (McMahon, 2007; Günther, 2013), Figura 1.
Figura 1: Diagrama de un espectrómetro de resonancia magnética nuclear. (Tomado y modificado de Günther, 2013).
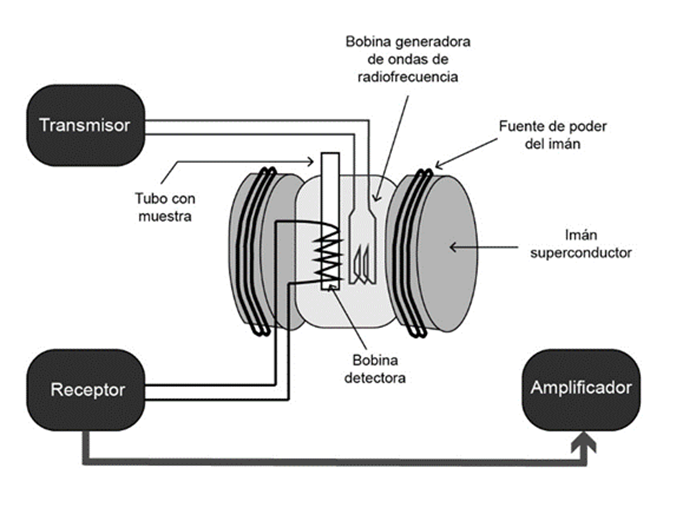
Figura 1: Scheme of a nuclear magnetic resonance spectrometer. (Taken and modified from Günther, 2013).
La exposición a un campo magnético genera que la transferencia de energía en los núcleos paralelos de menor energía se mueva al estado de espín de mayor energía, donde ahora están “en resonancia”. Lo anterior, origina una longitud de onda correspondiente a las frecuencias de radio aplicadas a la muestra, cuando el giro vuelve a su nivel basal la energía se emite a la misma frecuencia. Entonces, la señal que coincide con esta transferencia se mide y procesa para producir un espectro de resonancia magnética nuclear para el núcleo analizado (Rubinson y Rubinson, 2001; McMahon, 2007; Universidad Hebrea de Jerusalén, 2020).
En el caso del aluminio se busca al 27Al, que posee un núcleo cuadrupolar (spin 5/2) de alta sensibilidad que produce líneas amplias y evidentes en un intervalo de desplazamiento químico de 200 Hz, con una relación de frecuencia del 26.1%. La amplitud de línea de referencia es 11 Hz (a temperatura ambiente en un espectrómetro de 400 MHz) del compuesto Al(NO3)3 en D2O (agua pesada, óxido de deuterio) a una concentración 1.1 M y con un tiempo de relajación longitudinal de 0.03 s. El uso principal de la RMN de aluminio es detectar su presencia y medir su tasa de relajación. Siempre hay una señal amplia que surge de la sonda en el espectro de 27Al, pero hay poca información disponible sobre los cambios químicos del Al (Universidad Hebrea de Jerusalén, 2020).
Técnicas de cuantificación multielemental
Espectrometría de emisión atómica de plasma acoplado inductivamente. La espectrometría de emisión posee una menor susceptibilidad a las interferencias químicas que la espectrometría de absorción, debido a que la temperatura de atomización es mayor (≈ 9700 °C). Además, en esta técnica cada elemento tiene un espectro característico de longitud de onda en función de su estructura electrónica. Por lo tanto, se pueden determinar simultáneamente los espectros de muchos elementos (Skoog et al.,2018). Al unir este tipo de espectrometría con una fuente de plasma, que es una mezcla gaseosa conductora de electricidad, generalmente de argón, se logra la determinación de bajas concentraciones de elementos de compuestos altamente resistentes a la descomposición térmica, (p. ej.: óxido de boro, fósforo, tungsteno, uranio, circonio y niobio) y la determinación de no metales como el cloro, bromo, yodo y azufre (Skoog et al., 2018). Las muestras pueden ser líquidas o sólidas; para determinar la concentración de los elementos se deben realizar curvas de calibración para cada uno, en un intervalo de concentración comprendido entre 0 y 10 mg L-1. Las disoluciones se preparan a partir de soluciones patrón certificadas para el análisis de emisión atómica de 1000 mg L-1 en un medio de ácido nítrico (Skoog et al., 2018). El límite de detección para el aluminio es 0.1-1 µg kg-1 (Brown y Milton, 2005).
Espectrometría de masa de plasma acoplado inductivamente. Es una técnica utilizada para el análisis de contenidos totales simultáneos de elementos metálicos y no metálicos. Esta técnica es altamente sensible, puede cuantificar casi todos los elementos presentes en la tabla periódica con potencial de ionización menor al del argón en concentraciones traza (McMahon, 2007; Padilla-Cuevas et al., 2020). El argón es utilizado para atomizar la muestra, debido a la alta temperatura del plasma los compuestos de la muestra son disociados eficientemente (> 90%) y pueden atomizarse más de 50 elementos a la vez. La adición de la espectrometría de masas permite determinar el peso molecular de cada elemento de la muestra, sin generarse interferencias isobáricas (Skoog et al., 2018). El tiempo de medición es de 10 s por elemento. El límite de detección para la mayoría de los elementos es de 0.1 a 10 µg kg-1; en el caso del aluminio es entre 0.001-0.1 µg kg-1. Se ha informado que existen desviaciones estándar relativas del 2-4% en las regiones medias de las curvas de calibración (Brown y Milton, 2005). A pesar de que esta técnica tiene varios años de desarrollo, su costo es elevado, pero ofrece las mejores características de todas las espectrometrías atómicas en términos de sensibilidad, límites de detección, rendimiento y medición de elementos múltiples (Brown y Milton, 2005).
Cromatografía líquida de alta eficacia. En términos generales la cromatografía se refiere a la separación de los componentes de una mezcla, basándose en diferentes tipos de interacciones químicas entre las sustancias a analizar. En todas las separaciones cromatográficas, la muestra se desplaza en una fase móvil, que se hace pasar por una fase estacionaria con la que es inmiscible. En la cromatografía líquida, la fase móvil es un disolvente líquido que contiene la muestra como una mezcla de solutos. La HPLC es el tipo de cromatografía de elución más versátil y ampliamente utilizada para separar y determinar especies en materiales orgánicos, inorgánicos y biológicos (Skoog et al., 2018). La muestra es transportada a través de una fase estacionaria en una columna empaquetada por una fase móvil líquida a alta presión, luego, los componentes se separan entre sí en una columna y son cuantificados (McMahon, 2007; Lundanes, Reubsaet y Greibrokk, 2014). Las concentraciones trazas de materiales orgánicos e inorgánicos se pueden determinar entre 6-12 g, según el detector elegido. Al final, si es de interés para la investigación se puede recuperar cada fracción de la muestra al final de la columna (McMahon, 2007; Skoog et al., 2018).
Esta técnica generalmente se ha utilizado en estudios cuyo interés fue determinar la forma en que el Al se encuentra ligado dentro de las células vegetales. Es decir, las uniones del aluminio con aniones de ácidos orgánicos como el oxálico, cítrico o málico (Ma et al., 2001). Estas muestras se pueden obtener del medio de crecimiento (cultivos hidropónicos), la savia (generalmente recolectada con micropipeta los primeros 30 min después del corte en el tallo), exudados de raíz (Yang, Zhu, Zheng, Zhang y Zheng, 2011), e incluso del suelo.
Técnicas de cuantificación elemental in situ
Microscopía electrónica de barrido con un sistema de microanálisis de espectrometría de rayos X de energía dispersiva (EDS o EDX). Esta es una técnica de obtención de imágenes que utiliza un haz de electrones para explorar una muestra. Dado que la longitud de onda de los electrones es mucho menor que la longitud de onda de la luz visible, los efectos de difracción ocurren en dimensiones físicas mucho más pequeñas. Por lo tanto, la resolución de la imagen en microscopía electrónica es mucho mejor que en microscopía óptica; obteniendo imágenes de hasta 1 000 000 de aumentos y una resolución de hasta 3 nm en presión variable (McMahon, 2007). Su funcionamiento se basa en la incidencia de un haz de electrones sobre una muestra conductora, este haz se enfoca en un punto en el que se lleva a cabo un barrido de la superficie microestructural. Después se obtienen las imágenes por la detección de electrones secundarios que se emiten desde la superficie de la muestra, debido a la excitación por el haz de electrones primario (Skoog et al., 2018; Ul-Hamid, 2018).
La principal desventaja de la técnica es que las muestras deben verse en una cámara de aire para mantener las condiciones de vacío interno. En el caso de muestras biológicas deben tener un tratamiento previo (p. ej.: congelación, fijación o deshidratación), lo que puede provocar la producción de artefactos (McMahon, 2007; Lombi et al., 2011). Por ello, se recomienda consultar obras especializadas en el procesamiento de muestras biológicas p. ej.: (Goldstein et al., 2018; Fleck y Humbel, 2019).
Los microscopios electrónicos de barrido pueden tener incorporado un detector de espectrómetro de rayos X de energía dispersiva (EDS, por sus siglas en inglés Energy Dispersive X-Ray Spectrometer) para proporcionar información elemental basada en la emisión de rayos X fluorescentes después de la excitación con un haz de electrones incidente, que puede detectar fotones entre los 10 a 30 KeV. Debido al entorno de vacío, es posible analizar elementos de composición ligeros, así como metales y metaloides más pesados (Lombi et al., 2011; Goldstein et al., 2018). La funcionalidad de este detector se integra perfectamente con la operación del microscopio. La alta eficiencia del detector combinada con el gran ángulo sólido de recolección hace posible un tiempo de análisis de menos de 1 min, detectando concentraciones de µg kg-1 en un área de análisis de 7x7mm (Ul-Hamid, 2018; van der Ent et al.,2019). Otra ventaja es que este tipo de análisis permite conservar la integridad y distribución de los tejidos. Por lo que, esta técnica puede ser complementaria a los análisis netamente cuantitativos (Ipohorski y Bozzano, 2013).
Entre las desventajas, se incluye una resolución de baja energía (122 eV) debido a que los picos de rayos X poco espaciados no pueden ser distinguibles (p. ej.: Ti y Ba; S, Mo y Pb), especialmente cuando los picos de los principales elementos interfieren con los picos de los elementos traza con baja detectabilidad (0.1-0.2% en peso). Por ello, se recomienda profundizar en las reglas físicas que rigen la generación y detección de rayos X, para realizar una exploración cuidadosa en la identificación de los picos generados por el software y obtener un resultado preciso (Goldstein et al., 2018; Ul-Hamid, 2018).
Ablación láser con espectrometría de masas por atomización con plasma inductivamente. Como se mencionó anteriormente, la espectrometría de masas por atomización con plasma inductivamente acoplado realiza análisis multielemental a concentraciones traza, por medio de la detección de iones en muestras líquidas o gaseosas. A esta técnica se le puede añadir la ablación láser, que permite introducir muestras sólidas inorgánicas y orgánicas, polvo o materiales metálicos dentro del atomizador. La ablación utiliza un rayo láser de pulso intenso (Nd-YAG), y se hace incidir sobre la superficie de la muestra, para convertirla en vapor y partículas, que luego son dirigidas al atomizador del espectrómetro (Gauglitz y Moore, 2014; Hanć, Piechalak, Tomaszewska y Barałkiewicz, 2014; Skoog et al., 2018). Se puede realizar un análisis masivo con una resolución espacial de 100-1000 μm o un microanálisis local con una resolución espacial de 5-50 μm. Al enfocar el láser en un mismo punto es posible obtener perfiles elementales de profundidad (μm). Sin embargo, para tener una buena precisión se debe tener la certeza que el material vaporizado sea una muestra representativa con un fraccionamiento elemental insignificante durante el proceso de ablación. Lo anterior, puede minimizarse mediante el uso de una matriz estándar, que haga referencia a una concentración conocida en una muestra estándar p. ej.: 13C; (Klug et al., 2011; Lombi et al., 2011).
Elección del uso de técnicas para localizar y cuantificar aluminio en tejidos vegetales
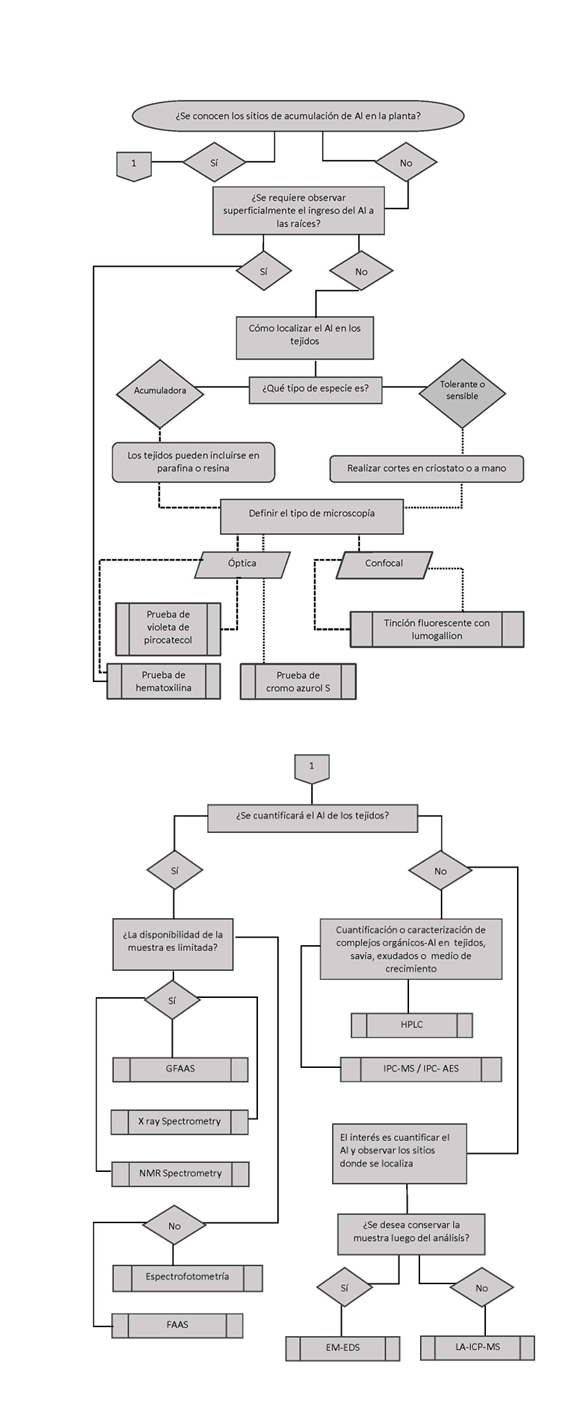
A continuación, se presenta una pequeña guía en forma de diagrama de flujo que apoya la elección de la técnica más adecuada para localizar o cuantificar aluminio en la(s) especie(s) en estudio (Figura 2).
Conclusiones
En la actualidad, la acidificación de los suelos está en aumento y el Al es un elemento disponible en ellos, lo que subraya la importancia de realizar investigaciones que evidencien los impactos que tiene este metal en las plantas. Hasta ahora se sabe que el Al es tóxico para la mayoría de las especies. Sin embargo, las especies tolerantes o acumuladoras pueden ser clave para entender los mecanismos de adaptación ante este escenario, por ello se hace necesario incrementar las investigaciones sobre los efectos del aluminio en las plantas.
Estos estudios deben enfocarse en la localización y la cuantificación del Al en los tejidos, para posteriormente, poder establecer las posibles vías y mecanismos fisiológicos, bioquímicos y moleculares implicados, con el fin de comprender mejor los procesos de adaptación, y por lo tanto, contribuir en el mejoramiento de cultivos más tolerantes al aluminio, y sentar las bases para las estrategias de fitoremediación.
Esta revisión se enfoca en la descripción técnica de las diferentes herramientas empleadas en la localización y cuantificación del Al de manera clara y puntual. Esta información integrada ayudará en los estudios de la interacción del Al y las plantas, reduciendo el tiempo para la elección de las técnicas, así como para esclarecer cuál técnica es más conveniente aplicar a los intereses de la investigación, y así poder dilucidar la naturaleza de la sensibilidad, tolerancia o acumulación del Al en las plantas.
Contribución de los Autores
Conceptualización, análisis formal, escritura, revisión y edición: V.M.R.S. Validación, administración del proyecto, adquisición de fondo: R.C.O. Investigación, metodología: V.M.R.S. Escritura: revisión y edición: V.M.R.S., R.C.O., S.K.H. y J.D.M.M. Investigación, escritura: preparación del borrador original, escritura: revisión y edición: V.M.R.S., S.K.H., R.C.O. y J.D.M.M.











 nueva página del texto (beta)
nueva página del texto (beta)