Introducción
El ñame espino (Dioscorea rotundata Poir.) es considerado un alimento básico y una buena fuente de carbohidratos, proteínas, vitaminas y minerales, y además, contribuye sustancialmente a la dieta humana como fuente importante de energía (González-Vega, 2012; Omojasola y Sanu, 2021).
El ñame se considera un alimento básico de gran importancia económica debido a que fomenta la generación de ingresos a productores, procesadores y vendedores. Este tubérculo, se produce principalmente en las regiones tropicales y subtropicales de África, Asia, América central y del sur. La mayor parte de la producción mundial de ñame proviene de la región agroecológica de sabana ubicada en África occidental, lo que representa el 92% (66.8 millones de toneladas) de la producción mundial (FAOSTAT, 2019). En Latinoamérica, Colombia es el segundo productor (409 165 toneladas) después de Haití.
En Colombia, el cultivo de ñame espino, ha alcanzado una alta importancia social en las zonas rurales de la región Caribe, debido a que el tubérculo hace parte de la dieta alimenticia de los pequeños productores, y genera además excedentes que son comercializados en los mercados locales. Adicionalmente, en los últimos años el tubérculo ha incursionado en los mercados internacionales, generando mejores precios e ingresos adicionales para los pequeños productores rurales. Según las cifras oficiales (MinAgricultura, 2019), entre los años 2015 y 2019 se han comercializado en el exterior un total de 32 383 toneladas de ñame espino con destino a los mercados de los Estados Unidos, Puerto Rico y las islas del Caribe (Guadalupe, Aruba y Curazao). Además de la importancia para las familias rurales, esto ha representado para el país ingresos por valor de US$27 362 millones. A pesar de este repunte en el mercado, las estadísticas oficiales solo registran un aumento del 8.5% en la productividad en los últimos cinco años, lo cual puede ser debido a las diversas limitaciones sanitarias y de producción que afectan el cultivo, entre las que se encuentran la baja calidad de la semilla utilizada para la siembra (MinAgricultura, 2019).
El ñame espino, es una planta dioica procedente de la hibridación de las especies silvestres D. abyssinica y D. praehensilis, las cuales, se distribuyen en áreas de sabana y selva tropical en África occidental y central, respectivamente (Scarcelli et al., 2019). Es una planta herbácea - perenne, de ciclo vegetativo largo (12 meses) y de reproducción sexual o clonal. Esta planta presenta una amplia adaptabilidad a condiciones de pluviosidad (1.500 a 2.000 mm) y fertilidad de suelos (Aighewi et al., 2021). La siembra se realiza utilizando tubérculos enteros o subdivididos en porciones más pequeñas, comúnmente denominadas como “presas”, las cuales presentan variabilidad en los porcentajes de brotación (Brice et al., 2019), lo cual, trae como consecuencia fallas en el establecimiento, des uniformidad en los cultivos, transmisión de plagas y enfermedades, baja producción y calidad de la cosecha. Aun cuando los tubérculos obtenidos en la cosecha son adecuados para el mercado local, recientes reportes indican que tan solo 30% de los tubérculos cosechados reúnen los requisitos de tamaño, forma y sanidad, requeridos por el mercado internacional (Moreno-Arteaga, Martínez y Mesa, 2012). La producción de tubérculos de ñame espino de forma clonal, limita la tasa de propagación masiva de ñame y la disponibilidad de tubérculos-semilla.
Aparte de lo anterior, en los últimos años se ha reportado (Martínez et al., 2021) un comportamiento muy inestable en la disponibilidad de semilla de ñame para la siembra, ocasionado por la escases de tubérculos en el mercado debido a precios favorables que incentivan su completa comercialización en el mercado local y de exportación, lo cual ha elevado sustancialmente el precio de la semilla. Considerando los altos precios y la cantidad de semilla requerida para la siembra (1.300 y 2.000 kg ha-1), lo anterior hace que actualmente el costo de la semilla para la siembra represente aproximadamente el 30% de los costos totales de producción del cultivo. Esta situación ha conllevado a que el ñame sea uno de los cultivos de economía campesina, con los costos más elevados para su establecimiento, pues requiere de una muy alta inversión tan solo para su establecimiento, convirtiendo en una inversión de muy alto riesgo, debido a los cambios que se puedan presentar en el comportamiento del clima.
Actualmente, en otros cultivos de propagación vegetativa se han desarrollado nuevos métodos para abordar los retos de los costos y la calidad de la semilla para la siembra, entre cuyas técnicas se encuentran el cultivo de tejidos y la producción de minitubérculos, lo cual garantiza una multiplicación más rápida y la obtención de plantas más uniformes, sanas y genéticamente de mejor calidad (Aighewi, Asiedu, Maroya y Balogun, 2015; Rehman, Zaman, Khalid, Rehman, y Noor, 2019; Farran y Mingo-Castel, 2006).
En estudios recientes realizados en el Caribe Colombiano se han identificado algunas bacterias asociadas a las raíces del cultivo del ñame, dentro de los cuales se han caracterizado algunas que han mostrado capacidad para incentivar el crecimiento, actuando como promotoras del crecimiento de las plantas o PGPR (Plant Growth Promotion Rizobacterias). Las rizobacterias también han mostrado, bajo condiciones experimentales su capacidad de solubilizar fósforo (Sánchez y Pérez, 2018), por lo que podrían presentar un impacto positivo en la producción de minitubérculos de ñame. En el presente trabajo de investigación, se evaluó la capacidad de las rizobacterias DCR11 (Azotobacter vinelandii), DSC21 (Brevibacillus laterosporus) y DSC1 (Bacillus licheniformis) para promover la producción de minitubérculos en plántulas de ñame obtenidas a partir de esquejes, bajo condiciones de casa de malla.
Materiales y Métodos
La presente investigación se realizó en las instalaciones del Centro de Investigación Turipaná, de Agrosavia localizado a 8º50’79” N y 75º47’58” O en el municipio de Cereté, departamento de Córdoba en Colombia. Este centro se encuentra ubicado a 13 m de altitud y presenta una temperatura mínima promedio de 24 °C y máxima promedia de 34 °C. La precipitación media anual varia de 1000 a 1500 mm año-1. Según la clasificación de Holdridge (1978) el área de estudio pertenece a la zona agroecológica Bosque seco Tropical (BsT).
Material vegetal
Para la presente investigación se utilizó el genotipo de ñame espino identificado con el código 0307-49SB, perteneciente al banco de germoplasma de ñame de Agrosavia. La producción del material vegetal para el experimento se ejecutó en cuatro etapas. En la primera etapa se garantizó la calidad genética del material, mediante la producción in vitro de plantas madre, a partir de semilla vegetativa super-élite. En la segunda etapa se realizó la aclimatación de las plántulas madre a las condiciones de la casa de malla; en la tercera etapa se obtuvieron los esquejes a partir de las plantas madre; y en la última etapa se realizó la siembra de los esquejes para la producción de plántulas para el experimento. A continuación, se detallan los procedimientos llevados a cabo en cada una de estas etapas.
Etapa 1. Producción de plantas madre. La producción de plantas madre se realizó en el Laboratorio de producción vegetal del Centro Investigación Turipaná, de Agrosavia. Para ello, se tomaron segmentos nodulares de 1.0 cm de largo, los cuales fueron sembrados en contenedores de polipropileno de 750 mL de capacidad, que contenían 80 mL del medio de cultivo Murashige y Skoog (MS)®, complementado con 30 g de sacarosa, 100 mg myoinositol®, 1.0 mg de tiamina® y 2.0 g de Phytagel®, a un pH de 5.8 (Protocolo GA-O-13). Posterior a la siembra, los contenedores fueron tapados y sellados en forma aséptica, y colocados en un cuarto de crecimiento durante 4 a 5 semanas a una temperatura de 26 a 30 °C con un fotoperíodo de 10 a 16 horas de luz.
Posteriormente, se seleccionaron plántulas uniformes, vigorosas, con abundantes raíces que presentaban de 4 a 5 cm de longitud y 4 a 6 hojas diferenciadas. Las plantas seleccionadas fueron lavadas con agua destilada, eliminando los residuos del medio de cultivo y las raíces fueron sumergidas en oxicloruro de cobre (2.0 g L-1), durante 2 a 3 min. Luego se secaron y envolvieron en papel absorbente humedecido y transportadas a la casa de malla para su siembra.
Etapa 2. Aclimatación. Las plántulas madre se sembraron en bandejas plásticas de 24 alveolos que contenían un sustrato compuesto por una mezcla de aluvión 60%, arena 30% y lombriabono 10%, previamente desinfectado con West Terrasafe® (5.0 mL L-1). En la casa de malla se realizó un proceso de endurecimiento manteniendo inicialmente las plántulas por espacio de tres semanas bajo condiciones de baja luminosidad (27-30% de la luz incidente, mediante polisombra), a una temperatura promedia de 28-34 °C y nebulización con agua cada 3 a 12 min por espacio de 3 a 12 segundos, con el fin de mantener la humedad relativa entre 80-95% y evitar la desecación. Al final de la tercera semana se retiró la polisombra y las plantas se mantuvieron durante otras tres semanas a plena luminosidad (100% de la luz incidente), registrándose un promedio de temperatura de 34-38 °C y nebulización cada 5 a 30 min por espacio de 5 a 20 seg para mantener una humedad relativa del 60-80%. A partir de la segunda semana de endurecimiento se realizaron riegos dirigidos con una frecuencia diaria, dos veces al día. De igual forma, se realizaron aplicaciones preventivas de fungicidas como Ridomil Gol®68 WG (1.0 g L-1), Dithane™ M-45 (2.0 g L-1), Nativo75 WG® (1.0 cc L-1) y Oxicloruro de cobre (4.0 g L-1) y se realizó una aplicación de fertilización foliar una vez por mes de Cerostress®. A partir de la sexta semana de crecimiento de las plantas madre, se consideró el material vegetal apto para la obtención de esquejes para el experimento.
Etapa 3. Obtención de esquejes. Los esquejes se obtuvieron a partir de la sexta semana de crecimiento de las plantas madre, obteniendo esquejes apicales, con una longitud entre 7 a 10 cm, con presencia de al menos dos nudos y un foliolo u hoja por esqueje. La extracción de los esquejes a partir de las plantas madre se realizó todo en el mismo día, obteniendo en total 4 536 esquejes, para un total de 189 bandejas.
Etapa 4. Siembra de esquejes y establecimiento del experimento. Los esquejes obtenidos fueron sembrados en bandejas de germinación de 24 alveolos, previamente llenas con un sustrato conformado por una mezcla de aluvión 85%, arena 10% y materia orgánica 5%, previamente desinfectado con el producto West Terrasafe® (5.0 mL L-1 1.3 Diformil Propano). La distribución de los esquejes para la siembra en cada bandeja se realizó teniendo en cuenta el tamaño del esqueje, donde los esquejes de 7-8 cm fueron ubicados en la parte central de la bandeja y los esquejes de 9-10 cm en los alveolos de la parte externa. Esto con el fin de generar sombreamiento en las plantas centrales, asimismo, poder cosechar plantas de la misma edad de desarrollo durante los muestreos. Una vez establecidos los esquejes, se realizaron riegos tres veces al día durante los primeros ocho días. Posteriormente, el riego se aplicó dirigido a cada bandeja con frecuencia diaria.
Las bandejas se distribuyeron en tres niveles de sombreamiento (0, 65 y 80%). Las condiciones ambientales promedio bajo cada nivel de sombreamiento fueron de 31.46 °C y humedad relativa del 78.66% a 0% de sombra; 28.96 °C y humedad relativa de 76.66% a 65% de sombreamiento; 30.06 °C y humedad relativa promedio del 80.66% a 80% de sombreamiento.
Producción de inóculos bacterianos e inoculación de esquejes
Se evaluó la inoculación de las rizobacterias identificadas con los códigos DCR11 (Azotobacter vinelandii), DSC21 (Brevibacillus laterosporus) y DSC1 (Bacillus licheniformis), las cuales fueron seleccionadas debido a que en experimentos previos mostraron capacidad para la promoción del crecimiento en plantas de ñame (Sánchez y Pérez, 2018). Dichas rizobacterias forman parte del banco de trabajo de microorganismos del Laboratorio de Microbiología Agrícola del Centro de Investigación Turipaná de Agrosavia.
Las rizobacterias fueron sembradas en medios de cultivo con caldo agroindustrial (Luna-Castellanos y Sánchez, 2022), en agitación orbital (Labnet Orbit™ 1900, USA) a 150 rpm. La densidad de la suspensión bacteriana fue determinada a una absorbancia de 540 nm, ajustándola a una población de 108 UFC mL-1. Los inóculos producidos en el laboratorio se empacaron en recipientes plásticos estériles con capacidad de 3.800 mL y transportados a casa de malla para ser inoculados en los diferentes tratamientos del experimento.
Tratamientos
Se evaluó la producción de minitubérculos en plántulas de ñame establecidas a partir de esquejes, bajo tres niveles de sombreamiento (0, 65 y 80%), e inoculación con tres rizobacterias (DCR11 A. vinelandii, DSC1 B. licheniformis, DSC21 B. laterosporus), a tres dosis de los inóculos y un control sin inoculación (0, 2, 4 y 6 mL pl-1). Lo anterior dio como resultado la evaluación de 27 tratamientos, correspondientes a la combinación de niveles de sombreamiento, las rizobacterias, y las dosificaciones del inóculo (Cuadro 1). El inóculo bacteriano fue aplicado directamente en el suelo, mediante inyección con jeringa al pie de los esquejes a los dos (2) días después de la siembra (DDS), y refuerzos a los 45, 95 y 130 DDS. El factor de sombrío se consideró debido a que la planta de ñame espino originariamente crece y se reproduce en ambientes forestales con sombrío permanente y baja disponibilidad de luz.
Cuadro 1: Tratamientos evaluados para la evaluación de la producción de minitubérculos en plantas de ñame espino.
Table 1: Treatments evaluated for the assessment of minituber production in hawthorn yam plants.
| Sombreamiento | Rizobacterias | Dosis |
| % | mL pl-1 | |
| 0 | Control | 0 |
| 0 | DCR11 Azotobacter vinelandii | 2 |
| 0 | DCR11 Azotobacter vinelandii | 4 |
| 0 | DCR11 Azotobacter vinelandii | 6 |
| 0 | Control | 0 |
| 0 | DSC1 Bacillus licheniformis | 2 |
| 0 | DSC1 Bacillus licheniformis | 4 |
| 0 | DSC1 Bacillus licheniformis | 6 |
| 0 | Control | 0 |
| 0 | DSC21 Brevibacillus laterosporus | 2 |
| 0 | DSC21 Brevibacillus laterosporus | 4 |
| 0 | DSC21 Brevibacillus laterosporus | 6 |
| 0 | Control | 0 |
| 65 | DCR11 Azotobacter vinelandii | 2 |
| 65 | DCR11 Azotobacter vinelandii | 4 |
| 65 | DCR11 Azotobacter vinelandii | 6 |
| 0 | Control | 0 |
| 65 | DSC1 Bacillus licheniformis | 2 |
| 65 | DSC1 Bacillus licheniformis | 4 |
| 65 | DSC1 Bacillus licheniformis | 6 |
| 0 | Control | 0 |
| 65 | DSC21 Brevibacillus laterosporus | 2 |
| 65 | DSC21 Brevibacillus laterosporus | 4 |
| 65 | DSC21 Brevibacillus laterosporus | 6 |
| 0 | Control | 0 |
| 80 | DCR11 Azotobacter vinelandii | 2 |
| 80 | DCR11 Azotobacter vinelandii | 4 |
| 80 | DCR11 Azotobacter vinelandii | 6 |
| 0 | Control | 0 |
| 80 | DSC1 Bacillus licheniformis | 2 |
| 80 | DSC1 Bacillus licheniformis | 4 |
| 80 | DSC1 Bacillus licheniformis | 6 |
| 0 | Control | 0 |
| 80 | DSC21 Brevibacillus laterosporus | 2 |
| 80 | DSC21 Brevibacillus laterosporus | 4 |
| 80 | DSC21 Brevibacillus laterosporus | 6 |
Diseño experimental
Se utilizó un diseño experimental completamente al azar (DCA) con arreglo en parcelas subdivididas con tres repeticiones. La parcela principal correspondió a los tres niveles de sobreamiento (0, 65 y 80%), las subparcelas correspondieron a las tres rizobacterias (DCR11 A. vinelandii, DSC1 B. licheniformis, DSC21 B. laterosporus y) y un control sin inoculación, y las sub-subparcelas a las dosis del inóculo (0, 2, 4 y 6 mL pl-1), lo cual conformó un total de 36 tratamientos. La unidad experimental estuvo conformada por una bandeja con 24 plantas, para un total de 108 bandejas en el experimento.
Variables evaluadas
Se evaluaron las siguientes variables:
Detección de hormonas. Se realizaron pruebas para comprobar la habilidad de las rizobacterias para la promoción de crecimiento, mediante la detección de la producción de citoquininas y auxinas (ácido indol-3-acético) (AIA). La detección de citoquininas se realizó bajo condiciones in vitro utilizando como medio de cultivo el caldo M9 suplementado 20% glucosa, 0.2% de casaminoácidos, 0.01% de tiamina y 2 pg de biotina L-1 (El-Tarabily, Nassar, Hardy y Sivasithamparam, 2003). Los caldos con las rizobacterias se colocaron a 30 ± 2 °C y 150 rpm durante cinco días, por triplicado, empleando como control positivo Bacillus subtilis ATCC® 19659™ y como controles de citoquininas Trans-Zeatin (Sigma aldrich®) y Trans-Zeatin Riboside (Sigma aldrich®). Una vez obtenidos los caldos se centrifugaron (Thermo, IEC HN-SII, USA) 14 mL del caldo de cultivo a 16.000 rpm durante 10 min a 4 °C y el sobrenadante se neutralizó con NaOH 7 N (pH 7.0); posteriormente se filtraron los caldos bacterianos a través de un filtro de acetato de celulosa (Millipore®, tamaño del poro 0.22 µm, diámetro 47 mm). Los caldos bacterianos se secaron y se extrajeron tres veces con acetato de etilo. Después del secado, la fase orgánica se volvió a disolver en metanol. A la fracción de metanol con los extractos bacterianos se les realizó una cromatografía sobre gel de Sílice 60 PF254 (Merck®), usando como fase móvil n-butanol/ácido acético/agua (12:3:5). La placa de gel de Sílice 60 PF254 (Merck®) se reveló bajo luz ultravioleta a 240 nm, determinando el Rf (Relación de la distancia recorrida por la muestra respecto a la distancia recorrida por el disolvente); para realizar el cálculo de Rf se utilizó la siguiente fórmula:
Las auxinas se determinaron igualmente bajo condiciones in vitro mediante el ensayo colorimétrico descrito por Glickman y Dessaux (1995). Para ello se utilizó como medio de cultivo el K-lactato suplementado con triptófano a 50 mg L-1. Los cultivos bacterianos se incubaron durante 72 h a 150 rpm en oscuridad y como control positivo se utilizó B. subtilis ATCC® 19659™. La lectura se realizó utilizando el reactivo de Salkowsky (FeCl3 7H2O 12 g L-1 en H2SO4 7.9M) en una relación 1:1 con la suspensión bacteriana, dejándose reaccionar durante 30 min bajo condiciones de oscuridad. La lectura se realizó en un espectrofotómetro (Genesys™ 10S UV-Vis, Thermo Scientific®, USA), a una absorbancia de 540 nm. Los datos de absorbancia se interpolaron con los datos de curva patrón, determinando la cantidad de indoles totales producidos en µg mL-1.
Producción de minitubérculos
A los 210 DDS se realizó un muestreo destructivo, para lo cual se extrajeron de cada bandeja las plantas ubicadas en parte central y se contabilizaron los minitubérculos formados en cada una de las unidades experimentales.
Manejo del experimento
El sustrato se caracterizó por presentar una textura franco-arcillosa, contenido de materia orgánica de 1.48%, pH 6.4, contenido de fósforo y potasio intercambiables de 17.89 y 0.79 mgL-1 respectivamente; teniendo en cuenta los requerimientos promedios del cultivo de ñame (O’sullivan, 2010) y el análisis del contenido de nutrientes en el sustrato elaborado se procedió a realizar la dosificación de los nutrientes. Para la fertilización se usó el producto comercial NutrimonTriple 15®, a una dosis de 10 g planta-1. La aplicación del fertilizante se efectuó de forma fraccionada: 20% a los 45 DDS, 30% a los 95 DDS y la última fracción correspondiente al 50% fue aplicada a los 130 DDS.
Adicionalmente, se realizaron aplicaciones de fertilizantes foliares y fungicidas desde los 8 hasta los 190 DDS. La frecuencia de aplicación varió según la fenología de la planta, desde los 8 a los 30 DDS se realizaron aspersiones foliares cada ocho (8) días de los productos Agrimins granulado® (4.0 mL L-1), Nutrifoliar completo® (5.0 mL L-1), Oxicloruro de cobre® (4.0 g L-1), Dithane M-45® (3.0 g L-1) y Ridomil Gold® (4.0 g L-1). Desde los 60 a 90 DDS se aplicaron con una frecuencia quincenal los fertilizantes Fosfostress® (3.0 mL L-1) y CAB® (2.0 mL L-1). Los fungicidas Amistar Top SC® (3.0 mL L-1), Benomyl® (3.0 g L-1) y Nativo 75 WG® (0.3 mL L-1) asperjados con una periodicidad quincenal, desde los 91 hasta los 170 DDS. Posteriormente, hasta los 190 DDS se realizaron aplicaciones quincenales de Cerostress® (5.0 mL L-1), Carbendazim® (1.0 mL L-1) y Propiconazole® (2.0 mL L-1).
Análisis estadístico
Los conteos del número de minitubérculos presentaron datos con una distribución no normal, por lo cual se sometieron a un análisis de comparación múltiple mediante la prueba de Kruskal-Wallis con la opción de Wilcoxon con el valor P aproximado (chi-cuadrado) y prueba de comparaciones múltiples de Bonferroni. Las demás variables se sometieron a análisis de varianza (ANOVA) previa comprobación del cumplimiento de los supuestos del modelo, mediante la prueba de Shapiro-Wilk y prueba de Levane. En los casos en que se detectaron diferencias significativas se compararon con una prueba de separación de medias utilizando la prueba HSD de Tukey. Los análisis estadísticos se realizaron con la ayuda del paquete estadístico SAS enterprises guide versión 9.4 (SAS, 2013).
Resultados y Discusión
Hormonas
Los experimentos demostraron la capacidad de las rizobacterias objeto de estudio para producir citoquininas y auxinas bajo condiciones in vitro, lo cual corrobora la potencialidad de uso como PGPR. En cuanto a la producción de citoquininas se destacan la rizobacteria DCR11 A. vinelandii por presentar valores superiores a los controles Trans - Zeatin®y Trans - Zeatin-Riboside®. La rizobacteria DCR11 presentó valores que fueron 31.71 y 29.37% superiores a los dos controles Trans - Zeatin® y Trans - Zeatin-Riboside®, respectivamente, mientras que la rizobacteria DSC21 B. laterosporus presentó valores 21.97 y 19.80% superiores a los mismos controles, respectivamente. La rizobacteria DSC1 B. licheniformis, por el contrario, presentó valores de citoquininas que resultaron inferiores a los controles (Cuadro 2).
Table 2: Cytokinin and auxin production by plant growth-promoting rhizobacteria.
| Rizobacterias | Citoquininas | AIA |
| (Rf)† | (µg mL-1)† | |
| DCR11 Azotobacter vinelandii | 0.947±0.02 a | 8.88±0.21 c |
| DSC21 Brevibacillus laterosporus | 0.877±0.08 ab | 11.47±0.29 b |
| DSC1 Bacillus licheniformis | 0.130±0.09 d | 13.00±1.22 b |
| Bacillus subtilis ATCC® 19659™ (Control positivo) | 0.283±0.04 d | 40.90±5.24 a |
| Control Trans - Zeatin® | 0.719±0.02 bc | NA†† |
| Control Trans - Zeatin-Riboside® | 0.732±0.02 c | NA†† |
| CV % | 8.23 | 16.51 |
| R- cuadrado | 0.98 | 0.97 |
†Promedio de tres repeticiones. Medias con distintas letras dentro de cada columna difieren estadísticamente (P ≤ 0.05). ††NA=No aplica.
†Average of three replicates. Means with different letters within each column differ statistically (P ≤ 0.05) (n = 3). ††NA= Does not apply.
Es bien conocido que las citoquininas son compuestos que al ser liberados por las bacterias en la rizosfera pueden influenciar el crecimiento de las plantas que crecen a su alrededor (Kabbara et al., 2020). Las citoquininas presentan efectos sobre la dominancia apical, la división celular, el crecimiento de las raíces, la señalización nutricional, la senescencia de tejidos y las interacciones entre plantas y patógenos (Lira-Saldívar, 2014; Rivero, Medina y Zavaleta, 2016; Gupta, Leibman, Pizarro y Bar, 2021). Al respecto algunos autores han identificado diversos géneros de bacterias aisladas del suelo que han mostrado capacidad para producir citoquininas, entre las cuales se pueden mencionar Pseudomonas, Bacillus y Azotobacter (Kapoor y Kaur, 2016; Chobotarov, Volkogon, Voytenko y Kurdish, 2017; Frébortová y Frébort, 2021). En estudios realizados por Maruyama et al. (1986) con bacterias Gram negativas detectaron fracciones de citoquinina (FC) con valores comparativos Rf: 0.5-0.6 y 0.7, los cuales resultan inferiores a los detectados en este experimento. De igual forma, Hussain y Hasnain (2009) determinaron fracciones de citoquininas en extractos bacterianos de B. licheniformis, B. subtilis y P. aeruginosa separados por FC con valores Rf: 0.5-0.54 y 0.58, respectivamente, igualmente inferiores a los encontrados en este experimento para las rizobacterias DSC21 y DCR11.
Con relación a las auxinas (Cuadro 2), los resultados de los experimentos mostraron la capacidad de las rizobacterias, objeto de este estudio para producir compuestos con actividad auxínica (Ácido Indol-3-Acético o AIA), sin embargo, en este caso las tres rizobacterias evaluadas presentaron valores estadísticamente inferiores al control positivo Bacillus subtilis ATCC® 19659™, con valores que fluctuaron entre 8.88 y 13.00 µg mL-1. Dentro de las tres rizobacterias evaluadas, los mayores valores de AIA encontrados se obtuvieron en DSC21 y DSC1 (Cuadro 2).
Los resultados de la presente investigación coinciden con reportes de Sosa-Pech, Ruiz, Tun, Pinzón y Reyes (2019) quienes trabajando con el género Bacillus reportan rangos de producción de AIA de 4.13 a 8.59 µg mL-1.
Minitubérculos
A los 210 DDS se pudo evidenciar la capacidad de producción de minitubérculos por parte de las plantas de ñame en condiciones de casa de malla por inducción con rizobacterias. Los minitubérculos producidos presentaron un peso promedio que varió entre 0.87 y 4.67 g, con una corteza de color café oscuro con aspecto áspero y abundantes raíces (Figura 1).
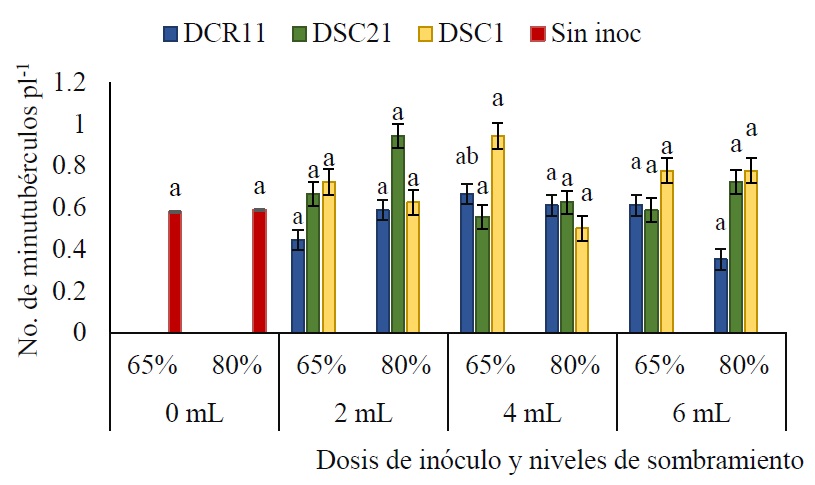
Los resultados del ANOVA arrojaron que entre los factores de estudio no hubo interacción significativa a los 210 DDS (P ≥ 0.05). La sombra es el único factor determinante en la producción de minitubérculos en plántulas obtenidas a partir de esquejes apicales (P ≤ 0.001). A los 210 DDS, los niveles de sombreamiento del 65 y 80% exhibieron diferencias significativas (P ≤ 0.05) respecto al control sin sombra (0%) (Figura 2). Entre los niveles de sombreamiento del 65 y 80% no se detectaron diferencias estadísticas significativas (P ≥ 0.05). Sin embargo, al emplear la sombra del 65% se generó un incremento del 3.41% en la producción de minitubérculos en comparación con la sombra del 80%. Asimismo, se observó que la rizobacteria DSC1 B. licheniformis es más efectiva bajo un nivel de sombreamiento del 65%, mientras que la rizobacteria DSC21 B. laterosporus presentó efectos positivos bajo un nivel de sombreamiento del 80% (Figura 2).
Lo anterior es indicativo de la necesidad de mantener condiciones de semipenumbra para maximizar la producción de minitubérculos. A este respecto, Primananda (2020) sugiere que la intensidad de luz óptima para el desarrollo y producción de las plantas o cultivos de ñame se encuentra entre 50-60%, lo que puede deberse a que el ñame es una especie que crece en ambientes bajo sombra forestal, domesticado por los agricultores en bosques perturbados en el ecotono bosque/sabana, donde el acceso a la luz es limitado por la presencia de árboles (Scarcelli et al., 2019). Diversos autores han indicado que el ñame presenta características umbrofilas que le permite crecer y producir bajo ambientes con restricciones de luz, lo que se acomoda a plantas con metabolismo C3 (Cornet, Sierra y Bonhomme, 2007). En este sentido, Lestari, Utami y Wawo (2019) en estudios realizados bajo esquemas de sombrío artificial, con niveles de 0, 25, 55 y 75% de sombrío, reportaron que el dosel de la planta crece de manera óptima en condiciones de plena luz, sin embargo, la producción de tubérculos y los niveles de clorofila fueron más uniformes bajo niveles de sombra del 25% y 55%, lo que coincide con los resultados de esta investigación. Estos niveles de sombreamiento constituyen un atributo importante para el desarrollo del sistema productivo de ñame bajo sistemas de agroforesteria.
Estudios realizados Shiwachi, Kikuno y Asiedu (2006) corroboran la producción de minitubérculos a partir de plántulas provenientes de la siembra de esquejes en dos variedades de D. rotundata, utilizando como medio de cultivo la cáscara de arroz carbonizada, bajo condiciones de sombra, a temperatura ambiente, logrando producir 1.7 minitubérculos por planta. Esto mismo fue corroborado por Aighewi et al. (2021), logrando la producción de 1.4 a 1.7 minitubérculos en plántulas establecidas a partir de esquejes en dos variedades de ñame, los cuales posteriormente fueron sembrados en campo, logrando una brotación entre el 87 y 97.8%.
Con relación a las rizobacterias, se evidenció que la inoculación de las rizobacterias DSC1 y DSC21 generó los mayores incrementos en la producción de minitubérculos (Figura 3). Lo anterior, probablemente debido a la capacidad de estas dos bacterias para producir auxinas y citoquininas, como factores promotores del crecimiento de las plantas.
Varios autores han descrito el potencial de los microorganismos para colonizar las raíces y afectar el crecimiento de las plantas (Kumar y Dubey 2020; Romano, Ventorino y Pepe, 2020; Lopes, Dias-Filho y Gurgel, 2021). El proceso de colonización de los microorganismos depende de varios factores, como: condiciones de humedad, quimiotaxis, adhesión y la capacidad de movimiento de los microorganismos (Loredo-Osti, López y Espinosa, 2004).
La colonización exitosa de una rizobacteria genera efectos beneficiosos sobre la salud y el crecimiento de la planta, lo que conlleva a una respuesta positiva al facilitar la absorción de ciertos nutrientes vegetales del medio ambiente (Sánchez-López, Pérez, Luna, García y Espitia, 2019; Rodríguez-Hernández et al., 2020) y la biosíntesis de hormonas promotoras del crecimiento de las plantas, reduciendo la susceptibilidad a enfermedades causadas por organismos fitopatógenos (Kim et al., 2009; Hamid, Lone y Mohamed, 2021).
La cepa bacteriana DSC1 correspondiente a la especie B. licheniformis, especie que ha sido referenciada como biocatalizador orgánico, asegurando una rápida colonización de la rizósfera, ocasionando un crecimiento vigoroso y sano de las plantas que crecen a su alrededor (Barreto, Valero, Muñoz y Peralta, 2007). En diversos estudios, se ha encontrado que el B. licheniformis posee la propiedad de producir sustancias hormonales que favorecen la división celular, la elongación radical, diferenciación celular y el incremento del área de la raíz en contacto con el suelo, especialmente debido a la formación de raíces adventicias (Molina-Romero et al., 2015; Velasco, Castellanos, Acevedo, Clarenc y Rodríguez, 2020). De igual forma, otras especies de este género, como B. laterosporus demuestran un aspecto muy amplio de actividades biológicas y un potencial como agente de control biológico (Li, Song, Yi y Kuipers, 2020), reduciendo la susceptibilidad a enfermedades causadas por organismos fitopatógenos (Hassan, Mclnroy y Kloepper, 2019; Aeron et at., 2020).
Respecto a las dosis y los niveles de sombreamiento, se evidenció que el uso de sombra sin la aplicación de inoculantes no generó diferencias significativas en la producción de minitubérculos (P ≥ 0.05). Sin embargo, la rizobacteria DSC1 B. licheniformis generó mayor número de minitubérculos a un nivel de sombreamiento del 65% y dosis de 4 mL (Figura 4). Por el contrario, a un nivel de sombreamiento del 80%, la DSC21 B. laterosporus fue la más efectiva, y en este caso la dosis de 2 mL tuvo efectos positivos (Figura 4).
Conclusiones
De acuerdo con estos resultados, se puede concluir que los tres factores estudiados (sombra, cepas y dosificación de la inoculación) juegan un papel fundamental en el proceso de formación de minitubérculos en las plantas de ñame. Las rizobacterias DSC1 B. licheniformis y DSC21 B. laterosporus presentaron la mayor potencialidad para su uso en la producción de minitubérculos a partir de la siembra de esquejes, bajo condiciones de casa de malla, lo cual probablemente se deba a su capacidad para producir fitohormonas. Una de las principales ventajas de la metodología para la producción de minitubérculos bajo condiciones de casa de malla, a partir de esquejes, es que se asegura la sanidad del material de propagación, garantizando la producción de una semilla de alta calidad sanitaria para la siembra de los cultivos en campo. Asimismo, esta metodología hace viable la producción masiva de semilla en ñame, garantizando la disponibilidad para los cultivos comerciales, además de presentar ventajas como tamaño pequeño, que facilita el almacenamiento, empaque y comercialización. Se requiere determinar los costos de producción masiva con la finalidad de calcular el valor económico del proceso de producción de semilla a base de minitubérculos, a fin determinar su factibilidad económica para las siembras comerciales de ñame.
Fondos
Este estudio fue financiado por el Ministerio de Agricultura y Desarrollo Rural Colombiano bajo los convenios número TV18 y TV19 con AGROSAVIA. Este trabajo formó parte del proyecto “Desarrollo de tecnologías para el manejo y producción de semillas de calidad para mejorar la uniformidad y productividad del cultivo de ñame de la región Caribe”.
Contribución de los Autores
Conceptualización: D.B.S.L. y J.C.T. Metodología: D.B.S.L. y J.J.T.C. Análisis: J.C.T. Laboratorio: L.L.L.C. y D.B.S.L. Análisis formal: J.C.T. Investigación: D.B.S.L., J.J.T.C., L.L.L.C., A.T.D.C y M.D.V.R.P. Recursos: D.B.S.L. Curación de datos: J.C.T. Preparación del borrador original: D.B.S.L. Revisión y Edición: J.C.T. y D.B.S.L. Visualización: J.C.T. y D.B.S.L. Supervisión: D.B.S.L. Administración del proyecto: D.B.S.L. Adquisición de fondos: D.B.S.L. y J.C.T.











 nueva página del texto (beta)
nueva página del texto (beta)