Introducción
Los aceites esenciales tienen potencial natural en los mecanismos de defensa de los vegetales, son compuestos volátiles producidos por muchas especies y actúan contra microorganismos fitopatógenos (Elshafie, et al., 2015). Su uso surge como una alternativa para prevenir y controlar enfermedades en la agricultura actual, cuyas prácticas de cultivo permiten utilizar determinadas sustancias en el manejo de patógenos (Robu, Covaci y Popescu, 2015). Entre los grupos importantes de plantas, las hierbas aromáticas contienen diferentes sustancias utilizadas en la medicina y agricultura para prevenir y tratar diferentes enfermedades (Juárez-Rosete et al., 2013; Chouhan, Sharma y Guleria, 2017).
El combate de enfermedades de la raíz de diversas especies de plantas cultivadas puede realizarse con aceites esenciales, cuyas propiedades con efecto fungicida (Wilson, Ghaouth y Wisniewski, 1999), pueden inhibir el crecimiento de fitopatógenos. Por otro lado, su uso y aplicación son prácticas sostenibles que mejoran la inocuidad de los cultivos y se consideran de bajo riesgo para el ser humano (Isman, 2000; Villa-Martínez et al., 2015). Dicho potencial antifúngico ha incrementado el interés para prevenir enfermedades de humanos y vegetales (Celis-Forero, Mendoza y Pachón, 2012; O’Bryan, Pendleton, Grandall y Ricke, 2016; Gogoi, Baruah y Nath, 1997; Wilson et al., 1999).
Un ejemplo de ello es el eugenol contenido en el clavo aromático, cuyos efectos son similares al fenol, considerado un anestésico que a dosis altas puede causar quemaduras a la superficie de estructuras de organismos plaga (Isaacs, 1983), por ejemplo, el sitio blanco del eugenol es la membrana citoplasmática de las bacterias (Devi, Nisha, Sakthivel y Pandian, 2010). Específicamente, el monoterpeno eugenol actúa sobre Botrytis cinerea, Monilinia fructigena, Penicillium italicum, Penicillium expansum y Phytophthora citrophthora en naranjas, peras y manzanas (Amiri, Dugas, Pichot y Bompeix, 2008; Landero et al., 2016).
Otra sustancia reportada por Matiz, Fuentes y León (2015), es el aceite de tomillo, al actuar como antibacterial en el control del acné. Al respecto, Coy y Acosta (2013) mencionan que la actividad antibacteriana se debe al 1,8-cineol con 21.5% en el control de Staphylococcus aureus, mientras que en otras investigaciones se observó efectividad sobre bacterias gram positivas y negativas (Nevas, Korhonen, Lindström, Turkki y Korkeala, 2004). Este compuesto también ha mostrado cierto control sobre hongos patógenos como Botrytis cinerea, Rhizopus stolonifer y de los pseudohongos Phytophthora italicum y P. citrophthora en post-cosecha (Camele et al., 2010).
Por otro lado, la canela (Cinnamomum sp.) es una especie que tiene algunas limitantes sanitarias pero significativas, como el daño causado por Phytophthora cinnamomi y Fusarium sp., que el manejo que se realiza generalmente mediante fungicidas químicos, lo cual ha tenido huella ambiental, siendo su mal uso la generación de resistencia en los patógenos del suelo (Baraldi et al., 2003). Por ello, existe la necesidad de alternativas menos tóxicas, de menor impacto para el ambiente y que sean efectivas para el manejo de estas enfermedades, sugiriendo así los aceites esenciales y extractos naturales en el manejo potencial de la marchitez causada por diferentes especies de Fusarium (Abdel-Monahim, Abo-Elyousr y Morsy, 2011).
Basado en la eficacia y las diferentes propiedades de los aceites naturales de plantas aromáticas o medicinales, se planteó determinar el potencial antifúngico de los aceites esenciales de tomillo y clavo sobre el control in vitro de P. cinnamomi y Fusarium sp. aislados de Cinnamomum verum.
Materiales y Métodos
Recolección de muestras y ubicación del estudio
El oomicete Phytophthora cinnamomi Rands y el hongo Fusarium sp. se aislaron de raíces de plantas de canela (Cinnamomum verum) con lesiones rojizas inducidas por Fusarium sp. y pudrición de raíces por P. cinnamomi. Durante la primavera/verano de 2018, se colectaron raíces de plantas de canela a 30 cm de profundidad, en Zozocolco de Hidalgo, Veracruz, México (20° 08′ 25.80″ N, 97° 34′ 31.80″ O). Posteriormente, las raíces se trasladaron, en bolsas Ziploc® y se procesaron en el laboratorio de hongos y patología vegetal del Centro de Agroecología del Instituto de Ciencias de la Benemérita Universidad Autónoma de Puebla.
Aislamiento de patógenos
El oomicete P. cinnamomi y el hongo Fusarium sp., se aislaron de raíces de canela, de forma aleatoria, se obtuvieron fracciones de raíces de un centímetro de longitud, posteriormente, se lavaron con NaClO al 1% v/v por 1 minuto y se enjuagaron tres veces (durante 3 min) con agua destilada. Para aislar a P. cinnamomi, se siguió la metodología de Andrade-Hoyos et al. (2012); los fragmentos de raíz se colocaron en cajas de Petri (de 9 cm), utilizando dos medios de cultivo, uno fue papa dextrosa agar (PDA de Bioxon®) y jugo-V8®, para este último se adicionaron antibióticos (pimaricina 10 µg L-1, ampicilina 292 µg L-1, rifampicina 10 µg L-1, pentacloronitrobenceno 0.10 g L-1 e himexazol 0.25 µg L‑1); finalmente, se colocaron a 28 ± 2 °C por 72 h. Para el aislamiento y purificación de Fusarium sp., se llevó a cabo un proceso similar, la siembra se hizo solo en PDA sin antibióticos y se incubó a 28 ± 2 °C por 72 horas.
Caracterización morfológica
La identificación morfológica del género Fusarium sp. causante de infección de raíces de canela, previamente se realizó inoculación en plántulas y se encontró la reproducción de síntomas y reaislamiento, se realizó de acuerdo con Burgess, Summerell, Bullock, Gott y Backhouse (1994) y P. cinnamomi, se llevaron a cabo estudios detallados sobre morfología de colonias, esporangios elipsoides papilados, y clamidosporas en placas de jugo V-8 clarificado, incubados a 28 ° C en la oscuridad durante 15 días. Se caracterizó con base en la metodología propuesta por Erwin y Ribeiro (1996).
Aceites esenciales
Las muestras frescas de hojas y tallo de tomillo se recolectaron en Atlixco, Puebla, y en el mercado local se compró el clavo seco, las fechas en las que se realizaron las colectas fueron en mayo del 2018. El material vegetal se trasladó dentro de una hielera y en el laboratorio se mantuvieron a 4 ºC, posteriormente se realizó la extracción del aceite esencial a partir de 1 kg de material vegetal.
Los aceites de tomillo y clavo se extrajeron mediante hidrodestilación como lo indican Wang, Wang y Yang (2009), utilizando un equipo Clevenger®, pesando 50 g de cada una de las especies (muestra fresca de tomillo y seca de clavo). Posteriormente, se agregó agua destilada estéril hasta cubrir en su totalidad a cada una de las muestras, enseguida se sometieron a temperatura de 100 ºC por 2h. Los aceites se separaron del hidrolato correspondiente y se almacenaron a 4 ºC, previo a su uso.
Control in vitro de Phytophthora cinnamomi y Fusarium sp. con Syzygium aromaticum y Thymus vulgaris
Para la preparación de cada tratamiento con sus respectivas repeticiones, previo a la solidificación (entre 40 y 50 °C) del medio, en placas con 100 mL del cultivo PDA se adicionaron los aceites Syzygium aromaticum (clavo) y Thymus vulgaris (tomillo) a tres concentraciones (60, 120 y 300 µL L-1) y cinco repeticiones por tratamiento y un tratamiento negativo (sin aceite). Posteriormente, un disco de 5 mm de diámetro de PDA con cultivo puro de 72 h de crecimiento, de P. cinnamomi y Fusarium sp., se transfirió al centro de otras placas con papa dextrosa agar (PDA) gelificado e incubó a 28 ± 2 ºC por 192 h (Figura 1).
Tasa de crecimiento (Tc) de especies fúngicas
Se calculó la tasa de crecimiento por día (mm/día), de acuerdo con el procedimiento establecido por Mead, Hudson y Hinton (1993), mediante la Ecuación 1. Para ello, se registraron los radios de crecimiento micelial de la colonia fúngica del día inicial y final. La Tc micelial se determinó registrando medidas con un vernier digital de los dos patógenos cada 8 h (Fusarium sp.) y 12 h (P.cinnamomi) durante 10 días (Abdel-Fattah, Shabana, Ismail y Rashad, 2007).
donde:
Tc = tasa de crecimiento
Cf = crecimiento diametral final en cm
Ci = crecimiento diametral inicial (día uno) en cm
Tf = tiempo final del crecimiento fúngico (día final)
Ti = tiempo inicial (día uno)
Esporulación
La esporulación de las colonias de P. cinnamomi se cuantificó a los 19 días de incubadas y en Fusarium sp. los conidios se contabilizaron a los 15 días, para ello, cada placa de Petri se enjuagó con 15 mL de agua destilada estéril, la superficie se raspó ligeramente con una espátula estéril y se filtró con gasa de algodón estéril (Protec®). Posteriormente, se tomó una alícuota de 0.5 mL de la suspensión de esporas del patógeno de cada tratamiento, y se transfirieron a una cámara de Neubauer para el conteo de conidios (Landero et al., 2016).
Análisis estadístico
El análisis de los resultados obtenidos se realizó considerando un diseño experimental completamente al azar, se realizaron análisis de regresión para los tratamientos S. aromaticum y T. vulgaris generando una ecuación con una curva representativa de cada uno de ellos (Liengme, 2002). Los resultados de crecimiento micelial y tasa de crecimiento de los patógenos se compararon mediante análisis de varianza utilizando un diseño factorial 2 × 2 y pruebas de separación múltiple de medias de Tukey (( = 0.05) con el software SAS v.9 para Windows®, (SAS, 1999). Los valores de crecimiento micelial mínimos y de producción de esporas máximos se estimaron a partir de la ecuación de regresión generada por el modelo con la ayuda del software Microsoft Excel®.
Resultados y Discusión
Control in vitro de P. cinnamomi y Fusarium sp.
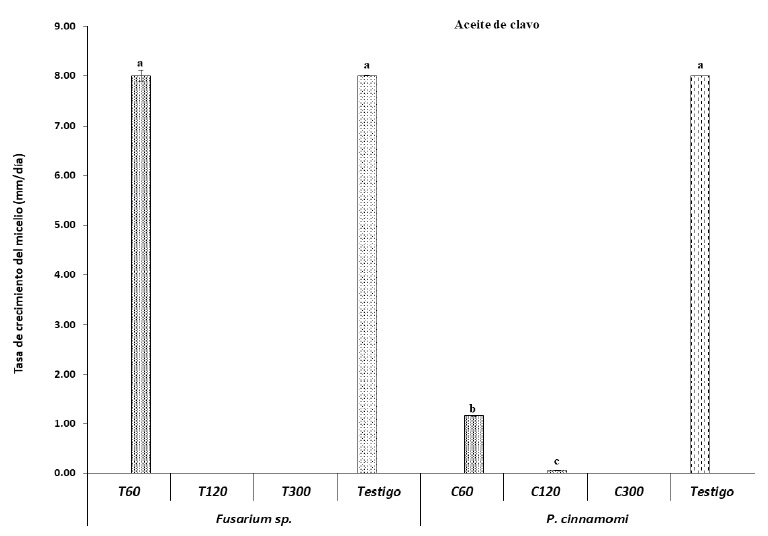
Al utilizar los aceites de tomillo y clavo a concentraciones diferentes, es notorio el efecto sobre el crecimiento de los patógenos aislados de Cinnamomum (Figura 1). El análisis del crecimiento de P. cinnamomi y Fusarium sp. con tratamientos de aceite esencial de tomillo y clavo, mostró coeficientes de variación entre 2 y 74%. Se identificaron diferencias significativas (P ≤ 0.05) en los efectos principales y la interacción simple en el crecimiento del micelio de ambos patógenos. Ambos aceites esenciales, a dosis bajas, muestran resultados estadísticamente iguales a los de los testigos, a excepción del aceite de tomillo que fue similar a las dosis más elevadas en control del crecimiento de los patógenos, mientras que la dosis media (120 µL L-1) y alta (300 µL L-1), inhibieron el crecimiento de Fusarium sp. y P. cinnamomi (Figura 2 y 3). Esto ha quedado de manifiesto con otros autores, quienes han investigado el potencial de estos aceites para el control de Rhizoctonia solani y Penicillium expansum en poscosecha de frutos (Landero et al., 2016), y en la inhibición del crecimiento de Rhizoctonia solani y Streptomycetes sp. (Arici y Sanli, 2014). Otro efecto observado, es la disminución de la actividad de enzimas degradadoras de la pared celular en la aplicación foliar de mentol sobre enfermedades causadas por patógenos necrótrofos en el frijol (Khaledi, Taheri y Tarighi, 2015). En el presente estudio, los aceites esenciales de clavo y tomillo tuvieron un 100% de control de Fusarium sp. y P. cinnamomi como se muestra en la Figura 2, demostrando el potencial control o inhibición de hongos fitopatógenos in vitro.
De acuerdo con el análisis de varianza (Figura 1 y 2), existen diferencias estadísticas significativas (P ≤ 0.0001) entre tratamientos (60, 120 y 300 µL L-1) a base de aceite esencial de clavo y tomillo sobre el crecimiento in vitro de cada uno de los patógenos. La tasa de crecimiento micelial es inversamente proporcional a las concentraciones de los aceites esenciales empleados. De tal modo que los testigos, tanto de Fusarium sp. como de P. cinnamomi, tuvieron una tasa de crecimiento de 8 mm por día. Las tres concentraciones de aceite de tomillo mostraron diferencia significativa, siendo las mejores 120 y 300 µL L-1. Sin embargo, también la dosis de 60 µL L-1, resultó mejor que el testigo (Figura 2).
Con el aceite de clavo, el crecimiento de Fusarium sp. fue nulo al utilizar dosis de 120 y 300 µL L-1, mientras que, con el mismo aceite el crecimiento de P. cinnamomi presentó una Tc micelial de 1.16 mm por día utilizando una dosis de 60 µL L-1. De igual manera, las dosis de 120 y 300 µL L-1 inhibieron la Tc micelial a un valor cercano a cero, con respecto al testigo (Figura 3).
Los aceites esenciales han demostrado potencial antimicrobiano como conservadores en el control de Rhizoctonia solani y Streptomycetes scabies en cultivo de papa (Arici y Sanli, 2014); en otros resultados, el aceite esencial de Cymbopogon citratus reduce hasta en un 60% el efecto de P. capsici y P. melonis (Amini, Farhang, Javadi y Nazemi, 2016). En el caso particular del aceite esencial de tomillo, se encontró que el efecto de su fase volátil es capaz de inhibir completamente el crecimiento de P. infestans (Soylu, Soylu y Kurt, 2006) y de la germinación de esporangios y zoosporas, y crecimiento micelial de P. capsici (Bi, Jiang, Hausbeck y Hao, 2012); así como en algunas especies de hongos en cereales (Matusinskya, Zouhar, Pavela y Novy, 2015). En otro estudio, los autores reportan que el follaje de orégano, romero y lavanda inhiben el crecimiento de Botritys cinerea, esto en función de la dosis utilizada (Soylu et al., 2006).
La inhibición in vitro de P. cinnamomi y Fusarium sp. con los aceites de clavo y tomillo demuestran su capacidad antimicrobiana para el control de estas dos enfermedades importantes en la producción agrícola. Dicho efecto sobre el crecimiento de los hongos fitopatógenos puede atribuirse a compuestos antimicrobianos como el carvacrol y eugenol, identificados en tomillo y clavo respectivamente (Daferera, Ziogas y Polissiou, 2003). En un estudio a diferentes concentraciones de aceite esencial de canela (60, 120 y 300 µL L-1) sobre frutos de pera en poscosecha afectados por P. expansum, el crecimiento micelial del patógeno se detuvo 81 h posteriores al tratamiento con la dosis más alta (Landero et al., 2016). Por otro lado, Sharma, Rajendran, Srivastava, Sharma y Kundu (2017), encontraron que el aceite de clavo inhibió el crecimiento del micelio de Fusarium oxysporum f. sp. lycopersici 1322 y la germinación de las esporas a 125 µL L-1. Por lo tanto, sugieren que el aceite de clavo es un potente agente antifúngico que podría usarse como biofungicida para el control de F. oxysporum y otros patógenos de forma preventiva. Se recomienda realizar pruebas a nivel de campo, ya que existen otros factores bióticos y abióticos que disminuyen la efectividad de los aceites esenciales en el control de enfermedades en los cultivos.
Esporulación
Con el aceite esencial del tomillo, Fusarium sp. disminuyó el número de esporas producidas. De acuerdo con los modelos matemáticos, se estima que el valor máximo de producción (245 esporas por mL) se presentaría si el hongo se desarrollara a una concentración de 79 µL L-1 de aceite esencial o bien, si se incrementa la concentración de este aceite arriba de 100 µL L-1, el número de esporas se reduciría completamente con 346.97 µL L-1 (Figura 3).
El modelo matemático (Figura 4), estimó la producción máxima de esporas, correspondiendo a 207 esporas por mL cuando el hongo se colocó a 60 µL L-1 de aceite esencial de clavo. También se observó que, por arriba de 50 µL L-1 de aceite de tomillo, el número de esporas se reduce hasta 73 esporas con 300 µL L-1. Sin embargo, después de 300 µL L-1 empieza a incrementar la cantidad de esporas (Figura 4).
Figura 4: Producción de esporas en Fusarium sp. con aceite esencial de tomillo. Emax = producción máxima de esporas por mililitro; CAET = concentración de aceite esencial de tomillo en µL L-1. Los dos parámetros se estimaron a partir de la ecuación de la forma y = ax2 + bx + c; y = número de esporas por milílitro, x = concentración de aceite esencial de tomillo.

Figure 4: Spore production in Fusarium sp. with thyme essential oil. Emax = maximum spore production per milliliter; CAET = concentration of thyme essential oil in µL L-1. The two parameters were estimated from the equation of the form y = ax2 + bx + c; y = number of spores per milliliter, x = concentration of thyme essential oil.
La inhibición in vitro de P. cinnamomi y Fusarium sp. con los aceites esenciales de clavo y tomillo, indican su capacidad antimicrobiana para el control de estas dos enfermedades importantes en la producción agrícola. De acuerdo con Daferera et al. (2003), el tomillo es una planta rica en carvacrol y el tomillo en eugenol; compuestos capaces de inhibir el crecimiento de algunos hongos y pseudohongos fitopatógenos (Botrytis cinerea, Fusarium sp.). Además, se ha reportado que los aceites esenciales disminuyen la severidad de algunas enfermedades afectando la germinación de esporas de algunas especies de hongos, entre ellos, Rhizopus stolonifer y Fusarium solani; esto los convierte en candidatos para la prevención de fitopatógenos en los programas de manejo integrado (Raymaekers, Ponet, Holtappels, Berckmans y Cammue, 2020).
Conclusiones
Los aceites de tomillo y clavo inhibieron el crecimiento micelial de P. cinnamomi y Fusarium sp. in vitro a dosis de 120 y 300 µL L-1. El más efectivo fue el aceite de clavo al inhibir completamente el crecimiento micelial y la germinación de esporas a 120 µL L-1 con un valor IC50 de 18.2 y 0.3 mg L-1 respectivamente. Cabe resaltar que con 120 µL L-1 de los aceites de clavo y tomillo son suficientes para detener el crecimiento de P. cinnamomi y Fusarium sp.
Los aceites esenciales son una alternativa potencial para el control de estos dos patógenos en plantas de canela. Sin embargo, es conveniente realizar pruebas de efectividad biológica en campo para tener mayor precisión en el control de los patógenos P. cinnamomi y Fusarium sp.
Disponibilidad de Datos
El conjunto de datos utilizados o analizados durante el estudio actual, están disponibles con el autor de correspondencia.











 nueva página del texto (beta)
nueva página del texto (beta)