Introducción
El cacao (Theobroma cacao L.) es nativo de las regiones tropicales húmedas de América del Sur (López-Medina y Gil-Rivero, 2017). Su producción mundial en el periodo 2017/2018 fue de 4.638 millones de toneladas (Nieto-Figueroa, Mendoza y Campos, 2020). Países como Costa de Marfil, Ghana, Indonesia, Nigeria y Camerún son los principales productores a nivel mundial, con un total del 73% de la producción global de granos de cacao, seguidos por Brasil, Ecuador, República Dominicana, Perú y México, quienes contribuyen con el 17% de la producción mundial, mientras que el 10% les corresponde a países de Asia y Oceanía (Gayi y Tsowou, 2017; Purcell, 2018).
El valor en el mercado de dicha producción fue de $98.3 mil millones de dólares (Marketsandmarkets, 2017). La cual se concentra en 5.5 millones de pequeños productores (0.2 a 0.5 hectáreas), no es tecnificada y se utilizan pocos insumos (Schneidewind et al., 2019). Se estima que en el futuro la producción mundial será insuficiente para su demanda, debido a factores como: pérdida significativa por plagas y enfermedades, árboles envejecidos, rendimientos limitados, y efectos del cambio climático (Nieto-Figueroa et al., 2020).
En África occidental, los árboles de cacao se derivan de semillas, mientras que en América del Sur y en el sudeste de Asia, se cultiva cacao mediante semillas y propagación vegetativa (injerto clonal) (Lahive, Hadley y Daymond, 2019). Además, la propagación vegetativa se usa para obtener copias exactas del genoma de la planta origen (Stuepp, Wendling, Xavier y Zuffellato, 2018). Esta propagación se hace por medio de tejido meristemático que contiene células indiferenciadas que pueden dar origen a los órganos requeridos para formar una nueva planta (Gárate-Navarro, Arévalo, do Bomfim y da Costa, 2017). Las investigaciones para mejorar la eficiencia de esta técnica de reproducción se han basado principalmente en analizar el origen de los esquejes, el efecto de la luz, la temperatura y la humedad, los mecanismos de enraizamiento y recientemente la aplicación de bioestimulantes (Essola, Gusua, Tchapda y Andre, 2017; Trofimuk, Kirillov y Egorov, 2020).
Los bioestimulantes son una alternativa viable para prevenir el estrés en las plantas y promover la producción agrícola (Du Jardin, 2015; Chakraborty et al., 2020). El quitosano es considerado un bioestimulante agrícola que es biocompatible, biodegradable e inocuo (Morin-Crini, Lichtfouse, Torri y Crini, 2019). Este compuesto se obtiene a partir de la quitina, la cual se extrae del exoesqueleto de crustáceos y de la pared celular de hongos verdaderos (Chakraborty et al., 2020). En su estructura química tiene monosacáridos de D-glucosamina y N-acetil glucosamina unidos por enlaces glucosídicos β 1-4 (Xing, Zhu, Peng y Qin, 2015). A este biopolímero se le atribuyen diferentes actividades bioactivas tales como: actividad antimicrobiana e inducción de respuesta inmune, de crecimiento y de desarrollo en las plantas (Bakshi, Selvakumar, Kadirvelu y Kumar, 2020). Sin embargo, el grado de acetilación, el tamaño del polímero y su viscosidad condicionan dichas actividades biológicas (Hidangmayum, Dwivedi, Katiyar y Hemantaranjan, 2019; Mukhtar-Ahmed, Khan, Siddiqui y Jahan, 2020; Chakraborty et al., 2020). Por ejemplo, Basa et al. (2020) concluyeron que el grado de polimerización y acetilación están estadísticamente relacionados con el grado de efectividad.
Se ha evaluado previamente el efecto del compuesto bioactivo quitosano como inductor de crecimiento y resistencia (Tayo, Ewane, Effa y Boudjeko, 2017), y su acción antimicrobiana contra patógenos del cacao (González-Peña, Gómez, Fernández, Vaillant y Falcón, 2016). Además, otros estudios también reportan los efectos antes mencionados en el bioestimulante Quitomax® cuyo ingrediente bioactivo es el quitosano (Jerez-Mompie, Morales, Dell'Amico y Falcón, 2018; Reyes-Pérez et al., 2019; Henríquez-Díaz et al., 2020; Gustavo-González et al., 2021). Sin embargo, hasta el momento no se han publicado artículos científicos que investiguen el efecto bioactivo del quitosano sobre el enraizamiento, establecimiento y crecimiento de esquejes de tallo en variedades de cacao. Por ello, el objetivo de este trabajo fue evaluar el efecto de Quitomax®, un bioestimulante a base de biopolímeros de quitosano, en dos variedades comerciales de cacao, en comparación con el producto comercial Raizyner GNS ya utilizado en la multiplicación de esquejes de este cultivo en Ecuador.
Materiales y Métodos
Condiciones generales para el desarrollo del experimento
Está investigación se estableció en la Facultad de Ciencias Agropecuarias de la Universidad Técnica Estatal de Quevedo, ubicada entre las coordenadas geográficas de 01º 06’ S y 79º 29’ O, a una altitud de 73 metros. La zona ecológica donde se estableció el experimento se clasifica como bosque húmedo tropical. La temperatura promedio durante el lapso del experimento fue de 25.3 °C; humedad relativa promedio del 86%, precipitación total de 1587.5 mm/año y una heliofanía total de 994.4 horas/luz/año (INAMHI, 2021).
Material vegetal
Se utilizaron esquejes de cacao con 35 días de edad, a partir de los clones CCN-51 y Nacional provenientes del banco de germoplasmas del Instituto Nacional de Investigaciones Agropecuarias (INIAP). Previo a la recolección de esquejes, se desinfectaron las manos y las herramientas (tijeras de podar y navaja) con una solución acuosa de hipoclorito de sodio al 1%. Los esquejes fueron obtenidos a partir de brotes originados en el 4° o 5° tallo lateral, cortando 15±2 cm del mismo. Para su obtención se realizó un corte en el tallo justo por debajo de cada nudo, además de realizar un corte en forma de cruz en la base de cada esqueje y proceder a sumergir la parte basal del corte en las soluciones correspondientes a cada tratamiento.
Quitosano
Como fuente de quitosano se utilizó el bioestimulante Quitomax® (RFC 010/17, registro central de fertilizantes de Cuba), el cual es una mezcla de biopolímeros de quitosano y sales químicas de amplio espectro de aplicación en cultivos, obtenido por el grupo de productos bioactivos del Instituto Nacional de Ciencias Agrícolas de Cuba (INCA) en el 2017. El quitosano de este producto tiene una masa molar de 100 kDa y un grado de acetilación del 13.7% (Falcón-Rodríguez, Costales, González y Nápoles, 2015).
Diseño experimental
El diseño experimental fue completamente al azar con un arreglo factorial (A ( B), donde A representó los dos clones y B a las tres concentraciones de Quitomax® utilizadas (0, 100, 500 y 1000 mg L-1), con tres repeticiones por tratamiento. Se aplicó el producto comercial Raizyner GNS (5000 mg L-1) como tratamiento control. Se utilizaron 10 estacas por repetición para un total de 240 esquejes en el experimento. Las plantas fueron tratadas por inmersión de la base de los esquejes por 30 minutos en las concentraciones de Quitomax®, y posteriormente transferidas a bolsas de polietileno de 1 kg con 25% arena estéril y 75% sustrato comercial Sogemix (75% Turba de Sphagnum spp., 25% vermiculita y caliza). Las plantas se almacenaron en una casa de cultivo y cubiertas con plástico al 90% de humedad relativa. El riego fue aplicado semanalmente con un nebulizador, mojando el sustrato en su totalidad (150 mL de agua destilada estéril).
Variables evaluadas
A los 60 días post plantación de los esquejes, se evaluó el número de hojas y el índice de plantas regeneradas (IPR) (Zaidi et al., 2006) mediante la Ecuación 1:
dónde: PEB es el número de plantas enraizadas con brotes y PI es el número total de plantas injertadas.
A los 90 días posteriores, se evaluaron la biomasa seca de la raíz, hojas y tallo, el número de raíces y la fracción radical (FR) (Ramos-Hernández et al., 2013) mediante la Ecuación 2:
dónde: BRS es la biomasa radical seca y BST es la biomasa seca total.
Para obtener biomasa seca (g), se pesó el material vegetal y se secó a 80 °C durante 72 h en una estufa (Shel Lab, modelo 1380 FM, E.U.A). Finalmente se volvió a pesar en balanza analítica.
Análisis estadístico
Los datos fueron sometidos a la prueba de normalidad de Kolmogorov-Smirnov (Massey, 1951) y la homogeneidad de varianzas según el criterio de Bartlett (Bartlett, 1937). Se realizó un análisis de varianza de una sola vía y la comparación múltiple de medias utilizando la prueba de Tukey con un nivel de significancia del 5% (( = 0.05). Los datos estadísticos fueron procesados empleando el programa estadístico Statistica v.12.0 (Statsoft).
Resultados y Discusión
El bioestimulante Quitomax® promovió un aumento significativo de las variables de crecimiento vegetativo evaluadas de los clones de cacao CCN-51 y Nacional (Figura 1), con las diferentes concentraciones aplicadas en comparación con el tratamiento control. El efecto bioestimulante fue mayor con el aumento de la concentración de Quitomax®, siendo el tratamiento con 1000 mg L-1 el que causó los mayores incrementos de biomasa seca de la raíz, el tallo y foliar, obteniéndose valores de entre 25 y 125% por encima del tratamiento control y en dependencia de la variable analizada.
Los beneficios que el quitosano causa en el desarrollo de los cultivos responden a la activación y mejora de diferentes procesos fisiológicos en la planta como son el aumento del enraizamiento, de la nodulación en especies simbióticas, de la absorción de nutrimentos esenciales para mejorar actividades metabólicas relacionadas con el crecimiento y con el incremento de la eficiencia y la tasa fotosintética, así como un mejor aprovechamiento del agua por la planta como resultado de una posible acción antitranspirante (Iriti et al., 2009; Costales-Menéndez et al., 2016; Costales-Menéndez, Falcón, García y Capdevila, 2020; Chakraborty et al., 2020).
El quitosano es un promotor del crecimiento vegetal no tóxico y biodegradable (Salachna y Zawadzińska, 2014). Respecto a las variables de crecimiento vegetativo evaluadas, se sabe que la aplicación foliar de quitosano sirve para varios propósitos, por ejemplo, aumenta la altura de la planta, el número de hojas, el peso del fruto y numero de frutos, y el rendimiento (Islam et al., 2018). La acumulación de biomasa está determinada por uno de los factores importantes, entre ellos el área foliar (Mukhtar-Ahmed et al., 2020). El incremento de la biomasa en los tratamientos con el bioestimulante Quitomax® podría estar ligado al incremento de hojas (área foliar). Se reportó un incremento en el área foliar en plantas de frijol, calabaza y naranja al aplicar quitosano, lo que proporcionó una mayor oportunidad para la absorción de luz por las moléculas de clorofila que conducen a una mayor acumulación de materia seca (Mondal, Malek, Puteh y Ismail, 2013; Ibraheim y Mohsen, 2015; Mohamed, 2018). También se sugiere que el quitosano puede inducir una señal para la síntesis de fitohormonas como las giberelinas y las auxinas para mejorar el crecimiento y desarrollo (Mukhtar-Ahmed et al., 2020).
Los resultados de la comparación del efecto bioestimulante del Quitomax® y el producto comercial Raizyner GNS, mostraron que estadísticamente tienen un efecto similar sobre las variables de crecimiento vegetativo evaluadas a las concentraciones de 100 y 500 mg L-1 (Cuadro 1).
Cuadro 1 Efecto del Quitomax® en el número de raíces y hojas de plantas de clones de cacao (CCN 51 y Nacional) en comparación con el producto comercial Raizyner GNS.E
Table 1: ffect of Quitomax® on the number of roots and leaves of cacao clone plants (CCN 51 and Nacional) compared with Raizyner GNS commercial product.
Variables |
Quitomax |
|||||||
0 |
100 |
500 |
1000 |
Raizyner GNS |
F |
P |
EE |
|
- - - - - - - - - - - - - - - - - - mg L-1 - - - - - - - - - - - - - - - - - - |
||||||||
Hojas |
9.3±3d |
12.8±3c |
16.7±3b |
19±3a |
14.2±3c |
85.5 |
0.005 |
1.6 |
Raíces |
4.7±2d |
7.2±2c |
8.8±2b |
11±2a |
7±2c |
60.2 |
10.5 |
|
3.7±2d |
7.8±2c |
9.2±2b |
10.5±2a |
7.2±2c |
100.5 |
1.2 |
||
Medias con letras iguales en la misma columna no difieren significativamente para el análisis de varianza (P < 0.05). FR = fracción radicular.
Means with the same letters in the same column do not differ significantly for the analysis of variance (P < 0.05). FR = root fraction.
Respecto a la concentración de 1000 mg L-1, Quitomax® fue estadísticamente mejor que el producto comercial Raizyner GNS y el tratamiento control con un 20 y 50% de diferencia respectivamente. Ya se ha establecido que el suministro exógeno de quitosano podría estar involucrado en el mantenimiento del estado nutricional a través de la estabilización de la membrana mediante un mayor nivel de antioxidantes, protegiendo así las membranas plasmáticas de los daños oxidativos y mejorando la permeabilidad de las células vegetales que eventualmente estimulan la absorción de nutrientes (Meshram, Deotale, Chute, Jadhav y Padghan, 2018).
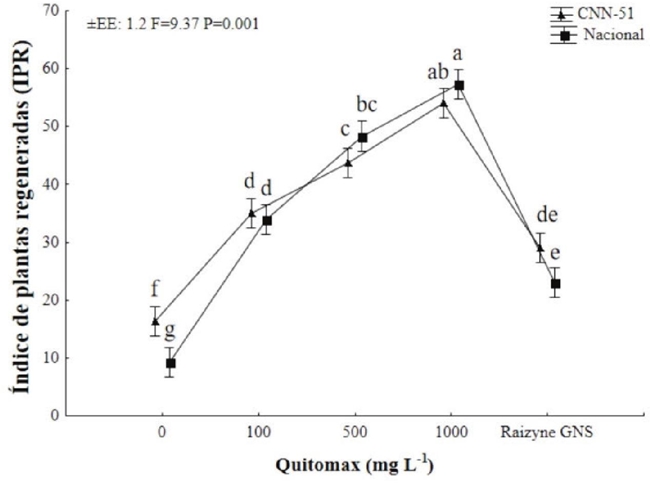
En relación a la regeneración de las plantas, Quitomax® disminuyó entre un 18 y un 50% los niveles de esquejes no enraizados (Figura 2). El máximo de supervivencia de las plantas (44 y 50% en dependencia del clon) se alcanzó con la concentración más alta (1000 mg L-1) evaluada de Quitomax®, resultado muy por encima del producto comercial Raizyner GNS, que redujo el nivel de esquejes no enraizados de entre 15 y 18% en ambas variedades estudiadas.
El aumento de la supervivencia de los esquejes provocado por el quitosano puede ser el resultado del efecto benéfico en la activación y mejora de variables fisiológicas que con llevan al fortalecimiento de la planta contra diferentes tipos de estrés biótico y abiótico, o también mediante activación directa de la resistencia basal de la planta como ha sido informado por autores previos (Falcón-Rodríguez, Costales, Cabrera y Martínez, 2011; Xing et al., 2015; Mukhtar-Ahmed et al., 2020).
La activación de la resistencia basal en la planta está ligada a aquella inmunidad que es inducida por un efector (IDE), como las moléculas de quitosano, con lo cual la planta inicia el aumento de genes relacionados a la defensa que generan un fortalecimiento físico de las paredes celulares (p. ej., producción de lignina y callosa), disparando la producción de fitoalexinas e induciendo la producción de proteínas con acción antimicrobiana (Burbano-Figueroa, 2020).
La protección contra el estrés biótico y abiótico que favoreció la regeneración de las plantas tratadas con el bioestimulante Quitomax® podría estar ligada a la producción de metabolitos secundarios como terpenos (aceites esenciales y sus constituyentes) y los fenoles (Mukhtar-Ahmed et al., 2020). Los terpenoides de bajo peso molecular, como el isopreno, mono-, sesqui- y di terpenoide, confieren tolerancia frente al estrés biótico y abiótico (Mewalal et al., 2017). Los fenoles representan el grupo más importante de entre los metabolitos secundarios en las plantas (Marchiosi et al., 2020). De las numerosas funciones con las que contribuyen los fenoles para mantener la sanidad de las plantas destacan la protección contra patógenos por la formación de barreras mecánicas (lignina y suberina) y la prevención del estrés oxidativo (Rhodes y Wooltorton, 2019).
Conclusión
La aplicación del bioestimulante Quitomax® cuyo ingrediente bioactivo es el quitosano, es un promotor de crecimiento que mejora la biomasa de raíz, hoja y tallo de plántas de cacao propagadas clonalmente por esquejes. Además, el tratamiento con quitosano incrementó el porcentaje de regeneración de las plantas de cacao al preservar a los esquejes de probable estrés biótico y abiótico. El Quitomax®, producto a base de quitosano, es un tratamiento viable para la promoción de crecimiento y bioestimulación de plantas de cacao durante la reproducción clonal por esquejes con resultados incluso mejores que los de algunos productos comerciales tales como Raizyner GNS.
Fondos
Fondo Competitivo de Investigación Científica y Tecnológica (FOCICYT) 7ma Convocatoria, a través del proyecto PFOC7-15-2020 “Metodología para la propagación de esquejes de cacao mediante el uso de bioestimulantes de amplio espectro de acción”.
Contribución de los Autores
Investigación, conceptualización, validación, administración del proyecto, adquisición de fondo: J.J.R.P. Escritura: revisión y edición: R.A.R.R. Investigación, metodología: L.T.Ll.R. Escritura: revisión y edición: M.Á.R.A. Escritura: preparación del borrador original, escritura: revisión y edición: A.B.F.R. Curación de datos, análisis de datos: R.A.P.G. Escritura, revisión, análisis formal: T.R.G.











 nueva página del texto (beta)
nueva página del texto (beta)