Introducción
El suelo es un recurso complejo que soporta diferentes funciones en sistemas naturales y agrícolas, tales como la producción de biomasa vegetal, reciclamiento de nutrientes minerales y el sostenimiento de la calidad del aire y agua (Bessou, 2018). La conversión del bosque hacia el uso agrícola puede afectar las características físico-químicas y procesos biológicos y, al mismo tiempo, alterar su funcionalidad en el ecosistema al reducir su fertilidad, capacidad de infiltración, contenido de materia orgánica, resiliencia y regeneración natural (Maranguit, Guillaume y Kuzyakov, 2017; Bessou, 2018). La intensificación de la agricultura y el uso inadecuado de fertilizantes químicos disminuyen la salud del suelo y, subsecuentemente, su capacidad productiva (Brevik et al., 2015; Maharjan, Maranguit y Kuzyakov, 2018). A medida que el suelo se degrada, se intensifica la pérdida de la cubierta vegetal y la conversión del bosque hacia el uso agrícola, urbano e industrial (Chakravarty, Ghosh, Suresh, Dey y Shukla, 2012).
En México, la tasa de deforestación es de las más altas del mundo (Velázquez et al., 2002). Se estima que, entre 2001 y 2016, el incremento de productividad agrícola promovió la pérdida de la cubierta vegetal equivalente a un promedio anual de 79 672 y 350 298 ha, respectivamente (CONAFOR, 2020). El estado de Michoacán perdió el 40% de su cubierta forestal original estimada en 1.5 millones de ha debido a la deforestación de sus bosques templados, reemplazo de cultivos nativos e intensificación del monocultivo de aguacate (Persea americana Mill.) (Bravo-Espinoza et al., 2014; Molina-Sánchez et al., 2019). Este sistema agrícola, dependiente del uso de insumos externos (fertilizantes y pesticidas), intensifica la acidez del suelo y disminuye la disponibilidad de fósforo (Bravo-Espinoza et al., 2014; González-Esquivel et al., 2015; Bayuelo-Jiménez et al., 2019).
El fósforo (P) es un nutriente clave que requiere atención en respuesta al cambio de uso del suelo (Maranguit et al., 2017) ya que es el segundo nutriente, después del nitrógeno, que más restringe la productividad de cultivos (Spohn, Ermak y Kuzyakov, 2013). Los Andisoles, altamente meteorizados y con altas cantidades de sesquióxidos, adsorben y retienen químicamente el P, lo que reduce su disponibilidad para el crecimiento vegetal (Takahashi y Dahlgren, 2016). En el suelo, el P se encuentra en diversas formas inorgánicas (Pi) y orgánicas (Po) que se agrupan según su labilidad y disponibilidad (Richter, Allen, Li, Markewits y Raikes, 2006). El P lábil, lo constituye fosfatos solubles de inmediata disponibilidad, fosfatos inorgánicos unidos a la superficie de arcillas y fosfatos orgánicos de rápida transformación (Hedley, Stewart y Chauhan, 1982). El P moderadamente disponible, es un acervo de fácil solubilización que consiste en fosfatos adsorbidos a los coloides del suelo, o bien, a formas recalcitrantes de P unido al hierro (Fe3+), aluminio (Al3+) y calcio (Ca2+) (Takahashi y Dahlgren, 2016). El P ocluido lo representan compuestos insolubles, resistentes a la mineralización y de reducido impacto en la fertilidad del suelo (Velásquez et al., 2016).
Diversos factores como el cambio de pH del suelo y la fuerte quimio-adsorción de los fosfatos con hidróxidos de Al3+ y Fe3+, el contenido de materia orgánica y el manejo agronómico al que el suelo se expone pueden alterar las formas, distribución y disponibilidad de P (Dahlgreen, Saigusa y Ugolini, 2004; Crews y Brookes, 2014; Maranguit et al., 2017). Por ejemplo, en suelos con pH ácido o alcalino, el P se convierte rápidamente en compuestos solubles amorfos y cristalinos (fosfatos de Ca2+ y Mg2+), mientras que en suelos ácidos en variscita (Al-P) y Strengita (Fe-P) (Dhillon, Torres, Driver, Figueiredo y Raun, 2017). Éstos forman parte de una reserva de P de lento ciclaje y limitada disponibilidad (Takahashi y Dahlgren, 2016). Otros factores como la proporción y calidad de los componentes orgánicos y las transformaciones de microbiota asociado al suelo (Achat et al., 2010) influyen en la reserva y mineralización del Po, que representa del 15 al 80% del P total (Achat et al., 2010; Oehl, Frossard, Fliessbach, Dubois y Oberson, 2004; Maharjan et al., 2018). En suma, la conversión del bosque a sistemas agrícolas convencionales puede alterar las formas de P en el suelo debido a una excesiva remoción (sin reemplazo) del P exportado a la planta, modificar sus propiedades y aumentar la proporción de formas recalcitrantes (Takahashi y Dahlgren, 2016; Maharjan et al., 2018).
Se usó el método de fraccionamiento secuencial de Hedley para determinar el impacto del uso del suelo (bosque de pino y monocultivo de aguacate) en las fracciones, distribución y biodisponibilidad de P en un suelo ácido. La hipótesis de trabajo señala que la conversión del bosque a un sistema agrícola de aguacate con manejo convencional intensivo aumentará las reservas de Pi a expensas del Po como consecuencia de una reducida acumulación de substratos orgánicos y (ii) que las formas lábiles de P disminuirán como consecuencia de la acidificación del suelo.
Materiales y Métodos
Características del suelo y obtención de muestras
La presente investigación se efectuó en Pablo Cuin, Ario, Michoacán (19° 13’ N y 101° 39’ O). Esta región se caracteriza por un clima templado subhúmedo con precipitaciones en verano [C (w2) (w)]. La temperatura media anual es de 20 °C y la altitud de 2000 m (INEGI, 2009). Los suelos dominantes son Andisoles vítricos (Alcalá, Hidalgo y Gutiérrez, 2009) caracterizados por un pH ácido (4.8-6.0), elevada capacidad de intercambio de cationes (25-30 cmol kg-1), alto contenido de materia orgánica (1.1-8.6%) y retención de fosfatos (> 55%) debida a la gran proporción de componentes de Al3+ (1.6-6.4%) y Fe (0.8-5.5%) (Alcalá et al., 2009). Los Andisoles tienen un uso forestal (Pinus spp.) y agrícola (Zea mays L. y Persea americana Mill.). Las características físicas y químicas del suelo se analizaron según los procedimientos de la Norma Mexicana (NOM-021-SEMARNAT-2000, 2002).
En el sitio de estudio se eligieron tres localidades con sistemas agrícolas de manejo convencional intensivo de aguacate, similares en condiciones de clima, suelo y edad (20 años). Las localidades se denominan: El Puente (Pu), Cincuenta (Ci) y Mirador (Mr) de una superficie de 1 ha cada una. En cada localidad se hallaban parcelas colindantes dedicadas a dos tipos de uso del suelo: bosque de pino (suelo nativo) y monocultivo de aguacate (suelo agrícola). En el suelo nativo se incluyeron muestras del mantillo (M) depositado en la superficie y los primeros 20 cm del suelo de bosque (B). En el suelo de uso agrícola se incluyeron muestras de cajete (hueco de 5 m de diámetro con un árbol en el centro y 10 m de distancia entre árboles) (Cj) y muestras de suelo entre hileras de árboles (calle) (Cc). Estas últimas para contrastar el efecto del uso del suelo agrícola con y sin cubierta vegetal en las fracciones, distribución y biodisponibilidad de P.
En cada parcela, se obtuvieron muestras de suelo de acuerdo con un diseño de cuadrantes de 10 ( 4 puntos separados entre sí por 30 m. El muestreo se realizó a una profundidad de 0-20 cm y las muestras compuestas, conformadas por las 40 submuestras obtenidas en cada parcela/localidad, se secaron, molieron y tamizaron (< 2 mm) previo a la incubación y análisis de P.
Incubación del suelo y fraccionamiento secuencial del fósforo
Las muestras de suelo se incubaron a capacidad de campo a 25±2 °C y 65% de humedad relativa durante siete días previo a la extracción secuencial para alcanzar el equilibrio después de las perturbaciones por el muestreo, secado, molienda y tamizado (Hedley et al., 1982). Después de la incubación, las muestras se almacenaron a 4 °C. El fraccionamiento de P se realizó de acuerdo con el método de Hedley et al. (1982) rectificado por Condron, Goh y Newman (1985). Este método utiliza una secuencia de extractantes que primero remueven el P inorgánico (Pi) y P orgánico (Po) lábil y, posteriormente las formas más estables de P. En resumen, en un tubo de plástico de 25 ml se colocó una muestra de 0.5 g de suelo (cinco repeticiones), la cual se sujetó a una extracción secuencial en el orden siguiente: (i) 10 ml de agua desionizada con una resina de intercambio aniónico (1.0 × 2.0 cm; AMI-7001S Membranes International Inc.) que extrae el lábil Pi (Resina-Pi) que se intercambia inmediatamente con la solución del suelo y disponible para la planta, (ii) 10 ml de NaHCO3 0.5M (Bic-Pi) a pH 8.5, para determinar el Pi relativamente lábil, (iii) 10 ml de NaOH 1.0 M (NaOH0.1-Pi) y NaOH 5 M (NaOH0.5-Pi) para determinar fosfatos de Al3+ y Fe3+ amorfos y cristalinos, así como el P quimio‑adsorbido a compuestos de Fe3+ y Al3+ y (iv) una extracción con 10 ml de HCl 1M (HCl‑Pi) para extraer el P mineral unido a Ca. Después de la adición de cada extractante, las muestras se agitaron durante 16 h y la suspensión del suelo se centrifugó a 3500 rpm durante 15 min. Finalmente, se determinó el P de las formas más estables y relativamente insolubles (Residual-P) mediante una digestión con H2SO4 concentrado y 30% H2O2. El P total y el Pi se midieron directamente de los extractantes, mientras que el Po se calculó por la diferencia entre el P total y Pi. El P total de los extractos alcalinos se obtuvo a partir de la digestión con H2SO4 y (NH4)2S2O8 en una autoclave. Se utilizaron los métodos de Murphy y Riley (1962) y Dick y Tabatabai (1977) para las determinaciones de P de los extractos ácidos y alcalinos, respectivamente. Las formas de P se agruparon en tres categorías de acuerdo con su labilidad de P (Cherubin et al., 2016): lábil (Resina-Pi, Bic-Pi y Bic-Po), moderadamente lábil (NaOH0.1-Pi, NaOH0.1-Po y HCl-Pi) y no lábil (NaOH0.5-Pi, NaOH0.5‑Po y Residual-P).
Determinación de P microbiano
Las muestras de suelo se incubaron a capacidad de campo a 25 °C durante 28 días. El P microbiano se determinó según el método de Morel, Tiessen y Stewart (1996). Nueve muestras de 0.5 g de suelo (por triplicado), se dividieron en tres conjuntos (A, B y C). El primer conjunto (A) se fumigó con 0.5 ml de CHCl3 concentrado durante 24 horas. A los conjuntos restantes (B y C) se les agregó 0.5 ml de agua desionizada. Posteriormente, se adicionó 10 ml NaHCO3 0.5 M (conjuntos A y B) y 10 ml NaHCO3 0.5 M + 50 µg P g‑1 (conjunto C). Después de la adición del extractante, las muestras se agitaron durante 16 h y la suspensión del suelo se centrifugó a 3500 rpm durante 15 min. Finalmente, se determinó el P inorgánico de cada muestra (Murphy y Riley, 1962). El P microbiano se calculó a partir de la concentración de Pi obtenido en las muestras de cada conjunto y la concentración corregida del P adsorbido durante la extracción con el NaHCO3.
Análisis estadístico
Las formas de P se expresaron en mg P kg-1 de suelo. Los valores medios del contenido de cada fracción de P, fueron comparados entre cada uso del suelo mediante un análisis de varianza (ANOVA) de acuerdo al procedimiento GLM (SAS, 2000). Para cumplir con los supuestos del análisis de varianza, se realizaron las pruebas de normalidad Kolmogorov-Smirnov y de homogeneidad de Bartlett en los datos originales (SAS, 2000). La comparación de medias obtenidas entre localidades para cada uso de suelo se llevó a cabo con la prueba de prueba de Tukey (P ≤ 0.05) (SAS, 2000). La relación entre las propiedades químicas del suelo y las formas de P se determinó con la prueba de Pearson (P ≤ 0.05).
Resultados y Discusión
El cambio de uso del suelo afectó las propiedades químicas y biológicas, y consecuentemente las formas, distribución y disponibilidad de P. En general, el suelo cultivado en cajete exhibió una alta saturación de bases de intercambio (Mg2+, K+) y concentración de Fe3+, en comparación al suelo de bosque y calle (Cuadro 1). La proporción de materia orgánica, sin embargo, disminuyó 26% con respecto al suelo con uso forestal. El pH de este suelo fue ácido (5.0), mientras que en el cultivado estuvo cercano a la neutralidad (6.5). La disponibilidad de P fue escasa (0.6 a 5.6 mg kg-1) en ambos sistemas, lo que confirmó la fuerte quimio-adsorción de los fosfatos en suelos de origen volcánico (Takahashi y Dahlgren, 2016).
Cuadro 1: Atributos físicos y químicas (0-20 cm) de un Andisol de Ario, Michoacán, México con uso de bosque y agrícola.
Table 1: Physical and chemical attributes (0-20 cm) of Andisol from Ario, Michoacan, Mexico with forest and agricultural use.
Localidad |
Textura |
pH |
Bases de intercambio |
Al3+ |
Fe3+ |
P |
|||||||
Arcilla |
Limo |
Arena |
Ca2+ |
Mg2+ |
K+ |
Na+ |
|||||||
- - - - - - - - % - - - - - - - |
- - - - - - - - - cmolc/kg-1 - - - - - - - - - |
mg kg-1 |
|||||||||||
Bosque | |||||||||||||
Puente |
12.8 |
24.0 |
63.2 |
6.9 |
4.5 |
11.2 |
6.2 |
3.4 |
1.5 |
0.1 |
0.2 |
43.1 |
0.6 |
Cincuenta |
12.8 |
44.0 |
43.2 |
6.0 |
5.6 |
16.3 |
9.5 |
4.6 |
2.2 |
0.1 |
0.4 |
52.2 |
0.7 |
Mirador |
12.8 |
34.0 |
53.2 |
5.6 |
5.2 |
10.5 |
5.8 |
3.3 |
1.3 |
0.1 |
0.2 |
43.6 |
0.6 |
Calle | |||||||||||||
Puente |
18.8 |
32.0 |
49.2 |
5.5 |
5.1 |
11.7 |
6.4 |
3.6 |
1.7 |
0.1 |
0.5 |
44.9 |
1.0 |
Cincuenta |
14.8 |
42.0 |
43.2 |
3.6 |
5.2 |
10.6 |
6.4 |
2.4 |
1.7 |
0.1 |
0.5 |
39.8 |
0.6 |
Mirador |
14.8 |
32.0 |
53.2 |
4.4 |
5.3 |
10.7 |
7.3 |
2.2 |
1.1 |
0.1 |
0.3 |
44.4 |
0.7 |
Cajete | |||||||||||||
Puente |
12.8 |
28.0 |
59.2 |
4.9 |
6.9 |
15.7 |
6.6 |
4.4 |
4.5 |
0.2 |
0.2 |
109.2 |
3.7 |
Cincuenta |
16.8 |
26.0 |
57.2 |
4.7 |
6.4 |
12.7 |
6.0 |
2.4 |
4.1 |
0.2 |
0.3 |
88.1 |
5.6 |
Mirador |
16.8 |
26.0 |
57.2 |
4.1 |
6.5 |
17.7 |
9.1 |
4.2 |
4.1 |
0.3 |
0.5 |
62.7 |
3.7 |
† MO = materia orgánica; ‡ CIC = capacidad de intercambio catiónico.
† MO = organic matter; ‡ CIC = cation exchange capacity.
El uso del suelo modificó las fracciones de P lábil, moderadamente lábil y no lábil (Figura 1). El P total del suelo cultivado, particularmente en la localidad de Cincuenta, incrementó de 505 a 613 mg kg-1 por efecto del uso, calle > cajete y éste fue mayor que el obtenido en el de bosque entre 448 y 527 mg kg-1 y mantillo entre 478 y 554 mg kg-1. Estas concentraciones están en los niveles determinados para Andisoles con reportes > 500 mg kg-1 (Dahlgreen et al., 2004).
Figura 1: Distribución de las formas lábiles (A); moderadamente lábiles (B); no lábiles (C) de fósforo según el uso del suelo: forestal (mantillo y bosque) y agrícola (calle y cajete) en las localidades de Puente (Pu); Cincuenta (Ci); Mirador (Mr) de Ario, Michoacán. Cada barra denota el error estándar de la media (n = 5). Las medias seguidas de diferente letra dentro de cada tipo de uso del suelo difieren significativamente de acuerdo a Tukey (P ≤ 0.05).

Figure 1: Distribution of labile forms (A); moderately labile (B); nonlabile (C) forms of phosphorus according to land use: forest (mulch and forest) and agricultural (street and bowl) in the towns of Puente (Pu); Cincuenta (Ci) and Mirador (Mr) de Ario, Michoacan. Each bar denotes the standard error of the mean (n = 5). The means followed by different letters within each type of land use differ significantly according to Tukey’s (P ≤ 0.05).
El suelo con uso agrícola (cajete > calle), por el contrario, obtuvo el mayor contenido de Pi lábil (Bic-Pi) de15 a 31 mg kg-1 en relación con el de bosque (21 a 27 mg kg-1) y mantillo (11 a 15 mg kg-1, respectivamente) (Figura 1a). Sin embargo, el P lábil (Resina-Pi) fue < 4 mg P kg-1. Esta concentración está por debajo del requerimiento óptimo para la producción de aguacate que es entre 37 a 48 mg P kg-1 (Quintero-Sánchez, Gioanetto, Díaz y Saldaña, 2011). En general, la aplicación continua de fertilizante fosfatado incrementa la fracción lábil de P (Dhillon et al., 2017) pero en suelos ácidos de origen volcánico, este acervo es limitado debida a su alta retención (Dahlgreen et al., 2004). El P lábil fluctuó entre 3.5 a 9.6% respecto al contenido total de P; proporciones similares a los valores obtenidos de 1 a 8% en otros estudios (Galván-Tejeda, Peña, Mora y Siebe, 2014; Bayuelo-Jiménez et al., 2019).
El fósforo moderadamente lábil se incrementó con el uso agrícola, de 178 a 208 mg kg-1 y de 157 a 195 mg kg-1 (cajete < calle) (Figura 1b). De esta reserva, la mayor proporción la obtuvo la fracción inorgánica NaOH0.1-Pi, de 76 a 107 mg kg-1, que representó de 14 a 19% de P total. En el suelo de bosque correspondió al <6% (Figura 1b). Esta fracción, moderadamente disponible, es una fuente potencial de P lábil en sistemas forestales (Galván-Tejeda et al., 2014) y agrícolas de México (Crews, 1996; Bayuelo-Jiménez et al., 2019). Sin embargo, requiere de largos procesos de transformación para liberar el fosfato quimio-adsorbido con Fe3+ y Al3+ (Hedley et al., 1982; Dahlgreen et al., 2004). La relación negativa entre la concentración de Al3+ y Fe3+ con el NaOH0.1-Pi (r = 0.52 y r = 0.83, P < 0.01) corroboran este hecho (Cuadro 2).
Cuadro 2: Coeficiente de correlación de Pearson (r) entre las propiedades del suelo y las diversas formas de fósforo (P).
Table 2: Pearson’s correlation coefficient (r) between soil properties and the various forms of phosphorus (P).
Propiedades |
Uso |
Labial |
Moderadamente lábil |
No lábil |
|||||||||||
Resina |
NaHCO3 |
NaOH0.1 |
HCL |
NaOH0.5 |
Residual |
||||||||||
Pi |
Pi |
Po |
Pi |
Po |
Pi |
Pi |
Po |
Pi |
|||||||
Bosque |
-0.38 |
0.26 |
-0.41 |
0.97*** |
0.91*** |
-0.89** |
0.95*** |
-0.30 |
-0.65* |
||||||
Cultivado |
0.15 |
-0.28 |
0.03 |
-0.46 |
-0.91*** |
0.37 |
0.76** |
-0.97*** |
0.22 |
||||||
pH |
Bosque |
0.27 |
-0.02 |
-0.63* |
0.74** |
-0.94 |
-0.62* |
0.90*** |
0.22 |
-0.88** |
|||||
Cultivado |
-0.44 |
-0.95*** |
-0.47 |
0.13 |
-0.46 |
-0.89** |
0.35 |
-0.88** |
-0.69* |
||||||
Fe |
Bosque |
-0.41 |
0.38 |
-0.46 |
0.99*** |
-0.90*** |
-0.85** |
0.91*** |
-0.27 |
-0.66* |
|||||
Cultivado |
-0.75** |
-0.93*** |
-0.82** |
-0.83** |
-0.56 |
-0.59 |
0.19 |
-0.76** |
-0.70** |
||||||
Al |
Bosque |
-0.36 |
0.06 |
-0.29 |
0.90*** |
0.38 |
-0.95*** |
0.98*** |
-0.36 |
-0.59 |
|||||
Cultivado |
0.86** |
0.90*** |
0.91*** |
-0.52 |
-0.87** |
0.68* |
0.01 |
0.65* |
0.83** |
||||||
Ca |
Bosque |
-0.51 |
0.84** |
-0.49 |
0.83** |
-0.58 |
-0.45 |
0.47 |
-0.15 |
-0.45 |
|||||
Cultivado |
-0.35 |
-0.95*** |
-0.40 |
0.11 |
-0.60 |
-0.80** |
0.49 |
-0.95*** |
-0.31 |
||||||
Pmicrobiano |
Bosque |
0.93** |
-0.03 |
-0.38 |
-0.52 |
0.25 |
0.82** |
-0.49 |
0.91*** |
-0.18 |
|||||
Cultivado |
0.78** |
0.83** |
0.85** |
0.70** |
0.54 |
0.43 |
-0.12 |
0.65* |
0.73** |
||||||
† MO = materia orgánica; ‡ CIC = capacidad de intercambio catiónico. * Significativo a P ≤ 0.05; ** P ≤ 0.01; *** P ≤ 0.001.
† MO = organic matter; ‡ CIC = cation exchange capacity. * Significat at P ≤ 0.05; ** P ≤ 0.01; *** P ≤ 0.001.
El fósforo de la fracción HCl fue mínimo, de 11 a 30 mg kg-1 en el suelo de bosque y mantillo y de 21 a 40 mg kg-1 en el suelo cultivado en cajete (Figura 1b). Esta fracción representó el 6% del P total y constituye la forma de Pi (PCa) más estable en los minerales [apatita, Ca5 (PO4)3 Cl, F, OH)] primarios del suelo (Takahashi y Dahlgren, 2016).
La fracción inorgánica de P residual fue alta en el suelo cultivado en calle con 232 mg kg-1 y cajete con 170 mg kg-1 (Figura 1c). Esta concentración es similar a la obtenida por Velásquez et al. (2016) y Bayuelo-Jiménez et al. (2019) en suelos ácidos de México. Esta fracción ocluida representó de 29 a 44% del contenido total de P y constituye la reserva más recalcitrante de P; usualmente unida a sesquióxidos de Fe3+ (Hedley et al. 1982; Dahlgreen et al., 2004). La correlación negativa entre el Fe3+ y el P residual del suelo (r = 0.70; P < 0.01), ratifica la prevalencia de una fuerte quimio-adsorción entre el fosfato y los óxidos amorfos de Fe (ferrihidrita) (Takahashi y Dahlgren, 2016).
En condiciones naturales, los Andisoles alofánicos se distinguen por su ligera a moderada acidez con pH 5 a 7 (Takahashi y Dahlgren, 2016). Sin embargo, la continua aplicación de fertilizantes amoniacales exacerba la solubilidad de Al3+ intercambiable y, en forma lineal, disminuye el pH dado por liberación de H+ (Tian y Niu, 2015). La acidificación del suelo resulta en una fuerte retención de fosfatos lábiles (Bic Pi), de moderada (NaOH0.1-Pi) y reducida (Residual-Pi) labilidad (Velásquez et al., 2016). Es inequívoco que, el uso recurrente de fertilizantes minerales que se aplica en sistemas agrícolas de aguacate en Michoacán (~ 95 kg P ha-1; como fosfato di-amónico) intensificó la adsorción y acumulación de fracciones inorgánicas estables (NaOH0.1-Pi, 15.7%) y recalcitrantes (Pi-residual, 42%) a la matriz del suelo (calle > cajete), pero no proveyó de una adecuada disponibilidad de Pi lábil (< 4 mg P kg-1 equivalente al 0.6% del P total). Es por esta razón que, los Andisoles requieren de una continua fertilización que asegure una pequeña cantidad de P biodisponible (Stutter et al., 2015). Sin embargo, no constituye la mejor estrategia para asegurar la sostenibilidad agrícola de este sistema (aguacate). Una situación recurrente en el consumo de fertilizantes, a nivel nacional, es su uso indiscriminado (Molina-Sánchez et al., 2019). Cifras de la FAOSTAT (2020) señalan que, en México, existe un consumo excesivo de fertilizantes de nitrógeno, fósforo y potasio (N-P-K) para uso agrícola. En el 2018, su uso correspondió a 133.2 kg ha‑1; 82.7 kg ha-1 y 30.2 kg ha‑1, respectivamente. En un periodo de 10 años (2008‑2018), la media de consumo de N-P-K en México fue de 196.7 kg ha‑1, mientras que a nivel mundial fue de 126.4 kg ha-1. La proporción de dosificación fue 63% superior al promedio global. Lo anterior, es un factor crítico que puede alterar las propiedades físico-químicas y procesos biológicos del suelo y, consecuentemente reducir su capacidad productiva (Maranguit et al., 2017).
En lo que respecta a la fracción orgánica, el suelo con uso forestal (incluido el mantillo) presentó la mayor concentración de Po (198 a 280 mg kg-1) en comparación al de uso agrícola (114 a 190 mg kg-1) y éste no varió entre calle y cajete, excepto en la localidad del Mirador (Figura 1). Cabe señalar que, en el suelo de bosque, las formas orgánicas de moderada labilidad (NaOH0.1-Po) constituyen un importante recurso de Po, en promedio de 126 mg P kg-1. En conjunto, la proporción del Po (Bic-Po, NaOH0.1-Po y NaOH0.5-Po) correspondió a 48% del P total del suelo (Figura 1b). Por el contrario, en el suelo con uso agrícola, el P orgánico representó el 29% del P total. Según Achat et al. (2010), valores superiores al 30% del contenido total de P correspondientes en la forma orgánica suponen una reserva sustancial de P en el suelo de bosque. En suelos agrícolas, sin embargo, esta proporción es menor y varía de 5 a 35% (Nash et al., 2014; Velásquez et al., 2016). Es plausible que la reducción del contenido de Po esté relacionada con la historia de manejo; aparentemente por una menor acumulación de substratos orgánicos en la superficie del suelo, en sincronía con una reducida transformación del Po (Bravo-Espinoza et al., 2014; Bünemann, Augstburger y Frossard, 2016).
La reserva de Po y el ciclaje de la materia orgánica son determinantes en el funcionamiento y productividad de sistemas naturales y agrícolas (Takahashi y Dahlgren, 2016). La materia orgánica participa en la estabilización de la estructura del suelo, la adsorción y liberación de nutrientes y en la retención de agua, lo que lo convierte en un indicador clave para la productividad agrícola y la resiliencia de los ecosistemas naturales (Harden et al., 2018). En Andisoles, es común que, el alto contenido de materia orgánica (2.1 a 25%) encubra los puntos de unión de los fosfatos a los hidróxidos de Al3+ y Fe3+ y, por tanto, constituya una fuente crucial de P-lábil (Meason, Idol, Friday y Scowcroft, 2009; Achat et al., 2012). La correlación positiva entre el contenido de materia orgánica y el NaOH0.1-Po (r = 0.91 P ≤ 0.001) del suelo de bosque (Cuadro 2), presupone una importante contribución a la reserva de P biodisponible (Figura 1a). En el suelo cultivado, por el contrario, hubo una correlación negativa entre la materia orgánica y la fracción NaOH0.1-Po (r = 0.91 P ≤ 0.001) y entre el NaOH-Po y el Al3+ (r = 0.84 P ≤ 0.01) (Cuadro 2). La presencia de óxidos de Al3+ incrementa la estabilidad de la materia orgánica (formación de complejos orgánicos poco disponibles para los microorganismos) y, consecuentemente, altera la mineralización del Po (Achat et al., 2012; Takahashi y Dahlgren, 2016).
La mineralización del Po derivado de microorganismos, es determinante en el ciclaje de P, particularmente en ecosistemas naturales y agrícolas cuya labilidad de Pi es deficiente (Achat et al., 2012; Oehl et al., 2004; Bünemann et al., 2016). Se estima que entre 50 a 75% del P microbiano está unido a los ácidos nucleicos, 20% a monoésteres-P y 5% a fosfolípidos (Kruse et al., 2015). El P microbiano representa una reserva importante y potencial de P lábil; por lo menos de 2.5 a 11.5% del P total en suelos de uso forestal (Spohn et al., 2013), de 2.4 a 2.6% del P total en suelos cultivados con manejo orgánico y de 0.6 a 1.2% del P total en aquellos cultivados con manejo convencional (Oehl et al., 2004).
En el suelo de bosque de esta región, el P derivado de la biomasa microbiana representó el 6.3% del P total, mientras que en el suelo cultivado alcanzó el 1.7% (Figura 2). La alta proporción de P microbiano (6.3%) y P inorgánico lábil (2.2%) en el suelo de bosque se atribuyó al efecto combinado de un alto contenido de materia orgánica (6%) (Figura 2) y una presumible rápida mineralización del Po (Bic-Po; 2.1%) en comparación al obtenido en el suelo agrícola (1.8%, 0.3% y 3.4%, respectivamente) (Figura 1a). La incorporación de hojarasca y residuos vegetales en la superficie del suelo promueven una mayor actividad microbiana, descomposición y mineralización de Po y Pi lábil en el suelo de bosque (Maharjan et al., 2018). Por el contrario, la combinación de un reducido ingreso de residuos (restos vegetales) e incremento de la erosión del suelo, aparte de acrecentar la lixiviación de bases, también disminuye el contenido de materia orgánica, la actividad microbiana y la subsecuente mineralización de las fracciones orgánicas de P (Oehl et al., 2004; Nash et al., 2014).
Figura 2: Fósforo microbiano según el uso del suelo: forestal (mantillo y bosque) y agrícola (cajete) de las localidades de Puente (Pu), Cincuenta (Ci) y Mirador (Mr) de Ario, Michoacán. Se omitió el suelo agrícola de calle por adolecer de P microbiano. Cada barra denota el error estándar de la media (n = 5). Las medias seguidas de diferente letra entre cada tipo de uso del suelo difieren significativamente de acuerdo a Tukey (P ≤ 0.05).
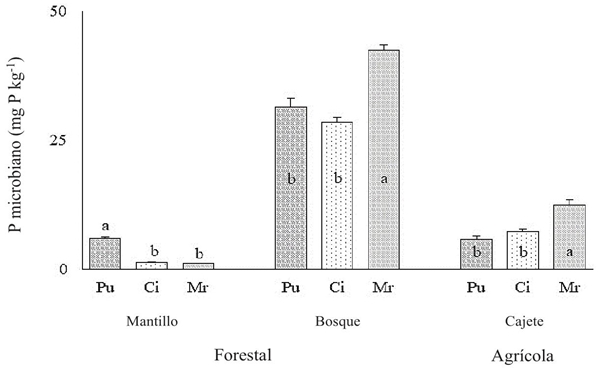
Figure 2: Microbial phosphorus according to soil use: forestry (mulch and forest) and agricultural (bowl) from the towns of Puente (Pu), Cincuenta (Ci) and Mirador (Mr) de Ario, Michoacan. Agricultural street soil was omitted because it had microbial P. Each bar denotes the standard error of the mean (n = 5). The means followed by different letters between each type of land use differ significantly according to Tukey (P ≤ 0.05).
En general, los resultados señalan que el suelo con uso forestal contiene importantes reservorios orgánicos que, entre otros factores, suministran el P requerido para el crecimiento vegetal (Maharjan et al., 2018). Sin embargo, la conversión del bosque a uso agrícola y la intensificación de este sistema productivo, dependiente del uso excesivo de fertilizantes minerales y pesticidas, acentúa la acidez del suelo, acelera la pérdida y estabilización de los substratos orgánicos que, subsecuentemente, alteran la mineralización y limitan la disponibilidad del elemento (Spohn et al., 2013; Maranguit et al., 2017).
La sostenibilidad agrícola de este sistema requiere de un mayor estudio de los procesos biológicos (mineralización e inmovilización) que regulan la disponibilidad de P y la conducción de prácticas que incrementen y restablezcan los substratos orgánicos, microbiota asociado al suelo (disminución de labranza, adición de cubiertas, reciclaje de materiales orgánicos y aplicación de composta) y la eficiente mineralización de las formas orgánicas de P (Maharjan et al., 2018). No menos importante es la implementación de estrategias que promuevan el desarrollo de variedades agrícolas más eficientes en el uso de P y menos dependientes de agroquímicos (Stutter et al., 2015).
Conclusiones
La conversión del bosque a un sistema agrícola intensivo de aguacate y dependiente del uso excesivo de fertilizantes sintéticos alteró las fracciones, distribución y disponibilidad de P. En el suelo agrícola, se intensificó la adsorción y acumulación de fracciones inorgánicas estables (NaOH0.1-Pi) y recalcitrantes (Pi-residual), pero no proveyó de una adecuada disponibilidad de Pi lábil. El alto contenido de P extraído en la forma estable (NaOH0.1-Pi) sugiere que esta fracción, retenida fuertemente con óxidos de Al3+ y Fe3+, es una fuente potencial de P disponible en Andisoles. Al mismo tiempo, una menor acumulación de materia orgánica, en sincronía con una reducida mineralización del Po, explicarían la reducida prevalencia de Po asimilable. En el suelo con uso forestal (incluido el mantillo), en cambio, las formas orgánicas (Bic-Po, NaOH-Po) fueron determinantes (48%) en proveer de P disponible. El alto contenido de materia orgánica y P microbiano sugiere que estos acervos son importantes en la mineralización del Po y, por consiguiente, en la contribución Pi lábial.
Disponibilidad de Datos
Los conjuntos de datos utilizados o analizados durante el estudio actual están disponibles del autor correspondiente a solicitud razonable y no discriminatoria.
Contribución de los Autores
JSBJ contribuyó en la conceptualización del estudio, adquisición de fondos, dirección, administración, análisis estadístico y escritura del manuscrito (revisión y edición). DTV contribuyó en los muestreos de campo, análisis químico, análisis estadístico y análisis de resultados.











 nueva página del texto (beta)
nueva página del texto (beta)



