Introducción
Colombia es un país exportador de carbón de importancia mundial, posee el 0.8% de las reservas mundiales de carbón, ubicándose en el cuarto puesto de los países con mayor exportación en el mercado (UPME-MinMinas, 2012). Con una producción anual cercana a los 85 millones de toneladas, el carbón se constituye como el producto minero que genera un mayor aporte al producto interno bruto (PIB) del país. El 90% del carbón producido en la región proviene de las zonas mineras de los departamentos de La Guajira y el Cesar (ANM, 2013).
La minería de carbón a cielo abierto implica eliminar completamente la vegetación y el suelo de un área para la extracción de minerales, impactando fuertemente en el suelo, el agua y la biodiversidad (Domínguez et al., 2018). En el departamento del Cesar, la minería de carbón degrada una gran variedad de hábitats de especies endémicas como lo son el bosque seco espinoso y bosque seco tropical; la pérdida de este último es de gran preocupación, debido a que en el país solo queda el 8% de los 9 millones de hectáreas de bosque seco original, en consecuencia, el 65% de las tierras que han sido deforestadas presentan desertificación (Humboldt, 2014). En el departamento, el 69% de los suelos padecen de desertización, siendo la minería una de las actividades que contribuyen a la formación de esta problemática (Minambiente, 2005; Pizano y García, 2014).
El material edáfico que queda tras la explotación minera, contiene todo tipo de materiales residuales, estériles mineros, entre otros. Sus características más notables son la ausencia o baja presencia de la estructura edáfica, propiedades químicas anómalas, disminución o desequilibrio en el contenido de nutrientes, ruptura de los ciclos biogeoquímicos, presencia de compuestos tóxicos, dificultad de enraizamiento, alteración en las comunidades de macros y microorganismos, incremento de la erosión y compactación, inestabilidad y escasa cohesión (Arranz, 2011; Asensio et al., 2013; Ahirwal y Maiti, 2016; Feng et al., 2019; Xiao et al., 2019). Dichas propiedades, afectan el establecimiento y crecimiento natural de las plantas, la eco-restauración de tierras (Maiti, 2013). Lo anterior, conlleva a desarrollar estudios y tomar medidas que busquen promover o activar las funciones ecosistémicas en los suelos.
La rehabilitación de suelos afectados por la explotación de carbón a cielo abierto, es una actividad basada en proyectos de ingeniería, los cuales buscan la recuperación de algunos atributos del suelo, el mejoramiento del sistema hidrológico y fomentan la restauración de los ecosistemas (Díaz-Muegue et al., 2013), a través de la interacción entre la vegetación y el suelo (Arranz, 2015); considerando que las plantas son bioacumuladores eficientes que pueden agregar material orgánico al suelo, y están asociadas con una gran cantidad y diversidad de organismos del suelo (Zhao et al., 2013). El proceso de recuperación de zonas degradadas no es un problema fácil de resolver, ya que requiere no sólo el lograr una producción masiva de plantas sino un establecimiento exitoso. Una estrategia de restauración, pudiera ser la revegetación del área con plantas nativas, mediante plantaciones directa, para lo cual es necesario conocer los requisitos de germinación y establecimiento de tales especies (Contreras, 20151).
En suelos degradados, el trasplante de árboles mejora las propiedades de los suelos, producto de las actividades del sistema de raíces y los exudados de la raíz (Massaccesi et al., 2015). Guazuma ulmifolia es un árbol nativo y pionero de América tropical, se encuentra frecuentemente en vegetación secundaria derivada de bosques tropicales perennifolios. Su efecto restaurador contribuye en la conservación de los suelos, fijación de nitrógeno y cobertura de hojarasca. Sus características fisiológicas le permiten ser de fácil adaptación, rápido crecimiento, y además muestra un potencial significativo para la reforestación productiva en zonas degradadas de selvas y en zonas secas o áridas (Lamarck, 1789). Se informó que el uso del árbol en conjunto de fertilizantes orgánicos y hongos formadores de micorrizas arbusculares (HMA), apoyo la recuperación áreas afectadas por minerías (Souza et al., 2012).
Por otro lado, los HMA pueden promover la restauración ecológica de áreas afectadas por la minería, mediante la adquisición de minerales y la tolerancia al estrés hídrico o biótico de las plantas, contribuir a la estructura y calidad del suelo y ayudar a mantener la estabilidad y el funcionamiento del ecosistema (Zhao et al., 2015; Wang, 2017; Pavithra y Yapa, 2018). Además, son capaces de establecer simbiosis con al menos el 80% de las especies vegetales (Brundrett, 2009). Así mismo se plantea, que HMA ayudan a reducir los daños causados por erosión y a mantener la estructura del suelo, mediante la producción de micelio y sustancias adherentes (Lozano Sánchez et al., 2015) como la glomalina, esta última, favorece la formación de agregados, retención de materia orgánica y captura de carbono en el suelo (Plaza et al., 2013; Nautiyal et al., 2019).
El uso de enmiendas como el biochar puede favorecer la adaptación y supervivencia de la vegetación y los microorganismos en el proceso de rehabilitación de suelos, debido a los efectos positivos que produce en las características del suelo. El biochar o biocarbón, es el producto de la transformación térmica de materiales orgánicos (biomasa) con escaso o limitado suministro de oxígeno a temperaturas relativamente bajas, inferiores a los 700 °C (Escalante et al., 2016). Se ha reportado que el biochar mejora las características fisicoquímicas del suelo, al reducir la densidad aparente, aumentar la porosidad, pH, carbono orgánico soluble, nitrógeno total, relación carbono: nitrógeno, fósforo disponible y potasio, además ayuda al secuestro de carbono (Escalante et al., 2016; Xiao et al., 2016); también incrementó la retención de humedad e infiltración del agua en suelo, proporcionando nutrientes y agregando carbono lábil en suelos altamente meteorizados (Trippe et al., 2015). Así mismo, se indicó que el biochar incrementó la germinación y longitud de la raíz en Brachiaria decumbens, redujo la concentración de sales, y ayudó a corregir la acidez de suelos afectados por la minería de carbón en Colombia (Díaz-Muegue et al., 2017).
El objetivo de esta investigación, fue evaluar el efecto de Guazuma ulmifolia, los hongos formadores de micorrizas arbusculares y el biochar producido a partir de cuesco de palma Elaeis guineensis, en las fases tempranas de rehabilitación de dos tipos de suelos disturbados por actividad minera, en cuanto a indicadores fisicoquímicos y microbiológicos de suelos, además del crecimiento de la planta.
Materiales y Métodos
Área de estudio
El departamento del Cesar se encuentra ubicado en el noreste de Colombia, en la llanura del Caribe, localizado entre los 07° 41’ 16” y 10° 52’ 14” N y 72° 53’ 27” y 74° 08’ 28” O del meridiano de Greenwich. Limita al norte con los departamentos de La Guajira y Magdalena; al sur con los departamentos de Bolívar y Norte de Santander, y al oriente con Norte de Santander y la república de Venezuela. Los suelos del departamento del Cesar, se caracterizan por ser superficiales o moderadamente profundos y pobremente drenados, de reacción fuertemente ácida y moderadamente alcalina, fertilidad natural baja y moderada (IGAC y CORPOCESAR, 2018).
El área específica de estudio hace parte del corredor minero del Cesar, en el corregimiento de la Loma, jurisdicción del municipio del Paso, ubicado en el centro-occidente del departamento. Presenta un clima cálido seco, la temperatura media anual es de 28.5 °C, en esta zona se registran los mayores déficits de lluvia, la precipitación promedio anual oscila entre 1000-1500 mm, siendo los meses más críticos entre diciembre y marzo. El ecosistema presente es el bosque seco tropical, la evapotranspiración total anual oscila entre 1700-1900 mm. Entre las especies forestales predominante de la zona se encuentran: Himenaea coubaril, Guazuma ulmifolia, Gliricidia sepiun, Ceiba pentandra, Crescentia cujute, entre otras (Hernández, 2003).
Caracterización inicial de los suelos mineros
Se seleccionaron cinco puntos de muestreo aplicando un criterio de selección a juicio recomendado por Barahona e Iriarte (2001), en dos tipos de suelos mineros que se encuentran en las fases tempranas del proceso de rehabilitación. El primero es un suelo acopiado, de tipo entisol (Lithic Troporthents) con compuestos ferrosos (IGAC, 1997; Hernández, 2003), el cual fue removido y acopiado en las etapas iniciales de la explotación de carbón, el segundo es un Tecnosol con plintitas (Hernández, 2003), formado a partir de la descomposición del material estéril. Las muestras fueron recolectadas a una profundidad máxima de 20 cm, y llevadas al laboratorio de suelo de la Facultad de Ingeniería y Tecnología de la Universidad Popular del Cesar, donde se dejaron secar a temperatura ambiente 29 °C, se molieron y tamizaron utilizando un tamiz malla 2 mm para su posterior análisis fisicoquímico y microbiológico.
Las características fisicoquímicas evaluadas en los suelos fueron las siguientes: Color en húmedo mediante el Sistema de Notación Munsell. Densidad aparente por el método de la probeta. Densidad real por el método del picnómetro de agua (2002). Textura por el método Bouyoucos (1962) para la fracción <2 mm. Capacidad de retención de humedad mediante NTC 5167 (ICONTEC, 2004). Fósforo (P) por el método de Oslen. Carbono orgánico por oxidación húmeda (Mingorance et al., 2007). Capacidad de intercambio catiónico aplicando NTC 5268 (ICONTEC, 2014). El pH se determinó en 1:1 suspensión de suelo-agua usando un electrodo de pH (Orion Scientific Waltham). La conductividad eléctrica se determinó en 1:5 suspensión de suelo-agua usando un conductimetro 720 WTW (IGAC, 2008).
Las características microbiológicas evaluadas en los suelos fueron las siguientes: actividad enzimática mediante la técnica de hidrólisis del di acetato de fluoresceína (FDA) de Schnürer y Rosswall (1982). Glomalina mediante la técnica sucesivas con citrato de sodio 50 mM pH 8.0 en autoclave a 121 °C por ciclos de 60 minutos hasta desaparición del color pardo-rojizo característico con posterior determinación espectrofotométrica mediante el método Bradford para proteínas como lo proponen Wright y Upadhyaya (1996). Conteo de esporas de hongos formadores de micorrizas arbusculares (HMA) por gramo de suelo aplicando la técnica de flotación-infiltración (Gerdeman y Nicholson, 1963).
Ensayo de germinación
Inicialmente las semillas se sometieron a un proceso pregerminativo, el cual consistió en colocarlas en baño maría durante 5 minutos a una temperatura de 80 °C, luego se lavaron con agua de grifo y con ayuda de tela de algodón se limpiaron para eliminar la capa de mucilago presente (Hernández et al., 2001). El contenido total de material (suelo + biochar) por cada caja de Petri fue 5 g, las dosis de biochar aplicadas fueron 0, 1, 5 y 10%. Por cada dosis se establecieron cinco réplicas y al mismo tiempo 10 semillas por cada réplica. El montaje tuvo una duración de 15 días. Las variables evaluadas fueron: porcentaje de germinación (%), biomasa (kg ha-1), longitud foliar y radicular (cm). Se aplicó un diseño experimental completamente al azar, teniendo como variable independiente las dosis de biochar y dependiente el porcentaje de germinación, biomasa, longitud foliar y radicular.
Ensayo a escala vivero
Se utilizaron plantas producidas en vivero con una longitud promedio de 18 cm y rizotrones con un área de 0.32 m2 y con capacidad de 1.8 kg. Los tratamientos aplicados fueron: tratamiento 1 (Guazuma ulmifolia + 25 g de biochar + 15 g de sustrato arenoso de micorrizas); tratamiento 2 (Guazuma ulmifolia + 15 g de sustrato arenoso de micorrizas); tratamiento 3 (Guazuma ulmifolia + 25 g biochar + 15 g sustrato arenoso micorrizas + 2 g de fertilizante químico-NPK) y tratamiento 4 (Guazuma ulmifolia), por cada tratamiento se establecieron tres réplicas. El montaje tuvo una duración de tres meses (90 días). Teniendo en cuenta lo anterior, en el ensayo se aplicó un diseño experimental de bloques al azar, con cuatro tratamientos y tres repeticiones.
Evaluación del crecimiento foliar, radicular y biomasa de la plántula Guazuma ulmifolia. Se realizó un seguimiento mensual al crecimiento foliar durante los tres meses (cm día-1), además se evaluó el crecimiento foliar y radicular antes y después de la plantación. Una vez culminado el ensayo, se determinó la biomasa (kg ha-1) a partir del peso seco, para esto las plántulas se introdujeron al horno durante 48 horas a una temperatura de 60 °C.
Recuento e infección por HMA en las raíces de las plantas. El conteo de esporas de HMA por gramo se realizó nuevamente mediante la técnica de flotación-infiltración (Gerdeman y Nicholson, 1963). El porcentaje de infección por HMA en las raíces de la plántula se determinó por el método de tinción de raíces, utilizando azul de tripano al 0.05% hasta cubrir totalmente las raíces y se calentó en el horno a 80 °C durante 20 minutos (Vierheilig et al., 2005). Se retiró el exceso de azul de tripano y se montó verticalmente en láminas portaobjetos de 5 a 10 raíces de 1 - 2 cm aproximadamente, posteriormente se observó en el microscopio a 10X y 40X. El cálculo del porcentaje de infección se hizo aplicando la Ecuación 1:
Caracterización de los suelos mineros después del ensayo en vivero. Una vez culminado el ensayo, se realizó el análisis de los suelos aplicando los procedimientos y métodos utilizados en la caracterización inicial.
Ensayo a escala campo
Se hizo in situ en el suelo Tecnosol que se encuentra en proceso de rehabilitación, cabe aclarar que el área en donde se instaló el ensayo difiere de los puntos de muestreo de donde se tomó el suelo para los ensayos anteriores, por lo tanto, fue necesario realizar la caracterización antes y después de la intervención. Se establecieron cuatro lotes con dimensiones de 7 × 45 m2. Los tratamientos aplicados fueron: lote 1 (Guazuma ulmifolia); lote 3 (Guazuma ulmifolia + 4.3 Mg ha-1 de biochar); lote 5 (Guazuma ulmifolia + 4.3 Mg ha-1 de biochar + 5.5 Mg ha-1 de sustrato arenoso de micorrizas) y lote 8 (Guazuma ulmifolia + 5.5 Mg ha-1 sustrato arenoso de micorrizas). Con base en lo anterior, en este ensayo se aplicó un diseño experimental de bloques al azar con cuatro tratamientos y cinco repeticiones.
Crecimiento del foliar y diámetro basal de la plántula Guazuma ulmifolia en lotes. Se plantaron 12 árboles por cada lote, a estas se les realizó un seguimiento en cuanto al crecimiento foliar (cm día-1) y del diámetro (cm día-1) durante seis meses.
Caracterización del suelo Tecnosol en lotes. La evaluación de las características de los suelos intervenidos se realizó después de 11 meses de la plantación, para esto, se establecieron cinco puntos de muestreo en el suelo rizoférico por cada lote. Las variables a evaluar fueron pH, conductividad eléctrica y fósforo.
Origen del biochar
El biochar se obtuvo en un horno piloto de producción con cilindro regulador de alta presión perteneciente a la Universidad Popular del Cesar, a partir de cuesco de la fruta de la palma de aceite (Elaeis guineensis Jac), mediante pirolisis lenta a una temperatura de 450 °C en atmósfera controlada de nitrógeno. De acuerdo a la caracterización realizada por Díaz-Muegue (2017 2), el biochar presentó pH: 8.92, CE: 0.24 dS m-1, carbono orgánico 0.68%, densidad aparente 0.28 g cm-3 y capacidad de intercambio catiónico: 42.8 cmol kg-1.
Análisis de datos
Las variables se sometieron a pruebas estadísticas descriptivas, como promedio y desviación estándar. Se hizo un análisis de varianza (ANOVA) seguido de la prueba de Duncan (P ≤ 0.05), con el fin de comparar los tratamientos y el testigo en relación a variables fisicoquímicas y microbiológicas de los suelos y el crecimiento de la plántula Guazuma ulmifolia. Se utilizó el software Statistical Package for the Social Sciences (SPSS) versión 2.0.
Resultados y Discusión
Caracterización inicial
Desde el punto de vista físico, el suelo Acopio se caracterizó por ser de color pardo rojizo oscuro (5YR -3/3), con densidad aparente y real de 1.36 y 1.92 g cm-3 respectivamente, de textura franco arcillo arenosa (62.10% arena, 20.55% arcilla y 17.35% limo) y con capacidad de retención de humedad moderada (35.22%). En cuanto a las propiedades químicas, presentó pH extremadamente ácido (4.25), con capacidad de intercambio catiónico moderada (25.97 meq 100g-1), y bajas concentraciones de sales (CE = 0.08 dS m-1), fósforo (0.85 mg kg-1) y carbono orgánico (0.05%). Con relación a las propiedades microbiológicas, la densidad de esporas de HMA fue de 8 esporas/g de suelo, la concentración de glomalina total y la actividad enzimática fue 0.04 mg g-1 y 8.04 mg kg-1 ha-1 respectivamente.
Por otro lado, el suelo Tecnosol se caracterizó por ser de color pardo oscuro (10YR-4/3), con densidad aparente y real 1.51 y 2.48 g cm-3 respectivamente, de textura tipo arcillosa (34.10% arena, 46.25% arcilla y 19.65% limo) y alta capacidad de retención de humedad (43.36%). Así mismo, presento pH neutro (6.73), alta capacidad de intercambio catiónico (44.94 meq 100-1), y bajas concentraciones de sales (CE = 0.35 dS m-1), fósforo (0.72 mg kg-1) y carbono orgánico (0.04%). Con una densidad de esporas de 2 esporas/gramo de suelo, la concentración de glomalina y actividad enzimática fue 0.03 mg g-1 y 10.02 mg kg-1 ha-1, respectivamente.
En relación a lo anterior, durante los procesos de extracción - pre minería, los suelos sufren alteraciones drásticas en sus propiedades fisicoquímicas y microbiológicas originales (Feng et al., 2019). Se ha manifestado que en los suelos mineros la actividad microbiana es baja, consecuente de la perdida de materia orgánica, lo cual puede afectar seriamente el contenido de nutrientes (Dorr et al., 2016). Por otro lado, la acumulación y oxidación de sulfuros en los suelos mineros tiende a incrementar la acidez en el medio, promoviendo así la insuficiencia nutritiva y toxicidad química, lo cual afecta la solubilidad, concentración y movilidad de las especies iónicas en ambientes acuosos, en consecuencia, su absorción por las plantas (Malik et al., 2018; Amoah et al., 2020). Por su parte los tecnosoles, son diferentes de los suelos naturales debido a su estructura y función ya que la extracción del carbón genera un alto nivel de compactación, limitando la disponibilidad de nutrientes y generando un desequilibrio en la actividad microbiana de este suelo (Feng et al., 2019).
Ensayo de germinación
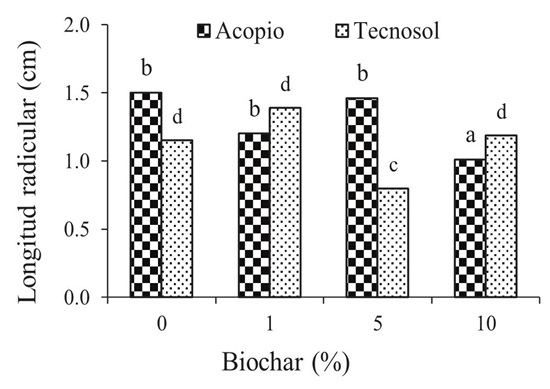
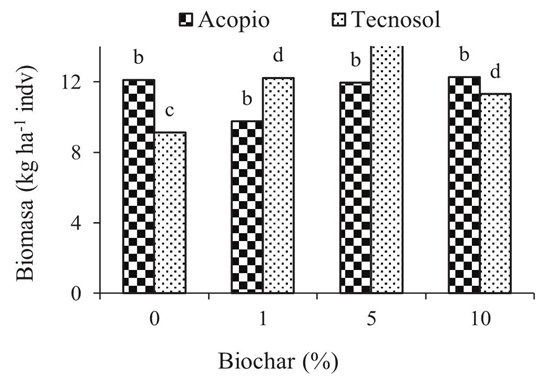
El efecto del biochar en el proceso de germinación de las semillas de Guazuma ulmifolia varío dependiendo de la concentración aplicada. En el suelo Acopio, el mayor porcentaje de semillas germinadas se obtuvo cuando se aplicó biochar al 1%, con un valor del 90%, hubo diferencia significativa (P < 0.05) con respecto a las demás dosis (Figura 1). Por otro lado, el porcentaje de germinación en el suelo Tecnosol disminuyó significativamente (P < 0.05) con la aplicación de biochar al 10% (Figura 2). En cuanto al crecimiento foliar y radicular de las plántulas, con la aplicación de 0, 1 y 5% de biochar, se obtuvo mayor crecimiento, sin embargo, con una concentración del 5% de biochar hubo mayor producción de biomasa (Figuras 3 y 4).
Con base en lo anterior, resultados similares obtuvieron Shamim et al. (2018) al estudiar el efecto de biochar en la germinación de semillas, el crecimiento temprano de Oryza sativa L. y los nutrientes del suelo, se manifestó que el biochar tiene un aumento significativo en el peso seco, de los brotes en comparación con el control. Además, la enmienda en una concentración del 10% inhibió en cierto grado el porcentaje la germinación de las semillas lo que contradice a lo obtenido por Abenza (20123), quien manifestó que la adición de las distintas enmiendas en forma de biochar al suelo no conlleva efectos inhibidores en el periodo de germinación, crecimiento y producción de la planta de Hordeum vulgare. A diferencia del suelo acopio, en el Tecnosol sin biochar la plántula tuvo un menor crecimiento foliar y radicular, además en biomasa, lo anterior podría ser consecuencia de la posible presencia de metales o compuestos tóxicos (Nirola et al., 2016).
Ensayo a escala vivero
Evaluación del crecimiento foliar, radicular y biomasa de la plántula Guazuma ulmifolia . Con la aplicación de los tratamientos 1 y 3, se evidenció el mayor crecimiento foliar (Figura 5). En el suelo Acopio, la plántula logró un crecimiento de 0.3 y 0.14 cm día-1, mientras que con los tratamientos 2 y 4 creció 0.03 y 0.05 cm día-1; así mismo en el suelo Tecnosol con el tratamiento 3, el crecimiento fue 0.2 cm día-1 a diferencia de los demás tratamientos en donde la máxima tasa de crecimiento fue 0.07 cm día-1. Por otro lado, el biochar y los HMA no produjeron diferencia significativa (P > 0.05) en el crecimiento radicular de la planta. En la Figura 5, se puede observar un decrecimiento de las plantas al mes de la plantación, lo anterior pudo deberse al estrés hídrico y biótico que sufrió la planta durante el periodo de adaptación (Quintão-Scalon et al., 2011), además de las condiciones edáficas de los materiales.
Figura 5: Crecimiento foliar de la plántula Guazuma ulmifolia en suelos Acopio y Tecnosol. A = acopio; T = tecnosol; T1 = tratamiento 1 (25 g biochar+15 g de sustrato arenoso de HMA); T2 = tratamiento 2 (15 g de sustrato arenoso de HMA); T3 = tratamiento 3 (25 g biochar+15 g de inóculo de HMA+2 g NPK); T4 = tratamiento 4 (suelo)
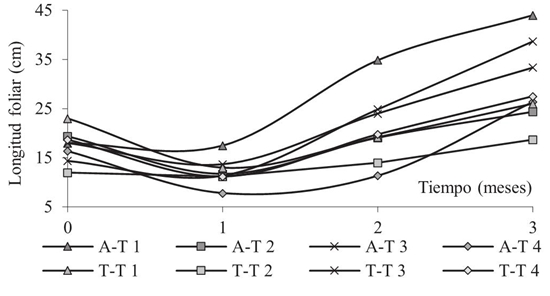
Figure 5: Foliar growth of the Guazuma ulmifolia seedling in Acopio and Tecnosol soils. A = Acopio; T = Tecnosol; T1 = treatment 1 (25 g biochar + 15 g of sandy HMA substrate); T2 = treatment 2 (15 g of sandy HMA substrate); T3 = treatment 3 (25 g biochar + 15 g of inoculum of HMA + 2 g NPK); T4 = treatment 4 (soil).
Respecto a la biomasa, en el suelo Acopio las plantas presentaron la mayor cantidad de biomasa (132.6 kg ha‑1 individuo-1) con la aplicación del tratamiento 1, seguido de los tratamientos 2, 4 y 3 con cantidades de 47.8, 41.7 y 37.5 kg ha-1 individuo-1. Sin embargo, en el suelo Tecnosol, la aplicación del tratamiento 3 incrementó el contenido de biomasa con 68.9 kg ha‑1 individuo-1, seguido de los tratamientos 4, 1 y 2 con cantidades de 53.3, 48.1 y 35.9 kg ha‑1 individuo‑1 respectivamente.
Infección por HMA en las raíces de las plantas. En el suelo Acopio, con la aplicación de los tratamientos 1 y 3 el porcentaje de infección fue 60%, a diferencia de los tratamientos 2 y 4 en donde solo se evidenció el 20%, mientras que en el suelo Tecnosol con la aplicación de los tratamientos 1, 2 y 3 se halló un porcentaje de infección del 20%, a diferencia del tratamiento 4 en donde no hubo micorrización. La simbiosis entre la plántula y los HMA se vio favorecida por la presencia de biochar, con la aplicación de los tratamientos 1 y 3 se observó mayor porcentaje de infección, lo cual estimuló a la plántula a obtener el máximo crecimiento y producción de biomasa. Estudios recientes demuestran, que el proceso de colonización de HMA en Theobroma cacao L, se vio favorecido por la presencia de biochar, así mismo el crecimiento y crecimiento del peso seco (Aggangan et al., 2019). Además, la incidencia del biochar y HMA mejoró la tolerancia al estrés hídrico (Hashem et al., 2019). La micorrización de la plántula Guazuma ulmofilia, podría garantizar la supervivencia de la plántula en el proceso de rehabilitación, estudios observaron una mayor mortalidad de Guazuma ulmifolia en plántulas no inoculadas (tres plantas) y en plántulas inoculadas con la mezcla de AMF nativo (Souza et al., 2012).
Caracterización de los suelos mineros después del ensayo en vivero
Los resultados que se presentan en los Cuadros 1, 2 y 3 fueron analizados estadísticamente, realizando una comparación entre las características iniciales de los suelos y los tratamientos mencionados en el marco metodológico. De acuerdo a lo expuesto en el Cuadro 1, en el suelo Acopio la densidad aparente se redujo significativamente (P < 0.05) con los tratamientos 2 y 4, mientras que el suelo Tecnosol dicha propiedad se redujo significativamente (P < 0.05) con los tratamientos 1 y 2. Se ha manifestado que la disminución en la densidad aparente de suelo por la aplicación de biochar, puede aumentar la porosidad total (Blanco, 2017), lo anterior podría favoreces la aireación y drenaje en el medio edáfico, así mismo la actividad en macro y microorganismos.
Table 1: Physical characteristics of the soils after the nursery test.
Características físicas | |||||||||
Suelo |
Tratamiento |
Color Munsell |
Densidad aparente |
Densidad real |
Textura |
Retención humedad |
|||
Tipo |
|||||||||
- - - - g cm-3 - - - - |
- - - - - % - - - - - |
% |
|||||||
Acopio |
1 |
5YR -4/3 |
1.31 c |
1.93 ab |
62.07 |
23.04 |
14.89 |
38.68 a |
|
2 |
5YR -4/3 |
1.28 c |
1.93 ab |
68.31 |
23.04 |
8.65 |
39.09 a |
||
3 |
5YR -4/3 |
1.31 c |
1.92 a |
64.8 |
17.9 |
17.3 |
36 ab |
||
4 |
5YR -4/3 |
1.23 abc |
1.92 a |
63.15 |
23.04 |
13.81 |
35.78 ab |
||
Tecnosol |
1 |
10YR-3/4 |
1.16 a |
2.49 c |
35.77 |
44.45 |
19.78 |
45.06 c |
|
2 |
10YR-3/4 |
1.18 ab |
2.49 c |
35.53 |
44.45 |
20.02 |
46.52 c |
||
3 |
10YR-3/4 |
1.26 bc |
2.49 c |
34.81 |
46.36 |
18.84 |
44.88 bc |
||
4 |
10YR-3/4 |
1.31 c |
2.48 c |
35.21 |
53.87 |
10.92 |
43.81 bc |
||
Ar = arena; Arc = arcilla; L = limo. Valores seguidos de la misma
Ar = sand; Arc = clay; L = silt. Values followed by the same letter do not present significant differences according to Duncan 0.05.
La aplicación de los tratamientos 1 y 2 generó diferencia significativa (P < 0.05) en la capacidad de retención de humedad de los suelos acopio y Tecnosol, siendo el tratamiento 2 el que generó un mayor aumento. En las demás características no se encontró diferencia significativa con la aplicación de los tratamientos.
Por otra parte, la aplicación de los 4 tratamientos produjo diferencia significativa (P < 0.05) en el pH de los suelos (Cuadro 2), en el suelo Acopio con el tratamiento 3, el pH varió desde extremadamente ácido (4.25) a moderadamente ácido (5.07) seguido a este, se encuentra los tratamientos 4, 1 y 2; mientras en el suelo Tecnosol, con el tratamiento 2 el pH se incrementó desde neutro (6.73) a medianamente alcalino (7.41). Una de las causas principales de la acidez en el suelo mineros es la presencia de metales pesado y oxidación de carbón mineral, estudios recientes han demostrado que el biochar y los HMA puede reducir la movilidad y el contenido disponible de metales como Cd, Pb y Zn, y aumentar el pH del suelo (Puga et al., 2016; Meng et al., 2018; Bruneel et al., 2019). La modificación de pH en los suelos que solamente fueron intervenidos por la plántula Guazuma ulmifolia permite plantear la siguiente hipótesis: Guazuma ulmifolia es una especie correctora de acidez en el suelo. Lo anterior podría explicarse por la capacidad que tienen la planta para absorber metales pesados (Marrugo et al., 2016), lo cual permite que disminuya su concentración en el suelo.
Table 2: Chemical characteristics of the soil after the nursery test.
Características químicas | ||||||
Suelo |
Tratamiento |
pH |
Conductividad eléctrica |
Capacidad de intercambio catiónico |
Fósforo |
Carbono orgánico |
H+ |
dS m-1 |
meq 100g-1 |
mg kg-1 |
% |
||
Acopio |
1 |
4.64 a |
0.04 a |
19.19 a |
2.11 c |
0.88 d |
2 |
4.73 a |
0.02 a |
16.87 a |
2.09 c |
0.97 d |
|
3 |
5.07 b |
0.02 a |
19.82 a |
1.94 b |
0.34 c |
|
4 |
4.82 a |
0.02 a |
25.62 a |
1.59 ab |
0.88 d |
|
Tecnosol |
1 |
6.96 c |
0.30 c |
22.72 a |
2.22 c |
0.39 c |
2 |
7.41 d |
0.27 c |
23.33 a |
1.07 a |
0.07 ab |
|
3 |
6.99 c |
0.17 b |
23.38 a |
1.82 b |
0.12 ab |
|
4 |
6.94 c |
0.12 b |
26.4 a |
1.22 ab |
0.87 d |
|
Tratamiento 1 (Guazuma ulmifolia + 25 g de biochar + 15 g de sustrato arenoso de micorrizas); tratamiento 2 (Guazuma ulmifolia + 15 g de sustrato arenoso de micorrizas); tratamiento 3 (Guazuma ulmifolia + 25 g biochar + 15 g sustrato arenoso micorrizas + 2 g de fertilizante químico-NPK); tratamiento 4 (Guazuma ulmifolia). Valores seguidos de la misma letra no presentan diferencias significativas según Duncan 0.05.
Treatment 1 (Guazuma ulmifolia + 25 g of biochar + 15 g of sandy mycorrhizal substrate); treatment 2 (Guazuma ulmifolia + 15 g of sandy mycorrhizal substrate); treatment 3 (Guazuma ulmifolia + 25 g biochar + 15 g mycorrhizal sandy substrate + 2 g of chemical fertilizer-NPK); treatment 4 (Guazuma ulmifolia). Values followed by the same letter do not present significant differences according to Duncan 0.05.
Por otro lado, la concentración de sales en el suelo Acopio se redujo significativamente (P < 0.05) con el tratamiento 3, también hubo diferencia significativa con los demás tratamientos; además, los tratamientos 2 y 4 redujeron la conductividad eléctrica (CE) moderadamente. En cambio, en el suelo Tecnosol la aplicación de los tratamientos 3 y 4 la CE disminuyó desde 0.35 dS m-1 a 0.27 y 0.17 dS m-1 (Cuadro 2).
Los cuatro tratamientos incrementaron significativamente la concentración de fósforo en los suelos (Cuadro 2), en el suelo Acopio con los tratamientos 1 y 2 se incrementó porcentualmente en un148 y 145.9% con respecto a la concentración inicial, mientras que con los tratamientos 3 y 4 aumentó porcentual de 128 y 87.1% respectivamente. De igual manera en el suelo Tecnosol, con el tratamiento 1 hubo un incrementó porcentualmente de 208.3% con respecto a la concentración inicial, seguido a este se encuentra los tratamientos 3, 4 y 2. Con respecto a lo anterior, se ha manifestado que el biochar libera lentamente fósforo en el suelo, además, la presencia de HMA en el suelo rizoférico tiende a aumentar la disponibilidad de este en las raíces de las plantas (Zwetsloot et al., 2016). Los HFM solubilizan fósforo en conjuntos con bacterias solubilizadoras de fosfato, incrementando la disponibilidad de fósforo en el suelo (Taktek et al., 2015 y 2017).
Por otra parte, la concentración de carbono orgánico aumentó con los tratamientos 1, 2 y 4 en el suelo Acopio, en concentraciones de 0.75 y 0.92%, mientras que en el suelo Tecnosol con los tratamientos 1 y 4 la concentración de carbono se incrementó 0.35 y 0.83%. Se informó que la aplicación de biochar al suelo aumenta significativamente el contenido de C total hasta el 68.8% (Laird et al., 2010). En nuestro caso la concentración de carbono por unidad en un 0.91%, dicho incremento podría estar relacionado con la composición química de la enmienda (0.86%), además de la capacidad para capturar CO2 y la acumulación de carbono en fracciones de agregado (Zhang et al., 2015; Jung et al., 2019), también con las actividades metabólicas de la planta y los microorganismos, sabiendo que en la simbiosis los HMA excretan sustancias como la glomalina, la cual tiene una estrecha relación con el carbono orgánico soluble (Seguel et al., 2008).
De acuerdo al Cuadro 3, la concentración de glomalina en el suelo Acopio se elevó significativamente con la aplicación del tratamiento 3, con un incremento porcentual de 100%, mientras que con los tratamientos el incremento fue de 1, 2 y 4 se incrementó hasta 75%; así mismo, en el suelo Tecnosol con los tratamientos 2 y 4 se incrementó en un 100% respecto al valor inicial, en cambio con los tratamientos 2, 3 y 4 la concentración se elevó en un 100%. La presencia de biochar mejora la micorrización, causando una mayor producción de glomalina y estimulación de exudados de la raíz, lo que puede modificar la C residual del suelo y mejorar la actividad microbiana. Los filamentos fúngicos y sus productos metabólicos también son agentes aglutinantes en los niveles meso y macro agregados del suelo (Carbone-Carneiro et al., 2015; Amoah et al., 2020), repercutiendo así en el incremento de la capacidad de retención de humedad y drenaje, reducción del nivel de erosión y lixiviación de nutrientes.
Table 3: Microbiological characteristics of soil after the nursery test.
Características microbiológicas | ||||
Suelo |
Tratamiento |
Esporas de HMA |
Glomalina total |
Actividad enzimática |
Esporas g-1 |
mg g-1 |
mg kg-1 ha-1 |
||
Acopio |
1 |
12 bc |
0.07 b |
25.51 a |
2 |
15 c |
0.07 b |
25.44 a |
|
3 |
8 b |
0.08 c |
26.37 a |
|
4 |
7 b |
0.07 b |
26.49 a |
|
Tecnosol |
1 |
3 a |
0.05 ab |
41.75 c |
2 |
2 a |
0.06 ab |
37.91 bc |
|
3 |
2 a |
0.06 ab |
31.57 ab |
|
4 |
2 a |
0.06 ab |
31.44 ab |
|
Tratamiento 1 (Guazuma ulmifolia + 25 g de biochar + 15 g de sustrato arenoso de micorrizas); tratamiento 2 (Guazuma ulmifolia + 15 g de sustrato arenoso de micorrizas); tratamiento 3 (Guazuma ulmifolia + 25 g biochar + 15 g sustrato arenoso micorrizas + 2 g de fertilizante químico-NPK); tratamiento 4 (Guazuma ulmifolia). Valores seguidos de la misma letra no presentan diferencias significativas según Duncan 0.05.
Treatment 1 (Guazuma ulmifolia + 25 g of biochar + 15 g of sandy mycorrhizal substrate); treatment 2 (Guazuma ulmifolia + 15 g of sandy mycorrhizal substrate); treatment 3 (Guazuma ulmifolia + 25 g biochar + 15 g mycorrhizal sandy substrate + 2 g of chemical fertilizer-NPK); treatment 4 (Guazuma ulmifolia). Values followed by the same letter do not present significant differences according to Duncan 0.05.
Por otro lado, la actividad enzimática en el Acopio se incrementó significativamente (P < 0.05) en todos los tratamientos en el suelo acopio, sobresaliendo los tratamientos 3 y 4. En el suelo Tecnosol, con los tratamientos 1 y 2 hubo la mayor variación desde 10.02 mg kg ha-1 a 41.75 y 37.91 mg kg-1 ha-1, de igual forma con los tratamientos 3 y 4 los niveles se acrecentaron hasta 31.57 y 31.44 mg kg-1 ha-1 con respecto al valor inicial. El aumento de la actividad enzimática, es un indicador del incremento del carbono orgánico, fósforo y la multiplicación de los microorganismos en los suelos. Trupiano et al. (2017), notaron un incremento de material vegetal por acción del biochar en el cultivo de lechuga en macetas, dichos autores manifestaron que la actividad de las enzimas relacionadas con los ciclos de nitrógeno, fósforo y carbono mejoraron con la aplicación de la enmienda; mejorando disponibilidad de estos elementos para las plantas y al mismo tiempo incrementando la capacidad de retención de humedad en el suelo.
Ensayo en campo
Crecimiento foliar y diámetro basal de la plántula Guazuma ulmifolia en lotes. Bajo las condiciones de estrés hídrico y la deficiencia de nutrientes en que la planta se encontraba, se evidencia (Figura 6) un mejor crecimiento cuando se le aplicó biochar y micorrizas, en el lote 5 la planta tuvo una tasa de crecimiento foliar y de diámetro de 0.15 y 0.004 cm día-1, mientras que en los lotes 1, 3 y 8 la tasa de crecimiento foliar fue 0.11, 0.08 y 0.005 cm día-1, a su vez la tasa de crecimiento de los diámetros en estos fue menor a 0.003 cm día-1.
Caracterización del suelo Tecnosol en lotes. De acuerdo al Cuadro 4, el suelo Tecnosol presentó pH moderadamente ácido, no se encontró incremento significativo de pH en los lotes; por lo contrario, en el lote 5 el pH disminuyó a fuertemente ácido (4.69).
Por otro lado, se encontró diferencia significativa en la conductividad eléctrica por cada tratamiento aplicado, destacando el lote 3 que varió desde 2.47 a 0.01 dS m-1 lo equivalente a una reducción del 99.39% con respecto al valor inicial. La concentración de fósforo se incrementó significativamente en los lotes 1 y 3 variando desde 0.81 mg kg-1 a 1.08 y 1.14 mg kg-1 lo equivalente a un 33.3 y 40.7%.
Conclusiones
La presencia del biochar en los procesos de germinación y crecimiento de las semillas de Guazuma ulmifolia incrementó el porcentaje de germinación, la longitud foliar y la biomasa de las plántulas. De acuerdo a los resultados obtenidos en el estudio, el biochar en una dosis del 1% se considera la concentración adecuada para obtener la mayor germinación de semillas, a una dosis del 5% promueve de manera más efectiva el crecimiento foliar, radicular y el contenido de biomasa de la planta, pero con una concentración del 10% inhibió en cierto grado la germinación de la plántula.
La micorrización de Guazuma ulmifolia es un factor clave en la rehabilitación de suelos ya que por medio de esté, el árbol podrá soportar las condiciones adversas que otras especies no han podido hasta el momento. El biochar resulta de gran interés en este proceso, de acuerdo con los resultados la enmienda favoreció la infección en la raíz de la planta, así mismo las micorrizas y el biochar potencializaron el crecimiento foliar y del diámetro, y la biomasa.
El uso del biochar y los hongos formadores de micorrizas mostró un potencial significativo en el proceso de rehabilitación de suelos mineros, se evidenció una mejora en las propiedades fisicoquímicas del suelo, al mismo tiempo promovió la actividad enzimática, micorrización y producción de la glomalina, mejorando así las condiciones edáficas. Los tratamientos 1 (planta+25 g de biochar + 15 g de sustrato arenoso de HMA) y 3 (planta + 25 g biochar + 15 de sustrato arenoso de HMA + 2 g de NPK) mostraron mejor respuesta en el mejoramiento de las características fisicoquímicas y microbiológicas de los suelos, con el tratamiento 1 se obtuvo una disminución de la densidad aparente, el incremento de fósforo, carbono orgánico y actividad enzimática, mientras que con el tratamiento 3 hubo mayor aumento de pH y glomalina, al mismo tiempo se encontró una disminución importante de la concentración de sales en los suelos. Con la plantación in situ en el suelo Tecnosol se demostró que los efectos del biochar y las micorrizas favorecen la disponibilidad de fósforo y carbono orgánico, aunque la variación de pH no fue significativa.
Dentro de las recomendaciones sugeridas por este estudio, se ínsita a evaluar con más exactitud el efecto del biochar y las micorrizas en el crecimiento radicular de la plántula Guazuma ulmifolia, ya que, por el alto contenido de arcilla en los suelos, el material se compactó en los rizotrones destruyéndose gran parte de las raíces al momento de extraerlas. Si se quiere establecer la plantación en campo, para garantizar un mayor éxito en el proceso de rehabilitación, se recomienda realizar la inoculación con los hongos formadores de micorrizas arbusculares (HMA) en presencia de biochar cuando la planta esté en la etapa de producción. Teniendo en cuenta las reducciones significativas de la conductividad eléctrica en los suelos, resulta de gran interés evaluar los efectos del biochar, las micorrizas y la plántula en suelos con altas concentraciones de sales, también se propone estudiar la influencia de la planta en la variación de pH en los suelos.
Los resultados obtenidos en la presente investigación son un gran avance para la rehabilitación de suelos mineros, quienes por lo general presentan escases de nutrientes y condiciones fisicoquímicas desfavorables, sabiendo que el uso de productos biotecnológicos como lo son el biochar, micorrizas arbusculares y plantas nativas en nuestro caso Guazuma ulmifolia, potencializan dicho proceso con la mejora de las propiedades de los suelos y los efectos positivos que causan en el crecimiento y supervivencia de la planta.
Disponibilidad de datos
Los datos utilizados o analizados durante el estudio actual están disponibles con los autores principales del trabajo (Laura Janeth Quiroz Mojica y María Margarita Daza Mendoza), ante solicitudes razonables.
Fondos
El estudio fue apoyado económicamente por la red de investigación RPBSD (red de Aprovechamiento de recursos naturales y obtención de productos biotecnológicos para suelos disturbados por actividad antrópica), aprobada y apoyada por Colciencias 2013-2018.
Contribución de los Autores
El desarrollo general de la investigación fue realizado por L.J.Q.M y M.M.D.M, quienes fueron las encargadas de elaborar y ejecutar el estudio, además, de escribir y editar el artículo, todo esto apoyado metodológica e investigativamente por L.C.D.M, quien fue la persona encargada de dirigir el estudio y revisar el artículo. Así mismo, G.A.P.M contribuyó con la revisión del artículo, además en conjunto con L.C.D.M colaboró con la gestión de los recursos. A.E.M.R ayudó con el análisis estadístico de los datos y la revisión general del artículo.











 nueva página del texto (beta)
nueva página del texto (beta)