Introducción
La micorriza arbuscular (MA) es la simbiosis mutualista que se establece entre hongos micorrízicos arbusculares (HMA) del phylum Glomeromycota y la raíz de la mayoría de plantas vasculares (Delavaux et al., 2019). Al respecto, cabe matizar que algunos investigadores postulan que el establecimiento de dichas asociaciones incrementa en las plantas su capacidad de absorción de agua y nutrimentos del suelo, principalmente de fósforo (Le Pioufle et al., 2019; Zhang et al., 2020). Además, aumentan la resistencia a plagas y enfermedades (Ravnskov et al., 2020), tolerancia al estrés abiótico (Begum et al., 2019) e influyen sobre las propiedades físico-químicas del suelo (Frey, 2019).
La tendencia taxonómica actual de los HMA incluye la combinación de métodos convencionales de identificación basados en caracteres discretos de la estructura subcelular de las esporas (como tamaño, color e hifa de sostén, entre otras) (Calhim et al., 2018), así como por los análisis filogenético-moleculares (de la región SSU, LSU e ITS) conocidos como taxonomía polifásica (Kusakabe et al., 2018; Sting et al., 2019). Al respecto, Schüßler (2006), identificó 10 géneros y 193 especies de HMA, pero posteriormente Oehl et al. (2011) reportaron 29 géneros con 230 especies ordenadas en 14 familias. Sin embargo, la diversidad de HMA en ecosistemas naturales y agroecosistemas podría ser mayor que la estimada (Öpik et al., 2008).
De manera particular, la abundancia, diversidad y funcionamiento de los HMA en los sistemas agrícolas hacia las plantas es influenciado por diversas prácticas agronómicas, incluyendo la labranza del suelo, barbecho, rastreo, rotación de cultivos, aplicación de agroquímicos o productos biológicos y prácticas culturales, entre otros (Chamkhi et al., 2019; Huang et al., 2019; Lehman et al., 2019).
El acolchado plástico es una práctica común para mejorar la producción y sostenibilidad de los cultivos (Gao et al., 2019), debido a su efecto sobre la relación suelo-agua-planta-atmósfera, sin embargo, puede afectar la abundancia y diversidad de los HMA al influir en el microclima del suelo (Dong et al., 2017; Qin et al., 2017).
En particular, existen estudios escasos acerca del efecto del color del acolchado plástico sobre las comunidades microbianas (Zhu et al., 2018; Huang et al., 2019), las cuales, son de importancia en la fertilidad del suelo (Okonji et al., 2018), conservación de la humedad y en la mejora del crecimiento y potencial productivo de los cultivos (Zhu et al., 2017). Por lo anterior, el objetivo del presente trabajo fue determinar la diversidad de HMA asociados al cultivo de calabacita italiana (Cucurbita pepo L.) cv. 'Grey Zucchini' establecido en campo utilizando acolchados plásticos de diferente color.
Materiales y Métodos
Área de estudio
El presente estudio se realizó en un área agrícola donde se cultivó calabacita italiana (C. pepo) durante los ciclos verano-otoño (V-O 2017) e invierno-primavera (I‑P 2017) localizado a 19° 29’-19° 36’ N, los meridianos 96° 48’-96° 58’ O y altitud de 1600 m, en Xalapa, Veracruz, México. Consideraciones climáticas reportadas por Soto y Gómez (1993) indican que la ciudad se encuentra ubicada en una zona de transición entre clima templado C(fm)w”b(i‟)g y clima semicálido (A)C(fm)w”(i‟)g con lluvia presente durante todo el año (máxime en verano) y una temperatura media anual comprendida entre 12 y 18 °C.
Tratamientos y manejo agronómico del cultivo
De acuerdo al sistema de producción establecido para C. pepo, se dispusieron ocho tratamientos: V (vermicomposta), APB (acolchado plástico blanco), APB+V; APR (acolchado plástico rojo), APR+V; APN (acolchado plástico negro), APN+V y C (control = sin vermicomposta y acolchado plástico). Dichos tratamientos fueron distribuidos en un diseño de bloques al azar de efectos aleatorios en arreglo factorial con tres repeticiones, y las interacciones vermicomposta (con y sin vermicomposta), acolchado (sin acolchar, con acolchado plástico rojo, blanco y negro) y ciclo de cultivo invierno-primavera (I-P) y verano-otoño (V-O). A los tratamientos con vermicomposta se les aplicaron 30 g de humus de lombriz al inicio del experimento.
Se obtuvo una muestra de suelo de los tratamientos al inicio y final de cada ciclo y se determinó; pH (1:2), N, P y K en mg·kg-1, materia orgánica (M.O., %) y textura en el Laboratorio de Suelos de la Facultad de Ciencias Agrícolas de la Universidad Veracruzana, Campus Xalapa y en el Laboratorio de Análisis de Suelos del INIFAP, Campus Cotaxtla, utilizando los métodos estandarizados y especificaciones indicadas en la NOM-021-RECNAT-2000 expedida por la Secretaría del Medio Ambiente y Recursos Naturales el día 31 de diciembre de 2002 (SEMARNAT, 2002) (Cuadros 1 y 2).
Cuadro 1: Análisis físicos y químicos del suelo donde se cultivó calabacita italiana durante el ciclo invierno-primavera (I-P).
Table 1: Physical and chemical analyses of the soil where zucchini pumpkin was grown during the winter-spring (W-S) cycle.
Parámetro |
Tratamientos |
|||||||
pH (1:2) |
6.2 |
5.7 |
5.1 |
4.8 |
4.8 |
5.8 |
4.8 |
5.8 |
Nitrógeno† |
1.4 |
1.8 |
1.9 |
1.9 |
1.7 |
2.3 |
1.9 |
1.8 |
Fósforo† |
571 |
598 |
652 |
721 |
589 |
617 |
637 |
719 |
Potasio† |
461 |
487 |
517 |
572 |
433 |
497 |
521 |
489 |
M.O. (%) |
1.2 |
1.7 |
1.5 |
1.8 |
1.9 |
2.1 |
1.7 |
1.7 |
Textura |
Migajón-arenosa |
|||||||
C = control sin vermicomposta y acolchado plástico; V = vermicomposta; APB = acolchado plástico blanco; APB+V = acolchado plástico blanco + vermicomposta; APR = acolchado plástico rojo; APR+V = acolchado plástico rojo + vermicomposta; APN = acolchado plástico negro; APN+V = acolchado plástico negro + vermicomposta. †Nutriente (mg·kg-1); M.O. = materia orgánica.
C = control without vermicompost and plastic padding; V = vermicompost; APB = white plastic padding; APB+V = white plastic padding + vermicompost; APR = red white plastic padding; APR+V = red white plastic padding + vermicompost; APN = black plastic padding; APN+V = black plastic padding + vermicompost. †Nutrient (mg·kg-1); M.O. = organic matter.
Cuadro 2: Análisis físicos y químicos del suelo donde se cultivó calabacita italiana durante el ciclo verano-otoño (V-O).
Table 2: Physical and chemical analyses of the soil where zucchini pumpkin was grown during the summer-fall (S-F) cycle.
Parámetro |
Tratamientos |
|||||||
pH (1:2) |
6.6 |
5.7 |
6.4 |
6.1 |
6 |
6.6 |
5.5 |
5.5 |
Nitrógeno† |
0.5 |
0.5 |
0.5 |
0.5 |
0.5 |
0.5 |
0.5 |
0.5 |
Fósforo† |
ND‡ |
ND |
ND |
ND |
ND |
4.5 |
ND |
4.6 |
Potasio† |
0.4 |
0.6 |
2.2 |
0.6 |
0.2 |
0.8 |
0.3 |
0.8 |
M.O. (%) |
6.8 |
11.4 |
0.4 |
11.4 |
7.8 |
11.4 |
6.9 |
11.4 |
Textura |
Migajón-arenosa |
|||||||
C = control sin vermicomposta y acolchado plástico; V = vermicomposta; APB = acolchado plástico blanco; APB+V = acolchado plástico blanco + vermicomposta; APR = acolchado plástico rojo; APR+V = acolchado plástico rojo + vermicomposta; APN = acolchado plástico negro; APN+V = acolchado plástico negro + vermicomposta. †Nutriente (mg·kg-1); M.O. = materia orgánica. ‡ND = No disponible.
C = control without vermicompost and plastic padding; V = vermicompost; APB = white plastic padding; APB+V = white plastic padding + vermicompost; APR = red white plastic padding; APR+V = red white plastic padding + vermicompost; APN = black plastic padding; APN+V = black plastic padding + vermicompost. †Nutrient (mg·kg-1); M.O. = organic matter. ‡ND = Not available.
El manejo agronómico del cultivo en ambos ciclos se basó en un acolchado plástico InterGro, Inc. de color negro, rojo y blanco, calibre 90 de baja densidad (LDPE Monocapa o co-extrusión de polietileno, con una capa de aluminio) con protección contra UV, y saturación hídrica-media con aspersión manual. Se fertilizó con urea (CO [NH2 ]2), DAP (fosfato diamónico, NP 18-46) y triple 17 (NPK 17-17-17) a los siete y 35 días después del trasplante (DDT, 26 g·planta-1) y una aplicación del fertilizante foliar Bayfolan® (20 mL·20 L-1). Se aplicaron insecticidas naturales (extracto de neem y jabón potásico), además de fungicidas de contacto (oxicloruro de cobre) y de acción sistémica (Aliette® WDG) en dosis reducida (1 g·L-1).
Obtención de las muestras
Para la identificación taxonómica de las morfoespecies de hongos micorrízicos arbusculares (HMA) se utilizó suelo rizosférico recolectado durante la aparición de botones florales (34 DDT) de C. pepo. Se colectó una muestra compuesta (formada por 15 submuestras) de cada tratamiento en cada ciclo del cultivo.
Colonización micorrízica
Las raíces de C. pepo fueron aclaradas con KOH y H2O2, teñidas con azul tripano en lactoglicerol (Phillips y Hayman, 1970) y evaluadas con un microscopio compuesto (100x) en tres campos visuales equidistantes sobre cada fracción en la que se registró la presencia o ausencia de estructuras micorrízicas como hifas, vesículas, arbúsculos y esporas (Giovannetti y Mosse, 1980).
Aislamiento e identificación de especies de hongos micorrízicos arbusculares (HMA)
De cada tratamiento se colectaron tres muestras de 50 g de suelo rizosférico de C. pepo, las cuales fueron procesadas mediante la técnica de tamizado húmedo y decantación, complementada con una centrifugación en un gradiente de sacarosa (50% peso/volumen) (Gerdemann y Nicolson, 1963). Las esporas fueron separadas bajo un microscopio estereoscópico y clasificadas en grupos adecuados de acuerdo a sus rasgos morfológicos utilizados en la taxonomía del filo Glomeromycota (hongos formadores de micorrizas arbusculares). Con una pipeta Pasteur, se colocaron grupos de 10 esporas sobre un portaobjetos con alcohol polivinílico y ácido láctico glicerol (PVLG) y PVLG mezclado con reactivo de Melzer 1:1 (v/v). A continuación, cada laminilla fue observada bajo microscopio óptico (40x y 100x) y se tomaron medidas de cada espora con una reglilla micrométrica (mm) acoplada al ocular (Nikon Optiphot II, Nikon, Tokio, Japón).
La confirmación de géneros y especies se realizó a partir de las claves taxonómicas propuestas por Schenck y Pérez (1990),Schüßler et al. (2001), Schüßler y Walker (2010) e INVAM (2020).
Estimación de la riqueza, abundancia e índice de diversidad de shannon-weaver
La riqueza se estimó con el número de especies encontradas en cada tratamiento, la abundancia relativa se calculó con el número de esporas de un morfotipo sobre el total de esporas aisladas multiplicado por 100, de acuerdo con Pérez-Luna et al. (2012); por su parte, el índice de diversidad de Shannon-Weaver (Shannon y Weaver, 1949) se calculó con la fórmula siguiente: H’= - Σ pi ln pi, donde pi fue el número de esporas de un morfotipo dividido entre el total de esporas aisladas.
Medición de la temperatura y humedad del suelo
La temperatura del suelo se midió con un termómetro para tierra (Gesa-803-795) registrándose una media de 18 °C en suelos sin acolchar, 22-23 °C con acolchado rojo, 20-21 °C con acolchado blanco y 23-24 °C con acolchado negro en el ciclo I-P, mientras que en el ciclo V-O se incrementaron en orden a 22 °C, 24-25 °C, 23-25 °C y 28-32 °C. También se monitoreo la humedad del suelo in situ con un Probador de Suelo 4-en-1 (AIZYR, modelo 694-770-606). En el ciclo I-P fue de 55% en tratamientos sin acolchar y 60-77% en los acolchados, y en el ciclo V-O estas fueron de 77% y entre 80-90%, respectivamente.
Análisis estadístico
Para el análisis estadístico se utilizó el software Statistica v. 12.0 para Windows. La distribución normal de los datos se comprobó según Kolmogorov-Smirnov (Massey, 1951) y la homogeneidad de las varianzas mediante la prueba de Bartlett (1937). Se realizaron análisis de varianza multifactorial y las medias se compararon según el criterio de Tukey (( = 0.05). El modelo matemático empleado en cada una de los ANOVAs fue el siguiente:
donde: Yijk = variable respuesta; µ = constante común para todas las observaciones; Fi = efecto de la i-ésima vermicomposta (j=1, 2); ACj = efecto del j-ésimo acolchado (k= 1, …,4); PCk = efecto de k-ésimo ciclo de cultivo (l=1, 2); F × ACij = efecto combinado de la i-ésima vermicomposta en el j-ésimo acolchado; F × PCik = efecto combinado de i-ésima vermicomposta en el k-ésimo ciclo de cultivo; AC × PCjk = efecto combinado del j-ésimo acolchado en el k-ésimo ciclo de cultivo; F × AC × PCijk = efecto combinado de i-ésima vermicomposta en el j-ésimao acolchado durante el k-ésimo ciclo de cultivo; eijk = error aleatorio ~N (0, σ2e).
Para el índice de diversidad se utilizó el software estadístico F Diversity (Casanoves et al., 2011) v. 10.0 para Windows.
Resultados y Discusión
Colonización micorrízica en raíces de C. pepo
Se encontraron diferencias significativas en los porcentajes de colonización micorrízica en raíces de C. pepo cultivado en campo (Tukey, P ≤ 0.05). Los mayores niveles de colonización micorrízica fueron promovidos por efecto de la vermicomposta (V) en ambos periodos del cultivo (I-P y V-O) con 59.2 y 96.06%, respectivamente. Este factor influyó cuando el humus de lombriz se aplicó al suelo en los distintos tratamientos y ciclos de cultivo. El factor ciclo de cultivo tuvo efectos significativos en las plantas colonizadas por los hongos micorrízicos arbusculares (HMA), siendo en el periodo V-O donde los porcentajes fueron mayores (Cuadro 3), respecto a I-P. En cuanto al factor acolchado plástico se refiere, los porcentajes menores de colonización se observaron en las plantas de los tratamientos con APN y APR sin distinción del ciclo de cultivo (Cuadro 3).
Cuadro 3: Interacción del ciclo de cultivo, acolchado plástico y vermicomposta sobre la colonización y riqueza de hongos micorrízicos arbusculares (HMA) en el cultivo de C. pepo L. Table 3: Interaction of the growing cycle, plastic padding and vermicompost on the colonization and richness of arbuscular mycorrhizal fungi (AMF) in the cultivation of C. pepo L.
Table 3: Interaction of the growing cycle, plastic padding and vermicompost on the colonization and richness of arbuscular mycorrhizal fungi (AMF) in the cultivation of C. pepo L.
Factor vermicomposta |
Ciclos de cultivo |
EE |
P |
||||||||
Invierno-Primavera |
Verano-Otoño |
||||||||||
Variante de acolchado plástico | |||||||||||
% Colonización |
|||||||||||
|
45.33± 0.50h |
35.67± 0.85i |
25.63± 0.90kl |
25.67± 0.74l |
80.83± 1.82b |
56.57± 0.40f |
37.41± 2.83i |
28.83± 1.99k |
3.54 |
0.001 |
||
|
59.20± 0.75e |
43.10± 0.51h |
32.33± 0.39j |
27.93± 0.39kl |
96.07± 0.90a |
66.23± 1.17d |
77.70± 0.16c |
46.37± 0.87g |
||||
Riqueza de HMA |
|||||||||||
|
21±0.0a (5.10) |
21±0.0a (5.10) |
18.33±0.58b (4.83) |
10±0.0g (3.87) |
12±0.0e (4.12) |
9±0.0h (3.74) |
10±0.0g (3.87) |
7±0.0i (3.46) |
0.008 |
0.001 |
||
|
21±0.0a (5.10) |
21±0.0a (5.10) |
16±0.0c (4.58) |
15±0.0d (4.47) |
11±0.0f (4) |
11±0.0f (4) |
10±0.0g (3.87) |
10±0.0g (3.87) |
||||
C = control; V = vermicomposta; APB = acolchado plástico blanco; APR = acolchado plástico rojo; APN = acolchado plástico negro. Valores entre paréntesis corresponden a promedios transformadas según Sqrt = x+5. Superíndices con al menos una letra en común no se diferencian entre sí según Tukey (P ≤ 0.05).
C = control; V = vermicompost; APB = white plastic padding; APR = red white plastic padding; APN = black plastic padding. Values in parentheses correspond to transformed averages according to Sqrt = x+5. Superscripts with at least one letter in common do not differ from each other according to Tukey (P ≤ 0.05).
El uso de acolchado plástico influye sobre las poblaciones microbianas debido principalmente a su efecto sobre la humedad y temperatura del suelo (Liu et al., 2012; Dong et al., 2017; Zhu et al., 2018). La cubierta plástica de color blanco refleja el 62% del espectro total de radiación visible en radiación fotosintéticamente activa comparada con los acolchados de color obscuro. Por lo anterior, los acolchados blancos contribuyen a la disminución del calentamiento del suelo e influyen positivamente sobre la colonización de las poblaciones microbianas en las plantas (Robledo-Torres et al., 2010; Ferdous et al., 2017) variable que en este trabajo confirma lo denotado puesto que las temperaturas promedio registradas en el APB fueron entre 20-21 °C en I-P y entre 23-25 °C en V-O.
Por otra parte, la aplicación de vermicomposta al parecer incrementó la colonización de los HMA en C. pepo debido al aporte de sustancias húmicas que sirven como fuente de nutrimentos para el crecimiento de los microorganismos en la rizosfera del hospedero (Pathma y Sakthivel, 2012; Meyer et al., 2015).
En relación a la riqueza de HMA, el ANOVA apuntó diferencias significativas (Tukey, P ≤ 0.05) por efecto de los factores evaluados (Cuadro 3). Así, la mayor riqueza se presentó en los tratamientos del ciclo I-P que contenían vermicomposta y la menor, por efecto del acolchado plástico, en APN.
El acolchado es un factor importante en la riqueza y abundancia de las comunidades microbianas debido a su efecto en la temperatura del suelo, la cual cambia de acuerdo al tipo de plástico y clima que prevalezca durante el ciclo del cultivo, influyendo sobre la respiración, metabolismo y capacidad de multiplicación de los microorganismos en el hospedero (Wetzel et al., 2014; Zhang et al., 2019).
Además de lo anterior, el color del plástico influye sobre las propiedades físico-químicas del suelo debido a la transmitancia de calor, emisividad proporcional y balance térmico que modifica las interacciones entre microorganismos-hospedero (Dong et al., 2017; Bi et al., 2018; Harris-Valle et al., 2018). Así, los plásticos transparentes o de color claro pueden mantener una temperatura alta del suelo (Adhikari et al., 2016) incrementando la tasa metabólica radical de los cultivos y con ello una alta producción de exudados radiculares, los cuales pueden jugar un papel importante en la abundancia y riqueza de los HMA (Jamiołkowska et al., 2019; Jie et al., 2019).
Abundancia de hongos micorrízicos arbusculares por morfoespecie
En el periodo de cultivo I-P se observaron diferencias en el número de especies de HMA asociadas a C. pepo. En dicho ciclo, el endófito con mayor presencia en las plantas con APN fue Acaulospora morrowiae (37%), seguida por A. scrobiculata (26%) y A. rehmii (22%) en el tratamiento de las plantas con APR+V, y Rhizophagus sinuosus (18.8%) en plantas con V. En esta época de siembra no se observaron estructuras de resistencia y propagación de Claroideoglomus etunicatum, C. claroideum, Gl. hoi, Rhi. aggregatus y Septoglomus constrictum en el tratamiento de las plantas con APN (Cuadro 4). Mientras tanto, en el ciclo V-O A. morrowiae fue el hongo MA con mayor presencia (50%) en las plantas con APN, seguida por A. scrobiculata (29%) en las plantas con APR+V y Gl. microaggregatum (24%) en plantas con APR. Por último, las plantas del tratamiento control (C) presentaron mayor abundancia de A. morrowiae y A. scrobiculata en ambos ciclos de cultivo (Cuadro 5).
Cuadro 4: Géneros y especies de hongos micorrízicos arbusculares (HMA) identificados en el suelo rizosférico de Cucurbita pepo L. cultivada en invierno-primavera.
Table 4: Genera and species of arbuscular mycorrhizal fungi (AMF) identified in the rhizospheric soil of Cucurbita pepo L. cultivated in winter-spring.
Morfoespecie |
Abundancia de esporas (%/número de esporas) |
|||||||
Acaulosporaceae (Acaulospora) |
||||||||
A. cavernata |
7.4 (369) |
1.6 (59) |
12 (369) |
1.8 (68) |
6.9 (162) |
2.4 (68) |
2.6 (32) |
2.2 (68) |
A. mellea |
11.3 (564) |
1.7 (62) |
5.4 (166) |
0.4 (16) |
11 (266) |
0.5 (16) |
- - - - - |
0.5 (17) |
A. morrowiae |
14.1 (697) |
1.7 (64) |
9.6 (295) |
11 (363) |
12 (295) |
9.6 (266) |
37 (454) |
20 (618) |
A. rehmii |
7.4 (368) |
1.6 (61) |
11 (367) |
16 (607) |
13 (305) |
22 (607) |
19 (364) |
20 (607) |
A. rugosa |
5.9 (296) |
1.7 (62) |
9.6 (296) |
10 (374) |
12.6 (296) |
13 (374) |
13 (170) |
12 (374) |
A. scrobiculata |
13.7 (680) |
1.6 (60) |
22 (680) |
17 (625) |
15.7 (367) |
26 (731) |
5.4 (67) |
21 (627) |
A. aff. foveata |
0.7 (37) |
0.8 (31) |
1.2 (38) |
0.7 (26) |
1.5(37) |
0.8 (23) |
0.6 (8) |
0.8 (25) |
Claroideoglomeraceae. (Claroideoglomus) |
||||||||
C. etunicatum |
0.06 (305) |
0.99 (36) |
1.6 (50) |
0.9 (35) |
2.1 (50) |
- - - - - |
- - - - - |
- - - - - |
C. claroideum |
3.1 (155) |
0.8 (32) |
0.4 (15) |
1.8 (68) |
7 (164) |
- - - - - |
- - - - - |
- - - - - |
Entrophosporaceae (Entrophospora) |
||||||||
E. infrequens |
0.3 (16) |
0.3 (14) |
0.5 (16) |
0.1 (5) |
- - - - - |
1.3 (36) |
- - - - - |
- - - - - |
Gigasporaceae (Gigaspora) |
||||||||
Gi. decipiens |
1.2 (62) |
0.4 (17) |
0.4 (15) |
0.3 (14) |
- - - - - |
0.5 (16) |
- - - - - |
0.5 (15) |
Gi. rosea |
1.2 (62) |
0.4 (17) |
1 (31) |
0.3 (13) |
0.3 (8) |
0.5 (14) |
- - - - - |
0.5 (15) |
Racocetraceae (Racocetra) |
||||||||
R. fulgida |
3.1 (154) |
0.4 (17) |
5.5 (170) |
0.4 (17) |
1.5 (37) |
0.7 (20) |
- - - - - |
0.5 (16) |
Glomeraceae. (Funneliformis) |
||||||||
F. mosseae |
0.9 (45) |
1.7 (63) |
1.46 (45) |
0.6 (23) |
1.9 (45) |
0.8 (24) |
1.3 (16) |
0.8 (24) |
Glomeraceae (Glomus) |
||||||||
Gl. clavisporum |
0.9 (46) |
10 (373) |
1.4 (44) |
4.8 (176) |
1.9 (45) |
6.3 (175) |
2.7 (34) |
5.9 (175) |
Gl. coremioides |
0.9 (46) |
18 (678) |
1.3 (41) |
5.5 (201) |
1.9 (45) |
7.3 (201) |
2.8 (35) |
6.8 (202) |
Gl. hoi |
1.2 (61) |
0.4 (16) |
0.4 (13) |
1.8 (66) |
1.7 (41) |
- - - - - |
- - - - - |
- - - - - |
Gl. microaggregatum |
12 (600) |
18.5 (675) |
8.6 (265) |
18.5 (673) |
2.4 (57) |
0.32 (9) |
- - - - - |
0.3 (9) |
Glomeraceae (Rhizophagus) |
||||||||
Rhi. aggregatus |
3.3 (164) |
0.4 (15) |
1.3 (41) |
1.8 (67) |
1.8 (44) |
- - - - - |
- - - - - |
- - - - - |
Rhi. sinuosus |
0.9 (45) |
18.8 (683) |
1.36 (42) |
4.5 (165) |
1.4 (35) |
5.9(164) |
2.5 (31) |
5.5 (165) |
Glomeraceae (Septoglomus) |
||||||||
Sep. constrictum |
3.7 (188) |
16 (595) |
2.1 (66) |
0.7 (28) |
1.6 (38) |
- - - - - |
- - - - - |
- - - - - |
C = control sin vermicomposta y acolchado plástico; V = vermicomposta; APB = acolchado plástico blanco; APB+V = acolchado plástico blanco + vermicomposta; APR = acolchado plástico rojo; APR+V = acolchado plástico rojo + vermicomposta; APN = acolchado plástico negro; APN+V = acolchado plástico negro + vermicomposta.
C = control without vermicompost and plastic padding; V = vermicompost; APB = white plastic padding; APB+V = white plastic padding + vermicompost; APR = red white plastic padding; APR+V = red white plastic padding + vermicompost; APN = black plastic padding; APN+V = black plastic padding + vermicompost.
Cuadro 5: Géneros y especies de HMA identificados en el suelo rizosférico de Cucurbita pepo L. cultivada en verano-otoño.
Table 5: Genera and species of AMF identified in the rhizospheric soil of Cucurbita pepo L. cultivated in summer-fall.
Morfoespecie |
Abundancia de esporas (%/número de esporas) |
|||||||
Acaulosporaceae (Acaulospora) |
||||||||
A. cavernata |
9 (303) |
1.9 (59) |
13 (368) |
2.3 (68) |
10 (162) |
2.7 (68) |
5.2 (32) |
2.4 (68) |
A. mellea |
10 (367) |
2 (62) |
9.6 (264) |
0.5 (16) |
16 (266) |
0.6 (16) |
2.2 (14) |
0.6 (18) |
A. morrowiae |
17 (604) |
2.1 (64) |
10 (295) |
12 (362) |
18 (295) |
10 (266) |
50 (305) |
22 (618) |
A. rugosa |
8.7 (295) |
- - - - - |
10 (295) |
12 (374) |
18 (296) |
15 (374) |
22 (140) |
22 (607) |
A. scrobiculata |
20 (704) |
2.8 (85) |
24 (669) |
21 (623) |
- - - - - |
29 (728) |
11 (67) |
22.8 (627) |
Claroideoglomeraceae (Claroideoglomus) |
||||||||
C. etunicatum |
7.9 (266) |
4.4 (134) |
13 (358) |
1.6 (49) |
3.1 (50) |
- - - - - |
- - - - - |
- - - - - |
Gigasporaceae (Gigaspora) |
||||||||
Gi. decipiens |
0.4 (15) |
0.5 (17) |
- - - - - |
- - - - - |
- - - - - |
0.6 (16) |
- - - - - |
0.4 (13) |
Glomeraceae (Glomus) |
||||||||
Gl. clavisporum |
1.3 (47) |
8.9 (267) |
- - - - - |
10 (295) |
2.3 (37) |
7 (174) |
2.6 (16) |
4.8 (132) |
Gl. coremioides |
1.4 (49) |
8.2 (247) |
3.1 (87) |
6.8 (200) |
2.8 (45) |
7.9 (197) |
5.7 (35) |
7.3 (201) |
Gl. microaggregatum |
17 (600) |
7.5 (225) |
13 (355) |
23 (673) |
24 (391) |
18 (464) |
- - - - - |
10.7 (295) |
Glomeraceae (Rhizophagus) |
||||||||
Rhi. sinuosus |
1.4 (49) |
9.8 (295) |
1.2 (33) |
7.3 (214) |
1 (17) |
6.7 (166) |
- - - - - |
6 (165) |
Glomeraceae (Septoglomus) |
||||||||
Sep. constrictum |
1.9 (66) |
19 (595) |
- - - - - |
0.9 (27) |
2.5 (41) |
- - - - - |
- - - - - |
- - - - - |
C = control sin vermicomposta y acolchado plástico; V = vermicomposta; APB = acolchado plástico blanco; APB+V = acolchado plástico blanco + vermicomposta; APR = acolchado plástico rojo; APR+V = acolchado plástico rojo + vermicomposta; APN = acolchado plástico negro; APN+V = acolchado plástico negro + vermicomposta.
C = control without vermicompost and plastic padding; V = vermicompost; APB = white plastic padding; APB+V = white plastic padding + vermicompost; APR = red white plastic padding; APR+V = red white plastic padding + vermicompost; APN = black plastic padding; APN+V = black plastic padding + vermicompost.
Sin bien los géneros Acaulospora y Glomus fueron los de mayor frecuencia en los diversos tratamientos, debido a que son géneros prominentes por ser reconocidos como ubicuos (Chandra y Kehri, 2006) y estar formado por hongos MA considerados cosmopolitas (Lekberg et al., 2008; Cesaro et al., 2008).
A. morrowiae fue una de las especies más abundantes en ambos ciclos de cultivo, lo cual se puede atribuir a que se trata de un hongo MA de los más ampliamente distribuidos en diversos parajes y ecosistemas naturales de México (Montaño et al., 2012; Alarcón et al., 2012) tales como bosque nuboso montano tropical (Lara-Pérez et al., 2014) y selvas tropicales húmedas (Álvarez-Sánchez et al., 2017), o bien en sistemas agroproductivos donde se cultiva agave (Trinidad-Cruz et al., 2017), chile poblano (Carballar-Hernández et al., 2017), maíz (Pérez-Luna et al., 2012) o café (Bertolini et al., 2018), entre otros.
Por otra parte, el acolchado plástico color negro pudiera tener efectos negativos sobre la esporulación de C. etunicatum y Sep. constrictum, ya que ambas morfoespecies no estuvieron presentes en los dos ciclos de cultivo. En dicho sentido, Zribi et al. (2011) mencionan que el polietileno negro es un material que absorbe la mayor parte de la radiación y, de este modo y en cierta medida, impide el calentamiento del suelo. Sin embargo, el efecto más comúnmente informado es el aumento de la temperatura promedio (ca. 1.7 a 2.8 ºC) en relación con la temperatura del suelo desnudo (Snyder et al., 2015).
Índice de diversidad de Shannon-Weaver
Para el índice de diversidad de Shannon-Weaver el análisis estadístico marcó diferencias significativas solo para los factores acolchado plástico y vermicomposta (Tukey, P ≤ 0.05) (Figura 1), pero no para el ciclo de cultivo.
Figura 1: Índice de Shannon-Weaver en raíces de Cucurbita pepo L. por efecto del acolchado plástico y la vermicomposta. C = control sin vermicomposta y acolchado plástico; APB = acolchado plástico blanco; APR = acolchado plástico rojo; APN = acolchado plástico negro. Letras iguales en la misma columna representan igualdad estadística (Tukey, P ≤ 0.05).
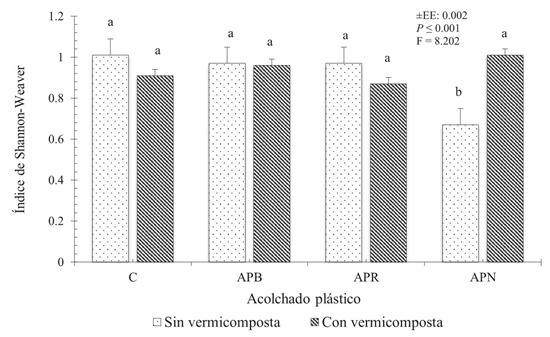
Figure 1: Shannon-Weaver index in roots of Cucurbita pepo L. by effect of plastic padding and vermicompost. C = control without vermicompost and plastic padding; APB = white plastic padding; APR = red white plastic padding; APN = black plastic padding. Equal letters in the same column represent statistical equality (Tukey, P ≤ 0.05).
El menor índice de diversidad fue observado en las plantas con APN y los mayores índices de diversidad se presentaron en los tratamientos donde se incorporó la vermicomposta (Figura 1).
El tipo de acolchado plástico influyó sobre la diversidad de los HMA en el suelo debido a las condiciones edáficas y climáticas que prevalecieron durante el experimento, las cuales afectan la tasa del crecimiento y la capacidad de adaptación de los microorganismos a diversas condiciones del suelo (Dong et al., 2017).
Al respecto Chifflot et al. (2009), comentaron que las pérdidas en diversidad microbiana del suelo pueden deberse a las diferentes prácticas agronómicas que se realizan durante el ciclo de los cultivos, incluyendo el acolchado plástico, los cuales modifican aspectos químicos o físicos del suelo o sustrato (Xiukang et al., 2015; 2015; Dong et al., 2017).
No obstante, para una producción agrícola sostenible, las comunidades microbianas son vitales como indicadoras de calidad y salud del suelo (Maji et al., 2017).
Conclusiones
La colonización micorrízica de las plantas de calabaza italiana estuvo condicionada por el factor ciclo de cultivo, vermicomposta y acolchado plástico. El uso del acolchado plástico afecta la simbiosis endófito-hospedero, específicamente el polímero de color negro interfirió sobre la micorrización, riqueza, abundancia e índice de diversidad de los hongos micorrízicos arbusculares (HMA). Finalmente, es importante identificar y conocer la diversidad de los HMA para seleccionar aquellas morfoespecies cuyo potencial de uso puede ser significativo para el desarrollo de biofertilizantes elegibles para contribuir a la sostenibilidad agroproductiva en sistemas específicos de producción.
Disponibilidad de Datos
Los conjuntos de datos utilizados o analizados durante el presente estudio están disponibles del autor correspondiente a solicitud razonable.
Fondos
Apoyo económico otorgado por parte de la Facultad de Ciencias Agrícolas de la Universidad Veracruzana, Campus Xalapa, así como también la erogación hecha por parte de los autores adscritos a dicha institución encargada de la enseñanza e investigación sobre cuestiones agronómicas sostenibles.
Contribución de los Autores
L.L.C. encargada del montaje del experimento, muestreos y trabajo de campo y laboratorio. R.Z.R. participó en la toma de datos, en la identificación de especies de hongos micorrízicos-arbusculares y en la preparación final del manuscrito. J.J.R.P. y B.M.A. contribuyeron en la revisión y aporte de sugerencias que sin duda mejoraron el contenido del manuscrito. J.L.L.R. es quien se encargó de realizar el análisis estadístico e interpretación de los resultados generados. L.G.H.M. contribuyó en la formulación del proyecto de investigación, así como en la estructura y redacción conclusiva del artículo.











 text new page (beta)
text new page (beta)



