Introducción
Las interacciones biológicas y los sinergismos entre los componentes de la biodiversidad, son principios ecológicos básicos que pueden manejarse para posibilitar y potenciar el desarrollo de procesos y servicios claves en el agroecosistema (Álvarez et al., 2014; Sarandón y Flores, 2014; Rosset y Torres, 2016), enfocados al control biológico de organismos plaga. Al respecto, el hongo parásito facultativo de huevos de nematodos Pochonia chlamydosporia var. catenulata posee una fase de vida saprofítica, durante la cual sobrevive a partir de los nutrientes existentes en la materia orgánica del suelo o sustrato, mientras que, durante su fase parasítica depende de su hospedante común, que generalmente son nematodos fitoparásitos (Kerry y Hirsch, 2011).
P. chlamydosporia var. catenulata posee la capacidad de adaptarse a diferentes condiciones edáficas y se supone que la actividad microbiana nativa del suelo influye sobre su crecimiento y desarrollo (Monfort et al., 2006). Por otra parte, se considera que las características químicas presentes en los suelos y sustratos, a pesar de que han sido poco estudiadas, pueden influir en la adaptación ecológica del hongo (Kerry y Hirsch, 2011).
Por otro lado, la capacidad de P. chlamydosporia var. catenulata para colonizar los suelos, los sustratos y la rizosfera vegetal, así como su actividad parasítica, es esencial en la selección de aislamientos para el manejo de nematodos fitoparásitos (Viggiano et al., 2014; Bontempo et al., 2014; Ceiro e Hidalgo, 2017). Se sabe que esa especie fúngica produce clamidosporas, las cuales se consideran estructuras de resistencia frente a condiciones ecológicas adversas en su medio natural, por ello, constituyen la principal fuente de inóculo de los productos basados en esa especie fúngica (Ceiro et al., 2014).
Actualmente, la selección de cepas fúngicas efectivas para la obtención de productos biológicos seguros para el manejo de nematodos formadores de agallas y otras dianas, en cultivos de importancia económica, es un gran desafío para la ciencia contemporánea (Ravensberg, 2011). Por esa razón, en Cuba se obtuvo un bioproducto robusto, consistente y seguro denominado KlamiC® a partir de la cepa IMI SD 187 de P. chlamydosporia var. catenulata, el cual se usa en el manejo efectivo de Meloidogyne spp., en cultivos hortícolas (Montes de Oca et al., 2009).
No obstante, en los suelos Ferralíticos, Fluvisoles y Pardos dedicados en Cuba a Sistemas de Producción Protegidos de Hortalizas (SPPH), se registran afectaciones por poblaciones nativas de Meloidogyne y se desconoce si este hongo nematófago logra establecerse en dichos suelos. Por ello, se propuso como objetivo de la presente investigación, evaluar el establecimiento in vitro de P. chlamydosporia var. catenulata en suelos Ferralítico, Fluvisol y Pardo.
Materiales y Métodos
Para evaluar el establecimiento del hongo en los suelos se utilizó la técnica suelo membrana según Grose et al. (1984) y Monfort et al. (2006) que permite evaluar la receptividad de suelos al hongo nematófago P. chlamydosporia. Se utilizaron tres tipos de suelo recomendados para el establecimiento de SPPH en Cuba (Casanova, 2007) (Cuadro 1).
Table 1: Main characteristics of the soils analyzed.
| Suelos | Procedencia | Ca | Mg | P | N | MO | pH | CE |
| - - cmol kg-1 - - | mg kg-1 | - - - - % - - - - | dS m-1 | |||||
| Ferralítico† (Ferralsol) | Habana | 37.0 | 27.5 | 910.0 | 3.53 | 6.10 | 8.20 | 0.63 |
| Fluvisol† (Fluvisol) | Granma | 23.8 | 15.3 | 671.6 | 2.16 | 3.79 | 7.73 | 0.85 |
| Pardo† (Cambisol) | Granma | 15.0 | 37.5 | 319.0 | 7.20 | 4.59 | 4.17 | 0.89 |
(†) Clasificación Genética de los Suelos de Cuba. ( ) World Reference Base.
(†) Genetic Classification of the Soils of Cuba. ( ) World Reference Base.
Cada suelo se tamizó a un tamaño de partícula de un milímetro y se tomaron porciones para esterilizarlas durante 45 min en autoclave, permaneciendo el resto en su forma natural. Se adicionaron 20 g de cada suelo (esterilizado y sin esterilizar) en placas Petri y luego se añadió cuidadosamente agua destilada estéril hasta lograr humedecimiento total. Seguidamente se colocó una membrana de acetato de celulosa (tamaño de poro 0.2 µ) y sobre la misma se ubicó un disco de 5 mm de la cepa IMI SD 187 de P. chlamydosporia var. catenulata, procedente de la periferia de una colonia joven desarrollada en medio agar-papa-dextrosa (APD, BioCen).
Por último, las placas se sellaron con parafilm y se incubaron durante 21 días a 25 ºC en la oscuridad. Transcurrido ese tiempo las membranas se retiraron, se enjuagaron con agua destilada estéril para eliminar restos de suelo, se trasladaron a placas Petri y finalmente se tiñeron con cotton blue durante 12 h a temperatura ambiente.
Microorganismos nativos totales de cada suelo
Conteo de hongos totales (UFC g-1): un gramo de suelo se diluyó en nueve mL de agar-agua (AA) {0.5 g de agar bacteriológico (BioCen) por litro de H2O destilada}, seguidamente se realizaron diluciones seriadas hasta 10-3, y de esta última se añadieron 0.2 mL sobre dos placas con agar maltosa sabouraud (BioCen) y fueron incubadas en oscuridad a 25 °C durante 72 h y pasado ese tiempo se cuantificaron las unidades formadoras de colonias.
Conteo de bacterias totales (UFC g-1): un gramo de suelo se diluyó en nueve mL de AA; seguidamente se realizaron diluciones seriadas hasta 10-4, y de esta última se añadieron 0.2 mL sobre dos placas con agar-triptona-soya (BioCen). Enseguida, las placas se incubaron en oscuridad a 25 °C durante 24 h y al cabo de ese tiempo se cuantificaron las unidades formadoras de colonias.
El crecimiento micelial de P. chlamydosporia var. catenulata sobre la membrana se determinó con una regla graduada. A partir de estos resultados se determinó el crecimiento relativo mediante la Ecuación 1:
donde:
CR = crecimiento relativo;
CNE = crecimiento en suelo no estéril
CE = crecimiento en suelo estéril.
Presencia de clamidosporas: las membranas fueron observadas en un microscopio óptico Zeiss-Axiolab® a 200 aumentos para confirmar la presencia de esporas.
Diseño experimental
Se conformaron seis tratamientos, mediante la combinación de los tipos de suelo y niveles de esterilización, bajo un diseño completamente aleatorizado con arreglo factorial (factor I: suelos; factor II: niveles de esterilización) y seis réplicas por cada tratamiento.
Análisis estadístico
Los datos obtenidos del análisis de poblaciones microbianas (bacterias y hongos) y el crecimiento micelial del hongo nematófago, se analizaron mediante ANOVA factorial y la prueba de comparación múltiple de medias de Duncan (P ≤ 0.05). El crecimiento relativo del hongo nematófago se procesó mediante ANOVA unifactorial y la prueba de Duncan (P ≤ 0.05). Se aplicó un análisis de regresión lineal para determinar la relación existente entre las poblaciones nativas de microorganismos presentes en los suelos, sobre el crecimiento de P. chlamydosporia var. catenulata. El procesamiento estadístico se realizó con el paquete estadístico InfoStat v. 8 (Di Rienzo, 2008).
Resultados y Discusión
Se encontraron diferencias significativas entre los agrupamientos de suelos en las variables poblaciones fúngicas, bacterianas y en el crecimiento micelial de P. chlamydosporia var. catenulata. En el suelo Pardo se registraron las mayores poblaciones nativas de bacterias 7.3 × 106 UFC) y hongos (1.2 × 105 UFC), respectivamente, seguido del Ferralítico (5.0 × 106; 0.5 × 105 UFC) y por último el Fluvisol (4.8 × 106; 0.3 × 105 UFC). Por otra parte, el crecimiento micelial de P. chlamydosporia var. catenulata en suelo estéril y sin esterilizar reveló los mayores valores en los suelos Fluvisol (23.67; 60.00 mm) y Ferralítico (22.67; 60.00 mm) en comparación con el Pardo (11.00; 49.00 mm) (Cuadro 2). El hongo nematófago produjo clamidosporas en todas las condiciones edáficas evaluadas (Figura 1).
Cuadro 2: Poblaciones microbianas nativas, crecimiento micelial y presencia de clamidosporas de P. chlamydosporia var. catenulata en tres tipos de suelos.
Table 2: Native microbial populations, mycelial growth and presence of chlamydospores of P. chlamydosporia var. catenulata in three types of soils.
| Suelos | Estéril | Conteo bacterias | Conteo hongos | DC (mm)±DE | C | ||||
| UFC | †UFC±DE | UFC | †UFC±DE | ||||||
| Fluvisol | No | 4.8×106 | 6.68±0.10 b | 0.3×105 | 4.57±0.11 c | 23.67±1.21 c | Si | ||
| Ferralítico | No | 5.0×106 | 6.70±0.05 b | 0.5×105 | 4.72±0.12 b | 22.67±1.37 c | Si | ||
| Pardo | No | 7.3×106 | 6.85±0.09 a | 1.2×105 | 5.08±0.03 a | 11.00±1.26 d | Si | ||
| Fluvisol | Si | - | - | - | - | 60.00±0.00 a | Si | ||
| Ferralítico | Si | - | - | - | - | 60.00±0.00 a | Si | ||
| Pardo | Si | - | - | - | - | 49.00±2.37 b | Si | ||
† Transformación LOG10x+1. DC = diámetro de la colonia; DE = desviación estándar; C = presencia de clamidosporas. Letras distintas en las columnas evidencian diferencias significativas (P ≤ 0.05), según la prueba de Duncan.
† LOG10x+1 transformation. DC = colony diameter; DE = standard deviation; C = presence of chlamydospores. Different letters in the columns show significant differences (P ≤ 0.05), according to Duncan’s test.

Las mayores poblaciones microbianas nativas registradas en el suelo Pardo, coincidieron con el menor desarrollo del hongo nematófago. Esto puede ser atribuible a una mayor competencia e interacciones entre los microorganismos de ese suelo con P. chlamydosporia var. catenulata. No obstante, en el suelo Pardo, una vez suprimida la actividad microbiana se constató menor desarrollo del hongo nematófago, lo cual sugiere que además de la actividad biótica, existen otras propiedades del suelo, que incidieron en el crecimiento de P. chlamydosporia var. catenulata. Probablemente, el pH ácido (4.7) del suelo Pardo influyó en el menor crecimiento de la especie fúngica. En ese sentido, Gao et al. (2009) informaron que en medio de cultivo ajustado a un pH ácido (4.0), el crecimiento micelial de la cepa HSY-12-14 de P. chlamydosporia var. chlamydosporia se redujo un 39%. Sin embargo, en otro estudio Hasanzadeh et al. (2012), sustentaron que este mismo hongo produce la mayor cantidad de micelio in vitro en un rango de pH entre 5-7.
Los resultados obtenidos sugieren que, para garantizar una mayor población del hongo y efectividad sobre su diana, deben tomarse medidas de manejo en el agroecosistema, como la corrección de la acidez del suelo, previo a la utilización de la cepa IMI SD 187 de P. chlamydosporia var. catenulata para el manejo de nematodos fitoparásitos. La presencia de clamidosporas constatada en los suelos evaluados pone de manifiesto que el hongo se multiplica bajo las condiciones edáficas evaluadas y produce estructuras de resistencia. Esto ratifica a las clamidosporas como la principal fuente de inóculo de esta especie fúngica (Ceiro et al., 2014; Escudero et al., 2017; Silva et al., 2017).
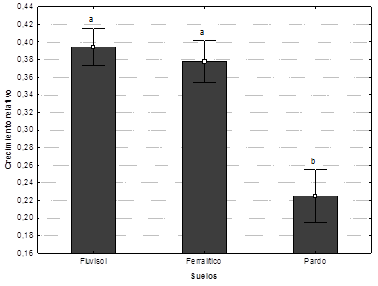
De acuerdo con los resultados de la prueba de Duncan, el crecimiento relativo de P. chlamydosporia var. catenulata reveló diferencias significativas (P ≤ 0.05) entre los agrupamientos de suelos. La especie fúngica alcanzó el mayor crecimiento en los suelos Fluvisol (0.39) y Ferralítico (0.37) en comparación con el Pardo (0.25). El resultado pone de manifiesto que los suelos Fluvisol y Ferralítico objeto de estudio, fueron más receptivos al establecimiento de P. chlamydosporia var. catenulata que el Pardo (Figura 2).
Por otra parte, la relación obtenida entre las poblaciones de microorganismos nativos de los suelos evaluados, respecto al crecimiento del hongo nematófago, reveló que al aumentar las poblaciones microbianas decreció el desarrollo de P. chlamydosporia var. catenulata. Los mayores valores de pendiente y coeficiente de determinación fueron determinados mayormente por efecto de las especies fúngicas (-14.26 y 0.86) en comparación con las especies bacterianas (-2.11 y 0.37) (Figura 3 A, B).

Este resultado confirma que las poblaciones fúngicas incidieron más que las bacterianas en la reducción del crecimiento de P. chlamydosporia var. catenulata bajo las condiciones experimentales evaluadas. Esto puede ser consecuencia de que existe una estrecha relación filogenética entre los hongos del suelo y P. chlamydosporia var. catenulata, los cuales comparten características comunes de hábitat, formas de alimentación y hospedantes (Stirling, 2011). Nuestros resultados se relacionan con las suposiciones sustentadas por Monfort et al. (2006), en el sentido de que el éxito del establecimiento de P. chlamydosporia en los suelos, dependió aparentemente de las poblaciones microbianas nativas.
Las evidencias encontradas en el presente estudio demuestran la persistencia y multiplicación de la cepa IMI SD 187 de P. chlamydosporia var. catenulata en diferentes condiciones edáficas. Igualmente, señalan la importancia de realizar estudios previos de establecimiento de este hongo al suelo, para minimizar riesgos edáficos que pudieran afectar la actividad biológica del mismo frente a su diana común (Meloidogyne spp.). Finalmente, la persistencia de P. chlamydosporia var. catenulata bajo las condiciones edáficas analizadas, tiene una estrecha relación con la activa actividad saprófita de este hongo en suelos y sustratos (Manzanilla et al., 2013).
Conclusiones
Los resultados obtenidos señalan que dos elementos esenciales, uno biótico relativo a la actividad microbiana de los suelos y el otro abiótico, referido al pH de estos, pueden influir significativamente en el establecimiento del hongo nematófago y sugieren que el uso de la cepa IMI SD 187 de P. chlamydosporia var. catenulata para el manejo biológico de Meloidogyne spp., en suelos Fluvisol, Ferralítico y Pardo, es eficiente siempre que no presenten un pH ácido.
Disponibilidad de Datos
Los conjuntos de datos utilizados o analizados durante el estudio actual están disponibles del autor correspondiente, a solicitud razonable.
Fondos
El estudio fue co-financiado por la Universidad de Granma y la Dirección de Sanidad Vegetal del Centro Nacional de Sanidad Agropecuaria (Cuba), y por el Fondo Sectorial de Investigación para la Educación (México), proyecto Proinnova CONACYT/PEASA 241777, bajo la responsabilidad de JMMS.
Contribución de los Autores
Conceptualización: W.G.C.C., M.H.V., L.H.D., J.A.O. y J.M.M.S. Metodología: W.G.C.C., M.H.V., L.H.D., J.A.O. y M.G.B. Software: W.G.C.C., M.H.V., L.H.D. y J.A.O. Validación: W.G.C.C., M.H.V., L.H.D. y J.A.O. Análisis formal: W.G.C.C., M.H.V., L.H.D., J.A.O. y M.G.B. Investigación: W.G.C.C., M.H.V., L.H.D. y J.A.O. Recursos: W.G.C.C. y J.M.M.S. Curación de datos: W.G.C.C., M.H.V., L.H.D. y J.A.O. Escritura, preparación del borrador original: W.G.C.C. Escritura, revisión y edición: W.G.C.C., M.G.B. y J.M.M.S. Visualización: W.G.C.C., M.H.V., L.H.D., J.A.O. y M.G.B. Supervisión: W.G.C.C., M.G.B. y J.M.M.S. Administración del proyecto: W.G.C.C. y J.M.M.S. Adquisición de fondos: W.G.C.C. y J.M.M.S.











 nueva página del texto (beta)
nueva página del texto (beta)



