Introducción
México ocupa el cuarto lugar a nivel mundial, en producción de rosa, gerbera y clavel bajo condiciones de invernadero (Orozco-Hernández, 2007). Para sostener la alta producción florícola, se aplican agroquímicos (fertilizantes y plaguicidas) al suelo; sin embargo, sus propiedades fisicoquímicas, así como las poblaciones microbianas benéficas involucradas en procesos bioquímicos del reciclado de carbono, nitrógeno y fósforo disminuyen gradualmente en cada ciclo de producción (Cruz et al., 2015; Cruz-Ruiz et al., 2015).
Los microorganismos del suelo que habitan la rizósfera de plantas, promueven el crecimiento vegetal mediante interacciones simbióticas (Polti et al., 2014), estas interacciones son impactadas negativamente por la aplicación de plaguicidas y fertilizantes. De las poblaciones microbianas benéficas que habitan el suelo y que contribuyen a su fertilidad, destacan los actinomicetos, grupo de bacterias Gram positivas con alto contenido de guanina y citosina en su ADN, constituyen una fracción significativa con una densidad poblacional de alrededor de 1 × 108 unidades formadoras de colonias (UFC) g-1 (Kalia y Gosal, 2011; Briceño et al., 2012). Los actinomicetos son considerados indicadores biológicos de la calidad del suelo, debido a que son capaces de sobrevivir en presencia de contaminantes como plaguicidas, hidrocarburos y metales pesados. Por ello, es recomendable monitorear su densidad poblacional, a fin de evaluar la calidad microbiológica del suelo (Quintero-Lizaola, 2014; Sheng et al., 2015; López-González et al., 2015).
Los efectos negativos causados a la microbiota edáfica, por la aplicación de fertilizantes y plaguicidas en el cultivo de flores, pueden ser mitigados mediante la aplicación de enmiendas orgánicas como la vermicomposta (producto orgánico estabilizado por la actividad de la lombriz Eisenia foetida) (Semple et al., 2001; Vaca-Paulín et al., 2006). Este producto, es un agente acondicionador y mejorador de la textura y materia orgánica del suelo (Camacho et al., 2014), contiene ácidos húmicos y fúlvicos que favorecen el crecimiento en las plantas, otorgando resistencia y resiliencia al ecosistema edáfico, permitiendo que sea sustentable (Arias-Estévez et al., 2008; Bustamante et al., 2010; Del Águila-Juárez et al., 2011).
El objetivo del presente estudio fue comparar la densidad poblacional de actinomicetos en suelos florícolas de cultivos de rosa y clavel y con la aplicación de vermicomposta para restaurar la calidad del suelo y de su microbiota edáfica.
Materiales y Métodos
Se colectaron muestras superficiales de suelo a una profundidad de 0 a 15 cm, en invernaderos del municipio de Tenancingo, Estado de México, donde se cultiva rosa, clavel y agapando. Se colectó 1 kg de suelo y se guardaron en bolsas de plástico, esta cantidad se utilizó para los análisis físicos y químicos del suelo y para los análisis microbiológicos se colectaron 50 g en cajas Petri estériles para almacenarse a 4 °C.
La vermicomposta fue proporcionada por el Dr. Cesar Vences Contreras de la Facultad de Agronomía de la Universidad Autónoma del Estado de México (UAEMex), que fue realizada con paja y estiércol de caballo, usando lombriz de tierra Eisenia foetida, variedad roja californiana.
Previo a la caracterización fisicoquímica, las muestras de suelo y vermicomposta fueron secadas al aire libre y tamizadas con malla de tamaño de poro de 2 mm. Se realizó el análisis de textura con base en el método del hidrómetro (Gee y Bauder, 1986). Luego se cuantificó el pH con suspensión suelo: agua (1:2.5 p/v) usando un potenciómetro (inoLab® pH 7110); además de la conductividad eléctrica (CE, reportado en las unidades deciSiemens por metro (dS m-1)) (1:5 p/v) del extracto acuoso; el contenido de materia orgánica se realizó según el método de Walkley y Black (1934) y el nitrógeno total (TN) fue medido mediante el método de Kjeldahl (Bremner, 1996).
Para la caracterización fisicoquímica se pesó de 2‑3 mg de muestra de cada tratamiento después de 28 días del experimento en una balanza AD6 [Perkin Elmer, USA ]; las muestras fueron analizadas en un analizador elemental para carbono orgánico y nitrógeno Perkin Elmer Model 2400 usando helio (grado cromatográfico) como gas acarreador.
El análisis microbiológico de las muestras de suelo y vermicomposta se hizo para conocer la densidad poblacional de actinomicetos, previo a mezclarse en el experimento en macetas. Por ello, se analizaron las muestras originales y por separado, por el método de conteo en placa; como a continuación se describe brevemente, asépticamente 10 g de suelo se colocaron en matraces Erlenmeyer con 90 mL de solución salina estéril (0.9% NaCl) y se agitó a 150 rpm por 30 minutos. Posteriormente, se realizaron diluciones seriadas en tubos con 9 mL de solución salina estéril y de cada dilución se sembró un volumen de 100 µL en placas de agar glicerol (Difco, Becton, Dickinson & Co., MD, USA) adicionando ampicilina a 50 µg mL-1 (para inhibir crecimiento de bacterias Gram negativas), las misma fueron incubadas a 30 °C durante 4 días. El resultado fue expresado en unidades formadoras de colonias por gramo de suelo (UFC g-1). Este procedimiento se realizó con sus respectivas tres replicas.
A fin de comparar los cambios en la densidad poblacional de actinomicetos en suelos florícolas y enmendados con vermicomposta, se elaboró un diseño experimental en bloques al azar. El experimento fue realizado en macetas de plástico con 500 g de suelo y se usó vermicomposta a una dosis de 40 Mg ha‑1. Se establecieron cinco tratamientos con cuatro repeticiones, agapando (A) considerado suelo control ya que no se aplican plaguicidas a este cultivo, suelo donde se cultiva rosa (SPR), suelo donde se cultiva clavel (SPC), suelo donde se cultiva rosa enmendado con vermicomposta (SPRV) y suelo donde se cultiva clavel enmendado con vermicomposta (SPCV). Los cambios en la densidad poblacional de actinomicetos fueron cuantificados por el método de conteo en placa antes descrito, cada siete días por 28 días en total. El análisis fisicoquímico de los tratamientos se realizó al inicio y al final del experimento.
En el análisis estadístico se utilizó el software Statgraphics 5.1. Se realizó un análisis de varianza (ANOVA) y una prueba Tukey HSD (Honest Significant Difference) (P < 0.05) para comparar las diferencias de los valores promedios de la densidad poblacional de actinomicetos entre los cinco tratamientos y en cada tiempo de muestreo. La comparación de las propiedades fisicoquímicas de los tratamientos fue hecha con un ANOVA y una prueba de LSD (P < 0.001).
Resultados y Discusión
El suelo donde se cultiva rosa, clavel y agapando es de textura arenosa (Cuadro 1), de acuerdo con Cruz et al. (2015) un suelo con textura arenosa es adecuado para la agricultura ya que favorece el crecimiento vegetal de raíces y está bien drenado. El pH (Cuadro 1) de todas las muestras está en la región neutra, los valores de CE están acordes a la Norma Oficial Mexicana NOM-021-RECNAT-2000 (SEMARNAT, 2000), excepto la CE de la vermicomposta que tuvo un valor elevado con respecto a los suelos. Con base en la misma norma, el contenido de materia orgánica es bajo en los suelos florícolas, esto sugiere que el suelo requiere de la adición de una enmienda que permita su restauración. Para el caso de la vermicomposta el contenido de materia orgánica es alto, por esta razón se le consideró como mejorador del suelo.
Cuadro 1: Caracterización fisicoquímica de las muestras originales de suelos florícolas de rosa, clavel, agapando y vermicomposta.
Table 1: Physicochemical characterization of the original samples of floricultural soils of rose, carnation, flower of love and vermicompost.
| Suelo florícola | Textura | pH | CE | Materia orgánica | Humedad |
| †dS m-1 | - - - - - - - - % - - - - - - - - | ||||
| A | F-Ar | 7.19± 0.36 | 0.14± 0.36 | 2.20± 0.68 | 37.3± 9.11 |
| SPR | F-Ar | 6.81± 0.18 | 1.32± 1.11 | 4.93± 0.29 | 29.3± 2.85 |
| SPC | F-Ar | 6.43± 0.54 | 1.43± 0.92 | 4.61± 0.29 | 18.1± 12.34 |
| V | - | 7.41± 0.06 | 3.99± 0.0 | 66.91± 23.94 | 51.0± 23.05 |
A = agapando (control); SPC = suelo cultivado con clavel; SPR = suelo cultivado con rosa; V = vermicomposta; F-Ar = arenoso; CE = conductividad eléctrica, † deciSiemens por metro.
A = flower of love (control); SPC = soil cultured with carnation; SPR = soil cultured with rose; V = vermicompost; F-Ar = sandy; CE = electrical conductivity, † deciSiemens per meter.
El contenido de actinomicetos en los suelos florícolas de clavel, rosa y agapando, así como de vermicomposta se muestra en la Figura 1. De manera natural un suelo no perturbado por actividad antropogénica y sin presencia de contaminantes tendría un contenido de actinomicetos de 1 × 108 UFC g-1 (Tiquia, 2005; Shrestha et al., 2015). De acuerdo con los resultados de la primera caracterización con las muestras originales, en el suelo donde se cultiva agapando la población de actinomicetos fue del orden cercano a 1 × 105 UFC g-1, este contenido es bajo y no es congruente debido a que no hay presencia de plaguicidas. El mayor contenido de actinomicetos con diferencias significativas (P < 0.006), fue encontrado en suelos donde se cultiva rosa y clavel con 7 × 105 UFC g-1 y 6.4 × 105 UFC g-1, respectivamente. Aun así, la densidad poblacional de actinomicetos no está en el orden de magnitud de 1 × 108 UFC g-1, ésta evidencia podría indicar que los microorganismos del suelo están siendo afectados por el uso de plaguicidas y manejo del cultivo.
Figura 1: Densidad poblacional de actinomicetos de las muestras originales de suelo y vermicomposta. Letras diferentes en cada barra de la gráfica denotan diferencias significativas, P < 0.0061, α = 0.05 (Tukey). S = suelo; P = plaguicida; A = agapando (control); R = rosa; C = clavel y V = vermicomposta.
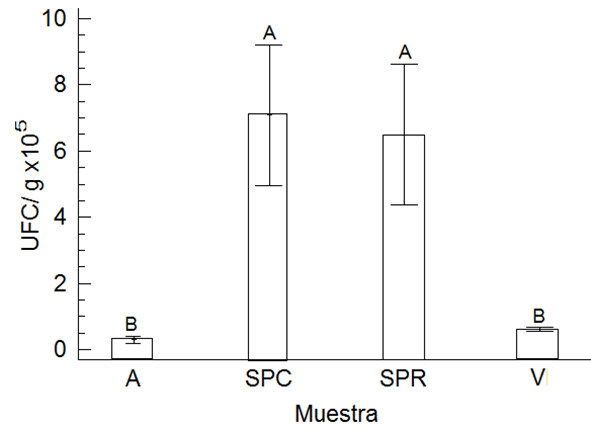
Figure 1: Population density of actinomycetes from the original soil and vermicompost samples. Different letters in each bar of the graph denote significant differences, P < 0.0061, α = 0.05 (Tukey). S = soil; P = pesticide; A = flower of love (control); R = rose; C = carnation and V = vermicompost.
Fuentes et al. (2010) y Benimeli et al. (2006) reportaron que los actinomicetos pueden crecer en suelos donde se aplican plaguicidas organoclorados, debido a que se han adaptado a ese tipo de ambiente. Esto sugiere que los actinomicetos que están presentes en suelos donde se cultiva rosa y clavel tienen la capacidad de sobrevivir a la aplicación de agroquímicos. Bhatti et al. (2017) y Sharma (2014) reportaron que debido a que los actinomicetos son formadores de esporas y además producen enzimas, es posible que sobrevivan en ambientes impactados con compuestos orgánicos persistentes como los plaguicidas que se aplican en la agricultura.
En el caso de la vermicomposta, es probable que la baja densidad poblacional de actinomicetos, se deba al tiempo de estabilización y mineralización de la materia orgánica lábil. Jeyabal y Kuppuswamy (2001) publicaron que el contenido de actinomicetos está en función del tiempo de maduración/estabilización, así como la disponibilidad de materia orgánica lábil que pudieran estar aún degradando los actinomicetos. A pesar de ello, la vermicomposta puede ser recomendada como mejorador de suelos y se ha reportado que la aplicación de vermicomposta en la biorremediación de suelos contaminados con plaguicidas, mejora sus características (Chen et al., 2015).
Según Quintero-Lizaola (2014) el contenido microbiano de la vermicomposta disminuye después del proceso de vermicompostaje, debido a que las lombrices de tierra degradan y mineralizan la materia orgánica lábil, así como también modifican las condiciones ambientales originales y específicamente, la conductividad eléctrica se puede ver incrementada y el pH se puede volver alcalino.
La Figura 2 muestra los cambios en la densidad poblacional de actinomicetos monitoreados a distintos intervalos de tiempo durante 28 días de experimento, con el uso de diferentes tratamientos adicionando vermicomposta a dosis de 40 Mg ha-1. Al inicio del experimento (0 días, Figura 2 a), todos los tratamientos comenzaron con una población de actinomicetos cercano a 1 × 105 UFC g-1. A los 7 días de tratamiento se detectó un incremento significativo en la densidad poblacional de actinomicetos en el tratamiento del suelo donde se cultiva rosa (SPR). Los tratamientos de suelo de clavel y rosa a los que se les adicionó vermicomposta (SPCV y SPRV) fueron significativamente iguales con respecto al suelo donde se cultiva clavel (SPC) y agapando (A) (Figura 2 b). Es probable que éste incremento se deba a un periodo de adaptación entre los microorganismos presentes en los diferentes tratamientos. En un estudio realizado por Liu y Kang (2014) reportaron que los microorganismos del suelo responden a los cambios ambientales, así como a la modificación de la estructura y composición del suelo.
Figura 2: Densidad poblacional de actinomicetos en suelos florícolas y tratados con vermicomposta 40 Mg ha-1. Tiempos de monitoreo: a) 0 días de tratamiento, b) 7 días de tratamiento, c) 14 días de tratamiento y d) 28 días de tratamiento. Letras diferentes en cada barra de la gráfica denotan diferencias significativas, P < 0.0061, α = 0.05 (Tukey). S = suelo; P = plaguicida; A = agapando (control); R = rosa; C = clavel y V = vermicomposta.
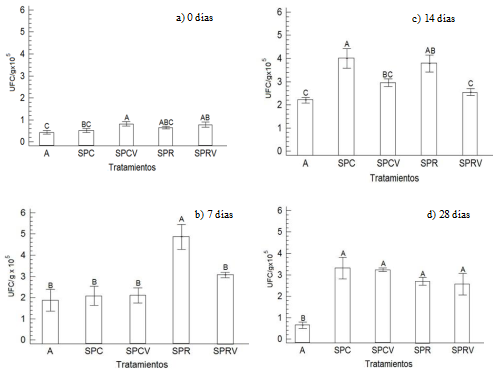
Figure 2: Population density of actinomycetes in floricultural soils and treated with vermicompost 40 Mg ha-1. Monitoring times: a) 0 days of treatment, b) 7 days of treatment, c) 14 days of treatment and d) 28 days of treatment. Different letters in each bar of the graph denote significant differences, P < 0.0061, α = 0.05 (Tukey). S = soil; P = pesticide; A = flower of love (control); R = rose; C = carnation and V = vermicompost.
La densidad poblacional de actinomicetos cuantificada a 14 d fue diferente en cada tratamiento (Figura 2 c). En los tratamientos sin vermicomposta (SPC y SPR) hubo mayor densidad poblacional de actinomicetos con respecto a los tratamientos adicionados con vermicomposta (SPCV y SPRV). La adición de vermicomposta a los suelos donde se cultiva rosa y clavel no tuvo el efecto aditivo esperado de actinomicetos.
De acuerdo con Quintero-Lizaola (2014) y Espinosa-Palomeque et al. (2017), los actinomicetos son buenos indicadores biológicos para evaluar la calidad de suelos contaminados por compuestos orgánicos persistentes. Por esta razón, es probable que los actinomicetos de los suelos florícolas sin adición de vermicomposta, sean más resistentes y fácilmente adaptables a la presencia de los plaguicidas que se aplican al suelo.
De acuerdo con Ros et al. (2010) y Orozco-Corral et al. (2016), la densidad poblacional de actinomicetos se estabiliza cuando han consumido la materia orgánica lábil del suelo, por lo que la materia orgánica no lábil que es más difícil de degradar, provoca que la población de actinomicetos disminuya. En la Figura 2 d se aprecia precisamente este fenómeno, es decir, la densidad poblacional de actinomicetos en el día 28 del experimento se mantuvo estable en el orden de 3 × 105 UFC g-1 para todos los tratamientos excepto el control (agapando).
En el Cuadro 2 se reportan los valores de pH, conductividad eléctrica, carbono orgánico y nitrógeno de todos los tratamientos, después de 28 días de experimentación. Con respecto al pH se encontraron diferencias significativas (F4, 15 = 213, P < 0.001), los tratamientos A y SPRV mostraron pH neutro y los tratamientos SPR, SPC y SPCV fueron moderadamente ácidos con base en la Norma Oficial Mexicana NOM-021-RECNAT-2000 (SEMARNAT, 2000). En la conductividad eléctrica (CE) hubo diferencias significativas (F4, 15 = 301, P < 0.001), siendo el tratamiento SPC el de mayor CE (2.44 ± 0.23 dS m-1).
Cuadro 2: Caracterización fisicoquímica de los diferentes tratamientos del suelo florícola, después de 28 días.
Table 2: Physicochemical characterization of the different floricultural soil treatments after 28 days.
| pH | CE | CO | TN | C/N | |
| †dS m-1 | - - - - - - - - % - - - - - - - - | ||||
| SPC | 6.34±0.06e | 2.44±0.23a | 2.64±0.14b | 0.34±0.01b | 7.76 |
| SPCV | 6.42±0.04d | 2.17±0.10bc | 3.24±0.14a | 0.34±0.01b | 9.52 |
| SPR | 6.51±0.06c | 2.19±0.10b | 2.84±0.16ab | 0.34±0.01b | 8.35 |
| SPRV | 6.67±0.10b | 2.02±0.21c | 3.10±0.14ab | 0.38±0.01a | 8.15 |
| A | 7.17±0.04a | 0.18±0.01d | 1.32±0.34c | 0.19±0.01c | 6.94 |
CE = conductividad eléctrica; CO = carbono orgánico; TN = nitrógeno total. † deciSiemens por metro. SPC = suelo donde se cultiva clavel; SPCV = suelo donde se cultiva clavel enmendado con vermicomposta; SPR = suelo donde se cultiva rosa; SPRV = suelo donde se cultiva rosa enmendado con vermicomposta; A = agapando (control).
CE = electrical conductivity; CO = organic carbon; TN = total nitrogen. † deciSiemens per meter. SPC = soil where carnation is cultured; SPCV = soil where carnation is cultured, amended with vermicompost; SPR = soil where rose is grown; SPRV = soil where rose is grown amended with vermicompost; A = flower of love (control).
El tratamiento con el mayor contenido de carbono orgánico (CO) fue SPCV con 3.24 ± 0.14 % (F4, 15 = 57, P < 0.001). El nitrógeno total (NT) también tuvo diferencias significativas, los tratamientos SPRV y control tuvieron el contenido más bajo de NT (F4, 15 = 196, P < 0.001). La relación C/N con el valor más alto fue en el tratamiento SPCV (9.52) seguido de SPR (8.35), SPRV (8.15), SPC (7.76) y finalmente el tratamiento A (6.94) (Cuadro 2).
El bajo contenido de carbono orgánico (reportado porcentualmente) en los tratamientos al finalizar el experimento (28 días), puede estar dado a la actividad microbiana debido al proceso de mineralización del carbono que haya sido favorecido en el suelo donde se cultiva clavel, rosa y agapando. De acuerdo con Awasthi et al. (2015) y Bhattacharya et al. (2016) la degradación de la materia orgánica se debe a la respiración microbiana del suelo.
Es evidente que la adición de vermicomposta incrementó la relación porcentual de carbono orgánico en los suelos florícolas. Barton et al. (2016), demostraron que la vermicomposta es un agente que mejora la humedad, textura y en este caso el contenido de materia orgánica también. Por esta razón, el uso de enmiendas orgánicas como la vermicomposta, ayuda a restaurar las propiedades fisicoquímicas de suelos impactados por el uso de fertilizantes y plaguicidas (Canarini et al., 2006; Cabanillas et al., 2013; Chatterjee et al., 2016;).
Conclusiones
Los resultados del presente estudio mostraron que la vermicomposta adicionada a los suelos florícolas cultivados con rosa y clavel, no incrementó la densidad poblacional de actinomicetos; sin embargo, ésta enmienda orgánica mejoró las propiedades fisicoquímicas de los suelos florícolas en sus respectivos tratamientos. La densidad poblacional de actinomicetos en los suelos cultivados con rosa y clavel está adaptada a la aplicación de plaguicidas.
Disponibilidad de Datos
Los conjuntos de datos utilizados o analizados durante el estudio actual están disponibles del autor correspondiente a solicitud razonable.
Contribución de los Autores
Administración del proyecto y adquisición de fondos: Gustavo Yáñez-Ocampo, contribuyó en la búsqueda de recursos, con el proyecto financiado. Análisis formal: Yolanda Marmolejo-Santillán, contribuyó en el análisis elemental de carbono y nitrógeno. Conceptualización: Gustavo Yáñez-Ocampo y Jorge Lugo-de la Fuente, contribuyeron en formulación y desarrollo de ideas, objetivos de la investigación. Escritura: preparación del borrador original: María Esther Sánchez-González y Nadia de la Portilla-López, contribuyeron en la redacción general del manuscrito. Escritura: revisión y edición: Jorge Lugo-de la Fuente contribuyó en corrección de estilo, normas editoriales, edición de gráficas y cuadros. Investigación: María Esther Sánchez-González, realizó los trabajos experimentales de campo y de laboratorio. Metodología: Rocío Vaca-Paulín, contribuyó en la elaboración del diseño experimental y el análisis estadístico de los datos. Recursos: Gustavo Yáñez-Ocampo, contribuyó en la búsqueda de recursos, con el proyecto financiado. Validación: Pedro Del Águila-Juárez, contribuyó en diseño de muestreo, revisión de datos experimentales de la investigación.











 nueva página del texto (beta)
nueva página del texto (beta)



