Introducción
La fusariosis de la espiga (FE) es una enfermedad que causa grandes pérdidas de rendimiento y calidad en granos de trigo a nivel mundial (Casa et al., 2004). Es producida principalmente por hongos pertenecientes al complejo Fusarium graminearum el cual está formado por 16 especies. En Uruguay, al igual que en los países productores de trigo de la región, Fusarium graminearum sensu stricto es la especie predominante (Umpiérrez et al., 2013). Los hongos de esta especie son capaces de producir micotoxinas en los granos, siendo el deoxinivalenol (DON) la toxina más frecuentemente producida en trigo (Edwards et al., 2001). El consumo de granos contaminados con DON tiene como efecto la aparición de trastornos digestivos (vómitos, diarrea), e incluso puede afectar la síntesis de proteínas o provocar deficiencias del sistema inmunológico en los animales llevando a pérdidas de peso (Pestka y Smolinski, 2005). Por ello, se maximizan esfuerzos en el control de la fusariosis en cereales de forma de disminuir pérdidas productivas y evitar problemas de salud ocasionados por el consumo de granos o productos derivados contaminados.
El ciclo de la fusariosis de espiga comienza con el inóculo primario del patógeno que se desarrolla en los rastrojos de la cosecha anterior. En condiciones apropiadas de temperatura y humedad las ascosporas provenientes de los peritecios y eventualmente los conidios del patógeno producidos en el rastrojo, pueden alcanzar las anteras de las flores de trigo (órgano susceptible) de la nueva cosecha y causar infección. La siembra sin laboreo, práctica común en la región, propicia la sobrevivencia saprofítica del patógeno sobre los rastrojos y, por tanto, favorece el desarrollo de la enfermedad (Inch y Gilbert, 2003).
La FE es actualmente una de las enfermedades que presenta más desafíos para su control. Ninguna práctica es por sí sola efectiva y, por lo tanto, es importante adoptar todas las medidas de control disponibles tanto culturales, químicas o biológicas que puedan contribuir a disminuir la incidencia de la enfermedad (Pereyra, 2003). Una práctica cultural que contribuye a la prevención de la enfermedad es intercalar en el tiempo cultivos de cereales con otros no susceptibles como oleaginosas o leguminosas, para de esta forma minimizar el inóculo (Dill-Macky y Jones, 2000). A su vez, el uso de variedades de trigo con menor sensibilidad a la FE es otra de las opciones de control, ya que hasta el momento no existen variedades completamente resistentes (Mazzilli et al., 2011). El manejo de la enfermedad incluye también el control químico mediante aplicación de fungicidas, como por ejemplo triazoles, al inicio de floración para impedir la infección de la planta (Amarasinghe et al., 2013). Sin embargo, la efectividad del control químico depende del momento y del método de aplicación, así como de la susceptibilidad de la población del patógeno que se busca controlar. En este contexto el control biológico, se presenta como una opción complementaria para reducir la incidencia y severidad de la enfermedad. Si bien no existe hasta el momento ningún producto comercial para la FE, el desarrollo en la investigación a nivel mundial es amplio y ha demostrado la posibilidad del uso de agentes microbianos para complementar el control de esta enfermedad (Schisler et al., 2002). En función de la biología de la enfermedad, existirían dos estrategias de biocontrol para disminuir los riesgos de infección. La primera tendría como objetivo disminuir el inóculo primario aplicando el biocontrolador sobre el rastrojo del cultivo anterior. La segunda se enfocaría en proteger el sitio de infección (la flor), para lo cual el agente de biocontrol debería aplicarse al inicio de la floración, de forma de impedir o minimizar la infección de la planta (Palazzini et al., 2018). En el primer caso, los antagonistas deberían ser buenos colonizadores de rastrojo, de forma tal que sean capaces de desarrollarse en el sitio de acción, impidiendo la colonización del patógeno y la propagación del inóculo primario (Villar et al., 2019). En ese sentido se han publicado trabajos basados en el uso de Trichoderma harzianum (Inch y Gilbert, 2007), Trichoderma gamsii (Matarese et al., 2012) o Microsphaeropsis spp. (Bujold et al., 2001) como controladores biológicos de F. graminearum en rastrojo de trigo. La capacidad del agente de biocontrol de sobrevivir y desarrollarse en los rastrojos en las condiciones ambientales del lugar sería fundamental para llevar a cabo esta estrategia de control, por lo cual el desarrollo de cepas antagonistas locales adquiere relevancia.
El objetivo del presente trabajo consistió en aislar y seleccionar cepas nativas de Trichoderma spp. para el control del inóculo primario de FE en trigo.
Materiales y Métodos
Patógeno
La cepa F. graminearum F224a, perteneciente a la colección de microorganismos de la Cátedra de Microbiología de la Facultad de Química, Udelar, fue seleccionada como patógeno para este estudio con base a los elevados niveles de deoxinivalenol producidos en cultivo, a la capacidad de producir peritecios en rastrojo de trigo en condiciones controladas (humedad y temperatura), y a los niveles de agresividad al ser inoculada en anteras de flores de trigo en ensayos en invernáculo (Umpiérrez et al., 2013).
Aislamiento de antagonistas
Las cepas de Trichoderma spp. utilizadas en este trabajo se aislaron de 20 muestras de rastrojo de trigo provenientes de la principal zona de producción de nuestro país localizada al este del río Uruguay, en los departamentos de Río Negro, Soriano y Colonia. Para ello, 10 g de rastrojo se colocaron en 100 mL de suero fisiológico estéril y se homogeneizaron en Stomacher 400® (Stomacher, UK) durante 2 min a máxima velocidad. Diluciones de esta suspensión fueron sembradas en superficie en placas de Potato Dextrose Agar (PDA, Oxoid) conteniendo neomicina (50 mg mL-1). Las colonias típicas de Trichoderma spp. fueron reaisladas en placas de PDA, y posteriormente se realizaron cultivos monospóricos a partir de las mismas. Los aislamientos obtenidos fueron conservados en tubos de PDA inclinado a 5 °C hasta su uso.
Identificación de antagonistas
Las cepas de Trichoderma fueron identificadas mediante el estudio de las secuencias de dos regiones génicas (ITS1-ITS2 y tef1α). En primer lugar, se realizó la extracción y purificación del ADN de cada cepa y a partir del ADN total se amplificó la región intergénica ITS1-ITS2 y una parte del gen que codifica para el factor de elongación de la traducción 1 alfa (tef1α), que comprende la totalidad del cuarto intrón y parte del cuarto y quinto exón del gen (Jaklitsch y Voglmayr, 2015). El ADN de cada cepa se extrajo según Garmendia y Vero (2016). A partir del ADN se realizaron las reacciones de amplificación en un volumen total de 25 μL utilizando 0.2 μL de cada primer 25 μM, 0.15 U de Taq polimerasa (Invitrogen), 0.75 μL de MgCl2 50 mM, 1 µL de cada solución de dNTP 5 mM (Invitrogen), 2.5 µL de buffer de amplificación (Invitrogen), aproximadamente 20 ng de ADN, completando el volumen de reacción con agua destilada estéril. En el caso de la amplificación de la región ITS1-ITS2 se utilizaron los cebadores ITS1 (5´-TCCCGGTTCGCTCGCCGTTACTA-3´) e ITS4 (5´-TCCTCCCGCTTATTGATATGC-3´) (White et al., 1990). La mezcla de reacción fue sometida a 5 min de desnaturalización a 95 °C, seguida de 35 ciclos de 1 min de desnaturalización a 95 °C, 30 seg de alineamiento a 55 °C, 1 min de extensión a 72 °C, para finalizar con una extensión de 10 min a 72 °C.
Para el gen tef1α, los cebadores utilizados fueron EF1-728F (5´-CATCGAGAAGTTCGAGAAGG-3´) (Carbone y Kohn, 1999) y Tef1 rev (5´-GCCATCCTTGGAGATACCAGC-3´) (Samuels et al., 2006). El ciclo de PCR fue igual al anterior excepto la temperatura de alineamiento la cual fue de 51 °C. Los cebadores utilizados en ambos casos fueron sintetizados por Byo Synthesis Company (Lewisvile, TX). Los productos de PCR fueron analizados en gel de agarosa al 0.8% conteniendo bromuro de etidio (5 μg mL-1) obteniéndose una banda de alrededor de 600 pares de bases. Los productos de amplificación de ambas regiones fueron purificados y secuenciados por Macrogen Inc. (Seúl, Corea). Las secuencias de ambas regiones fueron comparadas con las depositadas en la base de datos Genbank (https://www.ncbi.nlm.nih.gov/genbank/), utilizando la herramienta BLAST.
Análisis filogenético
Se realizó el análisis filogenético de las secuencias concatenadas (ITS1-ITS2 y gen tef1α) alineándolas con secuencias concatenadas de cepas tipo, las cuales se obtuvieron del GenBank. Las secuencias se alinearon usando el programa MEGA versión 6 (Tamura et al., 2013). Los árboles filogenéticos se construyeron por Neighbor-Joining (Saitou y Nei, 1987) y las distancias evolutivas fueron computadas con el método de Jukes-Cantor (Jukes y Cantor, 1969). Todas las posiciones conteniendo gaps o datos faltantes fueron eliminadas con la opción de comparación pareada de secuencias (Pairwise deletion option). La estabilidad de los grupos fue determinada utilizando un bootstrap de 1000 réplicas (Felsenstein, 1985).
Caracterización de las cepas de Trichoderma
Sensibilidad al fungicida tebuconazol. Se determinó la mínima concentración de fungicida capaz de inhibir el crecimiento del hongo (CIM). Para ello se prepararon placas de PDA con 0, 2, 4, 8, 16, 32 y 64 mg L‑1 de tebuconazol (Folicur 450( Bayer Crop Science), incorporado en el medio de cultivo (Umpiérrez et al., 2013). Sobre las placas se inocularon en forma puntual 5 μL de suspensión de conidios de las cepas a estudiar ajustadas a una concentración de 1 × 105 conidios mL-1. Se sembraron ocho cepas por placa y se realizaron dos repeticiones por tratamiento. Las placas se incubaron en estufa a 25 °C durante 5 días, evaluándose en forma visual presencia o ausencia de crecimiento, en cada uno de los tratamientos.
Determinación de la capacidad de producción de xilanasas. Para cada cepa de Trichoderma spp. se determinó la capacidad de producir xilanasas en medio mínimo con xilano como fuente de carbono. Se realizaron cultivos en medio líquido Yeast Nitrogen Base (YNB) (BioChemica, Sigma), adicionado con xilano al 0.5% como única fuente de carbono. Cada matraz conteniendo 40 mL de medio de cultivo se inoculó con 100 μL de una suspensión de conidios de la cepa a estudiar de 2 × 104 conidios mL-1 y se incubó en estufa a 25 °C.
La determinación de la actividad enzimática se realizó sobre una mezcla de 100 μL de buffer citrato-fosfato (pH 5.6), 50 μL de sobrenadante del cultivo (centrifugado y filtrado a través de un filtro de 0.45 μm de poro) y 50 μL de xilano al 1% en agua destilada. La mezcla se incubó en baño de agua a 40 °C durante 1 hora, luego se agregaron 300 μL de ácido dinitrosalicílico (DNS) y se calentó en baño de agua a ebullición durante 5 minutos. Finalmente se agregaron 500 μL de agua destilada y se midió la absorbancia a 540 nm contra cada blanco, preparado de igual manera que la mezcla de reacción, pero sin realizar incubación. En cada blanco el agregado el DNS y el calentamiento se realizaron inmediatamente después de obtener la mezcla. Cada reacción se realizó por triplicado. Una unidad de enzima fue definida como la cantidad que libera 1 μmol de azúcares reductores (expresada en equivalentes de glucosa) por minuto, en las condiciones de reacción.
Producción de quitinasas asociadas a la degradación de paredes de hongos. Se evaluó la capacidad de producción de quitinasas por cada cepa de Trichoderma spp. al crecer en YNB adicionado con paredes celulares de F. graminearum en una concentración de 0.5% (m/v) como única fuente de carbono (Vero et al., 2013). Los cultivos se realizaron inoculando en forma individual 100 μL de una suspensión de 2 ( 104 conidios mL-1 de cada cepa de Trichoderma spp. en matraces de 200 mL conteniendo 40 mL del medio. La incubación se realizó durante 10 días a 25 °C, sin agitación. Cada cultivo se realizó por triplicado. Una vez finalizada la incubación, cada cultivo se centrifugó y el sobrenadante fue filtrado a través de un filtro de acetato de celulosa de 0.45 μm de poro.
A partir del filtrado del cultivo de las distintas cepas de Trichoderma spp. se realizó la medida de la actividad quitinolítica según el método de Mahadevan y Crawford (1997) con algunas modificaciones. En pocillos de una placa de microtitulación de fondo plano se colocaron 90 μL de filtrado de cultivo y 10 μL de solución 0.18 mM de p-nitrofenil-N-Acetil-β-D-Glucosamidina (Sigma, St. Louis, MO) disuelto en tampón fosfato de potasio 50 mM, pH 6.1. La placa se incubó a 25 °C durante 24 h sin agitación y la reacción se finalizó con el agregado de 10 μL de NaOH 1 M. Se determinó la absorbancia a 405 nm en un lector automático Microplate Autoreader (Bio-tek Instruments,Winooski,VT), contra un blanco de cada muestra en el que se agregó la solución de NaOH previo a la incubación. La concentración de paranitrofenol obtenido en cada hidrólisis se determinó mediante curva estándar Se definió una unidad de enzima como la cantidad necesaria para liberar un micromol de paranitrofenol en un minuto. El ensayo se realizó por triplicado para cada cepa.
Producción de compuestos antifúngicos volátiles. La producción de compuestos antifúngicos volátiles fue analizada según Arrarte et al. (2017), con modificaciones. Placas de PDA fueron inoculadas centralmente con un disco de agar de cinco mm de cada cepa de Trichoderma, proveniente de un cultivo de 48 h de crecimiento. En otras placas de PDA se sembró centralmente un disco de la cepa de patógeno proveniente de un cultivo de 48 h de crecimiento. Se retiraron las tapas de ambas placas y las bases conteniendo el patógeno se colocaron encima de las bases con el antagonista, de modo tal que los cultivos quedaran enfrentados, Cada set de placas enfrentadas se selló con parafilm y se incubó a 25 °C. Como control se usaron pares con la cepa de F. graminearum en ambas placas. Se midió el diámetro de la colonia de F. graminearum al quinto día, momento en que la cepa del patógeno cubrió toda la placa control. La inhibición se expresó como el porcentaje de reducción del diámetro de la colonia respecto al control. El ensayo se realizó por triplicado.
Producción de compuestos antifúngicos solubles en medio líquido. Para este ensayo se siguió la metodología de Marques et al. (2018) con algunas modificaciones. Las distintas cepas de Trichoderma fueron inoculadas en matraces conteniendo 50 mL de medio YES (pH = 6) agregando 1 mL de una suspensión de 1 ( 106 conidios mL-1. Los cultivos fueron incubados a 25 °C, sin agitación, durante siete días. Al final de este lapso el sobrenadante del cultivo fue filtrado con filtros de poro 0.45 μm para obtener una solución libre de células. El mismo fue incorporado a igual volumen de PDA doble concentración y vertido en placas de Petri, previo ajuste a pH = 6. Como control se prepararon placas incorporando igual volumen de medio YES sin inocular. Sobre cada placa se sembró un disco de micelio de 5 mm de diámetro del patógeno y se incubó a 25 °C. Al cabo de 4 días de incubación se midieron los diámetros de las colonias de F. graminearum y se compararon con los alcanzados en las placas control. La inhibición se expresó como el porcentaje de reducción del crecimiento de las colonias en las placas conteniendo los diferentes filtrados, con respecto a la media de los controles. El ensayo se realizó por triplicado.
Cultivos duales de patógeno-antagonista
La capacidad de las distintas cepas de Trichoderma spp. de inhibir el crecimiento de Fusarium graminearum F224a, fue determinada mediante cultivos duales en placa de PDA a 25 °C. A partir de cultivos puros de tres días de crecimiento activo de los antagonistas y del patógeno sobre PDA se cortaron discos del borde de cada colonia con un sacabocado de 5 mm de diámetro. Se enfrentaron discos del patógeno con discos de los antagonistas en placas con PDA cada uno a 2.5 cm del centro de la placa. Como testigo se sembró en una placa un disco del patógeno en placa de PDA. Las placas se incubaron en estufa a 25 °C y se midió el diámetro de cada colonia luego de 5 días, momento en el que la colonia del patógeno había cubierto la placa control. La capacidad antagónica de cada cepa se estableció de acuerdo con la siguiente escala: (1) el radio de la colonia de F. graminearum fue mayor que 2.5 cm; (2) el radio de la colonia de F. graminearum fue menor que 2.5 cm; (3) la cepa de Trichoderma spp. creció sobre toda la placa cubriendo la colonia de F. graminearum. El ensayo se realizó por triplicado para cada caso.
Inhibición de la producción de peritecios del patógeno en cultivos patógeno-antagonista sobre rastrojo de trigo
Cinco cepas de Trichoderma spp. del clado Viride fueron seleccionadas para realizar este ensayo. La selección se basó en los resultados obtenidos en el estudio de cultivos duales, de forma de tener representantes de todas las categorías definidas en dicho ensayo. En este estudio se evaluó la inhibición que cada cepa de Trichoderma spp. causó en la producción de peritecios por parte del patógeno sobre rastrojos de trigo (Bujold et al., 2001). Diez trozos de rastrojo de trigo de aproximadamente 7 cm de longitud, conteniendo un nudo cada uno, previamente esterilizados, se inocularon mediante inmersión por 1 min en 50 mL de una suspensión conjunta de conidios del patógeno y antagonista (1 × 104 conidias mL-1). Las suspensiones fueron preparadas a partir de cultivos en tubos de PDA inclinado utilizando suero fisiológico con Tween 80 al 0.1% para extraer los conidios. Los rastrojos inoculados se colocaron en placas de Petri conteniendo arena humedecida previamente esterilizada. Cada tratamiento de antagonista-patógeno fue realizado por triplicado. Tanto los rastrojos como la arena usados en este ensayo fueron esterilizados mediante dos sesiones en autoclave a 121 °C durante 30 min en 2 días consecutivos. Como control se usaron rastrojos inoculados con una suspensión conteniendo únicamente conidios del patógeno. Las placas conteniendo los rastrojos tratados fueron incubadas a una temperatura de 25 °C con ciclos de luz-oscuridad de 12 h cada uno para promover el desarrollo de los peritecios. La humedad de la arena de cada placa fue controlada cada cinco días y se agregó agua destilada estéril cuando fue necesario para mantener el peso inicial de cada placa. A los 40 días, todos los peritecios en la cara superior de los rastrojos de cada placa fueron contados bajo lupa. Los resultados se expresaron como porcentaje de inhibición respecto al promedio de la cantidad de peritecios presentes en las placas control.
Correlación entre características de antagonismo
Se estudió el grado de correlación entre la producción de quitinasas y compuestos antifúngicos (volátiles y solubles), el crecimiento del patógeno en cultivo dual en placa y la formación de peritecios sobre rastrojo mediante la correlación de Spearman utilizando el programa estadístico Infostat( (Di Rienzo, 2015).
Análisis estadísticos
Los resultados fueron analizados usando análisis de varianza de una vía con el programa Infostat( (Di Rienzo, 2015). Previo al análisis se realizó la transformación de los porcentajes a arcoseno de la raíz cuadrada del valor dividido 100. La comparación entre medias se realizó con el test LSD Fisher (P < 0.05).
Resultados y Discusión
Aislamiento e identificación de antagonistas
Se obtuvieron 16 aislamientos de Trichoderma spp. provenientes de 20 muestras de rastrojo de trigo de diferentes zonas de cultivo, los cuales fueron identificados a nivel de especie mediante el análisis de las secuencias correspondientes a la región ITS1-ITS2 y parte del gen tef1α. Mediante la comparación con secuencias correspondientes a cepas tipo depositadas en el GenBank y análisis filogenético se determinó que las cepas pertenecían a cinco especies diferentes. La identificación de cada una de las cepas se muestra en el Cuadro 1. Nueve cepas fueron identificadas como T. koningiopsis (57%), tres como T. atroviride (19%), dos cepas con T. longibrachiatum (12%), una como T. afroharzianum y otra como T. rifaii.
Cuadro 1: Identificación de cepas Trichoderma spp. aisladas de rastrojo de trigo.
|
Cepa |
Especie |
|
T1, T4, TR7, TR8, TR9, T10, T11, T12, T251a |
T. ; koningiopsis |
|
TmE, TmB, To |
T. atroviride |
|
TR4 |
T. rifaii |
|
T35 |
T. afroharzianum |
|
T2, T3 |
T. longibrachiatum |
El árbol filogenético obtenido en dicho análisis incluyó secuencias de cepas tipo que mostraron similitud (98-100%) con ambas secuencias de las cepas en estudio (Figura 1). Se pudo constatar la presencia de tres grandes grupos con valores de boostrap de 100%. Uno de ellos corresponde al clado Viride donde se incluyen 12 de las cepas aisladas, de las cuales 9 se agrupan consistentemente con la cepa tipo T. koningiopsis GJS 93-20 (100% de boostrap) y tres de ellas con T. atroviride CBS 142.95 (100% de boostrap) la cual es también una cepa tipo.

Para la construcción del árbol se usó Neighbor-Joining, las distancias evolutivas se calcularon mediante el método de Jukes-Cantor y los valores de bootstrap se calcularon para 1000 repeticiones. El análisis filogenético fue hecho con el programa MEGA 6.
Figura 1: Árbol filogenético de las regiones ITS1-ITS2 y tef1α de cepas nativas y cepas de referencia de Trichoderma spp. analizadas en forma concatenada.
Otro grupo, en el que se ubican secuencias de dos cepas (T35 y T4), corresponde al clado Harzianum. Una de ellas se agrupa con la cepa tipo T. afroharzianum GJS 04-186 y la otra con T. rifaii DIS 355B quedando claramente separadas de cepas tipo de otras especies del clado. El grupo del que forman parte las cepas T3 y T2 corresponde al clado Longibrachiatum. Las cepas uruguayas agruparon con la cepa tipo T. longibrachiatum ATCC 18648, quedando separadas de la cepa tipo T. bissettii UTHSC 08-2443 la cual pertenece al mismo clado.
La mayoría de las cepas fueron identificadas como pertenecientes al clado Viride y dentro de éste a la especie T. koningiopsis. La presencia de esta especie ha sido descrita en regiones cálidas de América del Sur (Brasil y Perú) y en regiones más frías de América del Norte, en Canadá y este de Estados Unidos (Samuels, 2006). También dentro del mismo clado, otras tres cepas fueron identificadas como T. atroviride, especie que también ha sido reportada como cosmopolita (du Plessis et al., 2018). Dos de los aislamientos fueron identificados como T. longibrachiatum. Esta especie de amplia distribución geográfica, ha sido reportada como agente causal de infecciones localizadas y sistémicas en pacientes inmunodeprimidos o dializados (Druzhinina et al., 2008). Estas características imposibilitan el uso de esta especie como biocontrolador, especialmente si se plantea su uso en cultivos extensivos, por lo cual los aislamientos correspondientes no fueron considerados en este trabajo para ensayos posteriores. Los dos aislamientos restantes fueron identificados como T. afroharzianum y T. rifaii, pertenecientes al complejo de especies T. harzianum del clado Harzianum (Chaverri et al., 2015). Este complejo reúne por lo menos 14 especies entre las cuales se encuentra T. harzianum sensu stricto la cual da nombre al complejo. Un reciente trabajo de reclasificación de especies dentro de dicho complejo ha determinado que la especie T. harzianum sólo está presente en el hemisferio norte (Chaverri et al., 2015). Otras especies del clado, en cambio, tienen diferentes patrones de distribución geográfica. T. rifaii, por ejemplo, solamente ha sido encontrada en América del Sur y la especie T. afroharzianum ha sido reportada como de amplia distribución a nivel mundial. Por ello, el hallazgo de estas dos especies en Uruguay no resulta extraño. Hasta donde sabemos este es el primer reporte de T. afroharzianum y T. rifaii en Uruguay.
Caracterización de las cepas de Trichoderma spp.
Sensibilidad a Tebuconazol. La sensibilidad de las cepas nativas de Trichoderma spp. a este fungicida fue estudiada para determinar la posibilidad de una aplicación conjunta en un esquema de manejo integrado de la enfermedad. Los valores de CIM obtenidos para cada cepa fueron concordantes en las dos repeticiones del ensayo. Las cepas del clado Harzianum y del clado Longibrachiatum, que representan el 25% del total, presentaron una CIM de 16 mg L-1 mientras que las cepas del clado Viride fueron inhibidas con 32 mg L-1 del fungicida. La sensibilidad al tebuconazol de las cepas de Trichoderma spp. fue muy similar a la encontrada para las cepas de F. graminearum locales analizadas en un trabajo anterior (Umpiérrez et al., 2013), las cuales no han mostrado resistencia en condiciones de uso. A su vez, las cepas de Trichoderma aisladas en este trabajo, resultaron más sensibles al fungicida que cepas de origen europeo descritas por Hatvani et al. (2006), las cuales presentaron valores de CIM de 100 mg L-1 para tebuconazol. De acuerdo a los resultados se puede suponer que una aplicación conjunta del fungicida con el agente de biocontrol no sería efectiva, ya que podría comprometer la viabilidad del mismo.
Producción de xilanasas. Se determinó la capacidad de las cepas de Trichoderma spp. de producir xilanasas, enzimas asociadas a la capacidad de degradación de tejido vegetal y que facilitarían la degradación del rastrojo de trigo que actúa como soporte para el patógeno. Todas las cepas fueron capaces de producir xilanasas en las condiciones del ensayo (Figura 2). Se encontraron diferencias significativas (P ≤ 0.05) entre cepas de la misma especie del clado Viride, mientras que las cepas identificadas como T. longibrachiatum mostraron una actividad muy similar y relativamente baja. A su vez, la cepa con menor actividad fue TR4 identificada como T. rifaii perteneciente al clado Harzianum.
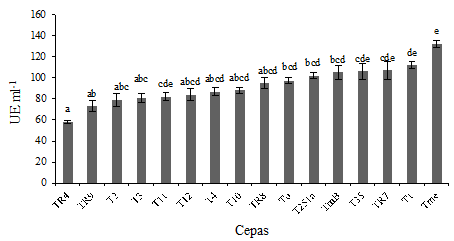
Las barras de error representan la desviación estándar de 3 repeticiones. Valores con letras distintas son significativamente diferentes según test de (LSD P ≤ 0.05).
Figura 2: Xilanasas (UE mL-1) producidas por las cepas de Trichoderma spp. en presencia de xilano como única fuente de carbono.
Producción de quitinasas. Para todas las cepas se estudió la capacidad de producir enzimas asociadas a la degradación de polímeros de la pared de hongos, tales como quitinasas y glucanasas. La producción de tales enzimas en forma extracelular se ha relacionado a la capacidad de micoparasitismo, mecanismo asociado a cepas de Trichoderma spp. con demostrada actividad biocontroladora de enfermedades vegetales de origen fúngico (Matarese et al., 2012). La capacidad quitinolítica de las diferentes cepas de Trichoderma spp. se muestran en la Figura 3 y representan la media de tres determinaciones independientes, realizadas a 25 °C. En dichas condiciones todas las cepas produjeron quitinasas extracelulares. Sin embargo, cuando el ensayo de actividad se realizó a 40 °C por media hora (protocolo desarrollado para xilanasas) los valores de actividad fueron muy bajos en promedio siendo no detectables en algunos casos.

Las barras de error representan la desviación estándar de 3 repeticiones. Valores con letras distintas son significativamente diferentes (LSD P ≤ 0.05).
Figura 3: Actividad quitinolítica (UE mL-1) de las diferentes cepas de Trichoderma spp.
Las cepas del clado Viride mostraron actividades dependientes de la cepa pudiéndose establecer diferencias significativas de actividad para cepas de la misma especie, como en el caso de las cepas de la especie T. koningiopsis. Las cepas del clado Longibrachitum desarrollaron actividades muy similares entre sí, sin diferencias significativas entre ellas ni con las pertenecientes a la especie T. atroviride del clado Viride. La actividad quitinilitica de las cepas del clado Harzianum fue significativamente diferente entre ellas, siendo la actividad asociada a la cepa identificada como T. afroharzianum significativamente mayor que la de la cepa de T. rifaii.
Los resultados evidenciaron que todas las cepas estudiadas podían producir enzimas capaces de degradar quitina, actividad fundamental para actuar como micoparásito.
Inhibición del crecimiento del patógeno debido a compuestos volátiles y solubles en el medio de cultivo
La mayoría de las cepas de Trichoderma spp. ensayadas fueron capaces de producir metabolitos volátiles y solubles con actividad antifúngica contra el patógeno en estudio. Los mayores porcentajes de inhibición del patógeno (alrededor del 40%) a causa de compuestos volátiles se lograron con las cepas T1 y T11 identificadas como T. koningiopsis, resultando en inhibiciones significativamente diferentes del resto (P ≤ 0.05) (Figura 4). Sin embargo, la inhibición alcanzada con otras cepas de la misma especie (TR8, TR7 y T251) fue muy leve, lo cual demuestra que la producción de metabolitos antifúngicos volátiles es una característica dependiente de la cepa. Varios compuestos volátiles han sido caracterizados como responsables de la actividad antifúngica de cepas de Trichoderma. Entre ellos se pueden citar compuestos aromáticos simples, pironas, terpenos volátiles e isocianatos (Stoppacher et al., 2010). La 6-pentyl-2H-pyran-2-ona (una pirona), compuesto volátil asociado con el aroma a coco característico de la especie T. atroviride (Garnica-Vergara et al., 2016), presenta actividad antifúngica. Su capacidad de inhibir in vitro del crecimiento de distintos hongos patógenos tales como Fusarium oxysporum f. sp. lycopersici y Rhizoctonia solani ha sido demostrada (Reino et al., 2008). Según estos autores los compuestos volátiles actuarían a distancia potenciando la acción localizada de las enzimas y los compuestos antifúngicos no volátiles. Las cepas que inhibieron en mayor grado al patógeno mediante la producción de compuestos antifúngicos solubles en el medio fueron las pertenecientes a la especie T. atroviride (TmE, TmB y To), junto a T35 (T. afroharzianum), con valores superiores al 60% de inhibición, presentando diferencias significativas con el resto de las cepas (P ≤ 0.05). Por su parte las cepas T1 (T. koningiopsis), T2, T3 (T. longibrachiatum) prácticamente no inhibieron el crecimiento del patógeno en este ensayo presentando valores inferiores al 15%. Las cepas del género Trichoderma producen una variedad de metabolitos secundarios con actividad antibacteriana, antifúngica y antiviral. Entre ellos se destacan unos péptidos de síntesis no ribosómica formados por entre 5 y 20 aminoácidos, algunos de los cuales normalmente no forman parte de proteínas, tales como el ácido alfa aminoisobutírico y la isovalina (Marik et al., 2018). Estos compuestos reciben el nombre de peptaiboles y actúan a nivel de membrana. Algunos de ellos son característicos de determinadas especies (Oh et al., 2005). Por ejemplo, las koningininas son producidas por T. koninigiopsis (McMullin et al., 2017) mientras que T. atroviride produce atroviridinas y neoatroviridinas (Komon-Zelazowska et al., 2007). Dado que se trata de metabolitos secundarios, los niveles de producción dependen del medio donde se desarrolle el hongo productor, por lo cual el verdadero rol de estos compuestos en la actividad biocontroladora en un patosistema debe verificarse in situ. Este trabajo estudió la producción de sustancias antimicrobianas solubles en medio YES, medio recomendado por Paterson y Bridge (1994) para la potenciación de la producción de metabolitos secundarios. Por lo tanto, los resultados obtenidos, deberían ser considerados sólo como indicativos de actividad antifúngica de cada cepa frente al patógeno. Sería importante corroborar su relación con la actividad antagonista sobre rastrojo.

Las barras de error representan la desviación estándar de 3 repeticiones. Valores de cada categoría con letras distintas son significativamente diferentes (LSD P ≤ 0.05).
Figura 4: Inhibición del crecimiento de F. graminearum mediante metabolitos antifúngicos volátiles y solubles producidos por las cepas de Trichoderma spp.
Cultivos duales de patógeno-antagonista
Se evaluó la inhibición del crecimiento del patógeno enfrentado a las diferentes cepas de Trichoderma spp. en cultivo dual en placa en PDA a 25 °C. El radio de la colonia del patógeno en la zona de enfrentamiento con el antagonista, se determinó al quinto día de cultivo, momento en que el micelio de la cepa de F. graminearum cubrió toda la superficie del medio en las placas control. Las cepas TmE, TmB y To (T. atroviride) y TR8 (T. koningiopsis) produjeron la inhibición total del patógeno creciendo y esporulando sobre el micelio del mismo. Las cepas T2, T3, T4, TR4, T12, TR9 y T251 inhibieron levemente el crecimiento del patógeno en las condiciones ensayadas. El resto de las cepas presentó un comportamiento intermedio. La Figura 5 muestra el radio de la colonia del patógeno en la placa de cultivo dual en la zona de enfrentamiento con cada antagonista, luego de 5 días de cultivo.

Las barras de error representan la desviación estándar de 3 repeticiones. Valores con letras distintas son significativamente diferentes (LSD P ≤ 0.05).
Figura 5: Radio (cm) de la colonia de F. graminearum en la zona de enfrentamiento con cada cepa de Trichoderma spp.
En la Figura 6 se observan ejemplos de cultivos duales. En a) la colonia del antagonista (T. atroviride TmE) creció sobre el patógeno y en b) el patógeno creció más allá de la zona de enfrentamiento con T. koningiopsis 251a, la cual es considerada un antagonista débil en las condiciones del ensayo.

Figura 6: Ensayo de inhibición de F. graminearum en cultivo dual con cepas de Trichoderma spp.; a) TmE - F. Graminearum; b) T251a - F. graminearum y c) placa control.
La inhibición del patógeno en cultivos duales es una de las formas más utilizadas para estudiar la capacidad biocontroladora de un microorganismo. El uso extendido de este método se debe a la sencillez del ensayo. Sin embargo, debe tenerse en cuenta que el mismo aporta solamente resultados indicativos, no definitivos. En primer lugar, la velocidad de crecimiento de los dos microorganismos enfrentados depende de las condiciones de cultivo, las cuales, no siempre son similares a las del sitio donde se espera que ocurra la interacción. En segundo lugar, debe considerarse, que la capacidad del agente de biocontrol de inhibir al patógeno depende en gran medida de la producción de compuestos inducibles o productos del metabolismo secundario y, por ello, la inhibición en medio de cultivo podría no corresponder a la inhibición en las condiciones de uso (Mondino y Vero, 2006).
Inhibición de la producción de peritecios del patógeno sobre rastrojo de trigo
El ensayo de inhibición de la producción de peritecios sobre rastrojos es el ensayo definitivo de este estudio ya que reproduce en forma más fiel, lo que se espera que ocurra en el campo. Los ensayos anteriores son solamente indicativos del potencial de biocontrol de los antagonistas. Todas las cepas de Trichoderma spp. ensayadas lograron inhibir significativamente la producción de peritecios por parte del patógeno sobre rastrojos de trigo (Figura 7).

Las barras de error representan la desviación estándar de 3 repeticiones. Valores con letras distintas son significativamente diferentes según test de LSD con P ≤ 0.05.
Figura 7: Peritecios producidos por el patógeno sobre rastrojos de trigo en presencia y en ausencia (control) de cepas de Trichoderma spp. del clado Viride.
Se observó una mayor producción de peritecios en el control y una colonización efectiva de los rastrojos por parte de las diferentes cepas de Trichoderma ensayadas (Figura 8). De las cepas seleccionadas, TmE y T11 demostraron mayor capacidad de producción de compuestos antifúngicos volátiles efectivos frente al patógeno, lo cual podría contribuir al control a distancia. La cepa TmE, a su vez, presentó una producción significativamente mayor de compuestos solubles antifúngicos y también una elevada producción de quitinasas. La acción sinérgica entre los compuestos antimicrobianos y las enzimas en la capacidad de biocontrol ya ha sido reportada previamente para cepas del género Trichoderma (Saravanakumar et al., 2017) y ha sido vinculada a la capacidad de actuar por micoparasitismo. A su vez, la cepa TmE fue la que produjo mayores niveles de xilanasas las cuales permitirían degradar xilanos presentes en el rastrojo favoreciendo la degradación del mismo. De acuerdo a los resultados de este trabajo la cepa TmE identificada como T. atroviride podría ser un buen antagonista capaz de colonizar el rastrojo de trigo e inhibir la formación de micelio y peritecios de F. graminearum, contribuyendo así al control de la fusariosis de espiga mediante la disminución del inóculo primario.
Correlación entre características de antagonismo
Se realizó el análisis de correlación de Spearman para los resultados obtenidos con las cinco cepas del clado Viride en los ensayos de actividad quitinilítica, inhibición del patógeno por compuestos antifúngicos volátiles o solubles, crecimiento del patógeno en cultivos duales en medio de cultivo y formación de peritecios del patógeno en cultivos duales sobre rastrojo de trigo. Los resultados del análisis se observan en el Cuadro 2. La diagonal principal muestra los valores de correlación de una variable consigo misma (valor 1). Los valores por encima de la diagonal principal corresponden a las probabilidades asociadas a la prueba de hipótesis de correlación nula entre las variables. Los valores ubicados por debajo de la diagonal principal muestran los coeficientes de correlación entre las variables. Mediante este análisis se determinó una fuerte correlación positiva (0.85) y significativa (P ≤ 0.05) entre el crecimiento del patógeno enfrentado a las distintas cepas del clado Viride en cultivo dual y la producción de peritecios por parte del patógeno en rastrojo en presencia de dichos antagonistas. Se constató que cuanto más afecta un antagonista el crecimiento del patógeno en cultivo dual en placa, mayor resulta la inhibición de la producción de peritecios en rastrojos en presencia de dicho antagonista. A su vez, se demostró una buena correlación negativa (-0.78) con un menor nivel de significancia (P = 0.12) entre la producción de quitinasas por parte de los antagonistas y la producción de peritecios del patógeno en rastrojos en presencia de dichos antagonistas. La producción de quitinasas también mostró correlación negativa (-0.80) con el crecimiento del patógeno en cultivo dual en presencia de las diferentes cepas de Trichoderma spp. En este caso, una mayor producción de quitinasas se correlacionó con un menor crecimiento del patógeno en cultivo dual (P = 0.10). Se pudo observar, que la inhibición del patógeno por compuestos antifúngicos volátiles y solubles producidos las cepas de Trichoderma spp. no mostró correlación significativa con la inhibición de producción de peritecios en rastrojo ni con la actividad de los antagonistas en cultivo dual. De acuerdo con estos resultados, el estudio del antagonismo en cultivo dual en placa y la producción de quitinasas en presencia de paredes del patógeno serían suficientes para determinar el potencial de cepas de Trichoderma como biocontrolador de la producción de peritecios de F. graminearum en rastrojo de trigo no siendo necesario la realización de los restantes ensayos para estimar dicho potencial.
Cuadro 2: Correlación entre actividades de las cepas de Trichoderma spp. asociadas al control de F. Graminearum.
|
Actividades |
Actividades |
||||
|
a |
1 |
0.10 |
0.93 |
0.31 |
0.05 |
|
b |
-0.80 |
1 |
0.72 |
0.14 |
0.12 |
|
c |
-0.05 |
0-22 |
1 |
0.72 |
0.23 |
|
d |
-0.57 |
0.75 |
0.22 |
1 |
0.22 |
|
e |
0.85 |
-0.78 |
-0.60 |
-0.67 |
1 |
a = crecimiento de F. graminearum en cultivos duales; b = producción de quitinasas; c = inhibición de F. graminearum por compuestos antifúngicos volátiles; d = inhibición de F. graminearum por compuestos antifúngicos solubles; e = producción de peritecios de F. graminearum.
Conclusiones
A partir de muestras de rastrojos de trigo fue posible aislar cepas de Trichoderma spp. capaces de colonizar dicho residuo e inhibir la formación de peritecios por parte del patógeno, de forma de controlar el inóculo primario y así disminuir los riesgos de aparición de fusariosis de espiga en trigo. Todas las cepas obtenidas exhibieron una o varias actividades que podrían relacionarse con su potencial como agente de biocontrol. Sin embargo, los estudios de correlación entre las diferentes actividades y la inhibición de peritecios en rastrojo evidenciaron que el desempeño en cultivo dual y la producción de quitinasas son características que se relacionan claramente con el desempeño del antagonista. La cepa seleccionada, T. atroviride TmE, se destacó por su potencial antagonista y por su capacidad de producir xilanasas las cuales se vinculan a la capacidad de colonización y degradación del rastrojo que sirve de soporte al patógeno.











 texto en
texto en 




