Introducción
El sistema milpa intercalada con árboles frutales (MIAF), es un sistema agroforestal que propicia un aprovechamiento integral del suelo, agua, luz solar y mano de obra familiar. El sistema favorece la captura de carbono, que contribuye a una mejor calidad del suelo (Cortés et al., 2012), reduce la pendiente al contribuir con la formación de terrazas, incrementa la productividad del suelo, el contenido de materia orgánica (MO), favorece la estructura del suelo, la infiltración del agua, reduce la emisión de CO2 a la atmósfera, controla la erosión hídrica, el sistema facilita un uso más eficiente del agua de lluvia en el corto, mediano y largo plazo (Cortés et al., 2012; Cortés y Turrent, 2012). El MIAF funciona como un sistema agrícola de producción diversificada con una combinación entre especies perennes y anuales que conforman una estructura vegetal ordenada en espacio y tiempo, lo que permite que las especies interaccionen agronómicamente (Juárez y Fragoso, 2014; Cortés et al., 2012; Albino et al., 2015). Está constituido por tres especies: árbol frutal, maíz y frijol, u otra especie comestible de preferencia leguminosa en intensa interacción agronómica (Turrent et al., 2017), además es una tecnología económica y socialmente viable (León et al., 2005).
El sistema MIAF favorece aprovechar el recurso suelo para: a) la producción de cultivos, b) la producción de forraje para el ganado y c) la producción de biomasa (forestal, arbórea y rastrera), manejo que permite se expresen cambios en las propiedades físicas, químicas, biológicas y por ende en la calidad del suelo.
García (2008), indica que la descomposición de la MO es un proceso que involucra tres pasos: 1) la asimilación parcial del carbono por parte de la biomasa del suelo, 2) la recirculación de CO2 hacia la atmosfera y 3) la transformación y polimerización a sustancias húmicas. Los microorganismos del suelo juegan un papel central en la retención y liberación de nutrientes en ecosistemas naturales, siendo al mismo tiempo una fuente y almacén de estos (Harte y Kinzing, 1993).
La MO en el suelo aumenta la capacidad de intercambio catiónico, la reserva de nutrientes, la capacidad tampón, los procesos de mineralización con las propiedades biológicas, favorece el desarrollo de la cubierta vegetal y sirve de alimento para microorganismos (Julca et al., 2006). Los microorganismos se adaptan a las diferentes condiciones ambientales y características del suelo, la actividad, cantidad, diversidad estructural y funcional de éstos, influye en gran parte en los procesos bioquímicos del suelo y en su productividad (Gałązka y Furtak, 2019).
Albrecht y Kandji (2003) reportaron la importancia de la agroforestería en la reducción de la concentración de CO2 en la atmósfera como parte de una agricultura sustentable ante escenarios de cambio climático. El almacén de carbono en un sistema agroforestal tropical es de 12 a 228 Mg ha-1 con un promedio de 95 Mg ha‑1. Kaur et al. (2000) encontraron que el carbono del suelo se incrementó de 11 a 52% respecto al valor original del carbono edáfico (0.47%), efecto debido a la integración de los árboles en el sistema después de seis a siete años. El sistema agroforestal estudiado por Kaur et al. (2000) tuvo influencia en la producción de CO2, la actividad respiratoria específica de biomasa y la tasa de mineralización del N, siendo menor en los valores registrados en comparación con el sistema agrícola tradicional de producción de arroz.
En un estudio realizado en un sistema MIAF, Juárez et al. (2008) reportaron que en el estado de Puebla al utilizar acolchados orgánicos (mulch), de paja de frijol y rastrojos de maíz, sobre la franja de suelo que ocupan las especies perennes, a razón de 10 cm de espesor por año, después de seis años se logró un incremento en el contenido de MO en el suelo; pasando de 0.71 a 1.74% en los primeros 30 cm, mientras que en Oaxaca la cantidad de MO registrada en la base de los árboles frutales del MIAF se ubicó en el rango 5.3 y 12.6%, similar al porcentaje de MO que se registra en los bosques del estado.
El objetivo del presente estudio fue evaluar las propiedades químicas y biológicas, en un suelo de ladera y relacionarlas con tres sistemas de manejo: a) milpa intercalada con árboles frutales (MIAF), b) sistema tradicional y c) labranza de conservación.
Materiales y Métodos
El presente trabajo se llevó acabo en el área experimental del Instituto Nacional de Investigadores Forestales, Agrícolas y Pecuarias (INIFAP) “Antonio Turrent Fernández” (ATF), ubicada en la comunidad Axochío perteneciente al municipio de San Andrés Tuxtla, Veracruz de Ignacio de la Llave, en las coordenadas 95° 17’ 57.44” O y 18° 20’ 1.01” N, con una altitud de 63 m. El clima es cálido subhúmedo con lluvias en verano (Aw2) (SRH, 1975) con precipitación anual que varía entre 1497 a 2703 mm con un promedio anual de 2006 mm en el periodo 2006 a 2016.
En el área experimental ATF existen tres sistemas de manejo del suelo, cada uno tipificado como tratamiento del suelo: a) sistema MIAF, establecido en el ciclo primavera-verano del 2003, con hileras de frutal de chicozapote, patrón de cultivo intercalado maíz-frijol, labranza mínima con tracción mecánica, b) labranza tradicional establecida en primavera-verano de 2003, patrón de cultivo maíz-maíz, labranza mínima con tracción mecánica, y c) un sistema de labranza de conservación establecida en 2015, patrón de cultivo maíz-maíz con labranza mínima de tracción animal. El sistema MIAF consiste en hileras de árboles de chicozapote (Manilkara zapota) espaciadas a 1 m, con espaciamiento entre hilera de árboles de 12 m en una ladera con 16% de pendiente. En la Figura 1 se observa la posición de la zona donadora (ZD, de escurrimientos y sedimentos), la zona media (ZM, donde se conservan las condiciones del terreno natural), la zona receptora (ZR, donde se acumulan los sedimentos acarreados y los volúmenes escurridos) y la zona de filtro (ZF, a lo largo de la cual se depositan los residuos de cosecha y ramas de árboles cortadas durante las podas).
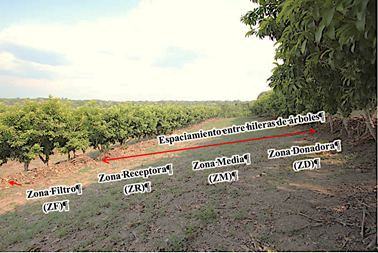
En el sistema MIAF se definieron tres líneas de muestreo perpendiculares a la pendiente y a los árboles frutales, en cada una se seleccionaron 13 sitios dando un total de 39 puntos de muestreo de suelos. En los lotes con sistemas labranza de conservación (LC) y labranza tradicional (LT) se tomaron tres puntos de muestreo (parte alta, media y baja de la parcela). El número total de puntos de muestreo fue de 45, las muestras se tomaron a una profundidad de 0 - 20 cm.
Para el análisis de comunidades microbianas, el muestreo de suelos se realizó en las ZD, ZM y ZF de cada línea y se obtuvo una muestra compuesta de cada sitio, zonas que corresponden al sistema MIAF. En los sistemas LT y en LC se tomó una muestra en la parte alta, media y baja de cada parcela para formar una muestra compuesta.
En las 45 muestras de suelo se determinaron: pH con una relación suelo: agua 1:2 (Van Reeuwijk, 1999); carbono orgánico del suelo (COS) (Walkley y Black, 1934, reportado en la NOM-021-SEMARNAT-2000); MO a partir del carbono orgánico del suelo multiplicado por el factor 1.724 de Van Benmelen (Jackson, 1964); el N total estimado a partir del contenido de MO en el suelo (Jackson, 1964; Carreón et al., 19951), N inorgánico por el método de Kjeldahl; fósforo extractable Bray-1 (Bray y Kurtz, 1945); potasio extractado con solución Morgan (acetato de sodio pH 4.8).
Para cuantificar la respiración del suelo se usó una muestra de 30 g de suelo previamente secado al sol y tamizado en malla 10 (2 mm), colocados en charolas de aluminio con 25% de humedad en relación al peso seco. La muestra húmeda se colocó en los frascos del equipo OxiTop OC110® con 1 g de hidróxido de calcio incubados por 10 días a 25 °C (Barrales et al., 2014). Los cálculos del consumo de O2 y el CO2 que emite la muestra de suelo se realizó con las ecuaciones de Veeken et al. (2003).
Para la evaluación de las comunidades microbianas de las muestras compuestas, se utilizaron placas Biolog EcoPlate; las cuales contienen 96 pozos con 31 fuentes de carbono y cloruro de trifenil tetrazolio (este compuesto adquiere un color violeta cuando la fuente de carbono se degrada) como indicador colorimétrico de actividad microbiana. Estas fuentes de carbono están destinadas a la determinación de los microorganismos pertenecientes a seis grupos funcionales: aminas, polímeros, aminoácidos, carbohidratos, ácidos carboxílicos y misceláneos, y agua destilada como testigo (Garland y Mills, 1991; Gałązka y Furtak, 2019). En cada pozo se inocularon 100 μL de disolución 10-3 preparada con 10 g de la mezcla de suelo compuesta de la zona más 90 mL de agua destilada, agitando por un minuto. De esta mezcla se tomó un 1 mL y se transfirió a otro tubo con 9 mL de agua destilada esterilizada. Se repitió el proceso dos veces más. Después de la incubación de las placas Biolog EcoPlate a 28 °C, se tomaron lecturas de densidad óptica del contenido de los pozos con espectrofotómetro (Biotek, modelo Synergy 2 con el programa Gen5), cada 24 h por tres días. Con las lecturas resultantes y con la Ecuación 1, se calcularon los promedios del desarrollo de color (AWCD, por sus siglas en inglés) por cada fuente de carbono y con la Ecuación 2 se obtuvo índice de Shannon-Weaver que se aplica para estimar la diversidad de organismos (Tian et al., 2013; Chen et al., 2013).
donde: AWCD es el desarrollo promedio de color, s representa el valor individual de cada fuente de carbono (pozo), n es la fuente de carbono total (31) y OD es la densidad óptica en el pozo i.
donde: H es el índice de Shannon-Weaver de diversidad de microorganismos, Pi el valor que representa el cambio de color del sustrato i.
Los tratamientos se evaluaron con ayuda de un diseño experimental completamente al azar. Con la finalidad de identificar diferencias en las propiedades químicas y de diversidad de microorganismos entre los sitios de muestreo de los tres tratamientos evaluados (sistema MIAF, labranza de conservación y labranza tradicional), se realizó un análisis de varianza (ANOVA), y una comparación de medias de los tratamientos con base en la prueba de Tukey (( = 0.05). El software que se utilizó fue el Statistical Analysis System (SAS) 9.4.
Resultados y Discusión
Propiedades químicas del suelo. Los sistemas de manejo tuvieron un efecto sobre las variables de respuestas (Cuadro 1). Se observa que entre los tratamientos (sistemas de manejo del suelo), existe un efecto de ellos sobre la MO y Nt (Cuadro 1). La MO en el suelo en el sistema MIAF presentó incremento de 1.02% con relación al sistema labranza tradicional. Por las características del sistema MIAF, que dispone hileras de árboles intercalados entre bandas de cultivos que retienen sedimentos, se logra una zona en la que la preparación del terreno para la siembra es más sencilla que en la labranza tradicional. Además, el sistema MIAF minimiza la remoción de residuos de cosecha y favorece la acumulación de hojarasca en la parte superior de la hilera de árboles frutales. Todo ello contribuye a una acumulación de sedimentos y MO en la zona del filtro. Según la clasificación de MO de Velasco (1983), el suelo para el sistema MIAF es considerado como rico en MO mientras que los suelos en LC y LT son medianamente ricos.
Table 1: Average value of some chemical characteristics in the three tillage systems.
|
Propiedades químicas |
Medias de tratamientos |
||
|
LT |
LC |
||
|
pH |
5.5 a |
5.2 a |
5.1 a |
|
Materia orgánica (%) |
3.85 a |
2.83 b |
2.66 b |
|
N inorgánico (mg kg-1) |
83.81 a |
79.23 a |
74.28 a |
|
N total (mg kg-1) |
1923.6 a |
1417.6 b |
1327.9 b |
|
P (mg kg-1) |
23.96 a |
22.82 a |
18.75 a |
|
K (mg kg-1) |
210.26 a |
146.67 a |
146.67 a |
MIAF = promedio de las distintas zonas; LT = labranza tradicional; LC = labranza de conservación. Valores de medias con igual letra dentro de la misma fila son estadísticamente iguales (Tukey, 5%).
MIAF = average of the different areas; LT = traditional tillage; LC = conservation tillage. Mean values with equal letter within the same row are statistically equal (Tukey, 5%).
Para el caso de Nt, suma de N orgánico e inorgánico, este se acumula en los sistemas cuando se dejan en el terreno los residuos de cosecha. Por la magnitud de Nt de 1923 mg kg-1, se puede apreciar que es una reserva importante de N en el suelo que corresponde a 4.223 Mg ha-1 a 20 cm de profundidad. El N inorgánico en los tres sistemas de manejo fue similar, con promedio de 79 mg kg-1; sin embargo, a pesar de ser abundante la reserva de N en el suelo, su disponibilidad para los cultivos es baja (4.11% de Nt) en el sistema MIAF. De acuerdo con la calificación que reporta Moreno (1978), que un intervalo de 1500 mg kg-1 a 2200 mg kg-1 es indicativo de un alto contenido de nitrógeno en el suelo, acorde con este intervalo en el sistema MIAF el Nt es considerado como rico, a diferencia de LC y LT que están en la clase de suelos medianamente ricos. Jackson (1964) reporta que existe una proporción de 5% del Nt que es disponible para los cultivos, relación que es similar a los valores de N inorgánico obtenidos en el presente estudio.
En cuanto al contenido de P, no hubo diferencias estadísticas significativas entre sistemas de manejo. El método de extracción Bray-1 es uno de los estimadores de la reserva de P para los cultivos y en los tres sistemas. Cuando el pH es inferior a 5.5 el mecanismo de retención de P, por parte de minerales amorfos ricos en Al, se activan y fijan al elemento; por lo que disminuye su disponibilidad en la solución del suelo (Sparks, 2003).
En las cuatro zonas del sistema MIAF (Cuadro 2), el análisis estadístico del; pH, MO, Nt, P y K mostraron diferencias estadísticamente significativas. La ZF, al ser receptora de escurrimientos superficiales de las zonas ubicadas en la parte más alta del sistema MIAF, también capta las sales disueltas y las distintas fracciones de la MO, lo que propicia la inactivación de las especies de Al que hayan sido disueltas (Gerke, 1994). Como el Al disuelto es la fuente principal de H+ en la solución del suelo, al ser inactivado por la MO humificada, o al reaccionar con los fosfatos, propicia que el valor de pH ascienda hasta 5.5; valor de referencia que señala la inactivación del Al3+ (Bohn et al., 2001). El cambio en el valor del pH, al ser menos ácido, propicia mejores condiciones para el desarrollo de especies vegetales como el maíz y el frijol, por lo que al sistema MIAF se le puede atribuir que favorezca una mejor calidad del suelo y la posibilidad de cultivar una mayor variedad de especies vegetales.
Table 2: Average value of six soil chemical properties for the MIAF management system.
|
Propiedad quÍmica |
Zona de muestreo en el MIAF |
|||
|
Filtro1 |
Receptora2 |
Media3 |
Donadora1 |
|
|
pH |
5.5 a |
5.1 b |
5.1 b |
5.2 a |
|
Materia orgánica (%) |
6.38 a |
3.31 b |
3.19 b |
2.72 b |
|
N inorgánico (mg kg-1) |
108.9 a |
78.4 a |
76.7 a |
73.5 a |
|
N total (mg kg-1) |
3188.1 a |
1656.6 b |
1,596.9 b |
1361.5 b |
|
P (mg kg-1) |
36.4 a |
31.39 a |
20.83 b |
8.27 b |
|
K (mg kg-1) |
335.6 a |
185.6 b |
169.2 b |
164.4 b |
1, 2, 3, 4 zonas de muestreo (9, 9, 12 y 9 número de muestras obtenidas en cada zona, respectivamente). Valores de medias con igual letra en la misma fila, son estadísticamente iguales (Tukey, 5%).
1, 2, 3, 4 sampling zones (9, 9, 12 and 9 number of samples obtained in each zone, respectively). Mean values with equal letter in the same row, are statistically equal (Tukey, 5%).
En el presente estudio, se registraron apreciables diferencias en el contenido de MO en el sistema MIAF. Destaca el valor de 6.38% en la zona del filtro en comparación con el valor de las áreas media y donadora de 2.72% (Cuadro 2), representa un incremento de 3.66%. Dicha diferencia significa que dentro del sistema MIAF no se acumula MO en las zonas donadora y media; mientras que en el filtro que es donde se depositan los residuos de cosecha y restos de la poda de los frutales, se favorece el almacenamiento de materia orgánica. El contenido de Nt y la MO tuvieron una tendencia similar entre las distintas zonas del MIAF.
El incremento de 15.6 mg kg-1del P-Bray en el filtro, comparado con el P registrado en ZM, se relaciona con el cambio en el pH, cuando es más cercano a la neutralidad, el P se encuentra en formas solubles (Bohn et al., 2001; Sparks, 2003). El K intercambiable, cuantificado dentro del filtro, tiene el valor más alto comparado con el resto de las zonas del MIAF. Dicho incremento se debe a que, al ser un elemento móvil, se propicia su acumulación en la ZF. Resultados similares fueron reportados por Bertol et al. (2007) quienes evaluaron el contenido de P, K y carbono orgánico en el agua de escorrentía procedente de lotes bajo tres sistemas de labranza. Sus resultados indican que la labranza cero tiene mayores concentraciones de P, K y carbono orgánico en los sedimentos de escorrentía. De manera similar Procházka et al. (2019), en un experimento de largo plazo, encontraron que en el agua de escurrimiento captada en tres cuencas se incrementó el contenido de diversos iones, entre ellos el K.
Respiración (CO2) por tratamiento y sistema de manejo. La respiración, medida en el Oxitop, registrada después de incubar las muestras del suelo del filtro por 10 días, tuvo valores cercanos a 90 mg de CO2 por kg. Este valor contrasta con la respiración en otras zonas de muestreo del MIAF y los otros sistemas de manejo, principalmente porque en esta zona se presenta mayor cantidad de MO acumulada y mineralizada; proveniente de residuos de cosecha, podas y caída de hojas. La cantidad de CO2 producto de la respiración, en las distintas zonas de la parcela de MIAF, disminuyó de la siguiente manera: ZF > ZM > ZR > ZD; lo cual tiene concordancia con las concentraciones de MO en el suelo (Figura 2).

En el Cuadro 3 se muestran los valores de carbono; CO2, desprendido, almacenado y desprendido orgánico en el suelo, por hectárea. En el sistema MIAF en la zona del filtro desprende mucho más C que los sistemas LC y LT, debido a una mayor cantidad de residuos de cosecha, lo cual concuerda con la actividad metabólica de los microorganismos (Figura 3) en esta zona del MIAF. Gałązka y Furtak (2019) mencionaron que la actividad microbiana está directamente relacionada con la concentración de sustratos utilizables por los microorganismos; en este caso, materia orgánica.
Table 3: Carbon detached from respiration in all three production systems.
|
Zona muestreada |
CO2 |
|||
|
mg kg-1 |
- - - - Mg ha-1 - - - - |
% |
||
|
Donadora |
55.19 |
0.033 |
34.23 |
0.10 |
|
Filtro |
563.62 |
0.338 |
81.37 |
0.42 |
|
Media |
84.76 |
0.051 |
35.29 |
0.14 |
|
Receptora |
77.82 |
0.047 |
46.89 |
0.10 |
|
LTLT |
67.89 |
0.041 |
36.51 |
0.11 |
|
77.5 |
0.047 |
34.20 |
0.14 |
|
|
781.39 |
0.469 |
185.04 |
0.76 |
|
† MIAF = total de todas las zonas del sistema. LT = labranza tradicional; LC = labranza de conservación; CD = carbono desprendido; CAS = carbono almacenado en el suelo; COD = carbono orgánico desprendido con respecto al almacenado en el suelo.
† MIAF = total of all zones in the system. LT = traditional tillage; LC = conservation tillage; CD = carbon detached; CAS = carbon stored in the soil; COD = organic carbon released with respect to that stored in the soil.

Diversidad microbiana.Se observaron cambios en la actividad metabólica, estimada a partir del AWCD, en cada uno de los diferentes sitios de muestreo. En ZF se encontró la mayor actividad metabólica de microorganismos (Figura 3), debido a una mayor cantidad de MO (6.38%) y al consumo que hacen de los sustratos de MO disponibles las comunidades microbianas (Gałązka y Furtak, 2019); además, coincide con la producción de CO2 (García, 2008) obtenida en los sitios de muestreo por descomposición de la MO.
En el sistema MIAF, el índice de Shannon-Weaver tendió a ser mayor que en LC y LT (Figura 4), los grupos funcionales pertenecientes al ciclo del N en los su465 presentaron un aumento evidente en ZF, comparado con ZM y ZD del sistema MIAF, mientras que los valores más bajos se presentaron en LT y LC. En este sentido, los valores más bajos de respiración se presentaron en ZD del sistema MIAF, y en los sistemas LT y LC, en ese orden decreciente. Al respecto, Dumontet et al. (2017) determinaron que las placas Biolog EcoPlate (y los índices de diversidad que se calculan a partir de estas placas, “Shannon-Weaver” por ejemplo), la respiración biológica y los conteos de microorganismos (cuenta viable) son excelentes indicadores de la fertilidad biológica en suelos ácidos adicionados con abonos orgánicos.

Así mismo, esta mayor actividad de grupos funcionales de microorganismos encontrada en ZF del sistema MIAF, en la que también otras variables presentaron valores destacados como; pH más cercano a neutro y mayores contenidos de MO, N inorgánico, N total, P total, P extractable y K.
Conclusiones
- El sistema de manejo del suelo milpa intercalada con árboles frutales (MIAF), desde el punto de vista de las propiedades químicas y biológicas evaluadas, propició que ciertos sectores del terreno incrementen su magnitud, mientras que en otras zonas sus valores se mantienen relativamente constantes.
- Como indicadores biológicos, la diversidad metabólica y la diversidad de microorganismos mostraron cambios en la diversidad funcional de las comunidades microbianas en los diferentes sistemas de producción.
- La pérdida de carbono orgánico, desprendido como CO2, es baja respecto a la magnitud de carbono almacenado en el suelo a pesar de ser más alta la actividad microbiana en el sistema MIAF.
- Las propiedades químicas del suelo, a lo largo de la zona de filtro del MIAF, son más favorables para la producción agrícola.











 nova página do texto(beta)
nova página do texto(beta)



