Introducción
La salinidad afecta el crecimiento y desarrollo de las plantas, limita su producción de biomasa y distribución espacial. En opinión de Flowers y Colmer (2008), las especies sensibles a sales como la mayoría de las plantas cultivadas, toleran un intervalo de conductividad eléctrica (CE) de 2 a 4 dS m-1 en la solución del suelo. Las moderadamente tolerantes crecen y tienen rendimientos aceptables a CE de 4 a 6 dS m-1, como el sorgo forrajero (Sorghum vulgare) y el algodón (Gossipium hirsutum); mientras que las tolerantes crecen y desarrollan a CE de 6 a 12 dS m-1, como la remolacha azucarera (Beta vulgaris) y la cebada (Hordeum vulgare). La mayoría de las leñosas perennes toleran de 2 a 4 dS m-1 de CE en sus distintas etapas de crecimiento (Taleisnik y López, 2011). Al respecto Qadir et al. (2008) indican que los géneros Prosopis, Acacia y Casuarina, toleran hasta 6 dS m-1 de CE. Halófitas como el mangle negro (Aviccenia germinans) toleran > 65 dS m-1 de sal (Sánchez et al., 2019a). En el valle costero de Oaxaca predomina la sal NaCl aportada por aguas de escorrentía, intrusión marina y aguas freáticas (Sánchez et al., 2012). En esta zona, la Selva Baja Caducifolia (SBC) ha sido perturbada por sabanización, riego con aguas salinas y contaminación por agro insumos. Estas condiciones y la evaporación excesiva, son ideales para que las sales minerales de la napa freática asciendan por capilaridad a la superficie del suelo y formen manchones salinos (Ortega et al., 2016). En algunos sitios las concentraciones salinas son > 6.4 g L-1, no tolerables por especies leñosas como Tabebuia rosea y Gliricidia sepium, que colonizan suelos degradados. La primera es considerada una especie secundaria inicial y la segunda como pionera (Pennington y Sarukhán, 1998; Rocha et al., 2010). De acuerdo a Munns y Tester (2008) ambas especies toleran < 2.56 g L-1 de sal y al exceder este nivel evidencian trastornos anatómicos y fisiológicos que limitan su crecimiento e impiden su establecimiento en suelos marginales. El objetivo de la investigación fue evaluar el crecimiento de plantas de las especies señaladas, en soluciones de NaCl con diferentes concentraciones, a f in de determinar su umbral de tolerancia a sales. Los resultados serán útiles para considerar la posible repoblación de estas especies en suelos afectados por sales de la costa de Oaxaca.
Materiales y Métodos
Caracterización del área de estudio
El experimento se realizó en el invernadero del jardín Botánico Chepilme de la Universidad del Mar, en San Pedro Pochutla, Oaxaca, con coordenadas 96° 26’ 48.93” O y 15° 46’ 14.49” N, a una altitud de 160 m (Figura 1). Es una zona de bajo lomeríos con suelos regosoles eutricos (Sánchez et al., 2014). La vegetación es SBC en regeneración por especies como Rosa María (Tecoma stans L.), Carnero (Coccoloba barbadensis Jacq.), Parota (Enterolobium cyclocarpum Jacq.), Tololote (Andira inermis Wright), Carnizuelo (Acacia cornígera L. Willd.), Pata de venado (Bauhinia divaricata L.), Suchicahue (Cordia alliodora), Huizache (Acacia farnesiana L. Willd.) y Cocuite (Gliricidia sepium), entre otros. El invernadero es de plástico tipo túnel con superficie de 86 m2. El clima es cálido subhúmedo con lluvias en verano de menor humedad Aw0 (w); la temperatura media anual es de 29 °C y la lluvia promedio anual varía de 900 a 1000 mm (INEGI, 2010).
Colecta, almacenamiento y tratamiento pre germinativo de semillas
Abarcó los meses de abril y mayo para Gliricidia sepium, mientras que para Tabebuia roseae se colectó a finales de junio, ambos de 2015. Las semillas se colectaron de diez árboles de cada especie en estado fitosanitario sano (Gold et al., 2004), en sitios de Puerto Escondido y Bajos de Chila, Agencias Municipales de San Pedro Mixtepec, Oaxaca. Para Tabebuia rosea se eligieron árboles con fuste recto, alturas de 12 a 15 m y diámetros de 28 a 30 cm. Las vainas se colectaron al presentar un cambio de coloración verde a café. La dehiscencia se logró mediante secado de semillas al sol durante setenta y dos horas y flujo de aire constante. Las semillas de Gliricidia sepium se seleccionaron de árboles con alturas de 10 a 12 m y fuste ramificado. La humedad nocturna se controló cubriendo la semilla con una lona. La semilla se extrajo de manera manual y se limpió de impurezas. En las de Tabebuia rosea, se eliminó la parte alada. Posteriormente, para prolongar su viabilidad, las semillas de ambas especies se almacenaron en seco a 4 °C de temperatura en bolsas de polietileno transparentes selladas (Roberts, 1973). Enseguida se realizó un tratamiento pre-germinativo de la simiente de ambas especies, embebiéndolas en agua destilada durante 24 h, el objetivo fue homogeneizar su periodo de emergencia (Quinto et al., 2009; Chan et al., 2012).
Preparación de macetas experimentales y variables de crecimiento evaluadas
En invernadero se establecieron cuarenta y dos macetas experimentales conteniendo 1.5 kg de agrolita y una cubierta de tezontle de 2 cm de espesor. A cada maceta se aplicaron 2 L de solución salina. En cada tratamiento se sembraron tres semillas por maceta, a distancia de 15 cm entre ellas y profundidad de 2.5 cm. Los tratamientos utilizaron soluciones de NaCl disueltas en agua destilada a concentraciones de 1.28 g L-1 (C1), 2.56 g L-1 (C2), 3.84 g L-1 (C3), 5.12 g L-1(C4), 6.40 g L‑1 (C5) y 7.68 g L-1 (C6), que en teoría disminuyen el crecimiento vegetal en el orden de 0% (C1), 25% (C2), 50% (C3), 75% (C4), 100% (C5) y 150% (C6) (Maas y Hoffman, 1977). Además, se utilizó un testigo (C0) con agua destilada. Los tratamientos se diseñaron como experimentos independientes en un modelo bloques al azar con tres réplicas por tratamiento. Las soluciones salinas se prepararon en el área de análisis de suelos y aguas del laboratorio de Tecnología de la Madera de la Universidad del Mar Campus Puerto Escondido, donde se les determinó el pH con un potenciómetro marca® Hanna modelo HI98129, CE en dS m-1 con un conductímetro marca® Oakton y el potencial osmótico (Ѱπ) en MPa mediante la igualdad propuesta por Richards (1985): Ѱπ (Mpa) = -0.036 × CE. También se preparó una solución nutritiva de Steiner (1984) con fórmula 24-8-16, la cual fue vertida a cada uno de los contenedores de las soluciones salinas. Además, se protegió a las plántulas contra fungosis, mediante Captan a razón de 2 g L-1 de solución, a la siembra y 14 días después de esta. El riego consistió en reponer el agua consumida por evapotranspiración cada tercer día, a f in de mantener las macetas a peso constante. El experimento se realizó del 25 de agosto de 2015 al 4 de enero de 2016 y comprendió las etapas de emergencia y crecimiento vegetativo inicial de plántulas. Las temperaturas en el invernadero fueron de 29 a 32 °C. La emergencia se consideró al momento en que las hojas embrionarias y el tallo fueron visibles sobre el sustrato. Para evaluar crecimiento se dejó la planta más vigorosa en cada maceta, es decir se evaluaron tres plantas por tratamiento. La emergencia se evaluó en un periodo de 20 días. También se realizaron determinaciones de altura de plantas y número de hojas por planta a los 20, 76 y 132 días después de la emergencia (DDE). El análisis de crecimiento consideró el número de hojas maduras, la longitud del tallo desde la superficie del sustrato hasta el ápice del tallo (cm), la tasa de incremento de longitud del tallo mediante la fórmula TIL= LT 2 − LT 1 t 2 − t 1 donde LT2 y LT1: longitud del tallo principal al final y al inicio de un periodo determinado; t2 y t1: tiempo final e inicial del periodo dado. La longitud de la raíz se midió desde la yema axilar de la unión tallo - raíz, hasta el ápice más distante. El diámetro de la raíz se midió en su unión con el tallo, mediante el uso de un vernier marca® Stainless hardened. La acumulación de biomasa consideró el peso seco de la raíz y de la parte aérea (tallo y hojas) y el peso seco total por planta mediante calcinación en mufla a 104 °C. También se calibró un modelo logarítmico de predicción del peso seco total de plantas (PST) en función de la concentración salina, mediante la ecuación Y = A ln(x) + B, donde: Y = peso seco total de la planta (g), A = ordenada al origen, B = pendiente de la recta o número de unidades (g) que incrementa o disminuye el PST por unidad de incremento salino en la solución, x = concentración salina de la solución (g L-1). Diferencias significativas entre tratamientos se obtuvieron mediante análisis de varianza, con el modelo Duncan α = 0.05 y el paquete estadístico SAS (2006).
Resultados y Discusión
Efecto de la salinidad en la emergencia de plántulas
La sal NaCl retrasó de manera diferencial la emergencia de plántulas de ambas especies al incrementar el nivel salino. Las de Tabebuia rosea iniciaron emergencia ocho días después de la siembra (DDS). Las plántulas testigo presentaron una emergencia de 55.55%; que disminuyó a 33.33% en plántulas sometidas a 1.28 g L-1 de concentración salina. En el Cuadro 1 se observa que la emergencia de estas plántulas se retrasó 14 días, transcurridos los cuales el porcentaje de emergencia fue de 100% para el testigo, que disminuyó hasta 11.11% a 5.12 g L-1 de concentración. La emergencia fue inhibida a concentraciones de 6.40 y 7.68 g L-1. Este comportamiento permaneció hasta el final del periodo evaluado (20 DDS). Por su parte las plántulas testigo de Gliricidia sepium, así como las sometidas a concentraciones de 1.28 y 2.56 g L-1, emergieron 5 DDS y registraron porcentajes de 66.66, 55.55 y 55.55% respectivamente. A mayores concentraciones no se registró emergencia. En las plantas testigo, como en las sometidas a los dos primeros niveles salinos, esta incrementó a 100% 14 DDS, y disminuyó en el orden 77.77% > 66.66% > 22.22% > 11.11% a salinidades de 3.84, 5.12, 6.40 y 7.68 g L-1, respectivamente. El porcentaje de emergencia permaneció hasta el final del periodo evaluado. El análisis estadístico indica que la emergencia de plántulas de ambas especies de 0 a 2.56 g L‑1 fue significativamente superior al resto de los tratamientos con P = 0.05. Los resultados indican que las semillas de Tabebuia rosea son muy sensibles al estrés salino, mientras que las de Gliricidia sepium son sensibles a dicho estrés. Al incrementar el nivel salino, ambas retrasaron catorce días la emergencia, cuyo porcentaje disminuyó. El efecto fue más pronunciado en semillas de Tabebuia rosea cuya emergencia se inhibió a más de 5.12 g L-1. Investigadores como Flowers y Yeo (1995) y Bazzigalupi et al. (2008), opinan que las semillas de muchas glicófitas, reducen 25% su porcentaje de germinación y emergencia cuando se les expone a CE de 2 a 4 dS m-1, mientras que soluciones salinas > 4 dS m-1 reducen 50% estas etapas del crecimiento. Estudios de Ramírez et al. (2014) con plantas de Tabebuia serratifolia (Vahl) a diversos niveles salinos de NaCl, demostraron que la germinación y emergencia no fueron afectados por CE < 6.0 dS m-1 en la solución salina del sustrato, mientras que CE de 8 a 10 dS m-1 disminuyeron 55.2% la emergencia. Estudios de Mendoza et al. (2001) con semillas de Gliricidia sepium sometidas a diversas concentraciones de NaCl, indican que a CE de 4.4 dS m‑1 se presentó una emergencia de 99.8%, en contraste a CE de 14.9 dS m-1, la emergencia se redujo 56%.
Cuadro 1: Porcentaje de emergencia de plántulas de Tabebuia rosea y Gliricidia sepium,
sometidas a diversas concentraciones de soluciones de
NaCl.
Table 1: Emergency percentage of
Tabebuia rosea and Gliricidia sepium seedlings, subject to
various concentrations of NaCl solutions.
| Especie | Concentración salina | CE medida | pH | Ѱπ † | Porcentaje de emergencia | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| 5 | 8 | 11 | 14 | 17 | 20 | |||||
| g L-1 | dS m-1 | MPa | - - - - - - - - Días después de la siembra (DDS) - - - - - - - - | |||||||
| Tabebuia rosea B | ||||||||||
| 0.00 | 0.00 | 6.90 | 0.00 | 0.00 | 55.55 | 100.00 | 100.00 | 100.00 | 100.00 a2* | |
| 1.28 | 2.38 | 5.57 | -0.08 | 0.00 | 33.33 | 66.66 | 77.77 | 77.77 | 77.77 a* | |
| 2.56 | 4.48 | 5.53 | -0.16 | 0.00 | 0.00 | 55.55 | 66.66 | 66.66 | 66.66 ab | |
| 3.84 | 6.10 | 5.57 | -0.21 | 0.00 | 0.00 | 33.33 | 55.55 | 55.55 | 55.55 ab | |
| 5.12 | 8.22 | 5.60 | -0.29 | 0.00 | 0.00 | 0.00 | 11.11 | 11.11 | 11.11 ab | |
| 6.40 | 10.20 | 5.78 | -0.36 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00b | |
| 7.68 | 12.28 | 6.10 | -0.44 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00b | |
| Gliricidia sepium A1* | ||||||||||
| 0.00 | 0.00 | 6.90 | 0.00 | 66.66 | 88.88 | 88.88 | 100.00 | 100.00 | 100.00a* | |
| 1.28 | 2.38 | 5.57 | -0.08 | 55.55 | 88.88 | 88.88 | 100.00 | 100.00 | 100.00a* | |
| 2.56 | 4.48 | 5.53 | -0.16 | 55.55 | 77.77 | 88.88 | 100.00 | 100.00 | 100.00a* | |
| 3.84 | 6.10 | 5.57 | -0.21 | 0.00 | 55.55 | 66.66 | 77.77 | 77.77 | 77.77b | |
| 5.12 | 8.22 | 5.60 | -0.29 | 0.00 | 44.44 | 55.55 | 66.66 | 66.66 | 66.66b | |
| 6.40 | 10.20 | 5.78 | -0.36 | 0.00 | 0.00 | 11.11 | 22.22 | 22.22 | 22.22c | |
| 7.68 | 12.28 | 6.10 | -0.44 | 0.00 | 0.00 | 0.00 | 11.11 | 11.11 | 11.11c | |
† Ѱπ = potencial osmótico; 1 A, B = prueba de medias entre especies y CE; 2 a, ab, b: Prueba de medias entre concentraciones salinas y porcentaje de emergencia 20 DDS (Pr > F = 0.010). Medias con la misma letra no son significativamente diferentes. * Significancia estadística (Duncan, α = 0.05).
† Ѱπ = osmotic potential; 1 A, B = test of means between species and CE; 2 a, ab, b: Test of means between saline concentrations and emergency percentage 20 DDS (Pr > F = 0.010). Means with the same letter are not significantly different. * Statistical significance (Duncan, α = 0.05).
La respuesta diferencial de las semillas de ambas especies a germinar y emerger en condiciones salinas, está relacionada con el potencial genético de tolerancia al estrés salino de cada especie. Para Mudgal et al. (2010) la ontogenia de cada especie es un factor decisivo en su tolerancia a sales. En condiciones naturales las semillas de ambas especies presentaron un periodo de emergencia de cinco días, que indica que la salinidad si retrasó esta etapa del crecimiento, en lo fundamental por el estrés osmótico y tóxico que produjo la sal NaCl en el tejido seminal, pues como señalan Taiz y Zeiger (1998) y Sánchez et al. (2019b), el estrés salino origina una disminución de la actividad química del agua al interior de la semilla, que deshidrata el tejido seminal en contacto con la solución salina.
Esta sequía fisiológica se acompaña de efectos tóxicos producidos por la excesiva absorción de iones sodio y cloro al interior de las células, que inhiben procesos enzimáticos importantes como la síntesis de nitrato reductasa y poliaminas, esenciales para que el tejido seminal promueva la germinación y la emergencia de plántulas. En este sentido, Azcón y Talón (2013) indican que la salinidad del medio de crecimiento, reduce el potencial osmótico entre el sustrato y la superficie de la semilla que restringe la imbibición de agua y retarda la activación y síntesis de enzimas, así como la movilización de sustancias seminales de reserva hacia zonas de crecimiento del eje embrionario, todo lo cual retardó la emergencia de plántulas.
Efecto en la longitud del tallo
En la Figura 2 se observa un efecto natural del crecimiento de las plantas de Tabebuia rosea y Gliricidia sepium, ya que la longitud del tallo incrementó en el tiempo. En efecto, 132 DDE las plantas testigo de ambas especies registraron la mayor altura con 13.10 y 16.80 cm, respectivamente. Sin embargo, el crecimiento longitudinal del tallo disminuyó al incrementar el nivel salino, ya que plantas de Tabebuia rosea alcanzaron 6.70 cm de altura a una concentración de 1.28 g L-1, mientras que a 6.40 y 7.68 g L-1 de sal, el crecimiento fue inhibido. Por su parte las plantas de Gliricidia sepium alcanzaron alturas promedio de 11.20 cm a 1.28 g L-1 de sal y redujeron su altura a 4.80 y 3.90 cm, cuando se les sometió a las máximas concentraciones. Esto indica diferencia del crecimiento de dichas especies, que depende de su ontogenia y capacidad para tolerar la salinidad (Flowers y Colmer, 2008). La tasa de incremento longitudinal (TIL) del tallo en ambas especies, 20 a 132 DDE disminuyó con incrementos de concentración salina. En Gliricidia sepium la TIL fue de 0.13 para el testigo, tasa que disminuyó a valores de 0.01 a una concentración de 7.68 g L-1. En ese mismo periodo, las plántulas de Tabebuia rosea registraron una TIL de 0.10 para el testigo, que disminuyó a valores de 0.01 a una concentración de NaCl de 5.12 g L-1. A mayor salinidad la TIL fue de 0, que se asocia a la inhibición de la germinación de semillas de esta especie a concentraciones salinas > 6.40 g L-1. La inferencia estadística arrojó diferencia significativa de las plantas testigo con respecto a las crecidas en los diferentes niveles salinos (P = 0.05). Las plántulas de ambas especies crecidas en el nivel 1.28 g L-1, fueron estadísticamente superiores a las sometidas al resto de las salinidades. La disminución del crecimiento del tallo en condiciones de estrés salino, se debe a que las células vegetales disminuyeron la producción de protoplasma, la división celular y la elongación de células meristemáticas, en lo fundamental por alteración del equilibrio homeostático y el daño tóxico provocado por la excesiva concentración de iones sodio y cloro en el citoplasma celular, tal y como lo observaron Sánchez et al. (2013) y Can et al. (2014) en plantas de papa y fríjol, sometidas a salinidad clorhídrica.
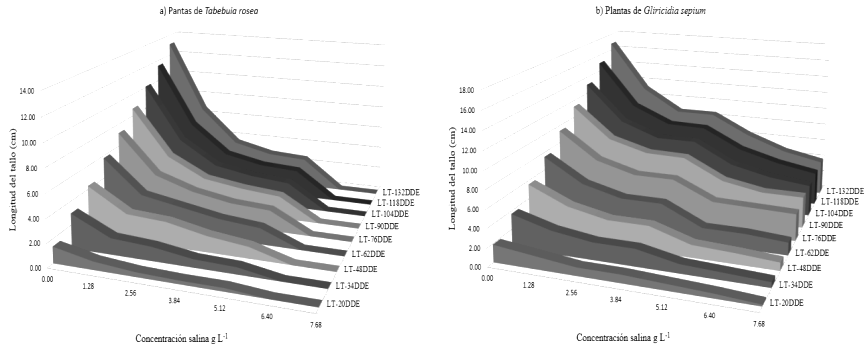
Figura 2: Longitud del tallo de plantas de a) Tabebuia roseae y b) Gliricidia sepium
crecidas diversos días después de la emergencia (DDE) en
soluciones de NaCl.
Figure 2: Plant stem
length of a) Tabebuia roseae and b) Gliricidia sepium grown
several days after the emergency (DDE) in NaCl
solutions.
La salinidad afectó la expansión unidireccional y longitudinal del tallo, como resultado se formaron plantas enanas con pequeños órganos y escaso rendimiento. Por su parte Flowers y Yeo (1995) reportaron el decrecimiento de tallos de árboles frutales sensibles al estrés salino como limón (Citrus lemon), naranja (Citrus cinensis) y aguacate (Persea gratísmima L.). En especies forestales, Taleisnik y López (2011) indica que el incremento de concentración de NaCl afectó negativamente el grosor de la pared celular de vasos xilemáticos, disminuyó el número de vasos producidos, y el diámetro de las fibras del lumen, así como la elongación de los brotes apicales de árboles de guaje (Leucaena leucocephala), Morera (Morus alba) y cacahuanano Gliricidia sepium (Jacq), cuya altura decreció. De acuerdo a Mesa (2003), las etapas de emergencia y plántula de ambas especies fueron las más sensibles a NaCl.
Efecto en el diámetro del tallo
Se observa, en el Cuadro 2, que las plántulas de Tabebuia rosea y Gliricidia sepium presentaron una ligera tendencia a disminuir el diámetro del tallo con incrementos de concentración salina 132 DDE. En las plantas testigo de Tabebuia rosea, se registró un diámetro de tallo de 0.43 cm, que disminuyó progresivamente a valores de 0.21, 0.12, 0.10 y 0 cm en un intervalo de 1.28 a7.68 g L-1 de sal. En plántulas de Gliricidia sepium, el máximo diámetro de tallo se registró en las plantas testigo con 0.79 cm. Esta magnitud disminuyó a 0.53 cm en la salinidad de 1.28 g L-1, hasta 0.26 cm para la salinidad de 7.68 g L-1. Una disminución intermedia se registró en el resto de las concentraciones salinas, sin que exista diferencia significativa con P = 0.05 entre las plantas testigo y las sometidas a condiciones salinas de ambas especies. No obstante, las plantas de Gliricidia sepium presentaron una menor reducción del diámetro del tallo, comparado con las de Tabebuia rosea, probablemente debido a las diferencias ontogénicas de cada especie para tolerar la salinidad (Rawson et al., 1988). Experimentos de Mendoza et al. (2001), demostraron que plantas de Gliricidia sepium redujeron el diámetro del tallo hasta 0.43 cm cuando se les sometió a una salinidad de 16.1 dS m-1, reducción que es menor a la registrada en la concentración salina de 7.68 g L-1 de la presente investigación. En general, NaCl redujo el crecimiento en el diámetro del tallo, que se atribuye al estrés hídrico y osmótico que produce la sal en las células del cambium, las cuales se deshidratan, pierden turgor y reducen su expansión, lo que incide en la disminución del diámetro del tallo de muchas glicófitas (Kafkafi y Bernstein, 2002; Mora et al., 2004). En opinión de Heuer y Nadler (1998), altos niveles salinos disminuyen el potencial osmótico del citoplasma, lo cual aminora el agua disponible para la actividad biológica celular, que produce deshidratación y letargo en el crecimiento del vegetal, en consecuencia, la expansión celular se detiene. Se considera que esta disfunción celular por estrés salino, condicionó la expansión diametral del tallo.
Cuadro 2: Diámetro de tallo y longitud de raíz de plantas de Tabebuia rosea y Gliricidia
sepium, crecidas en soluciones de diversa concentración salina
de NaCl.
Table 2: Stem diameter and root
length of Tabebuia rosea and Gliricidia sepium plants, grown in
solutions of different saline concentrations of
NaCl.
| Especie | Concentración salina | Diámetro de tallo 132 DDE† | Parámetros estadísticos | Longitud de raíz 132 DDE | Parámetros estadísticos | No. de hojas 20 DDE | No. de hojas 76 DDE | No. de hojas 132 DDE | Parámetros estadísticos |
|---|---|---|---|---|---|---|---|---|---|
| g L-1 | cm | cm | |||||||
| Tabebuia rosea B | |||||||||
| 0.00 | 0.43a*2 | M = 0.13 | 12.95 a*3 | M = 3.67 | 3 | 5 | 7a*4 | M = 2 | |
| 1.28 | 0.21a | σ = 0.14 | 6.52ba | σ = 4.65 | 2 | 3 | 4ab | σ = 2.64 | |
| 2.56 | 0.12a | CV = 1.07 | 2.85b | CV = 1.26 | 2 | 3 | 2b | CV = 1.32 | |
| 3.84 | 0.10a | 2.21b | 2 | 1 | 1b | ||||
| 5.12 | 0.10a | 1.22b | 1 | 1 | 0b | ||||
| 6.40 | 0.00a | 0.00b | 0 | 0 | 0b | ||||
| 7.68 | 0.00a | 0.00b | 0 | 0 | 0b | ||||
| Gliricidia sepium A*1 | |||||||||
| 0.00 | 0.79a | M = 0.42 | 16.84 a* | M = 8.70 | 4 | 9 | 16a*2 | M =5.57 | |
| 1.28 | 0.53a | σ = 0.18 | 11.02ba | σ = 4.35 | 4 | 9 | 8 | σ = 5.22 | |
| 2.56 | 0.40a | CV = 0.42 | 8.60b | CV = 0.50 | 3 | 7 | 6 | CV = 0.93 | |
| 3.84 | 0.40a | 8.57b | 3 | 6 | 4 | ||||
| 5.12 | 0.31a | 7.00b | 3 | 3 | 2 | ||||
| 6.40 | 0.29a | 5.76b | 2 | 3 | 2 | ||||
| 7.68 | 0.26a | 3.15b | 2 | 3 | 1 | ||||
† DDE = días después de la emergencia. 1 A, B = Prueba de medias entre especies y concentración salina; 2 a, b, ab: Prueba de medias entre concentraciones salinas y la variable diámetro de tallo; 3 a, b, ab: Prueba de medias entre concentraciones salinas y la variable longitud de la raíz; 4 a, b, ab: Prueba de medias entre concentraciones salinas y la variable No. de hojas 132 DDE. * Significancia estadística (Duncan, α = 0.05). Medias con la misma letra no son estadísticamente diferentes.
† DDE = days after emergency. 1 A, B = Test of means between species and saline concentration; 2 a, b, ab: Test of means between saline concentrations and the variable stem diameter variable; 3 a, b, ab: Test of means between saline concentrations and the variable root length variable; 4 a, b, ab: Test of means between saline concentrations and variable No. of leaves 132 DDE variable. * Statistical significance (Duncan, α = 0.05). Means with the same letter are not statistically different.
Efecto en la longitud de la raíz
En el Cuadro 2, es notorio que el mayor crecimiento radicular, se presentó en las plantas testigo de ambas especies (12.95 cm en Tabebuia rosea y 16.84 cm en Gliricidia sepium). Conforme incrementó el nivel salino, la longitud de la raíz disminuyó. Así en la concentración de 1.28 g L-1, la raíz se elongó en plántulas de cada especie 6.52 cm y 11.62 cm, respectivamente. La disminución fue consistente y progresiva de 2.56 g L-1 a 7.68 g L-1, ya que este órgano se redujo de 2.85 a 0.00 cm para Tabebuia rosea, y de 8.60 a 3.15 cm en plantas de Gliricidia sepium que presentaron mayor desarrollo longitudinal de la raíz. No obstante, en las máximas concentraciones salinas se observaron tejidos radiculares dañados por efectos cáusticos y necrosis. En el nivel salino extremo, las plantas de Tabebuia rosea dejaron de formar raíces.
Ramírez et al. (2014) obtuvo similares resultados en plantas de esta especie, ya que reporta una reducción del crecimiento de raíces acompañada de signos de necrosis, a salinidades > 3.84 g L-1. El análisis estadístico indica que las longitudes de raíces de plantas testigo de ambas especies, son significativamente superiores con P = 0.05 a las del resto de plantas sometidas a salinidad. La evidencia experimental demuestra que la salinidad disminuyó la longitud de la raíz en ambas especies, la afectación varió según la capacidad de cada especie vegetal para tolerar el estrés salino. El fenómeno fue observado por Zhong y Laüchli (1994) en plantas de algodón y maíz sometidas a 100 mM de NaCl en el medio de crecimiento, quienes atribuyeron la diferencia en expansión longitudinal de tallo y raíz, a la ontogenia de cada especie para tolerar la sal, lo que sugiere que existen especies vegetales intolerantes, moderadamente tolerantes o tolerantes al medio salino y que incluso esta diferencia se presenta entre órganos vegetales (Mass y Hoffman, 1977; Sánchez et al., 2008). En leñosas como Persea gratísima Mill, Ramírez et al. (2014) reportaron decrecimiento de la raíz a partir de 0.1 g L-1 de NaCl, la reducción fue severa a concentraciones > 3.0 g L-1. En Prosopis ruscifolia Griseb, concentraciones > 300 mM de NaCl formaron raíces anormales, retorcidas y manchas pardo oscuras sobre los hipocótilos (Bravo et al., 2016). Es probable que la mayor tolerancia a sales de Gliricidia sepium, esté relacionada con el hecho de que en las etapas iniciales presenta un crecimiento rápido poco sostenido que le permite evadir de manera temporal el estrés salino (Sánchez et al., 2019b). De acuerdo a Kafkafi y Bernstein (2002), la salinidad inhibe el crecimiento de la raíz, ya que las zonas de división celular y de elongación encargadas de aumentar el número y expansión celular de este órgano en forma unidireccional y longitudinal, responden al estrés con disminución del crecimiento.
Por su parte Azaizeh et al. (1992) observaron en plantas de pino sometidas a 3 g L-1 de NaCl, que las regiones meristemática y de alargamiento de la raíz, localizadas la primera a un milímetro de la yema radical y la segunda de tres a seis milímetros de la cofia, fueron severamente dañadas por la sal, toda vez que el tamaño final de las células y la división celular, se redujeron. De acuerdo a Bravo et al. (2016), en Prosopis ruscifolia, el diámetro de las raíces del cilindro central, la médula, el espesor de la hipodermis, el número de estratos celulares en la corteza y el periciclo, así como el diámetro tangencial de los vasos del polo de la xilema, decrecieron significativamente a concentraciones > 100 mM de NaCl. El decrecimiento de la raíz por efecto de soluciones de NaCl, también es señalado por Taleisnik y López (2011) en plantas leñosas del género Acacia y en arbustos del género Atriplex, en las que se afectó la magnitud de la expansión celular y el tamaño de la zona de elongación. Por su parte, Kafkafi y Bernstein (2002), indican que, ante el estrés salino, las células radicales dejan de sintetizar substancias promotoras del crecimiento.
Efecto en el número de hojas
En el Cuadro 2, se observa que las plantas testigo de Tabebuia rosea y Gliricidia sepium formaron en promedio el mayor número de hojas 132 DDE (7 y 16 hojas respectivamente), mientras que el número de hojas por planta disminuyó en forma diferencial con cada incremento salino. En el caso de Tabebuia rosea el número de hojas decreció de 4 a 0 en un intervalo de concentración de 1.28 g L-1 a 7.68 g L-1. Por su parte las plantas de Gliricidia sepium presentaron similar disminución en el número de hojas al incrementar el nivel salino, pero la diferencia cuantitativa fue de 8 a 1 hojas en el mismo intervalo de concentración. Esta diferencia fue significativa entre especies, ya que las plantas de Gliricidia sepium en igualdad de condiciones salinas produjeron mayor número de hojas que las de Tabebuia rosea. Así mismo, las plantas testigo de ambas especies son estadísticamente superiores a las crecidas en los diferentes niveles salinos. Entre niveles salinos la concentración que menos disminuyó el número de hojas por planta de ambas especies, fue la de 1.28 g L-1 estadísticamente superior al resto de las concentraciones (P = 0.05). Al igual que las otras variables medidas, el número de hojas aminoró conforme aumentó la concentración salina, lo que está asociado a un retraso de la formación del sistema foliar que presentó escaso número de hojas 132 DDE, por ejemplo, a concentraciones de 6.40 a 7.68 g L-1, las plantas de Tabebuia rosea no formaron hojas, ya que la germinación de las semillas fue inhibida a dichas concentraciones. Por su parte, las plantas de Gliricidia sepium formaron un escaso número de hojas a los mismos niveles salinos. Este desarrollo foliar no guarda relación con el que forman las plantas de ambas especies en condiciones naturales, ya que el número de hojas en la etapa de plántula para Tabebuia rosea y Gliricidia sepium es de 10 y 20 hojas, respectivamente (Navas et al., 2000). La reducción del sistema foliar por efecto de NaCl ha sido reportada por Poljakoff y Lerner (1994) y Can-Chulim et al. (2017), quienes coinciden en señalar que el crecimiento y desarrollo del tejido foliar se reduce ante el incremento salino, en primer término por un efecto de plasmólisis celular en el que el protoplasma se desprende de la pared celular y ocurre una ruptura de las conexiones intercelulares, por lo que la célula vegetal entra en un estado de quiescencia en el que se detiene la producción de nitrato reductasa y con ello la división celular y la elongación, lo que implica un retardo en la formación de foliolos. Sin embargo, cuando el sustrato es desalinizado, el protoplasma se integra de nuevo a la pared celular y los plasmodesmos son restaurados, entonces reanuda el crecimiento celular. Para Moorby y Milthorpe (1983), este proceso puede ser reversible o irreversible en función de la disposición de agua. Los efectos de la salinidad en el desarrollo vegetativo, dependen de la naturaleza de la sal, del estado de madurez de la planta, de la tolerancia del genotipo a la salinidad y de la disponibilidad de agua de la planta (Flowers y Colmer, 2008). El sistema foliar de las plantas experimentales, pudo ser atrofiado por el efecto de quiescencia a niveles salinos > 6.40 g L-1, en los cuales las plantas de Tabebuia rosea dejaron de producir órganos foliares, mientras que las de Gliricidia sepium presentaron una incipiente formación foliar. Otro factor que redujo el número de hojas de las plántulas de ambas especies, es la sequía fisiológica inducida por la sal NaCl. Ante esta deshidratación las hojas cierran sus estomas y ocurre una disminución de asimilación de bióxido de carbono, como secuela disminuye la tasa de producción fotosintética que incluso puede ser inhibida a bajas salinidades (Munns y Tester, 2008). La menor producción de fotosíntesis repercute en el decrecimiento de las células meristemáticas foliares, por lo que en el tiempo dejan de formarse renuevos. En suma, la salinidad afecta el área foliar fotosintéticamente activa y esto reduce el crecimiento. En condiciones salinas las hojas que realizan fotosíntesis dejan de hacerlo y se convierten en órganos de reserva de fotoasimilados, se avejentan y senecen como mecanismo de tolerancia a sales (Sánchez et al., 2019a).
Acumulación proporcional de biomasa en la parte aérea
La acumulación de biomasa en tallos y hojas de plantas de ambas especies, disminuyó al aumentar el nivel salino (Cuadro 3). La biomasa acumulada fue mayor en las plantas testigo de ambas especies con valores de 1.40 g planta-1 para plantas de Tabebuia rosea y 1.96 g planta-1 para las de Gliricidia sepium, valores significativamente superiores a los registrados en la parte aérea de plantas del resto de los tratamientos (P = 0.05). El tratamiento salino más sobresaliente en este rubro para ambas especies fue la concentración de 1.28 g L-1, en la que se produjo una acumulación promedio de biomasa de 0.80 g para plantas de Tabebuia rosea y de 1.0 g para plantas de Gliricidia sepium. Estos valores son superiores a los obtenidos en el resto de los tratamientos ensayados. La menor acumulación de biomasa en la parte aérea de plantas de ambas especies, se verificó a 6.40 g L-1 y 7.68 g L-1 de concentración, donde se registraron pesos de 0 g planta-1 para la primera especie y de 0.25 g planta-1 y 0.14 g planta-1 para la segunda. Entre especies, Gliricidia sepium acumuló más biomasa que Tabebuia rosea a igualdad de condiciones salinas. La acumulación proporcional de biomasa de plantas de estas especies expuestas a estrés salino, fue mayor en la parte aérea que en la raíz. En plantas de Tabebuia rosea esta acumulación fue de 62.5 a 59.25% del peso seco total a concentraciones salinas de 1.28 a 3.84 g L-1. Este porcentaje disminuyó a 48.14% a una concentración de 5.12 g L-1 de sal y a 0% a 6.40 y 7.68 g L-1 de sal. Por su parte las plantas de Gliricidia sepium acumularon biomasa en la parte aérea en un promedio de 65.71% respecto del peso seco total, a concentraciones de 1.28 a 3.84 g L-1 de NaCl. Esta acumulación disminuyó a 54.37% en plantas sometidas a 5.12 y 6.40 g L-1 de sal. Si bien es cierto que las plantas de Tabebuia rosea sometidas a salinidades de 1.28 a 3.84 g L-1 no presentaron diferencia. significativa en la acumulación de biomasa de la parte aérea, lo cierto es que esta reducción fue notoria a una concentración de 5.12 g L-1, donde la materia seca acumulada se redujo 23.66%. En las concentraciones salinas de 6.40 y 7.68 g L-1 la reducción fue del 100%. Similar comportamiento se observó en plantas de Gliricidia sepium a concentraciones de 1.28 a 3.84 g L-1, ya que no se presentó diferencia significativa en la acumulación de biomasa de la parte aérea respecto del testigo (P = 0.05). Sin embargo, una estimación porcentual indica que las plantas de esta especie, redujeron 17.85% la acumulación de biomasa respecto del testigo a concentraciones de 5.12 a 7.68 g L-1. Las plantas de ambas especies disminuyeron drásticamente la acumulación de biomasa de la parte aérea, Tabebuia rosea a concentraciones > 5.12 g L-1 y Gliricidia sepium a concentraciones de 7.68 g L-1. Se trata de umbrales de tolerancia en los que las plantas de la primera especie son sensibles a la salinidad clorhídrica, mientras que las de Gliricidia sepium se consideran moderadamente sensibles. Esto coincide con la clasificación de Maas y Hoffman (1977) para umbrales de tolerancia a sales. Observaciones semejantes fueron realizadas por Sánchez et al. (2008) en plantas de papa (Solanum tuberosum) cv. Alpha sometidas a diversos tipos de salinidad y niveles salinos y por Can-Chulim et al. (2017) en plantas de frijol (Phaseolus vulgaris L.). En opinión de Ramírez et al. (2014), la especie arbórea Tabebuia serratifolia redujo la acumulación de biomasa de la parte aérea a CE > 4.0 dS m-1 (2.56 g L‑1 de concentración salina); esta reducción se asoció a una disminución de disponibilidad de agua y nutrientes provocada por la sal en el medio de crecimiento (Sánchez et al., 2012; 2019b).
Cuadro 3: Efecto de las concentraciones de cloruro de sodio (NaCl) en la acumulación de
biomasa de parte aérea, raíz y peso seco total de plántulas de
Tabebuia rosea y Gliricidia sepium.
Table
3: Effect of sodium chloride (NaCl) concentrations on the
accumulation of biomass of aerial part, root and total dry
weight of seedlings of Tabebuia rosea and Gliricidia
sepium.
| Tabebuia rosea B | ||||||
|---|---|---|---|---|---|---|
| Salinidad | Parte aérea | Estadísticos | Raíz | Estadísticos | Peso seco total | Estadísticos |
| g L-1 | g planta-1 | g planta-1 | g planta-1 | |||
| 0.00 | 1.40 | M = 0.45 | 0.82 | M = 0.28 | 2.22a2* | M = 0.73 |
| 1.20 | 0.80 | σ = 0.49 | 0.48 | σ = 0.28 | 1.28b | σ = 0.78 |
| 2.56 | 0.35 | CV = 1.10 | 0.20 | CV = 1.0 | 0.55cb | CV = 1.07 |
| 3.84 | 0.32 | 0.22 | 0.54cb | |||
| 5.12 | 0.28 | 0.26 | 0.54cb | |||
| 6.40 | 0.00 | 0.00 | 0.00c | |||
| 7.68 | 0.00 | 0.00 | 0.00c | |||
| Gliricidia sepium A 1* | ||||||
| 0.00 | 1.96 | M = 0.71 | 0.93 | M = 0.39 | 2.89a* | M = 1.11 |
| 1.20 | 1.00 | σ = 0.63 | 0.45 | σ = 0.26 | 1.45b | σ = 0.89 |
| 2.56 | 0.78 | CV = 0.89 | 0.37 | CV = 0.67 | 1.15cb | CV = 0.80 |
| 3.84 | 0.64 | 0.42 | 1.06cb | |||
| 5.12 | 0.25 | 0.20 | 0.45c | |||
| 6.40 | 0.25 | 0.22 | 0.47c | |||
| 7.68 | 0.14 | 0.16 | 0.30c | |||
1A, B: Prueba de medias entre especies vegetales y concentraciones salinas; 2 a, b, cb, c: Prueba de medias entre concentraciones salinas y peso seco total de plantas (Pr > F = 0.0015). Medias con la misma letra no son significativamente diferentes. * Significancia estadística Duncan (α = 0.05).
1A, B: Test of means between plant species and saline concentrations; 2 a, b, cb, c: Test of means between saline concentrations and total dry weight of plants (Pr > F = 0.0015). Means with the same letter are not significantly different. * Duncan statistical significance (α = 0.05).
Acumulación de biomasa en la raíz
La acumulación de biomasa en la raíz tanto de plantas de Tabebuia Rosea como de Gliricidia sepium disminuyó al aumentar el factor salino. Esta tendencia se observa en el Cuadro 3. En las plantas testigo de Tabebuia rosea la acumulación promedio de biomasa radical fue de 0.82 g Pl-1 y decreció a 0.48 g Pl-1 hasta 0 g Pl-1 a concentraciones de 1.28 a 7.68 g L-1. Similar respuesta presentaron las plantas testigo de Gliricidia sepium donde la mayor acumulación promedio de biomasa en la raíz fue de 0.93 g Pl-1 que disminuyó a 0.45 g Pl-1 y 0.16 g Pl-1 respectivamente, al aumentar la salinidad de 1.28 g L-1 a 7.68 g L-1. Las plantas testigo de ambas especies fueron significativamente superiores a las crecidas en los tratamientos salinos con P = 0.05. En comparación a la biomasa acumulada en la parte aérea, la raíz en ambas especies, acumuló menos biomasa, al incrementar el nivel salino. En Tabebuia rosea, la acumulación de materia seca en promedio fue de 40.68% a concentraciones de 1.28 a 5.12 g L-1. A mayor salinidad se inhibió la acumulación de biomasa radicular, ya que las plantas no formaron raíces. Esto confirma que la raíz es uno de los órganos más vulnerables a condiciones salinas (Kafkafi y Bernstein, 2002). En este caso se observaron dos fenómenos, el primero es un ligero incremento en la acumulación de biomasa de las plantas crecidas en soluciones de NaCl de 1.28 a 3.84 g L-1, asociado a un crecimiento inicial poco sostenido de las plantas debido al efecto nutricional de la sal, de corta duración por el estrés osmótico y tóxico que produce al rebasar el umbral de tolerancia (Flowers y Colmer, 2008; Sánchez et al., 2019b). El otro tiene relación con disturbios en el abastecimiento de fotoasimilados de los órganos fuente hacia el órgano subterráneo, que al acumular menos biomasa limita su crecimiento. Así mismo las plantas de Gliricidia sepium acumularon más biomasa en la raíz que las de Tabebuia rosea, esto se debe a que algunas especies vegetales convierten las raíces en órganos de reserva como mecanismo de tolerancia a sales. Tabebuia rosea no tiene esta capacidad por lo que debe considerarse sensible a NaCl. La diferente tolerancia a NaCl de Tabebuia rosea y Gliricidia sepium también se observa en los valores del coeficiente de variación (CV) indicados en el Cuadro 3, ya que la concentración salina explica el 100% de la variación en acumulación de biomasa en la parte aérea y la raíz de plantas de Tabebuia rosea, mientras que en plantas de Gliricidia sepium esta variación es de 89% en la parte aérea y de 67% en la de la raíz, lo que indica que esta última tolera más la salinidad que la primera. Por su parte las plantas de Gliricidia sepium registraron en promedio 31.96% de materia seca acumulada respecto del peso seco total a concentraciones de 0 a 2.56 g L-1 de sal. Esta proporción aumentó a 46.04% hasta una concentración de 3.84 g L-1, después de lo cual el porcentaje de biomasa acumulada en la raíz decreció en forma notoria.
Predicción del PST de plantas experimentales en función de la concentración salina
Los modelos de calibración logarítmica de la Figura 3, predicen que el peso seco total que acumulan las plantas de las especies ensayadas, disminuye al aumentar la concentración de NaCl en solución. Entre especies, las de Tabebuia rosea redujeron más el peso seco total que las de Gliricidia sepium al aumentar la salinidad. Dada esta diferencia se considera que Tababeuia rosea presentó una menor tolerancia a NaCl que Gliricidia sepium. En opinión de Mendoza et al. (2005), esta última especie es capaz de colonizar suelos degradados por salinidad, factor abiótico que limita el crecimiento de otras especies. Por lo anterior, es prudente realizar más investigaciones que evalúen la tolerancia a sales de plantas de esta especie, en estadios de crecimiento subsecuentes al de plántula, a fin de observar y analizar su comportamiento en condiciones salinas por periodos de tiempo más prolongados, así como ensayar su plantación en zonas forestales costeras afectadas por sales. Los modelos propuestos, explican de manera satisfactoria el comportamiento de la acumulación de biomasa de las plantas experimentales en condiciones salinas. La escasa acumulación de biomasa en las plantas de ambas especies, es secuela de la reducción del crecimiento de la parte aérea y de la raíz por efectos salinos, que según Mudgal et al. (2010) resulta del cierre estomatal provocado por el estrés hídrico salino y la consiguiente sequía fisiológica, que origina una baja producción de foto asimilados en la hoja y una limitada distribución de carbohidratos y substancias nitrogenadas hacia la parte subterránea (Sánchez et al., 2013).
Conclusión
El estrés producido por la sal NaCl a concentraciones de 2.56 a 3.84 g L-1 retardó la emergencia de plántulas, disminuyó el crecimiento de tallos, hojas y raíces y redujo el peso seco total de plántulas de Tabebuia rosea y Gliricidia sepium. El decrecimiento fue severo a concentraciones > 5.12 g L-1. A mayor salinidad, se inhibió la germinación de semillas, por lo que se considera una especie sensible a NaCl en la etapa de plántula. Por su parte, las de Gliricidia sepium presentaron mayor tolerancia al estrés salino, ya que su crecimiento fue ligeramente superior, sin embargo, concentraciones > 6.40 g L-1 produjeron enanismo, por lo que se considera una especie moderadamente sensible a dicha sal.











 nueva página del texto (beta)
nueva página del texto (beta)





