Introducción
El género Lupinus pertenece a la familia Leguminosae, cuenta con más de 200 especies reportadas y su distribución a nivel mundial se localiza en el “Viejo Mundo” (Mediterráneo y África del Norte) y el “Nuevo Mundo” (Norte y Sur América) (Knight, 2009; Australian Government, 2013). En el estado de Jalisco (México) crecen de forma silvestre 10 especies del género Lupinus, entre ellas, L. exaltatus y L. rotundiflorus tienen potencial para ser utilizadas como forraje o abono verde (Ruiz-Moreno y Zamora-Natera, 2006; Zapata et al., 2019), principalmente por su característica de establecer la relación simbiótica con bacterias nativas del suelo y f ijar N atmosférico (N2), además de producir biomasa en temporada de bajas temperaturas y escasa precipitación (Herrera-Velazco et al., 2010; Zamora et al., 2019). Longa et al. (2017), reportaron la evidencia del aumento en la diversidad microbiana del suelo como respuesta al uso de abono verde; lo cual sugiere que dicho abono, puede emplearse para incrementar la actividad microbiana en el suelo.
En Jalisco, los cultivos agrícolas de mayor importancia son el maíz (Zea mayz L.) y el agave (Agave tequilana), generalmente se cultivan en condiciones de monocultivo en suelos de tipo Regosol y Luvisol (respectivamente). El suelo colectado para la investigación en la región de Zapopan (Regosol) y Amatitán (Luvisol) presentan bajo contenido de materia orgánica (MO) y nitrógeno (N) (Ibarra et al., 2007; Vivanco et al., 2010). Bajo el sistema de producción de monocultivo, es común el uso constante de agroquímicos y escasa aportación de enmiendas orgánicas. La aplicación de fertilizantes inorgánicos afecta negativamente la composición y riqueza de especies bacterianas y vegetales, producto de la acidificación del pH del suelo y la disponibilidad del nitrógeno en forma de amonio y nitratos (Zeng et al., 2016); lo que trae como consecuencia efectos negativos en el ciclo de la materia orgánica, la regulación de la población microbiana y su actividad (Bünemann et al., 2018). Los microorganismos del suelo desempeñan un papel vital en la dinámica edáfica a través de los procesos biológicos, esenciales para mantener la fertilidad del suelo y la productividad de los cultivos (Alvear et al., 2006; Cycoń et al., 2010). Además, los microorganismos son considerados como un indicador biológico y su monitoreo es mediante diferentes métodos: respiración de CO2, índices de biomasa (C y N de la biomasa microbiana), producción de NO3 -, entre otros (Bünemann et al., 2018).
Las especies vegetales utilizadas como AV juegan un papel esencial en la fertilidad y recuperación del suelo en los sistemas agrícolas, debido a su efecto a corto plazo en el suministro de nutrientes a los cultivos (Probert et al., 2005), mejoran la estructura del suelo, reducen la erosión, disminuyen perdidas de N por lixiviación, e incrementan la actividad biológica (Knight, 2009). Los AV con mayor potencial son las fabáceas o leguminosas, y los géneros más utilizados son: Vigna, Lablab, Vicia, Crotalaria, Indigofera, Rtothia, Tephrosia, Melilotus y Lupinus (García-Hernández, et al., 2010). Algunas especies de Lupinus han sido utilizadas y evaluadas como enmienda en diversos trabajos (Lora y Azero, 2005; Sivila de Cary y Hervé, 2006; Molina et al., 2011; Small, 2012). Barrientos et al. (2002), reportaron que las especies de Lupinus (L. albus y L. angustifolius) en simbiosis con bacterias f ijadoras de N atmosférico fijaron 39 y 25 kg de N ha-1 (respectivamente) a los 45 días después de la siembra, mientras que a los 80 días los valores de N fijado se incrementaron a 282 y 197 kg ha-1 (respectivamente); ambas especies son consideradas como mejoradoras del suelo. Por su parte, Stark et al. (2008) comprobaron que con la aplicación de 4 Mg ha-1 de residuos de L. angustifolius como AV al suelo, la actividad y la biomasa microbianas (C y N) se incrementó al menos dos veces más comparado al tratamiento sin aplicación de AV.
En México, la investigación relacionada a la aplicación de enmiendas al suelo y de los AV en particular, es un tema importante que se debe atender. Por lo anterior, el objetivo del presente estudio fue evaluar el uso de dos especies de leguminosas silvestres: Lupinus exaltatus y Lupinus rotundiflorus -del estado de Jalisco-, como abono verde (AV) y su efecto en la actividad microbiana del suelo. Para cumplir el objetivo, se realizó un estudio en condiciones de laboratorio y se monitoreo la actividad microbiana, en función de la respiración basal (CO2), y la biomasa microbiana (C-BM y N-BM).
Materiales y métodos
El experimento de incubación aeróbica se realizó en el laboratorio de Ingeniería Ambiental de la Universidad del Mar (campus Puerto Ángel, Oaxaca). El suelo empleado se colectó en campos agrícolas dedicados a la producción de maíz de temporal en el municipio de Zapopan (suelo Regosol); y otro dedicado al cultivo de agave (Agave tequilana) en el municipio de Amatitán (suelo Luvisol). En cada sitio se colectó una muestra compuesta de suelo; el terreno se dividió en diez cuadrantes para obtener submuestras (10) a una profundidad de 0-20 cm. La muestra se mezcló homogéneamente y previo a la caracterización físico-química (NOM-021-RECNAT-2000, 2002), el suelo se secó a temperatura ambiente y tamizó con malla de 2 mm de diámetro (Cuadro 1).
Cuadro 1: Características físicas y químicas del suelo Luvisol y Regosol, utilizados en el experimento de incubación aérobica.
Table 1: Physical and chemical characteristics of Luvisol and Regosol soil used in the aerobic incubation experiment.
| Determinaciones | Método | Luvisol | Regosol |
| pH | Potenciómetro | 5.05 | 4.60 |
| Materia orgánica % | Walkey-Black | 1.16 | 1.01 |
| Nitrógeno total % | Morgan | 0.11 | 0.10 |
| Arena % | Bouyoucos | 30.91 | 48.91 |
| Arcilla % | Bouyoucos | 43.09 | 17.09 |
| Limo % | Bouyoucos | 26.00 | 34.00 |
| C. E. milimhos cm-1 a 25 °C | Conductímetro | 0.18 | 0.13 |
| Densidad aparente g c.c-1 | Probeta | 0.97 | 1.09 |
C.E. = conductividad eléctrica. E.C. = electrical conductivity.
El material vegetal incorporado al suelo como enmienda fue, el abono verde de Lupinus rotudiflorus (AVR) y Lupinus exaltatus (AVE) y de Zea mays (AVM); las especies vegetales se cultivaron durante el ciclo de primavera-verano del 2016 en el campo agrícola experimental del Centro Universitario de Ciencias Biológicas y Agropecuarias (CUCBA, U. de G.) en Zapopan, Jalisco. La cosecha de las plantas fue en la etapa vegetativa, se secaron en estufa de aire forzado a 65 °C hasta obtener peso seco constante y posteriormente se molieron a un tamaño de partícula de 1 mm y se determinó el contenido de lignina mediante el método D 1106-56, el contenido de celulosa y hemicelulosa fue determinado por el método D 1103-60, (clave 1977a y 1977b, respectivamente) conforme a las normas establecidas por la American National Standard Institute (ANSI/ASTM) (Cuadro 2). La concentración de C y N se cuantificó con un analizador elemental CHSN-O Leco TruSpec® LECO Corporation.
Cuadro 2: Composición química de las especies vegetales utilizadas como enmienda: AVR, AVE y AVM, en el experimento de incubación aérobica (14 días).
Table 2: Chemical composition of the plant species used as an amendment: AVR, AVE and AVM, in the aerobic incubation experiment (14 days).
| Especie | C | N | C/N | Lignina | Celulosa | Hemicelulosa |
| - - - - - - % - - - - - - | - - - - - - - - - - - % - - - - - - - - - - - | |||||
| AVE | 42.48 | 3.06 | 14 | 19.85 | 35.69 | 17.35 |
| AVR | 39.52 | 3.26 | 12 | 18.62 | 35.09 | 17.38 |
| AVM | 42.02 | 1.74 | 24 | 7.52 | 38.30 | 26.57 |
AVR = abono verde de Lupinus rotudiflorus; AVE = abono verde de Lupinus exaltatus; AVM = abono verde de Zea mays.
AVR = green manure of Lupinus rotudiflorus; AVE = green manure of Lupinus exaltatus; AVM = green manure of Zea mays.
La evaluación de la actividad microbiana, a través de la respiración del CO2 y la cuantificación del C y N de la biomasa (C-BM y N-BM) se llevó a cabo con una incubación aeróbica del suelo por 14 días. Previamente, se realizó el acondicionamiento del suelo ajustando la humedad al 50% de su capacidad de retención de agua (CRA) agregando a cada suelo la cantidad necesaria de agua destilada, posteriormente se pre-incubo el suelo durante siete días para promover la actividad microbiana (Brookes et al., 1985). Transcurrido el tiempo de la pre-incubación, se pesaron 25 g de cada suelo y se mezcló con 0.4 g (base seca) de las diferentes enmiendas; para la cantidad adicionada de enmienda se consideró como referencia el equivalente a 36 Mg ha-1 con AV de Vicia sativa (Fabaceae) en mezcla con estiércol, probada por Pinto et al. (2017). Los tratamientos fueron AVE, AVR y AVM, y un control sin enmienda; la mezcla se colocó en frascos que fueron introducidos en jarras de 1 L junto con un vial que contenía 20 ml de NaOH 1M para atrapar el CO2 generado por la respiración microbiana. Para cada día de toma de muestra (0, 3, 7, 10, 14 días), se seleccionaron al azar tres replicas por cada tratamiento y el control; para determinar la producción de CO2 se utilizó el frasco con NaOH 1M; por otra parte, la muestra de suelo se dividió en dos partes para obtener las muestras fumigadas (con cloroformo) y las no fumigadas, y posteriormente determinar el carbono (C-BM) y nitrógeno (N-BM) de la biomasa microbiana.
El CO2 liberado durante la respiración microbiana del suelo se determinó por el método de titulación (Anderson, 1982). La determinación del C y N de la biomasa microbiana (C-BM y N-BM) fue por el método de fumigación-extracción con cloroformo (Vance et al., 1987).
El C-BM se determinó mediante el método de carbono orgánico extraíble (Alef y Nannipieri, 1995) y la cuantificación con la fórmula propuesta por Vance et al. (1987): C-BM = (CF-CNF)/Kc; CF: C orgánico extraído del suelo fumigado; CNF: C orgánico extraído del suelo no fumigado, Kc: fracción de la biomasa de C mineralizado a CO2 (0.45).
El N-BM se determinó por el método del N reactivo a ninhidrina (NRN) (Alef y Nannipieri, 1995), y calculado por la fórmula propuesta por Joergensen y Brookes (1990): N-BM = (NF-NNF)/Kc; NF: N extraído del suelo fumigado; NNF: N extraído del suelo no fumigado; Kc: Proporción microbiana de N mineralizado a NH4 + (0.54).
El análisis de los resultados se calculó con el programa estadística ver. 7.0; previo al análisis de los datos, se ejecutó la prueba de normalidad (Shapiro-Wilk test). Se realizó un análisis de varianza de medidas repetidas (RMANOVA), el factor principal fue la enmienda: AVR, AVE y AVM; y el tipo de suelo: Regosol y Luvisol; la variable dependiente fueron los días de incubación (día 1, 3, 7, 10 y 14). Los valores son expresados en base seca del suelo. La prueba post hoc de Fisher (LSD) se utilizó para la comparación de medias (P ≤ 0.05).
Resultados y discusión
Actividad microbiana del suelo
La biomasa microbiana total en el suelo incluye a todos los organismos vivos (latentes y activos) y muertos; la fracción activa es la porción de la biomasa microbiana total, involucrada en la utilización del sustrato, o bien, que responde fácilmente a la entrada de sustrato (Blagodatskaya y Kuzyakov, 2013); y la respiración microbiana es comúnmente usada para cuantificar la actividad metabólica de los microorganismos del suelo. En la incubación aeróbica por 14 días, la producción de CO2 presentó diferencias significativas (P ≤ 0.05) entre tratamientos, pero no para el tipo de suelo Regosol y Luvisol (Cuadro 3). El valor promedio de la producción de CO2 fue significativamente mayor en el suelo tratado con enmiendas en comparación al suelo control. Con el AVE, AVR y AVM, el promedio fue de 913.8, 898.0 y 737.4 mg kg-1 de CO2, respectivamente; el valor promedio del control fue 327.4 mg kg-1 de CO2; los resultados anteriores indican que la adición de enmienda contribuyó con una fuente de carbono disponible para incrementar la producción de CO2, presentando un efecto iniciador positivo. En la interacción entre suelo y tratamientos, la producción de CO2 en el control fue menor y significativamente diferente (326.5 y 328.2 mg kg-1 en el suelo Luvisol y Regosol, respectivamente) con respecto al tratamiento con enmienda (Cuadro 3). El tratamiento con AVM en el suelo Regosol produjo en promedio un 30% menos de CO2 con respecto a los tratamientos AVE y AVR. En el suelo Luvisol, la producción de CO2 fue significativamente diferente entre AVE, AVR y AVM, con valores de 904.3, 864.0 y 795.1 mg kg-1 CO2, respectivamente (Cuadro 3).
Cuadro 3: Producción de CO2, y contenido de C-BM y N-BM en el suelo con enmienda (AVE, AVR y AVM) y control; en el experimento de incubación aeróbica (14 días) en dos tipos de suelo: Regosol (R) y Luvisol (L). Los valores expresan el promedio general para cada tratamiento, suelo y su interacción. Las letras diferentes en las columnas indican diferencia significativa (P ≤ 0.05).
Table 3: Production of CO2, and content of C-BM and N-BM in the soil with amendment (AVE, AVR and AVM) and control in the aerobic incubation experiment (14 days) in two types of soil: Regosol (R) and Luvisol (L). Values represent the overall average for each treatment, soil and its interaction. Different letters in the columns indicate significant difference (P ≤ 0.05).
| Factor | CO2 | C-BM | N-BM | |
| mg kg-1 | (g C g-1 | (g N g-1 | ||
| Tratamiento | Control | 327.4 c | 1473.1 c | 3.7 d |
| AVM | 737.4 b | 5740.6 b | 21.1 b | |
| AVE | 898.0 a | 6678.5 a | 14.0 c | |
| AVR | 913.8 a | 6892.2 a | 23.2 a | |
| Suelo | ||||
| Regosol | NS | 4789.7 b | NS | |
| Luvisol | NS | 5602.6 a | NS | |
| Suelo + tratamiento | ||||
| L + Control | 326.5 e | 1775.8 e | 3.3 d | |
| L + AVM | 795.1 c | 5977.5 cd | 20.3 b | |
| L + AVE | 904.3 a | 7650.9 a | 13.7 c | |
| L + AVR | 864.0 b | 7006.5 b | 24.0 a | |
| R + Control | 328.2 e | 1170.4 f | 4.1 d | |
| R + AVM | 679.6 d | 5503.8 d | 21.8 b | |
| R + AVE | 923.2 a | 6133.6 c | 14.3 c | |
| R + AVR | 931.6 a | 6350.5 c | 22.5 a |
NS = sin diferencia significativa). NS = no significant difference.
La incorporación de enmiendas al suelo es una práctica que trae entre otras ventajas, el suministro de materia orgánica fresca, y proporcionar una fuente de energía y nutrientes para los microorganismos del suelo (Smith y Paul, 1990), mejorando la calidad (estructura y resistencia a la erosión) y fertilidad del suelo (Moreno-Cornejo et al., 2014). La respuesta de los microorganismos al aporte de sustrato y nutrientes al suelo, se conoce como efecto iniciador o priming effect (Kuzyakov et al., 2000), y la comunidad microbiana presente en el suelo, es la consumidora primaria de la fracción de la materia orgánica fácilmente disponible (lábil), principalmente polisacáridos (celulosa y hemicelulosa), activando sucesivamente la batería enzimática microbiana como las células que actúan sinérgicamente para despolimerizar la celulosa lábil; mientras que la β-glucosidasa (E.C. 3.2.1.21) libera la glucosa (Hobbie y Hobbie, 2013; Nevins et al., 2018) que se utilizará para la producción de energía, respiración microbiana y crecimiento de la población.
La producción de CO2 durante el tiempo de incubación se muestra en la Figura 1. En el día uno, en ambos suelos, la producción de CO2 en el control fue mayor (diferencia significativa) con respecto a los tratamientos con enmienda; sin embargo, del día tres al catorce, el promedio del control estuvo por debajo del promedio de los tratamientos con enmienda y fue significativamente diferente (Figura 1). En el AVM el incremento en la producción de CO2 del día uno al tres fue de aproximadamente 16.7 veces más; mientras que en AVE y AVR, el incremento solo fue de aproximadamente 2.7 y 2.9 veces más. La producción máxima de CO2 se presentó con el AVR en el día catorce (Regosol) y diez (Luvisol), respectivamente. En el suelo Regosol, el incremento en la producción de CO2 en AVE y AVR a partir del día siete y hasta el día catorce, fue significativamente mayor comparada al AVM y el control; solo con excepción de AVE que tuvo una disminución en el día catorce, paso de 1534.4 a 1160 mg kg-1. En el suelo Luvisol, por el contrario, del día diez al catorce se observó la disminución en la producción de CO2 en los tratamientos con enmienda; en AVR disminuyó 27%, y en AVE y AVM fue del 9% (aproximadamente).
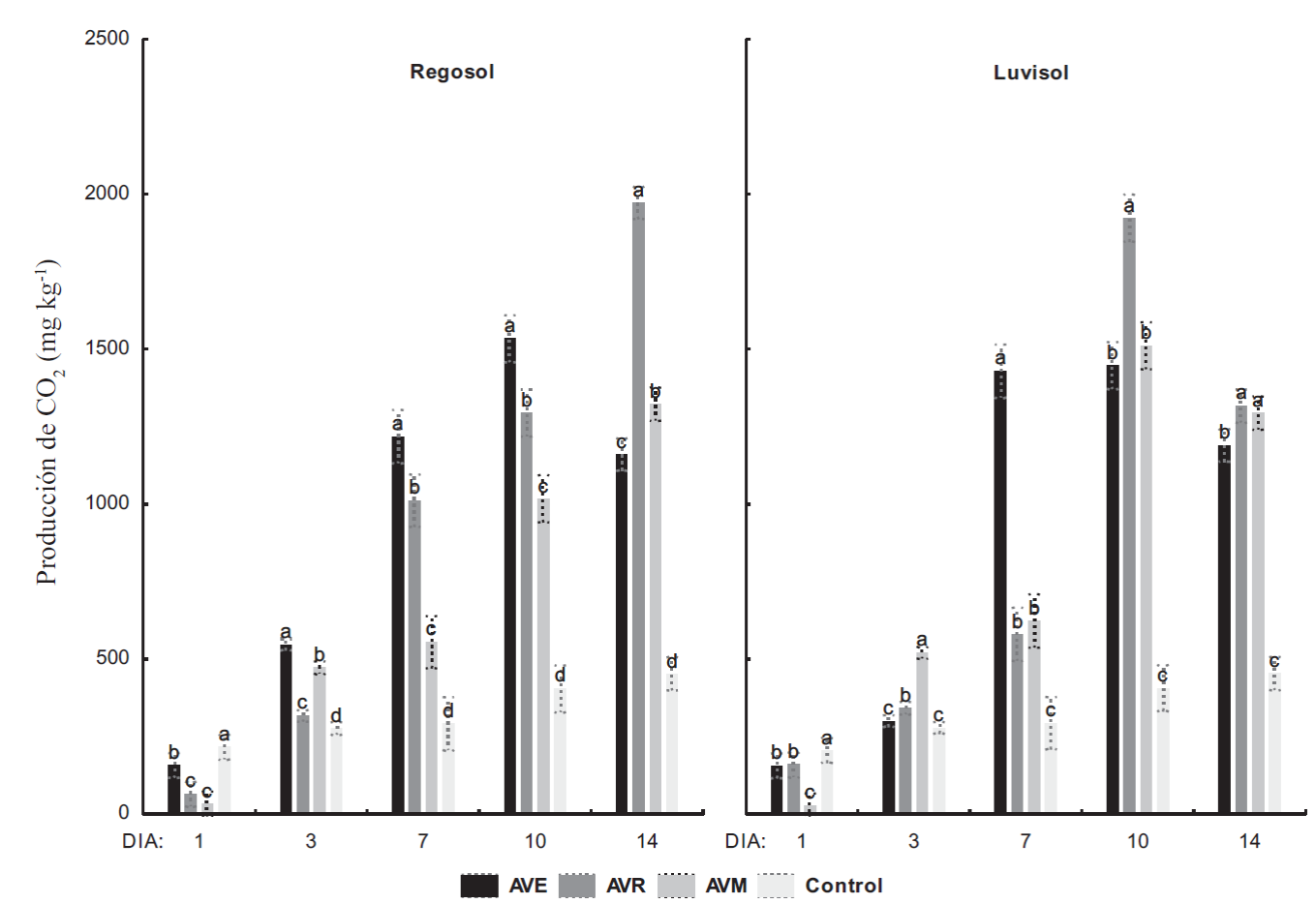
Figura 1: Dinámica de la producción de CO2 en dos suelos: Regosol y Luvisol; tratados con enmienda de AVE, AVR y AVM durante 14 días de incubación. Los valores son el promedio de tres repeticiones por tratamiento y por día. Las letras diferentes indican diferencia significativa (P ≤ 0.05) de los promedios para cada día.
Figure 1: Dynamics of CO2 production in two soils: Regosol and Luvisol treated with amendment of AVE, AVR and AVM during 14 days of incubation. Values are the average of three repetitions per treatment and per day. Different letters indicate significant difference (P ≤ 0.05) of the averages for each day.
Como se observa en la incubación aeróbica de 14 días (Figura 1), la producción acelerada de CO2 en los primeros siete días presentó un efecto iniciador positivo, como respuesta al aporte de carbón lábil (Blagodatskaya y Kuzyakov, 2013); con las enmiendas de AVE, AVR y AVM, se incrementó la actividad microbiana. La producción de CO2 en el suelo con AVR y AVE fue 1.23 y 1.21 veces más, en comparación con la enmienda de AVM (Cuadro 3); esto es debido al mayor contenido de celulosa y hemicelulosa, y la más alta relación C:N en AVM (Cuadro 2). Liang et al. (2017) reportaron resultados similares cuando adicionaron residuos de maíz con relación C:N de 27.6 y la producción de CO2 fue la más baja comparada con relaciones C:N de 16.9 y 10.3 en el mismo tipo de residuo. Debido al mayor contenido de nitrógeno (3%) y la baja relación de C:N (14 y 12, respectivamente) presente en los residuos de AVE y AVR, son considerados de mejor calidad (Chaves et al., 2004; Gentile et al., 2009); por ello, se obtuvo un incremento en la respiración microbiana del 19.2 y 17.9% (AVE y AVR, respectivamente) con relación a la producción de CO2 del AVM; los resultados coinciden con los obtenidos por Liang et al. (2017), quienes aplicaron al suelo residuos de maíz con tres relaciones de C:N (27.6, 16.9 y 10.3) y la producción de CO2 fue mayor en el tratamiento con la relación C:N más baja (10.3) y significativamente diferente al tratamiento con la relación C:N de 16.9 y 27.6, en 8.7 y 28.3%, respectivamente. El nuevo sustrato (enmienda) no solo provee de una fuente lábil de C y de energía, también abastece de una fuente de nitrógeno necesario para las comunidades microbianas, la cual es utilizada para promover su crecimiento (Sakala et al., 2000; Bird et al., 2001).
C y N de la biomasa microbiana del suelo
Los resultados del contenido de C-BM y N-BM en el experimento de catorce días de incubación aeróbica, mostraron diferencias significativas (P ≤ 0.05) entre los tratamientos; pero entre tipo de suelo solo existió diferencia en el contenido de C-BM (Cuadro 3).
El C-BM en el tratamiento con AVE y AVR (6892 y 6678 µg C g-1, respectivamente) fue mayor y significativamente diferente al tratamiento AVM (5740 µg C g-1) y el control (1476 µg C g-1). Con relación al tipo de suelo, existieron diferencias significativas (P ≤ 0.05) en el contenido de C-BM; en el suelo Luvisol (L) y Regosol (R) el valor promedio durante los 14 días de la incubación aeróbica fue de 5602.6 y 4789.7 µg C g-1, respectivamente. De la interacción suelo + tratamiento, en L+AVE y L+AVR se registraron los mayores promedios (7650.9 y 7006.5 µg C g‑1), seguidos por el promedio de R+AVR y R+AVE (6350.5 y 6133.6 µg C g‑1); en el tercer grupo se ubicó a L+AVM y R+AVM (5977.5 y 5503.8 µg C g-1), y finalmente al control con un promedio en ambos suelos de 1472.5 µg C g-1 (Cuadro 3).
En los días de incubación se observó una clara diferencia en el contenido C-BM en los tratamientos con enmienda vs control (Cuadro 4). En el suelo Regosol del día uno al diez, la cantidad de C-BM disminuyó en casi todos los tratamientos (excepto AVE en el día tres); para el día catorce (fin de la incubación) se observó un incremento de aproximadamente 1.5 veces en todos los tratamientos; por otra parte, en el suelo Luvisol, del día uno al tres, el C-BM se incrementó aproximadamente 2.1 y 1.8 veces en los tratamientos con AVR y AVM; al final de la incubación (día 14), el contenido de C-BM se incrementó en todos los tratamientos (Cuadro 4).
Cuadro 4: Comparación de medias (± error estándar) entre suelo y tratamiento, en el contenido de C-BM (μg C g-1), durante la incubación aeróbica (14 días). Las letras diferentes en las columnas indican diferencia significativa (P < 0.05).
Table 4: Comparison of means (± standard error) between soil and treatment in the content of C-BM (μg C g-1) during aerobic incubation (14 days). Different letters in the columns indicate significant difference (P < 0.05).
| Suelo | Tratamiento | Días de incubación | ||||
| 1 | 3 | 7 | 10 | 14 | ||
| Regosol | ||||||
| Control | 1474 d ± 395 | 1402 c ± 542 | 1366 c ± 287 | 1251 b ± 71 | 1359 d ± 992 | |
| AVM | 7486 b ± 149 | 6453 b ± 149 | 4801 b ± 149 | 3923 a ± 238 | 4853 c ± 178 | |
| AVE | 8790 a ± 216 | 9291 a ± 311 | 1843 c ± 265 | 3943 a ± 272 | 6799 b ± 285 | |
| AVR | 6350 b ± 327 | 6402 a ± 59 | 5524 a ± 89 | 4543 a ± 238 | 8932 a ± 149 | |
| Luvisol | ||||||
| Control | 1955 c ± 564 | 1597 c ± 548 | 521 c ± 142 | 2130 d ± 422 | 2672 c ± 751 | |
| AVM | 4162 b ± 81 | 7530 b ± 135 | 5285 a ± 243 | 5612 b ± 216 | 7296 b ± 54 | |
| AVE | 10865 a ± 415 | 9712 a ± 621 | 2053 b ± 258 | 7120 a ± 351 | 8503 b ± 543 | |
| AVR | 4817 b ± 189 | 10523a ± 81 | 5051 a ± 270 | 3601 c ± 27 | 11038a ± 54 | |
La aplicación de AV al suelo puede estimular a la biomasa microbiana a través del suministro de nutrientes y compuestos de C degradable; lo anterior explica el mayor contenido de C-BM en el suelo adicionado con AV en comparación del suelo control (sin enmienda); resultados similares obtuvieron Stark et al. (2007) cuando adicionaron residuos de Lupinus al suelo y el contenido de C-BM fue dos veces mayor con respecto al suelo control y con fertilización mineral. En el presente trabajo, el tratamiento con AVE y AVR presentó mayor contenido de C-BM con respecto al AVM; de acuerdo a Masunga et al. (2016), reportaron que a mayor contenido de C en el residuo, el contenido de C-BM es mayor; sin embargo, en las enmiendas utilizadas en el presente trabajo, el porcentaje de C es similar y la cantidad aplicada del residuo fue el mismo; por lo tanto, la diferencia encontrada entre las enmiendas, es debido a otros factores como el % N, la relación C:N y al contenido de lignina, celulosa y hemicelulosa (Mohanty et al., 2011).
El contenido de C-BM, fue diferente y significativo entre el tipo de suelo: Luvisol > Regosol, posiblemente debido a las características físico-químicas de cada suelo, como son: el contenido de arcilla, pH, capacidad de intercambio catiónico, la estructura del suelo, sodicidad y salinidad; las cuales tienen un efecto en la descomposición de la materia orgánica del suelo (Dendooven et al., 2015). El suelo Luvisol presenta 26% más de arcilla a diferencia del Regosol; Van Veen et al. (1987) y Amato y Ladd (1992), reportaron una estrecha relación entre el contenido de arcilla y la proporción de C en la biomasa microbiana. El menor tamaño de partícula de las arcillas (< 2 micras) genera una mayor área específica de contacto y aunado a la carga negativa de las partículas, permite la adsorción del material orgánico suministrado en la enmienda y el posterior aprovechamiento por los microorganismos del suelo; que en principio son las bacterias el primer grupo en atrapar y metabolizar la mayoría de los compuestos orgánicos fácilmente disponibles después de su entrada en el suelo (Paterson et al., 2007).
El valor promedio del N-BM en los tratamientos con la aplicación de enmienda fue mayor y diferente significativamente con respecto al control (Cuadro 3). El promedio en AVR y AVE fue de 23.2 y 14.0 µg N g-1, respectivamente; y de 21.1 µg N g-1 para AVM; en el suelo control el promedio fue de 3.7 µg N g-1 . No existió diferencia significativa entre el tipo de suelo en el contenido de N-BM. Con respecto a la interacción suelo + tratamiento, se presentó la tendencia de AVR > AVM > AVE > control, en ambos suelos (R y L).
En el contenido de N-BM durante los días de incubación, no se observó un patrón distintivo en ningún tratamiento y suelo (Cuadro 5); en general en todos los tratamientos se observa un aumento o disminución en el contenido de N-BM a través de los días; sólo en AVR se presentó un incremento significativo de 2.7 veces del día uno al día tres.
Cuadro 5: CComparación de medias (± error estándar) entre suelo y tratamiento, en el contenido de N-BM (μg N g-1), durante la incubación aeróbica (14 días). Las letras diferentes en las columnas indican diferencia significativa (P < 0.05).
Table 5: Comparison of means (± standard error) between soil and treatment, in the content of N-BM (μg N g-1), during aerobic incubation (14 days). Different letters in the columns indicate significant difference (P< 0.05).
| Suelo | Tratamiento | Días de incubación | ||||
| 1 | 3 | 7 | 10 | 14 | ||
| Regosol | ||||||
| Control | 1.9 c ± 0.72 | 2.1 d ± 0.14 | 2.4 d ± 0.17 | 7.9 c ± 1.41 | 6.3 c ± 0.69 | |
| AVM | 21.6 a ± 0.70 | 26.9 b ± 0.90 | 28.0 a ± 0.42 | 16.2 a ± 0.77 | 16.5 b ± 0.49 | |
| AVE | 21.6 a ± 0.73 | 12.9 c ± 1.90 | 8.8 c ± 0.45 | 11.0 b ± 0.43 | 17.4 b ± 0.89 | |
| AVR | 14.3 b ± 0.72 | 38.3 a ± 1.47 | 14.6 b ± 0.11 | 16.6 a ± 1.24 | 28.6 a ± 0.71 | |
| Luvisol | ||||||
| Control | 2.4 c ± 0.37 | 1.9 d ± 0.26 | 5.3 c ± 0.10 | 4.4 d ± 1.65 | 2.3 d ± 1.54 | |
| AVM | 12.1 b ± 0.43 | 21.9 b ± 0.65 | 26.7 a ± 0.15 | 22.0 b ± 0.26 | 18.8 b ± 0.43 | |
| AVE | 28.2 a ± 1.46 | 16.5 c ± 0.67 | 6.7 c ± 0.89 | 9.5 c ± 0.61 | 7.7 c ± 0.88 | |
| AVR | 10.9 b ± 0.75 | 31.5 a ± 0.43 | 15.4 b ± 0.98 | 32.5 a ± 0.43 | 29.7 a ± 0.12 | |
El contenido de N-BM fue significativamente diferente con la adición de enmiendas al suelo comparado al suelo control (sin enmienda); resultados similares reportaron Luo et al. (2018) con un aumento del 24% cuando adicionaron enmienda en comparación de la fertilización mineral; por otra parte, Stark et al. (2007) obtuvieron un incremento de dos veces en N-BM con la adición de Lupinus en comparación al suelo control (sin enmienda). El crecimiento de la biomasa microbiana y su función están relacionados con la entrada de sustrato en el sistema, y la incorporación al suelo con residuos de cultivos induce un aumento en la biomasa microbiana del suelo (Jiang-shan et al., 2005). El tipo y calidad de la enmienda (legumbre, composta, biosolido, etc.) depende de las características bioquímicas y del contenido de celulosa, hemicelulosa y lignina, además de la relación C:N. En el tratamiento con AVM aplicada al suelo Luvisol registró un aumento del contenido de N-BM del día uno al día siete; lo anterior, es debido a la inmovilización del N provocado por la incorporación de residuos de menor calidad, con bajo contenido de N y una relación C:N alta (Chaves et al., 2004; Manzoni et al., 2008; Gentile et al., 2009); el AVM en nuestro estudio presenta 3% de N y una relación C:N de 22. Partey et al. (2014) reportaron resultados similares al aplicar al suelo residuos de Zea mays con relación C:N de 37.2, el contenido de N-BM fue significativamente mayor con respecto al control (sin enmienda) y a los tratamientos con AV (T. diversifolia y V. faba). El tratamiento con AVR a pesar de tener mayor porcentaje de N y una relación C:N menor, presentó un comportamiento similar al de AVM, lo anterior indica que no solamente es la relación C:N la que determina la dinámica del C y N en el suelo. El contenido de lignina en AVM es en promedio 2.5 veces menor con respecto a las especies de Lupinus utilizados en el presente trabajo. Debido al bajo contenido de lignina y al mayor porcentaje de celulosa y hemicelulosa en el AVM, el contenido de C-BM y N-BM fue más estable y menos variable durante el periodo de incubación con respecto a AVE y AVR. La lignina persiste en los suelos debido a sus enlaces C-O-C y C-C no hidrolizables y a la abundancia de estructuras aromáticas; sin embargo, bajo condiciones favorables, la lignina puede ser mineralizada en un periodo relativamente corto (Han et al., 2016).
La aplicación de residuos vegetales al suelo como enmienda, se está convirtiendo en una importante práctica para renovar las fuentes temporales de carbono y nitrógeno en el suelo. La aplicación directa al campo de residuos con bajo contenido de N y alta relación C:N (p. ej.: Zea mays) disminuye la disponibilidad del N para el crecimiento de los cultivos; por el contrario, la aplicación de residuos vegetales como los AV con relaciones C:N menores de 22, pueden mineralizar suficiente N para satisfacer la demanda para el crecimiento de las plantas (Luo et al., 2018). La combinación de residuos vegetales con relaciones altas de C:N (como Zea mays) y residuos vegetales con relaciones bajas de C:N (como Lupinus), es una alternativa para superar la inmovilización prolongada de N y poder garantizar la mineralización neta del nitrógeno y su disponibilidad para el siguiente cultivo. Partey et al. (2014) aplicaron diferentes enmiendas al suelo (solas o combinadas) y encontraron que aplicando Zea mays combinado con Vicia faba o Trifolium diversifolia, se incrementó la mineralización del N en un 58 y 55% (respectivamente) en comparación con el Zea mays solo. Además de mejorar la disponibilidad del N, el uso combinado de enmiendas (principalmente el AV) favorece las propiedades físicas, químicas y biológicas del suelo, incrementa la actividad microbiana (producción de CO2), la biomasa microbiana (C, N) y la actividad enzimática como la deshidrogenasa, ureasa, glucosidasa, fosfatasa y sulfatasa (Tejada et al., 2008). En cuanto a la composición bacteriana, Longa et al. (2017) reportaron una mayor diversidad y abundancia de microorganismos cuando aplicaron AV al suelo. Las Actinobacteria y Proteobacteria (phylum bacteriales) son copiotrofos en el suelo y fueron las más abundantes, se presentan en condiciones de mayor disponibilidad de nutrientes y tienen una tasa de crecimiento alta. Un tercer phylum en orden de abundancia fue Acidobacteria, que en cambio contiene bacterias oligotróficas (sustrato pobre en nutrientes) del suelo; además, reportaron hongos del phylum Ascomycota, los cuales se especializan en acceder y degradar sustratos no disponibles para la mayoría de las bacterias. La sucesión o aparición de diferentes tipos de bacterias (no se hizo en este experimento) podría explicar la variación en el contenido de C y N de la biomasa microbiana con relación a los días de la incubación (Cuadro 4 y 5).
El aumento en la diversidad microbiana del suelo asociado con el uso de AV representa benef icios para la nutrición de las plantas, considerando que en los sistemas de agricultura orgánica la mineralización de la materia orgánica depende de la actividad de los microorganismos del suelo (Longa et al., 2017).
Conclusiones
- El uso de L. exaltatus (AVE) y L. rotundiflorus (AVR) como abono verde (AV) favoreció el incremento de la biomasa microbiana y actividad biológica del suelo en términos de la producción de CO2, contenido de N y C en la biomasa microbiana. De los AV utilizados, AVR presentó un mejor efecto iniciador, y además mantuvo un nivel más alto de actividad biológica comparado con el uso del AVM como enmienda.
- En la región de estudio se tiene como recurso disponible las especies nativas de Lupinus y los residuos de Zea mays; por lo tanto, y con base en los resultados presentados, se propone como una actividad agrícola para mejorar el uso de las enmiendas utilizadas, la aplicación al suelo de mezclas de residuos de AVE y AVR con AVM en diferentes proporciones, para promover la disponibilidad del nitrógeno mineralizado a las plantas del siguiente cultivo.











 nueva página del texto (beta)
nueva página del texto (beta)



