INTRODUCCIÓN
La actividad enzimática del suelo depende de su diversidad vegetal y microbiana e indica procesos importantes como la degradación de materia orgánica (mineralización), presencia de contaminantes, aplicación de fertilizantes, remediación o perturbación antrópica (Gianfreda y Rao, 2008; Rao et al., 2014). La contaminación con metales pesados, sales o xenobióticos disminuye la diversidad microbiana y puede anular la actividad de enzimas (Pérez-Leblic et al., 2012). El efecto depende del tipo de contaminante y la presencia de materia orgánica o arcillas que pueden actuar como amortiguadores (Deng et al., 2017).
Los contenidos de la materia orgánica del suelo (MOS) y sus características químicas son indicadores de diversos impactos, ya que se modifican por cambios en manejo, clima, vegetación, humedad, presencia de contaminantes o erosión (Ondrasek et al., 2019). Las sustancias húmicas (SH), son parte importante de la MOS, derivan de componentes vegetales y animales del suelo (Schnitzer y Monreal, 2011) y su composición a base de polímeros, cambia con el uso de suelo, condiciones ambientales o contaminación (Tan, 2014). La descripción más práctica de las SH húmicas se basa en sus contenidos de carbono y su coloración, esta última puede ser cuantificada con la absorbancia a diferentes longitudes de onda (450 a 726 nm), donde el índice E4/E6 (465/665), define la complejidad de las moléculas del humus, valores cercanos a 3 implican abundancia de polímeros con anillos aromáticos (Kumada, 1964; Markiewicz et al., 2018). Otros métodos para caracterizar las SH en su composición elemental o molecular, son la espectroscopia de infrarrojo, el análisis elemental acoplado a radioisótopos, la pirolisis con cromatografía de gases acoplada a espectrometría de masas y la espectroscopia de resonancia magnética nuclear, (Monnier, 2018).
La zona de estudio (chinampas al sur de la Ciudad de México: Xochimilco, San Gregorio Atlapulco, Tláhuac) es Patrimonio Mundial de la Humanidad (1986), Área Natural Protegida (1992) y Sitio RAMSAR 1363 (Humedal de Importancia Internacional) (2004). Tiene características especiales, como altos porcentajes de carbono (10 a 30%), contaminación salino-sódica (7 a 20 dS m -1), densidades aparentes bajas (0.2 a 0.5 g cc‑1) y moléculas húmicas cuya estabilidad depende del manejo antrópico y las condiciones edáficas (Reyes-Ortigoza y García-Calderón, 2004). Las actividades enzimáticas de estos suelos no han sido estudiadas. La presente investigación tuvo como objetivo estudiar la actividad enzimática y tipo de humus en chinampas con diferente salinidad, uso de suelo y ubicación geográfica, para reconocer el impacto de estos factores sobre la degradación química del suelo y promover la conservación de la zona.
MATERIALES Y MÉTODOS
La investigación se hizo con 45 suelos, de tres sitios de la zona chinampera: Xochimilco (19o 17’ 06” N, 99o 06’ 07” O), San Gregorio Atlapulco (19o 15’ 04” N, 99o 03’ 20” O) y Tláhuac (19o 16’ 28” N, 99o 00’ 10” O).
Se trabajó con muestras superficiales de suelo (0 a 40 cm), en cada sitio, hubo 15 muestras con tres diferentes usos (cinco de pastizal, cinco con cultivos agrícolas y cinco abandonados). El muestreo fue sistemático a distancias equidistantes de 500 m, con base en los programas QGis y Google Earth, donde se utilizaron mapas y cuadriculas vectoriales, para obtener la ubicación geográfica del sitio y las coordenadas de cada punto de muestreo, con esto se delimitó el área de estudio y aseguró el reparto homogéneo de las muestras seleccionadas.
El suelo se secó y tamizó a 2 mm para evaluar propiedades químicas. El pH se determinó por potenciometría, suelo: agua 1:2.5 (Peech, 1965). En el extracto de la pasta de saturación se midió: CE (conductividad eléctrica) con celda de conductividad como sensor (NOM-021-RECNAT-2000, 2002), iones solubles (cloruros, carbonatos, bicarbonatos, calcio, magnesio, sodio, potasio y sulfatos) por titulación volumétrica los cinco primeros y por turbidimetría el último (Richards et al., 1994). En suelo se cuantificaron: los iones intercambiables calcio, magnesio (titulación con EDTA) y sodio, potasio por flamometría, (ISRIC-FAO, 2002). La clasificación de salinidad en suelo se hizo por CE, pH y PSI (Richards et al., 1994).
El C orgánico, tanto en muestras de suelo como en las sustancias húmicas se hizo por Walkley y Black, mientras que el nitrógeno se evalúo por el método Kjeldahl, (ISRIC-FAO, 2002).
Las sustancias húmicas (SH) (ácidos húmicos (AH), ácidos fúlvicos (AF) y huminas) se extrajeron por el método Kononova y Bel’chicova (1961), con pirofosfato e hidróxido de sodio. Los AH purificados se utilizaron para obtener el espectro visible y calcular la relación E4/E6. El primero fue construido con las lecturas de absorbancia a longitudes de onda de 450 a 726 nm y el segundo se calculó por el cociente de absorbancias obtenidas a longitudes de onda 465/665.
Para determinar actividad enzimática, las 45 muestras de suelo se conservaron en refrigeración y tamizaron (2 mm) en húmedo. Las actividades (glucosidasa, fosfatasa, ureasa, sulfatasa, catalasa y deshidrogenasa) fueron evaluadas por triplicado donde se utilizaron tiempos de incubación y sustratos específicos (García et al., 2003).
Los valores de actividad enzimática, carbono en sustancias húmicas y salinidad se analizaron por ANDEVA y Prueba de Tukey para determinar diferencias significativas entre usos de suelo y sitios geográficos. También se hicieron correlaciones (R lineal, de Spearman´s, Kendall´s y lineales parciales) entre salinidad (PSI, CE y concentración de sodio) con carbono de sustancias húmicas y actividad de las enzimas estudiadas utilizando el Programa Past 3.1. Las gráficas con desviación estándar se hicieron con el programa R Core Team, 2018.
RESULTADOS Y DISCUSIÓN
Características del Humus
El uso del suelo, al igual que la ubicación geográfica modificaron las características del humus (Figura 1). En los espectros de absorción, las longitudes de 450 a 496 nm, definieron la existencia de moléculas que inician el proceso de humificación y provienen de moléculas sencillas (azúcares o carbohidratos) (Markiewicz et al., 2018). Los contenidos de carbono en ácidos húmicos (AH), ácidos fúlvicos (AF) y huminas mostraron diferencias significativas (Tukey P < 0.05), entre sitios geográficos y usos de suelo, lo que indicó cambios del proceso de humificación y estructura molecular de las SH. El mayor porcentaje de carbono en AH se encontró en chinampas de Tláhuac y pastizal mientras que en las chinampas abandonadas y de SGA fueron más abundantes los contenidos de carbono en AF y huminas, por tanto hubo menor complejidad molecular en el humus de estos últimos suelos (Figuras 2A y 2B). Wiesmeier et al. (2019), reportaron mayor acumulación de carbono en pastizal o bosque que en suelos agrícolas. Sin embargo en las chinampas hubo mayor contenido de carbono en suelos abandonados y cultivados (agrícolas) que en suelos de pastizal con diferencia significativa (Tukey P < 0.05), (Cuadro 1). Lo cual se atribuyó tanto al manejo y origen antrópico como al ambiente circundante. Se ha reportado que las características del humus se relacionan con ambientes y moléculas precursoras (Wu et al., 2017), en las chinampas la formación de humus debe estar asociada al ambiente lacustre y a moléculas precursoras como azúcares, ligninas o celulosa que provienen principalmente de lodos, estiércoles y compost (Xiao-Xia et al., 2019). En todos los suelos estudiados, hubo mayores contenidos de carbono en huminas que en AH y AF (Figuras 2A, 2B), este comportamiento, también lo señalaron Wiesmeier et al. (2019), en suelos agrícolas o forestales, donde la fracción dominante, de las sustancias húmicas, fueron huminas (más de 40%), lo que implicó en ambos casos, presencia de materiales insolubles con dominio de cadenas alifáticas de carbohidratos lípidos, ceras, así como de carbohidratos tipo celulosa (Hayes et al., 2017). Los índices E4/E6 con menores valores se encontraron en suelos de pastizal y Tláhuac (Figura 2C, 2D) e indicaron, que hubo mayor aromaticidad molecular en el humus de estos sitios.
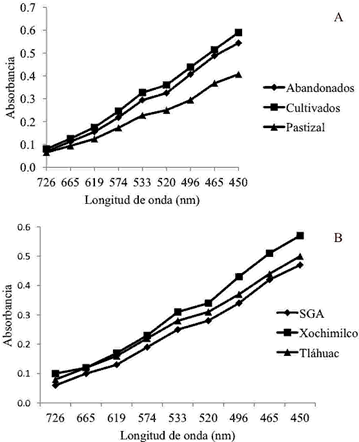
Figura 1: Espectros visibles de AH en suelos de chinampa (A) por uso de suelo; (B) por sitio geográfico. Figure 1: Visible spectra of humic acid in chinampa soil (A) by land use; (B) bygeographic site.
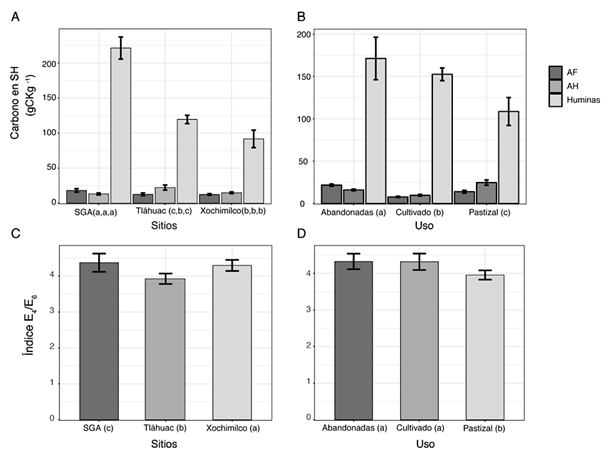
Figura 2: Carbono de SH en chinampas por sitios geográficos (A) y uso de suelo (B). Índice (E4/E6) de evolución del humus por sitios geográficos (C) y uso de suelo (D). Literales a, b, c en paréntesis definen diferencia significativa (Tukey P < 0.05). Figure 2: Carbon in humic substances in chinampas by geographic site (A) and land use (B). Index (E4/E6) of evolution of humus by geographic site (C) and land use (D). The letters a, b, c in parentheses indicate significant difference (Tukey P < 0.05).
Los rangos de carbono (Cuadros 1 y 2), cercanos a 30 g 100 g-1, en las chinampas estudiadas son parecidos a mejoradores orgánicos como el compost o estiércoles, e implican rápida degradación, siempre que existan rangos de temperatura entre 10 y 30 ºC y humedad entre 40 y 70% (Zanella et al., 2018a).
Cuadro 1: Contenidos de carbono y nitrógeno en suelos de chinampa por sitio geográfico. Table 1: Carbon and nitrogen contents in chinampa soils by geographic site.
| Muestra | C total | N total | C/N |
|---|---|---|---|
| - - - - - - - g 100 g-1 - - - - - - - | |||
| SGA | 25.28a | 0.76a | 33.25a |
| Xochimilco | 11.90b | 0.60a | 19.66b |
| Tláhuac | 15.44c | 0.75a | 20.87b |
Literales a, b, c en la misma columna definen diferencia significativa (Tukey P < 0.05). C = carbono; N = nitrógeno.
The letters a, b, c in the same column indicate significant difference (Tukey P < 0.05). C = carbon; N = nitrogen.
Las zona con mayor contenido promedio de carbono en suelo fue SGA y la de menor Xochimilco. Las relaciones C/N mostraron diferencia significativa (Tukey P < 0.05) entre sitios y usos de suelo y fueron mayores en SGA y suelos abandonados, por tanto mayor reserva de carbono en estos lugares. Sin embargo en todos los suelos de chinampa la relación C/N, definió mayor proceso de humificación que de mineralización, a pesar de que los contenidos de nitrógeno (> 0.6 g 100 g‑1 suelo) son muy altos, según la NOM 021, lo que se debió a la gran cantidad de carbono proveniente de lodos y mejoradores orgánicos (estiércol y compost), (Cuadros 1 y 2).
Cuadro 2: Contenidos de carbono y nitrógeno en suelos de chinampa por uso. Table 2: Carbon and nitrogen contents in chinampa soils by use.
| Muestra | C total | N total | C/N |
|---|---|---|---|
| - - - - - - - g 100 g-1 - - - - - - - | |||
| Abandonado | 20.90a | 0.75a | 27.10a |
| Cultivado | 17.00b | 0.69a | 23.96b |
| Pastizal | 14.72b | 0.67a | 22.71b |
Literales a, b, c en la misma columna definen diferencia significativa (Tukey P < 0.05). C = carbono; N = nitrógeno.
The letters a, b, c in the same column indicate significant difference (Tukey P < 0.05). C = carbon; N = nitrogen.
Los suelos de chinampas se clasifican como Antrosoles por las características de construcción, con acumulación de sedimentos lacustres, así como manejo con uso de residuos agrícolas, estiércoles y compostas (FAO, 2014). Las chinampas permanecen sobre remanentes del Lago Xochimilco-Chalco (Cuenca de México), cerca de canales con agua, por lo que permanecen inundados y el nivel freático es bajo. Con base en la construcción y características ambientales y agrícolas de las chinampas, el humus es Hidro Agro Mull con biomicroestructura (amiA) o sistemas humus vertedero (Zanella et al., 2018a, b ). Mientras que los resultados encontrados en las fracciones húmicas con proporciones dominantes de humina, así como, los porcentajes de carbono en AH e índices E4/E6 (3 y 4.5), (Figura 2), ubicaron al humus dentro del tipo mull terrestre, lo que también señalaron Reyes-Ortigoza y García-Calderón (2004).
Características de la Actividad Enzimática
En los sitios geográficos estudiados, los valores promedio de actividad enzimática (Cuadro 3), excluyendo ureasa y glucosidasa, mostraron diferencias estadísticas (Tukey P < 0.05). En Tláhuac siempre fueron menores los valores, excepto para ureasa. La actividad de deshidrogenasa, fue de valores más contrastantes, tuvo diferencias significativas (Tukey P < 0.05) y mostró la siguiente relación Xochimilco > SGA > Tláhuac. Esto implicó cambios en la población microbiana, puesto que la deshidrogenasa, se encuentra solamente dentro de células e indica presencia de microorganismos vivos, el resto de enzimas se ubican tanto en células como en la solución del suelo (García et al., 2003).
Cuadro 3: Actividad enzimática en suelos de chinampa por sitios geográficos. Table 3: Enzymatic activity in chinampa soils by geographic site.
| Muestra | Glucosidasa | Fosfatasa Ácida |
Fosfatasa Alcalina |
Sulfatasa | DH | Catalasa | Ureasa |
|---|---|---|---|---|---|---|---|
| µg PNG | - - - - µg PNP - - - - | µg PNS | µg TPP | mmoles de
H2O2 |
µg N-NH4 | ||
| - - - - - - - - - - - - - - - - - - - - - - - g-1 suelo h-1 - - - - - - - - - - - - - - - - - - - - - - - | |||||||
| SGA | 0.14a | 3.14a | 3.94a | 0.39a | 31.78a | 0.85a | 0.04a |
| Xochimilco | 0.12a | 2.71a | 2.75a | 0.40a | 44.84b | 0.99a | 0.13a |
| Tláhuac | 0.04a | 0.83b | 1.80b | 0.12b | 22.25c | 0.59b | 0.17a |
Literales a, b, c en la misma columna indican diferencia significativa (Tukey P < 0.05). DH = deshidrogenasa.
The letters a, b, c in the same column indicate significant difference (Tukey P < 0.05). DH = dehydrogenase.
En los usos de suelo estudiados, los valores promedio de actividad enzimática, excepto glucosidasa y sulfatasa, fueron menores en las chinampas abandonadas (Cuadro 4). La deshidrogenasa se consideró más sensible e indicadora, de los cambios, por su mayor actividad y las diferencias estadísticas (Tukey P < 0.05). En los suelos cultivados hubo más actividad de enzimas hidrolíticas (ureasa, fosfatasa y sulfatasa), con diferencia significativa (Tukey P < 0.05), en las dos últimas, por tanto la liberación de fosfatos y sulfatos, quizás estuvo asociada al frecuente uso de fertilizantes y mejoradores orgánicos en chinampas dedicadas al cultivo. En los suelos de pastizal se encontraron valores más altos en deshidrogenasa y catalasa, lo que implicó actividades microbianas mayores en estas chinampas, esto se atribuyó, a la existencia de múltiples raíces en pastos (Wiesmeier et al., 2019). Además en la zona chinampera, la fosfatasa reportada como muy sensible a cambios medioambientales (Guangming et al., 2017), mostró de manera más clara diferencias con respecto a su ubicación geográfica y uso de suelo (Cuadros 3 y 4).
Cuadro 4: Actividad enzimática en suelos de chinampa por uso. Table 4: Enzymatic activity in chinampa soils by use.
| Muestra | Glucosidasa | Fosfatasa Ácida |
Fosfatasa Alcalina |
Sulfatasa | DH | Catalasa | Ureasa |
|---|---|---|---|---|---|---|---|
| µg PNG | - - - - µg PNP - - - - | µg PNS | µg TPP | mmoles de
H2O2 |
µg N-NH4 | ||
| - - - - - - - - - - - - - - - - - - - - - - - g-1 suelo h-1 - - - - - - - - - - - - - - - - - - - - - - - | |||||||
| Abandonado | 0.12a | 2.03a | 2.45a | 0.29a | 23.94a | 0.75a | 0.07a |
| Cultivado | 0.09a | 2.43a | 3.44b | 0.41b | 32.97b | 0.75a | 0.13a |
| Paztizal | 0.10a | 2.21a | 2.60a | 0.21a | 41.96c | 0.92a | 0.13a |
Literales a, b, c en la misma columna indican diferencia significativa (Tukey P < 0.05). DH = deshidrogenasa.
The letters a, b, c in the same column indicate significant difference (Tukey P < 0.05). DH = dehydrogenase.
La actividad de catalasa cambia con la fertilidad y actividad microbiana del suelo, participa en la oxigenación durante la respiración aerobia (Trevors, 1984). Mientras que la deshidrogenasa indica los cambios redox microbianos y la degradación inicial de la materia orgánica (Ross, 1972), por lo que la mayor actividad de estas enzimas en chinampas con pastizal (Cuadro 4) pudo relacionarse con la existencia de moléculas jóvenes que inician el proceso de humificación (longitudes de onda 450-465) (Figura 1), además de que los pastizales tienen riqueza de carbono y diversidad de microorganismos (Yerena-Yamallel et al., 2014).
Actividad Enzimática-Humus
La ureasa es una enzima tipo hidrolasa que se asocia a disponibilidad de nitrógeno, como ya se mencionó en chinampas está por arriba de 0.6% (Cuadros 1 y 2), sobre todo en San Gregorio Atlapulco, aunque no se observa diferencia clara entre contenidos de nitrógeno y usos de suelo (Cuadro 2), se ha reportado que en pastizales se puede acumular y conservar por su mayor cantidad de raíces (Piñeiro et al., 2010). La urea es de los fertilizantes más aplicados en zonas agrícolas de estas chinampas, sobre todo en San Gregorio Atlapulco. La actividad de ureasa se ha reportado más dependiente del tipo de materia orgánica que del contenido (Pancholy y Rice, 1973), por tanto la baja actividad de ureasa en pastizales de estas chinampas se asoció a la mayor complejidad de sus sustancias húmicas (Figuras 1 y 2). Se ha señalado que las fracciones de ácidos húmicos del suelo son muy importantes para la estabilidad y actividad de la ureasa (Marzadori et al., 2000). La baja actividad de ureasa, en todos los usos de suelo y sitios geográficos estudiados (Cuadros 3 y 4), pudo asociarse a la formación de complejos entre está enzima y el humus (Guangming et al., 2017). Ceccanti et al. (2008), explicaron, como la complejidad de la materia orgánica afecta la actividad enzimática, encontraron gran variedad de complejos humus-enzimas que forman barreras biológicas y protegen contra la degradación. Por ello concluyeron que el contenido de carbono en las sustancias húmicas refleja la inmovilización y resilencia potencial de las enzimas. Así también García et al. (2016), encontraron que si el humus del suelo es más estructurado con proporción importante de carboxilos, alcoholes y fenoles existe alta capacidad de inmovilización de las enzimas.
En la diferentes zonas chinamperas hubo relación inversa entre actividad enzimática y evolución del humus, (Figuras 1, 2, Cuadro 3), en Tláhuac la evolución de humus fue mayor y la actividad enzimática menor, lo que implica mayores reservas de carbono y menor disponibilidad de nutrientes. Mientras que en San Gregorio Atlapulco, Xochimilco y chinampas cultivadas, hubo mayor actividad enzimática y menor evolución del humus, por lo que la disponibilidad de nutrientes debe ser mayor y las reservas de carbono menores (Figuras 1, 2, y Cuadros 3, 4). Sin embargo las zonas de Pastizal presentaron otro comportamiento pues en pastizal hay alta actividad enzimática y evolución del humus (Figuras 1, 2 y Cuadro 4) mientras que en las zonas abandonadas hay baja evolución del humus y baja actividad enzimática, esto definiría equilibrio entre el proceso de humificación-mineralización en estas últimas zonas.
Características de Salinidad
La salinidad se asoció al sitio geográfico y uso de suelo, los valores de pH, superiores a 8, así como los máximos contenidos de carbonatos, bicarbonatos y sulfatos se encontraron en Tláhuac y en las zonas de pastizal (Cuadros 5 y 6). Entre sitios las diferencias más significativas (Tukey P < 0.05), estuvieron asociadas a los valores de CE y sodio soluble, este último fue muy alto en SGA atribuible a la variabilidad entre suelos de la zona con condiciones extremas. En cuanto a los iones intercambiables la mayoría fueron más altos en Tláhuac y en pastizal a excepción del potasio (Cuadros 7 y 8). Lo que implica mayor problemática de sodio en la zona de Tláhuac y los suelos con uso de pastizal. En sodio soluble e intercambiable y PSI hubo diferencias significativas (Tukey P < 0.05) entre zonas y usos de suelo (Cuadros 5 a 8).
Cuadro 5: Valores promedio de pH, conductividad eléctrica (CE) e iones salinos solubles en suelos de chinampa por sitios geográficos. Table 5: Average values of pH, electrical conductivity (CE) and soluble saline ions in chinampa soils by geographic site.
| Muestra | pH | CE | CO3 | HCO3 | Cloruros | Ca2+ | Mg 2+ | Na+ | K+ | SO4 |
|---|---|---|---|---|---|---|---|---|---|---|
| H2O | dS m-1 | - - - - - - - - - - - - - - - - mmolc l-1 - - - - - - - - - - - - - - - - | mmolc kg-1 | |||||||
| 1:2.5 | ||||||||||
| SGA | 7.54a | 7.91a | 1.25a | 4.46a | 31.24a | 15.07a | 42.57a | 371.12a | 5.83a | 0.12a |
| Xochimilco | 8.42b | 9.48b | 1.81a | 3.45a | 29.52a | 12.99b | 34.04a | 59.60b | 3.44b | 0.06a |
| Tláhuac | 8.02b | 20.96c | 2.72b | 11.53b | 9.21b | 17.27a | 73.20b | 115.65c | 3.56b | 0.15a |
Literales a, b, c en la misma columna definen diferencia significativa (Tukey P < 0.05).
The letters a, b, c in the same column indicate significant difference (Tukey P < 0.05).
Cuadro 6: Valores promedio de pH, conductividad eléctrica (CE) e iones salinos solubles en suelos de chinampa por uso de suelo. Table 6: Average values of pH, electrical conductivity (CE) and soluble salt ions in chinampa soils by land use.
| Muestra | pH | CE | CO3 | HCO3 | Cloruros | Ca2+ | Mg 2+ | Na+ | K+ | SO4 |
|---|---|---|---|---|---|---|---|---|---|---|
| H2O | dS m-1 | - - - - - - - - - - - - - - - - mmolc l-1 - - - - - - - - - - - - - - - - | mmolc kg-1 | |||||||
| 1:2.5 | ||||||||||
| SGA | 7.59a | 13.32a | 1.95a | 4.55a | 21.55a | 17.94a | 51.23a | 78.41a | 5.42a | 0.09a |
| Xochimilco | 7.99a | 11.30b | 1.67a | 5.85b | 11.13b | 12.95b | 49.36a | 65.49b | 3.77b | 0.07a |
| Tláhuac | 8.40b | 13.73a | 2.17a | 9.04c | 37.28c | 14.43b | 49.22a | 402.46c | 3.65b | 0.17a |
Literales a, b, c en la misma columna definen diferencia significativa (Tukey P < 0.05).
The letters a, b, c in the same column indicate significant difference (Tukey P < 0.05).
Con base en los valores promedio de CE, PSI y pH, los suelos de San Gregorio Atlapulco, Xochimilco y los cultivados son salinos, mientras que los de Tláhuac, los abandonados y de pastizal son salino sódicos (Cuadros 7 y 8).
Cuadro 7: Valores promedio de iones intercambiables, CIC y PSI en suelos de chinampa por sitios geográficos. Table 7: Average values of exchangeable ions, CIC and PSI in chinampa soils by geographical sites.
| Muestra | Na+ | K+ | Ca+2 | Mg+2 | CIC | PSI | Clasificación |
|---|---|---|---|---|---|---|---|
| - - - - - - - - - - - - - - - - Cmol kg-1 - - - - - - - - - - - - - - - - | Salinidad (Richards, 1994) | ||||||
| SGA | 6.90a | 3.33a | 34.70a | 23.78a | 53.56a | 13.10a | Suelos Salinos Sódicos |
| Xochimilco | 10.41b | 2.84a | 37.99b | 22.27a | 79.25b | 14.13a | Suelos Salinos |
| Tláhuac | 14.74c | 2.23b | 41.40c | 77.66b | 84.41c | 20.14b | Suelos Salino Sódicos |
Literales a, b, c en la misma columna definen diferencia significativa (Tukey P < 0.05).
The letters a, b, c in the same column indicate significant difference (Tukey P < 0.05).
Cuadro 8: Valores promedio de iones intercambiables, CIC y PSI en suelos de chinampa por uso. Table 8: Average values of exchangeable ions, CIC and PSI in chinampa soils by use.
| Muestra | Na+ | K+ | Ca+2 | Mg+2 | CIC | PSI | Clasificación |
|---|---|---|---|---|---|---|---|
| - - - - - - - - - - - - - - - - Cmol kg-1 - - - - - - - - - - - - - - - - | Salinidad (Richards, 1994) | ||||||
| Abandonado | 11.62a | 3.14a | 37.53a | 38.33a | 76.09a | 15.08a | Suelos Salinos |
| Cultivado | 8.02b | 2.80a | 35.42a | 32.55a | 75.38a | 12.65b | Suelos Salinos |
| Pastizal | 12.41a | 2.48a | 41.14b | 52.83b | 65.75b | 19.64c | Suelos Salino Sódicos |
Literales a, b, c en la misma columna definen diferencia significativa (Tukey P < 0.05).
The letters a, b, c in the same column indicate significant difference (Tukey P < 0.05).
Salinidad - Evolución Humus
La salinidad no tuvo correlaciones con la evolución del humus, puesto que las zonas de Tláhuac y pastizal fueron las más contaminadas por sales (Cuadros 5 a 8), sin embargo mostraron más porcentaje de carbono asociado a SH complejas (Figura 2). Esto se atribuyó a los altos contenidos de carbono de 10 a 30 g kg-1 en la zona (Cuadros 1 y 2).
Salinidad - Actividad Enzimática
En cuanto a actividad enzimática y salinidad (Cuadros 3, 5 y 7), no hubo correlaciones, debido a que el comportamiento entre sitios fue diferente, en Tláhuac hubo mayor salinidad pero baja actividad enzimática, mientras que en SGA y Xochimilco, algunas enzimas fueron más activas y ciertos iones salinos se comportaron de forma irregular. Por otro lado, en chinampas con pastizal hubo alta salinidad pero enzimas intracelulares como la catalasa y deshidrogenasa tuvieron actividad (Cuadros 4, 6 y 8). Esto coincide con algunos trabajos reportados, donde hubo respiración del suelo sin correlación con la salinidad o conductividad eléctrica (Rietz y Haynes, 2003). También se ha encontrado que la sensibilidad de las enzimas a la salinidad es irregular, por ejemplo ureasa, fosfatasa alcalina y glucosidasa fueron inhibidas por la salinidad, pero no deshidrogenasa y catalasa (Pan et al., 2013). La explicación fue asociada a la capacidad de los microorganismos halofitos de acumular osmolitos (sales inorgánicas) y adaptarse a condiciones de estrés (Sagot et al., 2010). También a alteraciones, por la presencia de sales, en comunidades fúngicas pero no en bacterianas (Yan et al., 2015). Por tanto en las chinampas debe haber gran diversidad de bacterias que pudieron resistir la salinidad y hacer sus funciones de forma normal, por lo que no se vieron cambios marcados con respecto a la concentración de iones salinos en las actividades enzimáticas.
En las chinampas, deben existir microorganismos con adaptaciones a la salinidad y cambio de la estructura microbiana, así como formación de complejos humus-enzimas, por la alta incorporación de mejoradores orgánicos, esto influyó y enmascaro el efecto de la salinidad sobre la actividad enzimática.
Otra explicación, del efecto salinidad casi nulo, podría estar asociado a la presencia de diferentes porcentajes de humedad en el suelo, puesto que el contenido de agua en chinampas no es constante, por la cercanía de manto freático y los períodos de sequía, siempre cambian de acuerdo al tiempo y el espacio, esto afecta la disponibilidad de sales y nutrientes a plantas y microorganismos. La humedad del suelo y su distribución en el perfil es dependiente de la estación del año, de la precipitación, de la irrigación y de la temperatura (Jin et al., 2013).
Nannipieri et al. (2003), concluyeron que no siempre existe relación directa, entre diversidad microbiana y funcional (actividad enzimática y descomposición de materia orgánica).Esto se apreció en los suelos de chinampas donde las diferentes concentraciones de sales no mostraron relaciones precisas con la actividad enzimática ni con los procesos de humificación.
CONCLUSIONES
- La investigación mostró que los sitios geográficos y usos de suelo estudiados en la zona de chinampas de la Ciudad de México, influyeron en las características de la actividad enzimática y los procesos de humificación, ya que hubo diferencias significativas (Tukey P < 0.05). Por tanto existen cambios en estas propiedades químicas que implican degradación en la zona. La mayor actividad enzimática tanto en chinampas cultivadas, como de pastizal, así como en SGA y Xochimilco definió mayor mineralización (pérdida de nutrientes) en estos sitios y menor en suelos abandonados y de Tláhuac. En cuanto a las SH hubo mayor porcentaje de carbono en AH de chinampas de Tláhuac y pastizal, esto implico la conservación de este nutriente y disponibilidad a largo plazo. Con base en que el uso de suelo asociado al sitio geográfico en las chinampas, fue importante en los cambios de las propiedades químicas analizadas, los factores que deben cuidarse en esta área natural protegida, son el tipo de cultivo y su manejo, que debe incluir rotación de cultivos, para disminuir la pérdida de nutrientes (tendencia a degradaciones químicas mayores).
- La salinidad en los suelos de chinampa cambio según el sitio geográfico y el uso de suelo, puesto que la CE, PSI y pH clasificaron los suelos de SGA, Xochimilco y cultivados como salinos, mientras que los de Tláhuac, abandonados y de pastizal fueron salino sódicos. Sin embargo, la salinidad presente en las chinampas, no afecto los contenidos de carbono de las SH ni la actividad enzimática, atribuido a la formación de complejos humus-enzimas, puesto que en las zonas más contaminadas (Tláhuac y pastizales) hubo menores índices E4/E6, que definieron mayor reserva de carbono. Además, los iones salinos no tuvieron correlaciones con la actividad enzimática ni con los contenidos de carbono de las SH. Esto se atribuyó a los altos contenidos de carbono en los suelos de chinampa, promovidos por la alta incorporación de mejoradores orgánicos (estiércoles y compost).











 text new page (beta)
text new page (beta)



