Introducción
El suelo es el medio natural para el crecimiento de las plantas, y es el hábitat de numerosos microorganismos que desarrollan procesos biológicos vitales en los agroecosistemas y ecosistemas (González et al., 1990; Ruiz-Font, 2008). El suelo influenciado por las raíces de las plantas es la rizósfera, una zona de interacciones únicas y dinámicas entre las raíces y los microorganismos atraídos hacia ellas por los exudados radicales (Hinsinger y Marschner, 2006; Hartmann et al., 2009). Las interacciones entre microorganismos y plantas ocurren en esta zona, donde las plantas influencian directamente la estructura y función de las poblaciones microbianas, lo que tiene implicaciones ecológicas para las funciones del suelo (Eisenhauer et al., 2010) así como para la salud y productividad vegetal (Bloemberg y Lugtenberg, 2001).
Los microorganismos benéficos son parte del manejo sostenible de los ecosistemas a través de diversas estrategias, y se utilizan para beneficio de los seres humanos. En México, hay un creciente interés en los biofertilizantes o inoculantes microbianos para el beneficio de la producción agrícola y forestal, como una herramienta biotecnológica para promover el crecimiento, el desarrollo y la productividad de los cultivos, reducir los niveles de fertilización química y consecuentemente la contaminación ambiental (Padilla-Ramírez y Hernández-Mendoza, 2007).
La inoculación con bacterias no simbióticas y asociativas, como la fijadora de nitrógeno Azotobacter spp. o la solubilizadora de fosfatos Bacillus megaterium, se utiliza en Rusia y Europa del Este, mientras que en México y Argentina se usa la inoculación semi-comercial con hongos micorrízicos arbusculares (HMA) y bacterias promotoras de crecimiento del género Azospirillum (Bashan, 2007). Los HMA del Phylum Glomeromycota, habitan en los suelos y establecen una simbiosis mutualista con cerca del 80% de las plantas terrestres (Smith y Read, 2008). Esta biota microbiana contribuye fundamentalmente con la nutrición de las plantas al proporcionar una buena absorción de minerales, principalmente los poco móviles como el fósforo. También las plantas micorrizadas son más tolerantes a factores abióticos adversos como salinidad, sequía y contaminación (Rabie, 2005; Maiquetía et al., 2009; Camprubi et al., 2011), y bióticos como patógenos y depredadores vegetales (Ozgonen y Erkilic, 2007; Currie et al., 2011; Trinidad-Cruz et al., 2017a).
Los beneficios que la simbiosis micorrízica da a las plantas, son la promoción de crecimiento vegetal y la protección contra enfermedades. En el mercado hay diferentes marcas de inoculantes micorrízicos comercializados como biofertilizantes. Un grupo de estos biofertilizantes contienen propágulos del HMA Rhizophagus intraradices, aislados desde agroecosistemas principalmente de EE. UU. y Canadá, por lo que las respuestas obtenidas en las plantas sean menores a las esperadas dada la baja compatibilidad entre los simbiontes (Alarcón et al., 2012). El origen de los HMA usados como biofertilizantes es de interés, ya que las condiciones de suelo y clima del sitio donde la cepa se aísla, son determinantes para pronosticar las respuestas en las plantas. Los HMA nativos de plantas o condiciones edafo-climáticas regionales particulares, están adaptados a ellas y podrán adecuarse mejor y más rápidamente que los no nativos al ser usados como inoculantes. Por tanto, resulta de interés biotecnológico buscar cepas de HMA nativos de campos agrícolas o ecosistemas naturales adaptados a diversos factores y se puedan utilizar para elaborar biofertilizantes para el campo agrícola mexicano. La papaya (Carica papaya L.) responde positivamente y en corto tiempo a la inoculación con HMA (Khade y Rodrigues, 2009; Quiñones-Aguilar et al., 2012; 2014), por lo que se usó como especie vegetal modelo con el objetivo de evaluar la efectividad de distintos inóculos de HMA nativos aislados de rizósfera de A. cupreata en el crecimiento vegetal de plantas de papaya.
Materiales y Métodos
Material biológico y condiciones del experimento
El experimento en bloques al azar permaneció 100 días en condiciones de invernadero después del trasplante e inoculación de las plántulas de papaya. Se utilizaron ocho consorcios micorrízicos descritos por Trinidad-Cruz et al. (2017b), previamente propagados en invernadero por medio de cultivos trampa empleando arena y semillas de sorgo (Sorghum bicolor (L.) Moench), cebolla (Allium cepa L.) y poro (Allium porrum L.). Los propágulos micorrízicos iniciales se obtuvieron a partir de suelo rizosférico de A. cupreata no cultivado y cultivado en distintas plantaciones ubicadas en la zona de Denominación de Origen del Mezcal (DOM) del estado de Michoacán (Cuadro 1). Como inóculos de HMA de contraste se usaron el biofertilizante comercial a base de HMA EndoMic®, que contiene esporas de Glomus hoi like de origen cubano (comunicación personal con el empresario) y una cepa de Claroideoglomus claroideum (Schenk & Smith), aislada de un suelo volcánico endurecido (tepetate café) de la localidad de Tlalpan, municipio de Hueyotlipan, Tlaxcala; su efectividad como promotora de crecimiento de esta última cepa fue evaluada en Amelanchier denticulata y Eysendhartia polystachya (Hernández-Cuevas et al., 2011).
Cuadro 1 Origen de los consorcios de hongos formadores de micorriza arbuscular (HMA) de plantas de agave mezcalero (A. cupreata) del estado de Michoacán, México.
Table 1 Origin of the fungus consortia forming arbuscular mycorrhiza (AMF) of mezcalero agave plants (A. cupreata) from the state of Michoacán, Mexico.
| Municipio (localidad) | Sitio de muestreo | A. cupreata | Clave† | HMA exclusivo del consorcio‡ |
| Madero (Etúcuaro) | El Huizachal | Cultivado | EH-ME | Scutellospora dipurpurescens, Scutellospora sp. 1 |
| Las Campesinas | Cultivado | LC-ME | Pacispora sp. 1 | |
| Rancho Carlos Rojas | Silvestre | CR-ME | Sclerocystis rubiformis | |
| Morelia (Tumbisca) | El Limón | Cultivado | EL-MTu | Glomus sp. 2, Racocetra gregaria |
| Agua Dulce | Cultivado | AD-MTu | Rhizophagus clarus | |
| Tzitzio (Tzitzio) | Paso Ancho | Cultivado | PA-MT | Glomus sp. 3, Sclerocystis sinuosa |
| Barranca de las Nueces | Cultivado | BN-MT | Ambispora appendicula, Acaulospora sp.3, Glomus sp.1 | |
| Cerro del Metate | Silvestre | CM-MT | Dentiscutata erythropus |
† Clave consorcio indica las iniciales del sitio (dos letras) y el estado (M = Michoacán) del muestreo seguido de iniciales (una o dos letras) de la localidad de colecta. ‡ Según Trinidad-Cruz et al. (2017b).
† Consortium code indicates the initials of the site (two letters) and the state (M = Michoacán) of the sampling followed by initials (one or two letters) of the collection location. ‡ According to Trinidad-Cruz et al. (2017b).
El material vegetal consistió en semillas de papaya “Maradol Roja” (Semillas del Caribe®), cuya germinación se realizó en charolas de plástico, con arena estéril como sustrato. Las semillas emergieron 17 d después de la siembra. Para el trasplante e inoculación se seleccionaron plántulas con dos hojas verdaderas. Como sustrato de crecimiento se empleó una mezcla de arena (70%) y suelo mineral de la región agavera de Michoacán (30%). Ambos componentes se tamizaron para eliminar piedras y basura. Con el f in de eliminar interferencias por la presencia de otros microorganismos, los sustratos para germinación y la mezcla para crecimiento se esterilizaron en autoclave durante ocho horas a 120 °C y 1.055 kg cm-2 de presión. La mezcla esterilizada presentó una textura arena migajosa, pH neutro en agua (7.09), contenido de materia orgánica bajo (1.1%), conductividad eléctrica tipo no salino (0.288 ds m-1), contenido de N, P, K, Ca y Mg de 5, 13, 38, 218 y 147 mg kg-1 respectivamente, estos análisis fueron realizados por el Laboratorio de Análisis Agrícola de la empresa Servicios Analíticos Agroindustriales (SEANA), ubicado en la ciudad de Tarímbaro, Michoacán.
Condiciones de trasplante e inoculación de plántulas de papaya con HMA
Plántulas de papaya con dos hojas verdaderas y crecimiento similar, se trasplantaron a recipientes (bolsas negras de polietileno calibre 400, 30 × 30 cm) con 3 kg de mezcla previamente humedecida. En tratamientos sin inoculación, el trasplante se realizó sembrando una plántula en el centro de la maceta. En tratamientos con inoculación, ésta se realizó espolvoreando la raíz de la plántula al momento del trasplante con 80 esporas de HMA contenidas en arena. Durante el experimento los riegos se hicieron de acuerdo con las necesidades hídricas de las papayas de acuerdo al tamaño de la planta durante el desarrollo del experimento.
Diseño de tratamientos y experimental, análisis estadístico de datos
Se establecieron once tratamientos, del uno al ocho correspondieron a la inoculación micorrízica con los consorcios micorrízicos: 1) EH-ME, 2) LC ME, 3) CR-ME, 4) EL-MTu, 5) AD-MTu, 6) PA-MT, 7) BN‑MT, 8) CM-MT (Cuadro 1); 9) cepa de referencia C. claroideum; 10) biofertilizante comercial (EndoMic®); 11) control sin HMA. Para determinar la efectividad de los inóculos de HMA nativos de agave como promotores de crecimiento vegetal en papaya, 100 días después del trasplante (DDT) se evaluaron seis variables de crecimiento: altura de planta (AP), determinada en mm; diámetro del tallo (DT), determinado con un vernier digital (Surtek, Grupo Urrea®); biomasa seca de follaje (BSF) y de raíz (BSR), para su determinación las plantas se secaron en estufa a 65 °C, hasta peso constante; biomasa seca total (BST), calculada con la sumatoria de la BSF y BSR; área foliar (AF), en cm2, de forma manual, con un integrador automático del área foliar (LI-3100-LI-COR). El Índice Relativo de Dependencia Micorrízica (IRDM), basado en el método propuesto por Plenchette et al. (1983) se usó para determinar el nivel de necesidad de las plantas hacia los HMA. Como variables de respuesta de los HMA a la planta se consideraron el porcentaje de colonización micorrízica (PCM) mediante la técnica propuesta por McGonigle et al. (1990) modif icada, para lo cual las raíces fueron clareadas y teñidas (Phillips y Hayman, 1970), así como la densidad de esporas en 100 g de suelo seco (DE), cuya extracción se realizó por el método de tamizado húmedo y decantación (Gerdemann y Nicolson, 1963); el conteo de esporas se realizó de manera visual y con un contador manual, colocando bajo el estéreo-microscopio (VE-S5C, VelabMR); el tamizado con agua en una caja de Petri (90 mm) cuadriculada. Por último, se determinó el porcentaje de incremento de plantas micorrizadas con respecto a plantas sin micorrizar (PIPM) para las variables AP y BST, mediante la ecuación PIPM = [((AP o BST de planta micorrizada / AP o BST de planta no micorrizada) (100)) - 100].
El diseño experimental fue bloques al azar, con 11 tratamientos y 10 bloques, la unidad experimental (UE) fue una maceta con una planta de papaya y se tuvieron 10 UE por tratamiento. Se realizó un análisis de varianza y una prueba de comparación múltiple de medias Tukey (P ≤ 0.05) para cada variable de respuesta y se hizo un análisis de correlación de las variables de crecimiento con la variable DE mediante el programa Statgraphics (StatPoint Inc., 2005). Las variables BSF, BSR y BST fueron transformadas con Log10, AF con su inverso y DE con raíz cuadrada previo a su análisis estadístico.
Resultados y Discusión
Los HMA nativos promueven el crecimiento vegetal en plantas de papaya
El efecto de los inóculos de los consorcios de los hongos formadores de micorriza arbuscular (HMA) como promotores de crecimiento vegetal en papaya, fue estadísticamente diferente (Tukey, P ≤ 0.05) en la mayoría de las variables de crecimiento evaluadas (Cuadro 2); los inóculos de HMA: CM-MT y EL-MTu promovieron el crecimiento de las plantas en algunas variables de crecimiento evaluadas en comparación con los otros seis inóculos y testigos (Figura 1 y Cuadro 2). Sin embargo; otros consorcios, como BN-MT y AD-MTu también mostraron en AP, DT y PSF diferencias significativas (Tukey, P ≤ 0.05) con respecto al tratamiento sin inoculación de HMA. Estos cuatro inóculos nativos de agave provienen de los municipios de Morelia y Tzitzio, uno de ellos (CM-MT) fue aislado de rizósfera de agave silvestre, el resto se aislaron de agaves cultivados. Con respecto a los porcentajes de incremento en el crecimiento de las plantas para AP fue de 60% con CM-MT y para BST de 240% con AD-MTu. De los inóculos nativos, el tratamiento menos efectivo fue CR-ME, con incrementos con respecto al testigo sin HMA para AP y BST de solo 18 y 20% respectivamente (Figura 2). Los resultados indican que los inóculos CM-MT, EL-MTu, BN-MT y AD-MTu fueron eficientes como promotores de crecimiento de las plantas de papaya, algunos de ellos promovieron crecimiento en altura (inóculo CM-MT) y otros en acumulación de biomasa seca (inóculos AD-MTu y CM-MT) (Figura 2).
Cuadro 2 Efecto de los consorcios micorrízicos en el crecimiento de plantas de papaya en condiciones de invernadero a 100 días después del trasplante.
Table 2 Effect of mycorrhizal consortia on the growth of papaya plants under greenhouse conditions 100 days after transplantation.
| Tratamiento† (inoculo HMA) | Altura de planta | Diámetro de tallo | Biomasa seca de follaje | Biomasa seca de raíz | Área foliar |
| - - - - - - - cm - - - - - - - | - - - - - - - - - g - - - - - - - - | cm2 | |||
| EH-ME | 11.5 abc‡ | 0.694 bc | 0.67 b | 1.95 abcd | 119.7 ab |
| LC-ME | 11.6 abc | 0.755 abc | 1.53 ab | 2.30 abc | 169.0 a |
| CR-ME | 9.8 abc | 0.636 bc | 0.76 ab | 1.15 bcd | 74.8 ab |
| EL-MTu | 12.1 ab | 0.843 ab | 1.34 ab | 2.40 ab | 125.0 ab |
| AD-MTu | 10.9 abc | 0.942 ab | 1.89 ab | 3.17 a | 181.7 a |
| PA-MT | 11.6 abc | 0.791 abc | 1.56 ab | 2.44 ab | 154.3 ab |
| BN-MT | 11.8 ab | 0.851 ab | 1.19 ab | 1.71 abcd | 111.6 ab |
| CM-MT | 13.3 a | 1.064 a | 2.02 a | 3.13 a | 152.8 ab |
| C. claroideum | 10.0 abc | 0.651 bc | 1.09 ab | 1.54 abcd | 119.6 ab |
| EndoMic® | 7.7 c | 0.497 c | 0.81 ab | 0.91 cd | 67.7 ab |
| Sin HMA | 8.3 bc | 0.517 c | 0.68 ab | 0.87 d | 56.3 b |
† Clave: El Huizachal (EH-ME), Las Campesinas (LC-ME); Rancho Carlos Rojas (CR-ME), El Limón (EL-MTu), Agua Dulce (AD-MTu), Paso Ancho (PA-MT), Barranca de las Nueces (BN-MT), Cer ro del Metate (CM-MT). ‡ Letras distintas en la misma columna indican diferencias significativas (Tukey; P ≤ 0.05).
† Key: El Huizachal (EH-ME), Las Campesinas (LC-ME); Rancho Carlos Rojas (CR-ME), El Limón (EL-MTu), Agua Dulce (AD-MTu), Paso Ancho (PA-MT), Barranca de las Nueces (BN-MT), Cerro del Metate (CM-MT ). ‡ Different letters in the same column indicate significant differences (Tukey, P ≤ 0.05).

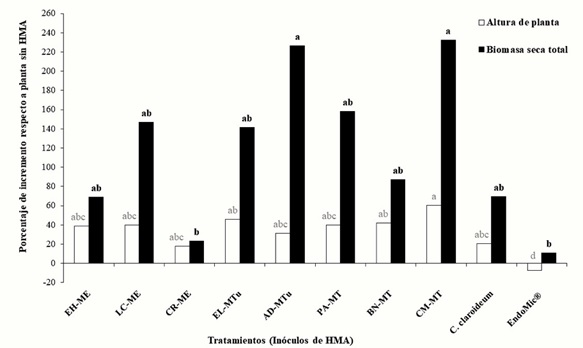
Figura 2 Incrementos en crecimiento de plantas de papaya micorrizadas con respecto a plantas sin hongo micorrízico arbuscular (HMA) en condiciones de invernadero. Letras distintas en el mismo tipo de variable de respuesta (color de rectángulo) indican diferencias significativas, según la prueba de Tukey (P ≤ 0.05).
La cepa de referencia C. claroideum mostró significativamente los menores valores de crecimiento y junto con el biofertilizante comercial EndoMic® y el testigo sin HMA fueron los tratamientos que produjeron la menor respuesta al crecimiento en papaya. No obstante que el biofertilizante comercial (EndoMic®) se recomienda para gramíneas, leguminosas, frutales (entre ellos papaya), hortalizas, ornamentales, etc., los resultados evidencian que no sólo no funcionó eficientemente, si no que, fue perjudicial para la papaya ya que ocasionó un decremento de -7.2% en el crecimiento de las plantas (AP) con respecto al testigo sin inocular (Figura 2). Estos resultados ponen de manifiesto que el empleo de consorcios de HMA de origen regional muestran mayor efecto en el crecimiento y por tanto, podrían ser adecuados para la elaboración de bioinoculantes con potencial para su comercialización como biofertilizantes, debido que a partir de ellos podrán esperarse mejores respuestas de crecimiento vegetal que las producidas por biofertilizantes con HMA de un origen lejano al lugar donde se empleará.
Actualmente existen en el mercado variedad de biofertilizantes a base de HMA (por ejemplo, la micorriza-INIFAP®, la micorriza de Biosustenta®, etc.); sin embargo, la mayoría de éstos contienen propágulos (esporas, hifas y fragmentos de raíz) del HMA Rhizophagus intraradices (sinónimo G. intraradices) que muchas veces suele ser recomendada como cepa universal para todo tipo de plantas y condiciones, por lo que R. intraradices es introducida cada vez más en los campos agrícolas mexicanos, sin la certeza de que los resultados obtenidos serán los mejores y del impacto que se ocasionará en los agroecosistemas por la introducción de cepas exóticas (Alarcón et al., 2012). Al respecto Armenta et al. (2010) indican que para México “la utilización de cepas nativas de microorganismos en la elaboración de biofertilizantes, presentan mayores posibilidades de efectividad en el campo, por estar adaptados a las condiciones del suelo de cada región”.
Los consorcios de HMA provenientes de suelos rizosféricos de A. cupreata utilizados en el presente estudio, fueron probados en otros cultivos de importancia económica, en los que también mostraron su eficiencia. En chile serrano (Capsicum annum L.) el inóculo CR‑ME promovió significativamente el crecimiento en AP, mientras que en maíz fue el CM‑MT y en frijol el AD-MTu (Reyes-Tena et al., 2015). Asimismo, los datos de la presente investigación, indican una preferencia de los consorcios hacia ciertas especies vegetales, según la respuesta de las plantas en términos de crecimiento, ya que mientras los inóculos CM-MT y AD-MTu fueron eficientes para dos especies vegetales, el primero para papaya y maíz (Reyes-Tena et al., 2015), y el segundo para papaya y frijol (Reyes-Tena et al., 2015); el inóculo CR‑ME solo fue adecuado para chile (Reyes-Tena et al., 2015). Por otra parte, los consorcios provenientes de agave, al estar integrados por una mezcla de especies de HMA, tienen la posibilidad de complementar los requerimientos de su planta hospedera, dado que ésta tiene varias posibilidades para elegir al HMA más afín a ella (Ochoa y Montoya, 2010). Los resultados del presente estudio indican un efecto positivo en el crecimiento vegetal por los consorcios, éste efecto es similar al reportado en cultivos tropicales inoculados con HMA; por ejemplo, en un trabajo en condiciones de vivero con C. papaya (cinco meses) y Ananas comosus L. (siete meses), Rodríguez-Romero et al. (2011) informaron un mayor crecimiento en plantas inoculadas con Funneliformis mosseae (sinónimo G. mosseae) y fertilizadas con 18.3 mg kg-1 de P, que en plantas únicamente fertilizadas con 100 mg kg-1 de P, lo que muestra que la micorrización ayuda a promover el crecimiento de las plantas sin aplicación de altos niveles de fertilización fosfatada en vivero.
La papaya es fuertemente colonizada por los HMA nativos
Como un indicador de la eficiencia y funcionalidad de los inóculos en las plantas de papaya, se determinó la colonización micorrízica (PCM) por estructura fúngica a los 100 días después del trasplante (Figura 3). Los resultados muestran que todos los inóculos de HMA colonizaron abundantemente las raíces de las plantas; sin embargo, aunque los PCM por hifas y arbúsculos fueron de 100%, no todos los inóculos estimularon eficientemente el crecimiento vegetal. La papaya es una especie vegetal que alcanza altos porcentajes de colonización, cuando es inoculada expresamente, además hay evidencias que su cultivo en ausencia de HMA y en suelos pobres, presentan crecimiento nulo (Quiñones-Aguilar et al., 2012; 2014). Esta situación coloca a C. papaya como una especie sumamente dependiente de asociarse con los HMA.

Con respecto a la colonización por vesículas las diferencias entre tratamientos fueron significativas (Tukey, P ≤ 0.05). Este aspecto es normal ya que las vesículas no son producidas por todas las especies de HMA, además de que al tratarse de estructuras de reserva, su presencia puede estar sujeta a cambios constantes en el interior de la raíz. Aun así, éstas estuvieron presentes en todos los casos, incluso en plantas inoculadas con EndoMic®. Los resultados del presente trabajo muestran cierta selectividad, debido a que algunos HMA evaluados promovieron el crecimiento vegetal de las plantas, a pesar de haber logrado colonizar la raíz de papaya en su totalidad.
La densidad de esporas de los HMA se relaciona con el crecimiento de papaya
Las esporas formadas por los HMA contienen lípidos de reserva y carbohidratos, sus paredes son gruesas, resistentes y contienen quitina, son la fuente más definida de inóculo y los únicos propágulos empleados para la identificación de especies, siendo además de vital importancia para el aislamiento y establecimiento de cultivos de HMA con fines experimentales (Smith y Read, 2008). En la Figura 4 se muestra la densidad de esporas (DE) generada en la rizósfera de las plantas de papaya inoculadas con los consorcios micorrízicos, presentándose diferencias estadísticas entre los distintos tratamientos (Tukey, P ≤ 0.05). Los consorcios CM‑MT, BN-MT y AD-MTu (1253, 1248 y 1123 esporas en 100 g de suelo seco, respectivamente) presentaron la mayor DE de HMA; por el contrario, los valores más bajos de esporas estuvieron en plantas inoculadas con C. claroideum y EndoMic® (967 y 823 esporas 100 g de suelo seco, respectivamente). Estos resultados sugieren que la respuesta en crecimiento de las plantas estuvo correlacionada positivamente con el grado de proliferación de esporas en la rizósfera (Figura 5), ya que el mayor crecimiento de las plantas se presentó cuando hubo mayor DE, esto puede relacionarse con el crecimiento de la planta, a mayor sistema de raíces hay mayor área de colonización y esporulación, y al haber un follaje más abundante el área fotosintética aumenta, lo que conlleva a un mayor abastecimiento de fotosintatos, necesarios para los HMA. Sylvia y Schenck (1983) indican que la esporulación puede estar relacionada con un incremento en la longitud del sistema de raíces, lo cual permite un mejor desarrollo de las esporas, en este sentido las plantas de papaya que respondieron a la micorrización, también incrementaron su sistema radical (Cuadro 2) y aumentaron su esporulación (Figura 4). Se observó que a pesar de que los consorcios de HMA colonizaron las raíces de las plantas en 100% (Figura 3), no todos promovieron su crecimiento (Cuadro 2); la colonización tampoco estuvo relacionada con la DE, lo cual coincide con numerosas evidencias que señalan que no existe una relación directa entre los niveles de colonización y de esporulación. La diferencia en la DE también pudo deberse a las condiciones experimentales (sustrato de baja fertilidad), dado que no todas las especies de HMA presentes en los distintos inóculos, tienen los mismos requerimientos para cumplir con eficiencia su ciclo de vida. Al respecto, Moreira et al. (2007) mencionan que factores como temperatura, luminosidad, tipo de suelo, exudados radicales e interacción con otros microorganismos podrían influir sobre las especies de HMA y su esporulación. Por su lado Sieverding (1991) menciona que las características del suelo suelen ser determinantes en el desarrollo de los HMA.
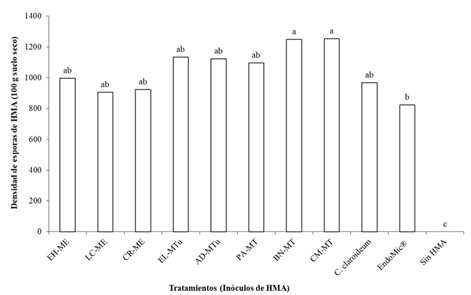

Los consorcios de HMA Agua Dulce (AD-MTu), Cerro del Metate (CM-MT), Paso Ancho (PA-MT) y Las Campesinas (LC-ME) promovieron el crecimiento vegetal, este resultado también se apoya por la correlación positiva encontrada entre la respuesta en crecimiento de las plantas con el número de esporas. Los coeficientes de correlación (r) más altos fueron con DT, AP y BSF (Figura 5). Los pocos nutrimentos, según la Norma Oficial Mexicana (NOM-021-RECNAT-2000, 2002), presentes en el sustrato empleado (N, P y K de 5, 13 y 38 mg kg-1 respectivamente), estuvieron disponibles para las plantas vía la simbiosis micorrízica, por lo que las plantas de papaya necesitan asociarse con HMA en suelos pobres para crecer. Se puede remarcar que las plantas de papaya sin HMA su crecimiento fue mínimo (Figura 1), mientras que las plantas que tuvieron consorcios las variables de crecimiento se incrementaron significativamente, esto pudiera deberse en parte, a la adaptación de los consocios de HMA a las condiciones ambientales de la región, lo cual no sucedió ni con el biofertilizante ni con la cepa C. claroideum que provenían de lugares muy lejanos al sitio de la experimentación.
Índice relativo de dependencia micorrízica (IRDM) de papaya hacia los HMA nativos
En 1975, Menge definió dependencia micorrízica como el grado al cual una planta depende de la micorrización para producir su máximo crecimiento o rendimiento a un nivel dado de fertilidad en el suelo. Aunque en la naturaleza cerca de 80% de las plantas forman micorriza arbuscular (Smith y Read, 2008), la necesidad de las especies vegetales a ésta puede depender del nivel de fertilidad que tenga el suelo (Plenchette et al., 1983). En el presente estudio se determinó la dependencia micorrízica (DM) mediante el IRDM de la papaya Maradol a los inóculos de HMA provenientes de campos agaveros, en un suelo pobre en nitrógeno y fósforo (5 y 13 mg kg-1 respectivamente) de acuerdo a la Norma Oficial Mexicana (NOM-021-RECNAT-2000, 2002). Los resultados de DM mostraron niveles variables, esto dependió del consorcio de HMA (Figura 6). Los grados de DM dados en porcentaje del IRDM estuvieron entre 10 y 70%. Los consorcios AD-MTu y CM-MT exhibieron los IRDM más altos, mientras que los inóculos CR-ME y EndoMic® presentaron los menores valores de dependencia. Esto sugiere que además del nivel de fertilidad en el suelo, los niveles de DM pueden ser afectados por la cepa o consorcio de HMA inoculado independientemente del porcentaje de colonización micorrízica, dado que todos los inóculos de HMA tuvieron una colonización por arbúsculos de 100% (Figura 3). No obstante, la DM está relaciona con los inóculos que promovieron el crecimiento de la planta (AD-MTu y CM-MT), por lo que el inoculo más deficiente en la promoción de crecimiento (EndoMic®) solo tuvo una DM de 10%. Al respecto, existen estudios que indican que a pesar de que el genoma de la papaya determina la dependencia micorrízica, ya que distintas variedades inoculadas con los mismos HMA y dosis de P responden diferencialmente a la micorrización (Trindade et al., 2001), también la especie de HMA es importante para inducir esta respuesta (Khade y Rodrigues, 2009). Quiñones-Aguilar et al. (2016) mostraron que los inóculos CM y AD tuvieron una dependencia micorriza alta empleando como planta hospedera a Agave inaequidens. Estos últimos datos en conjunto con los obtenidos en el presente estudio apuntan hacia la existencia de diferentes niveles de afinidad entre la especie vegetal y las especies o consorcios de HMA.
Conclusiones
Las plantas de papaya respondieron positivamente a la inoculación con los hongos formadores de micorriza arbuscular (HMA). Los consorcios de HMA provenientes de la rizósfera de A. cupreata del estado de Michoacán, manifestaron un efecto significativo en crecimiento vegetal de papaya, en comparación con el biofertilizante comercial EndoMic® (Glomus hoi like) o la cepa de referencia Claroideoglomus claroideum. Los consorcios de HMA CM-MT, AD-MTu, BN-MT y EL-MTu mostraron el mayor efecto significativo en el crecimiento en plantas de papaya.











 nueva página del texto (beta)
nueva página del texto (beta)



