Introducción
Los Andisoles son los suelos prevalecientes en la Meseta P’urhépecha, Michoacán (Alcalá et al., 2001). Estos suelos presentan una reducida disponibilidad de fósforo (P) y una acuciante retención de fosfatos, debida a la alta composición de materiales amorfos, como la imogolita, ferrihidrita, alófano y complejos órgano minerales de aluminio (Al) y hierro (Fe) (Dahlgren et al., 2004; Soil Survey Staff, 2006), que limitan el crecimiento vegetal.
En esta región, el uso potencial de los suelos de Ando es de bosque, pero una vasta superficie se ha transformado hacia el uso agrícola, principalmente para el cultivo de maíz y aguacate (Sánchez et al., 2009; Bravo-Espinoza et al., 2014; Orozco-Ramírez y Astier, 2017). El cambio de uso del suelo puede alterar las propiedades físicas, químicas y biológicas y, por tanto, su fertilidad y capacidad productiva (Maranguit et al., 2014). Los factores que alteran la distribución y disponibilidad de P en el suelo, incluyen las características inherentes del material parental, la disminución de la materia orgánica, la fuerte adsorción de PO43- con Al3+ y Fe3+ (hidróxidos) y la baja o inadecuada aplicación de fertilizantes orgánicos e inorgánicos (Bravo-Espinoza et al., 2014; Galván-Tejada et al., 2014; Maranguit et al., 2017; Maharjan et al., 2018).
En el suelo, el P está representado por diversas fracciones que se definen por su relación con sus constituyentes minerales y orgánicos (Hedley et al., 1982). Del contenido total de P en el suelo, sólo una pequeña fracción está en forma soluble (10-1%) (Kruse et al., 2015) y disponible para el crecimiento del cultivo; esta fracción está en equilibrio con la forma lábil que constituye los fosfatos adsorbidos a las arcillas y el P orgánico de fácil mineralización. El resto del P del suelo se encuentra en fracciones insolubles como fosfatos de hierro (Fe3+), aluminio (Al3+) y calcio (Ca2+) y fosfatos inmovilizado en las arcillas o adsorbidos en el humus (Nanzyo, 2002; Dahlgren et al., 2004; Kruse et al., 2015).
La disponibilidad de P para el crecimiento vegetal, tanto en ecosistemas naturales como agrícolas, depende de la interacción de sus diferentes fracciones en el suelo y de su regulación mediante procesos físico-químicos (sorción-desorción) y biológicos (mineralización e inmovilización) (Dahlgren et al., 2004; Crews y Brookes, 2014). Estos procesos pueden ser alterados por el manejo agronómico al que el suelo es expuesto. Por ejemplo, la conversión del bosque hacia sistemas agrícolas disminuye la cantidad de P lábil e incrementa la proporción de formas no disponibles (Galván-Tejada et al., 2014). La erosión acelerada, debida a la deforestación y cambio de uso del suelo reduce la materia orgánica (Zheng et al., 2005; Sánchez et al., 2009) e impide que este importante substrato orgánico libere P lábil (Maharjan et al., 2018). Por tanto, su fraccionamiento es útil para cuantificar el destino del P natural y aplicado a un sistema (Condron y Newman 2011; Riskin et al., 2013) y conocer las propiedades que controlan el contenido y comportamiento del P (Crews y Brookes, 2014; Galván-Tejada et al., 2014).
Existen diversas metodologías para fraccionar el P del suelo (Hedley et al., 1982; Cross y Schlesinger, 1995; Condron y Newman 2011). En general, éstas consisten en la extracción secuencial de una muestra de suelo con diversas soluciones que digieren correspondientemente determinados componentes unidos con el P. Así, se han identificado diversas categorías como P lábil, P unido a sesquióxidos de Fe y Al, P unido a fosfatos de calcio, P unido a formas orgánicas y, por último, una fracción de P residual u ocluido que tiene muy baja disponibilidad para las plantas. En particular, la metodología propuesta por Hedley et al. (1982) ha mostrado una buena relación con las formas de P del suelo y el crecimiento de los cultivos (Crews, 1996; Buehler et al., 2002; Redel et al., 2016).
Las técnicas radio-isotópicas, por otra parte, han sido concluyentes en la cuantificación del ortofosfato que puede ser transferido de la fase sólida del suelo a la solución (Frossard et al., 1993, Di et al., 1997) y en la determinación del tiempo en que el P está disponible para el crecimiento de las plantas durante el ciclo del cultivo (Frossard et al., 1993). Con estas técnicas, es posible marcar el P del suelo, el fertilizante y los residuos de plantas antes de aplicar el esquema de fraccionamiento secuencial (Buehler et al., 2002; Chen et al., 2003; Vu et al., 2010; Condron y Newman, 2011). A pesar de la importancia de estos métodos, su uso en estudios de dinámica de P en el suelo en México, es limitado.
En este estudio, se usaron los métodos de extracción secuencial y dilución isotópica para evaluar el efecto del uso del suelo (bosque y cultivado) y la adición de fertilizante fosfatado en las fracciones de P y su labilidad en un Andisol de la Meseta P’urhépecha. La hipótesis de trabajo señala que la disponibilidad de P en las diferentes formas extraídas secuencialmente, variará de acuerdo al uso del suelo y su intercambio dependerá de las características químicas del mismo.
Materiales y métodos
Propiedades del Suelo y Muestreo
El estudio se realizó en la Meseta Purhépecha, en la localidad de Cherán (19° 44’ 15” N y 102° 04’ 45” O), en el estado de Michoacán. El clima de esta región es templado sub-húmedo con lluvias en verano [C (w2) (w)]. La temperatura media anual es de 20 °C y la altura de 2140 m. El suelo es un Typic Hapludand (Soil Survey Staff, 1999) con una alta capacidad de intercambio catiónico (9.3-25 cmol kg‑1), materia orgánica (1.1‑8.6%) y baja saturación de bases (< 30%) (Alcalá et al., 2001). De acuerdo a Alcalá et al. (2009), en esta región se presenta una alta retención de fosfatos (> 55%) debida a la alta proporción de alófano (13‑26%), Al (1.6‑6.4%), Fe (0.8-5.5%) y ferrihidrita (5.8-8.4%). En el sitio de estudio, se eligió un área de 5 ha, en la cual estaban ubicados dos lotes contiguos dedicados a un uso de suelo de bosque de pino-encino (suelo nativo) y otro a cultivo de maíz (suelo cultivado). En esta superficie, se realizó un muestreo representativo del suelo siguiendo un diseño de cuadrícula de 6×8 puntos a una distancia de 40 m. Las muestras obtenidas a una profundidad de 0-20 cm, se mezclaron para conformar una muestra compuesta. Posteriormente, se secaron y tamizaron (< 2 mm) antes de la incubación y determinaciones de P. Se incluyeron los siguientes tratamientos: 1) Suelo nativo (Nativo -P); (2)Suelo nativo +P (Nativo +P); (3) Suelo cultivado (Cultivado -P); (4) Suelo cultivado +P (Cultivado +P). Para los tratamientos con P (Nativo +P y Cultivado +P), el P se adicionó como fosfato de amonio di-básico [NH4 (PO2)2] en tasas equivalentes a 10 y 40 mg kg-1 de fósforo. Para el tratamiento testigo, sólo se adicionó agua deionizada.
Características Físico-Químicas del Suelo
El análisis del suelo se realizó conforme a los métodos de la Norma Mexicana (NOM-021-RECNAT, 2000). Se usó el método de Bouyoucos para analizar la textura del suelo. La densidad aparente se evaluó en muestras de 211 cm3 deshidratadas a 105 °C hasta temperatura constante. El pH se midió de una suspensión de 1:2 agua: suelo. El aluminio intercambiable se extrajo con una solución 1.0 M de KCl y se determinó por titulación con 0.1 M de NaOH. La materia orgánica total se determinó por combustión (TOC-5050A Shimadzu). Las bases intercambiables y la capacidad de intercambio catiónico se determinaron por la técnica de acetato de amonio 1 N a pH 7. Los cationes (Ca, Mg, Na, K y Fe) se analizaron con un espectro de absorción atómica (SpectrAA 220 Varian). El P disponible (0.030 M NH4F, 0.1 M HCl) se determinó por el método de Bray y Kurtz (1945). En el Cuadro 1 se presentan las características físicas y químicas del suelo.
Cuadro 1 Propiedades físico-químicas (0-20 cm) del suelo de bosque y cultivado.
| Sistema | Textura | Bases intercambiables | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Arena | Limo | Arcilla | MO† | pH | CIC‡ | Ca | Mg | K | Na | Al§ | Fe | P | |
| - - - - - - - - % - - - - - - - - | - - - - - - - - - - cmolc kg-1 - - - - - - | - - - - - mg kg-1 - - | |||||||||||
| Bosque | 72.2 | 16.0 | 11.8 | 2.9 | 6.1 | 12.5 | 8.4 | 3.2 | 0.82 | 0.09 | 0.18 | 84.8 | 2.1 |
| Cultivado | 60.1 | 21.6 | 18.3 | 1.8 | 6.0 | 9.6 | 6.5 | 1.7 | 1.14 | 0.11 | 0.14 | 52.5 | 5.5 |
†MO = materia orgánica; ‡CIC = capacidad de intercambio catiónico; §Al = aluminio intercambiable.
Fraccionamiento Secuencial del Suelo Marcado con 32P
Antes de realizar el fraccionamiento del suelo, las muestras se pre-incubaron en una cámara (25 ºC y 65% humedad relativa) durante dos semanas en porciones de 100 g a 50% de su capacidad de campo. Las muestras pre-incubadas del suelo se marcaron con 1 mL de KH2 32P04 (5.3 MBq en 50 g suelo). El suelo se fraccionó secuencialmente después de un periodo de 49 días de incubación de acuerdo al método propuesto por Hedley et al. (1982) y modificado por Condron et al. (1985). En resumen, cada muestra de suelo (0.5 g) fue sujeta a una extracción secuencial, primeramente con resinas de intercambio aniónico (Resina-Pi) y después con NaHCO3 0.5M (Bic-Pi) para determinar la fracción lábil de P inorgánico; seguidamente se realizó la extracción con NaOH 1.0 M (NaOH0.1-Pi) y NaOH 5 M (NaOH0.5-Pi) para cuantificar el P unido a sesquióxidos Fe/Al amorfos y cristalinos (Hedley et al., 1982) y una extracción con HCl 1M (HCl-Pi) para determinar el P unido al calcio. Por último, se determinó el P residual u ocluido mediante una digestión con una mezcla de H2SO4 + H2O2 concentrados. El P asociado a la fracción orgánica se analizó por la diferencia entre el P obtenido a partir de la digestión con H2SO4 concentrado de alícuotas de los extractos obtenidos NaHCO3 0.5 M, NaOH 1 M y NaOH 5 M, a la cual se le sustrajo la cantidad correspondiente al P lábil delimitado previamente con los mismos extractantes. La concentración de P de los extractos ácidos y alcalinos se determinó con el método de Murphy y Riley (1962) y Dick y Tabatabai (1977), respectivamente. Para separar la fase soluble de 32Pi y 32Po de los extractos de NaHCO3 (Bic-Po) y NaOH (NaOH0.1-Po y NaOH0.5‑Po), se usó molibdato de amonio disuelto en isobutanol (Jayachandran et al., 1992). La radioactividad de cada fracción se determinó en un contador (Hidex 300 SL) usando líquido de centelleo (Packard Instagel Plus XF) en una relación 2:18 (extracto: líquido).
La actividad específica (AE) del suelo, se determinó como Radioactividad (R) (32P) por unidad de P (31P) (Bq mg-1 P). La proporción de P (%) y la cantidad de P (mg kg-1) en cada fracción de P del suelo derivada de las dos fuentes de P adicionado, se calculó de acuerdo a la técnica de dilución isotópica descrita por Fardeau (1996).
donde: AEfracción y AEP adicionado corresponden a la AE (Bq mg-1 P) de cada fracción y el P marcado que se adicionó al suelo, respectivamente.
Análisis Estadístico
Los análisis se realizaron con base a un diseño de bloques completos al azar con tratamientos arreglados en parcelas divididas con tres repeticiones por tratamiento. Se utilizó el procedimiento GLM para el análisis estadístico de los datos obtenidos de las cantidades de 31Pi en las diferentes fracciones del elemento y para cada uso de suelo y nivel de P aplicado. Los datos de porcentaje de 32Pi recuperado en cada fracción se transformaron a base logarítmica para su posterior análisis estadístico. La separación de medias se realizó con Tukey con valores de P ≤ 0.05 para comparar las diferencias entre uso del suelo y tratamientos de P en cada fracción evaluada (SAS Institute, 2000). Se utilizó el análisis de correlación de Pearson (P ≤ 0.05) para relacionar las formas de P con las características químicas del suelo.
Resultados y discusión
Efecto del Uso de Suelo y Fertilización en las Fracciones de Fósforo
El tipo de uso del suelo y la aplicación de fertilizantes afectan las propiedades físicas y químicas del mismo (Maranguit et al., 2014). En este estudio, se observó que el suelo cultivado (cultivado-P) presentó un incremento en la saturación de bases (K+) y un decremento en la concentración de Fe2+, en comparación al de bosque (Bosque -P) (Cuadro 1). La disponibilidad de P en la solución, por consiguiente, aumentó con la fertilización (2.1 a 5.1 mg kg-1). A pesar de ello, la concentración de P disponible fue inferior al requerido para un adecuado crecimiento del cultivo (>15 mg kg-1) (Crews, 1996; Setiyono et al., 2010).
En el Cuadro 2, se muestran los contenidos obtenidos de las diferentes fracciones de P. Los tratamientos con P tuvieron un efecto significativo en las fracciones inorgánicas. Asimismo, las diferencias entre uso del suelo, tratamientos de P y las interacciones para todas las fracciones, excepto las orgánicas (NaOH0.1-Po y NaOH0.5-Po) fueron significativas. El P total del suelo de bosque y cultivado incrementó significativamente por efecto de la dosis de P aplicado (662 a 747 y 695 a 828 mg kg-1, respectivamente) y éste fue mayor con respecto a los suelos no fertilizados (620 y 615 mg kg-1). De acuerdo a Kruse et al. (2015), el P total en el suelo varía de 101 a 103 g kg-1, dependiendo del horizonte del suelo (sub-suelo < superficie), substrato (arenoso < limoso), pedogénesis (antiguo < reciente), uso del suelo (bosque < pastizal < cultivado) y su intensidad de uso (extensivo < intensivo). Las concentraciones obtenidas en este estudio se encuentran en el rango reportado en Andisoles (490-2425 mg kg-1) (Crews, 1996; Redel et al., 2008; Meason et al., 2009; Galván-Tejada et al., 2014) y constituyen, a largo plazo, un suministro potencial de P.
Cuadro 2 Fracciones de fósforo (P) obtenidas en un Andisol de la Meseta P’urhépecha con diferente uso de suelo y fósforo adicionado.
| Tratamientos | Resina | Bicarbonato | NaOH0.1 | HCl | NaOH0.5 | Residual | Total | |||
|---|---|---|---|---|---|---|---|---|---|---|
| Pi | Pi | Po | Pi | Po | Pi | Pi | Po | Pi | P | |
| - - - - - - - - - - - - - - - - - - - - - - - - - - mg kg-1 - - - - - - - - - - - - - - - - - - - - - - - - - - | ||||||||||
| Bosque 0P | 3.7 b | 28.2 ab | 16.1 a | 42.1 c | 77.6 a | 21.8 a | 83.5 c | 30.0 b | 319.5 a | 618.5 c |
| Bosque 10P | 4.7 a | 24.2 b | 18.8 a | 59.8 b | 77.0 a | 26.6 a | 101.0 b | 38.5 a | 307.3 a | 661.8 b |
| Bosque 40P | 3.8 b | 31.3 a | 21.4 a | 80.6 a | 78.0 a | 24.1 a | 119.5 a | 42.8 a | 315.5 a | 747.1 a |
| Cultivado 0P | 5.1 b | 28.3 b | 23.3 a | 60.1 c | 31.8 a | 35.1 b | 58.2 c | 33.0 a | 339.5 c | 614.5 c |
| Cultivado 10P | 7.6 a | 36.2 a | 15.6 b | 67.3 b | 42.4 a | 45.5 a | 69.9 b | 30.8 a | 373.1 b | 688.4 b |
| Cultivado 40P | 7.9 a | 42.5 a | 15.2 b | 99.1 a | 35.0 a | 50.7 a | 80.6 a | 29.5 a | 462.0 a | 821.8 a |
| ANOVA | ||||||||||
| Suelo (S) | *** | *** | NS | *** | *** | *** | *** | NS | *** | *** |
| Fósforo (P) | *** | ** | * | *** | NS | *** | *** | ** | ** | *** |
| S × P | *** | * | * | *** | NS | *** | * | NS | *** | ** |
Letras en la misma columna indican diferencias significativas según la prueba de Tukey (P ≤ 0.05). NS = no significativo. * Significativo a P ≤ 0.05, ** P ≤ 0.01, ***P ≤ 0.001. ANOVA para uso de suelo, nivel de P aplicado e interacción.
El suelo cultivado (cultivado +P) presentó, en cambio, los valores más altos de P inorgánico lábil (Resina-Pi + Bic-Pi) (44 y 50 mg kg-1) con respecto al de bosque (bosque +P) (29 y 35 mg kg-1, respectivamente). A pesar de que la fertilización promueve que la fracción lábil se mantenga en rangos altos (Riskin et al., 2013), es común que en Andisoles esta fracción sea menor debido a su alta sorción (Dahlgren et al., 2004; Soil Survey Staff, 2006). En términos porcentuales, el P-lábil varió entre 5 a 6% con respecto al P total (Figura 1), lo cual coincide con valores obtenidos por otros autores (Bünemann et al., 2004; Galván-Tejada et al., 2014; Redel et al., 2016).
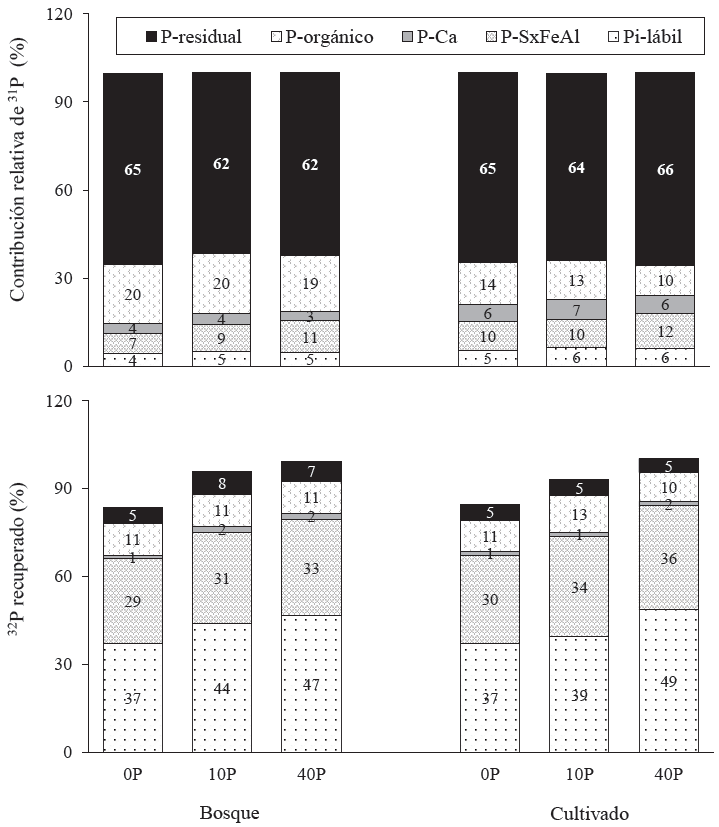
Figura 1 Contribución relativa de las formas de 31P con respecto al P total y porcentaje de 32P recuperado: Pi-lábil (Resina + Bicarbonato), P-SxAlFe (NaOH0.1); P-Ca (HCl); P-orgánico (Bicarbonato + NaOH0.1 + NaOH0.5) y P-ocluido (P-residual + NaOH0.5) en un Typic Haplaund con diferente uso del suelo y P adicionado (0, 10 y 40 mg kg-1).
El fósforo de la fracción inorgánica de NaOH0.1-Pi fue significativamente mayor en el suelo cultivado, de 60 a 99 mg kg-1 (Cuadro 2) y constituyó de 10 a 12% de P total (Figura 1). Esta fracción es un componente importante en sistemas agrícolas (Crews, 1996) y forestales de México (Galván-Tejada et al., 2014) pero su disponibilidad es reducida debido a que el P está quimio-adsorbido en el interior de fosfatos amorfos de Fe y Al (Dahlgren et al., 2004). Según Kruse et al. (2015), el aumento de la concentración de óxidos de Fe y Al a pH menores de 5.5, intensifica la proporción de P adsorbido o fijado y reduce la eficiencia del fertilizante aplicado. Alcalá et al. (2009), mencionan que en Andisoles de la Meseta P’urhépecha, los aumentos de esta fracción están relacionados linealmente con Al intercambiable y Fe amorfos. En nuestro estudio, observamos que el Al (r = 0.53; P < 0.01) se correlacionó negativamente con el NaOH0.1-Pi (Cuadro 3). Esta correlación es atribuida al aumento de la actividad del Al intercambiable.
Cuadro 3 Recuperación de 32P (%) del total adicionado (0, 10 y 40 mg kg-1) en cada forma de fósforo (P) de un Andisol de la Meseta P’urhépecha.
| Tratamientos | Resina | Bicarbonato | NaOH0.1 | HCl | NaOH0.5 | Residual | |||
|---|---|---|---|---|---|---|---|---|---|
| Pi | Pi | Po | Pi | Po | Pi | Pi | Po | Pi | |
| Bosque 0P | 23.6 c | 13.6 b | 4.9 a | 28.8 c | 4.3 a | 1.3 b | 3.5 c | 1.3 b | 2.0 a |
| Bosque 10P | 27.4 b | 16.5 a | 6.4 a | 31.2 b | 3.4 b | 1.6 a | 5.5 b | 1.6 a | 2.1 a |
| Bosque 40P | 30.1 a | 17.5 a | 5.9 a | 35.0 a | 3.2 b | 2.1 a | 4.7 a | 1.8 a | 2.0 a |
| Cultivado 0P | 23.4 b | 13.9 b | 3.3 b | 30.1 b | 5.9 a | 1.3 b | 3.7 b | 1.6 b | 1.4 b |
| Cultivado 10P | 24.5 b | 14.9 b | 5.6 a | 39.4 b | 5.4 a | 1.2 b | 4.0 b | 1.8 a | 1.5 b |
| Cultivado 40P | 30.4 a | 18.2 a | 3.8 a | 39.5 a | 4.9 a | 1.6 a | 3.2 a | 1.2 a | 1.9 a |
| ANOVA | |||||||||
| Suelo (S) | ** | NS | ** | NS | *** | *** | *** | ** | *** |
| Fósforo (P) | *** | *** | NS | *** | * | *** | *** | ** | * |
| S × P | * | ** | NS | * | * | * | *** | ** | * |
Letras en la misma columna indican diferencias significativas según la prueba de Tukey (P ≤ 0.05). NS = no significativo. * Significativo a P ≤ 0.05, ** P ≤ 0.01, ***P ≤ 0.001. ANOVA para uso de suelo, nivel de P aplicado e interacción.
El P de la fracción HCl del suelo de bosque fue muy bajo, variando de 22 a 27 mg kg-1. Los mayores contenidos hallados correspondieron al suelo cultivado, de 35 a 51 mg kg-1, probablemente debido a la mayor cantidad de fosfatos primarios en el suelo (Shoji et al., 1993). El HCl-Pi, correspondiente a la fracción de Pi más estable en minerales primarios de baja solubilidad como la apatita, fue mínimo (< 2%). Esto explica la pobre extracción con 1 M HCl y la incapacidad del ácido para disolver los fluorofosfatos de Ca. La relación negativa entre el contenido de Ca y la fracción de HCl (r = 0.55; P < 0.01) corroboran este hecho.
De todas las fracciones inorgánicas de P, el Pi-residual alcanzó los valores más elevados en el suelo cultivado con 339 mg kg-1 seguido del suelo de bosque, con 320 mg kg-1. La fracción Pi-residual menos soluble presentó los contenidos más altos con la adición de P (462 mg kg-1). Estos valores concuerdan con los de Velásquez et al. (2016) quienes hallaron, en los suelos con mayor grado de meteorización (Andisoles) fracciones más insolubles unidas a arcillas y sesquióxidos. El Pi-residual es, según Dahlgren et al. (2004), el reservorio interno de Pi ligado al Fe2+. El Pi-residual representó de 63 a 65% del P total, lo cual refleja la menor disponibilidad y el aumento de formas recalcitrantes y de difícil transformación (Hedley et al. 1982). Los resultados de este estudio confirmaron que relación entre el contenido de Fe2+ (r = 0.93; P < 0.001) y el P residual del suelo es negativa, lo que demuestra la alta fijación de P debido a la presencia mineral de Fe2+.
Como se esperaba, el suelo de bosque presentó el mayor contenido de P orgánico en comparación al cultivado y éste no varió con la adición de P (Cuadro 2). Particularmente, las formas de NaOH0.1-Po, resultaron de mayor importancia en el suelo de bosque, en promedio 77 mg kg-1. La participación del P-orgánico (Bic-Po, NaOH0.1-Po y NaOH0.5-Po) con respecto al P-total, en términos porcentuales (Figura 1) correspondió a 21%. De acuerdo a Beck y Sánchez (1994), valores superiores del 20% del P-total establecidos en la forma orgánica representan una importante reserva de P en el suelo (Beck y Sánchez, 1994). En el suelo con manejo agrícola, hubo una disminución significativa del P orgánico (29 mg kg-1) por efecto de la aplicación de fertilizante (Cuadro 2). Este representó el 14% del P total (Figura 1). Las diferencias en esta fracción probablemente estén relacionadas con la historia de fertilización de este suelo; al parecer por una reducción de la materia orgánica (Cuadro 1) en paralelo con un incremento en la mineralización del P orgánico (Velásquez et al., 2016; Maranguit et al., 2017). Una menor cantidad de residuos depositados en la superficie puede disminuir el contenido de materia orgánica (Bravo-Espinoza et al., 2014; Maharjan et al., 2018) y la capacidad del suelo para retener las fracciones de NaOH-Po (Zamuner et al., 2008). El mayor contenido de P orgánico determina un aumento de las formas de mayor asimilabilidad (Bic-Po y NaOH-Po), que por posterior mineralización se transformarían en Bic-Pi (Cross y Schelesinger, 1995; Guppy et al., 2005). Meason et al. (2009) mencionan que en Andisoles, los altos contenidos de materia orgánica pueden encubrir los sitios de sorción de P relacionados a Fe y Al, y que éstos pueden ser una fuente importante para el P-lábil. En este estudio, observamos que hubo una correlación positiva (P ≤ 0.01) entre la materia orgánica y las diferentes formas de P orgánico del suelo (Bic-Po; r = 0.55 y NaOH0.1-Po; r = 0.68). Es posible, que estas fracciones hayan contribuido con el incremento de la fracción inorgánica lábil (Cuadro 2).
La Distribución de 32P entre las Formas de Fósforo
La técnica de dilución isotópica demostró que el 32P se intercambió rápidamente con las fracciones inorgánicas de P en la resina y, progresivamente, con las formas menos lábiles de Bic-Pi e NaOH0.1-Pi (Cuadro 3). Estas fracciones, a su vez, aumentaron con la adición de P, siendo la fracción de NaOH0.1-Pi, la mayor fuente del nutriente. En la fracción lábil de ambos suelos (Resina-Pi + Bic-Pi) se recuperó el 37% de P (Cuadro 3; Figura 1) y este porcentaje aumentó a 47% con la adición de fertilizante. Asimismo, la cantidad de 32P extraído en la fracción inorgánica de NaOH0.1-P fue alta (36%). En las fracciones inorgánicas (HCl-Pi y residual), por el contrario, sólo se recuperó una pequeña cantidad de 32P (< 2%) (Figura 1).
En los Andisoles de esta región, las fracciones de resina-Pi + Bic-Pi y NaOH0.1-Pi, constituyen importantes reservorios de P en el suelo. Nuestros resultados son consistentes con los obtenidos en Oxisoles (Buhler et al., 2002), Vertisoles y Acrisoles (Vu et al., 2010). Estos estudios demostraron que el 33P se intercambia rápidamente con la fracción de Pi de resina, y progresivamente en formas moderadamente lábiles (NaHCO3 y NaOH0.1-P). La fracción inorgánica de HCl y residual, por el contrario, estuvo pobremente involucrada en los procesos de intercambio con 32P, ya que esta forma corresponde al P que está fuertemente adsorbido en la superficie de apatitas y que no está disponible para la planta (Shoji et al., 1993). La recuperación de 32P en la fracción orgánica (21%) del suelo de bosque fue significativa y demostró que estas formas contribuyen notoriamente en la dinámica de P en ecosistemas naturales. Rodrigues et al. (2015) mencionan que en suelos tropicales, el mantenimiento de las formas orgánicas de P es un acervo crucial para el funcionamiento y productividad del suelo ya que éste es menos susceptible a las reacciones de sorción.
En general, en los suelos cultivados y fertilizados, ocurrió un mayor intercambio isotópico entre las formas inorgánicas lábiles (resina y bicarbonato) y moderadamente lábiles (NaOH0.1-P), resaltando la importancia de este acervo como P potencialmente disponible para la planta. Las fracciones orgánicas, al contrario, parecen ser más importantes en suelos que aún no han sido fertilizados. Similares resultados fueron reportados por Oberson et al. (2001) y Briceño et al. (2004).
Conclusiones
El uso del suelo afectó las formas y distribución del fósforo (P). El P derivado del suelo cultivado (con historia de fertilización) y de bosque se distribuyó entre todas las fracciones inorgánicas y orgánicas pero su proporción dependió de las características del mismo. El Pi estuvo representado mayormente por formas químicas estables (NaOH-Pi) y relativamente insolubles (HCl-Pi y Residual-Pi). El P adicionado al suelo se acumuló mayormente en las formas inorgánicas lábiles (Resina-Pi y Bic-Pi) y de moderada labilidad (NaOH0.1-Pi), que están relativamente accesibles para los cultivos. Por el contrario, el P orgánico lábil (Bic-Po) y moderadamente lábil (NaOH-Po) disminuyó por el cambio de uso del suelo y la reducción de la materia orgánica.
Con el uso de 32P se confirmó que existe un rápido intercambio entre las fracciones lábiles y el 31P adsorbido en la superficie del suelo (Resina-Pi y NaHCO3-Pi) y las fracciones menos lábiles (NaOH0.1-Pi). El 32P se distribuyó en todas las fracciones inorgánicas, sugiriendo que todas las fracciones sufren, directa o indirectamente, un intercambio con 32P. Sin embargo, la recuperación de 32P dependió de la historia de fertilización y las características físico-químicas del suelo. La alta proporción de 32P recuperado en la fracción de NaOH-Pi sugiere que esta fracción es de gran importancia en la fertilidad de Andisoles cultivados. En el suelo de bosque en donde no se aplicó fertilizante, por el contrario, las fracciones orgánicas fueron más importantes (21%) en mediar la disponibilidad de P. Las técnicas de fraccionamiento secuencial y radio-isotópica fueron concluyentes en la caracterización de las formas y cuantificación del ortofosfato que puede ser transferido de la fase sólida del suelo a la solución. Esta información es de especial relevancia para ampliar el conocimiento sobre el impacto del cambio del uso del suelo sobre este recurso natural.











 nueva página del texto (beta)
nueva página del texto (beta)


