Introducción
La fenología vegetal se refiere a la producción periódica de las estructuras vegetativas y reproductivas, es resultado de las interacciones entre factores bióticos y abióticos que determinan el tiempo más adecuado para el crecimiento y la reproducción de las plantas (van Schaik et al., 1993). La repetición anual de eventos fenológicos sincronizados con el clima, tales como floración y fructificación, es frecuentemente utilizada para definir las secuencias estacionales (Bradley et al., 1999). Entre los eventos fenológicos, la floración es un proceso importante al influir en la formación de los frutos y al afectar a muchos animales que dependen del néctar como recurso energético (Parada Quintero et al., 2012).
Una de las consecuencias más probables del cambio climático, es la pérdida de sincronización entre especies en distintos niveles tróficos, manifestado como el desajuste entre los requerimientos y la disponibilidad de alimento para las de niveles superiores, lo cual puede repercutir en fracasos reproductivos o disminución de la supervivencia (Moreno et al., 2005).
El uso de plantas como indicadores biológicos juega un papel importante en el desarrollo de investigaciones sobre la variabilidad ambiental, cambio climático y efectos antropogénicos, dada su sensibilidad de respuesta a las condiciones climáticas y edafológicas, no solo predicen los cambios, si no que en algunos casos lo anticipan (Battey, 2000). La etapa fenológica de floración es considerada como una de las más sensibles a cambios climáticos (Spano et al., 1999); de ahí que el seguimiento de patrones de floración es de suma importancia.
La fenología a nivel de paisaje se ha estudiado mediante imágenes satelitales (White et al., 2009) lo que permite observaciones de largo plazo y mayor alcance espacial que supera la limitada cobertura espacio-temporal de las observaciones in situ basadas en parcelas (p.ej., observaciones humanas, cámaras fenológicas, torres de flujo), además proporciona información de lugares no cubiertos por estaciones de observación in situ (Reed et al., 1994; Zhao y Schwartz, 2003). Los estudios de la fenología a nivel de paisaje mediante imágenes satelitales proporcionan evidencias que corroboran las respuestas ecológicas a escenarios históricos de cambio climático (Badeck et al., 2004; Peng et al., 2018).
Además, para una comprensión integral de cómo la vegetación y los ecosistemas responden a los cambios en las condiciones ambientales, y para modelar esta información a nivel de ecosistema, es de crucial importancia la disponibilidad de conjuntos de datos fenológicos obtenidos a partir de protocolos de observación estandarizados (Denny et al., 2014). Por lo tanto, se requiere una escala precisa y estándar que describa las etapas de crecimiento fenológico como punto de partida para facilitar la recopilación y el análisis de datos (Meier et al., 2009). La escala BBCH es ampliamente adoptada en todo el mundo para la descripción de las etapas de desarrollo del crecimiento de varios cultivos de importancia económica; pero no se ha desarrollado una descripción detallada de las etapas de crecimiento fenológico en huizache (Acacia farnesiana (L.) Willd.), al mismo tiempo que se le da seguimiento con sensores remotos.
El presente trabajo tuvo como objetivo identificar las etapas de la floración del huizache, así como aplicar la codificación numérica de la escala general de la BBCH a las etapas identificadas y proporcionar una descripción específica. Además, se analiza el Índice de Vegetación de Floración y Follaje (IVFF) propuesto por Casiano y Paz (2018), para establecer una relación entre las diferentes etapas fenológicas incluyendo la floración de huizache (Acacia farnesiana (L.) Willd.) y los índices de vegetación, lo que aporta evidencia de campo del alcance del IVFF.
Materiales y Métodos
Para el presente estudio se analizó la relación entre los patrones fenológicos de floración y sus repuestas espectrales. Inicialmente se realizó una revisión de literatura que permitió contextualizar los patrones de floración en distintos tipos de vegetación. Por otra parte, se buscó una escala numérica que asociara los estados fenológicos con los índices de vegetación. El trabajo de campo se realizó conforme el protocolo de medición utilizado por Casiano y Paz (2018).
Patrones de floración y su escala fenológica
La fenología vegetativa (botones foliares y posteriormente hojas, ramas, tallos y cortezas) de individuos perennes y caducifolios se encuentra estrechamente relacionada con la disponibilidad de agua como factor causal del proceso de síntesis (Lieberman y Lieberman, 1984; Parada et al., 2012 ) y es relativamente fácil de predecir; por otro lado la fenología reproductiva o floral (desarrollo de flores y frutos) depende de la compleja interacción de una serie de factores endógenos y exógenos que intervienen en la inducción de la floración tales como temperatura ambiental, fotoperiodo, humedad ambiental, entre otros. Uno de los factores que más intervienen en los patrones y duración de la floración, es la disponibilidad de agua en selvas tropicales caducifolias y en ambientes árido-tropicales (Parada-Quintero et al., 2012), lo que permite establecer tres categorías para dichos patrones (Croat, 1975): (a) Floración inducida por las lluvias, se ubican las especies anuales, las herbáceas, que se mantienen latentes en bulbos y raíces, varias leñosas y casi todas las trepadoras. (b) Floración en la temporada de sequía, comprende casi íntegramente especies leñosas que desarrollan sus flores y frutos, de manera preferente durante la temporada seca y cálida (marzo-julio), y en menor grado en la más “fresca” (octubre-diciembre). Es posible que el patrón y los niveles de precipitación pluvial de la temporada previa participen en cierta medida en la intensidad de la floración en los años de observación, como ha demostrado Beatley (1974). En México, gran parte de estas plantas prolongan sus eventos fenológicos por varios meses; por ejemplo, las cactáceas Lophocereus schottii, Stenocereus thurberi, S. gummosus y Pachycereus pringlei, así como el “mezquite” (Prosopis spp.), se mantienen en floración de dos a cinco meses, y en fructificación de uno a tres meses y (c) floración sostenida, en esta clase caben especies leñosas y herbáceas perennes en las que es posible encontrar individuos en floración siguiendo un patrón irregular (León de la Luz et al., 1996).
Los ciclos fenológicos de las plantas pueden ser anuales, para las que cumplen todo su desarrollo dentro de un año o perennes, cuyos individuos permanecen con vida durante varios años.
Uno de los vocabularios fenológicos comunes necesarios, es la descripción uniforme de los estadios de crecimiento de las plantas. La agricultura, agrometeorología y las aseguradoras agrícolas usan estadios fenológicos de plantas con objetivos diferentes (Peng et al., 2018). También las ciencias botánicas aplicadas usan estadios de desarrollo fenológicos (Reed et al., 2003; Piga et al., 2018). En 1991, un grupo de trabajo interdisciplinario propuso la escala BBCH (Biologische Bundesanstalt, Bundessortenamt und CHemische Industrie) para la descripción de las etapas de crecimiento de cultivos y malezas (Lancashire et al., 1991); a partir de la cual Hack et al. (1992) propuso una escala más avanzada, la escala BBCH extendida, para especies de plantas mono y dicotiledóneas. La escala BBCH usa un código decimal que se aplica a las mismas etapas de crecimiento de diferentes especies de plantas. Proporciona un enfoque preciso y simplificado para identificar las etapas de crecimiento fenológico de la planta en función de características morfológicas externas fácilmente observables. El ciclo de crecimiento completo de la planta se subdivide en 10 etapas principales de crecimiento claramente reconocibles y distinguibles, codificadas de 0 a 9 en orden ascendente (Cuadro 1). Cada etapa principal se subdivide a su vez en etapas secundarias, que también se numeraron del 0 al 9. Las principales etapas de crecimiento son fases de mayor duración y las etapas secundarias se definen como pasos cortos en el curso del desarrollo de la planta. La combinación de los números de etapa principal y secundaria da como resultado un código de dos dígitos.
Cuadro 1: Estadios principales de crecimiento (Hack et al., 1992).
Estadio |
Descripción |
0 |
Germinación, brotación, desarrollo de la yema |
1 |
Desarrollo de las hojas (brote o tallo principal) |
2 |
Formación de brotes laterales / macollamiento (ahijamiento) |
3 |
Crecimiento longitudinal del tallo o crecimiento en roseta, desarrollo de brotes (retoños)/ encañado (tallo principal) |
4 |
Desarrollo de las partes vegetativas cosechables de la planta o de órganos vegetativos de propagación / embuchamiento |
5 |
Emergencia de la inflorescencia (tallo principal) / espigamiento |
6 |
Floración (tallo principal) |
7 |
Desarrollo del fruto |
8 |
Coloración o maduración de frutos y semillas |
9 |
Senescencia, comienzo |
El uso de la escala BBCH en las prácticas agrícolas, como en la investigación de plantas y diferentes disciplinas como la climatología y la meteorología, se ha informado en varios artículos de revisión (Meier et al., 2009; Szabó et al., 2016; Wenden et al., 2016). Sin embargo, en el estudio de vegetación natural no hay publicaciones, según nuestro conocimiento, donde describan etapas fenológicas usando la escala BBCH para especies de A. farnesiana.
Repuestas espectrales de las etapas fenológicas de la vegetación
La caracterización de la fenología de la vegetación puede ser hecha directamente en campo (Borchert, 1980; Heideman, 1989; Bullock y Solis-Magallanes, 1990); sin embargo, implica costos altos y las áreas de muestreo son limitadas para la observación. Una alternativa que ha sido explorada es la toma de fotografías digitales montadas en estructuras por encima de la vegetación (Richardson et al., 2009; Parihar et al., 2013) para caracterizar la fenología, pero con aun limitada generalidad geográfica. Para resolver el problema se han utilizado los desarrollos tecnológicos de sensores remotos a bordo de plataformas satelitales. La tecnología de los sensores remotos, dado su enfoque espacial exhaustivo y la temporalidad de las visitas a un mismo pixel, plantea una solución eficiente y de bajo costo (Zhang y Goldberg, 2011). Para la modelación de la fenología se han utilizado diferentes índices de vegetación (IV) (Zhang et al., 2017), de los que sobresalen el NDVI (Rouse et al., 1974), el EVI (Liu y Huete, 1995) y el EVI2 (Jiang et al., 2008), en los que los datos de los IV se filtran para reducir su variabilidad (Kathuroju et al., 2007; Atkinson et al., 2012) y poder detectar umbrales que definan los estadios fenológicos (Zhang et al., 2006; Zhang y Goldberg, 2011). En relación con la fenología del follaje, los IV han sido utilizados para def inir los patrones fenológicos de los ecosistemas o biomas a escala regional o global (Zhang et al., 2004; Stöckli y Vidale, 2004; Zhang et al., 2006). El crecimiento y senescencia del follaje es analizado por los IV basados en el alto contraste entre las bandas espectrales del rojo (R) e infrarrojo cercano (IRC) para diferenciar la vegetación de otros objetos terrestres. En el caso de la floración, las bandas que mejor caracterizan su fenología están también asociadas al R e IRC (Wouters et al., 2013), aunque en el caso de fotografías digitales (solo bandas del visible) se han usado IV sin el IRC (Richardson et al., 2009; Parihar et al., 2013) y aun en el caso de contar con las bandas del IRC, los índices solo usan las bandas del visible (Ge et al., 2006; Chen et al., 2009), reflejando la idea de que la floración es distinguible en función de los colores de las flores. En el caso de sensores remotos, las bandas del visible (rojo, verde y azul) tienen efectos atmosféricos importantes provenientes de aerosoles (Kaufman y Tanré, 1996), lo que limitan su uso en la detección de la floración.
Modelación espectral de los patrones fenológicos
La evolución temporal de la vegetación es un factor importante que tomar en cuenta cuando se construyen IV que se asocian a etapas fenológicas. Otra consideración importante, son las condiciones de iluminación que cambian con respecto al horario de medición y a la época del año (geometría sol-sensor), lo que introduce efectos que distorsionan los valores del R e IRC. Para tomar en cuenta este efecto es conveniente estandarizar estas condiciones mediante un modelo simplificado de geometría de iluminación-visión (Bolaños y Paz, 2010):
donde: θv es el ángulo cenital de visión, θs el de iluminación solar, χ es una variable angular de posición, R es la reflectancia de cualquier banda, Rn es la reflectancia normalizada por posición angular y efecto de escala (función logaritmo natural) y g es un parámetro que define la geometría sol-sensor.
La ventaja del modelo es que solo tiene un parámetro, el cual puede estimarse con un solo dato de medición. En lo siguiente solo se considerarán reflectancias normalizadas y estandarizadas a la geometría θv = 0° y θs = 30°, de tal forma que todas las mediciones espectrales tienen una base común de observación. La inversión del modelo de geometría sol-sensor, relaciones (1), para estimar reflectancias no normalizadas introduce errores (Bolaños y Paz, 2010), por lo que no es necesaria en términos de su uso en índices de vegetación y se evita así la propagación de errores.
Los índices espectrales de vegetación basados en líneas de igual cantidad de vegetación o área foliar (iso-IAF) y propiedades ópticas diferentes de los suelos debajo de la vegetación (dada las tonalidades y rasgos morfométricos de los suelos) resultan complejos de modelar en el espacio R-IRC (Romero et al., 2009). Una alternativa de diseño de IV es considerar los patrones de las curvas iso-suelo (mismo suelo y cantidad variable de vegetación), usando el IRC como banda de saturación más lenta posible; en este sentido, Paz et al. (2011) propusieron el Índice de Vegetación basado en líneas Iso-Suelo (IVIS) con el cual se logra minimizar el efecto del suelo subyacente a escala de píxel. El IVIS se def ine en términos de reflectancias normalizadas y estandarizadas como:
Los parámetros se definieron como dIRCns = 0, dIRCn∞ = 3, anS = 0 y bnS = 0.8 y se usan en las discusiones siguientes.
Casiano y Paz (2014), con información de experimentos provenientes de diferentes componentes de la vegetación (material muerto, hojas, yemas y flores) en arreglos que aproximan las etapas fenológicas de la floración, plantearon un modelo en el que usa el índice IVISn (Figura 1).
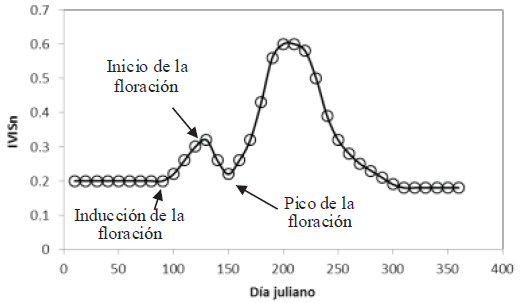
Figura 1: Esquematización de los estadios de la floración en vegetación caducifolia (Casiano y Paz, 2018). IVIS = índice de vegetación basado en líneas iso-suelo.
Con base en el patrón de floración de la Figura 1, la inducción de la floración la constituye el crecimiento de brotes foliares y material fotosintético, lo que corresponde con la parte de crecimiento del IVISn hasta un valor máximo; después se produce un decrecimiento del IVISn hasta un valor mínimo (pico de floración), de allí en adelante, el índice refleja el crecimiento del follaje. El patrón de la floración que se muestra en la Figura 1 solo se detecta cuando la floración es intensa y sincrónica, además de que el fondo de la vegetación debe ser obscuro ya que las tonalidades claras enmascaran el color de las flores y sus mezclas. En términos de reflectancias normalizadas y estandarizadas, el trabajo de Casiano y Paz (2018) mostró que en el incremento del follaje, el Rn y IRCn siguen patrones contrarios (decrecen y crecen, respectivamente), mientras que en la etapa de floración ambas bandas crecen o decrecen simultáneamente; aunque para el caso de flores de color amarillo, este comportamiento está ausente y es contrario a lo esperado, lo que puede atribuirse a que este color tiene un patrón de reflectancias similar al suelo y material muerto, donde la señal de las hojas coexistentes es dominante ante el pico de floración. Pese a que el IVISn disminuye el efecto del suelo subyacente y está propuesto para detectar floración y follaje, no es capaz de distinguirlos entre sí. Una propuesta alternativa que aprovecha la respuesta de crecimiento y decrecimiento simultaneo de las bandas del Rn y IRCn durante la etapa fenológica de floración es el índice de vegetación para floración y follaje (IVFF) (Casiano y Paz, 2018). El IVFF se define en términos de reflectancias normalizadas y estandarizadas:
La ventaja del IVFF en el formato de razón es que cuando se presenta la floración, el patrón del índice crece y decrece; contrario al follaje donde la etapa vegetativa tiene un patrón decreciente y la de senescencia uno creciente, distinguiéndose claramente la dominancia de los patrones (hojas o flores), Figura 2, de tal manera que si se intercambia el numerador por el denominador en la definición del IVFF, relación (3), se obtienen patrones contrarios en la Figura 2.
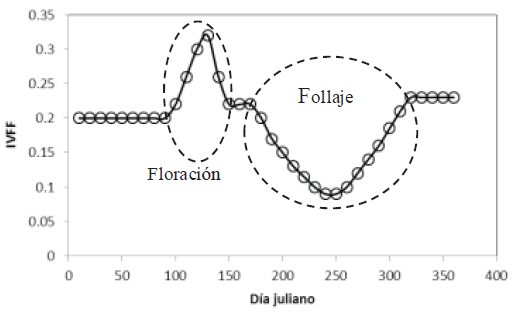
Figura 2: Esquematización de los estadios de la floración y follaje en un bosque tropical caducifolio (Casiano y Paz, 2018). IVFF = índice de vegetación para floración y follaje.
Casiano y Paz (2014) aproximaron un evento de floración ocurrido en un bosque tropical caducifolio o vegetación caducifolia en general bajo el enfoque de Ge et al. (2006), donde la vegetación y sus estadios fenológicos se generan a partir del cambio de la proporción de sus componentes (p.ej. tallos, yemas, flores abiertas y postflores) y con especial énfasis en los trabajos realizados por Parada Quintero et al. (2012), Bullock y Solís-Magallanes (1990) y Borchert (1980) quienes reportan estacionalidad de la floración y crecimiento vegetativo para épocas secas y húmedas, respectivamente, en selvas. Para integrar cada escenario simulado (diferente proporción de elementos) a la escala BBCH se tomó como referencia el trabajo de Borchert (1980) quien sugiere la hipótesis de que los árboles tropicales de referencia se conducen bajo el mismo patrón fenológico de un frutal caducifolio (manzano), el cual puede describirse bajo la escala fenológica BBCH (Hack et al., 1992).
Trabajo de campo
El seguimiento por satélite es una alternativa razonable tecnológicamente y de gran cobertura a un precio económico (Burgan y Hartford, 1993). De todas formas, la equivalencia entre los datos ofrecidos por los satélites Landsat TM y ETM+ y los muestreos de vegetación son satisfactorios, básicamente, en áreas de vegetación homogénea, que se reducen, en climas áridos, a zonas de cultivo. En estas zonas se cumple el requisito de una variabilidad territorial mínima (Coromines et al., 2009). Esta limitada variabilidad podemos sintetizarla en tres características: a) la superficie es bastante llana, b) son zonas homogéneas de vegetación con base en una tipología de plantas presentes (la misma especie, incluso la misma variedad) y c) son zonas homogéneas de vegetación respecto a la edad de las plantas. En zonas forestales existe gran variabilidad espacial, debida fundamentalmente a la cobertura vegetal y a la orografía; sin embargo, en pastizales y matorrales de zonas áridas se logran grandes extensiones homogéneas de cobertura, en las que los datos a nivel de superficie son comparables con los datos satelitales (Stohlgren et al., 1997).
Hechas las consideraciones anteriores, se estableció una parcela cuadrada de 30 × 30 m que atienden a la configuración y resolución espacial de los satélites Landsat ETM+; en el parque urbano de la presa San José, San Luis Potosí, S.L.P., con coordenadas centrales de parcela 22° 8’ 54.852’’ N y -101° 2’ 47.446’’ O (Figura 3). El trabajo de campo se desarrolló durante los meses de febrero y marzo del 2014 en el que se le dio seguimiento a 11 árboles de huizache (Acacia farnesiana (L.) Willd.) localizados al interior de la parcela.
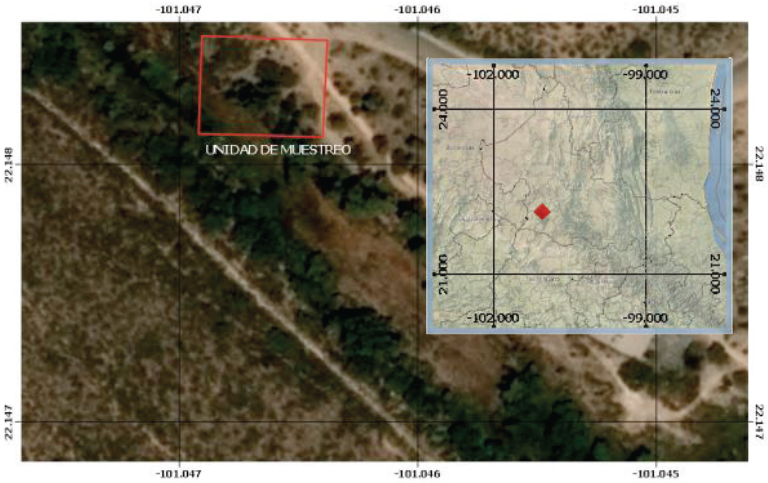
Figura 3: Localización y establecimiento de la parcela para el muestreo de árboles de huizache (Acacia farnesiana (L.) Willd.).
Las alturas de los huizaches medidos fluctuaron entre 1 y 2 m, los estados fenológicos fueron referidos y adaptados a la escala BBCH (Hack et al., 1993) y reportados en bitácoras.
Los árboles de A. farnesiana (L.) Willd., se enumeraron e identificaron mediante etiquetas plastificadas, para llevar un seguimiento a cada individuo (Figura 4).
Las mediciones de reflectancia espectral en árboles de huizache se llevaron a cabo bajo condiciones de cielo soleado con ángulos de elevación solar entre 1 y 30 grados. Las mediciones espectrales se realizaron con un radiómetro multiespectral portátil (MSR5-590, CROPSCAN, Inc. U.S.A); que mide reflectancias del dosel en cinco regiones del espectro electromagnético (485, 560, 660, 830, 1650 nm) y cuyo campo de visión del sensor es de 28°. El radiómetro fue montado en un bastón telescópico en posición cenital a 3.20 m sobre el suelo, cubriendo un área de 1.60 m2 (a la que se le denomina área efectiva de medición, AEM). La reflectancia obtenida en cada punto de muestreo fue el promedio de tres repeticiones.
Resultados y Discusión
Los árboles de A. farnesiana (L.) Willd., se hallaron en diferentes estadios fenológicos (Figura 5) y para cada uno de ellos, se registraron datos cualitativos de foliación y floración. Los datos cualitativos se asociaron a los datos espectrales para el análisis.
Los huizaches, en conjuntos, mostraron tres comportamientos fenológicos distintos. El primer conjunto conformado por los arboles de huizache 1, 2, 3, 7, 10 y 11 se les encontró desde ramas desnudas y con indicios de yemas foliares, continuaron sus estadios hasta cubrirse de follaje (desarrollo de hojas) pero no presentaron yemas florales. La Figura 6 muestra los estadios abreviados con una letra (E) y un número, el número significa el estadio en el que se encontró el árbol, medido en día juliano (DJ) que se muestra al pie del diagrama.

Figura 6: Estadios fenológicos (E) de árboles de huizache 1, 2 y 3; medidos en los días julianos (DJ) del 57 al 85.
El conjunto de árboles enumerados con las etiquetas 7, 10 y 11; además de no presentar floración, su cobertura foliar fue menor a los árboles 1, 2 y 3 (Figura 7).

Figura 7: Árboles de huizache 7, 10 y 11, sin etapa fenológica de floración durante el tiempo de medición. Estadios fenológicos (E), días julianos (DJ).
A los árboles 4 y 5, se les encontró en etapas de inicio y fin de la floración hasta el desarrollo de follaje (Figura 8).

Figura 8: Árboles de huizache 4 y 5, con etapa fenológica de floración. Estadios fenológicos (E), días julianos (DJ).
Los árboles 6, 8 y 9 se midieron en sus últimas etapas de floración, además presentaron escaso follaje y baja intensidad de floración (apenas una flor) (Figura 9).

Figura 9: Árboles de huizache 6, 8 y 9, con baja intensidad de floración y follaje. Estadios fenológicos (E), días julianos (DJ).
La adaptación de los estadios fenológicos de huizache a la escala BBCH, se realizó con base en el comportamiento fenológico de frutales con hueso (Cuadro 2).
Cuadro 2: Adaptación de la escala BBCH para los árboles de huizache, medidos en San Luis Potosí.
Estadio |
Descripción |
1 |
Estadio 01. Comienzo del hinchado de las yemas; los botones empiezan a hincharse dentro de las escamas. |
05 |
Estadio principal 0. Brotación. Las yemas de invierno aparecen puntiagudas, marrón brillante. El estadio 5, se caracteriza por ser 'lanoso', lana marrón claramente visible. |
13 |
Estadio principal 1. Desarrollo de las hojas. 3 o más hojas desplegadas. |
15 |
Estadio principal 1. Desarrollo de las hojas. En los estadios continúan desplegando hasta 5 o más hojas. |
40 |
Follaje verde amarillento creciente, sin capítulos flores verdes visibles y hasta un 90% de follaje en ramas. |
41 |
Follaje verde intenso creciendo, sin capítulos flores visibles. |
50 |
Estadio principal 5. Aparición del órgano floral. 50, Presencia de inflorescencias. Follaje hasta un 50% o más. |
62 |
Estadio Principal 6, se refiere a floración. Estadio 66 plena floración, mayor al 50%. Cubrimiento parcial de follaje hasta un 50% o más (en huizache, coloración verde amarillento). |
65 |
Estadio Principal 6, se refiere a floración. Estadio 65, mayor al 50% de floración. Cubrimiento parcial de follaje mayor al 50% (en huizache, coloración verde amarillento). |
66 |
Estadio Principal 6, se refiere a floración. Estadio 66, mayor al 50% de floración. Cubrimiento parcial de follaje mayor al 70% (en huizache, coloración verde intenso). |
67 |
Estadio Principal 6, se refiere a floración. Estadio 67, flores marchitándose: la mayoría de los pétalos, caídos, follaje (verde) superior al 90%. |
69 |
Estadio Principal 6, se refiere a floración. Estadio 69, fin de la floración: todos los pétalos caídos, follaje (verde) superior al 90%. |
70 |
Estadio Principal 7, se refiere al fin de la floración. Estadio 70, flores sin pétalos en su lugar se percibe la presencia del primer fruto. Cubrimiento total de follaje mayor al 95% o más, así como el crecimiento de ramas (en huizache, coloración verde brillante y ramas nuevas en color marrón). |
71 |
Estadio Principal 7, se refiere al fin de la floración. Estadio 70, flores sin pétalos en su lugar se percibe la presencia del primer fruto. Cubrimiento total de follaje mayor al 95% o más, así como el crecimiento de hojas ramas (en huizache, coloración verde brillante y ramas nuevas en color marrón). |
72 |
Estadio Principal 7, se refiere al fin de la floración. Estadio 70, flores sin pétalos en su lugar se percibe la presencia del primer fruto. Cubrimiento total de follaje mayor al 95% o más, así como el crecimiento de hojas ramas (en huizache, coloración verde brillante y ramas nuevas se empiezan a tornar color café, algunas tonalidades de las hojas se comienzan a percibir amarillentas). |
Patrones de los árboles sin floración
Los patrones temporales encontrados mostraron que los estadios que corresponden a la aparición y comienzo del hinchado de las yemas foliares (estadios del 01 al 05; Figura 10, árbol 3) se realizan en periodos breves (10 días), aunque resalta el notable desarrollo vegetativo que alcanza en los 5 días subsecuentes en los que logra cubrir del 90 al 100% de cobertura total del árbol; el desarrollo vegetativo se exhibe como cambio súbito (línea vertical de la Figura 10); ya con la maquinaria fotosintética establecida en cada uno de los árboles, los cambios en las etapas fenológicas siguientes ocurren de manera imperceptibles.
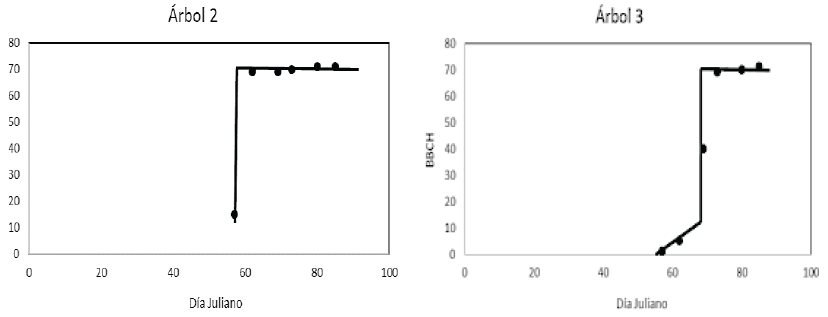
Figura 10: Patrón de etapas fenológicas en la escala BBCH para A. farnesiana (L.) Willd. El cambio del patrón entre estadios desde la aparición de yemas foliares al desarrollo de las hojas es muy rápido.
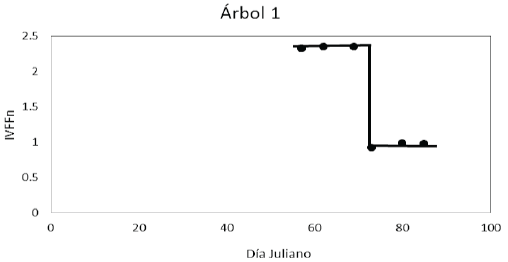
El patrón fenológico en el espacio del índice de vegetación IVFFn-Tiempo, se exhibe de forma inversa (Figura 11) al patrón mostrado en el espacio BBCH-Tiempo. Los valores del IVFFn en las etapas de aparición e hinchado de las yemas foliares en un contexto de ramas sin hojas tienden a descender, en la medida de que las yemas crecen en el tiempo. En ambos espacios se observa que el desarrollo vegetativo se lleva a cabo en un tiempo muy breve representado por un cambio súbito (línea vertical, Figuras 10 y 11).
El patrón temporal del IVFFn en el que descienden sus valores durante los primeros estadios fenológicos (01 al 15) de las yemas foliares hasta el descenso súbito marcado por el desarrollo vegetativo (línea vertical) se observó tanto en árboles con baja densidad o cobertura de hojas (árbol 10) como en los de mayor densidad de hojas y ramas (árbol 3) (Figura 12).
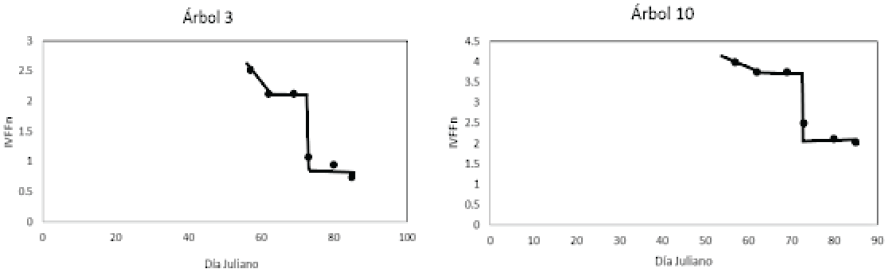
Figura 12: Patrón temporal del IVFFn en arboles con alta (árbol 3) y baja (árbol 10) cobertura foliar.
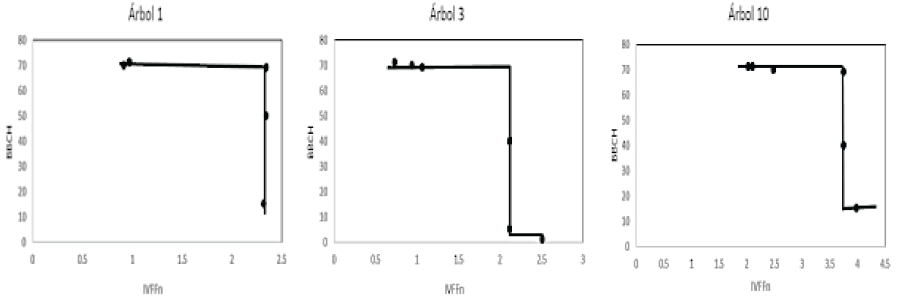
La adaptación fenológica de la escala BBCH a los árboles de huizache, permitió asociar cada uno de los estadios con su respectivo valor del índice de vegetación espectral IVFFn. El patrón encontrado en el espacio IVFF-BBCH se muestra en la Figura 13. Los estadios del desarrollo vegetativo (inicio y fin del desarrollo foliar), se localizan sobre la línea vertical del patrón. Los valores del IVFFn en la meseta izquierda de la curva, indican el establecimiento de cobertura foliar total de los árboles, la cual permanece con cambios mínimos en el tiempo. El patrón encontrado es recurrente tanto en árboles localizados con estadios tempranos en la escala BBCH (aparición de yemas foliares, arboles 3 y 10), como en aquellos en los que justo iniciaron el desarrollo vegetativo (árbol 1).
Patrones de los árboles con estadios fenológicos de floración
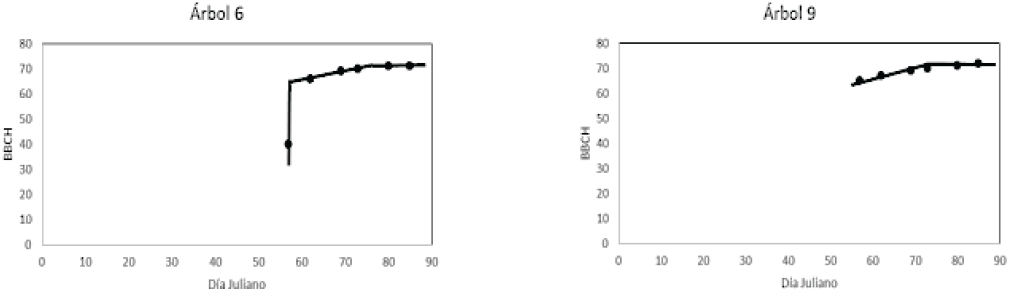
Los estadios de desarrollo vegetativo y floración fueron observados en los huizaches 4 y 5. Estos dos árboles alcanzaron la mayor cantidad de cobertura foliar y mayor densidad de floración. El patrón temporal que muestra la Figura 14 corresponde al desarrollo vegetativo al mismo tiempo que ocurren los estadios fenológicos. El plano inclinado de la curva en el espacio BBCH-Tiempo para los huizaches 4 y 5, atienden a los estadios de floración (Estadios BBCH del 62 al 70), la fase de meseta corresponde al f in de la floración y predominio del follaje.
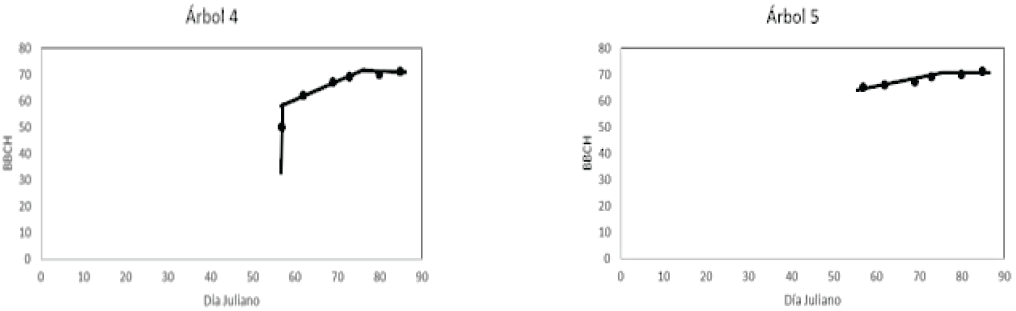
Figura 14: Patrones de fenoestadios en la escala BBCH del desarrollo vegetativo y floración para los árboles de huizache 4 y 5.
Otros árboles localizados con estadios de desarrollo vegetativo y floración, pero con escaso follaje y floración fueron los árboles 6, 8 y 9, cuyo patrón temporal de estadios en la escala BBCH se muestra en la Figura 15.
Con base en la Figura 15, los estadios de floración se localizan en el plano inclinado de la curva en el espacio BBCH-Tiempo. Como se observa, los patrones de estadio fenológicos de la Figura 14 son similares a los de los árboles 4 y 5, pese al escaso follaje y floración.
La respuesta espectral que se muestra en la Figura 15 con valores del índice de vegetación IVFFn, presenta un patrón parecido al de los arboles con solo desarrollo vegetativo y sin floración, la diferencia estriba en que en lugar de encontrar una línea vertical que indica el rápido desarrollo vegetativo (Figura 12), se localiza un plano inclinado que incluye tanto los fenoestadios de desarrollo foliar o vegetativo y los de floración.
El patrón temporal del IVFFn que se muestra en la Figura 17 para los árboles con escaso follaje y floración (árboles 6 y 8), sigue la misma tendencia que los arboles 4 y 5 de la Figura 16, salvo que éstos últimos se caracterizan por contener alta cobertura foliar y mayor densidad de floración. En ambas figuras (16 y 17) el plano inclinado contiene los datos del IVFFn para los estadios de desarrollo vegetativo y floración.
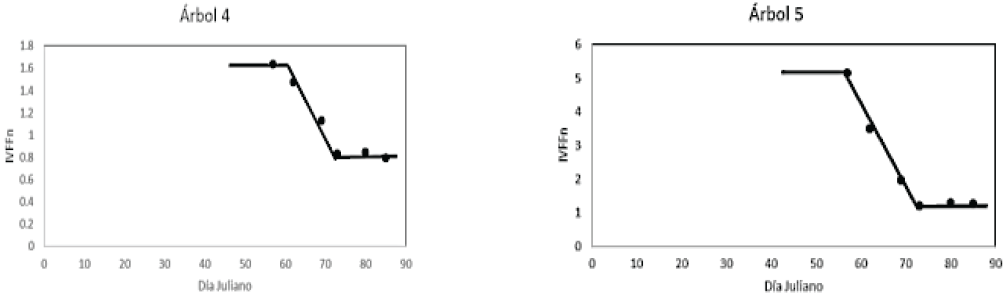
Figura 16: Patrón temporal del índice de vegetación IVFFn para árboles con estadios fenológicos de desarrollo vegetal y floración al mismo tiempo.
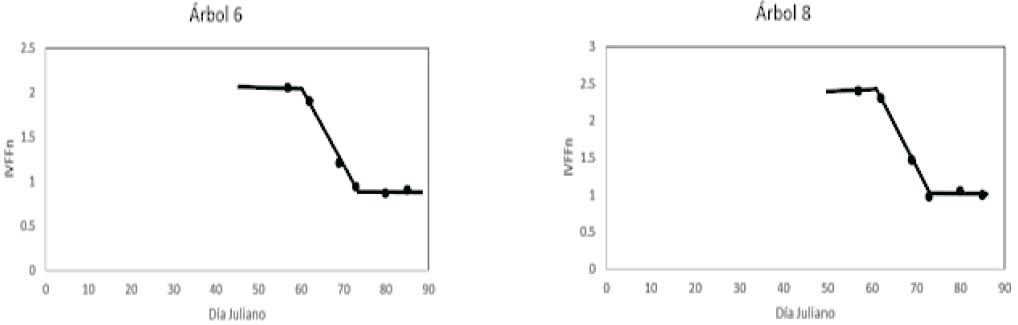
Figura 17. Patrón temporal del IVFFn para los estadios de desarrollo vegetativo y floración en huizaches con escaso follaje y floración.
El planteamiento del patrón fenológico en espacio IVFFn-BBCH se realizó con el objetivo de encontrar una relación que asocie el índice de vegetación con alguna etapa fenológica. En este sentido, el patrón de fenoestadios correspondientes a solo el desarrollo vegetativo en el espacio IVFFn-BBCH se observa como una línea vertical (Figura 13), en tanto que para el desarrollo simultaneo de estadios de vegetación y floración o solo de floración conforman un plano inclinado (Figura 18).
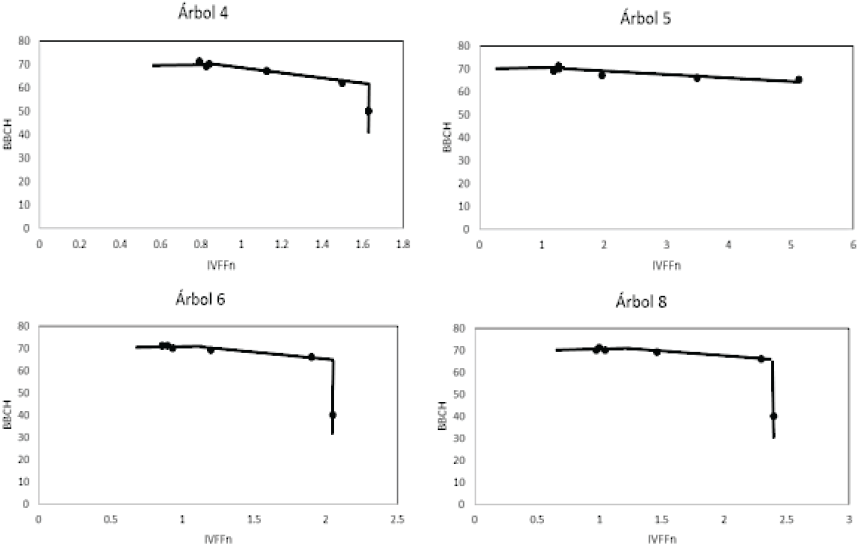
Figura 18: Patrón de los estadios fenológicos de desarrollo vegetal y floración en el espacio IVFFn-BBCH.
Puesto que la escala BBCH extendida (Hack et al.,1992) aplica el mismo código a las mismas etapas de crecimiento de diferentes especies de plantas; en el presente trabajo, el patrón fenológico encontrado para A. farnesiana (L.) Willd. (Figura 10) es similar a los reportados por Behrens et al. (2006) y Canisius et al. (2018) para canola (Brassica napus L.), trigo (Triticum spp.) y cebada (Hordeum vulgare L.), así como el reportado por Erten et al. (2014) para arroz (Figura 19).
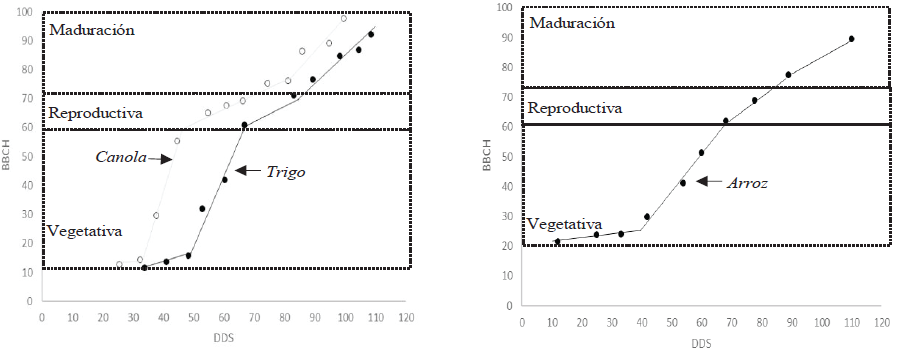
Figura 19 Patrones fenológicos de cultivos anuales bajo la codificación BBCH. Fuente: Elaboración propia con datos de Behrens et al. (2006), Canisius et al. (2018) y Erten et al. (2014). *DDS = días después de la siembra.
Los estadios fenológicos encontrados en el presente trabajo para A. farnesiana (L.) Willd., inician con la aparición de brotes o yemas foliares (BBCH 00-09) (Figura 10); sin embargo, otros árboles inician en los estadios BBCH 30-39 que corresponden a la elongación de tallos o ramas; o bien, al inicio de aparición de yemas florales o inflorescencias (BBCH 50-59) (Figura 14 y 15) esto coincide con lo reportado por Alvarado Vázquez (2003)1 quien encontró que el huisache es una especie que no pierde completamente sus hojas en ninguna temporada, presentando un recambio gradual de hojas en diferentes épocas del año, aunque con un momento de notable desarrollo vegetativo, en la que llega a alcanzar un renuevo de hojas del 40 a 50%. Existe otra época de desarrollo vegetativo, aunque de menor intensidad, la cual coincide con las lluvias de primavera (mayo y junio) y en la cual se observó un renuevo de hojas de hasta un 20%.
En cuanto a la etapa de floración, Alvarado Vázquez (2003)1 observó que algunos árboles de A. farnesiana (L.) Willd., en su etapa de formación de botones, es la más larga, iniciando en el mes de noviembre y concluyendo en febrero; posteriormente desde el mes de enero, algunos de estos botones maduran rápidamente, consecuentemente, el periodo de floración es breve; mientras que otros lo hacen gradualmente hasta el mes de marzo o principios de abril. También observó que otros árboles, no presentan etapas de floración en periodos interanuales, solo recambio gradual de hojas.
Pese a que el seguimiento espectral bajo el índice IVFFn, para cada uno de los estadios fenológicos realizado en el presente trabajo, se realizó en solo dos meses (febrero a marzo), permite abordar todas las configuraciones fenológicas presentadas durante dos años por A. farnesiana (L.) Willd. y reportadas por Alvarado Vázquez (2003)1. Dichas configuraciones fenológicas muestran patrones invariantes en los espacios BBCH-Tiempo, IVFFn-Tiempo e IVFFn-BBCH, lo cual permite realizar una propuesta general de modelación fenológica a partir de cada uno de ellos.
Modelo general de fenología del desarrollo vegetativo, desarrollo vegetativo y floración o floración
Los estadios de desarrollo vegetativo pueden modelarse por una línea recta ascendente en el espacio BBCH-Tiempo, en tanto que el desarrollo vegetativo y floración o solo floración la hace mediante un plano inclinado (Figura 20a). Pese a que el patrón se invierte en el espacio IVFFn-Tiempo, la respuesta espectral como índice de vegetación IVFFn genera líneas más pronunciadas en las que nuevamente, la línea vertical corresponde a los estadios de desarrollo vegetativo y el plano inclinado al desarrollo vegetal con floración, Figura 20b.
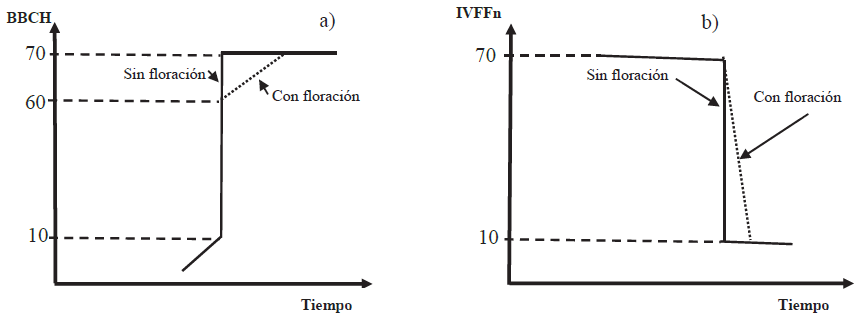
Figura 20: Modelo general de los estadios fenológicos para el desarrollo vegetativo y desarrollo vegetativo con floración en los espacios BBCH-Tiempo e IVFFn-Tiempo.
El modelo en el espacio IVFFn-BBCH, asocia los valores más altos del índice de vegetación IVFFn con los primeros estadios fenológicos y sus valores tienden a descender conforme se desarrollan las yemas foliares y florales. A diferencia del patrón en el espacio IVFFn-Tiempo donde la floración está implícita en la línea inclinada que corresponde a su desarrollo vegetativo, en este espacio se logra distinguir los momentos donde inicia y termina la floración (puntos de inflexión de la línea vertical, Figura 21).
Conclusiones
Los datos obtenidos en campo permitieron aplicar la codificación BBCH para la descripción fenológica de A. farnesiana (L.) Willd.
Se encontró un patrón fenológico de A. farnesiana (L.) Willd. bajo la escala BBCH, que comparte con otras plantas las mismas características de los macro-fenoestadios de desarrollo vegetativo, reproductivo y maduración.
Existe evidencia de campo de la relación entre Índice de Vegetación para Floración y Follaje (IVFF) y los estadios fenológicos en la escala BBCH, que permiten plantear un esquema para la modelación de los fenoestadios para A. farnesiana (L.) Willd. a partir de datos espectrales.
Se recomienda obtener datos espectrales satelitales y a nivel individual de cultivos y otras especies silvestres, a partir de los cuales se infieran sus etapas fenológicas.











 nueva página del texto (beta)
nueva página del texto (beta)