Introducción
En el norte de Chihuahua se encuentra un ecosistema desértico caracterizado por comunidades vegetales micrófilas y xerófilas, creciendo dentro de un variado mosaico de asociaciones vegetales (Granados-Sánchez et al., 2011). Estas comunidades se desarrollan en suelos pobres en nutrientes, escasa precipitación y días de intensa luz solar. Respecto a su clasificación, SEMARNAT (2013) reconoce tres tipos de matorral en la vegetación desértica: matorral desértico micrófilo de suelos de aluvión, matorral mediano subinerme en rocas calizas y matorral desértico crasicaule ligado a rocas y suelos de naturaleza ígnea. En los ecosistemas áridos y semiáridos, las plantas soportan condiciones climáticas y ambientales muy estresantes como largos periodos de sequía, temperaturas extremas, suelos de baja fertilidad y altos grados de erosión. Se considera que esta resistencia puede estar relacionada con la presencia de hongos micorrízicos de tipo vesículo arbusculares (HMVA) (Monroy-Ata et al., 2007; Montaño et al., 2007; Martínez-García, 2011). Las micorrizas son una simbiosis mutualista de hifas de hongos y raíces de plantas vasculares, en la que se presenta un beneficio mutuo, debido al intercambio bidireccional. Esta asociación favorece el crecimiento y desarrollo de las plantas que crecen en condiciones limitantes, principalmente en el desarrollo del sistema radical por estimulación, la formación de nuevas raíces y, por lo tanto, plantas más tolerantes al estrés ambiental y eficientes en el aprovechamiento de nutrientes y agua del suelo. Esto es debido a la extensión del hongo fuera de la raíz y entre las raíces secundarias, incrementando el volumen de suelo explorado, permitiendo capturar nutrientes más allá de la zona de alcance de la raíz y transportarlos a la planta. Los HMVA han incrementado su importancia en diversas ramas de la ciencia y la tecnología, como es el caso de la comprensión de la dinámica vegetal y de la sucesión ecológica, restauración ambiental y obtención de biofertilizantes no contaminantes (Montaño et al., 2007). Los estudios realizados en zonas áridas son escasos, y la mayoría trata sobre la restauración de zonas deterioradas mediante el uso de micorrizas vesículo arbusculares en matorral xerófilo (Uhlmann et al., 2004; Caballero-Mellado et al., 2007; Monroy-Ata et al., 2007; Ochoa-Meza et al., 2009; Martínez-García, 2011). Debido a que en México los ecosistemas áridos y semiáridos ocupan aproximadamente un 60% del territorio nacional, y en el norte de Chihuahua domina el ecosistema desértico cuya riqueza vegetal se caracteriza por presentar un elevado grado de endemismo, es de suma importancia realizar análisis ecológicos de los diferentes tipos de comunidades vegetales, tipo de suelo que las caracterizan y su relación con la presencia de HMVA, los cuales han incrementado su importancia en diversas ramas de la ciencia y la tecnología (Alarcón y Ferrera-Cerrato, 1999). El objetivo de este trabajo fue relacionar el tipo de suelo con la presencia de hongos micorrízicos vesículo-arbusculares (HMVA) en la rizósfera de las plantas de matorrales desérticos, como una posible respuesta a la resistencia de las plantas bajo condiciones ambientales extremas en tres comunidades vegetales en el área natural protegida (ANP) médanos de Samalayuca, municipio de Juárez, Chihuahua, dada la gran importancia que tiene esta área por ser una de las de mayor diversidad de flora y fauna, alta en endemismos y reconocido por su sistema complejo único de dunas de arena.
Materiales y Métodos
Descripción del área de estudio
El área de estudio se localizó en el ejido Villa luz, dentro del área natural protegida (ANP) médanos de Samalayuca, localizada entre las coordenadas extremas 31° 39’ 36’’ y 29° 25’ 12’’ N y las coordenadas 109° 02’ 24’’ y 107° 14’ 24’’ O, en el municipio de Juárez del estado de Chihuahua, México. Su clima se caracteriza por ser árido y extremoso, cuya clasif icación hecha por Köppen corresponde a Bwkw(x’) clasificado como un clima muy seco templado con lluvias en verano. La temperatura máxima ha sido de 41. 2 ºC y la mínima de -16 ºC. Las precipitaciones más altas se presentan en los meses de julio a septiembre, representando el 58.9% de la precipitación media anual (SEMARNAT, 2013). De acuerdo con la clasificación de la COTECOCA (1978) en la región de Samalayuca se determinaron tres comunidades vegetales: 1) Por adaptación climática: matorral inerme parvifolio y matorral mediano subinerme, representadas por especies arbustivas dominantes como la gobernadora (Larrea tridentata) y el mezquite (Prosopis juliflora var. glandulosa); junto con otras especies de menor abundancia como son el chamizo (Atriplex canescens), ocotillo (Fouquieria splendens), hojasén (Flourensia cernua) y palma (Yucca spp.); 2) Por su tipo de suelo, el matorral de médanos se encuentra rodeando el cuerpo de dunas móviles con escasa vegetación. Se caracteriza por la presencia de especies arbustivas, principalmente: P. juliflora var. glandulosa, A. canescens, Poliomintha incana, Artemisia f ilifolia y algunas cactáceas como Opuntia violacea var. macrocentra, O. engelmanii y O. Leptocaulis (Enríquez, 2003; Álvarez, 20131).
Muestreo
Durante los meses de marzo a octubre de 2016, se realizaron dos muestreos de tipo preferencial, seleccionando cuatro puntos de muestreo con base en el tipo de comunidad vegetal registrada en campo. En cada uno de ellos, se lanzaron transectos de 100 m, para generar diez parcelas de 20 × 25 m2 en cada zona seleccionada. En cada parcela se registró el número de individuos por especie vegetal para obtener la abundancia relativa para cada especie por comunidad vegetal (Krebs, 1998).
Análisis de la vegetación
Para determinar la diversidad por comunidad vegetal se utilizó el Índice de Shannon Winner, el cual estima la diversidad con base en una muestra extraída al azar; dominancia de Simpson que mide la probabilidad de que dos individuos seleccionados al azar de una población de N individuos, provengan de la misma especie, y equitatividad de Pielou que mide el grado de repartición de los individuos en las especies presentes para estimar el índice de diversidad y uniformidad de las comunidades vegetales muestreadas, utilizando el programa Estimate S versión 9.1.0 (Colwell, 2016). Así mismo, se utilizó el Índice de Morisita para evaluar la similitud de comunidades por afinidad de especies y abundancia de las mismas, utilizando el programa PAST versión 2.09 (Moreno, 2000). Se tomaron submuestras de suelo de 500 g a una profundidad de 0 a 30 cm, las cuales fueron mezcladas para obtener muestras compuestas de cada sitio de muestreo, con cuatro repeticiones por zona de muestreo. Así mismo, se obtuvieron muestras de suelo adherido a raíz de las especies vegetales presentes en las parcelas muestreadas para el registro de HMVA.
Características del suelo. Cada muestra de suelo fue secada a temperatura ambiente y tamizada; se les realizaron análisis físicos y químicos como: pH, textura, conductividad eléctrica, nitrógeno mineral y fósforo extractable. El pH se midió con un potenciómetro HANNA modelo HI 207 la conductividad eléctrica con conductímetro YSI Modelo 85/10 FT, la textura de suelo por el método de Bouyoucos, el nitrógeno mineral se determinó por el método micro-Kjeldahl y el fósforo por el método Olsen (NOM-021-RECNAT-2000, 2002; Keeney y Nelson, 1982; Olsen y Sommers, 1982).
Extracción e identificación de hongos micorrízicos vesículo-arbusculares (HMVA). La extracción y conteo de esporas se realizó mediante tamizado húmedo, y decantación, seguido de una centrifugación en una solución de sacarosa al 70% (Trejo Aguilar et al., 2008). Para ello se tomaron de 100 a 250 g de suelo pegado a la raíz de algunas plantas características de cada comunidad vegetal; se colocó la muestra en un recipiente de cristal de 1000 mL aforado con agua; en donde fueron mezcladas por cinco minutos y filtradas en un conjunto de tamices de diferente luz de malla (1 mm, 500 µm y 20 µm). Se recuperaron los residuos que quedaban en los tamices con ayuda de una pipeta; las muestras fueron depositadas en tubos de 50 mL para su centrifugación, una primera con agua durante cinco minutos a 3000 rpm, y otra con sacarosa al 70%. La centrifugación fue de un minuto a 3000 rpm. Finalmente, lo recuperado fue depositado en cajas Petri, para su observación en estereoscopio y su separación, de tal forma que se pudieron realizar preparaciones permanentes de las esporas con alcohol polivinílico y lugol (Hernández-Cuevas et al., 2003). Posteriormente se observaron las esporas con microscopio óptico Motic Serie B1-220 y se registraron los datos de frecuencia por suelo y tipo de comunidad. Para la identif icación a nivel de género se consideraron las descripciones especializadas de Morton et al. (2004).
Análisis estadístico. Para determinar diferencias significativas entre los diferentes tipos de suelo y las comunidades vegetales estudiadas, se realizó un análisis de varianza, usando el programa SPSS Statistics 23.0, y una prueba de comparación múltiple de promedios Tukey para estimar los resultados de mayor o menor nivel (P ≤ 0.05). Asimismo, un análisis de correlación Pearson se llevó a cabo para evaluar las asociaciones entre las variables de suelo, con la frecuencia de esporas de hongos vesículo arbusculares (HMVA).
Resultados y Discusión
Abundancia vegetal relativa por zona
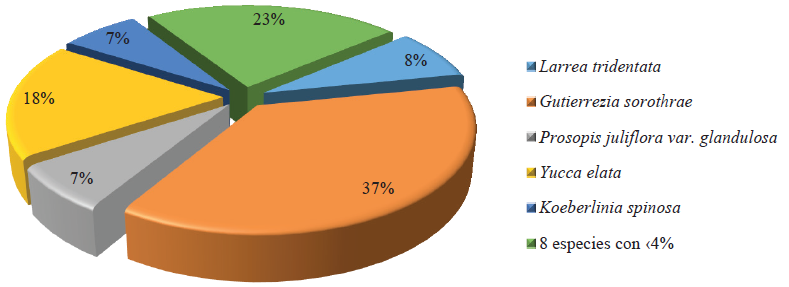
Se registraron los siguientes tipos de comunidad vegetal: Matorral inerme parvifolio (MIP) (28 spp.) donde Larrea tridentata representó el 38% del total de individuos presentes en el área (Figura 1). Matorral mediano subinerme (MMS) en esta zona se registraron 32 especies, de las cuales 25 contaban con menos del 3% de la abundancia total, destacando Fouquieria splendens y Yucca elata, por lo que se decidió agruparlas, representando así el 24% de los individuos registrados; L. tridentata representó el 23% de los individuos de la zona y Bahia absintifolia presentó un 19% de individuos (Figura 2). Matorral de médanos (MDM), Gutierrezia sarothrae representó al 37% de los individuos de la comunidad vegetal, mientras que ocho especies con menos del 4% de abundancia individual, representaron el 23% de los individuos, en este grupo se ubican las Asteráceas; Y. elata presentó una alta abundancia con el 19% del total de los individuos, mientras que Prosopis juliflora solo representó el 7% (Figura 3). Sin embargo, la cobertura de P. juliflora var. glandulosa fue la más representativa como especie clave, al servir como hábitat y alimento de especies animales en este tipo de comunidad. La abundancia concuerda con lo mencionado por Enríquez (2003) y Sosa et al. (2006), quienes determinaron los tipos de vegetación existente en zonas áridas de Chihuahua y encontraron los mismos tipos de vegetación y abundancias similares a las registradas en este estudio, principalmente matorral micrófilo y asociaciones de especies arbustivas, principalmente Larrea-Prosopis-Yucca-Flourencia cernua. La especie con mayor presencia fue L. tridentata, se encontró en las tres comunidades vegetales, y en dos de ellas era una de las especies de mayor abundancia. Estos resultados concuerdan con los presentados por González y Sosa (2003) y Sosa et al. (2006); al hacer una clasificación de comunidades vegetales en regiones áridas del desierto chihuahuense, y en ambos estudios encontraron que las especies presentes en más del 50% del área de estudio fueron L. tridentata y P. juliflora var. glandulosa.
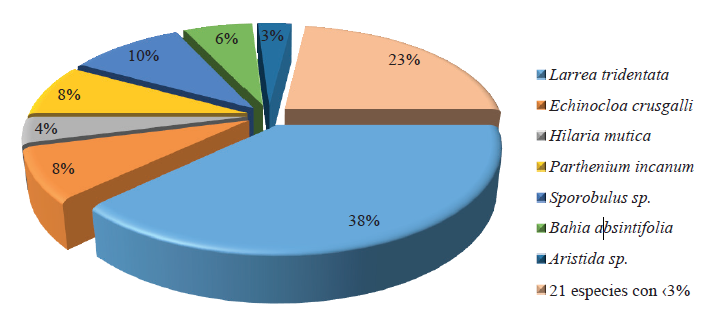
Figura 1: Abundancia relativa de las especies vegetales en la zona de matorral inerme parvifolio de gobernadora.
Análisis de diversidad vegetal
Se encontró que el matorral parvifolio (MIP) presentó la más alta frecuencia, se registraron 2734 individuos, no obstante, el índice de diversidad no es muy elevado (H’=1.78). En este caso, el índice de dominancia de Simpson resultó elevado (D = 0.71), la baja diversidad se debe a la alta dominancia de algunas de estas especies, principalmente L. tridentata como la más abundante, lo cual coincide con el bajo resultado de equitatividad (J’= 0.39). El matorral mediano subinerme (MMS) representó la comunidad vegetal con mayor riqueza (32 spp.), no obstante que la frecuencia es baja comparada con el MIP, ya que solo se registraron 701 individuos, la distribución de la abundancia es mucho mayor (J’ = 0.69) y esto queda de manifiesto al ver los resultados de diversidad (H’ = 2.36). MDM es el sitio de menor riqueza (13 spp.) y frecuencia, esta comunidad vegetal es la que presentó menor dominancia (D = 0.22); a su vez presentó una diversidad más elevada (H’ = 2.45); debido principalmente a que las especies se distribuyen de una forma más regular en esta zona, por lo que se registró la mayor equitatividad (J’= 0.86), (Cuadro 1). Estos resultados se relacionan con las abundancias relativas por zona, en este caso la comunidad con mayor dominancia resultó ser la que presentó una alta abundancia de una sola especie (L. tridentata); así mismo la zona con menor dominancia de especies es la que presentó una distribución en cuanto abundancias de las especies más homogénea. En general, la riqueza y distribución florística fue menor a la registrada en otros estudios con vegetación similar (Encina-Domínguez et al., 2013; Mata et al., 2014; Alanís-Rodríguez et al., 2015). Sin embargo, los datos coinciden con respecto a las familias mejor representadas como Cactaceae, Fabaceae y Asteraceae, las cuales son asociadas a comunidades de matorrales desérticos del norte de México (Estrada-Castillón et al., 2005; González-Rodríguez et al., 2010). Carmona Lara et al. (2008) mencionan que las cactáceas se distribuyen de manera más uniforme, lo que concuerda con lo encontrado en la comunidad MMS que se caracteriza por una riqueza de cactáceas representativas, tales como: Opuntia engelmanii, O. violácea, O. f icus-indica, Echinocactus coccineus, entre otras, cuyos valores reflejan una baja dominancia, pero una alta equitatividad, lo que indica una distribución muy cercana a la homogeneidad.
Cuadro 1: Parámetros ecológicos de las comunidades vegetales estudiadas.
Parámetros ecológicos |
|||
Riqueza (S) |
28 |
32 |
13 |
Frecuencia (N) |
2734 |
701 |
394 |
Diversidad de Shannon (H') |
1.78 |
2.36 |
2.45 |
Equitatividad de Pielou (J') |
0.39 |
0.69 |
0.86 |
Dominancia de Simpson (D) |
0.71 |
0.38 |
0.22 |
MIP = matorral inerme parvifolio; MMS = matorral mediano subinerme; MM = matorral de médanos.
Similitud entre comunidades vegetales
Las comunidades vegetales similares fueron MIP y MMS, ya que comparten el 76.64% de las especies vegetales, mientras que las zonas menos similares entre sí fueron MMS y MDM, ya que solo el 21.21% de las especies se presentaron en ambas zonas (Cuadro 2).
Cuadro 2: Resultados del índice de similitud de Morisita.
† Diagonal superior e inferior: porcentaje de similitud de especies. MIP = matorral inerme parvifolio; MMS = matorral mediano subinerme; MDM = matorral de médanos.
Se formaron tres grupos: las zonas de MIP-MMS (76% similitud), MIP-MDM (31% similitud) y el tercer grupo formado por MDM-MMS (22% similitud) (Cuadro 2). La alta similitud evidente entre MMS y MIP es debido a que en ambas comunidades hay una alta abundancia de L. tridentata; de modo que la comunidad donde menos se presenta esta especie es la que menor similitud comparte con el resto. Algunos estudios con resultados similares, como los de González et al. (2013), muestran que el 86 % de la cobertura total proviene de Larrea tridentata (48 %) y Flourensia cernua (38 %). Por otra parte, los valores de los índices se asemejan a los presentados por González-Delgado et al. (2016), en el cual caracterizaron la composición florística de dos sitios del matorral micróf ilo en Nuevo León, presentando igualmente dominancia por L. tridentata y F. cernua, los índices de similitud entre estas se vieron afectados de la misma manera que en nuestro estudio por la ausencia-presencia de la especie dominante
Caracterización del suelo por comunidad vegetal
La textura del suelo en MIP fue arenosa franca, con pH medianamente alcalino, sin problemas de salinidad. La concentración de nitrógeno inorgánico (NH4 + NO3) del suelo fue bajo, mientras que el contenido de fósforo se presentó en un nivel alto (Cuadro 3). La textura del suelo para MMS fue arenosa franca, pH medianamente alcalino, con un contenido de nitrógeno bajo, y al igual que la anterior comunidad los niveles de fósforo fueron altos, siendo en este sitio el suelo en el cual se presentó la mayor concentración, así mismo presentó diferencias estadísticas significativas (P < 0.05) en cuanto a conductividad eléctrica, ya que contó con la concentración mayor de sales solubles entre las comunidades vegetales evaluadas. Finalmente, en MDM la textura del suelo fue arenosa, con pH medianamente alcalino, con baja salinidad de acuerdo a la concentración eléctrica. El nitrógeno inorgánico se encontraba en niveles muy bajos y la cantidad de fósforo fue similar a la presentada en el MIP. Las características químicas del suelo son muy importantes para la oclusión del fósforo soluble, ya que este elemento se encuentra preferentemente en suelos alcalinos, aunque es común encontrarlo unido a iones de calcio y magnesio (Cross y Schlesinger 2001; Buckingham et al., 2010). Es de esperarse que en suelos calcáreos como los encontrados en los matorrales de dunas (MM), el fósforo asimilable se encuentre reducido o poco disponible para las plantas.
Cuadro 3: Medias de los parámetros del suelo analizados para cada comunidad.
Parámetro |
P < 0.05 |
|||
pH |
7.8075 |
7.99 |
7.9875 |
0.465 |
Conductivad eléctrica (dS m-1) |
1.059 b† |
1.213 ab |
1.481 a |
0.000* |
Temperatura (°C) |
22.5 a |
21.75 a |
21.375 a |
0.004* |
Nitrógeno inorgánico (mg kg-1) |
17.5675 a |
17.7325 a |
6.6875 b |
0.015* |
Fósforo asimilable (mg kg-1) |
23.0625 b |
72.5075 a |
23.6425 b |
0.004* |
Arena (%) |
88.7 b |
88.24 b |
98.2 a |
0.000* |
Limo (%) |
13.28 a |
13.2 a |
3.78 b |
0.000* |
Arcilla (%) |
1.98 |
1.44 |
1.98 |
0.224 |
Clasificación textural |
Arenosa franca |
Arenosa franca |
Arenosa |
† Datos con diferente letra son estadísticamente diferentes (P < 0.05) según Tukey. * Datos que indican significancia. MIP = matorral inerme parvifolio; MMS = matorral mediano subinerme; MDM = matorral de médanos. (Cuadro horizontal).
Wilson y Thompson (2005) mencionan que la principal fuente de nitrógeno en estos paisajes está dada por las relaciones simbióticas con bacterias fijadoras de nitrógeno en los mezquites, además del aporte significativo que las hojas en descomposición pueden acarrear al suelo. En este estudio los valores bajos de nitrógeno y fósforo pueden estar relacionados con los valores altos del pH, dando como resultado una baja disponibilidad (Dragovic et al., 2008); González-Rodríguez et al. (2013) reportaron valores similares en el pH del suelo en dos sitios de estudio en el Noroeste de México (Nuevo León y Coahuila), mencionan que esta variable tiende a limitar la solubilidad de macro y micro nutrientes en el suelo, siendo los macronutrientes nitrógeno y fósforo los más afectados. En cuanto al contenido de fósforo extractable en el suelo, la comunidad vegetal del MMS presentó los mayores niveles de fósforo, mientras que el resto de las comunidades MM y MIP no presentaron diferencias estadísticas significativas (Cuadro 3). Esto puede deberse a la riqueza vegetal de especies arbustivas y densidad de esporas de hongos endomicorrízicos presentes en el suelo. Los residuos orgánicos de las plantas, animales y biomasa microbiana muerta contienen compuestos de fósforo orgánico que pueden ser hidrolizados y mineralizados por acción de enzimas (fosfomono-, fosfodi- y fosfotri-esterasas) de origen tanto microbiano, fúngico o vegetal (Cross y Schlesinger, 2001; Tapía-Torres y García-Oliva, 2013). Es importante recalcar que la zona MMS presentó la mayor riqueza tanto en géneros de especies vegetales como de HMVA. Los suelos de las diferentes zonas presentaron textura arenosa. El MDM presentó el mayor porcentaje de arena, mientras que MIP y MMS no presentaron diferencias significativas. La comparación del porcentaje de limo, el cual se comporta de manera inversa al porcentaje de arena, es decir, también presenta dos grupos, solo que en este caso MM, es el matorral con menor cantidad de limo, mientras que los matorrales MIP y MSM presentaron un porcentaje de limo similar (Cuadro 3).
Identificación y número de esporas de HMVA
Se encontraron un total de 133 esporas en cuatro géneros: Glomus, Acaulospora, Gigaspora y Paraglomus, coincidiendo con los resultados obtenidos por Camargo et al. (2010); Lugo et al. (2008) y Sánchez Colín (2005), quienes reportaron la presencia de los géneros Acaulospora, Glomus y Gigaspora en vegetación xeróf ila del país. Glomus ha sido el principal género observado en zonas áridas y dunas (Beena et al., 2000a y b). Algunas especies reportadas son: Glomus mosseae, Glomus dimorphicum, Glomus fasciculatum, aunque también pueden estar presentes los géneros Gigaspora (Gigaspora gigantea), Acaulospora (Acaulospora taiwania) y Sclerocystis (Ferrera y Lara, 1987; Beena et al., 2000a y b). Mohan y Mishra (1998) reportaron que esporas de los géneros: Glomus, Gigaspora y Sclerocystis estuvieron colonizando suelos desérticos de la India. El MMS fue la comunidad con mayor número de HMVA (n = 106 esporas) concentrados en su mayoría en el género Glomus. La zona MDM presentó el menor número de esporas y géneros de HMVA, seguido del MIP con 19 registros de esporas. Estos resultados coinciden con los que obtuvieron Chimal-Sánchez et al. (2016), reportando que la zona de mayor riqueza también fue un matorral mediano subinerme, considerado como una zona de transición entre las comunidades vegetales estudiadas; mientras que en las demás comunidades muestreadas cuya vegetación es más definida, la densidad de esporas fue mucho menor. La mayoría de los estudios de zonas áridas en México, coinciden que los suelos presentan una riqueza de esporas baja (Bashan et al., 2007; Tapia-Goné et al., 2008; Chimal-Sánchez et al., 2016). Algunas especies se encontraron en más de una comunidad vegetal (Cuadro 4).
Cuadro 4: Riqueza y número de esporas por comunidad vegetal.
Género |
|||
Acaulospora |
13 |
11 |
6 |
Glomus |
6 |
86 |
2 |
Gigaspora |
- |
5 |
- |
Paraglomus |
- |
4 |
- |
Número de esporas |
19 |
106 |
8 |
Riqueza (géneros) |
2 |
4 |
2 |
MIP = matorral inerme parvifolio; MMS = matorral mediano subinerme; MM = matorral de médanos.
Existen otros factores que son importantes a considerar como respuesta a la presencia y densidad de esporas en las comunidades vegetales. Entre ellos se encuentra la identidad del hospedero, la afinidad entre hongo-planta, las características físico-químicas del suelo, el clima y específicamente la humedad retenida en el suelo (Armenta et al., 2016), algunas de ellas no consideradas en este estudio.
Comparación del número de esporas por comunidad vegetal en relación a la concentración de nitrógeno inorgánico y fósforo asimilable
El análisis de correlación de Pearson indicó que no existió relación estadística significativa entre la cantidad de nitrógeno inorgánico del suelo presente en cada comunidad vegetal con el número de las esporas de HMVA (Figura 4); De acuerdo con Santos et al. (2006) existe una correlación negativa entre el nitrógeno y la presencia de HMVA; pero de acuerdo con otros investigadores (Pezzani et al., 2006; Camargo y Dhillion, 2003), existe una relación positiva entre los niveles de nitrógeno en el suelo y la cantidad de esporas en el área; a pesar de que no se encontró dicha relación, se puede apreciar una tendencia, ya que el suelo de la comunidad con mayores valores de esporas coincide con ser el que presentó la mayor concentración de nitrógeno. García Sánchez et al. (2008) no encontraron relación entre los niveles de nitrógeno y la diversidad, densidad o presencia de HMVA. Sin embargo, respecto al fósforo, se identificó una significativa relación entre la concentración de este y la densidad de esporas (r = 0.987), destacando en el MMS. Aguilera Gómez et al. (2008) encontraron que existía una relación entre el número de esporas y la cantidad de fósforo presente en el suelo; al igual que Pezzani et al. (2006) y Valentine y Kleinert (2007), quienes encontraron que los lugares con mayor cantidad de fósforo coincidían con ser los de mayor cantidad, riqueza y colonización de HMVA. Las micorrizas arbusculares son consideradas como las asociaciones fúngicas que aportan el mayor y más importante flujo de carbono y nutrientes dentro de los ecosistemas desérticos (Montaño et al., 2007; Brundrett, 2009). Sin embargo, las condiciones climáticas, principalmente la distribución y frecuencia de las lluvias, pueden influir en la abundancia de las mismas (Gutiérrez-Gutiérrez et al., 2017). En algunos estudios realizados en México, particularmente en la sierra sonorense, se ha denotado que la variación de la capacidad de esporulación de los hongos, no sólo depende del hospedante al que los HMVA se encuentren asociados sino también, por la presencia de lluvia o períodos de sequía, principalmente en la rizósfera de plantas crassicaule del género Agave, la esporulación es más abundante en la estación lluviosa que en la época de sequía, además de mostrar una diversidad funcional entre los hongos MVA a lo largo del año. Mencionan también que la disponibilidad de elementos como sodio, potasio y magnesio son determinantes para establecer una relación micorrízica (Ochoa-Meza et al., 2008). La variable precipitación en relación con la densidad de esporas no fue considerada en este estudio.
Conclusiones
A partir de la caracterización de las esporas se lograron identificar los géneros Acaulospora, Glomus, Gigaspora y Paraglomus de los hongos micorrízicos de tipo vesículo arbusculares (HMVA) presentes en las tres zonas estudiadas dentro del ANP médanos de Samalayuca. En general las especies vegetales dominantes en todos los sitios fueron Larrea tridentata y Prosopis juliflora var. glandulosa, sin embargo, la comunidad vegetal de mayor riqueza de especies fue el matorral mediano subinerme con mayor vegetación característica de zona áridas, como Atriplex canescens, Yucca elata y Fouquieria splendens. Los suelos del área de estudio resultaron arenosos, alcalinos, sin problemas de salinidad, bajos en nitrógeno inorgánico y altos en fósforo extractable. La relación entre la cantidad de esporas y concentración de nutrientes demuestra que entre más pobre en nutrientes, principalmente en fósforo menor número de esporas y viceversa, aunque no se pudo determinar directamente la resistencia de las plantas con la presencia de los HMVA. Sin embargo, se puede concluir que puede existir una relación de la riqueza de especies vegetales con la concentración de fósforo y la densidad de esporas de HMVA, debido a que la comunidad matorral mediano subinerme (MMS) presentó las tres características mencionadas en mayor número. Por ello, se recomienda continuar los estudios de identificación de especies de HMVA en la rizósfera de las principales especies vegetales más dominantes del matorral desértico y relacionarlo con la calidad del suelo, estacionalidad, clima y los atributos principales de dichas especies vegetales para encontrar una respuesta más directa del comportamiento de estas tres variables; suelo, hongo y planta.











 nueva página del texto (beta)
nueva página del texto (beta)