Introducción
La fruticultura en la región manzanera de Chihuahua, que comprende los municipios de Cuauhtémoc, Guerrero, Cusihuiriachi, Carichi, Namiquipa, Bachíniva y Casas Grandes, juega un papel fundamental en el sector primario al ser el cultivo más intensivo y que más empleo genera en el estado, contribuyendo al desarrollo socioeconómico, la seguridad y soberanía alimentaria de México. Sin embargo, en la última década el rendimiento, la calidad de fruto y la rentabilidad se han visto afectadas por el uso excesivo de los fertilizantes de síntesis (Monge et al., 2006), lo que ha ocasionado altos índices de contaminación, aumento de la compactación, incremento de las sales, disminución de la materia orgánica y el decremento de la biodiversidad de los suelos (Harris y Bezdicek, 1994).
Debido a que el uso de fertilizantes químicos a largo plazo ha demostrado tener efectos perjudiciales sobre la estructura del suelo y su salud, lo que con lleva a la erosión y rendimientos bajos. El uso excesivo de los fertilizantes altera el equilibrio natural del suelo y puede quemar químicamente las raíces de las plantas (Hawes et al., 2003).
El nitrógeno es considerado el nutriente mas limitante para el crecimiento de las plantas en su ambiente natural (Baca et al., 2000). El nitrógeno presente en la atmosfera es la reserva más grande en la naturaleza, sin embargo, no es utilizado por las plantas directamente, su asimilación necesita de un proceso de reducción que es realizado solamente por microorganismos, los cuáles son capaces de realizar la fijación en el ciclo del nitrógeno (Baca et al., 2000).
De forma natural existen dos maneras de f ijar nitrógeno, mediante abundante energía lumínica para la formación de nitritos (NO2) y nitratos (NO3) los cuales son llevados al suelo. Esto contribuye con el 10% de la producción total anual de nitrógeno fijado (Fisher y Newton, 2002). La otra y la más importante se deriva de la actividad microbiana selecta del suelo, donde los microorganismos absorben el nitrógeno atmosférico y lo convierten en amonio (NH4). Algunos microorganismos se encuentran libres en el suelo y se alimentan de materia orgánica, otros se encuentran creciendo en asociación con las raíces y otros establecen simbiosis con plantas, donde la planta le da energía para crecer mientras que la bacteria le provee nitrógeno. Estos procesos biológicos contribuyen con el 65% de la producción total anual de nitrógeno fijado (Fisher y Newton, 2002).
El uso indiscriminado de fertilizantes químicos ha causado pérdidas en la productividad de los suelos donde se realizan prácticas agrícolas incorrectas, las cuales ocasionan la degradación de propiedades biológicas, físicas y químicas del suelo (Carvajal y Mera, 2010).
El exceso de fósforo puede interferir con la absorción de micronutrientes, como el zinc y hierro, así mismo, el exceso de potasio en forma de potasa aumenta el pH del suelo, lo que causa una mala absorción de nutrientes (Stevenson y Cole, 1999).
Los efectos negativos del uso de fertilizantes de síntesis en el medio ambiente son indiscutibles, los productos químicos que se encuentran en los fertilizantes, como nitratos y fosfatos, contaminan acuíferos y cuerpos de agua superficiales (Orozco-Corral y Valverde-Flores, 2012).
La biofertilización es una tecnología en expansión que está vinculada con la inclusión de microorganismos al suelo, siendo de gran importancia para el desarrollo de cultivos obteniendo mayores rendimientos, inocuos, de mejor calidad fitosanitaria, a su vez aumentar el contenido de materia orgánica del suelo (Da Silva et al., 1999).
El uso de biofertilizantes ha tomado cada vez más fuerza, ya que originan procesos rápidos, consumen poca energía, no contaminan el medio ambiente, incrementan la fertilidad del suelo y proporcionan protección frente a microorganismos fitopatógenos, al aportar microorganismos benéficos que ayudan a mantener un equilibrio ecológico por medio de la liberación de nutrientes inorgánicos aumentado la fertilidad de los suelos de cultivo (Carvajal y Mera, 2010).
El recurso suelo es complejo de estudiar y analizar, debido a su complejidad estructural y carencia de métodos eficientes para su evaluación, especialmente en lo que se refiere al ecosistema microbiológico. Actualmente, un elemento central del estudio de los suelos es la evaluación de su calidad, donde las propiedades microbiológicas han mostrado ser de gran relevancia, ya que influyen directamente con las diversas funciones del suelo, por lo que una alteración de éstas, puede desencadenar cambios drásticos en las propiedades físicas y químicas del suelo (Di Giovanni et al., 1999; Stenberg, 1999; Widmer et al., 2001).
En la última década se han incrementado los estudios de la microbiología de los suelos debido fundamentalmente, a que se ha reconocido su importancia en los ecosistemas microbiológicos edáficos, por lo que su análisis permitiría el monitoreo y predicción de los cambios en la calidad del suelo. Sin embargo, este análisis estructural no ha podido llevarse a cabo por la falta de información sobre la biodiversidad de estos ecosistemas (Torsvik et al., 1980; Torsvik et al., 1990).
Los estudios microbiológicos del suelo son a menudo subvalorados por su complejidad, dejándolos en desventaja respecto a los análisis de las propiedades físicas y químicas. Sin embargo, éstos últimos no han permitido explicar que las alteraciones en la calidad del suelo responden principalmente a sus cambios microbiológicos (Widmer et al., 2001).
Los microorganismos presentes en el suelo son factores clave en los ciclos de la mayoría de los nutrientes, especialmente en el ciclo del carbono, nitrógeno, azufre y fósforo. En el caso del ciclo del carbono, son responsables de la descomposición de residuos orgánicos y de la degradación de compuestos orgánicos contaminantes presentes en el suelo, siendo muy frecuente la utilización de biofertilizantes como enmiendas orgánicas para su activación o repoblación (Ros et al., 2010). La energía presente en el ecosistema del suelo deriva, entre otros compuestos, de esa descomposición de la materia orgánica por los microorganismos (Pepper y Gerba, 2005). Otra de las funciones importantes de las bacterias es la secreción de sustancias adherentes en forma de polisacáridos que ayudan en la formación de micro y macroagregados que proporcionan estabilidad a la estructura del suelo (Voroney, 2007).
Las bacterias presentan otras características importantes. Una de ellas es la capacidad de producir antibióticos. La finalidad de la producción de antibióticos presumiblemente es la de competir y señalizar su presencia a patógenos (Davies, 2006). Los actinomicetos producen antibióticos como eritromicina, neomicina, tetraciclina, anfotericina y estreptomicina. Las bacterias del género Bacillus producen polimixina y bacitracina (Killham y Prosser, 2007).
Los biofertilizantes ejercen una acción fitosanitaria ya que producen una colonización de microorganismos benéficos que compiten contra patógenos que están en el suelo, por lo cual son útiles para control biológico de enfermedades (Bashan, 1986; DeLucca et al., 1990; Linderman, 1993; Pérez et al., 2000; Zago et al., 2000).
La sustentabilidad de los sistemas agrícolas a largo plazo debe fomentar el uso y manejo efectivo de los recursos naturales de los agroecosistemas. En este sentido, los biofertilizantes son un componente vital de los sistemas sustentables, ya que constituyen un medio económicamente atractivo y ecológicamente aceptable de reducir el uso de los fertilizantes de síntesis y de mejorar la cantidad y calidad de los recursos naturales. Para ello, se hace imprescindible adoptar una estrategia de suministro de nutrientes a los cultivos mediante biofertilizantes líquidos, todo ello dentro del marco de la sustentabilidad, tendencia surgida en contraposición a la Revolución Verde, para reducir los daños causados al ambiente, a la salud del hombre y los animales por los métodos irracionales que se han empleado en las últimas décadas (Alins et al., 2013).
Debido a lo anterior, la obtención de biofertilizantes, bioestimuladores del crecimiento y bioplaguicidas de origen microbiano y botánico, constituyen pilares básicos para un manejo sustentable, productivo y económicamente viable de la fruticultura en México (Dibut Alvarez y Martínez Viera, 2013).
Por lo que el objetivo en este trabajo fue medir efectos de la aplicación combinada de biofertilización y fertilización química, sobre las propiedades físicas, químicas y biológicas del suelo.
Materiales y Métodos
En el presente trabajo se evaluó la aplicación de biofertilizantes por fertirriego en plantaciones de manzano. El estudio se realizó en los ciclos 2012-13, 2013-14 y 2014-2015 en una plantación de manzanos (Malus domestica Borkh) cv. Golden Supreme sobre portainjerto Malling 7 (M-7), con 27 562 árboles, establecida en 2002, con un marco de plantación de 2 × 4.75 m (1052 árboles ha-1), bajo un sistema de riego por microaspersión, ubicada en el municipio de Guerrero, Chihuahua, México, 28° 28’ 18.44” N, 107° 12’ 8.52” O, con una superficie total de 26.2 ha.
Se establecieron dos tratamientos, el tratamiento 1 (T-1) donde se aplicó biofertilizante y 50% de fertilizantes químicos en una superficie de 15.8 ha. El tratamiento 2 (T-2) fue el testigo, representando el manejo tradicional del productor, donde se aplicó solamente la fertilización química en una superficie de 10.4 ha (Figura 1).
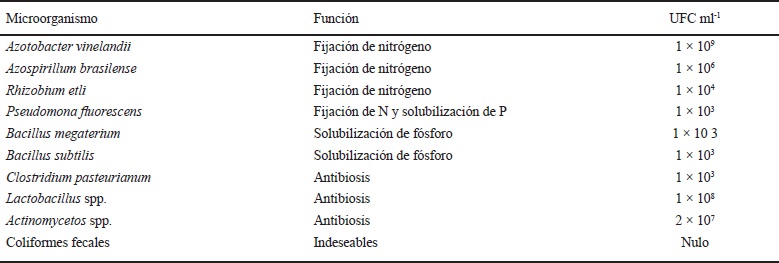
El biofertilizante utilizado fue un consorcio de microorganismos benéficos (Azotobacter vinelandii, Clostridium pasteurianum, Rhizobium etli, Pseudomona f luorescens, Bacillus megaterium, Bacillus subtilis, Azospirillum brasilense, Actinomyces spp. y Lactobacillus spp.), aminoácidos, enzimas, ácidos húmicos y fúlvicos, con aporte de macro y micro elementos minerales (Cuadro 1).
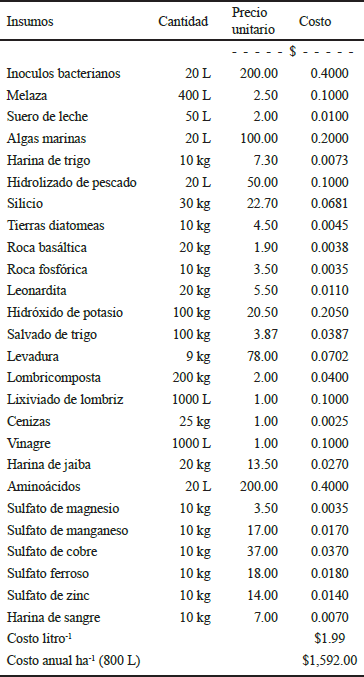
Cuadro 1 Insumos para la elaboración de 10 000 litros de biofertilizante en biorreactores y su costo por litro.
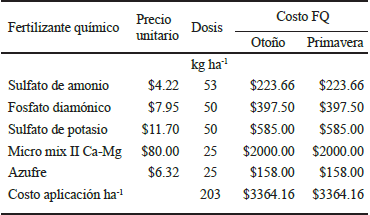
Los fertilizantes químicos utilizados para los tratamientos se muestran en el Cuadro 2.
El T-1 (Cuadro 3), consistió en la aplicación de fertilizantes de síntesis y biofertilizantes. La fertilización química se efectuó en una sola aplicación en postcosecha antes de entrar en dormancia en el mes de noviembre en cada ciclo (2012-13, 2013-14 y 2014-2015), su aplicación fue en círculo a un metro del tronco del árbol para ello se mezclaron previo a su aplicación, 53 kg de sulfato de amonio [(NH4)2SO4], 50 kg de fosfato diamónico [(NH4)2HPO4], 50 kg de sulfato de potasio (K2SO4), 25 kg de azufre granulado y 25 kg de micro mix II Ca-Mg®, para una dosificación de 203 kg ha-1 (193 g árbol -1). Para la biofertilización se realizaron ocho aplicaciones por fertirriego en cada ciclo, a una dosis de 100 L ha-1, dichas biofertilizaciones se programaron de la siguiente manera: una antes de la dormancia (noviembre), una durante la dormancia (enero), dos en floración (abril), una en plena floración (mayo), una en postfloración (junio) y dos en desarrollo de fruto (julio).
El T-2 (Cuadro 2), consistió solamente en fertilización química, efectuándose en dos ocasiones en cada ciclo (2012-13, 2013-14 y 2014-2015), una en postcosecha antes de entrar en dormancia en noviembre y otra en abril durante la brotación, su aplicación fue en círculo a un metro del tronco del árbol. Se aplicaron 53 kg de sulfato de amonio [(NH4)2SO4], 50 kg de fosfato diamónico [(NH4)2HPO4], 50 kg de sulfato de potasio (K2SO4), 25 kg de azufre granulado y 25 kg de micro mix II Ca-Mg® (complejo de microelementos); todos ellos fueron mezclados previamente, su dosificación fue de 203 kg ha-1 (193 g árbol‑1).
En ambos tratamientos se aplicaron 6 Mg ha-1 de lombricomposta en banda (Figura 2), en cada ciclo agrícola (2012-13, 2013-14 y 2014-2015) en el mes de enero (Cuadro 4).
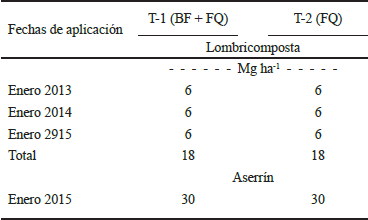
Cuadro 4 Aplicación de lombricomposta y de acolchado de aserrín de pino en los tratamientos establecidos.
En el mes de enero del ciclo agrícola 2014-15 se aplicaron, en ambos tratamientos, 30 Mg ha-1 de aserrín de pino como acolchado orgánico (Cuadro 4), con un espesor de 30 cm y un metro de ancho a cada lado del centro de la línea de árboles, cubriendo la lombricomposta (Figura 3).
Para el análisis de las propiedades físicas y químicas del suelo se tomaron cuatro muestras antes del inicio, durante y después de los tratamientos en el mes de septiembre de 2012, 2013, 2014 y 2015, dos muestras de suelo sobre la línea de árboles y dos entre líneas, a una profundidad de 0-20, 20-40 y 40-60 cm, se mezclaron homogéneamente para formar una sola muestra para cada profundidad y se realizaron cuatro repeticiones. Se determinaron las propiedades físicas: punto de saturación (PS), capacidad de campo (CC), punto de marchitez permanente (PMP), humedad aprovechable (HA), densidad aparente (Da) por el método de cilindro, porosidad (Po), velocidad de infiltración (Vi) por el método de anillo infiltrómetro y la clase textural por el método del densímetro de Bouyoucos.
Mediante análisis de laboratorio se determinaron las propiedades químicas: porcentaje de materia orgánica (MO) por el método de Walkley y Black, la conductividad eléctrica (CE) por el método conductivimétrico en extracto de saturación expresado en dS m-1, el pH en H2O y en cloruro de potasio (KCl) mediante los métodos AS-02 y AS-04, siguiendo la NOM-21-RECNAT-2000, el porcentaje de cationes o bases intercambiables Ca++, Mg++, K+ y Na+ y la capacidad de intercambio catiónico (CIC) expresado en meq 100‑1 de suelo por el Método de Versanato.
Para la determinación de los macroelementos totales (K, Ca, Mg y Na) el método utilizado fue por absorción atómica previa extracción en una solución de acetato amónico 1N a pH 7 y son expresados en ppm. Del mismo modo, utilizando el método por absorción atómica previa extracción con DTPA, se determinó la disponibilidad en ppm de los microelementos Fe, Zn, Mn, Cu y B. El método del Sulfato de Brucina se utilizó para la determinación del nitrógeno como nitrato (N-NO3) expresado en kg ha-1. Para el P se utilizó el método Bray y Kurtz P-1, siendo expresados en mg kg-1. El azufre como sulfato (S-SO4) fue extraído mediante la solución de fosfato de calcio. El método turbidimétrico se utilizó para el S. El B fue determinado mediante el Método de la Curcumina. En ambos casos su absorbancia fue medida por colorimetría y su expresión es en mg kg-1.
El biofertilizante se elaboró mediante un proceso de fermentación en biorreactores de 10 000 L (Figura 4), con oxigenación constante, utilizando cepas de microorganismos benéficos, productos orgánicos de origen animal y vegetal (Cuadro 1).
El biofertilizante fue sometido a análisis químico (Cuadro 5) y se determinó el contenido porcentual de los macronutrientes (N, P, K, Ca y Na), así como también el contenido de micronutrientes (Fe, Zn, Mn y Cu) expresados en mg L-1 y las propiedades químicas de MO y pH expresados en porcentaje y la CE en dS m‑1, siguiendo la metodología establecida en la NOM-21‑RECNAT-2000.
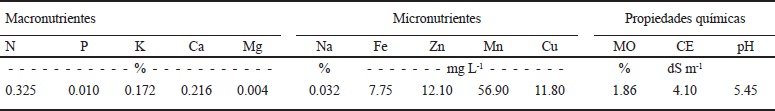
MO = materia orgánica; CE = conductividad eléctrica.
Cuadro 5 Análisis químico y nutricional del biofertilizante.
El biofertilizante también fue analizado en su contenido microbiológico (Cuadro 6), para lo cual se utilizaron laboratorios especializados y medios de cultivo específicos. La evaluación de la densidad de poblaciones de bacterias fijadoras de N (BFN), solubilizadoras de P (BSP) y generadoras de antibiosis (BGA), se realizó con el método de conteo de células vivas por siembra en superficie (Madigan et al., 2004). Se utilizaron diluciones seriadas con base en 10, se diluyeron 10 g del biofertilizante en 90 ml de agua estéril, hasta 1 × 10-6. Se tomó 0.1 ml de cada dilución y se colocó en el centro de la caja de petri con medios de cultivos sólidos específicos, distribuyéndose con espátula trigalsqui. Las muestras se incubaron a temperatura de 27 °C durante 24-72 h. El procedimiento se realizó por triplicado. El conteo de células viables se realizó contando las UFC mL-1 que crecieron en la superficie del medio de cultivo con contador de colonias Darkfield Quebec.
Para el análisis microbiológico del suelo, se colectaron cuatro muestras de suelo en cada horizonte de 0-20, 20-40 y 40-60 cm, antes del inicio, durante y después de los tratamientos en el mes de septiembre de 2012, 2013, 2014 y 2015, dos muestras de suelo sobre la línea de árboles y dos entre líneas, se mezclaron las muestras de cada horizonte para formar una sola muestra homogénea para cada profundidad y se realizaron cuatro repeticiones. La evaluación de la densidad de poblaciones de BFN, BSP y BGA, se realizó con el método de conteo de UFC. Se utilizaron diluciones seriadas con base en 10, se diluyeron 10 g del suelo en 90 ml de agua estéril, hasta 1 × 10-6. Se tomó 0.1 mL de cada dilución y se colocó en el centro de la caja de petri con medios de cultivos sólidos específicos. Las muestras se incubaron a temperatura de 27 °C durante 24-72 h. El procedimiento se realizó por triplicado. El conteo de células viables se efectuó contando las UFC ml-1 que crecieron en la superficie del medio de cultivo con un contador de colonias Darkf ield Quebec, luego se transformó a UFC g-1 de suelo.
La cuenta en placa de los coliformes fecales se realizó con apego a la metodología propuesta en las Normas Oficiales Mexicanas NOM-112-SSA1-1994, NOM-113-SSA1-1994, NOM-114-SSA1-1994 y NOM-143-SSA1-1995.
Para el análisis estadístico de los datos se utilizó el programa SPSS versión 15.0. Los resultados de las propiedades físicas y químicas se analizaron mediante un análisis de varianza (ANOVA) y comparación de medias (DMS) con un nivel de significancia P < 0.05. El análisis estadístico de las propiedades microbiológicas comenzó con la transformación logarítmica (LOG 10) de los valores de UFC g-1 de suelo. Se comprobó la distribución normal (Kolmogorov-Smirnov). Se realizaron los análisis de las medidas de dispersión. Se comprobó la homogeneidad de las varianzas (Levene) y se realizó un análisis de varianza (ANOVA) y comparación de medias (Tukey) con un nivel de significancia P< 0.05. Las correlaciones fueron calculadas utilizando el coeficiente R de Pearson.
Resultados y Discusión
En el tratamiento 1 (T-1) hubo un incremento estadísticamente significativo (P > 0.05) de los valores al final del estudio de las siguientes variables: punto de saturación (PS), capacidad de campo (CC), punto de marchitez permanente (PMP), humedad aprovechable (HA) y la porosidad (Po). En el tratamiento 2 (T-2) no se observaron diferencias con significancia estadística. La velocidad de infiltración básica no presentó diferencias en T-1 y T-2 (Cuadro 7).

PS = punto de saturación; CC = capacidad de campo; PMP = punto de marchitez permanente; HA = humedad aprovechable; Da = densidad aparente; Po = porosidad; Vi = velocidad de infiltración; FA = franco arenosa. † Letras iguales sobre las hileras son estadísticamente similares a DMS (P > 0.05).
Cuadro 7 Propiedades físicas del suelo al inicio y final del experimento en T-1 y T-2.
Los biofertilizantes pueden actuar mediante la síntesis de reguladores de crecimiento, como auxinas y giberelinas, que producen un aumento en el desarrollo de pelos radicales y en la densidad misma de la raíz, manifestándose en el aumento de la capacidad de absorción de agua y captación de nutrientes, dando a la planta mayor viabilidad, productividad y resistencia a condiciones adversas como sequía (Saharan y Nehra. 2001).
De acuerdo con Brady y Weil (1999), las enmiendas orgánicas, tal y como se aplicó en los dos tratamientos por tres años, ayudan en la estabilidad de agregados, reducen la plasticidad, cohesión y pegajosidad de la arcilla, haciendo que los suelos sean laborables, con lo cual aumenta la capacidad de retención de agua. Los ácidos húmicos también atacan los minerales del suelo y aceleran su descomposición, aumentando nutrientes esenciales como cationes intercambiables. Influyen además en la biología del suelo al proveer alimento a los organismos del suelo.
La HA es una de las variables más importantes del suelo, ya que representa la capacidad de retención y almacenamiento de agua. En T-1 hubo un aumento significativo del 10.36% con respecto al inicio del experimento y en T-2 no se observan cambios con significancia estadística.
La Da representa la relación entre sólidos y espacio poroso del suelo. En T-1 hubo un decremento significativo de la Da del 9.42%, mientras que en T-2 no hubo cambios con significancia estadística.
La reducción de la porosidad del suelo repercute desfavorablemente sobre las propiedades físicas debido a una menor aireación del suelo, menor capacidad de infiltración de agua y dificultad para la penetración de las raíces. En T-1 se observó un incremento importante de la porosidad al final del estudio (9.26%), debido posiblemente a la acción estimuladora del crecimiento radicular del biofertilizante líquido y lombricomposta aplicados. En T-2 hubo un descenso de -4.25% respecto al inicial.
Se muestran en el Cuadro 8 los coeficientes de correlación (R2) de Da con las propiedades físicas del suelo y MO, donde se puede apreciar que las correlaciones fueron significativamente mayores en T-1 que en T-2. La disminución de Da tuvo efecto sobre las propiedades físicas del suelo, favoreciendo la capacidad de almacenamiento de agua y la porosidad.
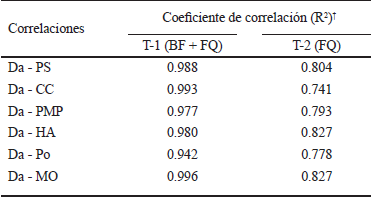
Da = densidad aparente; PS = punto de saturación; CC = capacidad de campo; PMP = punto de marchitez permanente; HA = humedad aprovechable; Po = porosidad; MO = materia orgánica. † Coeficiente de correlación R de Pearson (P > 0.05).
Cuadro 8 Coeficientes de correlación entre las propiedades físicas del suelo y la materia orgánica del mismo.
Lo anterior es corroborado por Castellanos (1980, 1982) quien observó que el contenido de humedad aumenta debido a prácticas de aplicación de abonos orgánicos sólidos, ya que disminuye la densidad aparente; se incrementa la porosidad y se modifica la estructura al mejorar la formación de agregados, todo ello influye en un aumento en la retención de humedad.
Las características químicas del suelo cambiaron significativamente en los dos tratamientos comparándolo en el estado inicial (Cuadro 9). En el T-1 hubo un aumento en el contenido de MO del suelo, mientras que en T-2 se dio un ligero descenso. En T-1 se observaron cambios en las propiedades fisicoquímicas del suelo, destacando el aumento de MO, CIC y el descenso del Na+ y K+ intercambiable con respecto al estado inicial del suelo. En T-2 los cambios en de MO, Ca++ y CIC mostraron un descenso, mientras que el K+ se vio aumentado, lo que es un reflejo de la pérdida de fertilidad.

MO = materia orgánica; CE = conductividad eléctrica; pH = potencial hidrógeno; Ca++ = calcio; Mg++ = magnesio; K+ = potasio; Na+ = sodio; CIC = capacidad de intercambio catiónico. ‡ Letras iguales son estadísticamente similares a DMS (P > 0.05).
Cuadro 9 Propiedades químicas del suelo al inicio y final del experimento en T-1 y T-2.
Los resultados de MO observados en el T-1 a la profundidad de 0 a 30 cm reflejan la capacidad de los biofertilizantes líquidos y sólidos para incrementar la MO en el suelo. La importancia del incremento de MO en el suelo se hace evidente en este estudio, ya que ésta resulta fundamental en la búsqueda de la sustentabilidad en la agricultura (Johnston et al., 2009) y el contenido adecuado en el suelo mejora la capacidad de amortiguamiento, enriquece la CIC, mejora la estructura evitando la erosión y permite el desarrollo de la microbiología benéficas (Aslantas et al., 2007). Los resultados encontrados en el presente estudio tienen similitud con lo publicado por Salazar-Sosa et al. (2003), quienes reportaron incrementos de MO utilizando lombricomposta. Castellanos (1982) menciona que el 50% del estiércol es biodegradado en el primer año, lo cual provee MO en el suelo en predios donde se han aplicado los tratamientos de estiércol por años consecutivos.
Los cambios encontrados en la densidad aparente, la porosidad y la biomasa microbiana, proporcionan evidencias de que los biofertilizantes y mejoradores aplicados durante tres años consecutivos impactaron positivamente sobre el suelo, lo que concuerda con lo publicado por Del Pino et al. (2008), quien encontró que las compostas tuvieron un efecto benéfico en las propiedades físicas (infiltración, la agregación y la densidad aparente) y biológicas del suelo. Salazar et al. (2007) encontró resultados desfavorables sobre las propiedades químicas del suelo tras la aplicación de compostas, asegurando que los efectos residuales de la aplicación de composta favorecen la acumulación de P, nitratos (NO3) y un incremento de la CE después de cuatro años bajo producción de maíz (Salazar et al., 2007), concordando con los resultados encontrados en el T-1, donde hubo un incremento de la CE , del N-NO3 y del P (Cuadros 9 y 10).
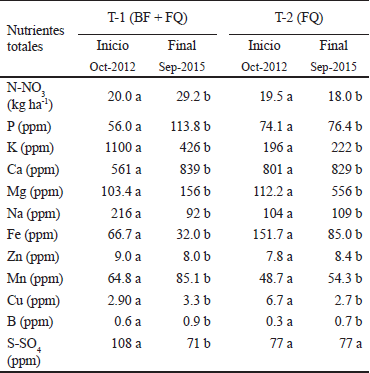
N-NO3 = nitrógeno como nitrato; P = fosforo; K = potasio; Ca = calcio; Mg = magnesio; Na = sodio; Fe = fierro; Zn = zinc; Mn = manganeso; Cu = cobre; B = boro; S-SO4 = azufre como sulfato. ‡ Letras iguales son estadísticamente similares a DMS (P > 0.05).
Cuadro 10 Contenido de nutrientes del suelo al inicio y final del experimento en T-1 y T-2.
En T-1 el incremento del contenido de MO se reflejó en el aumento de los cationes intercambiables Ca++ y Mg++, mientras que el K+ y Na+ se vieron disminuidos. En T-2 los cationes intercambiables Ca++ y Mg++ bajaron, el K+ aumentó y en Na+ no hubo cambios.
El efecto que tuvo el incremento del contenido de MO sobre las propiedades químicas en T-1, se reflejó en el aumento de la CIC (Cuadro 9) y del contenido de nutrientes totales (Cuadro 10), favoreciendo la absorción de los minerales y en T-2 se observó un descenso.
Para Restrepo (1996), los principales aportes de las compostas bovinas al suelo son: retener, filtrar y liberar los nutrientes N, P, K, Ca, Mg, Fe, Zn, Cu y B, según la cantidad, mejoran las características físicas del suelo como la porosidad, densidad aparente, capacidad de retención de agua disponible, incrementa el contenido de MO, beneficia la aireación, corrige la acidez del suelo, multiplica la actividad microbiológica. El contenido de nutrientes totales del suelo, en T-1 fueron significativamente diferentes respecto a los valores iniciales, destacando el incremento de N-NO3, P, Ca, Mg y Mn, la estabilización de K y el descenso del Na (Cuadro 10).
El incremento del contenido de MO en T-1, tuvo una alta correlación con el aumento de la CIC, macro y micronutrientes del suelo, mientras que en T-2 dicha correlación fue significativamente menor (Cuadro 11). los resultados coinciden con lo observado por López et al. (2001), quienes reportaron que el uso de estiércoles incrementa el contenido de MO en un 15%. Salazar-Sosa et. al. (2010), publicaron que el valor total de las compostas se debe a la aportación de nutrimentos y al incremento de MO del suelo, y Castellanos (1986) encontró resultados similares, ambos señalan que la adición de abonos orgánicos al suelo afecta positivamente la concentración de MO y otros elementos, igualmente Eghball et al. (2004), observaron un incremento de 3.5% de MO en suelos con N residual proveniente de compostas. Estos resultados evidencian que el incremento de MO obtenido en el T-1 (Cuadro 9), pudiera ser por el uso continuo y conjunto de lombricomposta, biofertilizante líquido y a la acción de los microorganismos sobre el acolchado orgánico de aserrín de pino, los cuales aceleraron su descomposición.

MO = materia orgánica; N (NO3) = nitrógeno como nitrato; P = fósforo; K = potasio; Ca = calcio; Mg = magnesio; Na = sodio; Fe = fierro; Zn = zinc; Mn = manganeso; Cu = cobre; B = boro; S (SO4) = azufre como sulfato. †Coeficiente de correlación R de Pearson (P > 0.05).
Cuadro 11 Correlación entre la materia orgánica (MO) y el contenido de nutrientes del suelo.
Los resultados anteriores también muestran que los abonos orgánicos son una alternativa para sustituir la fertilización inorgánica. Esto se debe a que los abonos orgánicos abastecen al suelo de nutrimentos como el N y los demás elementos esenciales que contiene la composta. Esto coincide con lo señalado por Castellanos et al. (1996) y Barber et al. (1992), quienes reportaron que los estiércoles se mineralizan un 70% a partir del primer año de aplicación y tienen un efecto residual en el suelo hasta por dos años y el resto se transforma en humus, que se incorpora al suelo y produce un efecto benéfico en la estructura del suelo durante el primer año.
Al inicio del ciclo 2012-13 y final del ciclo 2014‑15, se pudo apreciar que en el T-1 hubo un aumento significativo en las bacterias benéficas (Cuadro 12). En el T-2 se observó que no hubo cambios significativos, solamente descendieron las UFC gr-1 suelo de Rhizobium etli y Pseudomona f luorescens. Los coliformes fecales totales se mantuvieron sin presencia por encima de los límites permisibles establecidos por la Norma Oficial Mexicana NOM‑112-SSA1-1994.

† Letras iguales son estadísticamente similares a Tukey (P > 0.05).
Cuadro 12 Análisis microbiológico del suelo al inicio y final del experimento en T-1 y T-2.
La distribución de las UFC gr-1 suelo de cada microorganismo en T-1 (Figuras 5, 6 y 7) mostraron una respuesta exponencial a las aplicaciones de biofertilizante en tres horizontes del suelo (0-20, 20-40 y 40-60 cm) y una marcada disminución a mayor profundidad con respecto a los horizontes más superficiales.

Figura 5, 6, 7 . Respuesta de los microorganismos a la aplicación de biofertilizante en tres horizontes del suelo (0-20, 20-40 y 40-60 cm). Av = Azotobacter vinelandii; Re = Rhizobium etli; Cp = Clostridium pasteurianum; Ab = Azospirillum brasilense; Pf = Pseudomona fluorescens; Bm = Bacillus megaterium; Bs = Bacillus subtilis; Lb =Lactobacillus spp.; Am = Actinomycetos spp.
Cole (1993), menciona que una alta calidad del suelo se da cuando los componentes minerales y orgánicos son organizados dentro de las partículas de los poros. Los agregados afectan la porosidad del suelo, movimiento de agua y gases dentro del suelo, retención de agua, actividades microbianas y crecimiento de plantas. El incremento de la biomasa y actividad biológica mostró efectos significativos en los valores de las propiedades físicas y químicas del suelo, Da, Po, HA, MO, CE y CIC principalmente (Cuadro 13), observándose altas correlaciones en T-1, mientras que en T-2 fueron bajas, concordando con lo dicho por Wallace et al. (2009).
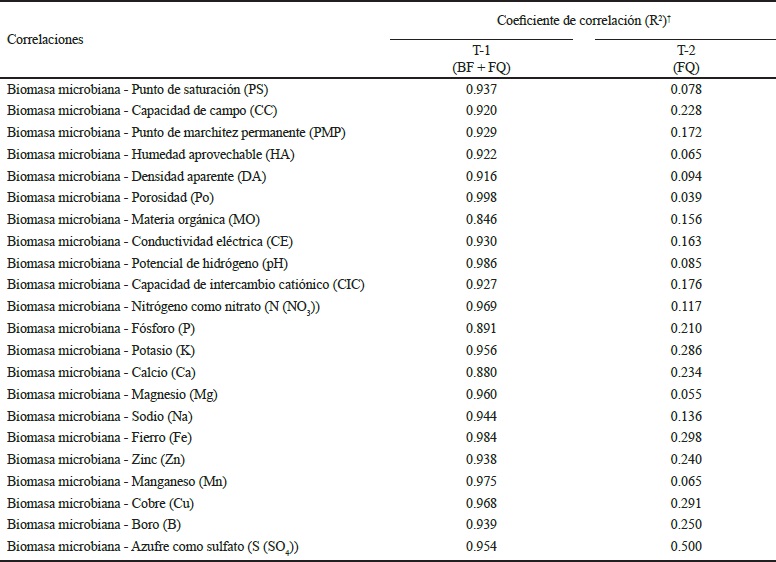
† Coeficiente de correlación R de Pearson (P > 0.05).
Cuadro 13 Correlación entre la biomasa microbiana con las propiedades físicas y químicas del suelo.
Saharan y Nehra (2001), encontraron que la aplicación continua de microorganismos mejoran las características estructurales del suelo, mediante la formación de agregados estables, resultado del crecimiento microbiano implicados en los ciclos biogeoquímicos de algunos nutrientes, de manera que actúan como biofertilizantes, aportando nutrientes al suelo e incrementando el contenido de MO del suelo, concordando con los resultados obtenidos en T-1, donde se pueden apreciar las altas correlaciones entre el incremento de la biomasa microbiana con las propiedades físicas y químicas del suelo (Cuadro 13).
Se realizó un sumatoria de la densidad de poblaciones de BFN (Azotobacter vinelandii, Rhizobium etli y Azospirillum brasilense) BSP (Pseudomona f luorescens, Bacillus megaterium y Bacillus subtilis) y BGA (Clostridium pasteurianum, Lactobacillus spp. y Actinomycetos spp.) al inicio y al f inal del estudio de ambos tratamientos. En T-1 el incremento de la biomasa microbiana al término del estudio fue de alta significancia y en T-2 no hubo cambios significativos (Figura 8).
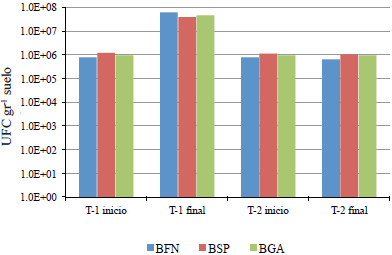
Figura 8 Biomasa microbiana al inicio y final en T-1 y T-2. BFN = bacterias fijadoras de nitrógeno; BSP = bacterias solubilizadoras de fósforo; BGA = bacterias generadoras de antibiosis
Respecto a la sumatoria de la densidad de poblaciones de BFN, BSP y BGA al final del estudio de ambos tratamientos en los horizontes muestreados (0‑20, 20‑40 y 40‑60 cm), se pueden observar que en T-1 se incrementó la biomasa microbiana en el horizonte más superficial siendo significativamente mayor, mostrando una tendencia exponencial a disminuir en los horizontes más profundos. En T-2 la población microbiana total mostró una diferencia significativa con respecto a T-1 (Figura 9).
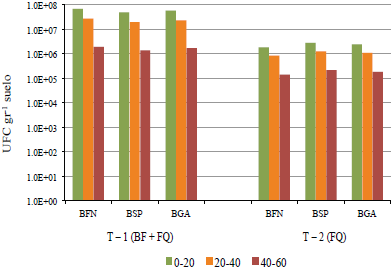
Figura 9 Biomasa microbiana al final del estudio en tres horizontes del suelo (0-20, 20-40 y 40-60 cm). BFN = bacterias fijadoras de nitrógeno; BSP = bacterias solubilizadoras de fósforo; BGA = bacterias generadoras de antibiosis.
Debe tenerse en cuenta que la calidad de los suelos es un concepto holístico que no se puede definir por una sola propiedad, por lo tanto para evaluar el estado y salud de un suelo deberán relacionarse entre sí los parámetros físicos, químicos y biológicos. En T-1 hubo cambios significativos en los indicadores de calidad del suelo que señalan un aumento de fertilidad (Cuadro 14).

HA = humedad aprovechable; Da = densidad aparente; Po = porosidad; MO = materia orgánica; CIC = capacidad de intercambio catiónico; Na+ = sodio intercambiable; K+ = potasio intercambiable; N-NO3 = nitrógeno como nitrato; P = fósforo; Ca = Calcio; Mn = Manganeso.
Cuadro 14 Porcentajes de cambio de los principales indicadores de fertilidad del suelo en T-1 y T-2, al inicio del experimento.
En T-1, la biofertilización combinada con fertilizantes químicos, la adición de 6 Mg ha-1 anuales de lombricomposta por tres ciclos consecutivos (2012-13, 2013-14 y 2014-15) y la aplicación de aserrín de pino como acolchado orgánico en el último ciclo de este estudio (2014-15), aumentó la estabilidad de agregados, el contenido de N total, posiblemente por la descomposición que realizan los microorganismos de aserrín y la materia orgánica contenida en la lombricomposta.
En el primer año no hubo significancia estadística respecto a los rendimientos, pero en el segundo y tercer año los rendimientos del T-1, en el cual se aplicaron 800 L ha-1 de biofertilizante en cada ciclo, fueron significativamente mayores que al inicio del experimento (Cuadro 15).

† Letras iguales son estadísticamente similares a Tukey (P > 0.05).
Cuadro 15 Rendimientos obtenidos durante los ciclos 2012-13, 2013-14 y 2014-15 en T-1 y T-2.
Se presentó diferencia de los rendimientos por hectárea entre T-1 y T-2 así como en los beneficios económicos (Cuadro 16), observándose un incremento en el T-1 del 2.5% (400 kg ha-1) con un beneficio económico de $2880.00 ha-1 para el ciclo 2012-13; para el 2013-14 el aumento en el rendimiento en T-1 fue mayor que en T2, siendo 15% (6100 kg ha-1), reflejando un beneficio de $43 676.00 ha-1. En 2014-15, en T-1 hubo un mayor rendimiento del 19.8% (4200 kg ha-1) y el beneficio fue de $30 282.0 ha-1. Las respuestas en rendimiento concuerdan también con Castellanos (1980), quién mencionó que el estiércol incrementó la producción de sorgo para grano.
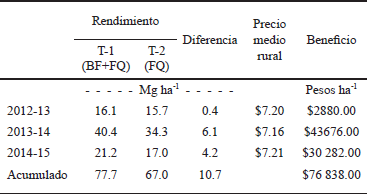
Cuadro 16 Relación de los rendimientos con los beneficios obtenidos durante los ciclos 2012-13, 2013-14 y 2014-15 en T-1 y T-2.
El costo del T-1 (FQ) por ciclo fue de $6728.32 ha-1 y para los tres ciclos (2012-13, 2013-14 y 2014-15) fue de $20 184.96, mientras que para el T-2 (BF + FQ) el costo por ciclo fue de $4956.16 ha‑1 y para los tres ciclos fue de $14 868.48 (Cuadro 17). Esto representa un ahorro del 26.34% ($5316.48 ha-1) del T-1 con respecto al T-2.
Conclusiones
-. La aplicación combinada de biofertilizantes y fertilizantes químicos, aunado a la incorporación de lombricomposta durante tres años consecutivos y la aplicación de aserrín de pino como acolchado, influyeron positivamente sobre el incremento de la materia orgánica (MO) del suelo, la capacidad del suelo de almacenar agua (HA), la disponibilidad, retención y aprovechamiento de los nutrientes del suelo (CIC) debido posiblemente al incremento de la biomasa y actividad microbiana.
-. Existió una alta correlación entre las UFC ml-1 y dosificación del biofertilizante aplicado con el incremento de la CIC (R2 = 0.927) y MO (R2 = 0.846).
-. Debido a la combinación de biofertilizantes, fertilizantes químicos, así como a la incorporación de lombricomposta el nitrógeno disponible en el suelo se incrementó en 46%, el fósforo soluble en 103.21%, el calcio en 49.55% y el manganeso en 31.33% con respecto a la situación inicial del experimento.
-. El uso de biofertilizante tuvo efecto significativo en el descenso del sodio (67.57%) intercambiable, disminuyendo el riesgo de sodicidad.
-. La aplicación de biofertilizantes como la lombricomposta y el aserrín en los suelos agrícolas es la forma más económica de incrementar la MO del suelo. Además puede facilitar la recuperación de los suelos y mejorar su calidad en la región de Cuauhtémoc, Chihuahua, los cuales son muy pobres en MO (menor de 1%) y tienden a una pérdida de nutrientes por erosión eólica.











 nueva página del texto (beta)
nueva página del texto (beta)