Introducción
El cultivo de fresa (Fragaria × ananassa Duch.) ha sido importante para México desde mediados del siglo XX, cuando se inició la demanda del producto en el mercado estadounidense. La superficie sembrada en nuestro país durante el año 2013 fue de 6721 hectáreas, con una producción de 329 463 toneladas, lo que representó más de 3740 millones de pesos, siendo Michoacán, Baja California y Guanajuato, los estados con mayor superficie plantada (SIAP, 2014). La importancia del cultivo de la fresa no se basa solamente en la superficie destinada a su cultivo, también es generador de divisas para el país debido a la exportación de la fruta, principalmente a los EE UU, además de que su cultivo requiere mucha mano de obra, dado que la mayoría de las actividades se realizan de manera manual, adicionando los jornales utilizados durante su procesamiento industrial.
Entre las problemáticas que enfrenta el cultivo de la fresa, se puede señalar la susceptibilidad de las variedades comerciales a las plagas y enfermedades. Para este último caso, la fresa puede ser afectada por un gran número de enfermedades; Maas (1984) describe 104 diferentes, de las cuales 24 corresponden a enfermedades fungosas que afectan las raíces y la corona de las plantas, destacándose entre estas últimas aquellas provocadas por los hongos habitantes del suelo, como: Rhizoctonia spp., Fusarium spp., Phytophthora spp. y Verticillium albo atrum, entre otros, los cuales provocan enfermedades tipo “secadera”. Para su control se han utilizado diversos métodos entre los que sobresalen el uso de fumigantes y fungicidas con los consecuentes riesgos de contaminación del medio ambiente. Otros fitopatógenos de la fresa habitantes del suelo son los nematodos Meloidogyne spp., Pratylenchus spp., Xiphinema spp., Aphelenchoides fragariae, Ditylenchus dipsaci y Belonolaimus spp., además de la bacteria vascular Pseudomonas solanacearum (Maas, 1984).
Los fumigantes agrícolas son productos de amplio espectro de acción usados contra diversos fitopatógenos del suelo. No son selectivos, por lo que es necesario que su aplicación se realice previa al establecimiento del cultivo. El metam sodio y el bromuro de metilo son fumigantes que han mostrado eficacia en el control de diversos patógenos del suelo. Este último fumigante, aunque muy eficiente, ha tenido que ser retirado del mercado debido a que daña la capa de ozono, razón por la cual se han realizado diversas investigaciones para encontrar productos alternativos. Stromberger et al. (2005) evaluaron fumigantes que pudieran sustituir al bromuro de metilo tales como la cloropicrina, el 1,3-dicloropropeno, el iodometano y el bromuro de propargil, encontrando potencial de uso en ellos al tener un efecto de control sobre algunos hongos habitantes del suelo, pero con la desventaja de también ser potencialmente contaminantes del ambiente.
La alternativa que aquí se presenta es el uso de ozono, el cual es un producto inocuo para el suelo, el agua o los productos agrícolas. Tiene además un amplio espectro de acción, por lo que su aplicación puede servir para controlar diversas especies no solo de hongos fitopatógenos, sino también de bacterias y nematodos, además de que puede ser aplicado sobre el cultivo ya establecido, con la ventaja de ser usado en el momento que sea necesario, contrastando con los productos fumigantes de acción más fuerte que, aunque con demostrada acción contra organismos fitopatógenos, pueden tener un efecto tóxico sobre las plantas que posteriormente se establezcan, como lo demostraron Peeden et al. (2011), quienes encontraron que aunque las poblaciones de los hongos fitopatógenos Pythium y Fusarium se redujeron de 3255 y 10 058 a 1175 y 1096 UFC g-1 de suelo seco, respectivamente, la residualidad del bromuro de metilo después de cuatro semanas de su aplicación, ocasionó que el follaje de las plantas de fresa se redujera de 29.8 a 10.4 g de peso seco planta-1.
Por ser un potente agente oxidante, el ozono ha sido utilizado como germicida en la industria alimenticia (Naitou y Takahara, 2008) y en el tratamiento de agua de uso urbano, para el control de un amplio rango de organismos patógenos, incluyendo bacterias, protozoos y virus (EPA, 1999; Galvis et al., 2005). También se ha demostrado su efecto al aplicarlo en forma de gas sobre hongos que afectan productos vegetales en el almacén; Vijayanandraj et al. (2006), encontraron alteraciones en la germinación de esporas y la morfología colonial al aplicar ozono sobre Aspergillus niger, hongo causante de la pudrición negra de la cebolla. Tiedemann (1992), reportó un incremento de la susceptibilidad de plantas de trigo al hongo Septoria nodorum, al exponer su follaje a concentraciones de 80, 160 y 240 µg m-3 de ozono; en contraste la resistencia de las mismas plantas, pero inoculadas con el hongo Bipolaris sorokiniana, se vio incrementada cuando las concentraciones de ozono fueron altas, lo que sugiere un efecto ambivalente del ozono al ser capaz tanto de predisponer a las plantas al ataque de fitopatógenos como a inducirles resistencia a esos mismos microorganismos (Zuccarini, 2009). Además del efecto del ozono sobre hongos fitopatógenos, este gas ha resultado también efectivo contra algunas bacterias, como lo demostraron Mohan et al. (2005), al lograr una reducción de la viabilidad de Xanthomonas oryzae, por lo que sugirieron lavar la semilla de arroz con agua ozonizada y con ello evitar posteriores brotes de la enfermedad en el campo.
Adicional al efecto del ozono sobre diversos microorganismos, se ha demostrado que este gas puede alterar la morfología y fisiología de las plantas. En concentraciones moderadamente elevadas su efecto sobre las plantas puede ser negativo, como lo demostró Volk et al. (2006), al encontrar una disminución de la productividad de gramíneas establecidas en una pradera, lo cual es consecuencia de diversos cambios bioquímicos y moleculares que se dan en las plantas al interaccionar con el ozono como contaminante ambiental (Kangasjärvi et al., 2005; Dizengremel et al., 2009; Wilkinson y Davies, 2009). Contrariamente, otras investigaciones reportaron efectos positivos sobre las plantas, Zuccarini (2009), encontró un efecto elicitor del ozono y la consecuente defensa de las plantas a diferentes tipos de estrés. Varios experimentos han demostrado la capacidad del ozono para estimular la producción y acumulación de fitoalexinas y otras sustancias en diferentes especies de plantas (Keen y Taylor, 1975), por lo que Zuccarini (2009) concluyó que el ozono es un importante elemento que puede ser utilizado en plantas para inducir resistencia a estrés biótico o abiótico, con la particular ventaja del bajo impacto ambiental. No se encontraron trabajos sobre el uso agrícola del ozono aplicado al suelo disuelto en el agua de riego para el control de microorganismos del suelo. La presente investigación tuvo como objetivo evaluar la eficacia del ozono disuelto en agua, aplicado en el sistema de riego por goteo, para reducir las poblaciones de bacterias, hongos y nematodos habitantes del suelo en una plantación de fresa, y en consecuencia verificar su posible efecto positivo sobre el crecimiento de las plantas.
Materiales y métodos
Fue utilizada una parcela con una superficie de 23 000 m2 dentro de un rancho agrícola comercial ubicado en el kilómetro cinco de la carretera Abasolo-Pastor Ortíz, comunidad de Tamazula del municipio de Abasolo, Gto., con coordenadas 20° 24’ 59.03” N y 101° 33’ 59.54” O y una altitud de 1701 m. Para poder aplicar de manera práctica los fumigantes ajustándose a las condiciones del agricultor, la parcela fue dividida en dos subparcelas, recibiendo una de ellas el tratamiento con metam sodio, fumigante de amplio uso entre los productores de fresa de la zona, utilizándose como testigo regional, y la otra subparcela fue tratada con ozono. El metam sodio se aplicó el tres de septiembre del 2010 de acuerdo a las recomendaciones técnicas propias del fabricante. En cada subparcela fueron seleccionados al azar 10 sitios de muestreo en donde se tomaron el mismo número de muestras de suelo y planta por fecha; dichos sitios de muestreo fueron permanentes a lo largo de todo el experimento con la finalidad de evitar la variación poblacional espacial de los microorganismos del suelo. Las primeras muestras fueron solo de suelo y se tomaron un día antes de las aplicaciones de metam sodio y ozono. Debido a que el ozono es de acción inmediata, al día siguiente de su aplicación se tomaron nuevas muestras de suelo, mientras que para el caso del metam sodio, que permanece varias semanas haciendo su efecto, las nuevas muestras se tomaron 25 días después de su aplicación. Posteriormente el muestreo fue mensual y consistió de muestras tanto de suelo, con un total de 12 fechas, de septiembre de 2010 a agosto de 2011, como de planta, con un total de ocho fechas, de diciembre de 2010 a agosto de 2011, ya que fue a partir de diciembre que se determinó que las plantas de fresa tenían suficiente tamaño. Tomando como unidad experimental a cada sitio de muestreo, en total se analizaron en el laboratorio 10 muestras de suelo y 10 de plantas por cada tratamiento, en cada una de las fechas señaladas. Dado que el muestreo fue destructivo, en cada ocasión se tomaron muestras de suelo y planta adyacentes al lugar de la toma de la muestra anterior. Las muestras de suelo se tomaron con la ayuda de una barrena a 30 cm de profundidad, mientras que las plantas fueron extraídas del mismo punto de muestreo donde se tomó el suelo. Ambos tipos de muestras se colocaron en bolsas de polietileno y fueron refrigeradas a 4 °C hasta su procesamiento.
La generación de ozono se hizo utilizando un ozonizador marca SOLZAID® modelo S2750 con una capacidad de generación de 3 g de ozono por hora y su aplicación fue a través del riego por goteo. Al aire capturado por este equipo se le extrajo la humedad al forzarlo a pasar por un tubo de metacrilato con desecante; posteriormente el aire se hizo circular por una celda donde se produjo la descarga eléctrica que provocó la excitación de las moléculas de oxígeno y su consecuente transformación en ozono. El ozono así producido fue inyectado durante cinco horas a una bolsa plástica con capacidad de 20 000 litros llena previamente con agua, procurando iniciar el proceso alrededor de las 4:00 a.m. para lograr una temperatura lo más baja posible. La capacidad oxidante del ozono en el agua para riego fue estimada utilizando un medidor portátil marca HANNA tipo ORP (oxidation and reduction potential), cuidando llegar a una concentración de ozono que alcanzara un poder oxidante entre 400 y 500 mili voltios, momento en que estuvo en condiciones de ser enviada como agua de riego a la subparcela. Esta aplicación se realizó el 28 de septiembre de 2010 después de humedecer el suelo con un riego previo y de la aplicación del ozono en la subparcela correspondiente, en esta misma fecha se realizó la plantación de fresa de la variedad Camino Real (día corto) en ambas subparcelas, bajo un sistema “tres bolillo”, a doble hilera en surcos de 1.2 m de ancho obteniendo una densidad de 100 000 plantas ha-1.
Las poblaciones generales de bacterias, hongos y nematodos habitantes del suelo fueron cuantificadas en las muestras de suelo tomadas. Para la siembra y conteo de las bacterias y hongos se empleó la técnica de diluciones con siembra en placa (Madigan et al., 1997), utilizando agar nutritivo para bacterias y papa dextrosa agar para hongos (DIFCOTM). Cada muestra se sembró por triplicado, incubándose las cajas Petri a temperatura ambiente (24-26 °C) por 24 horas para las bacterias y cuatro días para los hongos, después de lo cual se contaron las unidades formadoras de colonias (UFC) presentes. Por otro lado, la cuantificación de nematodos se hizo siguiendo la técnica combinada de tamizado-centrifugado (Barker et al., 1986), expresando el resultado final como número de nematodos por cada 100 mL de suelo.
El crecimiento de las plantas de fresa fue estimado utilizando las plantas recolectadas mensualmente en el campo. Para ello las plantas fueron cuidadosamente sacadas del suelo con la ayuda de una pala para recuperarlas con todo y raíz y proceder de inmediato a su lavado a chorro de agua corriente hasta que el suelo adherido fue totalmente eliminado, para posteriormente evaluar la masa seca de la raíz y el follaje, después de introducir dichos tejidos a una estufa a 60 °C por 24 horas.
Para cada fecha de muestreo, los datos registrados de las variables dependientes fueron sometidos a la prueba estadística de Kolmogorov-Smirnov para verificar normalidad en cada muestra y a la prueba de Levene para constatar si había homogeneidad de varianzas entre las dos muestras; cuando estos supuestos se cumplieron, se aplicó la prueba T-Student, y cuando no se cumplieron, se utilizó la prueba U de Mann-Whitney (Statgraphics Plus Ver. 5.1 Professional, 2001), todo lo anterior bajo el criterio de comparación de dos muestras aleatorias independientes, donde los tratamientos fueron antes y después de la aplicación para las poblaciones de los microorganismos del suelo (bacterias, hongos y nematodos), y fueron ozono y metam sodio para el caso del crecimiento vegetal (follaje y raíces).
Resultados y discusión
Efecto de los fumigantes sobre las poblaciones microbianas del suelo
Se obtuvieron diferencias estadísticas significativas en las poblaciones de los tres microorganismos, al comparar antes y después de la aplicación de los fumigantes (Cuadro 1). El metam sodio produjo una reducción mayor en las poblaciones de hongos y nematodos, llegando a disminuir hasta 4.8 veces ambos microorganismos, mientras que para el caso de las bacterias la reducción fue de solo 1.3 veces. Se confirma con esto la eficacia del metam sodio como fumigante del suelo tal y como se ha demostrado en el pasado al aplicarlo para el control de bacterias (Kritzman y Ben-Yephet, 1989), hongos (Stephens et al., 1999) y nematodos (Boutsis et al., 2011), trayendo como consecuencia de su uso, incrementos en el rendimiento de fresa hasta de un 18 % (Camprubí et al., 2007). En cambio, en el ozono, el mayor efecto se observó en las bacterias, con una disminución de 3.5 veces su población; en los hongos y nematodos, las reducciones fueron de 2.6 y 1.9 veces, respectivamente.
Cuadro 1 Población microbiana del suelo en dos subparcelas, antes y después de aplicar los fumigantes metam sodio y ozono.
| Variable de respuesta | Tipo de fumigante | Prueba de estadística | Valor de P | Medias | |
|---|---|---|---|---|---|
| Antes | Después | ||||
| Bacterias | Metam sodio | T = 2.83376 | 0.01100** | 14.2 × 106 a | 10.4 × 106 b |
| (UFC g-1 de suelo seco) | Ozono | T = 6.23887 | 0.00005** | 4.30 × 106 a | 1.2 × 106 b |
| Hongos | Metam sodio | U = 0.00000 | 0.00010** | 27.5 × 104 a† | 5.7 × 104 b† |
| (UFC g-1 de suelo seco) | Ozono | T = 6.26960 | 0.00004** | 22.8 × 104 a | 8.5 × 104 b |
| Nematodos | Metam sodio | T = 5.6571 | 0.00000** | 36.3 a | 7.5 b |
| (UFC g-1 de suelo seco) | Ozono | T = 3.60033 | 0.00205** | 20.3 a | 10.4 b |
T = T-Student; U = Mann-Whitney. † Medianas. Medias/Medianas con distinta letra en sentido horizontal indican diferencias significativas.
En la dinámica poblacional de bacterias, hongos y nematodos habitantes del suelo, durante el periodo de septiembre de 2010 a agosto de 2011, ocurrió una disminución inicial importante de las poblaciones de los tres microorganismos (Figuras 1, 2 y 3), mostrando posteriormente una tendencia de estabilidad que se extendió hasta el mes de noviembre para las bacterias y los nematodos, y hasta enero para el caso de los hongos.

Figura 1 Medias del número de bacterias (UFC) por fecha de muestreo en los tratamientos con metam sodio (MS) y ozono (OZ).

Figura 2 Medias del número de hongos (UFC) por fecha de muestreo en los tratamientos con metam sodio (MS) y ozono (OZ).
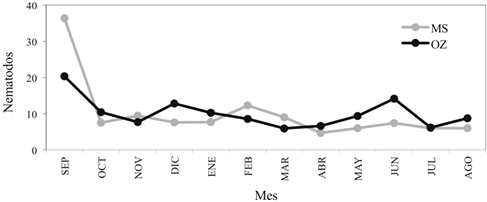
Figura 3 Medias del número de nematodos por fecha de muestreo en los tratamientos con metam sodio (MS) y ozono (OZ).
Algunos trabajos han reportado el efecto del ozono aplicado en forma de gas sobre organismos fitopatógenos, tal es el caso de Igura et al. (2003), quienes utilizando agua ozonizada para disminuir las conidias de Fusarium oxysporum en condiciones sin suelo, encontraron una disminución de cuatro veces la población inicial de conidias en escala logarítmica cuando emplearon 1 ppm de ozono disuelto en agua a temperaturas de 15, 20 y 30 ºC. Asimismo, Nicoué et al. (2004), obtuvieron un efecto positivo y significativo del ozono aplicado como gas sobre la disminución de los hongos Rhizopus stolonifer y Botrytis cinerea, los cuales ocasionan la pudrición de la fruta de fresa; otros estudios in vitro muestran que a concentraciones de ozono de 0.05 y 0.01 ppm después de 36 horas, el conteo de R. stolonifer y B. cinerea disminuyeron en 99 y 98%, respectivamente. Por su parte, Mohan et al. (2005), lograron una reducción en la viabilidad de Xanthomonas oryzae con agua ozonizada, por lo que sugirieron lavar la semilla de arroz con agua ozonizada y con ello evitar posteriores brotes de la enfermedad en el campo. Se ha señalado el efecto benéfico del ozono aplicado en forma de gas (1ppm) sobre la disminución en la esporulación y el crecimiento del micelio de hongos que afectan productos vegetales en el almacén (Vijayanandraj et al., 2006). Otros trabajos como el de Santos et al. (2016), señalaron la reducción en escala logarítmica de 3.8 veces el conteo de levaduras y la completa inhibición de hongos del género Aspergillus y Penicillium en granos de arroz tratados con ozono a una concentración de 5 mg L-1 y un f lujo de 13.97 min. Por otro lado, también se han reportado efectos negativos sobre el follaje de plantas de trigo (Tiedemann, 1992), con tratamientos prolongados y altas concentraciones, causando lesiones en las hojas y permitiendo un rápido crecimiento después de la inoculación con Septoria nodorum y Bipolaris sorokiniana.
En la presente investigación el ozono se disolvió y concentró en el agua, lo que proporcionó la ventaja de ser aplicado en el suelo en donde nuevamente se liberó como gas, interactuando con las poblaciones de microorganismos y contribuyendo a la disminución, tanto de hongos como de bacterias, tal como se ha reportado para este tipo de organismos en la literatura, pero afectó además a los nematodos, para lo cual no se encontraron reportes del uso del ozono para su control. En general, no se encontró información en la literatura sobre un trabajo similar en donde se haya utilizado ozono disuelto en agua de riego para el tratamiento del suelo, con el objetivo de disminuir las poblaciones de microorganismos en el mismo y posteriormente ver el efecto indirecto en el crecimiento vegetal. La fácil volatilidad del ozono, una vez liberado del agua, ayuda a su distribución en el suelo favoreciendo su acción biocida; otros compuestos han demostrado su efectividad deletérea contra microorganismos gracias a su volatilidad; así Chambers et al. (2013), demostraron una reducción del crecimiento de Botrytis cinerea, Colletotrichum gloeosporioides, Colletotrichum acutatum, Phomopsis obscurans y Gnomonia fragariae al aplicar compuestos volátiles aplicados en frutos de fresa.
Después de las rápidas disminuciones iniciales de las poblaciones de bacterias, hongos y nematodos mencionadas anteriormente, las dinámicas poblacionales de los tres microorganismos se mantuvieron bajas y relativamente estables, no aumentando significativamente a lo largo de los meses en los que se realizó la evaluación, terminando en agosto de 2011 con aproximadamente el mismo comportamiento inicial después de la aplicación de los fumigantes (Figuras 1, 2 y 3). Además, se pudo observar que para este mismo periodo, los valores de las poblaciones de los tres microorganismos encontradas en la parcela con ozono fueron similares a los valores registrados en el testigo regional donde se aplicó el metam sodio. Cabe mencionar que después de la aplicación inicial de ambos fumigantes en septiembre de 2010, estos no se volvieron a aplicar, razón que explica en parte la posterior tendencia a la estabilidad de las poblaciones microbianas. El efecto deletéreo del metam sodio no perdura con el paso del tiempo, ya que este tipo de productos son biodegradados por microorganismos del suelo (Warton et al., 2001) o se pierden por lixiviación o volatilidad en el ambiente, en particular el ozono utilizado como compuesto fumigante disuelto en el agua de riego permanece tan solo por 30 minutos, aproximadamente.
Efecto sobre el crecimiento vegetal
El crecimiento de las plantas de fresa fue evaluado cuantificando la masa seca del follaje o parte aérea y las raíces (Figuras 4 y 5). Se compararon mensualmente las medianas de los pesos de follaje y raíces para los tratamientos de ozono y metam sodio, mediante la aplicación de la prueba U de Mann-Whitney. De diciembre de 2010 a agosto de 2011, en ningún caso se encontraron diferencias estadísticas significativas entre medianas, solo en el mes de junio se obtuvieron las mayores diferencias numéricas (Figuras 4 y 5), se observó que para el peso del follaje, el tratamiento de metam sodio registró una mediana de 29.8 g en contraste con 15.85 g del tratamiento de ozono (U = 19.0, P = 0.0685), similarmente para el peso de raíces, el metam sodio obtuvo una mediana de 8.35 g comparada con 4.30 g obtenidos con el ozono (U = 19.0 y P = 0.0675). El follaje de las plantas aumentó con el paso de los meses, sobre todo a partir del mes de abril, debido al ascenso en la temperatura del ambiente. Una tendencia similar ocurrió en el crecimiento de las raíces, por estar ambos tejidos relacionados, es decir, que para lograr un crecimiento en el follaje, se requiere que también las raíces lo hagan. Este comportamiento siguió un patrón sigmoide, parecido a lo que se ha demostrado en otros estudios con el crecimiento de hojas, coronas, raíces, f lores y frutos a lo largo del ciclo vegetativo de la fresa (Menzel y Smith, 2014). El mayor crecimiento del follaje logrado en la variedad Camino Real fue de 29.8 g de peso seco por planta para el testigo regional y de 25.0 g para el tratamiento con ozono, obtenidos en los meses de junio y julio, respectivamente; lo cual resultó ligeramente menor a lo obtenido por Strassburger et al. (2011) quienes en la misma variedad reportaron 32.1 g de peso seco.

Figura 4 Medianas del peso seco de follaje por fecha de muestreo en los tratamientos con metam sodio (MS) y ozono (OZ).

Figura 5 Medianas del peso seco de raíces por fecha de muestreo en los tratamientos con metam sodio (MS) y ozono (OZ).
La única aplicación de ozono en la subparcela correspondiente disminuyó inicialmente y de manera significativa las poblaciones de bacterias, hongos y nematodos habitantes del suelo, sin embargo, de acuedo con la información presentada esto no inf luyó sobre el crecimiento de las raíces y el follaje de las plantas de fresa; de hecho, a partir del mes de marzo ambos crecimientos se mantuvieron por debajo del mostrado en las plantas desarrolladas en la parcela tratada con metan sodio (testigo regional). El efecto estimulante del ozono sobre las plantas de fresa podría haberse presentado solo en el caso de haber realizado un mayor número de aplicaciones del mismo distribuidas a lo largo del tiempo, tomando en consideración que la descomposición del ozono da como resultado oxígeno, que puede ser utilizado por las raíces de las plantas para su respiración y por ende en la absorción de nutrimentos, pero es necesario tener cuidado de no llegar a niveles de concentración de ozono que resulten tóxicos a las plantas, como en el estudio realizado por Keutgen et al. (2005), quienes encontraron una disminución del área foliar de las plantas de fresa al exponerlas por dos meses a un ambiente de 78 ppb de ozono, los mismos autores, en un trabajo posterior, modificaron la concentración de ozono a 156 µg m-3 no encontrando efecto negativo en el rendimiento del fruto, reportando además que hay variedades de fresa mas susceptibles que otras (Keutgen y Pawelzik, 2008). Finalmente, el uso del ozono dirigido al suelo mediante su aplicación con el agua de riego, sigue dos propósitos, el primero busca reducir las poblaciones microbianas fitopatógenas habitantes del suelo, y a consecuencia de esto, el segundo pretende conseguir un estímulo en el crecimiento de las plantas, por lo que se sugiere continuar estudiando el fenómeno, hasta lograr una dosis óptima y un número adecuado de aplicaciones que permitan conseguir resultados satisfactorios.
Conclusiones
Se mostró un efecto deletéreo sobre hongos, bacterias y nematodos, con la aplicación única de ozono en el agua de riego al inicio del cultivo de fresa, disminuyendo significativamente las poblaciones iniciales de estos organismos en el suelo, y a consecuencia de esta disminución, no se presentó un estímulo positivo sobre el crecimiento del follaje y las raíces de las plantas de fresa de la variedad Camino Real, por lo que se sugiere realizar futuras investigaciones bajo un programa de aplicaciones continuas.
El metam sodio demostró ser un fumigante efectivo contra los tres tipos de microorganismos evaluados, habiendo reducido las poblaciones de nematodos y hongos en una mayor proporción que el ozono.











 nueva página del texto (beta)
nueva página del texto (beta)


