Introducción
El cloro (Cl) es un micronutrimento para las plantas superiores y sus funciones en el metabolismo vegetal son diversas: regulador estomático, osmótico, enzimático y del pH celular, productor de oxígeno en la fotosíntesis, estabilizador del potencial de membrana, participante en la turgencia celular, y en la resistencia o tolerancia a enfermedades (Xu et al., 2000; White y Broadley, 2001; Wenrong et al., 2010). El efecto del Cl en los cultivos está bien documentado, pero en un gran número de casos su efecto se asocia al sodio (Na), cuyo exceso sería el principal responsable de la reducción del crecimiento, con poca atención al Cl (Tavakkoli et al., 2011). El cloruro (Cl-) es el principal anión en la mayoría de los suelos salinos (Wenrong et al., 2010) y una alta concentración de Cl- en el suelo puede provocar relaciones extremas entre iones afectando el rendimiento de los cultivos (Fageria, 2001). El Na y Cl son igualmente importantes, ya que ambos pueden ser tóxicos para las plantas si se acumulan en altas concentraciones en el citoplasma (Teakle y Tyerman, 2010; Tavakkoli et al., 2011).
El Na es un elemento considerado benéfico, porque estimula el crecimiento de algunas especies de plantas, por ejemplo la espinaca (Amaranthus sp.) y la remolacha azucarera (Beta vulgaris L.) (Marschner, 1995), pero para la mayoría de especies vegetales, altas concentraciones de Na afectan su crecimiento al generar deficiencias de K, Ca y Mg (Parida y Das, 2005) o toxicidad por Na (Tester y Davenport, 2003).
Altas concentraciones de Na+ y Cl- en el medio afectan la absorción de N, P, K, Ca, S y Zn mediante interacciones de antagonismo y afectan la capacidad selectiva de las membranas (Shiyab et al., 2013; Hussain et al., 2015).
Sinaloa es el principal productor de tomate a nivel nacional; sin embargo, por problemas de sanidad en suelos provocados por nemátodos fitoparásitos y especies de Fusarium oxysporum, los horticultores sinaloenses están sembrando el tomate en suelos cercanos a la costa, donde el agua de riego es de menor calidad, contiene concentraciones de Cl y Na con restricción de uso por toxicidad (4-10 meq Cl L-1 y 3-10 meq Na L-1) (Hanson et al., 2006). Altas relaciones de adsorción de Na en el agua de riego deterioran las propiedades del suelo, afectan el rendimiento de los cultivos (Ghafoor et al., 2004) y disminuyen la disponibilidad de Ca en los suelos y su absorción por las plantas (Imran et al., 2010; Naeem et al., 2013). Los iones Cl y Na pueden interactuar con los nutrimentos de la solución nutritiva (SN) reduciendo su disponibilidad y provocando desbalances nutrimentales, deficiencias y toxicidad en las plantas (Tester y Davenport, 2003).
Los productores del valle de Culiacán usan SN de baja salinidad (CE < 2.5 dS m-1) para la fertirrigación del tomate; estas SN están compuestas de seis macronutrimentos (K+, Ca2+, Mg2+, NO3-, H2PO4- y SO42‑) y cinco micronutrimentos (Fe, Cu, Zn, Mn, y Mo). Aunque el Cl es un micronutrimento esencial para las plantas no se aplica en las SN, porque los aportes de Cl de la atmósfera varían anualmente de 17.6 a 36 kg ha‑1 (Reynolds et al., 1997), aunque las cantidades de Cl depositadas en los suelos mediante el riego y la fertilización pueden ser mayores a 1000 kg ha-1 (White y Broadley, 2001), lo cual excede la demanda de las plantas, por lo que la toxicidad por Cl es un peligro latente. Poco se conoce del uso de SN de baja salinidad que contengan concentraciones de Cl y Na con peligro de provocar toxicidad a las plantas de tomate. Por lo tanto, el objetivo de la presente investigación fue evaluar los efectos principales y la interacción de tres relaciones de Cl-/aniones (NO3-, H2PO4- SO42, Cl-) [25/100, 50/100 y 75/100 ] y tres relaciones de Na+/cationes (Ca2+, K+, Mg2+, Na+) [25/100, 50/100 y 75/100] en soluciones nutritivas, sobre la composición mineral (Na, K, Ca y Mg) de hojas y tallos en dos híbridos de tomate.
Materiales y métodos
Desde el 14 de octubre al 9 diciembre de 2011 se realizaron dos experimentos en un invernadero del Centro de Investigación en Alimentación y Desarrollo (CIAD), Coordinación Culiacán (24° 44’ 01.3’’ N, 107° 27’ 16.4’’ O; altitud de 26 m); la temperatura máxima promedio del aire fue 40.3 °C y la mínima 18 °C. Las semillas de tomate de crecimiento indeterminado cv. “Polaris”, tipo roma, y cv. “ISIS”, tipo bola, se sembraron en charolas de poliestireno de 200 cavidades con volumen individual de 30 cm3; como sustrato se utilizó una mezcla de turba y vermiculita (1:1 v/v). El diseño para ambos experimentos fue completamente al azar con arreglo factorial de tratamientos 32, y cuatro repeticiones, para un total de 36 unidades experimentales por experimento, donde cada unidad experimental consistió de 30 plántulas. Los factores y niveles evaluados fueron: 1) tres relaciones (25/100, 50/100 y 75/100) porcentuales Cl-/ aniones (NO3-, H2PO4-, SO42-, Cl-), y 2) tres relaciones (25/100, 50/100 y 75/100) porcentuales Na+/cationes (K+, Ca2+, Mg2+, Na+) (Cuadro 1). Al combinar las tres relaciones porcentuales Cl-/aniones con las tres relaciones porcentuales Na+/cationes resultaron nueve SN, las cuales se diseñaron a partir de modificaciones de la solución universal de Steiner (1984), ya que esta solución no incluye Cl- ni Na+ en su composición, y consistieron en incrementar la concentración de Cl- con relación a NO3-, H2PO4-, SO42-, así como la concentración de Na+ con relación a K+, Ca2+, Mg2+. En el Cuadro 2 se presenta la composición química de las SN, una vez que fueron calculadas y ajustadas a un potencial osmótico de -0.072 MPa, de acuerdo a los lineamientos propuestos por Steiner (1984). Las SN se prepararon con sales inorgánicas grado reactivo y agua destilada y se les añadieron las concentraciones de micronutrimentos (mg L-1) siguientes: Fe 2.5, Mn 0.5, B 0.5, Cu 0.02 y Zn 0.05. El Fe se proporcionó como Fe-EDTA y el pH de las SN se ajustó a 5.5±0.1 con HCl 1N o NaOH 1N. Diez días después de la siembra se inició la aplicación de las SN, cuyas concentraciones se incrementaron cada 10 d en el orden: 50, 75 y 100%. Las plántulas se regaron diariamente a las 08:00 y 14:00 h asperjando al follaje los tratamientos con atomizadores (1 L de capacidad) hasta el escurrimiento de la solución por los orificios inferiores de las cavidades. Cuarenta días después de la siembra se evaluó el efecto de los factores sobre la composición mineral y se seleccionaron 20 plántulas por tratamiento de cada cultivar y se integraron en cuatro repeticiones compuestas, cada una, con cinco plántulas, las que se fraccionaron en hojas y tallos. En estos órganos se realizó el análisis químico para determinar las concentraciones de Na, K, Ca y Mg conforme a las metodologías reportadas por Motsara y Roy (2008). Na y K fueron determinados con un fotómetro de f lama y Ca y Mg con espectrómetro de absorción atómica. El análisis de varianza de las variables consideradas se realizó para los factores principales y para su interacción, con el paquete estadístico SAS versión 8 (SAS, 1999).
Cuadro 1 Relaciones porcentuales entre los iones de las soluciones nutritivas utilizadas.
†Sumatoria de aniones; ‡ Sumatoria de cationes.
Cuadro 2 Composición química de las soluciones nutritivas usadas en el experimento.
‡CE = conductividad eléctrica en dS m-1.
Resultados y discusión
Concentración de Nutrimentos en Hojas y Tallos de Tomate “cv. Polaris”
No se encontró efecto significativo de la interacción Cl-/aniones × Na+/cationes para los nutrimentos Na, K, Ca y Mg, por lo cual el análisis de los resultados fue para los efectos de los factores principales. Así, hubo diferencias (P ≤ 0.05) en las concentraciones de Na, K, Ca y Mg en hojas debido a los niveles de la relación Cl-/aniones, donde al utilizar las relaciones 25/100 y 50/100 Cl-/aniones se obtuvieron valores más altos de las concentraciones de cationes, respecto a las hojas donde se utilizó las relaciones 75/100 Cl-/aniones (Cuadro 3). Hubo una relación inversa entre la relación Cl-/aniones y las concentraciones de Na, K, Ca y Mg en hojas, ya que al incrementar de 25/100 a 75/100 la relación Cl-/aniones en la SN, las concentraciones de los nutrimentos disminuyeron 36.5, 16.7, 25 y 26.3%, respectivamente. La reducción de Na, K, Ca, y Mg es difícil de explicar, por la carencia de trabajos realizados en condición de baja salinidad y alta proporción de Cl- en la SN; en la relación75/100 Cl-/aniones hubo una mayor absorción de Cl en hojas (3.84%), la cual es alta, considerando un rango óptimo de 0.2 a 0.4 g Cl kg-1 de materia seca (Marschner, 1995), equivalentes a 0.02 a 0.04% de Cl, aunque las plantas usualmente contienen de 2 a 20 g Cl kg-1 de materia seca (0.2 a 2% de Cl) (Wenrong et al., 2010). La mayor absorción de Cl, pudo provocar un desbalance nutrimental que se ref lejó en una menor absorción de Na, K, Ca y Mg, porque una alta concentración de Cl en la solución puede reducir la actividad química de los iones y provocar relaciones desbalanceadas Na+/Ca2+, Cl-/NO3-, Na+/K+, Ca2+/Mg2+ (Fageria, 2001), y hacer susceptible a la planta al daño por iones específicos (Cl- y Na+) y desbalances nutrimentales. Komosa y Gorniak (2015) encontraron una relación positiva entre la concentración de Cl en la SN y la concentración de Cl en hojas de tomate, similar a lo encontrado en el presente trabajo. De igual manera, en ambos trabajos las concentraciones de K y Ca fueron reducidas. Genc et al. (2010) reportaron que concentraciones mayores de 10 molc m-3 de Cl redujeron la concentración de Mg en genotipos de trigo (Triticum aestivum L.), resultado similar fue obtenido en esta investigación con la relación 75/100 Cl-/aniones, equivalente a 12.28 molc m-3 de Cl (Cuadro 2), y difiere de lo reportado por Komosa y Gorniak (2015), quienes mencionan que las concentraciones de Mg en hojas de tomate no fueron afectadas por el Cl en la SN.
Cuadro 3 Concentración de Na, K, Ca y Mg en hojas de plántulas de tomate cv. Polaris por efecto de las relaciones de Cl-/aniones y Na+/cationes en la solución nutritiva.
| Factor | Na | K | Ca | Mg |
|---|---|---|---|---|
| - - - - - - - - - - - - - - - - - - - - - - % - - - - - - - - - - - - - - - - - - - - - - - | ||||
| Relación porcentual de Cl-/aniones | ||||
| 25/100 | 1.04 a† | 1.62 a | 4.24 a | 1.14 a |
| 50/100 | 0.88 ab | 1.59 a | 4.05a | 1.08 a |
| 75/100 | 0.66 b | 1.35 b | 3.18 b | 0.84 b |
| Relación porcentual de Na+/cationes | ||||
| 25/100 | 0.46 c | 2.04 a | 4.53 a | 1.12 a |
| 50/100 | 0.85 b | 1.50 b | 3.74 b | 0.95 b |
| 75/100 | 1.27 a | 1.02 c | 3.20 b | b |
†Letras distintas en la misma columna indican diferencias significativas, según la prueba de Tukey (P ≤ 0.05).
El factor Na+/cationes provocó diferencias (P ≤ 0.05) en las concentraciones de Na, K, Ca y Mg en hojas (Cuadro 3), y de Na, K y Ca en tallos (Cuadro 4). Hubo una relación directa entre la relación Na+/cationes y la concentración de Na en hojas y tallos, ya que al aumentar la relación Na+/cationes en la SN las concentraciones de Na aumentaron (P ≤ 0.05). Con 75/100 Na+/cationes en la SN la concentración de Na se incrementó 176.1% en hojas y 155.3 % en tallos, comparado con 25/100 Na+/cationes (Cuadros 3 y 4), atribuible a la alta proporción de Na (75%) en la SN, respecto a los cationes K+ (8.75%), Ca2+ (11.25%) y Mg2+ (5%) (Cuadro 1), lo que favoreció la absorción de Na. Este resultado es parecido a lo reportado por Komosa y Gorniak (2015), quienes mencionan que aumentos de Na en el medio de crecimiento aumentaron la absorción y translocación de Na en el cultivo de tomate. La relación 75/100 Na+/cationes provocó una reducción significativa (P ≤ 0.05) de K en hojas y tallos (50.9 y 52.1%, respectivamente) comparado con 25/100 Na+/cationes, probablemente por antagonismo o competencia provocado por la mayor concentración de Na en la SN, que disminuyó la conductividad hidráulica o la permeabilidad de los tejidos al agua, desplazando al K+ de los sitios de intercambio (Halperin y Lynch, 2003) reduciendo la absorción de K+ (Parida y Das, 2005; Naeini et al., 2006; Lu et al., 2009) y su acumulación en las hojas (Komosa y Gorniak, 2015), y por la menor concentración de K (8.75%) en la SN 75/100 Na+/cationes, respecto a la SN 25/100 Na+/ cationes, la cual tuvo 26.25 %K (Cuadro 1).
Cuadro 4 Concentración de Na, K, Ca y Mg en tallos de plántulas de tomate cv. Polaris por efecto de las relaciones de Cl-/aniones y Na+/cationes en la solución nutritiva.
| Factor | Na | K | Ca | Mg |
|---|---|---|---|---|
| - - - - - - - - - - - - - - - - - - - - - - - % - - - - - - - - - - - - - - - - - - - - - - - | ||||
| Relación porcentual de Cl-/aniones | ||||
| 25/100 | 0.97 a† | 2.43 a | 1.43 a | 0.68 a |
| 50/100 | 0.99 a | 2.34 a | 1.41 a | 0.77 a |
| 75/100 | 0.75 a | 2.74 a | 1.55 a | 0.71 a |
| Relación porcentual de Na+/cationes | ||||
| 25/100 | 0.47 b | 3.26 a | 1.49 ab | 0.67 a |
| 50/100 | 1.00 a | 2.69 b | 1.63 a | 0.82 a |
| 75/100 | 1.20 a | 1.56 c | 1.27 b | 0.68 a |
†Letras distintas en la misma columna indican diferencias significativas, según la prueba de Tukey (P ≤ 0.05).
El antagonismo entre Na y K resulta por la semejanza de sus radios iónicos y energías de hidratación (Schachtman y Liu, 1999; Biggin et al., 2001), por lo que Na compite con K por los sitios de unión eléctrica a nivel celular, afectando la entrada de K al interior de la célula al usar sus sistemas de transporte (Tale et al., 2013). Además, el Na facilita la salida de K hacia el exterior de las células, debido a que altera la integridad de las membranas celulares al desplazar al Ca (Marschner, 1995; Vaghela et al., 2010). En condición salina el Na provoca inactivación de enzimas y de funciones celulares esenciales, consecuentemente los cultivos en suelos salinos pueden presentar una alta concentración de Na y baja concentración de K (Munns y Tester, 2008). El antagonismo Na-K observado en condición salina (CE > 4 dS m-1), coincide con lo encontrado en el presente estudio, realizado en situación de baja salinidad (CE < 2.1 dS m-1), pero con alta proporción de Na en la SN. La relación 75/100 Na+/cationes redujo 29.4% la concentración de Ca en hojas y 14.8% en tallos (Cuadros 3 y 4), explicable por el antagonismo del Na con el Ca (Vaghela et al., 2010), debido al mayor porcentaje de Na (75%) y menor de Ca (11.25%) en la solución 75/100 Na+/cationes, comparado con 25/100 Na+/cationes, cuyos porcentajes de Na y Ca fueron 25% y 33.75% cada uno (Cuadro 1), y coincide con Epstein (1972), quien menciona que el exceso de un catión puede reducir la absorción de otros cationes por las plantas, por lo que una baja relación de Ca/cationes es desfavorable para la absorción de Ca (Läuchli, 1990) y es favorable para la acumulación de iones tóxicos y para la salida de solutos al alterar la estabilidad y permeabilidad de la membrana plasmática. En condiciones salinas, Husain et al. (2004) y Vaghela et al. (2010) encontraron que altas concentraciones de Na en la solución del suelo redujeron la concentración de Ca en trigo (Triticum aestivum L.), y en el arbusto (Salvadora persica L.), respectivamente. En el presente trabajo el antagonismo Na-Ca se presentó en SN con baja salinidad (CE < 2.1 dS m-1), no obstante dicha competencia comúnmente se ha reportado en situación salina (CE > 4 dS m-1), donde la absorción de Na por las plantas se incrementa, mientras que Ca disminuye, debido a la interacción entre iones, precipitación y aumentos en la fuerza iónica, que reducen la actividad del Ca (Alam, 1999). En contraste, al aumentar la concentración de Ca en el medio se incrementa su absorción, mientras que la de Na disminuye (Lazof y Bernstein, 1999; Vaghela et al., 2010).
Concentración de Nutrimentos en Hojas y Tallos de Tomate “cv. ISIS”
Hubo efecto significativo (P ≤ 0.05) de la interacción Cl-/aniones × Na+/cationes en la SN para las concentraciones de Na y K en hojas (Figuras 1 y 2). Cuando la interacción fue significativa, no se discutieron los efectos principales de los factores, ya que el análisis de la interacción es de mayor utilidad que los efectos principales (Montgomery, 2002). En hojas las concentraciones de Na obtenidas con las tres relaciones Na+/cationes presentaron diferencias significativas entre las relaciones 25 y 50/100 Cl-/aniones y similar con 75/100 Cl-/aniones (Figura 1).

Figura 1 Efecto de la interacción Cl-/aniones × Na+/cationes en la solución nutritiva sobre la concentración de Na en hojas de tomate cv. ISIS. Puntos con letras iguales en cada columna y en cada línea no son estadísticamente diferentes (Tukey, P ≤ 0.05).
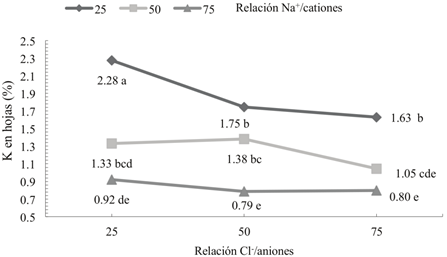
Figura 2 Efecto de la interacción Cl-/aniones × Na+/cationes en la solución nutritiva sobre la concentración de K en hojas de tomate cv. ISIS. Puntos con letras iguales en cada columna y en cada línea no son estadísticamente diferentes (Tukey, P ≤ 0.05).
En las relaciones 25 y 50/100 Cl-/aniones las concentraciones mayores de Na (1.60 y 1.01%) en hoja se obtuvieron cuando se aplicó la relación 75/100 Na+/ cationes y las menores concentraciones (0.41 y 0.35 %Na) con 25/100 Na+/cationes. Los resultados de Shiyab et al. (2013) en tomate (Lycopersicon esculentum L.); Wang et al. (2015) en pasto (Leymus chinensis L.), y Maqsood et al. (2015) en maíz (Zea mays L.) parcialmente explican este resultado debido a que ellos también encontraron mayor concentración de Na en los órganos vegetales con los aumentos de Na en la SN, pero no evaluaron la interacción con Cl-. En la relación 75/100 Cl-/aniones, aunque no hubo diferencias en las concentraciones de Na obtenidas con las tres relaciones Na+/cationes, se lograron los menores porcentajes de Na en las hojas, comparado con 25 y 50/100 Cl-/aniones. Munns et al. (2006) mencionan que glicofitas, como el trigo (Triticum aestivum L.) disminuyen el transporte de Na a las hojas, especialmente a los cloroplastos (Sudhir y Murthy, 2004) y acumulan el Na en raíces y tejidos vasculares, mientras que especies como la cebada (Hordeum vulgare L.) excluyen al Na de sus tejidos foliares, lo que permite mayor tolerancia al Na (Khan et al., 2001), por lo tanto las reducciones en las concentraciones de Na obtenidas en el presente trabajo pueden ser una respuesta de las plantas para evitar daños por toxicidad. Las concentraciones de K obtenidas con las relaciones Na+/cationes presentaron diferencias significativas en las tres relaciones Cl-/aniones (Figura 2). En estas relaciones, los mayores valores de K (2.28, 1.75 y 1.63%) se obtuvieron con 25/100 Na+/ cationes y los menores (0.92, 0.79 y 0.80%) con 75/100 Na+/cationes. Las reducciones en los porcentajes de K en las hojas por la relación 75/100 Na+/cationes en la SN se atribuyen principalmente al antagonismo Na-K debido a la alta proporción de Na (75%), respecto al catión K+, lo que genera mayor disponibilidad de Na y menor de K en la SN (Cuadro 1). Este resultado ref leja un doble desbalance nutrimental en las hojas por alta absorción de Na y baja absorción de K, lo que coincide con los desbalances que se presentan en plantas que crecen en suelos salinos (Munns y Tester, 2008; Wang et al., 2015). El antagonismo Na-K, se discutió anteriormente en hojas y tallos de tomate “cv. Polaris”. Hubo diferencias significativas (P ≤ 0.05) del factor Cl-/aniones para las concentraciones de Ca y Mg en hojas (Cuadro 5) y Ca, Mg y Na en tallos (Cuadro 6). Las menores concentraciones de Ca y Mg en hojas y tallos fueron obtenidas con la relación 75/100 Cl-/aniones, mientras que las mayores se obtuvieron con 25/100 Cl-/aniones. Ocurrió una relación inversa entre la relación Cl-/aniones y las concentraciones de Ca y Mg en hojas y tallos, ya que al incrementar la relación Cl-/aniones en la SN las concentraciones de estos nutrimentos disminuyeron. Este resultado coincide con el obtenido en hojas del cultivar Polaris, por lo que en ambos cultivares la relación 75/100 Cl-/aniones redujo las concentraciones de Ca y Mg. La concentración de Na en tallos fue significativamente menor para la relación 75/100 Cl-/aniones respecto a 25/100 Cl-/aniones (Cuadro 6), posiblemente a desbalances nutrimentales en las plántulas, provocado por la mayor concentración de Cl en tallos (3.8%) en la relación 75/100 Cl-/aniones, comparado con 3% de Cl en la relación 25/100 Cl-/aniones.
Cuadro 5 Concentración de Ca y Mg en hojas de plántulas de tomate cv. ISIS por efecto de las relaciones de Cl-/aniones y Na+/cationes en la solución nutritiva.
| Factor | Ca | Mg |
|---|---|---|
| - - - - - - - - - - - - - - - - - - - - % - - - - - - - - - - - - - - - - - - - - - | ||
| Relación porcentual de Cl-/aniones | ||
| 25/100 | 3.11 a† | 0.96 a |
| 50/100 | 2.95 a | 0.87 a |
| 75/100 | 2.48 b | 0.70 b |
| Relación porcentual de Na+/cationes | ||
| 25/100 | 3.30 a | 0.99 a |
| 50/100 | 2.63 b | 0.79 b |
| 75/100 | 2.61 b | 0.75 b |
†Letras distintas en la misma columna indican diferencias significativas, según la prueba de Tukey (P ≤ 0.05).
Cuadro 6 Concentración de Na, K, Ca y Mg en tallos de plántulas de tomate cv. ISIS por efecto de las relaciones de Cl-/aniones y Na+/cationes en la solución nutritiva.
| Factor | Na | K | Ca | Mg |
|---|---|---|---|---|
| - - - - - - - - - - - - - - - - - - - - - - - - - - - % - - - - - - - - - - - - - - - - - - - - - - - - - - - | ||||
| Relación porcentual de Cl-/aniones | ||||
| 25/100 | 0.98 a† | 2.55 a | 1.59 a | 0.75 a |
| 50/100 | 0.90 ab | 2.35 a | 1.55 a | 0.63 ab |
| 75/100 | 0.78 b | 2.16 a | 1.38 b | 0.60 b |
| Relación porcentual de Na+/cationes | ||||
| 25/100 | 0.36 b | 2.89 a | 1.43 b | 0.57 b |
| 50/100 | 1.08 a | 2.71 a | 1.74 a | 0.79 a |
| 75/100 | 1.21 a | 1.43 b | 1.36 b | 0.62 b |
†Letras distintas en la misma columna indican diferencias significativas, según la prueba de Tukey (P ≤ 0.05).
Hubo diferencias (P ≤ 0.05) entre tratamientos ante el uso de la relación Na+/cationes para las concentraciones de Ca y Mg en hojas (Cuadro 5), y Ca, Mg, Na y K en tallos (Cuadro 6), donde las menores concentraciones de Ca y Mg en ambos órganos se obtuvieron con la relación 75/100 Na+/cationes, mientras que las mayores fueron obtenidas con 25/100 Na+/cationes. Este resultado indica una relación inversa entre la relación Na+/cationes y las concentraciones de Ca y Mg, ya que al incrementar la relación Na+/cationes las concentraciones de estos nutrimentos disminuyeron, lo que puede atribuirse al antagonismo Na-Ca (Wakeed et al., 2009) y Na-Mg provocado por la mayor concentración de Na (Cuadro 1), respecto a los cationes Ca y Mg en la SN lo que favoreció la absorción de Na y limitó la de Ca y Mg. Hubo una relación directa entre la relación Na+/cationes y la concentración de Na en tallos, en contraste, la relación fue inversa respecto al K, ya que las concentraciones de este nutrimento en tallos disminuyeron con los aumentos de la relación Na+/cationes (Cuadro 6) debido al antagonismo Na-K (Lu et al., 2009).
Conclusiones
La respuesta de los cultivares de tomate “Polaris e ISIS” a las relaciones Cl-/aniones y Na+/cationes en la solución nutritiva fueron diferentes. Hubo una relación inversa entre los tratamientos de la relación Cl-/aniones y las concentraciones de Na, K, Ca y Mg en hojas de tomate cultivar Polaris y las concentraciones de Na, K, Ca y Mg en tallos de cultivar ISIS. Hubo una relación directa entre los tratamientos de la relación Na+/cationes y las concentraciones de Na en hojas y tallos de cultivar Polaris; en contraste, para las concentraciones de K, Ca y Mg en hojas, K y Ca en tallos de Polaris y para Ca y Mg en hojas y tallos de cultivar ISIS, la relación fue inversa. Los resultados indican que soluciones nutritivas de baja salinidad (CE < 2.5 dS m-1), con alta proporción de Cl- y Na+ provocaron desbalances nutrimentales debido al antagonismos Cl-K+, Cl-Ca2+, Cl-Mg2+, Na+-K+, Na+-Ca2+ y Na+-Mg2+ que alteraron las concentraciones de los cationes K+, Ca2+, Mg2+ y Na+ en hojas y tallos de plántulas de tomate.











 nueva página del texto (beta)
nueva página del texto (beta)


