Introducción
El estudio del ciclo global del carbono (C) es prioritario para entender las consecuencias del incremento acelerado de la concentración de CO2 en la atmósfera, así como para diseñar estrategias a fin de reducir sus emisiones, y de esta manera mitigar el cambio climático global (Prentice et al., 2001; Sitch et al., 2008). Los esfuerzos se han dirigido a estimar el contenido de C en los principales reservorios de los ecosistemas y los factores que determinan su almacenamiento y dinámica (Quéré et al., 2014). En los ecosistemas terrestres el almacén más importante de C es el suelo, pues contiene hasta tres veces más C que la vegetación o la atmósfera (Schlesinger y Bernhardt, 2013). La cantidad de C almacenado en el suelo depende del clima, composición de la vegetación, actividad microbiana y régimen de disturbio (Jobbagy y Jackson, 2000; Sitch et al., 2008). Asimismo, el C es la principal fuente de energía para la actividad de las comunidades microbianas del suelo, puesto que regula los procesos de transformación de los nutrimentos y la fertilidad del mismo (Perroni et al., 2010; Montaño y Sánchez-Yáñez, 2014).
Los ecosistemas áridos y semiáridos cubren un tercio de la superficie continental (Pointing y Belnap, 2012) y contienen 36% del C almacenado en los ecosistemas terrestres (Campbell et al., 2008). En México estos ecosistemas son ampliamente reconocidos por su alta diversidad vegetal (6000 especies) y de endemismos (50%), así como por la variedad de procesos funcionales que los distingue y por ocupar cerca de 60% del territorio nacional (Challenger, 1998; Balbontin et al., 2009). No obstante, los estudios sobre la dinámica del C en México se han centrado principalmente en los ecosistemas tropicales húmedos (Segura-Castruita et al., 2005), mientras que las regiones áridas y semiáridas han sido menos estudiadas, aunque la información existente revela generalidades sobre cómo su alta heterogeneidad espacio-temporal afecta los almacenes y flujos del C, lo cual podría ser relevante ante las altas tasas de movimiento de C que a futuro podrían presentar estos ecosistemas a nivel mundial (Poulter et al., 2014).
Las investigaciones en ecosistemas áridos y semiáridos mexicanos han documentado desde el intercambio neto de C con la atmósfera, la productividad primaria, el flujo del C a través de la producción de materia orgánica y su descomposición, hasta el almacenamiento del C en la fitomasa (aérea y subterránea) y en el suelo. Además, estudios más recientes evalúan el efecto de diferentes especies de plantas, biocostras (consorcios de cianobacterias, líquenes y musgos) y microorganismos en las transformaciones del C en el suelo, con el fin de comprender los mecanismos multiescalares que determinan la productividad neta del ecosistema. En este contexto, el objetivo del presente trabajo fue sintetizar y analizar la información disponible, a diferentes escalas (ecosistémica, comunidades, biocostras y microbiana), sobre almacenes, flujos y factores que determinan la dinámica del C en distintos sitios localizados en las regiones áridas y semiáridas de México (Cuadro 1A-B), las cuales son las más sureñas de los desiertos de Norteamérica y corresponden a la zona intertropical. Esta síntesis es crucial para guiar los esfuerzos colectivos en estas regiones del país, pero también para generar una base empírica referente a magnitudes, procesos y controles que contribuyen a escenarios globales, pues estos ecosistemas pueden representar sumideros y fuentes de C a la atmósfera, por lo que considerarlos en los análisis globales podría impactar los actuales escenarios y las estrategias de mitigación del cambio climático global.
Cuadro 1-A Características generales de los sitios en donde se han evaluado los almacenes y flujos de carbono en regiones áridas de México.

WRB = Base Referencial Mundial del Recurso Suelo 2007; MOS = materia orgánica del suelo.
Cuadro 1-B Características generales de los sitios en donde se han evaluado los almacenes y flujos de carbono en regiones semiáridas de México.

WRB = Base Referencial Mundial del Recurso Suelo 2007; MOS = materia orgánica del suelo.
El intercambio neto de C en el ecosistema
El flujo de C en las regiones áridas y semiáridas de México está fuertemente controlado por la estacionalidad y la cantidad de la lluvia anual. Una métrica importante para entender la respuesta de estos ecosistemas a la variabilidad climática es el intercambio neto de CO2 entre el ecosistema y la atmósfera. Este parámetro integra el flujo fotosintético (p. ej.: productividad primaria bruta, PPB) y la respiración (p. ej.: el flujo combinado de la respiración autótrofa, Ra y la respiración heterótrofa, Rh) del ecosistema, y puede ser medido de forma continua a escala ecosistémica con técnicas micrometeorológicas (Baldocchi, 2008) o en parcelas experimentales con cámaras estáticas (Jasoni et al., 2005). En pastizales de la región semiárida Chihuahuense (Meseta Central, Ojuelos Jalisco) Delgado-Balbuena et al. (2013) estudiaron, mediante cámaras estáticas, el efecto de la pérdida de la cobertura vegetal y del cambio en la composición de especies en los flujos de C, registrando que sitios sobrepastoreados y matorralizados funcionan como sumideros netos de C, ganando en promedio 77.6 y 25.8 g C m-2 año-1, respectivamente. En contraste, un pastizal con exclusión de ganado durante 28 años fue una fuente neta de C al perder 25.7 g C m-2 año-1, en tanto que un sitio con pastoreo moderado no mostró pérdidas ni ganancias de C (0.003 g C m-2 año-1), lo cual por un lado indica que el sobrepastoreo estimula el crecimiento de la biomasa subterránea que constituye un almacén considerable de C en el suelo, y por el otro resalta la importancia del uso y manejo de estos ecosistemas en el secuestro de C.
El intercambio neto de C se ha registrado en varios ecosistemas semiáridos de México (Vargas et al., 2013), entre los que destacan los trabajos realizados en el matorral sarcocaule en Baja California Sur (Hastings et al., 2005; Bell et al., 2012), el matorral subtropical en Rayón, Sonora (Tarin et al., 2012) y el matorral mediterráneo en El Mogor, Baja California (Aguirre, 2014)1. En estos ecosistemas se reportó que la cantidad de lluvia determinó los flujos anuales y estacionales del carbono. Por ejemplo, en un año con lluvia promedio (196 mm) el matorral sarcocaule capturó C (52 g C m-2 año-1), mientras que en un año seco (55 mm) representó una fuente neta de C a la atmósfera (258 g C m-2 año-1; Bell et al., 2012), lo cual sugiere que este tipo de ecosistemas se pueden convertir en fuente o sumidero de C, dependiendo de la cantidad de lluvia. Por otro lado, los flujos de C pueden variar al interior del año, a pesar de que sean años húmedos (Figura 1). En la época seca pueden ocurrir ganancias o pérdidas de C casi nulas; sin embargo durante los meses húmedos, además de que estos ecosistemas reverdecen rápidamente, inician un intenso intercambio de gases. Las evidencias indican que al inicio del temporal, el flujo respiratorio es dominante (pérdida neta de CO2 hacia la atmósfera), como consecuencia de la rápida activación de la microbiota del suelo, que comienza a descomponer la materia orgánica lábil remanente de la temporada de crecimiento anterior; pero durante el pico de la temporada de crecimiento, el intercambio de C fue dominado por la PPB y, por lo tanto, dominó la captura del C (Hastings et al., 2005; Tarin et al., 2012). En contraste, en el matorral subperennifolio del noroeste de Baja California, el balance del sistema es típicamente positivo o cercano a cero (Aguirre, 2014)1.

Los datos son promedios de diez días en años con precipitación promedio para cada sitio. Símbolos oscuros corresponden al matorral sarcocaule de La Paz, Baja California Sur para el año 2002 (HHastings et al., 2005) y los símbolos claros al matorral subtropical de Rayón, Sonora en 2009 (Tarin et al., 2012). Valores positivos indican pérdida de C de la superficie a la atmósfera y valores negativos ganancia de la atmósfera al ecosistema.
Figura 1 A) Intercambio neto de carbono medido con la técnica de correlación de vórtices en dos matorrales áridos de México localizados en el desierto Sonorense. B) Acumulación mensual de lluvia para cada ecosistema, las barras oscuras son de Rayón y las barras claras de La Paz.
Las emisiones de C asociadas a la respiración del suelo (Rs) se presentan cuando existe un pulso de humedad. Por ejemplo, en el matorral subtropical de Rayón, Sonora, Cueva-Rodríguez et al. (2012) reportaron que la humedad favoreció la Rs hasta una tasa de 8.8 ± 1.4 µmol m-2 s-1, mientras que en días secos la tasa de Rs se mantuvo a menos de 0.5 µmol m-2 s-1 (Cuadro 2). Asimismo, León et al. (2014) reportaron que el flujo de CO2 del suelo en el matorral mediterráneo de El Mogor en Baja California se incrementó 522% después de su re-humedecimiento. Este tipo de ecosistemas se han caracterizado por una amplia variabilidad de lluvia entre años (Bell et al., 2014), lo cual ocasiona que la Rs sea muy variable en el tiempo y dependa de la frecuencia de los eventos de lluvia (Cueva-Rodríguez et al., 2012). Además, cuando estos ecosistemas se aprovechan para la agricultura de riego (González et al., 2015), se observan igualmente incrementos de hasta 481% en las emisiones de CO2 poco tiempo después del riego del cultivo de maíz (1.79 µmol m-2 s-1), en comparación con el cultivo de temporal (0.38 µmol m-2 s-1). Un factor adicional que podría modificar las estimaciones y conceptos de balances de flujos de C entre la tierra y atmósfera, es el flujo horizontal del COS en el paisaje. Smith et al. (2007) enfatizaron que hay desplazamiento del COS y hojarasca ladera abajo con la erosión (Cuadro 2), por lo que el almacenamiento del C en el suelo y también la Rs pudieran estar desligados de la productividad primaria neta local, con diferentes sesgos a través del paisaje; sin embargo, estos flujos son prácticamente desconocidos.
Producción y descomposición de hojarasca como flujo de C al suelo
Las plantas, al igual que otros organismos autótrofos como las cianobacterias, transforman la energía solar en compuestos químicos por medio de la fotosíntesis. Parte de la energía química generada se invierte en sus procesos metabólicos y el resto la utilizan para formar biomasa, en diversas estructuras que pueden ser accesibles a los consumidores heterótrofos. La caída de hojas, troncos y ramas desde el dosel al suelo es la mayor ruta de transferencia de C en los ecosistemas terrestres, en virtud de que representa un alto porcentaje de la PPB (Meentemeyer et al., 1982). Los estudios sobre el aporte de hojarasca y los factores que intervienen en su descomposición en matorrales y pastizales áridos y semiáridos de México concluyen que la caída de hojarasca está relacionada con la composición y estructura de la vegetación, y que su producción puede ser escasa o abundante durante las estaciones de crecimiento, dependiendo de la cantidad de lluvia (Martínez-Yrízar et al., 1999). Por ejemplo, el matorral xerófilo tamaulipeco tuvo mayor producción de hojarasca en comparación con otros sitios más secos, como el matorral sarcocaule en Baja California Sur y el matorral xerófilo en Sonora (Búrquez et al., 1999; Martínez-Yrízar et al., 1999; Maya y Arriaga, 1996; Pavón et al., 2005; González-Rodríguez et al., 2013) (Cuadro 2).
La velocidad de descomposición de la hojarasca reportada en los desiertos mexicanos oscila dentro del intervalo de 0.001 a 0.44 g C año-1 (Cuadro 2), siendo inferior a otros ecosistemas húmedos y subhúmedos, como los bosques tropicales estacionales o bosques tropicales subhúmedos (0.45 y 2.0 g C año-1, respectivamente; García-Oliva et al., 2006). La descomposición está influenciada por factores abióticos y la fauna edáfica, en particular termitas, hormigas y microartrópodos fitófagos y saprófitos (Montaña et al., 1988; Martínez-Yrízar et al., 2007; Arriaga y Maya, 2007; Miguel, 20132; Villarreal-Rosas et al., 2014). La producción de hojarasca ocurre justo cuando la disponibilidad de agua y la actividad de los descomponedores se reduce (Miguel, 2013)2, por lo que la radiación solar y temperatura se tornan extremas y actúan en la degradación de la hojarasca al punto que, tras las lluvias de verano, cuando las condiciones son propicias para la reactivación de hongos y bacterias, ocurre la mayor pérdida de masa (Arriaga y Maya, 2007), que probablemente depende de una intensa foto-oxidación que altera la composición química de la materia orgánica (Feng et al., 2011) y cuya contribución es necesario demostrar en futuros experimentos en estos ecosistemas. Los datos también sugieren que la hojarasca podría no representar un flujo importante de C al suelo en este tipo de ecosistemas en términos de biomasa; sin embargo, este flujo puede ser crítico desde el punto de vista energético en el contexto del metabolismo microbiano.
Almacenes y flujos de C en la vegetación y el suelo
El contenido de C en el suelo está controlado por las condiciones ambientales, la comunidad vegetal y el uso del suelo. En las Figuras 2 y 3 se presentan los contenidos de C en la biomasa aérea, subterránea y en el suelo, para diferentes ecosistemas áridos y semiáridos de México. Los estudios muestran que el C almacenado en la fitomasa total de estos ecosistemas varía de 2.3 a 19.5 Mg ha-1, donde el C en la biomasa aérea fluctúa de 1.6 a 15.4 Mg ha-1 y en las raíces de 0.7 a 10.1 Mg ha-1 (Pavón y Briones 2000; Návar et al., 2002; Pavón, 2007; Medina-Roldán et al., 2008; Návar 2008; Búrquez et al., 2010; Perroni et al., 2014; Becerril-Piña et al., 2014; Tapia-Torres et al., 2015a) (Figura 2). Así mismo, los datos citados indican que los matorrales áridos presentan los valores más bajos de C total, especialmente en Cuatro Ciénegas, Coahuila, México, en comparación con los matorrales semiáridos, que a su vez tienden a almacenar más C en su biomasa aérea (Figura 2). Esta tendencia puede estar asociada a una mayor disponibilidad de agua a lo largo del año, y a temperaturas menos extremosas (Cuadro 1A-B). Por su parte, los pastizales áridos y semiáridos almacenan hasta tres veces más C en sus raíces que en la biomasa aérea, y el contenido de C en las raíces tiende a ser mayor en los pastizales semiáridos (Figura 2). Lo anterior implica que el retorno del C al suelo ocurre por medio de la biomasa radical, como ha sido reportado en otros ecosistemas secos dominados por pastos (Sims y Singh, 1978).

Figura 2 Biomasa (Mg ha-1) y contenidos de carbono (Mg C ha-1) en la porción aérea, raíces y fitomasa total en diferentes ecosistemas áridos y semiáridos de México. Referencias: 1. Búrquez et al., 2010; 2. Perroni et al., 2014; 3. Tapia-Torres et al., 2015; 4. Návar et al., 2002; 5. Návar, 2008; 6. Medina-Roldán et al., 2008; 7. Becerril-Piña et al., 2014; 8. Pavón, 2007; 9. Datos inéditos de biomasa aérea estimados con base en las ecuaciones propuestas por Návar et al., 2004; 10. Pavón y Briones, 2000.
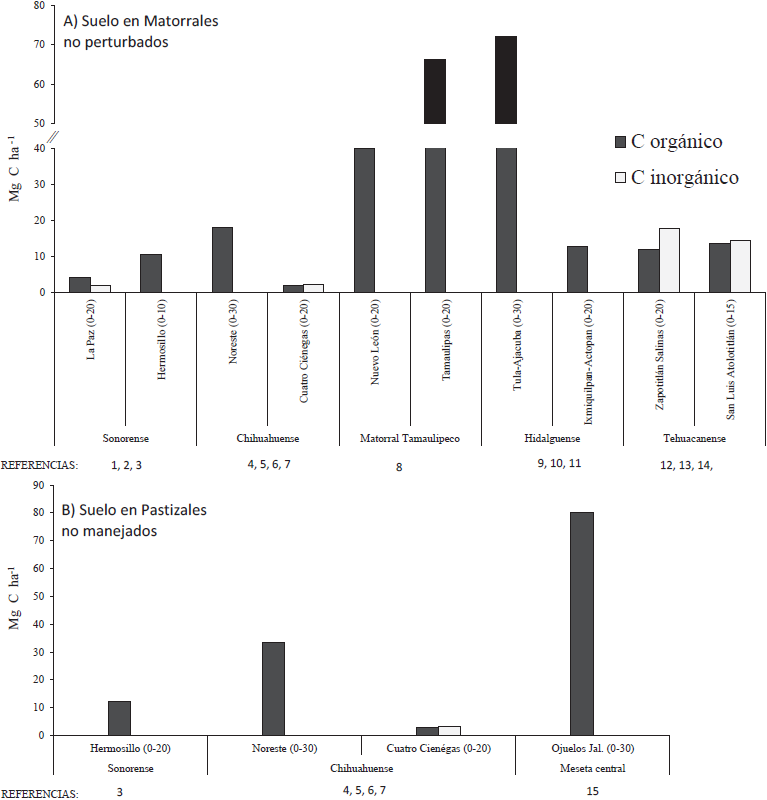
Figura 3 Almacén de carbono (Mg C ha-1) en el suelo de diferentes: A) Matorrales y B) Pastizales de ecosistemas áridos y semiáridos de México. Referencias: 1. Ayala et al., 2015, datos inéditos; 2. Núñez et al., 2001; 3. Morales-Romero et al., 2014; 4. Jurado, 2012; 5. Jurado et al., 2013; 6. Perroni et al., 2014; 7. Tapia-Torres et al., 2015a; 8. Segura-Castruita et al., 2005; 9. Sánchez-González et al., 2012; 10. García-Sánchez et al., 2015, datos inéditos; 11. Montaño et al., 2006; 12. Camargo-Ricalde et al., 2010; 13. Sandoval-Pérez et al., 2016, datos inéditos; 14. Montaño et al., 2015 (datos inéditos). Adelante del nombre de cada región de estudio y entre paréntesis se reporta la profundidad (cm) a la que se midió el C en el suelo.
El almacén de C orgánico del suelo (COS) en los matorrales áridos y semiáridos fluctúa de 2.1 a 72 Mg C ha-1, mientras que el almacén de C inorgánico del suelo (CIS) varía de 1.95 a 17.9 Mg C ha-1, aunque solo ha sido evaluado en tres regiones (Figura 3). El almacén promedio de COS en matorrales áridos de las regiones Sonorense y Chihuahuense es de 8.8 Mg C ha-1 (2.1-18 Mg C ha-1), en donde los valores más bajos corresponden al matorral sarcocaule en Baja California Sur y al matorral xerófilo en Cuatro Ciénegas, Coahuila; en tanto que los valores más altos ocurren en los matorrales xerófilos de Hermosillo y noreste de Chihuahua (Figura 3). En contraste, el almacén promedio de COS en los matorrales de las regiones semiáridas Hidalguense y Tehuacanense fue de 27.6 Mg C ha-1 (11.9-72 Mg C ha-1), indicación de que almacenan tres veces más COS que las regiones áridas. No obstante, la estimación del CIS en el Valle de Tehuacán-Cuicatlán sugiere también que los suelos semiáridos podrían almacenar dos veces más CIS que las regiones áridas (Cuatro Ciénegas y La Paz, Figura 3) y que en ambas regiones el CIS representaría entre 40 y 54% del C total en el suelo. Los suelos del matorral tamaulipeco (Tamaulipas) y los matorrales xerófilos de Tula-Ajacuba, en la región Hidalguense, representan el mayor almacén de COS (66 - 72 Mg C ha‑1). Návar (2008) estimó hasta 184 Mg C ha-1 en los primeros 50 cm del suelo en el matorral tamaulipeco; sin embargo, este valor está fuera del rango reportado en otros ecosistemas de México (Segura-Castruita et al., 2005). Lo anterior podría deberse a que el almacén de C se estimó a una mayor profundidad del suelo que en las otras regiones, y a que una alta densidad de especies arbustivas como Acacia berlandieri, Prosopis glandulosa y Cordiabois sieri acumulan hasta 0.51 Mg C ha-1 año-1 en estos ecosistemas (Návar, 2008).
El almacén de C en suelos con pastizales no perturbados varía entre 2.8 y 80 Mg C ha-1, en donde la tendencia sugiere que los suelos de las regiones áridas Sonorense y Chihuahuense contienen menos COS que las regiones semiáridas de la Meseta central, como en Ojuelos, Jalisco (Figura 3). Los reportes en la región árida muestran, a escala local, que las especies vegetales dominantes determinan la cantidad de COS. Por ejemplo, en el noreste de Chihuahua, la cantidad de COS varía según el tipo de pastizal, ya que el suelo del pastizal mediano con presencia de Aristida sp., Bouteloua gracilis y B. hirsuta tuvo 21.3 Mg C ha‑1, mientras que el pastizal amacollado dominado por B. gracilis y B. hirsuta contiene 42 Mg C ha-1, y el pastizal halófilo con Sporobolus airoides, Eragrostis obstusiflora y Muhlenbergia repens almacena 14 Mg Cha-1 (Jurado, 2012; Jurado et al., 2013). En contraste, en la región semiárida, los datos para los pastizales de Ojuelos, Jalisco, indican que la variación del C en el suelo oscila entre 3 y 110 Mg ha-1, en función de la cubierta vegetal y el tipo de pastizal. De tal manera, los pastizales sin pastoreo dominados por Pleuraphis mutica (= Hilaria mutica) y Sporobolus aeroides exhibieron mayor contenido de COS (hasta 110 Mg C ha-1; Medina-Roldán et al., 2008). Los datos sugieren que los suelos con pastizal presentan mayor entrada de materia orgánica, principalmente por la biomasa radical (Tapia-Torres et al., 2015a), lo cual favorece la acumulación del C orgánico en el suelo.
El CIS es el almacén menos variable con la estacionalidad de la lluvia, en tanto que el COS es el más dinámico a lo largo del año y se relaciona positivamente con la mineralización del C (Sandoval-Pérez et al. (2016) datos inéditos). En la región semiárida Sonorense, Núñez et al. (2001) mostraron que el contenido de COS en zonas cerca de arroyos fue similar al de zonas en laderas (1.42 mg g-1 contra 1.63 mg g-1, respectivamente), y que el contenido de COS fue mayor bajo el dosel de las plantas (0.62 mg C g-1) que en las áreas abiertas (0.15 mg C g-1). Estos autores indicaron que, en el suelo colectado en laderas y bajo el dosel de las plantas, la mineralización de C aumentó al adicionar mantillo de plantas anuales, posiblemente por que este tiene una mejor calidad que estimuló la actividad microbiana, pues el mantillo de las plantas anuales tuvo el doble de concentración de fósforo (P) que el de las perennes. En contraste, el mantillo de las plantas perennes favoreció la mineralización de C en el suelo colectado en áreas abiertas, sugiriendo una composición microbiana diferente, o una menor concentración de nitrógeno (N) en el suelo de este hábitat. Asimismo, los valores de mineralización de C que se reportan en el suelo de las regiones áridas Sonorense y Chihuahuense son mayores que los de las regiones semiáridas (Cuadro 2). La mineralización de C también varía entre suelos asociados a diferentes especies; p. ej.: en la región del Bajío, la incorporación de hojarasca al suelo de P. laevigata y A. tortuosa incrementa en 2.7 y 2.4 veces, respectivamente, la actividad y biomasa microbianas en el suelo bajo la copa de estas leguminosas, en relación con las áreas abiertas y con el suelo agrícola (Reyes-Reyes et al., 2002, 2003). De forma similar, Montaño et al., 2015 (datos inéditos) reportan que algunas leguminosas, como M. luisana, incrementan el C lábil en el suelo bajo su copa y presentan mayores tasas de mineralización de C (70 µg C g-1 d-1) en comparación con otras especies de Mimosa spp. (41 µg C g-1d-1) y con sus áreas abiertas (21 µg C g-1 d-1). En general, estos estudios reportan que la mineralización potencial del C aumenta en la estación seca y que su reducción durante la estación de lluvias está asociada a la activación y crecimiento de grupos microbianos heterotróficos que, desde el inicio de las lluvias y a lo largo de la época húmeda, usan los compuestos lábiles de C y participan en la descomposición de la MOS.
Impacto del cambio de uso de suelo en los almacenes y flujos de carbono
Las investigaciones realizadas en diferentes regiones áridas y semiáridas de México muestran que el cambio de uso de suelo tiene un efecto negativo sobre el almacén de C en los suelos. Considerando como línea base la cantidad de C que los suelos con matorral y pastizal pueden almacenar bajo condiciones de no perturbación (Figura 3), el cambio de uso de suelo de estos tipos de vegetación a matorral perturbado, cultivos agrícolas de temporal, pastizales sobrepastoreados y uso urbano, han reducido el almacén de COS entre 30 y 76% (Figura 4). Los estudios a escalas locales y regionales indican que en la región árida Sonorense de Baja California Sur, la agricultura y la urbanización disminuyeron el almacén de COS en 30 y 94%, respectivamente. Asimismo, en el matorral semiárido tamaulipeco Návar (2008) reportó que el almacén de COS se reduce en cerca de 50% cuando los matorrales son transformados a agricultura, especialmente en los suelos cultivados durante 15 años continuos. Dicho autor estima también que la acumulación de C en el suelo, después de 15 años de abandono y sin practicar la agricultura fue de 7.7 Mg C ha‑1. En la región semiárida Hidalguense Sánchez-González et al. (2013), al comparar el almacén de COS entre matorral xerófilo y maíz de temporal en los primeros 30 cm del suelo (crono-secuencia de 3 a 100 años), indicaron que el suelo del matorral almacenó 72 Mg C ha‑1 y que en el suelo con cultivo de maíz de temporal este valor se redujo a 43 Mg C ha-1. Este mismo estudio indicó que las parcelas de maíz bajo riego con agua residual comienzan a recuperar sus almacenes de COS al nivel de los matorrales después de 30 años y que, hasta los 50 años, el almacén de COS en el suelo logra estabilizarse. En la región semiárida Hidalguense Montaño et al. (2006) documentaron, también, que la perturbación de la vegetación arbustiva ocurrida a lo largo de una década (1990-2000) redujo el almacén de COS de 12.9 a 9.4 Mg C ha-1 en los primeros 20 cm de profundidad, debido a la pérdida de 31% de la diversidad de especies y de 66% de las especies originales con respecto a los matorrales conservados. De manera similar Montaño et al., 2015 (datos inéditos) mostraron que la transformación del bosque de Chichipera (dominado por Polaskia chichipe, cactaceae) a agricultura de maíz-frijol disminuye en 76% el COS en la región semiárida del Valle de Tehuacán-Cuicatlán, y que el CIS se redujo de 14.3 a 5.6 Mg C ha-1, mientras que el sistema agroforestal Milpa-Chichipera practicado en la región logra mantener el almacén de COS en valores cercanos a la vegetación conservada (9.4 Mg C ha-1).

Figura 4 Almacén de carbono (Mg ha-1) en el suelo, bajo diferentes cambios de usos de la tierra en ecosistemas áridos y semiáridos de México. Referencias: 1. Ayala et al., 2015, datos inéditos; 2. Morales-Romero et al., 2014; 3. Martínez-Piedragil, 20133; 4. Becerra, 20144; 5.Segura-Castruita et al., 2005; 6. Reyes-Reyes et al., 2003; 7. Medina-Roldán et al., 2008; 8. Friedel et al., 2001; 9. Sánchez-González et al., 2012; 10. García-Sánchez et al., 2015, datos inéditos; 11. Montaño et al., 2006; 12. Montaño et al., 2015 (datos inéditos). Adelante del nombre de cada región de estudio y entre paréntesis se reporta la profundidad (cm) a la que se midió el C en el suelo.
Las evaluaciones de la dinámica del C también revelan la función de algunas especies vegetales en amortiguar el impacto del cambio de uso de suelo en el almacenamiento del C en el mismo. Por ejemplo en la Meseta central, en Dolores Hidalgo, Guanajuato, el suelo bajo la copa del mezquite (Prosopis laevigata) y Huizache (Acacia tortuosa) acumula más MOS y COS en comparación con las áreas abiertas y los suelos agrícolas (Frías-Hernández et al., 1999, Reyes-Reyes et al., 2003). Asimismo, en los matorrales perturbados de la región semiárida Hidalguense, P. laevigata favoreció el almacén de COS en relación con las áreas abiertas (6.8 Mg C ha-1 bajo la especie contra 2.7 Mg C ha-1 en áreas abiertas), evidenciando la capacidad de esta especie en mantener la cantidad de C en el suelo (Montaño et al., 2006). En esta misma región el suelo asociado a P. laevigata, Opuntia streptacantha y Mimosa biuncifera tiene más COS (5.19 a 6.16 Mg C ha-1), pero la perturbación promueve también la presencia de otras especies como Mimosa biuncifera, Cylindropuntia imbricata, Flourencia resinosa y Agave striata, que aportan diferente cantidad y calidad de hojarasca al suelo, donde los valores de COS están entre 5.9 a 6.5 Mg C ha-1, los cuales son similares a los del suelo con matorrales conservados (García-Sánchez et al., 2012). En la región semiárida del Valle de Tehuacán-Cuicatlán, las especies de Mimosa spp. también incrementan el COS en relación con las áreas abiertas (AA) sin cobertura vegetal (Camargo-Ricalde et al., 2010). Por ejemplo, M. lacerata es la especie con el mayor contenido de COS en el suelo bajo su influencia (5.4 Mg C ha-1 contra AA= 3.7 Mg C ha‑1) en comparación con M. texana var. filipes (4.9 Mg C ha‑1 contra AA= 1.4 Mg C ha-1), M. luisana (4.4 Mg C ha-1 contra AA= 2.9 Mg C ha-1) y M. polyantha (3 Mg C ha-1 contra AA= 1.9 Mg C ha-1).
Existen también algunas evidencias que muestran que la trasformación del matorral a cultivo puede no afectar el contenido de COS, o bien incrementarlo. Este es el caso de la conversión del matorral espinoso a pasturas de buffel (Pennisetum ciliare), que no modificó el contenido de COS en la región Sonorense (Morales-Romero et al., 2014); de la producción de alfalfa en Cuatro Ciénegas, en la región árida Chihuahuense, en donde el incremento del COS fue asociado a la fertilización de las parcelas (Becerra, 2014)4, y del cultivo maíz con riego de agua residual en el Valle del Mezquital, en la región Hidalguense (Friedel et al., 2000), lo cual promueve la producción vegetal y, por tanto, una mayor incorporación de C orgánico al suelo. No obstante, la conversión a buffel sí afectó la mineralización del C y el C microbiano del suelo. El C microbiano aumentó de 633 µg C g-1 en el matorral a 1120 µg C g-1 en la pastura; mientras que la mineralización de C se redujo de 2.5 mg Cg-1d-1 en el matorral a 13 mg C g-1 d-1 en la pastura. En contraste, Medina-Roldán et al. (2008) reportaron mayor contenido de C en el suelo de pastizales con pastoreo moderado que con sobrepastoreo en Ojuelos, Jalisco, indicando que el pastoreo redujo de 15 a 20% el C total en pastizales con cobertura vegetal entre 5 y 10% respecto a valores de cobertura (35 a 40%) propios de estos ecosistemas. Este estudio también reporta que las mayores tasas de captura de C ocurren en pastizales en buena condición y las menores en pastizales sobrepastoreados (9 contra 3 μmol m-2 s-1).
Islas de fertilidad y de recursos en la dinámica del C a escala de la comunidad
La distribución en parches de la cobertura vegetal es una de las características de los ecosistemas áridos o semiáridos. Los parches de vegetación pueden variar en su forma, tamaño y composición de especies, y pueden nombrarse como “mosaicos de vegetación” o “asociaciones vegetales” cuando se refieren a grandes extensiones (≥100 m2); o bien, islas de fertilidad o islas de recursos cuando están conformados por una o pocas especies en áreas no mayores a 15 m2 (Greig-Smith, 1979). La característica principal de las “islas” es la existencia de altas concentraciones de C y N, y elevadas proporciones de microorganismos en el suelo bajo su influencia, en contraste con las áreas abiertas sin vegetación (García-Moya y McKell, 1970; Reynolds et al., 1999; Carrillo-García et al., 2000a; Camargo-Ricalde et al., 2010). Las islas contribuyen a: i) captar partículas suspendidas mediante la reducción de la velocidad del viento al chocar con la vegetación (Núñez et al., 2001); ii) aumentar la concentración de C y N (García-Moya y McKell, 1970; Schlesinger et al., 1996; Reynolds et al., 1997; 1999); iii) incrementar la disponibilidad de otros nutrimentos y agua (Burke et al., 1998; García-Sánchez et al., 2012); iv) acumular a largo plazo el N al promover la actividad microbiana a través del aporte de C lábil (Perroni et al., 2010); v) incrementar la riqueza vegetal (Perroni et al., 2006); vi) favorecer la productividad (Reynolds et al., 1997); vii) crear hábitats (Carrillo-García et al., 2000b; Valderrain-Algara et al., 2010; García-Sánchez et al., 2012); y viii) promover interacciones bióticas (Camargo-Ricalde y Dhillion, 2003; Perroni et al., 2006).
Existen varias evidencias sobre el efecto diferencial de la(s) especie(s) que conforman las islas de fertilidad o de recursos (Cuadro 3) en la acumulación del C en el suelo de regiones áridas y semiáridas de México. Las mayores contribuciones al COS fueron registradas en las regiones semiáridas con mayor precipitación (Valle del Mezquital, Hidalgo y Valle de Tehuacán-Cuicatlán, Puebla-Oaxaca; Figura 5). Es posible que los mecanismos de acumulación del COS en las islas estén relacionados con las comunidades microbianas heterótrofas activas, cuyas poblaciones se incrementan con el humedecimiento del suelo. Por otro lado, el suelo del Valle del Mezquital, con 550 mm de precipitación anual, presenta las mayores tasas de mineralización neta potencial de C (0.14-0.26 mg C g-1 día-1) (Cuadro 3) y la menor tasa de residencia de COS (37.14 días) (Figura 5). En contraste Mapimí, una de las regiones más áridas y con menos precipitación (Cuadro 3, Figura 5) presenta la menor tasa de mineralización neta potencial, pero la mayor tasa de residencia de COS (1147 días). Así, aunque se desconoce la tasa de mineralización de C para la región más seca (La Paz, Baja California Sur), la tendencia podría ser también hacia los valores más bajos. En este sentido Valderrain-Algara et al. (2010) observaron en el matorral sarcocaule de Baja California Sur, que la vegetación podría estar acumulando materia orgánica en el suelo a través de la producción de hojarasca, conservando el COS mediante la actividad de la fauna, desechos orgánicos, alimentos y heces, en comparación con las áreas abiertas y el suelo desnudo; además de promover la eliminación y transporte de nutrimentos de las áreas abiertas por erosión y su posterior deposición hacia las islas. Lo anterior apoya la hipótesis de que las “islas” son esenciales en la regulación del ciclo de C en estos ecosistemas, por lo que un aumento neto en la superficie de influencia de las islas de fertilidad y de recursos con todas sus interacciones bióticas asociadas, podría representar un sumidero importante de CO2 y un “hotspot” de conservación del COS. El conocimiento sobre los mecanismos de conservación y transformación del C en islas de fertilidad o de recursos podría ayudar a comprender su papel en la regulación del ciclo global del carbono.
Cuadro 3 Valores promedio de materia orgánica, carbono orgánico e inorgánico, nitrógeno y fósforo total, así como tasas netas potenciales de mineralización de C y N en el suelo de islas de fertilidad o de recursos (IF o IR) formadas por distintas especies, en contraste con las áreas abiertas de ecosistemas áridos y semiáridos de México.
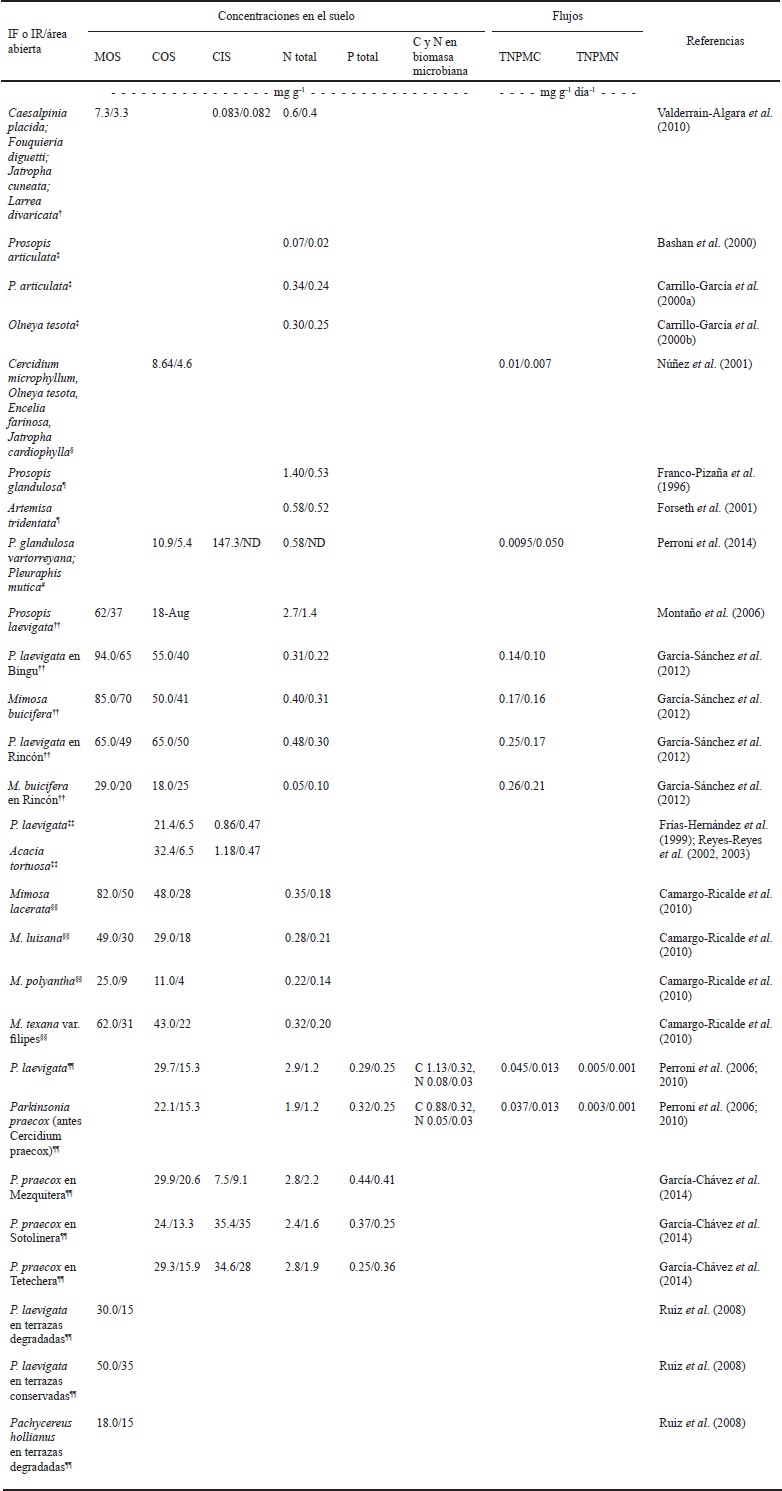
† Estación Biológica CIBNOR, Baja California Sur; ‡ Desierto Sonorense; § Hermosillo, Sonora; ¶ Desierto Chihuahuense; # Mapimí, Durango; †† Valle del Mezquital, Hidalgo; ‡‡ Dolores Hidalgo, Guanajuato; §§ Valle de Tehuacán-Cuicatlán, Puebla-Oaxaca; ¶¶ Valle de Zapotitlán Salinas, Puebla. MOS = materia orgánica del suelo, COS = carbono orgánico del suelo, CIS = carbono inorgánico del suelo, TNPMC = tasa neta potencial de mineralización de carbono, TNPMN = tasa neta potencial de mineralización de nitrógeno.

Figura 5 Contribución de islas de fertilidad/recursos al carbono orgánico del suelo (COS) y a la materia orgánica del suelo (MOS) en diferentes ecosistemas áridos y semiáridos de México. BC = Baja California Sur (región árida Sonorense); S = Región árida Sonorense (Sonora); C = Región árida Chihuahuense (Cuatro Ciénegas); H = Región semiárida Hidalguense (Meseta Central y Valle del Mezquital) y T = Región semiárida Tehuacanense (Valle de Tehuacán-Cuicatlán). Mapa adaptado de Briones (1994) y datos para BC (Valderrain-Algara et al., 2010); S (Núñez et al., 2001); C (Perroni et al., 2014); H (Reyes-Reyes et al., 2003; Montaño et al., 2006); T (Perroni et al., 2010; Camargo-Ricalde et al., 2010). El tiempo de residencia (TR) fue calculado de acuerdo con Schelesinger et al. (1996) como la división del almacén entre el flujo de C, que en este caso fue la tasa neta potencial de mineralización de C en el suelo de la isla. El porcentaje de COS se calculó como: [ (valor asociado a la isla - valor en el área abierta) × 100] / valor asociado a la isla (Véase Cuadro 3).
El papel de las biocostras en los almacenes y flujos del C
Las biocostras o costras biológicas del suelo son comunidades bióticas formadas por la íntima asociación entre partículas de suelo, cianobacterias, algas, hongos, líquenes, hepáticas y briófitas. Las biocostras están ampliamente distribuidas en las zonas áridas y semiáridas, conformando un manto que cubre hasta 70% de la superficie del suelo, tanto en áreas sin vegetación como en islas de vegetación (Belnap y Lange, 2001). Castillo-Monroy y Maestre (2011) mencionan que a nivel mundial las biocostras ejercen un papel clave en el ciclo del C en los ecosistemas áridos y semiáridos, ya que fijan CO2 atmosférico y liberan cerca de 50% al suelo por lixiviación y descomposición, aumentando hasta tres veces el COS respecto al suelo sin biocostras. Tanto en el matorral sarcocaule como en áreas erosionadas de Baja California Sur, el suelo con biocostras tuvo mayor contenido de C (1.59 Mg C ha‑1en el suelo con biocostras contra 0.66 Mg C ha-1 sin biocostras) y sustancias húmicas de menor complejidad química, las cuales están asociadas a más cantidad de arcillas retenidas en las biocostras y conforman complejos recalcitrantes que son parte importante del C almacenado en el suelo (Maya et al., datos inéditos). En la región semiárida del Valle de Tehuacán-Cuicatlán, las biocostras disminuyen la variación espacial y estacional de los almacenes de C total (2.2 Mg C ha-1) y C inorgánico (1.4 Mg C ha‑1), al no diferir de los suelos sin biocostras (C total = 1.9 Mg C ha-1 y C inorgánico = 1.2 Mg C ha-1). En contraste, la variabilidad del COS fue mayor, ya que las biocostras lo incrementaron en la estación seca a valores promedio de 0.92 Mg C ha-1 bajo las biocostras, en comparación con valores de 0.67 Mg C ha-1 en el suelo sin biocostras (Sandoval-Pérez et al. (2016) datos inéditos).
Las biocostras favorecen los flujos de C de forma directa e indirecta. Por ejemplo, en la región árida de La Paz, Baja California Sur, el suelo con biocostras parece estimular directamente el flujo de C por respiración en comparación con el suelo sin biocostras, durante la estación de lluvias (Cuadro 2). En la misma región, las biocostras pueden influenciar indirectamente el flujo de C a través de la descomposición, al favorecer la abundancia de microartrópodos que degradan la hojarasca (micro-fitófagos y saprófitos), lo cual ayuda a explicar el mayor contenido de C registrado en el suelo con biocostras (Villarreal-Rosas et al., 2014). En este mismo sentido, en la región semiárida del Valle de Tehuacán-Cuicatlán, las biocostras favorecen la retención del mantillo a través de su estructura rugosa, al atrapar materiales orgánicos desplazados por erosión. Así, las biocostras registran 105.7 g m-2 de mantillo sobre su superficie durante la estación seca y 125.2 g m-2 en la estación lluviosa (Sandoval-Pérez et al. (2016) datos inéditos).
El mantillo acumulado sobre las biocostras puede favorecer la entrada de C al suelo, aumentar la mineralización del C (Cuadro 2) y ser fuente de alimento para la fauna edáfica, por lo que las biocostras y el suelo por debajo de ellas son más ricos y diversos en microartrópodos, lo cual aumenta la descomposición del mantillo (k = -0.00093), en comparación con el suelo sin biocostras (k = -0.00066) (Miguel, 2013)2.
Relación entre el C y la transformación microbiana y disponibilidad de otros nutrimentos
El C, N y P son elementos esenciales y su adquisición es fundamental para todos los seres vivos, y en el suelo, el suministro de C orgánico a los microorganismos puede regular la disponibilidad de otros nutrimentos, pues representa la principal fuente de energía para la actividad microbiana. No obstante, los mecanismos que los organismos utilizan para obtener tanto el C como el N y P son distintos y, por tanto, la adquisición de estos elementos depende del balance C:N:P, que varía entre organismos (Sinsabaugh et al., 2009). La relación C:nutrimentos puede reflejar la disponibilidad de los nutrimentos y la demanda energética y nutricional de los organismos. Por ejemplo, una adecuada disponibilidad de C orgánico favorece la actividad de los microorganismos heterótrofos y regula su capacidad de mineralizar el N o el P; así, cuando la disponibilidad del P es muy baja, el cociente C:P de la biomasa microbiana tiende a ser alto y se ha observado que existen microorganismos eficientes en inmovilizar P o N cuando alguno de estos es limitante, siempre y cuando exista C en formas lábiles, por lo cual el cociente C:P o C:N en la biomasa microbiana disminuye al incrementarse la inmovilización del P o N; en consecuencia, una mayor disponibilidad de C en el suelo favorece la protección de estos nutrimentos en la biomasa microbiana.
En la región semiárida del Valle de Tehuacán-Cuicatlán, Perroni et al. (2010) reportaron que el C orgánico, al promover la actividad microbiana heterotrófica favorece la retención del N en el suelo asociado a P. laevigata. Asimismo, las altas tasas de mineralización de C y N en el suelo bajo la copa de M. luisana, M. polyantha y M. taxana var. filipes están correlacionadas positivamente tanto con mayores concentraciones de C orgánico lábil, como con una mayor biomasa microbiana en el suelo asociado a estos taxa (Montaño et al. (2015) datos inéditos). De tal manera, el suelo asociado a estas leguminosas representa un “hotspot” biogeoquímico con alta actividad microbiana, mejores condiciones micro-ambientales y una reserva de C lábil para los microorganismos. En esta misma región se ha registrado también que las biocostras del suelo actúan como “mantos de fertilidad” al mejorar las condiciones micro-ambientales e incrementar la concentración de C orgánico y C lábil en el suelo, en particular en la estación seca, lo que favorece la biomasa microbiana y mineralización de C y N en el suelo bajo la influencia de las biocostras (Sandoval-Pérez et al. (2016) datos inéditos). Al respecto se ha sugerido que más C lábil y un bajo cociente C:N promueven la formación de NH4 + y también la inmovilización del N en la biomasa microbiana, pero que en la estación lluviosa, cuando hay menos C lábil, los microorganismos quimiolitotróficos se activan, favoreciendo la nitrificación (Sandoval-Pérez et al. (2016) datos inéditos). De esta forma, cuando el agua no es limitante y hay poco C lábil en el suelo, los microorganismos usan al N como fuente de energía para su actividad, por lo que el mantenimiento de la disponibilidad de nutrimentos en el suelo bajo las biocostras depende de la relación N:C lábil en estos ecosistemas.
Por otro lado, en el suelo de matorrales xerófilos y pastizales halófilos en el Valle de Cuatro Ciénegas, en la región árida Chihuahuense, se reportó una correlación entre la biomasa radical, el C que se incorpora al suelo, los nutrimentos y la composición de la comunidad de bacterias del suelo. Los estudios al respecto revelan que el pastizal, al almacenar más C en formas lábiles, promueve la conservación del N mediante un ciclo cerrado, donde domina la mineralización e inmovilización del N, mientras que el matorral, con menos disponibilidad de C lábil, presentó un ciclo abierto más vulnerable a f lujos de pérdida del N, que ocurren a través de la nitrificación (Tapia-Torres et al., 2015a). Los estudios basados en el análisis de la actividad de enzimas involucradas en la transformación del C, N y P, así como en sus formas disponibles en el suelo y en la biomasa microbiana (Tapia-Torres et al., 2015b) muestran que los suelos de esta región árida presentan los valores más bajos de actividad eco-enzimática, pero la relación estequiométrica C:N:P cercana a 1 coincide con la reportada en diferentes ecosistemas a nivel mundial. Los patrones eco-enzimáticos registrados en Cuatro Ciénegas sugieren que la comunidad microbiana del suelo puede estar co-limitada por la cantidad y disponibilidad de C (energía) y N (o P), ya que dedica más energía a adquirir el nutrimento limitante que a incrementar su biomasa, lo cual está regulado por la disponibilidad del C en el suelo.
Conclusiones
-. La información disponible respecto a la dinámica del C en ecosistemas áridos y semiáridos de México muestra que la productividad del ecosistema (p. ej.: ganancia o pérdida anual) y la respiración del suelo están determinadas por la importancia relativa de los periodos de humedad, en donde el flujo respiratorio o el asimilatorio domina y dependen de la variabilidad de la precipitación. No obstante, es necesario intensificar en tiempo y espacio las mediciones de los flujos verticales del C, distinguir entre la respiración heterótrofa y la respiración autótrofa en el suelo e integrar los flujos verticales con los horizontales a escala del paisaje. Asimismo, la producción de hojarasca en estos ecosistemas es controlada por la variabilidad de la lluvia, en tanto que su descomposición depende de variables bióticas y abióticas, ya que ante la limitación de agua para la actividad microbiana, este flujo se compensa por la acción de la radiación solar y la temperatura.
-. En matorrales y pastizales, la fitomasa es un almacén importante de C, pero el suelo es un almacén de C que representa entre 45% y 90% del C total para estos tipos de vegetación, respectivamente. Las regiones semiáridas parecen tener los mayores almacenes de C, tanto en la vegetación como en el suelo, con una alta contribución de las islas de fertilidad y de recursos, en comparación con las áridas. Sin embargo, el cambio de uso de suelo en la mayoría de los casos disminuye a la mitad el C orgánico almacenado en el mismo. Ante esto, las especies vegetales que forman islas de fertilidad/recursos son cruciales para amortiguar el impacto del cambio de uso de suelo sobre el almacenamiento del C. La producción de hojarasca es cinco veces menor que la reportada en ecosistemas húmedos, donde la mayor parte del C está en la biomasa vegetal, lo cual siguiere que los suelos son el principal almacén de C en los ecosistemas áridos y semiáridos de México.
-. De manera adicional, las biocostras como componentes de estos ecosistemas también podrían tener una contribución importante como controladores edáficos de la acumulación del COS, ya que su rápida respuesta a la estacionalidad de la lluvia determina la disponibilidad del C y los procesos microbianos que regulan la disponibilidad del N en el suelo. Además, al ser hábitat de fauna edáfica y microorganismos, las biocostras potencian los flujos del C y la transformación de los nutrimentos en el suelo a través de la respiración, la descomposición del mantillo y la mineralización de la materia orgánica. Es necesario señalar que en algunos casos las biocostras forman parte de las islas de fertilidad y de recursos, por lo cual actúan conjuntamente en favorecer el almacenamiento de C en el suelo; sin embargo, aún no ha sido explorada su contribución relativa a los almacenes y flujos de C en estos ecosistemas. Asimismo, el contenido de COS en las regiones áridas y semiáridas es muy pequeño en comparación con otros ecosistemas, pero su dinámica y disponibilidad es esencial para el mantenimiento de las relaciones estequiométricas entre bioelementos que controlan los procesos microbianos encargados de regular la disponibilidad de otros nutrimentos esenciales y determinantes para la fertilidad del suelo.
-. La información relacionada con los almacenes y los flujos de C en los ecosistemas áridos y semiáridos de México es aún poca y fragmentada. Gran parte de los estudios se limitan a cuantificar el COS sin considerar el CIS, y a evaluar su almacenamiento en los primeros centímetros (0-30) del perfil del suelo. Si bien la mayoría de los suelos en estas regiones son someros y jóvenes, es necesario estandarizar la profundidad de los muestreos para evaluar los almacenes de C. La mayoría de los estudios también se han efectuado durante uno o dos años, y rara vez han incorporado la medición de más de un almacén o flujo. Además, muchos de los estudios se centran en una problemática funcional o ambiental específica y se elaboran en una escala espacial determinada por el tipo de investigación, el investigador y los recursos financieros. Por ejemplo, la mayoría de las mediciones del intercambio neto de C a escala ecosistémica corresponden a matorrales de las regiones áridas del país, y no se han llevado a cabo en las regiones semiáridas, con excepción de los pastizales semiáridos en Ojuelos, Jalisco. En este sentido, la agenda de investigación del ciclo del C en México requiere de un esfuerzo coordinado para realizar estudios en sitios específicos que incorporen la variabilidad espacial y temporal en todas las escalas y contextos ambientales posibles, y que empleen metodologías estandarizadas para poder documentar a largo plazo y de una manera más completa la contribución de los ecosistemas áridos y semiáridos de México al almacenamiento y flujo del C (Vargas et al., 2012). Por último, también es necesario entender mejor cómo la composición de la comunidad microbiana del suelo, en interacción con el C disponible y la variabilidad del agua, regula los procesos involucrados en la transformación de los nutrimentos y de qué manera estos están vinculados a la presencia de genes que permiten sintetizar las enzimas adecuadas para el balance C-nutrimentos en el suelo (López-Lozano et al., 2012).











 nueva página del texto (beta)
nueva página del texto (beta)



